Estudi de la relació estructura/funció
en Metal
·
lotioneïnes d’Invertebrats, Protozous i Plantes
TESI DOCTORAL
Realitzada al Departament de Genètica de la Facultat de
Biologia de la Universitat de Barcelona, sota la direcció de la
Dra. Sílvia Atrian i laDra.Mercè Capdevila
A
Afonso, C., Hathout, Y. & Fenselau, C. (2004). Evidence for zinc ion sharing in
metallothionein dimers provided by collision-induced dissociation. Int-J.Mass.Spectr. 231, 207-11.
Amiard, J. C., Amiard-Triquet, C., Barka, S., Pellerin, J. & Rainbow, P. S. (2006). Metallothioneins in aquatic invertebrates: their role in metal detoxification and their use as biomarkers. Aquat Toxicol 76(2), 160-202.
Andersen, R. A., Daae, H. L., Mikalsen, A. & Alexander, J. (1989). Occurrence of various forms of metallothionein in the rat after a short-term cadmium injection regimen. Comp Biochem Physiol C 93(2), 367-75. Andrews, G. K. (2001). Cellular zinc sensors:
MTF-1 regulation of gene expression. Biometals 14(3-4), 223-37.
Angerer, L. M., Kawczynski, G., Wilkinson, D. G., Nemer, M. & Angerer, R. C. (1986). Spatial patterns of metallothionein mRNA expression in the sea urchin embryo. Dev Biol 116(2), 543-7.
Auld, D. S. (2001). Zinc coordination sphere in biochemical zinc sites. Biometals 14(3-4), 271-313.
B
Barsyte, D., Lovejoy, D. A. & Lithgow, G. J. (2001). Longevity and heavy metal resistance in daf-2 and age-1 long-lived mutants of Caenorhabditis elegans. Faseb J 15(3), 627-34.
Barsyte, D., White, K. N. & Lovejoy, D. A. (1999). Cloning and characterization of
metallothionein cDNAs in the mussel Mytilus edulis L. digestive gland. Comp Biochem Physiol C Pharmacol Toxicol Endocrinol 122(2), 287-96.
Bebianno, M. J. & Langston, W. J. (1993). Turnover rate of metallothionein and cadmium in Mytilus edulis. Biometals 6(4), 239-44.
Belevich, I., Verkhovsky, M. I. & Wikstrom, M. (2006). Proton-coupled electron transfer
binding metallothionein from mantle tissue of the terrestrial gastropod Helix pomatia L. Biochem J 328 (Pt 1), 219-24.
Bertinato, J. & L'Abbe, M. R. (2004). Maintaining copper homeostasis: regulation of copper-trafficking proteins in response to copper deficiency or overload. J Nutr Biochem 15(6), 316-22.
Bertini, I., Donaire, A., Feinberg, B. A., Luchinat, C., Piccioli, M. & Yuan, H. (1995). Solution structure of the oxidized 2[4Fe-4S] ferredoxin from Clostridium pasteurianum. Eur J Biochem 232(1), 192-205.
Bertini, I., Hartmann, H. J., Klein, T., Liu, G., Luchinat, C. & Weser, U. (2000). High resolution solution structure of the protein part of Cu7 metallothionein. Eur J Biochem 267(4), 1008-18.
Bilecen, K., Ozturk, U. H., Duru, A. D., Sutlu, T., Petoukhov, M. V., Svergun, D. I., Koch, M. H., Sezerman, U. O., Cakmak, I. & Sayers, Z. (2005). Triticum durum metallothionein. Isolation of the gene and structural characterization of the protein using solution scattering and molecular modeling. J Biol Chem 280(14), 13701-11.
Binz, P. A., Kägi, J. (2001).
http://www.biochem.unizh.ch/mtpage/MT. html.
Blindauer, C. A., Harrison, M. D., Parkinson, J. A., Robinson, A. K., Cavet, J. S., Robinson, N. J. & Sadler, P. J. (2001). A metallothionein containing a zinc finger within a four-metal cluster protects a bacterium from zinc toxicity. Proc Natl Acad Sci U S A 98(17), 9593-8.
Bofill, R., Capdevila, M., Cols, N., Atrian, S. & Gonzalez-Duarte, P. (2001). Zinc(II) is required for the in vivo and in vitro folding of mouse copper metallothionein in two domains. J Biol Inorg Chem 6(4), 405-17. Bofill, R., Palacios, O., Capdevila, M., Cols, N.,
Duarte, R., Atrian, S. & Gonzalez-Duarte, P. (1999). A new insight into the Ag+ and Cu+ binding sites in the metallothionein beta domain. J Inorg Biochem 73(1-2), 57-64. Boldrin, F., Santovito, G., Gaertig, J., Wloga, D.,
copper-Bibliografia
Boldrin, F., Santovito, G., Negrisolo, E. & Piccinni, E. (2003). Cloning and sequencing of four new metallothionein genes from Tetrahymena thermophila and T. pigmentosa: evolutionary relationships in Tetrahymena MT family. Protist 154(3-4), 431-42. Bongers, J., Walton, C. D., Richardson, D. E. &
Bell, J. U. (1988). Micromolar protein concentrations and metalloprotein stoichiometries obtained by inductively coupled plasma atomic emission
spectrometric determination of sulfur. Anal Chem 60(24), 2683-6.
Bonneton, F., Theodore, L., Silar, P., Maroni, G. & Wegnez, M. (1996). Response of Drosophila metallothionein promoters to metallic, heat shock and oxidative stresses. FEBS Lett 380(1-2), 33-8.
Brkljacic, J. M., Samardzic, J. T., Timotijevic, G. S. & Maksimovic, V. R. (2004). Expression analysis of buckwheat (Fagopyrum esculentum Moench) metallothionein-like gene (MT3) under different stress and physiological conditions. J Plant Physiol 161(6), 741-6.
Brouwer, M., Syring, R. & Hoexum Brouwer, T. (2002). Role of a copper-specific
metallothionein of the blue crab, Callinectes sapidus, in copper metabolism associated with degradation and synthesis of hemocyanin. J Inorg Biochem 88(2), 228-39. Buchanan-Wollaston, V. (1994). Isolation of
cDNA clones for genes that are expressed during leaf senescence in Brassica napus. Identification of a gene encoding a senescence-specific metallothionein-like protein. Plant Physiol 105(3), 839-46. Butt, A., Mousley, C., Morris, K., Beynon, J.,
Can, C., Holub, E., Greenberg, J. T. & Buchanan-Wollaston, V. (1998). Differential expression of a senescence-enhanced metallothionein gene in Arabidopsis in response to isolates of Peronospora parasitica and Pseudomonas syringae. Plant J 16(2), 209-21.
C
Cai, L., Satoh, M., Tohyama, C. & Cherian, M. G. (1999). Metallothionein in radiation
exposure: its induction and protective role. Toxicology 132(2-3), 85-98.
Calderone, V., Dolderer, B., Hartmann, H. J., Echner, H., Luchinat, C., Del Bianco, C., Mangani, S. & Weser, U. (2005). The crystal structure of yeast copper thionein: the
solution of a long-lasting enigma. Proc Natl Acad Sci U S A 102(1), 51-6.
Capasso, C., Carginale, V., Crescenzi, O., Di Maro, D., Parisi, E., Spadaccini, R. & Temussi, P. A. (2003). Solution structure of MT_nc, a novel metallothionein from the Antarctic fish Notothenia coriiceps. Structure 11(4), 435-43.
Capdevila, M., Cols, N., Romero-Isart, N., Duarte, R., Atrian, S. & Gonzalez-Duarte, P. (1997). Recombinant synthesis of mouse Zn3-beta and Zn4-alpha
metallothionein 1 domains and characterization of their cadmium(II) binding capacity. Cell Mol Life Sci 53(8), 681-8.
Cavaletto, M., Ghezzi, A., Burlando, B., Evangelisti, V., Ceratto, N. & Viarengo, A. (2002). Effect of hydrogen peroxide on antioxidant enzymes and metallothionein level in the digestive gland of Mytilus galloprovincialis. Comp Biochem Physiol C Toxicol Pharmacol 131(4), 447-55. Ceratto, N., Dondero, F., van de Loo, J. W.,
Burlando, B. & Viarengo, A. (2002). Cloning and sequencing of a novel metallothionein gene in Mytilus galloprovincialis Lam. Comp Biochem Physiol C Toxicol Pharmacol 131(3), 217-22.
Chabicovsky, M., Niederstatter, H., Thaler, R., Hodl, E., Parson, W., Rossmanith, W. & Dallinger, R. (2003). Localization and quantification of Cd- and Cu-specific metallothionein isoform mRNA in cells and organs of the terrestrial gastropod Helix pomatia. Toxicol Appl Pharmacol 190(1), 25-36. Cherian, M. G. & Kang, Y. J. (2006).
Metallothionein and liver cell regeneration. Exp Biol Med (Maywood) 231(2), 138-44. Cho, S. H., Hoang, Q. T., Kim, Y. Y., Shin, H. Y.,
Ok, S. H., Bae, J. M. & Shin, J. S. (2006). Proteome analysis of gametophores identified a metallothionein involved in various abiotic stress responses in Physcomitrella patens. Plant Cell Rep 25(5), 475-88.
Christianson, D. W. (1991). Structural biology of zinc. Adv Protein Chem 42, 281-355.
Ciocan, C. M. & Rotchell, J. M. (2004). Cadmium induction of metallothionein isoforms in juvenile and adult mussel (Mytilus edulis). Environ Sci Technol 38(4), 1073-8.
Clendennen, S. K. & May, G. D. (1997). Differential gene expression in ripening banana fruit. Plant Physiol 115(2), 463-9. Cobbett, C. & Goldsbrough, P. (2002).
Phytochelatins and metallothioneins: roles in heavy metal detoxification and
homeostasis. Annu Rev Plant Biol 53, 159-82. Cobine, P. A., McKay, R. T., Zangger, K.,
Dameron, C. T. & Armitage, I. M. (2004). Solution structure of Cu6 metallothionein from the fungus Neurospora crassa. Eur J Biochem 271(21), 4213-21.
Cols, N., Romero-Isart, N., Bofill, R., Capdevila, M., Gonzalez-Duarte, P., Gonzalez-Duarte, R. & Atrian, S. (1999). In vivo copper- and cadmium-binding ability of mammalian metallothionein beta domain. Protein Eng 12(3), 265-9.
Cols, N., Romero-Isart, N., Capdevila, M., Oliva, B., Gonzalez-Duarte, P., Gonzalez-Duarte, R. & Atrian, S. (1997). Binding of excess cadmium(II) to Cd7-metallothionein from recombinant mouse Zn7-metallothionein 1. UV-vis absorption and circular dichroism studies and theoretical location approach by surface accessibility analysis. J Inorg Biochem 68(3), 157-66.
Cook, W. J., Kar, S. R., Taylor, K. B. & Hall, L. M. (1998). Crystal structure of the
cyanobacterial metallothionein repressor SmtB: a model for metalloregulatory proteins. J Mol Biol 275(2), 337-46.
Coupe, S. A., Taylor, J. E. & Roberts, J. A. (1995). Characterisation of an mRNA encoding a metallothionein-like protein that
accumulates during ethylene-promoted abscission of Sambucus nigra L. leaflets. Planta 197(3), 442-7.
Coyle, P., Philcox, J. C., Carey, L. C. & Rofe, A. M. (2002). Metallothionein: the
multipurpose protein. Cell Mol Life Sci 59(4), 627-47.
Cserjesi, P., Fang, H. & Brandhorst, B. P. (1997). Metallothionein gene expression in embryos of the sea urchin Lytechinus pictus. Mol Reprod Dev 47(1), 39-46.
D
Dallinger, R. (1996). Metallothionein research in
Dallinger, R., Berger, B., Hunziker, P. E., Birchler, N., Hauer, C. R. & Kagi, J. H. (1993). Purification and primary structure of snail metallothionein. Similarity of the N-terminal sequence with histones H4 and H2A. Eur J Biochem 216(3), 739-46. Dallinger, R., Chabicovsky, M., Lagg, B.,
Schipflinger, R., Weirich, H. G. & Berger, B. (2004). Isoform-specific quantification of metallothionein in the terrestrial gastropod Helix pomatia. II. A differential biomarker approach under laboratory and field conditions. Environ Toxicol Chem 23(4), 902-10.
Dallinger, R., Wang, Y., Berger, B., Mackay, E. A. & Kagi, J. H. (2001). Spectroscopic
characterization of metallothionein from the terrestrial snail, Helix pomatia. Eur J Biochem 268(15), 4126-33.
Dalton, T., Fu, K., Enders, G. C., Palmiter, R. D. & Andrews, G. K. (1996). Analysis of the effects of overexpression of metallothionein-I in transgenic mice on the reproductive toxicology of cadmium. Environ Health Perspect 104(1), 68-76.
Davies, C. & Robinson, S. P. (2000). Differential screening indicates a dramatic change in mRNA profiles during grape berry ripening. Cloning and characterization of cDNAs encoding putative cell wall and stress response proteins. Plant Physiol 122(3), 803-12.
de Miranda, J. R., Thomas, M. A., Thurman, D. A. & Tomsett, A. B. (1990). Metallothionein genes from the flowering plant Mimulus guttatus. FEBS Lett 260(2), 277-80. Debec, A., Mokdad, R. & Wegnez, M. (1985).
Metallothioneins and resistance to cadmium poisoning in Drosophila cells. Biochem Biophys Res Commun 127(1), 143-52. Degtyarenko, K. (2000). Bioinorganic motifs:
towards functional classification of metalloproteins. Bioinformatics 16(10), 851-64.
Dondero, F., Cavaletto, M., Ghezzi, A. R., La Terza, A., Banni, M. & Viarengo, A. (2004). Biochemical characterization and
157-Bibliografia
Dong, J., Song, M. O. & Freedman, J. H. (2005). Identification and characterization of a family of Caenorhabditis elegans genes that is homologous to the cadmium-responsive gene cdr-1. Biochim Biophys Acta 1727(1), 16-26.
Durliat, M., Bonneton, F., Boissonneau, E., Andre, M. & Wegnez, M. (1995). Expression of metallothionein genes during the post-embryonic development of Drosophila melanogaster. Biometals 8(4), 339-51.
E
Egli, D., Domenech, J., Selvaraj, A.,
Balamurugan, K., Hua, H., Capdevila, M., Georgiev, O., Schaffer, W. & Atrian, S. (2006a). The four members of the Drosophila Metallothionein family exhibit distinct yet overlapping in heavy metal homeostasis and detoxification. Genes to Cells 11(6), 647-58.
Egli, D., Selvaraj, A., Yepiskoposyan, H., Zhang, B., Hafen, E., Georgiev, O. & Schaffner, W. (2003). Knockout of 'metal-responsive transcription factor' MTF-1 in Drosophila by homologous recombination reveals its central role in heavy metal homeostasis. Embo J 22(1), 100-8.
Egli, D., Yepiskoposyan, H., Selvaraj, A., Balamurugan, K., Rajaram, R., Simons, A., Multhaup, G., Mettler, S., Vardanyan, A., Georgiev, O. & Schaffner, W. (2006b). A family knockout of all four Drosophila metallothioneins reveals a central role in copper homeostasis and detoxification. Mol Cell Biol 26(6), 2286-96.
Elgren, T. E. & Wilcox, D. E. (1989). A unique low frequency Raman band associated with metal binding to metallothionein. Biochem Biophys Res Commun 163(2), 1093-9.
F
Fabris, D., Zaia, J., Hathout, Y., Fenselau,C. (1996). Retention of thiol protons in two classes of protein zinc coordination centers. J. Am. Chem. Soc. 118, 12242-3.
Fang, X., Wu, J. & Wei, G. (1994). Radiolysis of metallothionein in deaerated and oxygen-saturated solutions. Radiat Res 138(2), 165-70.
Ferrarello, C. N., Fernandez de la Campa, M. R., Carrasco, J. F. & Sanz-Medel, A. (2000). Speciation of metallothionein-like proteins of the mussel Mytilus edulis at basal levels by chromatographic separations coupled to
quadrupole and double-focusing magnetic sector ICPMS. Anal Chem 72(24), 5874-80. Ferreri, C., Kratzsch, S., Landi, L. & Brede, O. (2005). Thiyl radicals in biosystems: effects on lipid structures and metabolisms. Cell Mol Life Sci 62(7-8), 834-47.
Finney, L.A., O'Halloran, T.V. (2003). Transition Metal Speciation in the Cell: Insights from the Chemistry of Metal Ion Receptors. Science 300, 931-936.
Foley, R. C., Liang, Z. M. & Singh, K. B. (1997). Analysis of type 1 metallothionein cDNAs in Vicia faba. Plant Mol Biol 33(4), 583-91. Fowler, B. A., Hildebrand, C. E., Kojima, Y. &
Webb, M. (1987). Nomenclature of
metallothionein. Experientia Suppl 52, 19-22. Freedman, J. H., Slice, L. W., Dixon, D., Fire, A.
& Rubin, C. S. (1993). The novel metallothionein genes of Caenorhabditis elegans. Structural organization and inducible, cell-specific expression. J Biol Chem 268(4), 2554-64.
Fu, C. & Miao, W. (2006). Cloning and Characterization of a New Multi-Stress Inducible Metallothionein Gene in Tetrahymena pyriformis. Protist 157(2), 193-203.
Furey, W. F., Robbins, A. H., Clancy, L. L., Winge, D. R., Wang, B. C. & Stout, C. D. (1987). Crystal structure of Cd,Zn
metallothionein. Experientia Suppl 52, 139-48.
G
Gan, T., Munoz, A., Shaw, C. F., 3rd & Petering, D. H. (1995). Reaction of 111
Cd7-metallothionein with EDTA. A reappraisal. J Biol Chem 270(10), 5339-45.
Garcia-Hernandez, M., Murphy, A. & Taiz, L. (1998). Metallothioneins 1 and 2 have distinct but overlapping expression patterns in Arabidopsis. Plant Physiol 118(2), 387-97. Garza, A., Vega, R. & Soto, E. (2006). Cellular
mechanisms of lead neurotoxicity. Med Sci Monit 12(3), RA57-65.
Geffard, A., Amiard-Triquet, C. & Amiard, J. C. (2005). Do seasonal changes affect
metallothionein induction by metals in mussels, Mytilus edulis? Ecotoxicol Environ Saf 61(2), 209-20.
George, S. G. (1983). Heavy metal detoxication in the mussel Mytilus edulis-composition of Cd-containing kidney granules (tertiary lysosomes). Comp Biochem Physiol C 76(1), 53-7.
mussel tissues after exposure to cadmium or mercury. Arch Environ Contam Toxicol 42(1), 36-42.
Ghoshal, K., Wang, Y., Sheridan, J. F. & Jacob, S. T. (1998). Metallothionein induction in response to restraint stress. Transcriptional control, adaptation to stress, and role of glucocorticoid. J Biol Chem 273(43), 27904-10. Giedroc, D. P., Chen, X. & Apuy, J. L. (2001).
Metal response element (MRE)-binding transcription factor-1 (MTF-1): structure, function, and regulation. Antioxid Redox Signal 3(4), 577-96.
Giles, G. I., Tasker, K. M. & Jacob, C. (2001). Hypothesis: the role of reactive sulfur species in oxidative stress. Free Radic Biol Med 31(10), 1279-83.
Giritch, A., Ganal, M., Stephan, U. W. & Baumlein, H. (1998). Structure, expression and chromosomal localisation of the metallothionein-like gene family of tomato. Plant Mol Biol 37(4), 701-14.
Gruber, C., Sturzenbaum, S., Gehrig, P., Sack, R., Hunziker, P., Berger, B. & Dallinger, R. (2000). Isolation and characterization of a self-sufficient one-domain protein. (Cd)-metallothionein from Eisenia foetida. Eur J Biochem 267(2), 573-82.
Gupta, R. K., Dobritsa, S. V., Stiles, C. A., Essington, M. E., Liu, Z., Chen, C. H., Serpersu, E. H. & Mullin, B. C. (2002). Metallohistins: a new class of plant metal-binding proteins. J Protein Chem 21(8), 529-36.
H
Hall, J. L. (2002). Cellular mechanisms for heavy metal detoxification and tolerance. J Exp Bot 53(366), 1-11.
Hamer, D. H., Thiele, D. J. & Lemontt, J. E. (1985). Function and autoregulation of yeast copperthionein. Science 228(4700), 685-90. Haq, F., Mahoney, M. & Koropatnick, J. (2003).
Signaling events for metallothionein induction. Mutat Res 533(1-2), 211-26. Hardivillier, Y., Leignel, V., Denis, F., Uguen, G.,
Cosson, R. & Laulier, M. (2004). Do
organisms living around hydrothermal vent sites contain specific metallothioneins? The
of its metal-responsive region. Mol Cell Biol 9(12), 5445-55.
Hathout, Y., Reynolds, K. J., Szilagyi, Z. & Fenselau, C. (2002). Metallothionein dimers studied by nano-spray mass spectrometry. J Inorg Biochem 88(2), 119-22.
Hawkes, S. J. (1997). What is a "Heavy Metal"? Journal of Chemical Education 74(11), 1374. Hayashi, Y., Nakagawa, C. W. & Murasugi, A.
(1986). Unique properties of Cd-binding peptides induced in fission yeast, Schizosaccharomyces pombe. Environ Health Perspect 65, 13-9.
Hensbergen, P. J., Donker, M. H., Van Velzen, M. J., Roelofs, D., Van Der Schors, R. C., Hunziker, E. & Van Straalen, N. M. (1999). Primary structure of a cadmium-induced metallothionein from the insect Orchesella cincta (Collembola). Eur J Biochem 259(1-2), 197-203.
Howden, R., Goldsbrough, P. B., Andersen, C. R. & Cobbett, C. S. (1995). Cadmium-sensitive, cad1 mutants of Arabidopsis thaliana are phytochelatin deficient. Plant Physiol 107(4), 1059-66.
I
Imagawa, M., Onozawa, T., Okumura, K., Osada, S., Nishihara, T. & Kondo, M. (1990). Characterization of metallothionein cDNAs induced by cadmium in the nematode Caenorhabditis elegans.Biochem J 268(1), 237-40.
Imbert, J., Culotta, V., Furst, P., Gedamu, L. & Hamer, D. (1990). Regulation of
metallothionein gene transcription by metals. Adv Inorg Biochem 8, 139-64.
J
Jacob, C., Maret, W. & Vallee, B. L. (1998). Control of zinc transfer between thionein, metallothionein, and zinc proteins. Proc Natl Acad Sci U S A 95(7), 3489-94.
Jenny, M. J., Ringwood, A. H., Schey, K., Warr, G. W. & Chapman, R. W. (2004). Diversity of metallothioneins in the American oyster, Crassostrea virginica, revealed by
Bibliografia
response to different stressors. Gene 379;156-65.
K
Kägi, J. & Kojima, Y. (1987). Metallothionein II: Proceedings of the "Second international meeting on metallothionein and other low molecular weight metal-binding proteins". Birkhäuser, Basel.
Kägi, J.& Vallee, B.L. (1960). Metallothionein: a cadmium- and zinc-containing protein from equine renal cortex. J Biol Chem. 235; 3460-5. Kar, S. R., Adams, A. C., Lebowitz, J., Taylor, K. B. & Hall, L. M. (1997). The cyanobacterial repressor SmtB is predominantly a dimer and binds two Zn2+ ions per subunit. Biochemistry 36(49), 15343-8.
Kar, S. R., Lebowitz, J., Blume, S., Taylor, K. B. & Hall, L. M. (2001). SmtB-DNA and protein-protein interactions in the formation of the cyanobacterial metallothionein repression complex: Zn2+ does not dissociate the protein-DNA complex in vitro. Biochemistry 40(44), 13378-89.
Kawashima, I., Kennedy, T. D., Chino, M. & Lane, B. G. (1992). Wheat Ec metallothionein genes. Like mammalian Zn2+
metallothionein genes, wheat Zn2+ metallothionein genes are conspicuously expressed during embryogenesis. Eur J Biochem 209(3), 971-6.
Khoo, H. W. & Patel, K. H. (1999).
Metallothionein cDNA, promoter, and genomic sequences of the tropical green mussel, Perna viridis. J Exp Zool 284(4), 445-53.
Kille, P., Winge, D. R., Harwood, J. L. & Kay, J. (1991). A plant metallothionein produced in E. coli. FEBS Lett 295(1-3), 171-5.
Klaassen, C. D. & Liu, J. (1998). Metallothionein transgenic and knock-out mouse models in the study of cadmium toxicity. J Toxicol Sci 23 Suppl 2, 97-102.
Kondo, M., Imagawa, M., Maruyama, K., Okada, Y., Tsunasawa, S. & Nishihara, T. (1990). Biochemical and immunochemical characterization of Caenorhabditis elegans metallothioneins I and II induced by cadmium. Biomed Environ Sci 3(3), 315-25. Kugawa, F., Yamamoto, H., Osada, S., Aoki, M.,
Imagawa, M. & Nishihara, T. (1994). Metallothionein genes in the nematode Caenorhabditis elegans and metal inducibility in mammalian culture cells. Biomed Environ Sci 7(3), 222-31.
Kulkarni, P. P., She, Y. M., Smith, S. D., Roberts, E. A. & Sarkar, B. (2006). Proteomics of metal transport and metal-associated diseases. Chemistry 12(9), 2410-22. Kumari, M. V., Hiramatsu, M. & Ebadi, M.
(1998). Free radical scavenging actions of metallothionein isoforms I and II. Free Radic Res 29(2), 93-101.
L
Lastowski-Perry, D., Otto, E. & Maroni, G. (1985a). Nucleotide sequence and
expression of a Drosophila metallothionein. J Biol Chem 260(3), 1527-30.
Lauverjat, S., Ballan-Dufrancais, C. & Wegnez, M. (1989). Detoxification of cadmium. Ultrastructural study and electron-probe microanalysis of the midgut in a cadmium-resistant strain of Drosophila melanogaster. Biol Met 2(2), 97-107.
Lazo, J. S., Kondo, Y., Dellapiazza, D., Michalska, A. E., Choo, K. H. & Pitt, B. R. (1995). Enhanced sensitivity to oxidative stress in cultured embryonic cells from transgenic mice deficient in metallothionein I and II genes. J Biol Chem 270(10), 5506-10. Lecoeur, S., Videmann, B. & Berny, P. (2004).
Evaluation of metallothionein as a biomarker of single and combined Cd/Cu exposure in Dreissena polymorpha. Environ Res 94(2), 184-91.
Ledger, S. E. & Gardner, R. C. (1994). Cloning and characterization of five cDNAs for genes differentially expressed during fruit development of kiwifruit (Actinidia deliciosa var. deliciosa). Plant Mol Biol 25(5), 877-86. Lee, J., Shim, D., Song, W. Y., Hwang, I. & Lee,
Y. (2004). Arabidopsis metallothioneins 2a and 3 enhance resistance to cadmium when expressed in Vicia faba guard cells. Plant Mol Biol 54(6), 805-15.
Leignel, V., Hardivillier, Y. & Laulier, M. (2005). Small metallothionein MT-10 genes in coastal and hydrothermal mussels. Mar Biotechnol (NY) 7(3), 236-44.
Lemoine, S., Bigot, Y., Sellos, D., Cosson, R. P. & Laulier, M. (2000). Metallothionein Isoforms in Mytilus edulis (Mollusca, Bivalvia): Complementary DNA Characterization and Quantification of Expression in Different Organs after Exposure to Cadmium, Zinc, and Copper. Mar Biotechnol (NY) 2(2), 195-203.
Liao, V. H. & Freedman, J. H. (1998). Cadmium-regulated genes from the nematode Caenorhabditis elegans. Identification and cloning of new cadmium-responsive genes by differential display. J Biol Chem 273(48), 31962-70.
Lichtlen, P., Wang, Y., Belser, T., Georgiev, O., Certa, U., Sack, R. & Schaffner, W. (2001). Target gene search for the metal-responsive transcription factor MTF-1. Nucleic Acids Res 29(7), 1514-23.
Lieb, B. (2003). A new metallothionein gene from the giant keyhole limpet Megathura
crenulata. Comp Biochem Physiol C Toxicol Pharmacol 134(1), 131-7.
Liu, J., Hara, C., Umeda, M., Zhao, Y., Okita, T. W. & Uchimiya, H. (1995a). Analysis of randomly isolated cDNAs from developing endosperm of rice (Oryza sativa L.):
evaluation of expressed sequence tags, and expression levels of mRNAs. Plant Mol Biol 29(4), 685-9.
Liu, J., Liu, Y., Hartley, D., Klaassen, C. D., Shehin-Johnson, S. E., Lucas, A. & Cohen, S. D. (1999). Metallothionein-I/II knockout mice are sensitive to acetaminophen-induced hepatotoxicity. J Pharmacol Exp Ther 289(1), 580-6.
Liu, Y., Liu, J., Iszard, M. B., Andrews, G. K., Palmiter, R. D. & Klaassen, C. D. (1995b). Transgenic mice that overexpress metallothionein-I are protected from cadmium lethality and hepatotoxicity. Toxicol Appl Pharmacol 135(2), 222-8.
M
Mackay, E. A., Overnell, J., Dunbar, B., Davidson, I., Hunziker, P. E., Kagi, J. H. & Fothergill, J. E. (1993). Complete amino acid sequences of five dimeric and four
monomeric forms of metallothionein from the edible mussel Mytilus edulis. Eur J Biochem 218(1), 183-94.
Madden, E. F. (2003). The role of combined metal interactions in metal carcinogenesis: a review. Rev Environ Health 18(2), 91-109. Maret, W. (2004). Zinc and sulfur: a critical
biological partnership. Biochemistry 43(12), 3301-9.
Maret, W., Larsen, K. S. & Vallee, B. L. (1997). Coordination dynamics of biological zinc "clusters" in metallothioneins and in the DNA-binding domain of the transcription factor Gal4. Proc Natl Acad Sci U S A 94(6), 2233-7.
Margoshes, M. & Vallee, B. L. (1957). A cadmium protein from equine kidney cortex. J Am Chem Soc 79, 4813-4. Marino, F., Sturzenbaum, S. R., Kille, P. &
Morgan, A. J. (1998). Cu-Cd interactions in earthworms maintained in laboratory microcosms: the examination of a putative copper paradox. Comp Biochem Physiol C Pharmacol Toxicol Endocrinol 120(2), 217-23. Maroni, G., Wise, J., Young, J. E. & Otto, E.
(1987). Metallothionein gene duplications and metal tolerance in natural populations of Drosophila melanogaster. Genetics 117(4), 739-44.
Masters, B. A., Kelly, E. J., Quaife, C. J., Brinster, R. L. & Palmiter, R. D. (1994). Targeted disruption of metallothionein I and II genes increases sensitivity to cadmium. Proc Natl Acad Sci U S A 91(2), 584-8.
McNulty, M., Puljung, M., Jefford, G. & Dubreuil, R. R. (2001). Evidence that a copper-metallothionein complex is responsible for fluorescence in acid-secreting cells of the Drosophila stomach. Cell Tissue Res 304(3), 383-9.
Meneghini, R. (1997). Iron homeostasis, oxidative stress, and DNA damage. Free Radic Biol Med 23(5), 783-92.
Merrifield, M. E., Chaseley, J., Kille, P. & Stillman, M. J. (2006). Determination of the Cd/S cluster stoichiometry in Fucus
vesiculosus metallothionein. Chem Res Toxicol 19(3), 365-75.
Miseta, A. & Csutora, P. (2000). Relationship between the occurrence of cysteine in proteins and the complexity of organisms. Mol Biol Evol 17(8), 1232-9.
Bibliografia
Identification and characterization of a recombinant metallothionein protein from a marine alga, Fucus vesiculosus. Biochem J 338 (Pt 2), 553-60.
Munoz, A., Forsterling, F. H., Shaw, C. F., 3rd & Petering, D. H. (2002). Structure of the (113)Cd(3)beta domains from Homarus americanus metallothionein-1: hydrogen bonding and solvent accessibility of sulfur atoms. J Biol Inorg Chem 7(7-8), 713-24. Murphy, A. & Taiz, L. (1995). Comparison of
metallothionein gene expression and nonprotein thiols in ten Arabidopsis
ecotypes. Correlation with copper tolerance. Plant Physiol 109(3), 945-54.
Murphy, A., Zhou, J., Goldsbrough, P. B. & Taiz, L. (1997). Purification and immunological identification of metallothioneins 1 and 2 from Arabidopsis thaliana. Plant Physiol 113(4), 1293-301.
N
Nair, P. S. & Robinson, W. E. (1999). Purification and characterization of a histidine-rich glycoprotein that binds cadmium from the blood plasma of the bivalve Mytilus edulis. Arch Biochem Biophys 366(1), 8-14.
Narula, S. S., Brouwer, M., Hua, Y. & Armitage, I. M. (1995). Three-dimensional solution structure of Callinectes sapidus
metallothionein-1 determined by
homonuclear and heteronuclear magnetic resonance spectroscopy. Biochemistry 34(2), 620-31.
Nashef, A. S., Osuga, D. T. & Feeney, R. E. (1977). Determination of hydrogen sulfide with 5,5'-dithiobis-(2-nitrobenzoic acid), N-ethylmaleimide, and
parachloromercuribenzoate. Anal Biochem 79(1-2), 394-405.
Navabpour, S., Morris, K., Allen, R., Harrison, E., S, A. H.-M. & Buchanan-Wollaston, V. (2003). Expression of senescence-enhanced genes in response to oxidative stress. J Exp Bot 54(391), 2285-92.
Nemer, M., Stuebing, E. W., Bai, G. & Parker, H. R. (1995). Spatial regulation of SpMTA metallothionein gene expression in sea urchin embryos by a regulatory cassette in intron 1. Mech Dev 50(2-3), 131-7.
Nemer, M., Thornton, R. D., Stuebing, E. W. & Harlow, P. (1991). Structure, spatial, and temporal expression of two sea urchin metallothionein genes, SpMTB1 and SpMTA. J Biol Chem 266(10), 6586-93.
Nemer, M., Travaglini, E. C., Rondinelli, E. & D'Alonzo, J. (1984). Developmental
regulation, induction, and embryonic tissue specificity of sea urchin metallothionein gene expression. Dev Biol 102(2), 471-82. Nemer, M., Wilkinson, D. G., Travaglini, E. C.,
Sternberg, E. J. & Butt, T. R. (1985). Sea urchin metallothionein sequence: key to an evolutionary diversity. Proc Natl Acad Sci U S A 82(15), 4992-4.
Nettesheim, D. G., Engeseth, H. R. & Otvos, J. D. (1985). Products of metal exchange reactions of metallothionein. Biochemistry 24(24), 6744-51.
O
Ohtake, H., Suyemitsu, T. & Koga, M. (1983). Sea urchin (Anthocidaris crassispina) egg zinc-binding protein. Cellular localization, purification and characterization. Biochem J 211(1), 109-18.
Olafson, R. W., McCubbin, W. D. & Kay, C. M. (1988). Primary- and secondary-structural analysis of a unique prokaryotic
metallothionein from a Synechococcus sp. cyanobacterium. Biochem J 251(3), 691-9. Otvos, J. D., Liu, X., Li, H., Shen, G. & Basti, M.
(1993). Dynamic Aspects of Metallothionein Structure. 55-74. Metallothionein III, Biological Roles and Medical Implications. Birkhäuser-Verlag, Basel, Switzerland. Otvos, J. D., Olafson, R. W. & Armitage, I. M.
(1982). Structure of an invertebrate metallothionein from Scylla serrata. J Biol Chem 257(5), 2427-31.
Oz, G., Zangger, K. & Armitage, I. M. (2001). Three-dimensional structure and dynamics of a brain specific growth inhibitory factor: metallothionein-3. Biochemistry 40(38), 11433-41.
P
Palmiter, R. D. (1998). The elusive function of metallothioneins. Proc Natl Acad Sci U S A 95(15), 8428-30.
Palumaa, P., Mackay, E. A. & Vasak, M. (1992). Nonoxidative cadmium-dependent dimerization of Cd7-metallothionein from rabbit liver. Biochemistry 31(7), 2181-6. Palumaa, P. & Vaher, M. (1996). Metal-induced
dimerization of Cd7-metallothionein. Role of anions. Ann Clin Lab Sci 26(3), 264-8. Palumaa, P., Zerbe, O. & Vasak, M. (1993).
Formation and spectroscopic
of metallothionein. Biochemistry 32(11), 2874-9.
Pande, J., Pande, C., Gilg, D., Vasak, M., Callender, R. & Kagi, J. H. (1986). Raman, infrared, and circular dichroism
spectroscopic studies on metallothionein: a predominantly "turn"-containing protein. Biochemistry 25(19), 5526-32.
Pande, J., Vasak, M. & Kagi, J. H. (1985). Interaction of lysine residues with the metal thiolate clusters in metallothionein.
Biochemistry 24(23), 6717-22.
Pena, M. M., Koch, K. A. & Thiele, D. J. (1998). Dynamic regulation of copper uptake and detoxification genes in Saccharomyces cerevisiae. Mol Cell Biol 18(5), 2514-23. Piccinni, E., Albergoni, V. (1996). Cadmium
detoxification in Protists.
Comp.Biochem.Physiol.C 113(2), 141-7. Piccinni, E., Bertaggia, D., Santovito, G., Miceli,
C. & Kraev, A. (1999). Cadmium metallothionein gene of Tetrahymena pyriformis. Gene 234(1), 51-9.
Piccinni, E., Irato, P., Coppellotti, O. & Guidolin, L. (1987). Biochemical and ultrastructural data on Tetrahymena pyriformis treated with copper and cadmium. J Cell Sci 88 (Pt 3), 283-93.
Piccinni, E., Staudenmann, W., Albergoni, V., De Gabrieli, R. & James, P. (1994). Purification and primary structure of metallothioneins induced by cadmium in the protists Tetrahymena pigmentosa and Tetrahymena pyriformis. Eur J Biochem 226(3), 853-9. Pitt, B. R., Schwarz, M., Woo, E. S., Yee, E.,
Wasserloos, K., Tran, S., Weng, W., Mannix, R. J., Watkins, S. A., Tyurina, Y. Y., Tyurin, V. A., Kagan, V. E. & Lazo, J. S. (1997). Overexpression of metallothionein decreases sensitivity of pulmonary endothelial cells to oxidant injury. Am J Physiol 273(4 Pt 1), L856-65.
Q
Quaife, C. J., Findley, S. D., Erickson, J. C., Froelick, G. J., Kelly, E. J., Zambrowicz, B. P. & Palmiter, R. D. (1994). Induction of a new metallothionein isoform (MT-IV) occurs during differentiation of stratified
expanded by insertion mutagenesis. Protein Eng 3(3), 205-13.
Riek, R., Precheur, B., Wang, Y., Mackay, E. A., Wider, G., Guntert, P., Liu, A., Kagi, J. H. & Wuthrich, K. (1999). NMR structure of the sea urchin (Strongylocentrotus purpuratus) metallothionein MTA. J Mol Biol 291(2), 417-28.
Rigby, K. E., Chan, J., Mackie, J. & Stillman, M. J. (2006). Molecular dynamics study on the folding and metallation of the individual domains of metallothionein. Proteins 62(1), 159-72.
Rigby, K. E. & Stillman, M. J. (2004). Structural studies of metal-free metallothionein. Biochem Biophys Res Commun 325(4), 1271-8. Robbins, A. H., McRee, D. E., Williamson, M.,
Collett, S. A., Xuong, N. H., Furey, W. F., Wang, B. C. & Stout, C. D. (1991). Refined crystal structure of Cd, Zn metallothionein at 2.0 A resolution. J Mol Biol 221(4), 1269-93.
Robinson, N. J., Barton, K., Naranjo, C. M., Sillerud, L. O., Trewhella, J., Watt, K. & Jackson, P. J. (1987). Characterization of metal binding peptides from cadmium resistant plant cells. Experientia Suppl 52, 323-7.
Roesijadi, G., Kielland, S. & Klerks, P. (1989). Purification and properties of novel molluscan metallothioneins. Arch Biochem Biophys 273(2), 403-13.
Romero-Isart, N., Cols, N., Termansen, M. K., Gelpi, J. L., Gonzalez-Duarte, R., Atrian, S., Capdevila, M. & Gonzalez-Duarte, P. (1999). Replacement of terminal cysteine with histidine in the metallothionein alpha and beta domains maintains its binding capacity. Eur J Biochem 259(1-2), 519-27. Roosens, N. H., Bernard, C., Leplae, R. &
Verbruggen, N. (2004). Evidence for copper homeostasis function of metallothionein (MT3) in the hyperaccumulator Thlaspi caerulescens. FEBS Lett 577(1-2), 9-16.
S
Bibliografia
Scudiero, R., Capasso, C., Carginale, V., Riggio, M., Capasso, A., Ciaramella, M., Filosa, S. & Parisi, E. (1997). PCR amplification and cloning of metallothionein complementary DNAs in temperate and Antarctic sea urchin characterized by a large difference in egg metallothionein content. Cell Mol Life Sci 53(5), 472-7.
Scudiero, R., Capasso, C., De Prisco, P. P., Capasso, A., Filosa, S. & Parisi, E. (1994). Metal-binding proteins in eggs of various sea urchin species. Cell Biol Int 18(1), 47-53. Scudiero, R., Temussi, P. A. & Parisi, E. (2005).
Fish and mammalian metallothioneins: a comparative study. Gene 345(1), 21-6. Searle, P. F. (1990). Zinc dependent binding of a
liver nuclear factor to metal response element MRE-a of the mouse metallothionein-I gene and variant
sequences. Nucleic Acids Res 18(16), 4683-90. Serra, R., Isani, G., Tramontano, G. & Carpene,
E. (1999). Seasonal dependence of cadmium accumulation and Cd-binding proteins in Mytilus galloprovincialis exposed to
cadmium. Comp Biochem Physiol C Pharmacol Toxicol Endocrinol 123(2), 165-74.
Shang, Y., Song, X., Bowen, J., Corstanje, R., Gao, Y., Gaertig, J. & Gorovsky, M. A. (2002). A robust inducible-repressible promoter greatly facilitates gene knockouts,
conditional expression, and overexpression of homologous and heterologous genes in Tetrahymena thermophila. Proc Natl Acad Sci U S A 99(6), 3734-9.
Sievers, C., Deters, D., Hartmann, H. J. & Weser, U. (1996). Stable thiyl radicals in dried yeast Cu(I)6-thionein. J Inorg Biochem 62(3), 199-205.
Silar, P., Theodore, L., Mokdad, R., Erraiss, N. E., Cadic, A. & Wegnez, M. (1990).
Metallothionein Mto gene of Drosophila melanogaster: structure and regulation. J Mol Biol 215(2), 217-24.
Silar, P. & Wegnez, M. (1990). Expression of the Drosophila melanogaster metallothionein genes in yeast. FEBS Lett 269(1), 273-6. Slice, L. W., Freedman, J. H. & Rubin, C. S.
(1990). Purification, characterization, and cDNA cloning of a novel metallothionein-like, cadmium-binding protein from Caenorhabditis elegans. J Biol Chem 265(1), 256-63.
Soazig, L. & Marc, L. (2003). Potential use of the levels of the mRNA of a specific
metallothionein isoform (MT-20) in mussel (Mytilus edulis) as a biomarker of cadmium
contamination. Mar Pollut Bull 46(11), 1450-5.
Southon, A., Burke, R., Norgate, M., Batterham, P. & Camakaris, J. (2004). Copper
homoeostasis in Drosophila melanogaster S2 cells. Biochem J 383(Pt 2), 303-9.
Sturzenbaum, S. R., Georgiev, O., Morgan, A. J. & Kille, P. (2004). Cadmium detoxification in earthworms: from genes to cells. Environ Sci Technol 38(23), 6283-9.
Suzuki, K. T., Ohnuki, R. & Yaguchi, K. (1983). Post-mortem and in vitro dimerization of metallothionein in cadmium-accumulated rat liver and kidney. Toxicol Lett 16(1-2), 77-84.
Swain, S. C., Keusekotten, K., Baumeister, R. & Sturzenbaum, S. R. (2004). C. elegans metallothioneins: new insights into the phenotypic effects of cadmium toxicosis. J Mol Biol 341(4), 951-59.
Syring, R. A., Hoexum Brouwer, T. & Brouwer, M. (2000). Cloning and sequencing of cDNAs encoding for a novel copper-specific metallothionein and two
cadmium-inducible metallothioneins from the blue crab Callinectes sapidus. Comp Biochem Physiol C Toxicol Pharmacol 125(3), 325-32.
T
Tang, W., Kido, T., Gross, W. A., Nogawa, K., Sabbioni, E. & Shaikh, Z. A. (1999). Measurement of cadmium-induced metallothionein in urine by ELISA and prevention of overestimation due to polymerization. J Anal Toxicol 23(3), 153-8. Tanguy, A., Boutet, I., Bonhomme, F., Boudry, P.
& Moraga, D. (2002). Polymorphism of metallothionein genes in the Pacific oyster Crassostrea gigas as a biomarker of response to metal exposure. Biomarkers 7(6), 439-50. Tanguy, A. & Moraga, D. (2001). Cloning and
characterization of a gene coding for a novel metallothionein in the Pacific oyster Crassostrea gigas (CgMT2): a case of adaptive response to metal-induced stress? Gene 273(1), 123-30.
Templeton, D. M. & Cherian, M. G. (1985). Chemical modifications of metallothionein, II. Metabolic fate of cadmium bound to metallothionein polymers. Toxicol Lett 25(3), 279-86.
Theocharis, S. E., Margeli, A. P., Klijanienko, J. T. & Kouraklis, G. P. (2004). Metallothionein expression in human neoplasia.
Thornalley, P. J. & Vasak, M. (1985). Possible role for metallothionein in protection against radiation-induced oxidative stress. Kinetics and mechanism of its reaction with superoxide and hydroxyl radicals. Biochim Biophys Acta 827(1), 36-44.
Timmermans, M. J., Ellers, J., Roelofs, D. & van Straalen, N. M. (2005). Metallothionein mRNA expression and cadmium tolerance in metal-stressed and reference populations of the springtail Orchesella cincta.
Ecotoxicology 14(7), 727-39.
Tio, L., Villarreal, L., Atrian, S. & Capdevila, M. (2004). Functional differentiation in the mammalian metallothionein gene family: metal binding features of mouse MT4 and comparison with its paralog MT1. J Biol Chem 279(23), 24403-13.
Tommey, A. M., Shi, J., Lindsay, W. P., Urwin, P. E. & Robinson, N. J. (1991). Expression of the pea gene PSMTA in E. coli. Metal-binding properties of the expressed protein. FEBS Lett 292(1-2), 48-52.
Tucker, S. L., Thornton, C. R., Tasker, K., Jacob, C., Giles, G., Egan, M. & Talbot, N. J. (2004). A fungal metallothionein is required for pathogenicity of Magnaporthe grisea. Plant Cell 16(6), 1575-88.
U
Uchida, Y., Takio, K., Titani, K., Ihara, Y. & Tomonaga, M. (1991). The growth inhibitory factor that is deficient in the Alzheimer's disease brain is a 68 amino acid metallothionein-like protein. Neuron 7(2), 337-47.
V
Vallee, B. L. & Auld, D. S. (1990). Zinc
coordination, function, and structure of zinc enzymes and other proteins. Biochemistry 29(24), 5647-59.
Valls, M., Bofill, R., Gonzalez-Duarte, R., Gonzalez-Duarte, P., Capdevila, M. & Atrian, S. (2001). A new insight into metallothionein (MT) classification and evolution. The in vivo and in vitro metal binding features of Homarus americanus
metazoan copper-thionein related to fungal forms. FEBS Lett 467(2-3), 189-94.
Vasak, M. (1991). Metal removal and
substitution in vertebrate and invertebrate metallothioneins. Methods Enzymol 205, 452-8.
Vasak, M. (2005). Advances in metallothionein structure and functions. J Trace Elem Med Biol 19(1), 13-7.
Vatamaniuk, O. K., Bucher, E. A., Sundaram, M. V. & Rea, P. A. (2005). CeHMT-1, a putative phytochelatin transporter, is required for cadmium tolerance in Caenorhabditis elegans. J Biol Chem 280(25), 23684-90.
Vatamaniuk, O. K., Bucher, E. A., Ward, J. T. & Rea, P. A. (2001). A new pathway for heavy metal detoxification in animals.
Phytochelatin synthase is required for cadmium tolerance in Caenorhabditis elegans. J Biol Chem 276(24), 20817-20.
Vergani, L., Grattarola, M., Borghi, C., Dondero, F. & Viarengo, A. (2005). Fish and
molluscan metallothioneins. Febs J 272(23), 6014-23.
Viarengo, A., Burlando, B., Cavaletto, M., Marchi, B., Ponzano, E. & Blasco, J. (1999). Role of metallothionein against oxidative stress in the mussel Mytilus galloprovincialis. Am J Physiol 277(6 Pt 2), R1612-9.
Viarengo, A., Burlando, B., Ceratto, N. & Panfoli, I. (2000). Antioxidant role of
metallothioneins: a comparative overview. Cell Mol Biol (Noisy-le-grand) 46(2), 407-17. Villarreal, L., Tio, L., Atrian, S. & Capdevila, M.
(2005). Influence of chloride ligands on the structure of Zn- and Cd-metallothionein species. Arch Biochem Biophys 435(2), 331-5. Villarreal, L., Tio, L., Capdevila, M. & Atrian, S.
(2006). Comparative metal binding and genomic analysis of the avian (chicken) and mammalian metallothionein. Febs J 273(3), 523-35.
W
Wachtershauser, G. (1988). Before enzymes and templates: theory of surface metabolism. Microbiol Rev 52(4), 452-84.
Wagner, G., Frey, M. H., Neuhaus, D.,
Bibliografia
metallothionein-3 (MT-3). FEBS Lett 580(3), 795-800.
Wang, Y., Mackay, E. A., Kurasaki, M. & Kagi, J. H. (1994). Purification and characterisation of recombinant sea urchin metallothionein expressed in Escherichia coli. Eur J Biochem 225(1), 449-57.
Wang, Y., Mackay, E. A., Zerbe, O., Hess, D., Hunziker, P. E., Vasak, M. & Kagi, J. H. (1995). Characterization and sequential localization of the metal clusters in sea urchin metallothionein. Biochemistry 34(22), 7460-7.
Wilhelmsen, T. W., Olsvik, P. A., Hansen, B. H. & Andersen, R. A. (2002). Evidence for oligomerization of metallothioneins in their functional state. J Chromatogr A 979(1-2), 249-54.
Wilkinson, D. G. & Nemer, M. (1987). Metallothionein genes MTa and MTb expressed under distinct quantitative and tissue-specific regulation in sea urchin embryos. Mol Cell Biol 7(1), 48-58.
Willuhn, J., Schmitt-Wrede, H. P., Greven, H. & Wunderlich, F. (1994). cDNA cloning of a cadmium-inducible mRNA encoding a novel cysteine-rich, non-metallothionein 25-kDa protein in an enchytraeid earthworm. J Biol Chem 269(40), 24688-91.
Winge, D., Dameron, C. T. & Mehra, R. K. (1992). Metal:Sulfide Quantum Crystallites in Yeast. In Stillman, M.J., Shaw, C.F., 3rd & KT, S. (Eds.), Metallothioneins pp. 257-70. New York: VCH.
Winge, D. R. & Miklossy, K. A. (1982). Differences in the polymorphic forms of metallothionein. Arch Biochem Biophys 214(1), 80-8.
Winge, D. R., Nielson, K. B., Gray, W. R. & Hamer, D. H. (1985). Yeast metallothionein. Sequence and metal-binding properties. J Biol Chem 260(27), 14464-70.
Y
You, C., Mackay, E. A., Gehrig, P. M., Hunziker, P. E. & Kagi, J. H. (1999). Purification and characterization of recombinant
Caenorhabditis elegans metallothionein. Arch Biochem Biophys 372(1), 44-52.
Z
Zangger, K. & Armitage, I. M. (2002). Dynamics of interdomain and intermolecular
interactions in mammalian
metallothioneins. J Inorg Biochem 88(2), 135-43.
Zangger, K., Oz, G., Otvos, J. D. & Armitage, I. M. (1999). Three-dimensional solution structure of mouse [Cd7]-metallothionein-1 by homonuclear and heteronuclear NMR spectroscopy. Protein Sci 8(12), 2630-8. Zangger, K., Shen, G., Oz, G., Otvos, J. D. &
Armitage, I. M. (2001). Oxidative
dimerization in metallothionein is a result of intermolecular disulphide bonds between cysteines in the alpha-domain. Biochem J 359(Pt 2), 353-60.
Zhang, B., Egli, D., Georgiev, O. & Schaffner, W. (2001). The Drosophila homolog of
mammalian zinc finger factor MTF-1 activates transcription in response to heavy metals. Mol Cell Biol 21(14), 4505-14. Zhou, G. K., Xu, Y. F. & Liu, J. Y. (2005).
Characterization of a rice class II metallothionein gene: tissue expression patterns and induction in response to abiotic factors. J Plant Physiol 162(6), 686-96. Zhou, J. & Goldsbrough, P. B. (1994). Functional homologs of fungal metallothionein genes from Arabidopsis. Plant Cell 6(6), 875-84. Zhu, C., Lü, T., Zhang, R., Zhao, N., Liu, J.
(2000). Modeling of kiwifruit
metallothionein Kiwi503. Chinese Science Bulletin 45(15), 1413-7.
Zhu, Z., DeRose, E. F., Mullen, G. P., Petering, D. H. & Shaw, C. F., 3rd. (1994). Sequential proton resonance assignments and metal cluster topology of lobster metallothionein-1. Biochemistry 33(30), 8858-65.
·
TESI DOCTORAL
Realitzada al Departament de Genètica de la Facultat de
Abreviatures
aa: Aminoàcids.
C-term: Carboxi-terminal, corresponent a l’extrem de la proteïna que té un grup carboxil lliure (COO-). CD: Espectroscòpia de Dicroisme Circular.
Cdn-MT: MT que conté “n” ions de Cd. Cys: Cisteïna.
ESI-MS: Espectrometria de Masses amb ionització per electroesprai. FPLC: Cromatografia líquida de ràpida resolució.
GC-FPD: Cromatografia de gasos acoblada a un detector fotomètric de flama. His: histidina.
ICP-AES: Espectroscòpia d’emissió atòmica de plasma acoblat per inducció. IR: Espectroscòpia d’infraroig.
M: metall.
MT: metal·lotioneïna.
N-term: amino-terminal, corresponent a l’extrem de la proteïna que té un grup amino lliure (- NH2).
NMR: Ressonància Magnètica Nuclear. PC: fitoquelatina.
ROS: espècies reactives d’oxigen. RSS: espècies reactives de sofre.
TOF-ESI-MS: Espectrometria de masses de temps de vol amb ionització per electroesprai. Tris: Tris (hidroximetil) aminometà.
UV-vis: Espectroscòpia d’absorció d’ultraviolat-visible.
Espècies
Caenorhabditis elegans. Nematode.
Drosophila melanogaster: Insecte, dípter. Nom comú: mosca del vinagre. Mytilus edulis. Mol·lusc bivalve marí. Nom comú: Musclo.
Quercus suber. Planta espermatòfita arbòrea. Nom comú: Alzina surera. Strongylocentrotus purpuratus: Equinoderm. Nom comú: eriçó de mar. Tetrahymena pyriformis. Espècie de protozou del grup dels ciliats.
Pèptids
C18: Pèptid mutant corresponent a la regió C-terminal de la MT QsMT de Q.suber. CeC: Pèptid mutant corresponent a la regió C-terminal de la MT MTL2 de C.elegans. CeΔHis: Pèptid mutant corresponent a la regió C-terminal de la MT MTL2 de C.elegans. CeMT2: MTL2 de C.elegans.
CeN: Pèptid mutant corresponent a la regió N-terminal de la MT MTL2 de C.elegans. MeMT: MT-10-IV de M.edulis.
MtnA: també anomenada Mtn, una de les isoformes MT de D.melanogaster. MtnB: també anomenada Mto, una de les isoformes MT de D.melanogaster. MtnC, una de les isoformes MT de D.melanogaster.
MtnD, una de les isoformes MT de D.melanogaster.
N25: Pèptid mutant corresponent a la regió N-terminal de la MT QsMT de Q.suber.
N25-C18: Pèptid mutant corresponent a la MT QsMT de Q.suber amb l’espaiador delecionat. QsMT: MT QsMT de Q.suber.
·
TESI DOCTORAL
Realitzada al Departament de Genètica de la Facultat de
Discussió
1- UN ESTUDI
FUNCIONAL
DE
LES METAL·LOTIONEÏNES
En l’estudi de la funció d’un gen o proteïna, existeixen dues aproximacions bàsiques: Una consisteix en alterar la seva estructura o participació en el sistema en què presumptament participa, i veure què succeeix , en cas de succeir alguna cosa (és l’anomenada genètica reversa i consisteix en l’estudi de mutants puntuals o organismes Knock-Out). L’altra, de vessant
més descriptiva, es centra en estudiar les propietats intrínseques d’aquest gen o proteïna per intentar establir quins són els seus camps d’acció potencials. Mentre la primera corre el risc de topar amb efectes que no tenen res a veure amb el funcionament habitual del sistema, o dificultats en atribuir la xarxa de relacions causa-efecte, la segona corre el risc de descriure allò que són estrictament propietats, i no pas funcions, de l’element estudiat. Habitualment, les dues aproximacions es complementen en qualsevol procés de recerca, i tot i que aquesta tesi està plantejada fonamentalment a descriure les potencialitats funcionals de les MT, planteja també alguns casos d’estudi per anàlisi de mutants.
La metodologia adoptada permet obtenir agregats metall-MT sintetitzats en cèl·lules d’E.coli i, per tant, en un ambient fisiològic
representatiu de l’ambient en què es sintetitzen aquestes MT en forma nativa. Això suposa que els agregats metall-MT obtinguts són formes estables en ambients intracel·lulars i, per tant, molt més representatius d’aquells que es conformin en els respectius organismes originals que no pas formes obtingudes per síntesi química i/o per reconstitució “in vitro” de
complexos metàl·lics a partir de pèptids apo als quals s’han afegit metalls. Caldria tenir en compte, però dos aspectes generals relacionats amb aquesta metodologia: 1) Moltes proteïnes presenten habitualment processos de modificació post-traduccionals La majoria dels mecanismes pels quals es duen a terme aquests processos en cèl·lules eucariotes (de les que
són originàries les MT estudiades en aquesta tesi) no es troben actius en cèl·lules procariotes (en què s’han sintetitzat els agregats metall-MT estudiats en aquesta tesi). Tot i això, s’ha descrit que aquests processos no prenen habitualment part en la formació dels agregats metall-MT, per la qual cosa podem considerar que aquesta limitació no aplica a l’estudi de MT recombinants, i 2) El procés de síntesi implica l’addició d’altes concentracions de metalls (Zn, Cu o Cd) en el medi, possiblement allunyades de les concentracions en què aquestes MT es trobarien in vivo. Tot i això, dades d’altres
autors indiquen que el contingut intracel·lular de metalls és molt similar entre diferents organismes (Finney & O’Halloran, 2003).
Tot seguit es discuteixen de manera global els resultats obtinguts en quatre apartats: la relació entre l’estructura i el comportament coordinant de les MT (la seva funció molecular), la relació entre el comportament coordinant i les dades de què es disposa de la “funció fisiològica”, el paper dels sulfurs en les MT, i les aportacions metodològiques a l’estudi de les MT.
2- LA RELACIÓ
ESTRUCTURA-PROPIETATS COORDINANTS
EN MT
Tot seguit es comenta, de forma general i transversal, les relacions que es poden extreure d’aquesta tesi entre els diferents nivells estructurals i les propietats coordinants de les MT estudiades. Aquestes propietats coordinants inclouen tant les preferències de coordinació metàl·lica com la capacitat d’unió a metalls, participació de lligands exògens i estructures primàries, secundàries, terciàries i quaternàries.
2.1- L’estructura primària i les preferències de coordinació metàl·lica
disposició de les Cys, la presència de les His i el possible paper d’altres aminoàcids.
2.1.1- La mida del pèptid MT i la quantitat de cisteïnes
En aquesta tesi s’ha estudiat el comportament coordinant de pèptids MT amb mides molt diferents, des de la MT de
Tetrahymena, amb 107 aminoàcids i 31 Cys,
fins al fragment C-terminal de QsMT de
Quercus suber, anomenat pèptid C18,
constituït per 18 residus, dels quals 6 són Cys. De forma general, s’aprecia que els pèptids més petits (C18 i N25 de QsMT) presenten comportaments peculiars com la formació de dímers que es poden atribuir a la seva reduïda mida.
La MT més petita coneguda és la de
Neurospora crassa (NcMT), amb 25
aminoàcids i 7 Cys, que uneix 6 Cu(I) (Lerch, 1980). Els nostres resultats indiquen que C18 (6 Cys) dimeritza quan s’enllaça a Cu(I), mentre N25 (8 Cys) no necessita fer-ho per a unir aquest mateix metall. La dimerització en C18 indicaria que aquest és un pèptid massa petit per conformar agregats Cu(I)-MT estables en un entorn fisiològic, de forma monomèrica.
Aquest resultat confirmaria que la MT de
Neurospora no només és la MT més petita
que es coneix, sinó que possiblement sigui la MT més petita que pot unir Cu sense necessitat de dimeritzar. Els pèptids MT NcMT, C18, N25 mostren preferència cap a coordinació de Cu(I), i tots tenen un contingut inferior a 8 Cys. Al mateix temps, C18 i N25 donen lloc a més d’un agregat quan uneixen Zn o Cd, amb espècies dimèriques, suggerint també inestabilitat cap a la coordinació de metalls divalents. Els pèptids MT que contenen 9 Cys presenten comportaments diversos: mentre el domini beta de la MT1 de mamífer
independent (Bofill et al., 1999) i el domini
N-terminal independent de la MT de
Els pèptids MT de mides superiors, com el domini alfa de la MT de mamífer (11 Cys)
(Bofill et al., 1999) o la MT de Synechococcus
SmtA (Blindauer et al., 2001) (amb un total
de 12 aminoàcids coordinants, 9 Cys i 3 His) presenten, en canvi, especificitat per la unió de Zn. De manera general, doncs, els resultats semblen indicar que els pèptids MT que incloguin menys de 7 Cys no donen lloc a agregats estables de Cu, i que, per altra banda, l’estabilitat i preferència per la unió de Zn s’assoleix en pèptids MT a partir de les 9 Cys en la seva seqüència. Aparentment, existirien restriccions espacials que marcarien aquestes limitacions. Tot i això, aquestes restriccions no impedeixen que pèptids MT majors de 9 Cys presentin un caràcter de Cu-tioneïnes, com seria el cas de CeHis (forma mutant de la MT2 de C.elegans amb 18 Cys),
SpMTA d’equinoderm (amb 20 Cys), les isoformes de Drosophila MtnA (10 Cys),
MtnB, MtnC i MtnD (12 Cys), MT4 de mamífer (20 Cys) (Tio et al., 2004) i CUP1 de
llevat (12 Cys) (Winge et al., 1985). En tot
cas, les MT silvestres de menys de 11 aminoàcids coordinants tenen en comú la preferència de coordinació de Cu.
2.1.2- Els patrons de cisteïnes
Discussió
Alhora, cadascun d’aquests ions metàl·lics veuran més satisfets els seus requeriments en quant a les geometries de coordinació tot depenent de la disposició de les Cys al llarg del pèptid. En aquest sentit, els primers estudis realitzats en el nostre grup amb anterioritat a aquesta tesi, posaren de manifest que les metal·lotioneïnes MT1 de mamífer (Bofill et al., 2001) i MTH de
llamàntol (Valls et al., 2001), que presenten
doblets Cys-Cys en la seva seqüència, manifestaven un comportament de Zn-tioneïna, mentre la MT de Drosophila MtnA
(Valls et al., 2000), i el domini beta de la MT1
de mamífer (Cols et al., 1999), que
presentaven patrons de distribució de Cys del tipus Cys-X-Cys i una absència total de doblets Cys-Cys, manifestaven caràcter de Cu-tioneïna. Aquesta correspondència entre la preferència pel Zn i els doblets Cys-Cys, a més, es corresponia amb la visió, generalment acceptada, que el domini beta
de la MT de mamífer constituiria un domini evolutivament més “primitiu” amb preferència pel Cu, mentre el domini alfa
(amb doblets de Cys) constituiria un domini més “modern”, amb preferència cap al Zn. Tot i així, la bibliografia posà de manifest des d’un primer moment que CUP1 de llevat era una Cu-tioneïna, malgrat presentar doblets Cys-Cys (Hamer
et al., 1985; Winge et al., 1985), i,
paral·lelament a aquesta tesi, estudis realitzats per altres membres del grup de recerca han determinat que MT4 de mamífer (amb doblets de Cys) mostra preferència pel Cu. Addicionalment, la presència d’un mateix patró cisteínic, els triplets Cys-Cys-Cys, estava associada a especialització funcional pel Cu en
C.sapidus (Syring, et al., 2000), i per a metalls
divalents en el gènere Tetrahymena
(Santovito et al., 2001).
Així doncs, sembla que els patrons de Cys, encara que relacionats amb les preferències de coordinació metàl·lica, no en són els únics determinants.
En aquesta tesi s’ha estudiat el comportament coordinant de 9 MT i de 6 formes mutants. Dels 15 pèptids estudiats, només 4, MtnA (descrit parcialment abans
per Valls et al. (2000), C18 i N25 de QsMT
(sense doblets Cys i amb caràcter de Cu-tioneïna) i TpMT1 de Tetrahymena (amb
doblets Cys i caràcter de Zn-tioneïna) mostren preferències coordinants que responen a l’associació entre la presència/absència de doblets Cys i les preferències coordinants descrites anteriorment. Les MT SpMTA d’equinoderm, MtnB, MtnC i MtnD de
Drosophila, presenten doblets Cys, i tot i
això són Cu-tioneïnes. En la forma mutant CeHis de la MT de C.elegans en què s’ha
deleccionat la His, la presència de doblets Cys-Cys no és suficient com per a determinar una preferència pel Zn. La MT MT-10-IV de M.edulis, malgrat no presentar
ni un sol doblet Cys-Cys en la seva seqüència, és la MT que, entre totes les estudiades en aquesta tesi, mostra majors graus d’estructuració i de preferència pel Zn. Les nostres dades semblen indicar que la presència/absència de doblets Cys-Cys, tot i poder ser un factor implicat en la determinació de les preferències coordinants, no les determina de forma unívoca. En el cas de la MT de Tetrahymena,
la relació entre els patrons d’expressió i la presència/absència de triplets de Cys en les diferents MT d’aquest gènere sembla indicar que la presència de triplets podria estar associada a l’especificitat funcional cap a unió de metalls divalents. Les nostres dades indiquen que TpMT1 (amb triplets Cys-Cys-Cys) és una Zn-tioneïna i semblen estar d’acord amb aquesta associació.
2.1.3- Les histidines
Com s’ha ja comentat en la introducció, d’entre els aminoàcids no cisteínics amb capacitat d’unió a metalls, en destaca la His, un aminoàcid del que s’ha ja provat la seva capacitat d’unió a metalls en alguns agregats metall-MT (Romero-Isart et al.,
1999; Blindauer et al., 2001).
En aquesta tesi s’han dut a terme estudis amb CeMT2 de C.elegans i QsMT de
Quercus suber, que contenen una His,
His juga un paper en la coordinació metàl·lica, el paper d’aquest aminoàcid sembla ésser molt diferent per a les dues MT.
La participació de la His en QsMT sembla estar restringida a la coordinació de Cd. En Cu-QsMT no s’aprecien diferències entre la forma silvestre i el mutant N25-C18 (que està mancat de la zona central o espaiador),
cosa que suggereix que l’espaiador i la His que hi està inclosa no juguen un paper en la unió a metalls ni l’estructuració de l’agregat. En Zn-QsMT les anàlisis dels espectres Raman i CD no aporten cap indici de la participació de la His en la unió a metalls. És només en les síntesis de Cd-QsMT que la participació d’aquesta His en la coordinació metàl·lica, és evidenciada tant per inequívoques senyals del seu espectre Raman, com per absorbàncies al CD que ja s’havien observat anteriorment en pèptids MT1 en què alguna Cys havia estat mutada a His (Romero-Isart et al.,
1999). En les diverses síntesis de Cd-QsMT s’han obtingut continguts metàl·lics similars, però existeixen diferències en els seus CD que es poden atribuir a diferents participacions de la His. Això indicaria que la His és un lligand opcional de QsMT que aporta una variabilitat estructural que no afecta la capacitat quelatant total de la proteïna.
En el cas de C.elegans, la His sembla jugar
un paper molt més fonamental. En la forma mutant CeHis (amb deleció per la His terminal), el CD dels agregats de Zn indica diferències estructurals importants respecte la forma silvestre. Tot i així, per a Zn i Cd, encara que la His sembla jugar un paper en la formació de dímers (com es comenta més endavant) la seva pèrdua no sembla afectar la capacitat coordinant.
L’efecte més determinant, però, és el que s’observa en la unió de Cu, ja que la pèrdua de la His provoca un canvi en les
homometàl·lic de Cu. Aquesta diferència indica un paper crucial de la His en la determinació de les preferències coordinants de CeMT2.
En ésser purificades en forma nativa d’organismes sotmesos a altes concentracions de Cd, les isoformes CeMT1 i CeMT2 mostren un contingut metàl·lic diferent. Així, d’acord amb la literatura, CeMT1 (amb 4 His) uneix Cd i Zn, mentre que CeMT2 (amb només una His) uneix només Cd (You et al., 1999).
També s’ha descrit a la bibliografia que la presència d’His a la zona C-terminal és important també per determinar l’especificitat funcional de SmtA de cianobacteri i participa en la unió a metalls i processos de dimerització en la MT de pollastre (Villarreal et al., 2006), i
conseqüentment, els nostres resultats, indiquen que en les MT que inclouen His en la seva seqüència l’estudi de la seva participació en la constitució d’agregats metàl·lics és indispensable
2.2- Altres lligands: lligands exògens Malgrat que els elements dels diferents nivells estructurals (estructura primària, secundària, terciària i quaternària) determinarien d’una manera important les propietats coordinants, existeixen indicis de la participació de lligands exògens en agregats metall-MT. Lligands exògens com el compostos inorgànics que contenen fòsfor (Palumaa, et al., 1993), clorurs (Maret et al., 2002) i sulfur (Capdevila et al., 2005)
són els principals exemples d’un camp no del tot ben explorat en les MT.
Els agregats metall-MT sintetitzats in vivo en E.coli contenen ions sulfur (S2-)
Discussió
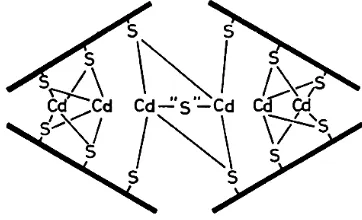
1992). Els agregats metall-sulfur d’aquest tipus reben el nom de cristallytes.
L’estructura d’aquests cristallytes estaria
basada en els sulfurs actuant de pont entre dos ions metàl·lics, tal com es veu a la Fig. 29 (Winge et al., 1985; Hayashi, et al., 1986).
Durant la caracterització dels agregats Cd-QsMT d’aquesta tesi s’obtingueren alguns resultats aparentment incoherents: els espectres de CD mostraven absorbàncies entre 260 i 320 nm, que no es corresponien amb les esperades per a la coordinació Cd-tiolat, i l’estequiometria mitjana dels agregats calculada per ICP-AES no es corresponia amb els resultats calculats a partir d’ESI-MS.
Fig. 29- Estructura del cluster metàl·lic de les Cd-PC de S.pombe. Esquema extret de (Hayashi et al., 1986). Les línies gruixudes representen les PC, les línies primes representen els enllaços Cd-Sulfur i Cd-tiol que mantenen l’agregat unit.
L’estudi de l’espectre de CD mostrà que absorcions similars a les detectades en els agregats Cd-QsMT s’havien observat prèviament en agregats Cd-MtnA (Valls et al., 2000), i havien estat associades a
complexos Cd-fitoquelatina que contenien sulfurs. Les absorbàncies detectades al CD, doncs, indicaven que els agregats Cd-QsMT podien contenir ions sulfur actuant com a lligands del Cd, que podien explicar els estranys resultats obtinguts.
El desenvolupament de nous protocols d’anàlisi (ICPàcid, GC-FPD) i la reinterpretació de les dades (ESI-MS) considerant la presència dels ions sulfur permeté confirmar aquesta hipòtesi i establir la presència d’ions sulfur no només en QsMT, sinó de manera general en totes les MT estudiades. Els resultats obtinguts en aquesta tesi indiquen que els agregats
metall-MT sintetitzats heteròlogament en
E.coli contenen ions sulfur. Tot i que en un
[image:21.595.102.283.299.409.2]primer moment, la presència de sulfur fou detectada exclusivament en els agregats amb Cd, els resultats presentats en aquesta tesi posen en evidència que els ions sulfur són també presents en agregats Zn-MT i Cu-MT, tot i que els agregats Cd-MT són els que ne presenten una major quantitat, i els agregats Cu-MT són els que en tenen un menor contingut. El senyal espectroscòpic al CD dels sulfurs varia en funció del metall a què es troben enllaçats. Mentre en els agregats Cd-MT s’ha establert una sèrie d’absorcions característiques de l’enllaç S-Cd entre 260 i 300 nm, en els agregats Zn-MT, només s’han detectat absorcions molt lleus en la zona entre els 250 i els 270 nm. En els agregats Cu-MT, la complexitat dels espectres de CD fa difícil atribuir les absorcions a la interacció sulfur-Cu(I). Les empremtes de CD de forma general i els espectres Raman en el cas concret de QsMT indiquen que els ions sulfur estan en aquests agregats interaccionant directament amb metalls, i que podrien estar units als metalls d’una forma similar a la que aquests ions s’uneixen al ferro en la ferredoxina (Fig. 30) o al cadmi en les fitoquelatines. En el cas de Cd-QsMT, l’estudi per espectrometria Raman ha permès determinar que els ions sulfur presents en l’agregat presenten no una, sinó vàries geometries d’unió dins d’un mateix agregat.
Fig. 30- Estructura del cluster metàl·lic de la ferredoxina. Extret de (Bertini et al., 1995).
contenen sulfurs i agregats metall-PC que no en contenen (Reese et al, 1988). En les
PC, la presència de sulfurs és un factor que s’ha associat a un increment de la capacitat quelatant (Hayashi et al, 1986) i la capacitat
detoxificadora per translocació a vacuola en plantes (Hall, 2002). Això suggereix que en les PC els sulfurs no serien un element estructural imprescindible (com passa en les ferredoxines), sinó que més aviat n’incrementarien les capacitats funcionals. En les MT, els nostres resultats indiquen també la coexistència en una mateixa mostra d’agregats metall-MT amb ions sulfur i sense. Tot i això, la presència d’ions sulfur no sembla incrementar significativament les capacitats quelatants de les MT d’invertebrats i T.pyriformis
analitzades en aquesta tesi. Només en el cas de QsMT s’aprecien increments de capacitat coordinant d’ions Cd(II) respecte a la d’ions Zn(II) de forma concomitant a l’increment del contingut d’anions sulfur d’aquests complexos.
La presència generalitzada, la coexistència d’espècies amb i sense sulfur i el fet que en general aquests no afectin la capacitat coordinant de la proteïna indiquen que els sulfurs en les MT aportarien propietats funcionals no relacionades d’una manera crucial amb l’estructuració dels agregats metall-MT, tot i poder col·laborar en la seva l’estabilitat.
Tot i que els nostres resultats demostren clarament que les MT tenen la propietat d’incorporar ions sulfur en els seus agregats, i que aquesta incorporació pot tenir efectes estructurals i funcionals, fins al moment no s’havien descrit aquesta característica després de quasi 50 anys d’estudi de les MT. En constatar aquest fet, es generen dues qüestions:
1) si aquesta és una propietat general de les MT, perquè no ha estat detectada amb anterioritat? La majoria dels estudis
mitjançant l’acidificació d’agregats metall-MT purificats de teixit nadiu o procedents de síntesi heteròloga. Aquest procés d’obtenció de la MT demetalada suposaria la pèrdua dels ions sulfur que estiguin units a l’agregat metall-MT original. En altres casos, tot i que s’ha treballat amb agregats metall-MT nadius, aquests han estat obtinguts després d’exhaustius processos de purificació cromatogràfica, al llarg dels quals les espècies que contenen ions sulfur poden haver estat descartades, per constituir pics minoritaris, o allunyar-se de les propietats que hom pressuposa per als agregats metall-MT.
Per tant, en les metodologies emprades rutinàriament per als estudis estructurals i de comportament coordinant, es poden haver perdut els agregats originals que contenen sulfur.
Addicionalment, cal afegir també, que la quantitat d’ions sulfur continguts en els agregats és en general, prou baixa com perquè aquests passin desapercebuts, i que aquesta només ha estat excepcionalment elevada en els agregats QsMT i Cd-TpMT1.
2) contenen els agregats metall-MT formats en l’organisme aquests ions sulfur? La síntesi heteròloga permet obtenir agregats metall-MT fisiològicament més representatius que aquells que s’obtenen mitjançant la reconstitució o valoració in vitro. Tot i així, la síntesi heteròloga de MT
en E.coli implica per a la cèl·lula un estrès
metabòlic afegit a l’estrès metàl·lic al que és sotmesa en suplementar els medis amb els metalls. És un fet conegut que els mecanismes de defensa davant la toxicitat per metalls impliquen en E.coli una