FORMATO 1 (Anexo No.2)
CARTA DE AUTORIZACIÓN DE LOS AUTORES PARA LA CONSULTA, LA REPRODUCCIÓN PARCIAL O TOTAL, Y PUBLICACIÓN ELECTRÓNICA DEL TEXTO COMPLETO.
(OPCIONAL)
Bogotá, 3 de febrero del 2010
Señores
BIBLIOTECA GENERAL Cuidad
Estimados Señores:
Los suscritos
Marque con una X
Tesis doctoral
0
Trabajo de GradoO
Martha Cecilia Mesa Villanueva, con CC No. 51716876 , autor(es) de la tesis doctoral y/o trabajo de grado titulado UEstudio de la respuesta inmune human mediada por Linfocitos T contra Rotavirus" presentado y aprobado en el año 2010 como requisito para optar al título de Doctor en Ciencias Biológicas; autorizo (amos) a la Biblioteca General de la Universidad Javeriana para que con fines académicos, muestre al mundo la producción intelectual de la Universidad Javeriana, a través de la visibilidad de su contenido de la siguiente manera:
• Los usuarios puedan consultar el contenido de este trabajo de grado en Biblos, en los sitios web que administra la Universidad, en Bases de Datos, en otros Catálogos y en otros sitios web, Redes y Sistemas de Información nacionales e internacionales Boセ・ョ@ Access" y en las redes de información del país y del exterior, con las cuales tenga convenio la Universidad Javeriana.
• Permita la consulta, la reproducción, a los usuarios interesados en el contenido de este trabajo, para todos los usos que tengan finalidad académica, ya sea en formato CD-ROM o digital desde Internet, Intranet, etc., y en general para cualquier formato conocido o por conocer.
• Continúo conservando los correspondientes derechos sin modificación o restricción alguna; puesto que de acuerdo con la legislación colombiana aplicable, el presente es un acuerdo jurídico que en ningún caso conlleva la en¡¡.jenación del derecho de autor y sus conexos.
De conformidad con lo establecido en el artículo 30 de la Ley 23 de 1982 y el artículo 11 de la Decisión Andina 351 de 1993, セセウ@ derechos morales sobre el trabajo son propiedad de los 。オエッイ・ウGセ@ los cuales son irrenunciables, imprescriptibles, inembargables e inalienables.
Firma, nombre completo y documento de identificación del estudiante
Marth. Ceciti. Mes. Villanuev. c.c No.51716876
Al
ッNLセ@
Nャセ@
FORMATO 2 (Anexo No.3)
FORMULARIO DE LA DESCRIPCIÓN DE LA TESIS DOCTORAL O DEL TRABAJO DE
GRADO
TÍTULO COMPLETO D E LA TESIS DOCTORAL O TRABAJO DE GRADO:
"Estudio de la respuesta inmune human mediada por Linfocitos T contra RotavÍrus"
SUBTÍTULO, SI LO TIENE: _ _ _ _ _ _ _ _ _ _ _ _ _ __ _ _ _ _ _ _ _
AUTOR O AUTORES
Nombres Com letos
Mesa Villanueva Martha Cecilia
DIRECTOR (ES) TESIS D OCTORAL O DEL TRABAJO DE GRADO
Apellidos Completos N ombres Completos
Angel Uribe Juana
Franco Cortés Manuel Antonio
Nombres Com letos
TRABAJO PARA OPTAR AL TÍTULO DE: Doctor en Ciencias Biológicas
FACULTAD: Ciencias
PROGRAMA: Carrera _ Licenciatura _ Especialización __ Maestría __ D octorado セ@
NOMBRE DEL PROGRAMA: Doctorado en Ciencias Biológicas
NOMBRES Y APELLIDOS DEL DIRECTOR DEL PROGRAMA: Manuel Antonio Franco Cortés
CIUDAD: Bogotá, 2010
NÚMERO DE PÁGINAS: 144
TIPO DE ILUSTRACIONES:
- ilustraciones
- Mapas
Retratos
X Tablas, gráficos y diagramas
- Planos
MATERIAL ANEXO (Vídeo, audio, multimedia o producción electrónica):
Duración del audiovisual: _ _ _ _ _ minutos. Número de casetes de vídeo:
DVCam Otro. Cual?
DVCPro
Formato: VHS
Vídeo 8 Hi8
Beta Max Beta Cam Mini DV
Sistema: Americano NTSC ___ Europeo P AL _ _ SECAM _ _ _
Número de casetes de audio: _______ _
Número de archivos dentro del CD (En caso de incluirse un CD-ROM diferente al trabajo de grado):
PREMIO O DISTINCIÓN (En caso de ser LAUREADAS o tener una mención especial):
Tesis Laureada
DESCRIPTORES O PALABRAS CLAVES EN ESPAÑOL E INGLÉS: Son los ténninos que definen los temas que identifican el contenido. (En caso tk duda para tksignar estos tkscriptores, se recomienda consultar ¿"(m la Unidad tk Procesos Técnicos tk la Biblioteca General en el correo bibl¡oteca@iaveriana.edu.c"O, donde se les orientará).
ESPAÑOL Rotavirus
Linfocitos T
Factor transformante de crecimiento Beta Linfocitos T reguladores
Células mononucleares de sangre periférica Memoria Inmunológica
Interleucinas Interferones Células dendrlticas Niños
Adultos
Respuesta sistémica
INGLÉS Rotavirus T cells
Transforming growth factor Beta T regulatory cells
Peripheral blood mononuclear cells Immunological memory
Interleulcins Interferons Dendritic cells Children Adults
Systemic response
RESUMEN DEL CONTENIDO EN ESPAÑOL E INGLÉS: (Máximo 250 palabras - 1530 caracteres) :
recuentos normales de LTreg tgfMセK N@ En los cultivos de CMSP de adultos Sa{lOS expuestos a RV, se detectó infección de los linfocitos, células NK, monocitos y CD y secreción de IFN-a, pero no de IL-12. También se observó que las CDp participaban en la producción de IFN-y en los LT-RV CD4+ y CD8+. Por el contrario, las CMSP de niños con GE-RV aguda no mostraron evidencia ex vivo de infección por RV.
PONTIFICIA UNIVERSIDAD JAVERIANA
FACULTAD DE CIENCIAS
PROGRAMA DE POSTGRADO
ESTUDIO DE LA RESPUESTA INMUNE HUMANA MEDIADA POR LINFOCITOS T
CONTRA ROTAVIRUS
MARTHA CECILIA MESA VILLANUEVA
TESIS
Presentada como requisito parcial
Para optar al título de
DOCTOR EN CIENCIAS BIOLÓGICAS
Bogotá, D.C.
NOTA DE ADVERTENCIA
"La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis.
Solo velará porque no se publique nada contrario al dogma y a la moral católica y porque las tesis no contengan
ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia"
ESTUDIO DE LA RESPUESTA INMUNE HUMANA MEDIADA POR LINFOCITOS T
CONTRA ROTAVIRUS
MARTHA CECILIA MESA VILLANUEVA
APROBADO
______________________________ ______________________________ Manuel Antonio Franco, MD, PhD Juana Angel, MD. PhD
Director Directora
_____________________________ ______________________________ Concepción Puerta Bula, Bac. PhD Beatriz Parra, Bac. PhD
Jurado Jurado
______________________________ ___ ___________________________ Carlos Alberto Parra López, MD. PhD Carlos Julio Montoya, MD. PhD
Jurado Jurado
ESTUDIO DE LA RESPUESTA INMUNE HUMANA MEDIADA POR LINFOCITOS T
CONTRA ROTAVIRUS
MARTHA CECILIA MESA VILLANUEVA
_____________________________ ______________________________
Ingrid Schuler, Biol. PhD Manuel Antonio Franco, MD, PhD
ESTUDIO DE LA RESPUESTA INMUNE HUMANA MEDIADA POR LINFOCITOS T
CONTRA ROTAVIRUS
RESUMEN
Antecedentes: Rotavirus (RV) es el principal agente etiológico de gastroenteritis (GE) severa en niños menores de 5 años en todo el mundo; sin embargo, los mecanismos de la respuesta inmune sólo se conocen parcialmente. Los trabajos previos con ensayos de
citometría de flujo y ELISPOT han detectado LT circulantes CD4+ IFN-+, IL-13+ ó IL-4+ y de
LT CD8+ IFN-+ específicos de RV en adultos sanos en frecuencias de 0,00-0,03; estos
valores se incrementan aproximadamente 10 veces en adultos con GE-RV; pero son escasos ó inferiores al límite de detección de esas técnicas en niños con GE-RV. En el presente trabajo se estudió si esta respuesta (inferior a las frecuencias de LT específicos de otros virus reportados en la literatura) podría deberse a la secreción de citocinas diferentes, a la presencia de mecanismos reguladores y en el caso particular de los niños a linfopenia ó a la infección de las células mononucleares de sangre periférica (CMSP) con RV.
Materiales y métodos: i) La producción de citocinas en LTCD4+ y CD8+ específicos de RV
fue evaluada en cultivos de CMSP estimulados con RV, tinción intracelular y citometría de flujo. ii) La existencia de mecanismos reguladores se analizó en cultivos similares luego de
remoción de células CD25+ ó de inhibición del TGF-. iii) Los valores relativos y absolutos de
diferentes poblaciones leucocitarias se determinaron mediante analizadores electrónicos y citometría de flujo. iv) Para analizar la infección por RV de las CMSP de niños con GE-RV
primero se analizó la interacción in vitro de las CMSP de adultos sanos con RV. Para esto,
en linfocitos, monocitos y células dendríticas (CD), el perfil de citocinas inducido por el virus y
el papel de las CD en la promoción de la respuesta de IFN-+ por LT específicos de RV.
Posteriormente se evaluó si existían CMSP de niños con GE por RV infectadas por el virus.
Resultados: Se detectaron frecuencias de LTCD4+ circulantes específicos de RV secretores
de IFN-/IL2 (>0,02), en aproximadamente 50% de adultos sanos, así como LTCD4+ IL-10+ e
IL-2+ (>0,02) en adultos infectados por RV durante las fases aguda y de convalescencia
respectivamente. Por el contrario, en los niños con GE-RV los LTCD4+ y CD8+ circulantes
específicos de RV y secretores de IFN-, IL-13, IL-2, IL-10 ó de IL-17 estuvieron por debajo
del límite de detección (0,02); adicionalmente sólo se evidenció linfopenia en 5/12 niños con
GE-RV. La frecuencia de LTCD4+ y LTCD8+ IFN-+ específicos de RV se incrementó en las
muestras de adultos sanos luego de remoción de células CD25+, de inhibición del TGF- y
en mayor grado cuando se utilizaron los dos tratamientos. El efecto regulador del TGF-
también se observó en adultos pero no en niños con GE aguda por RV, a pesar de la
presencia en ellos de recuentos normales de LTreg TGF-+. En los cultivos de CMSP de
adultos sanos expuestas a RV, se observó infección de los linfocitos, células NK, monocitos
y CD y secreción de IFN-, pero no de IL-12. También se observó que las CDp participan en
la producción de IFN- en los LTCD4+ y CD8+ específicos de RV. Por el contrario, las CMSP
de niños con GE aguda por RV no mostraron evidencia ex vivo de infección por RV.
Conclusiones
debe a la existencia de un pool de LT secretor de IL-2, IL-10 ni IL-17, ni a la presencia de
linfopenia ni a regulación por el TGF-. Adicionalmente permiten proponer que la baja
respuesta T pudiera estar asociada con la antigenemia (26/32 niños con GE-RV) y la falta de activación del compartimiento sistémico en las primeras infecciones por RV. Esta suposición se basa en la ausencia de proteínas virales en las CMSP de los niños que contrasta con la infección in vitro de las CMSP de adultos y su eficiente secreción de
citocinas inflamatorias e IFN- así como en su participación en la inducción de IFN- por los
LT específicos de RV. Por otro lado, la detección de LT CD4+ IFN-+ e IFN-+/IL-2+ sólo en
algunos adultos y su ausencia en niños sugiere que la respuesta T contra RV se construye a
través de las re-infecciones con inducción de una población de LT IL-2+ que podría
corresponder a un pool de memoria, probablemente protector. Aparentemente, junto con el
desarrollo de los LT efectores también se inducen mecanismos reguladores mediados por
células CD25+ y por el TGF-. Estos mecanismos son responsables parcialmente de las
LISTA DE ABREVIATURAS
Ac Anticuerpo
Acm Anticuerpo monoclonal
ADN Acido desoxiribonucleico
Ag Antígeno
ARN Acido ribonucleico
ARN cd Acido ribonucleico de cadena doble
ARN cs Acido ribonucleico de cadena sencilla
ARN m Acido ribonucleico mensajero
CMH Complejo Mayor de Histocompatibilidad
CPA Célula presentadora de Ag
CSA Célula secretora de anticuerpos
CMN Células mononucleares
CMSP Células mononucleares de sangre periférica
CMV Citomegalovirus
d días
EBV Virus de Epstein-Barr
GE-RV Gastroenteritis por RV
GL Ganglio
IFN- Interferón alfa
IFN- Interferón gama
Ig Inmunoglobulina
IL-10 Interleucina 10
IL-13 Interleucina 13
IL-4 Interleucina 4
iLTreg Linfocito T regulador inducido
LB Linfocito B
LCR Líquido cefaloraquídeo
LIE Linfocito intraepitelial
LTm Linfocito T de memoria
LTreg Linfocito T regulador
m meses
min minutos
MOI Multiplicidad de infección
NLM Nódulo linfoide mesentérico
PP Placa de Peyer
RCP Reacción en cadena de la polimerasa
RER Retículo endoplasmático Rugoso
RV Rotavirus
TGF- Factor transformante del crecimiento beta
TGI Tracto gastrointestinal
TLAI Tejido linfoide asociado al intestino
uff unidades formadoras de foco
VHS Virus herpes simple
VI Virus de influenza
VLHT-1 Virus de la leucemia T humana tipo 1
VPH Virus del papiloma humano
VV Virus de vaccinia
TABLA DE CONTENIDO
1. INTRODUCCIÓN...1
2. OBJETIVOS...4
2.1. OBJETIVO GENERAL...4
2.2. OBJETIVOS ESPECÍFICOS...4
3. JUSTIFICACIÓN...5
4. ANTECEDENTES BIBLIOGRÁFICOS...6
4.1. ROTAVIRUS...6
4.1.1. Estructura... 6
4.1.2. Clasificación... 7
4.1.3. Ciclo de vida... 9
4.1.4. Crecimiento en cultivo... 10
4.1.5. Epidemiología... 11
4.1.6. Fisiopatología de la infección por RV en humanos... 13
4.1.7. Manifestaciones clínicas... 14
4.2. RESPUESTAINMUNECONTRARV...15
4.2.1. Inmunidad innata... 17
4.2.2. Inmunidad adaptativa... 17
4.2.2.1. Respuesta de LB...18
4.2.2.2. Respuesta de LT...18
4.2.2.3. Vacunas para RV...20
5. HIPÓTESIS 1: LOS LT ESPECIFICOS DE RV SECRETAN CITOCINAS DIFERENTES A IFN-, IL-13 E IL-4 ...23
5.1. IL-2...24
5.2. IL-10...25
5.3. IL-17...25
5.4. LT MULTIFUNCIONALES...27
6. HIPÓTESIS 2: LOS LT ESPECÍFICOS DE RV ESTÁN MODULADOS POR LT REG...32
6.1. POBLACIONES DE LTREG...32
6.1.1. LT reg naturales... 32
6.1.2. LTr1 ...35
6.1.3. LTh3 ... 37
6.2. LA IMPORTANCIA DE TGF- EN EL CONTROL DE LA RESPUESTA INMUNE...38
6.3. MÉTODOS DE ESTUDIO DE LOS LTREG...43
7. HIPÓTESIS 3: LA BAJA FRECUENCIA DE LOS LT ESPECÍFICOS DE RV EN LOS NIÑOS SE RELACIONA CON LINFOPENIA....48
8. HIPÓTESIS 4: LA BAJA FRECUENCIA DE LOS LT ESPECÍFICOS DE RV SE RELACIONA CON INFECCIÓN DE LAS CMSP CON EL VIRUS...49
9. ARTICULO 1: "A TGF-Β MEDIATED REGULATORY MECHANISM MODULATES THE T CELL IMMUNE RESPONSE TO ROTAVIRUS IN ADULTS BUT NOT IN CHILDREN" ....53
10. ARTICULO 2: "INTERACTION OF ROTAVIRUS WITH HUMAN PERIPHERAL BLOOD MONONUCLEAR CELLS: PLASMACYTOID DENDRITIC CELLS PLAY A ROLE IN STIMULATING MEMORY ROTAVIRUS SPECIFIC T CELLS IN VITRO". VIROLOGY, 2007. 366: 174-184....56
11. DISCUSIÓN GENERAL...60
12. PERSPECTIVAS...72
BIBLIOGRAFÍA...73
ANEXOS I...90
1. INTRODUCCIÓN
Desde su descubrimiento en 1973 (Bishop et al., 1973), el rotavirus (RV) ha sido identificado como el principal agente de morbilidad y mortalidad por gastroenteritis (GE) aguda en la población infantil en países desarrollados y en vía de desarrollo, respectivamente (Parashar et al., 2006). El impacto de esta infección sobre la salud pública hizo imperativo el desarrollo
de métodos de prevención que condujeron a la generación de las vacunas Rotarix y
Rotateq que actualmente se utilizan en varios países (Ward, McNeal, and Steele, 2008). Sin
embargo, como los mecanismos de inducción y mantenimiento de la inmunidad contra RV no se conocen claramente, la investigación al respecto sigue vigente con el fin de mejorar las vacunas existentes y de definir marcadores de protección asociados con la infección natural y post-vacunación. La infección natural por RV induce una respuesta inmune no esterilizante que protege de enfermedad severa más no de reinfección, de modo que un individuo se infectará repetidamente con RV e incluso adultos al cuidado de niños con GE aguda por RV pueden presentar síntomas de enfermedad desde leves hasta moderados (Rodriguez et al., 1987). En los primeros años de vida, pocos días después de una infección natural por RV, se detectan anticuerpos (Acs) IgM, IgG e IgA específicos en suero e IgA en heces y algunos estudios muestran que la IgA es un marcador de protección de enfermedad severa; aunque, por razones desconocidas no es una respuesta permanente (Angel, Franco, and Greenberg, 2007). La presencia de estos Acs se correlaciona con proliferación de LT en algunos niños infectados y en los adultos (Offit et al., 1992; Offit et al., 1993); sin embargo, cuando se
estudia el perfil de citocinas, para definir la polaridad Th1(IFN-+)/Th2(IL-13 ó IL-4) y la
respuesta de LTCD8+ (IFN-+, IL-13+ ó IL-4+) circulantes específicos de RV, sólo se observan
sanos e infectados pero sorprendentemente estas respuestas son aún más bajas o nulas en niños con GE aguda por RV (Jaimes et al., 2002; Rojas et al., 2003).
Hasta el momento no se conoce la razón de esta baja respuesta y en el presente trabajo se plantearon las siguientes hipótesis que podrían explicarla.
Hipótesis 1: Los LT específicos de RV secretan citocinas diferentes de IFN-, IL-13 e IL-4,
tales como IL-2, IL-10 e IL-17. Esta hipótesis se sustenta en la observación de que durante la
respuesta inmune la mayoría de LT no se polarizan, es decir no secretan IFN- ni IL-13/IL-4
sino IL-2 (Iezzi, Scheidegger, and Lanzavecchia, 2001); además, esta población IL-2+ es particularmente relevante porque se asocia con el pool de LT de memoria central (Harari et
al., 2006; Sallusto et al., 1999; Seder, Darrah, and Roederer, 2008). La presencia de LT IL-10+ e IL17+ se supone puesto que son poblaciones cuya generación se favorece en el Tejido Linfoide asociado al intestino (TLAI) (Ahern et al., 2008; Kamanaka et al., 2006) y de hecho, LT IL-17+ se han observado muy recientemente en respuesta a la proteína VP6 de RV en el modelo murino (Smiley et al., 2007).
Hipótesis 2: Los LT específicos de RV están bajo el control de LT reguladores (LTreg). Esta hipótesis se basa en observaciones recientes sobre la existencia de LTreg que modulan la respuesta de los LT efectores específicos de diferentes organismos infecciosos (Belkaid, 2007) y en que el sistema inmune TLAI es un compartimiento que favorece la generación de tres subpoblaciones de células reguladoras: los LTr1 (IL-10+) (Roncarolo et al., 2006), los
linfocitos ayudadores tipo 3 (LTh3) (TGF-+) (Faria and Weiner, 2006) y los LTreg
convertidos ó inducidos (iLTReg) Foxp3+ (TGF-+) (Curotto de Lafaille and Lafaille, 2009).
Hipótesis 4: Los LT específicos de RV son bajos en los niños porque sus CMSP son susceptibles de infección por RV. Esta hipótesis se basa en los hallazgos recientes de antigenemia y viremia en niños infectados por RV (Blutt et al., 2003; Blutt et al., 2007), en la presencia intracelular de proteínas de RV en macrófagos, LB y células dendríticas (CD) de las placas de Peyer (PP) y el bazo de animales infectados por RV. (Ramig, 2007) y en CD derivadas de monocitos (moDC) de adultos humanos expuestas in vitro a RV (Narvaez,
2. OBJETIVOS
2.1. Objetivo general
Determinar si la baja respuesta de LT circulantes específicos de RV observada en humanos se debe a variaciones en el perfil de citocinas secretado por los LT, a la presencia de mecanismos reguladores, a linfopenia ó a la infección de las CMSP por el virus.
2.2. Objetivos Específicos
2.2.1. Comparar la producción de IFN-, IL-13, IL-2, IL-10 e IL-17 en los LT circulantes
específicos de RV en adultos sanos y en niños y adultos con GE-RV.
2.2.2. Determinar si la respuesta de LT circulantes específicos de RV en adultos sanos y
en niños y adultos con GE-RV está regulada por células CD25+ y/ó por el TGF-.
2.2.3. Evaluar la presencia de linfopenia en niños con GE-RV presente ó pasada ó de
diferente etiología y su relación con la respuesta de LT específica del virus.
2.2.4. Determinar si las CMSP de adultos sanos son susceptibles de infección in vitro por
RV y el perfil de citocinas que secretan.
2.2.5. Evaluar in vitro el papel de las CD plasmacitoides y del IFN- en la inducción de la
respuesta de LT de memoria específicos de RV en adultos sanos.
2.2.6. Determinar si las CMSP de niños con GE aguda por RV se infectan in vivo con RV y
3. JUSTIFICACIÓN
4. ANTECEDENTES BIBLIOGRÁFICOS
En esta parte del manuscrito se expondrán algunos conceptos fundamentales sobre el ciclo de vida y la respuesta inmune general al RV. La revisión del estado del arte se realizará teniendo como hilo conductor las hipótesis propuestas.
4.1. ROTAVIRUS
4.1.1. Estructura
Los RV son virus ARN de doble cadena (ARN cd), desnudos y de simetría icosaédrica que pertenecen a la familia Reoviridae (Estes, 2007). Su genoma está compuesto de 11
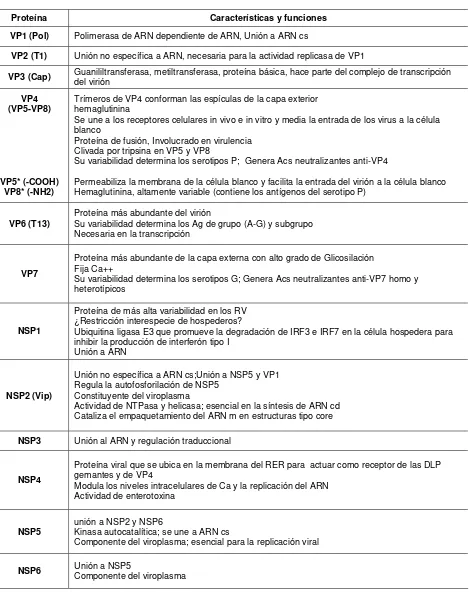
[image:19.612.161.472.416.688.2]segmentos de ARN cd que codifican 6 proteínas estructurales (VP) y 6 proteínas no estructurales (NSP) (Figura 1, tabla 1).
Mediante microscopía electrónica se han caracterizado como partículas morfológicamente similares a una rueda, de 100 nm de diámetro y estructuralmente organizadas en tres capas concéntricas: interna, intermedia y externa. La capa interna está formada por las proteínas VP1, VP2, VP3 y el genoma; la intermedia por la proteína VP6 y la externa por las proteínas VP7 y VP4. Las partículas virales infecciosas completas o de tres capas (TLP/triple layer particles) cuando se tratan in vitro con quelantes de calcio liberan la capa externa de VP4 y
VP7 generando partículas de doble capa (DLP/double layer particles) no infecciosas. La partícula tiene unos canales acuosos que comunican el exterior con la capa interna para conducir hacia adentro los metabolitos necesarios en la síntesis del ARN viral; y hacia afuera, el ARN viral recién sintetizado (Prasad Nature 1996). El genoma de RV es muy diverso debido a mutaciones puntuales (ocurren en una tasa de <5 x 10-5 /nucleótido /cada replicación viral), a fenómenos de reasociación y en menor grado a rearreglos genéticos específicamente del gen de la proteína VP6 (Estes, 2007).
4.1.2. Clasificación
Tabla 1. Características y funciones de las proteínas de RV (Estes, 2007; Franco MA, 2008)
Proteína Características y funciones
VP1 (Pol) Polimerasa de ARN dependiente de ARN, Unión a ARN cs
VP2 (T1) Unión no específica a ARN, necesaria para la actividad replicasa de VP1
VP3 (Cap) Guanililtransferasa, metiltransferasa, proteína básica, hace parte del complejo de transcripción del virión VP4
(VP5-VP8)
VP5* (-COOH) VP8* (-NH2)
Trímeros de VP4 conforman las espículas de la capa exterior hemaglutinina
Se une a los receptores celulares in vivo e in vitro y media la entrada de los virus a la célula blanco
Proteína de fusión, Involucrado en virulencia Clivada por tripsina en VP5 y VP8
Su variabilidad determina los serotipos P; Genera Acs neutralizantes anti-VP4
Permeabiliza la membrana de la célula blanco y facilita la entrada del virión a la célula blanco Hemaglutinina, altamente variable (contiene los antígenos del serotipo P)
VP6 (T13) Proteína más abundante del virión Su variabilidad determina los Ag de grupo (A-G) y subgrupo Necesaria en la transcripción
VP7
Proteína más abundante de la capa externa con alto grado de Glicosilación Fija Ca++
Su variabilidad determina los serotipos G; Genera Acs neutralizantes anti-VP7 homo y heterotípicos
NSP1
Proteína de más alta variabilidad en los RV ¿Restricción interespecie de hospederos?
Ubiquitina ligasa E3 que promueve la degradación de IRF3 e IRF7 en la célula hospedera para inhibir la producción de interferón tipo I
Unión a ARN
NSP2 (Vip)
Unión no específica a ARN cs;Unión a NSP5 y VP1 Regula la autofosforilación de NSP5
Constituyente del viroplasma
Actividad de NTPasa y helicasa; esencial en la síntesis de ARN cd Cataliza el empaquetamiento del ARN m en estructuras tipo core
NSP3 Unión al ARN y regulación traduccional
NSP4
Proteína viral que se ubica en la membrana del RER para actuar como receptor de las DLP gemantes y de VP4
Modula los niveles intracelulares de Ca y la replicación del ARN Actividad de enterotoxina
NSP5 unión a NSP2 y NSP6 Kinasa autocatalítica; se une a ARN cs
Componente del viroplasma; esencial para la replicación viral
neutralizantes. Se han descrito 15 serotipos VP7 (ó G, por glicoproteína) y 18 VP4 (ó P; por sensible a proteasa). La disponibilidad de herramientas de biología molecular ha permitido caracterizar también genotipos G y P con base en la secuencia de nucleótidos del ARN viral y existe una buena correlación entre serotipo y genotipo G, pero no para el P; por esta razón, se ha creado un sistema dual de clasificación para VP4 en el que el serotipo P es seguido del genotipo en paréntesis cuadrados. Por ejemplo, la cepa de RV de monos
Rhesus, RRV, es G3P[3] y la humana, Wa, se clasifica como G1P1[8]. A nivel mundial, 5
serotipos (G1-G4 y G9) y tres P (P4, P6 y P8) son los aislados con mayor frecuencia en las infecciones humanas (Estes, 2007). Adicionalmente, también se han descrito los electroferotipos de acuerdo con los patrones de migración de los segmentos de ARN cd de los RV cuando se someten a electroforesis en gel de poliacrilamida; estos patrones son característicos de cada grupo y se utilizan en el laboratorio para verificar la pureza de las preparaciones de RV (Estes, 2007).
4.1.3. Ciclo de vida
In vivo, RV infecta preferencialmente los enterocitos maduros presentes en las puntas de las
vellosidades intestinales. Para entrar a una célula, los RV se unen secuencialmente a receptores de la superficie celular con requerimientos que varían entre las diferentes cepas. Por ejemplo, a diferencia de muchas cepas de RV animales, las cepas humanas no requieren ácido siálico en los pasos de adhesión inicial a la célula blanco, sino moléculas
como los gangliósidos GM1 y GM3 y la integrina 21 que se une a VP4 (presente en VP5*
exactamente). Después, el virus se debe unir a un receptor secundario como HSC70 o
mediante VP7 a las integrinas X2, 41 ó v3 antes de entrar a la célula. Estas
arreglos de proteínas y lípidos son los responsables de la susceptibilidad o no de una célula al RV. Después de su adhesión, el virus entra a la célula mediante un mecanismo no muy claro que podría ser penetración directa de la membrana plasmática ó endocitosis. En los endosomas, las bajas concentraciones de Ca++ promueven el desprendimiento de la capa externa de modo que las DLPs transcripcionalmente activas entran al citoplasma. Este proceso requiere que antes de entrar a la célula el virus sea activado con tripsina; en efecto, en presencia de la enzima el proceso ocurre en 4-5 minutos (min) y conduce a una infección productiva, pero en su ausencia requiere de 30-50 min y las partículas virales son endocitadas y transportadas a los lisosomas en una ruta que resulta en infección abortiva. En las DLP transcripcionalmente activas se sintetizan los 11 segmentos de ARN (+) que son expulsados y que actúan como ARN mensajero (ARN m) para la síntesis de proteínas virales estructurales y no estructurales; una de éstas, NSP3, inhibe la síntesis de proteínas celulares. Por otro lado, NSP2 y NSP5 forman estructuras electrodensas llamadas viroplasmas donde ocurre el empaquetamiento del ARN viral, la replicación y el ensamblaje de las DLP y los ARN cs se convierten en ARN cd. Las proteínas virales VP4, VP7, NSP1, NSP3 y NSP4 no hacen parte del viroplasma pero se requieren en otros procesos. NSP4 se fija a la membrana del retículo endoplasmático rugoso (RER) y desde allí se une a VP6 presente en las DLPs para facilitar su gemación al espacio intraluminal del RER. Allí, las DLP se cubrirán con VP7 y VP4 para dar origen, en una secuencia de pasos aún no entendida, a las TLPs que son expulsadas del RER y luego de la célula antes o durante una lisis, aparentemente de tipo apoptótico. Aproximadamente se liberan 1x1011 partículas virales/g materia fecal muy resistentes a la degradación a temperatura ambiente, lo cual facilita la transmisión de RV entre los hospederos (Estes, 2007)
In vitro, los RV pueden unirse a muchos tipos de células pero sólo infectan eficientemente
líneas celulares derivadas de adenocarcinoma de colon humano como Caco-2 y HT29 y de riñón de mono, MA104. En estos cultivos, el rendimiento de partículas virales se incrementa en presencia de tripsina que cliva la proteína VP4 en los fragmentos VP5' y VP8' (Estes, 2007). Generalmente en el laboratorio se utilizan sobrenadantes de células MA104 lisadas que contienen tanto TLPs como DLPs; sin embargo, para algunos experimentos se utilizan solamente TLPs purificadas que se obtienen mediante ultracentrifugación en gradientes de densidad de CsCl, porque los lisados pueden contener un exceso de proteínas virales libres y de DLPs o de otros moduladores que interfieran con los experimentos in vitro. A pesar del
tratamiento con tripsina, el rendimiento de los cultivos de RV humanos es muy bajo; por eso, en el presente trabajo, la mayoría de ensayos se realizó con lisado de células MA104 infectadas con la cepa de RV de simio, RRV. En algunos experimentos seleccionados se utilizaron lisados de células MA104 infectadas con la cepa de RV humano, Wa ó TLPs purificadas de RRV o Wa; en todos los casos se confirmó la cepa de RV mediante electroferotipificación.
4.1.5. Epidemiología
deshidratación y causa aproximadamente 1600 muertes diarias en el mundo (Parashar et al., 2006).
La incidencia de los serotipos de RV varía con la ubicación geográfica y la estación. Los más comunes son G1-G4 y G1P1A [8]; siendo esta última la cepa asociada con más de 70% de infecciones rotavirales en Norteamérica, Europa y Australia pero sólo con 30% en Latinoamérica y Asia y 23% en África. Desde 1990, el serotipo G9 se ha asociado con GE más severa en Latinoamérica y G12 con brotes en la India (Estes, 2007).
inmunidad homo y heterotípica (Velazquez et al., 1996). En niños infectados la excreción del virus determinada por ELISA y PCR se presenta hasta 10, 20 y 25-57 días (d) post-diarrea en 43%, 70% y 30% de los casos respectivamente. Las infecciones también pueden ocurrir en adultos y son frecuentes en adultos mayores; un 50% de adultos que cuidan niños con diarrea por RV se infectan y 50% de ellos presentan síntomas leves (Rodriguez et al., 1987).
En un estudio realizado en Colombia en los años 2003-2004 en Bogotá, Barranquilla y Cali se detectó RV como causa de diarrea en el 50% de los casos siendo motivo de 16 hospitalizaciones/1000 y 1 muerte/2000 niños. En 199 casos positivos por ELISA, se encontraron los genotipos G3P8, G2P4, G1P8 y mixtos con frecuencias de 32,7; 21,1; 19,1 y 8,5%, respectivamente. En Bogotá el genotipo más frecuente fue G1P8 (36,9%) seguido por G3P8 (29,2%) y G2P4 (16,9%) (Caceres et al., 2006). El CDC estima que la infección por RV ocasiona 1318 muertes cada año en Colombia (http://www.cd.cgov/ncidod/EID/vol9no5/02-0562).
4.1.6. Fisiopatología de la infección por RV en humanos
Convencionalmente se considera que RV se replica exclusivamente en los enterocitos maduros de las puntas de las vellosidades del intestino delgado (Estes, 2007); sin embargo, la mayoría de infecciones en animales y niños menores se asocian con presencia de Ag (Blutt et al., 2003), ARN (Ray et al., 2006) e incluso de virus infecciosos en sangre (Blutt et al., 2007); además, la replicación viral extraintestinal también ha sido evidenciada en el modelo murino (Fenaux et al., 2006).
cambia de columnar a cuboide lo que resulta en acortamiento y atrofia; las células en las puntas vellosas se desprenden y en la lamina propia aumenta el número de células
reticulares y la infiltración por células mononucleares (CMN); sin embargo, los síntomas no se correlacionan con el daño histológico (Ramig, 2004; Ramig, 2007). La patogénesis de la infección del tracto gastrointestinal (TGI) por RV no es clara y se atribuye a diferentes causas: malabsorción, secreción, aumento de la permeabilidad y estímulo del sistema nervioso entérico. La malabsorción, secundaria a la destrucción de los enterocitos, produce un aumento del bolo alimenticio no digerido hacia el colon que ocasiona diarrea osmótica. Los otros tres factores parecen estar relacionados con la proteína viral NSP4. Esta proteína se comporta como una enterotoxina y eleva la concentración intracelular de calcio, lo cual produce ruptura de las "tight junctions" permitiendo el escape de líquido y en las células de la
cripta, un incremento en la secreción de Cl- y de agua. Además, NSP4 produce activación del sistema nervioso entérico aumentando la secreción de fluido intestinal y de electrolitos (Ramig, 2004; Ramig, 2007).
4.1.7. Manifestaciones clínicas
Un aspecto importante de la infección por RV es su diseminación extraintestinal y la asociación con manifestaciones sistémicas tales como compromiso hepático (hepatitis transitoria), respiratorio (tos, faringitis, otitis media, neumonía), de piel (exantema) y neurológico (encefalitis, meningitis, convulsiones); incluso, en muchos estudios se han detectado proteínas y/ó ARN viral en secreciones respiratorias y LCR de los niños afectados (Ushijima et al., 1994). También se han reportado casos aislados de GE por RV asociados con complicaciones y muerte y presencia de proteínas y/ó ARN viral en bazo, corazón, pulmón, riñón, testículos, vejiga, glándulas adrenales y páncreas (Lynch et al., 2003); sin embargo, hacen falta estudios experimentales en animales y de vigilancia epidemiológica en humanos que permitan establecer si la presencia de RV durante el curso de manifestaciones sistémicas es sólo aleatoria ó si RV es su agente causal (Ramig, 2007).
4.2. RESPUESTA INMUNE CONTRA RV
Por su replicación en el intestino, se ha asumido tradicionalmente que los mecanismos inductores y efectores de la respuesta inmune contra RV se generan y actúan en la mucosa intestinal; sin embargo, la presencia de antigenemia (Blutt et al., 2003) y viremia (Blutt et al., 2007), descritas recientemente en modelos animales y en niños con GE aguda por RV, sugieren la participación de una respuesta inmune sistémica que hasta el momento no se conoce. Se considera que la PP es el principal sitio de inducción de la respuesta inmune en el intestino. Los RV se unen a las células M y a través de ellas, los Ags virales son transportados a las CPA de la PP y del nódulo linfoide mesentérico (NLM). Estas células presentan los Ags para activación de los LTh seguido de expansión de LT y LB. Desde los NLM los linfocitos efectores salen por los linfáticos eferentes para llegar al conducto torácico y desembocar en la circulación sanguínea para migrar luego de regreso a la lamina propia y
integrina 47 y el CCR9 en la membrana de los linfocitos, que interactúan respectivamente
con MAdCAM1 y TECK del endotelio de las vénulas postcapilares del intestino (Butcher et al., 1999; Kunkel et al., 2000; Rott et al., 1997). Se presume que los Ags virales en el compartimiento sistémico estimulan adicionalmente la formación de linfocitos efectores y células secretoras de Acs (CSA) que se establecen en MO y de linfocitos memoria que se ubican en el bazo (Malik, 2008).
los pacientes con inmunodeficiencia severa combinada, en los cuales RV ocasiona infección crónica, síntomas prolongados e infección extraintestinal (Gilger et al., 1992).
4.2.1. Inmunidad innata
La replicación de RV en el intestino es clave en la inducción de la respuesta inmune debido a mediadores solubles, secretados por los enterocitos y otras células, que modulan la respuesta adaptativa en una forma que no se conoce claramente. Las citocinas IL-8, IL-1,
IFN- e IFN- se observan en el intestino de ratones infectados por RV (Rollo et al., 2005;
Rollo et al., 1999; Sheth et al., 1996) e in vitro, pueden inducir una resistencia dependiente
de la dosis a la infección por RV (Bass, 1997). Sin embargo, nuestro grupo mostró recientemente que las células Caco-2 infectadas con RV producen IL-8, PGE2, bajas
concentraciones de TGF- y nulas de las citocinas pro-inflamatorias IL-1, IL-6, IL-12p70 y
TNF-, un ambiente claramente anti-inflamatorio (Rodriguez et al., 2009). Este ambiente
podría ser inducido en parte por el mismo virus; de hecho, RV tiene varios mecanismos para regular negativamente la síntesis de citocinas de la respuesta innata temprana. Entre estos mecanismos se encuentran la degradación en el proteasoma de los factores de transcripción
IRF3, IRF5 e IRF7, involucrados en la síntesis de IFN- (Barro and Patton, 2005; Barro and
Patton, 2007), la inhibición de la señalización de IFN-I e IFN-II en las células blanco mediante bloqueo de la traslocación de STAT1 y STAT2 al núcleo (Holloway, Truong, and Coulson,
2009) y la inhibición de la síntesis de IFN- mediante retención de NFB en el citoplasma
bien sea por secuestro en los viroplasmas o por bloqueo de la degradación de I- (Graff,
Ettayebi, and Hardy, 2009). Es probable que estos eventos estén asociados con la inflamación leve de la mucosa intestinal característica de la infección por RV (Ramig, 2004).
4.2.2.1. Respuesta de LB
En humanos, la infección aguda por RV induce la producción de Acs IgM séricos que son reemplazados por IgG e IgA; también se observa IgM intestinal seguida de IgA y muy bajos niveles de IgG (Uhnoo et al., 1988). Los títulos de IgG e IgA séricas y de IgA fecal se correlacionan con protección luego de infección natural, aunque esta observación no es consistente y la respuesta de IgA es de corta duración, tal vez porque no se generan LB de memoria de larga vida (Angel, Franco, and Greenberg, 2007). Los Acs anti-RV están dirigidos contra diferentes proteínas virales. Los Acs anti-VP4 y anti-VP7, por su efecto neutralizante, se consideran protectores; sin embargo, los títulos de Acs homo y heterotípicos no siempre se correlacionan con protección, lo cual sugiere que mecanismos adicionales están involucrados. Por ejemplo, en el modelo murino se han identificado Acs IgA anti-VP6 protectores (Burns et al., 1996) y un estudio in vitro sugiere que en su
transcitosis hacia el lumen intestinal la IgA anti-VP6 puede inhibir la replicación de RV en el interior de las células epiteliales (Corthesy et al., 2006). En humanos, los Acs anti-VP6 así como anti-NSP4 están siendo estudiados para establecer su utilidad como marcadores de protección de la infección y/ó de la enfermedad (Angel, Franco, and Greenberg, 2007; Malik, 2008).
4.2.2.2. Respuesta de LT
En humanos, la respuesta inmune T contra RV se estudia in vitro mediante cultivos de CMSP
Kobayashi, 1990). En niños sanos menores de 6 m, el porcentaje de respuestas proliferativas a RV es bajo y se incrementa con la edad de modo que hacia los 5 años, el 80% es positivo (Offit et al., 1992). En algunos niños con GE-RV se observan respuestas proliferativas bajas que decaen rápidamente para ser casi indetectables al cabo de 12 m post-infección (Makela et al., 2004; Offit et al., 1993). También se ha observado proliferación en 50% de adultos sanos en respuesta a NSP4 (Johansen et al., 1999). En general, la linfoproliferación frente a RV es fuerte y consistente en adultos pero declina rápidamente en niños con infección confirmada por RV.
En contraste, en estudios del grupo diseñados para determinar la polarización Th1 (IFN-+) /
Th2 (IL-13 ó IL-4) en la respuesta inmune contra RV mediante citometría de flujo se ha
observado que la frecuencia de LTCD4+ IFN-+ (Th1) específicos del virus es
aproximadamente de 0,03% en adultos sanos, que se incrementa hasta unas 10 veces durante la fase aguda de una GE-RV; y que no hay LTCD4+ IL-13+ (Th2); adicionalmente se
evidencian porcentajes similares para LTCD8+ IFN-+. Por el contrario, la frecuencia de LTh1
(IFN-+), LTh2 (IL-13+) y CD8+ IFN-+ específicos de RV en niños con GE-RV de 4-24 m es
muy baja o inferior al límite de detección de la citometría de flujo (Jaimes et al., 2002).
Resultados similares para LTh1 (IFN-+) y Th2 (IL-4+) se han observado en adultos sanos y
niños con GE-RV mediante ELISPOT así como valores similares de CD8+ IFN-+ en adultos
sanos (Kaufhold et al., 2005; Rojas et al., 2003). En algunos niños con GE-RV se detectan
LT CD8+ IFN-+ (Rojas et al., 2003) y CD4+ IFN-+ específicos de RV (Malik et al., 2008) por
ELISPOT. En conjunto estos resultados muestran que la respuesta de LT específicos de RV secretores de las clásicas citocinas Th1/Th2 es baja en niños y que por el contrario la
respuesta de LTCD4+ y CD8+ secretores de IFN-+ es detectable en adultos. Es probable que
memoria (LTm) en intestino u otros órganos (Masopust et al., 2001) ó a la polarización hacia un fenotipo secretor de citocinas diferentes, siendo interesante la existencia de LTh17 en respuesta a la proteína VP6 acoplada a la proteína adyuvante LT de E.coli en ratones
(Smiley et al., 2007). Otras alternativas posibles se relacionan con procesos ineficientes de activación y polarización que generarían LT anérgicos (Faria and Weiner, 2005), o no polarizados (no secretores de citocinas) (Sad and Mosmann, 1994) que mantienen la capacidad de proliferar. Estas situaciones son factibles en el TLAI debido a la presencia de CDs secretoras de moléculas que favorecen la inducción de respuestas tolerogénicas a Ags de alimentos y bacterias comensales. Las CD de las PP murinas, por ejemplo, secretan
mayores cantidades de TGF- e IL-10 que las de bazo (Sato and Iwasaki, 2005), y además,
producen ácido retinoico, metabolito necesario para la generación de LTreg TGF-+
(Manicassamy and Pulendran, 2009). Finalmente como en niños con GE-RV se ha reportado linfopenia (Wang, 2007) y antigenemia/viremia (Blutt et al., 2003; Blutt et al., 2007), es probable que la baja respuesta T detectada in vitro pudiera estar asociada con la
interacción de las CMSP con Ags o partículas virales completas de RV.
4.2.2.3. Vacunas para RV
Como la infección natural por RV protege de enfermedad severa, las vacunas se han diseñado con virus vivos atenuados. Los primeros ensayos se hicieron con RV de animales (procedimiento jenneriano) basado en dos premisas, primera que los virus heterólogos son naturalmente atenuados para el hombre y segunda, que el reconocimiento heterotípico protege. La primera vacuna que se utilizó fue la RIT4237 G6P [1] bovina que resultó efectiva en Finlandia con una protección mayor de 80% para un virus heterotípico humano pero que no fue eficaz en países en vía de desarrollo. En 1998 se introdujo en Estados Unidos de
comparte G3 con las cepas de RV humanas y que además contenía virus reasociados para los genes de VP7 de las cepas humanas G1, G2, y G4; sin embargo, se retiró un año más tarde por una asociación baja pero significativa con intususcepción (Murphy et al., 2003).
Actualmente se utilizan dos vacunas en humanos, Rotateq y Rotarix. Rotateq (Merck)
es una vacuna reassortant bovina-humana pentavalente; está basada en la cepa bovina
WC3 G6P[5] y contiene reassortants para los genes de RV humano G1, G2, G3, G4 ó P1A[8]
(procedimiento jenneriano modificado). Esta vacuna reduce los casos de GE por RV G1-G4 en un 75%, la GE severa en un 98% y las hospitalizaciones y emergencias en un 95%
(Vesikari et al., 2006). Rotarix (GlaxoSmithKline) es una vacuna basada en la cepa humana
de RV 89-12 que pertenece al tipo más común en el mundo, G1P1A[8] que fue aislada de un niño con GE por RV y atenuada mediante múltiples pases en cultivo. La eficacia fue mayor de 86% contra diarrea severa causada no solo por G1P[8] sino también contra las relacionadas en VP4, G3P[8], G4P[8] y G9P[8]; y, solo del 41% contra la cepa G2P[4] (Ward, McNeal, and Steele, 2008). Dos dosis dan 89% de protección contra cualquier enfermedad por RV y 100% de protección contra infección severa (Bernstein 1999). Actualmente se aplica en más de 100 países del mundo incluido Colombia (Ruiz-Palacios
2006; Vesikari 2006). Curiosamente y similar a Rotateq, Rotarix protege en un 59% de
5. HIPÓTESIS 1: LOS LT ESPECIFICOS DE RV SECRETAN CITOCINAS DIFERENTES
A IFN-, IL-13 e IL-4
La población de LT que responde ante un antígeno es heterogénea en fenotipo y función. El entendimiento actual sobre esta heterogeneidad se basa en dos paradigmas: El paradigma de la polarización Th1/Th2 (Mosmann et al., 1986) y el paradigma de la existencia de LT de memoria central (LTCM) y de memoria efectora (LTEM) (Sallusto, Geginat, and Lanzavecchia, 2004). Sin embargo, en los últimos años se ha observado que existen poblaciones de LT
distintos a Th1(IFN-+) / Th2 (IL-4+, IL-5+, IL13+) (Sallusto and Lanzavecchia, 2009) y que las
funciones de los LTCM y los LTEM se sobrelapan en algunas infecciones (Seder, Darrah, and Roederer, 2008).
En el caso de la polarización Th1/Th2, se ha observado que dependiendo del Ag, la fuerza de la señal vía TCR, las moléculas coestimuladoras, las citocinas y el entorno tisular, se
generan a veces LTh17 (IL-17+, IL-22+), LTreg inducidos (iLTreg) (TGF-+), LTreg tipo 1
(LTR1) (IL-10+), LT ayudadores de los LB en el folículo linfoide (LTFH) (IL-21+), LTh0 (IFN-+
/IL-13+) y LT no polarizados (IL-2+) (Sallusto and Lanzavecchia, 2009; Seder, Darrah, and Roederer, 2008). Por esta razón cuando en el estudio de la respuesta inmune contra un
organismo infeccioso sólo se analizan unas pocas citocinas como IFN- e IL-13 se incurre en
el error de ignorar la posible existencia de otras poblaciones celulares. Adicionalmente, la citometría multiparamétrica ha permitido detectar poblaciones de LT multifuncionales, que
secretan 2 o más citocinas ó moléculas efectoras; como LT IFN-+/IL-2+, LT IFN-+/TNF-+,
En cuanto al paradigma LTCM (CCR7+/CD62L+/CD45RO+/CD127+ ó CD27+/CD28+, secretores de IL-2+ y rápidamente proliferantes, presentes en órganos linfoides secundarios) / LT
EM (CCR7-/CD62L-/CD45RO+/CD127-/+ ó CD27+/CD28-, no proliferantes, secretores rápidos de
IFN-+ ó IL-13+) (Harari et al., 2006), varios estudios han mostrado que en la respuesta al
virus de la inmunodeficiencia humana (HIV), citomegalovirus (CMV), virus de Epstein-Barr (EBV) y virus de vaccinia (VV) en humanos, existen poblaciones de LTEM como fuente principal de IL-2, de modo que la denominación LTCM / LTEM basada en los parámetros descritos anteriormente puede ser inadecuada, al menos en algunas infecciones y se estudia actualmente la relación de los linfocitos multifuncionales con el fenotipo LTCM / LTEM así como con el de LT efectores y LT efectores terminalmente diferenciados (Harari et al., 2006; Seder, Darrah, and Roederer, 2008).
En la respuesta inmune a RV, el estudio de linfocitos T secretores de IFN-, IL-13 e IL-4 ha
permitido establecer que existe una respuesta de memoria Th1 y de LTCD8+ IFN-+
específicos de RV en sangre periférica de adultos sanos y con GE-RV pero no en niños con GE-RV (Jaimes et al., 2002; Rojas et al., 2003). Debido a la posibilidad de producción de otras citocinas, en el presente estudio se analizó la presencia de LTCD4+ y LTCD8+
secretores de IL-2, IL-10 e IL-17, adicionalmente a la de IFN-+ e IL-13+, así como también la
presencia de poblaciones multifuncionales.
5.1. IL-2
Es una citocina con poca función efectora, pero siempre se ha considerado que es necesaria en la expansión y desarrollo de la función de los LT efectores y de las células NK in vitro. Sin
embargo, estudios recientes sugieren que in vivo la IL-2 es dispensable en los procesos de
sin genes de IL-2, CD25 (IL-2R) ó CD122 (IL-2R) generan respuestas linfoproliferativas T4
y T8 cuando se estimulan con superantígenos, virus de vaccinia, LCMV y VHS y además son linfocitos susceptibles de apoptosis inducida por activación. Sin embargo, IL-2 si parece ser indispensable en la generación de las respuestas de memoria de LT CD4 y CD8. Los LTCD4+ de ratones sin gen de IL-2 responden adecuadamente in vivo al estímulo con CD pulsadas con péptidos, pero sobreviven poco y generan un número muy bajo de células de memoria; tal vez por un defecto en la expresión del receptor de IL-7. Por otro lado, IL-2 no es necesaria para la generación de los LTCD8+ de memoria pero si para la respuesta de estos ante un estímulo secundario; curiosamente IL-2 no es necesaria en el momento de la respuesta secundaria sino durante la programación de los LTCD8+ en las fases iniciales de la respuesta primaria (Schluns and Lefrancois, 2003).
5.2. IL-10
IL-10 es una citocina reguladora producida por células de la inmunidad innata como CD y macrófagos y por células de la inmunidad adaptativa como LTh2, LTreg naturales (LTreg), LTr1 y LTh3. Adicionalmente, IL-10 también puede ser producida por LTh1 secretores de
IFN-. La IL-10 suprime la proliferación y la secreción de citocinas por los LTh murinos
mediante la inhibición de la capacidad presentadora de las CPA; sin embargo también incrementa la proliferación y la actividad citotóxica de los LTCD8+, inhibe la apoptosis de los LB y favorece el switch de clase hacia IgA (Roncarolo et al., 2006). Algunos conceptos
básicos de la biología de los LT IFN-+/IL-10+ y de los LTreg y LTr1 se resumen más
adelante.
IL-17 es una citocina secretada por un linaje de LTCD4+ diferente de Th1 y Th2 conocido como LTh17 (Rouvier et al., 1993). Estos LTh17 se generan a partir de LT humanos
estimulados en presencia de IL-6, IL-1 y bajas dosis de TGF- (Acosta-Rodriguez et al.,
2007; Manel, Unutmaz, and Littman, 2008) y se mantienen y expanden en presencia de IL-23 derivada de CD en un ambiente que es particularmente favorable en el intestino delgado (Aggarwal et al., 2003; Ahern et al., 2008). IL17 es una citocina proinflamatoria que promueve la expresión de otras citocinas proinflamatorias y hematopoyéticas (Fossiez et al., 1996). Aunque se ha determinado que los LTh17 son claves en la respuesta contra organismos extracelulares que causan infección aguda como Candida (Milner et al., 2008),
algunos estudios muestran que también se generan LTh17 en la fase crónica de infección por HCV (Rowan et al., 2008), en las fases tempranas de infección por HIV (Yue et al., 2008) en el compartimiento sistémico y en el TLAI post-terapia HAART, asociándose con recuperación de la polifuncionalidad y protección (Macal et al., 2008). Por otro lado, LTCD8+ secretores de IL-17 (LTc17) se han aislado de pulmones de ratones infectados con virus de influenza (VI) en los cuales tienen un efecto protector al comienzo de la infección, mediado por reclutamiento de neutrófilos, CD y LTm (Hamada et al., 2009).
En el modelo murino de infección por RV existen antecedentes que sugieren la participación de IL-17; en los ratones adultos inmunizados con la proteína VP6 de RV y la proteína LT de
Escherichia coli como adyuvante se detecta transcripción del ARN m de IFN- y de IL17 en
los linfocitos intestinales (intraepiteliales/LIE y de la lamina propia) y de las PP en las
primeras 24 h post-dosis de refuerzo; y además, un segundo pico a los 6-8 d en los linfocitos
intestinales. La principal fuente de IL-17 son los LIE y la de IFN- los LT de la lamina propia
IFN- (McNeal et al., 2007), el de promover la síntesis de péptidos antimicrobianos ó el de
mantener la función de barrera del epitelio intestinal (Aujla, Dubin, and Kolls, 2007). Adicionalmente, los LTh17 podrían mediar algún mecanismo de protección dependiente de
las otras citocinas que secretan tales como IL-17F, IL-6, IL-21, IL-22 y TNF- (Dong, 2008).
5.4. LT multifuncionales
Los LT multifuncionales son linfocitos que producen simultáneamente más de una citocina ó molécula efectora como perforina o granzima. Su detección en los últimos años ha sido posible mediante la citometría de flujo multiparamétrica y ha permitido una caracterización más fina de la respuesta inmune mediada por LTCD4+ y LTCD8+ contra diferentes organismos infecciosos, siendo evidente que algunos perfiles se asocian con la respuesta inmune de memoria y/ó el control de la enfermedad. Las tablas 2 y 3 resumen los hallazgos de poblaciones multifuncionales en la respuesta a virus causantes de infecciones agudas y crónicas en humanos. De estos estudios se derivan algunas conclusiones generales:
i) Los LT multifuncionales se asocian con mejor control de la carga viral; por ejemplo, los
LTCD4+ IFN-+/IL-2+ constituyen la respuesta preponderante luego de infecciones virales que
se resuelven tales como VI ó por virus que persisten en bajos niveles como EBV, virus de la varicela-zoster (VZV), CMV y en pacientes HIV+ no progresores o en tratamiento. Por el contrario, en individuos HIV+ progresores, con alta carga viral, la población mayoritaria es de
LTCD4+ que producen IFN- exclusivamente. En el caso de los LTCD8+ específicos de HIV,
se observa una mayor frecuencia de células con mayor capacidad de proliferación, función
citolítica y múltiples citocinas (TNF-/IFN-/IL-2) en los no progresores tanto en sangre como
en la mucosa rectal (Seder, Darrah, and Roederer, 2008).
ii) Los LT multifuncionales tienen mayor capacidad efectora; esto se debe no sólo a su mayor
Tabla 2. Perfiles de LT CD4+ multifuncionales en diferentes infecciones virales humanas (%) IL-2+ total IFN-+ Total IL-2+ single IFN-+ single
IL-2+/
IFN-+ Referencia
Infección
aguda Influenza
0,94 a n=1
(Linnemann, Jung, and Walden, 2000)
X=0,18 b (Waldrop et al., 1997)
Parotiditis
0,20 (n=1) (Maino and Picker,
1998)
Sarampión
0,09 (n=1) Mediana: 0,35
(0,08-0,85) c
(Maino and Picker, 1998) (Nanan et al., 2000)
0,03-0,1 (Kang et al., 2004)
X=0,09 X=0,16 (Kannanganat et al., 2007)
Infuenza
0,33(n=1) 0,51(n=1) 0,03(n=1) 0,21(n=1) 0,30(n=1) (Tilton et al., 2007)
RSV 0,07 (n=1) (de Bree et al., 2007)
Vaccinia X=0,11 X=0,09 (Kannanganat et al.,
2007)
Adultos sanos
Adenovirus 0,14 (n=1) 0,27(n=1) 0,02(n=1) 0,15(n=1) 0,12(n=1) (Tilton et al., 2007)
EBV (0,04-5,20) X=1,4 (Amyes et al., 2003)
5,41 (n=1) (Maino and Picker,
1998)
X=0,10 X=0,70 X=0,10 (Harari et al., 2005)
CMV
X=0,11 X=0,55 (Kannanganat et al.,
2007)
0,00-0,17 d (Oxenius et al., 2001)
Infección primaria
HIV
X=0,05 X=0,25 X=0,03 (Harari et al., 2005)
X=0,05 X=0,03 X=0,03 (Harari et al., 2005)
EBV Mediana=0,08
(0,01-0,20) c (Nanan et al., 2000)
X =0.36 Mediana=0,71
(0,15-23) b (Waldrop et al., 1997)
X=1,73 X=1,98 (Waldrop et al., 1998)
0,67 (n=1?) 2,60 (n=1??) (Suni, Picker, and
Maino, 1998) X=1,21 0,52
(0,35-2,18) (Asanuma et al., 2000)
CMV
X=0,10 X=0,20 X=0,20 (Harari et al., 2005)
X=0,22 0,15
(0,05-0,52) (Asanuma et al., 2000)
VHS
X=0,05 X=0,02 X=0,02 (Harari et al., 2005)
VZV X=0,11 0.08
(0,00-0,28) (Asanuma et al., 2000)
0,05 0,15 0,02 (Harari et al., 2005)
HIV+
progresores 0,00-0,66
Mediana=0,12 e (Pitcher et al., 1999)
0,15 0,10 0,15 (Harari et al., 2005)
HIV+ LTNP 0,1-1,7
Mediana=0,40 e (Pitcher et al., 1999)
HIV+ Tratamiento
control carga 100% 0,05 0,04 0,03 (Harari et al., 2005)
Infección crónica
HCV + + ++ (Harari et al., 2006)
Los valores presentados corresponden a frecuencias de LTCD4+ secretores de citocinas determinados con virus
completos y citometría de flujo, excepto en los casos señalados.
a péptido MP63-70. b Ag sin coestimuladoras. c estímulo con LCL autólogas infectadas. d proteínas
Tabla 3. Perfiles de LT CD8+ multifuncionales en diferentes infecciones virales humanas (%) IL-2+ total IFN-+ Total IL-2+ single IFN-+ single
IL-2+/
IFN-+ Referencia
Infección
aguda HCV 0,005-0,37 (Urbani et al., 2005)
Fiebre amarilla 0,5-3,0 (14d) 0,1-1,5 (2m) (Miller et al., 2008)
Vaccinia 3-14 (14d)
aprox. 1 (100d) (Miller et al., 2008)
Vacunación
Influenza
X=0,35 adultos X=0,39 niños de 6m-4años
(He et al., 2008)
Niños sanos
6m-10 años Influenza
X=0,08
(He et al., 2008)
Sarampión Mediana: 0,24
(0,05-0,48) a (Nanan et al., 2000)
Infuenza X=0,39 (0,06-1,6)
0,40
(He et al., 2003) (He et al., 2008)
Adultos sanos
RSV aprox. 0,133 b (Heidema et al., 2008)
EBV 34-60% /LTCD8+ (Hoshino et al., 1999)
CMV 0 +++++ 0 +++++ 0 (Harari et al., 2006)
Infección primaria
HIV 0 +++++ 0 +++++ 0 (Harari et al., 2006)
0,63-1,29 Kuzushima 1999
EBV
Mediana:0,14
(0,08-0,32) a (Nanan et al., 2000)
EBV control carga
viral + ++++ 0 ++++ + (Harari et al., 2006)
X=1,111,22
(0,06-3,26) (Asanuma et al., 2000)
CMV
0,00 (n=1??) 1,33 (n=1??) (Suni, Picker, and
Maino, 1998)
CMV control carga + ++++ 0 ++++ + (Harari et al., 2006)
VHS Nd (Asanuma et al., 2000)
VZV Nd (Asanuma et al., 2000)
HCV+ sin control de
carga + ++++ 0 ++++ + (Harari et al., 2006)
HIV
progresores 0
+++++ 0 +++++ 0
(Harari et al., 2006)
HIV+ LTNP + ++++ 0 ++++ + (Harari et al., 2006)
Infección crónica
HIV+ control carga sólo
40%
+ ++++ 0 ++++ + (Harari et al., 2006)
Los valores presentados corresponden a frecuencias de LTCD8+ secretores de citocinas determinados con virus completos y citometría de flujo, excepto en los casos señalados.
Nd = no detectable. a estímulo con LCL infectadas. b ELISPOT y virus completo
célula cuando se compara con células que sólo secretan una citocina (Kannanganat et al., 2007).
iii) La secreción de IFN- por un LTCD4+ requiere una estimulación de menor potencia vía
solamente IFN- pero si el estímulo y la coestimulación se incrementan la célula puede
secretar adicionalmente IL-2 para permitir la expansión celular (Seder, Darrah, and Roederer, 2008).
iv) El perfil de citocinas secretado por LT específicos de un Ag cambia durante los diferentes
estadíos de la infección; por ejemplo, durante la respuesta primaria, los LT vírgenes
expandidos productores de IL-2 con o sin TNF- se mantienen durante más tiempo y son un
reservorio de LTm y pueden posteriormente secretar IFN- (TNF-/IL-2/IFN-).
v) Al re-encuentro con el Ag, en la respuesta secundaria, estos LT multifuncionales pueden
convertirse en células efectoras de menor funcionalidad (dos citocinas) ó terminales (sólo
IFN-) ó persistir como LTm; cuando el estímulo es mayor, tal como ocurre durante las
infecciones virales agudas, la diferenciación procede rápidamente hacia la población efectora CD4+ (Seder, Darrah, and Roederer, 2008).
vi) En respuesta a un estímulo, los LTCD8+ vírgenes se expanden y todos producen IFN-;
entre ellos una población secreta también TNF- y otra menor IL-2; sin embargo, si el Ag
persiste, como ocurre en las infecciones crónicas, la capacidad de producir citocinas se va perdiendo paulatinamente. La secreción de IL-2 por los LTCD8+ se relaciona con su capacidad de mantenerse por sí mismos por el efecto autocrino de la IL-2 en ausencia de LTCD4+.
vii) Entre los LTCD8+, los LTCM son mejores productores de IL-2 y los LTEM tienen mayor actividad citolítica; sin embargo, a veces no es posible determinar la multifuncionalidad de las poblaciones de LTCD8+ porque su frecuencia es muy baja y sólo se logra la caracterización después de expansión por estimulación antigénica in vitro como ocurre en el caso de LT
viii) Los perfiles de respuesta son diferentes para diferentes virus pero no se conoce la razón;
se sugiere que puede deberse a características particulares de cada virus, a que el virus desvía la maduración celular o induce senescencia prematura de los LT ó que se debe a la carga viral. Por ejemplo se ha observado que en la fase aguda de la infección por HIV y
CMV, la carga viral se asocia con respuestas de LT IFN-+ en tanto que durante la fase
crónica, con una menor carga viral, se observan tres poblaciones de LTCD4+, IFN-+, IL-2+ e
IFN-+/IL-2+ y dos poblaciones de LTCD8+, IFN-+ e IFN-+/IL-2 (Harari et al., 2006).
ix) Los LT multifuncionales IFN-+/IL-10+ (Th1-like) se han observado en clonos de LT de
lavado broncoalveolar de pacientes con tuberculosis (Gerosa et al., 1999), en líneas de LT específicos de Borrelia derivados de pacientes con enfermedad de Lyme (Pohl-Koppe et al.,
1998) o de pacientes con Malaria (Plebanski et al., 1999) así como en cultivos ex-vivo de LT
de sangre periférica de individuos con M. tuberculosis (Boussiotis et al., 2000). En modelos
murinos de infección por Leishmania y Toxoplasma se demostró recientemente que estos
LTh1 like son realmente LTh1 recientemente activados Tbet+ que producen IL-10 de forma
transitoria y rápida y se ha sugerido que pueden representar una respuesta reguladora dominante en el marco de infecciones inductoras de inflamación y altamente polarizadas hacia LTh1 (Anderson et al., 2007; Jankovic et al., 2007). Es posible que esta población
Th1-like se genere en respuesta a otros organismos infecciosos y que sea ignorada con
frecuencia debido al carácter transitorio de la producción de IL-10. Al respecto es interesante la observación de que la producción de IL-10 no está fijada en los LTm por
eventos epigenéticos como ocurre con la de IFN- en los LTh1 y que esto probablemente se
6. HIPÓTESIS 2: LOS LT ESPECÍFICOS DE RV ESTÁN MODULADOS POR LT REG
Varios estudios recientes han mostrado que la respuesta inmune contra los virus HIV, dengue (DV), de hepatitis C (HCV) y de hepatitis B (HBV) es modulada por LTreg. En el caso del TGI, la función de los LTreg es indispensable para controlar respuestas inflamatorias que podrían lesionar el tejido; en este contexto, se ha observado que los LTreg modulan la respuesta a los organismos comensales de la microbiota intestinal normal y a Ags de los alimentos. Particularmente relevante es la observación de que el TLAI promueve y sostiene el desarrollo de este tipo de células. Debido a su carácter de patógeno entérico en el presente estudio se postuló que la baja frecuencia de LTCD4+ y CD8+ circulantes específicos de RV podría deberse a la presencia de un mecanismo regulador dependiente de LTreg.
6.1. Poblaciones de LTreg
Existen dos grupos de LTreg, los LTreg naturales (LTreg) y los LTreg adaptativos que a su
vez incluyen a los LTr1 (IL-10+), los LTh3 (TGF-+) y los LTreg convertidos Foxp3+, también
conocidos como LTreg inducidos (iTreg) (Shevach, 2006).
6.1.1. LT reg naturales
proliferar en respuesta a Ags microbianos (Suffia et al., 2006). Los LTreg además de CD25 y Foxp3 expresan constitutivamente las moléculas CTLA4, GITR, OX40, CD39, CD73, FR4 y CD62L; algunos son CD45RA+/CD45RO- y otros CD45RA-/CD45RO+; y, recientemente se
mostró que tienen una baja expresión de CD127 (IL-7R) (Liu et al., 2006); sin embargo,
ninguno de estos marcadores es útil para su caracterización inequívoca porque también se expresan en LT activados (Belkaid, 2007). El marcador más fidedigno de su linaje es Foxp3, especialmente en ratones (Fontenot, Gavin, and Rudensky, 2003), no así en los humanos en quienes Foxp3 se expresa transitoriamente en LT efectores recientemente activados (Gavin et al., 2006). Foxp3 es el regulador maestro de la diferenciación y función de los LTreg en el control de la homeostasia inmune y de su potencial de proliferación y propiedades metabólicas (Josefowicz and Rudensky, 2009).
La activación de los LTreg requiere señales a través del TCR y una vez activados no sólo modulan la respuesta a su Ag específico sino también a Ags no relacionados (supresión
"bystander"). Adicionalmente "convierten" a los LT efectores en LTreg adaptativos
productores de IL-10 ó de TGF- mediante un mecanismo conocido como tolerancia
infecciosa (Jonuleit et al., 2002; Shevach, 2009), induciendo así un estado de tolerancia estable (Tang and Bluestone, 2008). El mecanismo de acción de los LTreg no es claro y los ensayos in vivo e in vitro han mostrado resultados a veces contradictorios. In vitro, los LTreg
se activan mediante el TCR y aunque no proliferan, es decir son anérgicos, pueden regular a los LTCD4+ y LTCD8+. Los LTreg suprimen la inducción del ARN m de IL-2 (y de otras citocinas efectoras) en los LT respondedores Foxp3- (Oberle et al., 2007; Thornton and Shevach, 1998) y generalmente se considera que su mecanismo supresor es independiente
de IL-10 y TGF- solubles pero dependiente de contacto mediado por TGF- presente en su