i
UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA
La Universidad Católica de Loja
ESCUELA DE INDUSTRIAS AGROPECUARIAS
Tesis previa a la obtención del título de Ingeniero en Industrias Agropecuarias
AUTORAS:
Deycy Cecilia Ovaco Vaca
Ivanova Cecibel Pineda Llanes
DIRECTOR:
Ing. Geovanny Figueroa
LOJA
–
ECUADOR
2011
LOS RESIDUOS DE CACAO (
Theobroma cacao
L
.
) COMO
ii
Cesión de derechos de tesis.
Nosotras Deycy Cecilia Ovaco Vaca e Ivanova Cecibel Pineda Llanes, declaramos expresamente ser autoras del presente trabajo y eximimos expresamente a la Universidad Técnica Particular de Loja y a sus representantes legales de posibles reclamos o acciones legales.
Adicionalmente declaramos conocer y aceptar la disposición del Art. 67 del Estatuto Orgánico de la Universidad Técnica Particular de Loja que en su parte pertinente textualmente dice: “Forman parte del patrimonio de la Universidad la propiedad intelectual de investigaciones, trabajos científicos o técnicos y tesis de grado que se realicen a través, o con el apoyo financiero, académico o institucional de la
Universidad”.
_________________________ _____________________
iii
C
ertificación.
Ing. Geovanny Figueroa
DOCENTE DE LA ESCUELA DE INDUSTRIAS AGROPECUARIAS DE LA UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA.
Director del trabajo de tesis:
“Los residuos de cacao (Theobroma cacao L.) como fuente alternativa de antioxidantes”
CERTIFICA:
Haber revisado minuciosamente el presente trabajo, por lo tanto queda autorizada su presentación y defensa ante los tribunales respectivos.
_______________________ Ing. Geovanny Figueroa
iv
Dedicatoria.
Dedico esta tesis principalmente a Dios por haberme permitido el milagro de la vida, por ser mi luz, mi fuerza y mi compañía en todos los momentos de mi vida para poder cumplir con mis objetivos propuestos. A mis padres Emérita Vaca y Eduardo Ovaco porque sin su educación y apoyo brindado no hubiese podido concluir este trabajo ni todas las metas que me he propuesto.
A mis hermanos, por su gran apoyo brindado, a mis sobrinos por formar parte de mi alegría y la adoración en mi vida. A mis primas queridas que siempre han sido mis mejores amigas. A todas mis amigas y compañeros por sus consejos y compartir bellos momentos.
Deycy Ovaco
Dedico principalmente a Dios por bendecirme siempre y darme las fuerzas para seguir adelante.
A mis padres Yolanda Llanes y Ángel Pineda y por el apoyo incondicional, con sus palabras de aliento en los momentos más difíciles de mi vida ya que han sido un pilar fundamental durante mis estudios, por creer en mí, de esta manera llegar a cumplir todos mis propósitos.
A mis hermanos Danny y Diana, además de ser mis amigos y formar parte de mi vida han sabido apoyarme siempre.
v
Agradecimiento.
Le damos gracias a Dios por guiar nuestros pasos en cada momento de nuestra vida.
Nuestro sincero agradecimiento a la Universidad Técnica Particular de Loja, que a través de la Ing. Ruth Martínez directora del Centro de Transferencia de Tecnología e Investigación Agroindustrial, nos facilitó los medios necesarios para realizar ésta tesis de grado.
A la empresa Transmar Commodity Group Ecuador por su apoyo brindado.
Nuestro infinito agradecimiento al Ing. Geovanny Figueroa por su orientación y apoyo para llevar a cabo la realización de este trabajo.
A todos y cada uno de los docentes que formaron parte de nuestra formación como profesionales, ayudándonos a tener una visión diferente de la formación profesional, para trazar metas más altas y trascender diariamente en nuestras vidas.
A todos nuestros compañeros con los que compartimos nuestra vida estudiantil, por los bellos momentos vividos.
vi
TABLA DE CONTENIDOS
Cesión de derechos de tesis. ii
Certificación. iii
Dedicatoria. iv
Agradecimiento. v
Resumen. xii
Abstract. xiii
1. Introducción. 2
2. Fundamento teórico. 4
2.1 Generalidades. 4
2.1.1 Producción. 4
2.1.2 Variedades. 5
2.1.3 Beneficio del cacao. 5
2.1.4 Usos de los residuos de cacao. 7
2.2 Antioxidantes. 8
2.2.1 Cuantificación de la actividad antioxidante. 8
3. Objetivos. 11
3.1 General. 11
3.2 Especifico. 11
4. Materiales y métodos. 13
4.1 Reactivos analíticos. 13 4.2 Equipamiento. 13
4.3 Muestras. 13
4.4 Preparación de las muestras. 14 4.5 Composición proximal de los residuos de cacao. 16
4.5.1 Humedad. 16
4.5.2 Cenizas. 16
4.5.3 Grasa. 16
4.5.4 Fibra Cruda. 17
vii
4.5.6 Determinación de hidratos de carbono asimilables. 17
4.6 Obtención de extractos. 18 4.7 Cuantificación de la actividad antioxidante. 19
4.7.1 Método ABTS. 19
4.7.2 Método DPPH. 19
4.7.3 Método FRAP. 20
4.7.4 Determinación de Fenoles Totales. 20
4.7.5 Muestra control. 21
4.7.6 Obtención del rendimiento. 21
4.8 Análisis estadístico de los resultados. 21
5. Resultados y discusiones. 23
5.1 Evaluación física de la mazorca de cacao. 23 5.2 Composición proximal de los residuos de cacao. 24 5.3 Actividad antioxidante en los residuos de cacao. 26
6. Conclusiones y Recomendaciones. 35
6.1 Conclusiones. 35 6.2 Recomendaciones. 36
7 Bibliografía. 38
viii
ÍNDICE DE TABLAS.
PáginasTabla 1. Descripción general de los sectores de estudio. 13
Tabla 2. Caracterización física. 23
Tabla 3. Resultados de: pH, °Brix, acidez e índice de madurez. 24
Tabla 4. Humedad de los residuos de cacao. 24
Tabla 5. Composición proximal de los residuos de cacao. 26
ix
ÍNDICE DE GRÁFICAS
PáginasGráfica 1. Rendimiento de extracción método ABTS. 28
Gráfica 2. Porcentaje de rendimiento de extracción en peso. 29
Gráfica 3. Comparación de los diferentes métodos de cuantificación antioxidante en cáscara de cacao.
30
Gráfica 4. Comparación de la actividad antioxidante de los residuos de cacao con respecto a los residuos de otras frutas método ABTS extracción etanolica.
31
Gráfica 5. Comparación de la actividad antioxidante en el grano de cacao con respecto a otras frutas extracción etanolica.
32
Gráfica 6. Comparación de la concentración de fenoles totales de los residuos de cacao con residuos de frutas mediante extracción etanolica.
x
ÍNDICE DE FOTOGRAFIAS.
PáginasFotografía 1. Cacao Nacional por Trinitario. 4
Fotografía 2. Separación de la cáscara. 14
xi
ÍNDICE DE ANEXOS.
PáginasAnexo 1. Obtención de extracto mediante metanol – acetona. 45
Anexo 2. Obtención de extracto mediante etanol. 46
Anexo 3. Determinación de ABTS. 47
Anexo 4. Determinación de DPPH. 48
Anexo 5. Determinación de FRAP. 49
Anexo 6. Determinación de Fenoles Totales. 50
xii
R
esumen.
En la presente investigación se trabajó con cáscara, pulpa, testa y grano de cacao provenientes de los sectores de Taura y Cone, de la variedad Nacional por Trinitario de la provincia del Guayas, proporcionados por la empresa Transmar Commodity Group Ecuador. Se determinó la actividad antioxidante de los extractos obtenidos con mezcla de solventes (metanol / agua 50:50 y acetona / agua 70:30) y etanol absoluto, utilizando los métodos basados en la capacidad de reducción férrica (FRAP), inhibición del radical ácido 2,2`-azino-bis(3-etilbenzotiazolin)-6-sulfónico (ABTS) y 2,2-Difenil-1-picrihidrazilo (DPPH) y Fenoles Totales. La cáscara de cacao es el residuo con mayor actividad antioxidante, con valores para la extracción etanólica para el Sector Taura de: ABTS 68,2 ± 0,4; DPPH 63,5 ± 6,8; FRAP 5,9 ± 0,1 μmol TE / g BS; Fenoles Totales 693,2 ± 31,3 mg (GAE) / 100 g BS; y para el Sector de Cone: ABTS 67,2 ± 0,4; DPPH 51,2 ± 0,6;
xiii
A
bstract.
In this research project, we worked with peel, pulp, husk and seeds cocoa from fields in the towns of Taura and Cone. These beans are of the Trinity national variety, which is found only in Guayas province. The cocoa provided by company Transmar Commodity Group Ecuador. Using for differents methods: ferric reducing antioxidant power (FRAP), inhibition of the radical 2,2'-azinobis(3-ethylebenzothiaziline-6-sulfonate) (ABTS) and 2,2-diphenyl-1-picryl-hydrazyl (DPPH) and total phenols, we were able to determine the antioxidant activity of the residues cocoa extracts, which we had obtained by using either the solvent absolute ethanol and mixture of various solvents (methanol / water 50:50 and acetone / water 70:30). The cocoa peel extracts had the highest antioxidant activity of residues, with ethanol extraction for Taura values of: ABTS 68,2 ± 0,4; DPPH 63,5 ± 6,8;
FRAP 5,9 ± 0,1 μmol TE / g DW; total phenols 693,2 ± 31,3 mg (GAE) / 100 g DW; and
for Cone values of: ABTS 67,2 ± 0,4; DPPH 51,2 ± 0,6; FRAP 5,6 ± 0,1 μmol TE / g DW;
xiv
INTRODUCCIÓN
2
1.
Introducción.
Según el informe de la organización Internacional del cacao para el año 2009-2010, la producción de cacao (Theobroma cacao L.) en el Ecuador fue de 150.000 toneladas métricas (1) generando aproximado 1.350.000 toneladas métricas de residuos de cacao: cáscaras 89,6%, pulpa 8,4% y testa 2% (2) considerando que en la industria cacaotera solo se aprovecha económicamente el grano, lo que representa un 10% del peso del fruto fresco (3). Estos residuos actualmente son aprovechados como fuente de abono orgánico, ya que mejora la fertilidad del suelo (4), la elaboración de un producto a base de cáscara de cacao tostado altamente soluble y rico en fibra dietaría, para posibles aplicaciones en la industria farmacéutica y alimentaria (5). Lamentablemente en Ecuador, los residuos no se están aprovechando en su totalidad por lo que se pueden considerar un problema medio ambiental (3).
Dentro de la línea de investigación “Aplicación de tecnologías emergentes y tradicionales
en procesos agroindustriales” del Centro de Transferencia de Tecnología e Investigación
3
FUNDAMENTO TEÓRICO
4
2.
Fundamento teórico.
2.1 Generalidades.
Theobroma cacao L. nombre científico que recibe el árbol del cacao, en griego significa
“alimento de los dioses”; fue clasificada por el naturalista sueco Carlos Linneo (11)
El cacao es originario de los bosques húmedos de América del sur, los granos generalmente se utilizan en la industria del chocolate, cosmética, farmacéutica y otros derivados (12).
Fotografía 1. Cacao Nacional por Trinitario.
Fuente: Investigación de Campo.
2.1.1 Producción.
5
Según los datos del último Censo Agropecuario Nacional citado por Quingaísa y Riveros (13) existen 243,146 ha de cacao como cultivo solo y 191.272 ha de cultivo asociado, donde más del 90% corresponde a cacao fino de aroma y el 10% restante es forastero (CCN51).
Se exporta el 60% de la producción en grano, el 40% llega a las industrias, donde se lo transforma en derivados en los siguientes porcentajes: 17% polvo, 34% manteca, 28% licor y 21% torta, exportando parte de los derivados y parte se queda en el mercado nacional (14).
2.1.2 Variedades.
Las variedades de cacao se dividen en tres grupos: Criollos, Forasteros y la mezcla de los dos conocidos como Trinitario. En Ecuador en base a estudios sobre morfología, DNA y sabor, se considera la existencia de otra variedad conocida como cacao Arriba denominado así por su zona de origen, con características de un sabor floral, pulpa poca abundante, granos de gran tamaño con color morado claro, sabor ligero amargo con poca astringencia, olor y sabor floral dulce con una sensación a flores, como un perfume fresco, entre jazmín, rosas y lilas (13).
2.1.3 Beneficio del cacao.
Este consiste en una serie de operaciones sucesivas que comienzan con la cosecha y apertura de las mazorcas maduras para la obtención de los granos, fermentación, secado, limpieza, selección, clasificación y almacenamiento del grano (15).
El proceso de beneficio o acondicionamiento provee al cacao las cualidades organolépticas y físicas que lo convierte en una materia prima conservable, transportable y apta para la transformación industrial (16).
a) Separación de la cáscara.
6
de la separación de los granos de la cáscara. Se realiza generalmente de forma manual, deslizando los dedos de la mano a lo largo de la placenta o vena central de la mazorca, evitando no mezclar los granos con la placenta o vena, para evitar deteriorar la calidad del grano (17).
b) Fermentación.
La fermentación tiene por objetivo, la descomposición y remoción de la pulpa azucarada por la acción de levaduras y bacterias acéticas. Reduciendo la astringencia y el sabor amargo del grano (16), por efecto de la temperatura (45 - 50 °C) y penetración del ácido acético, ayudando a la separación de la testa del grano (15).
Durante el desarrollo del proceso de fermentación el cacao enfrenta varios problemas que afectan la calidad final, entre los que destacan:
Los componentes de la materia prima, como la variedad genética compuesto de partes de diversa naturaleza y las variaciones del grado de madurez y contenido de impurezas. La concentración de la producción en la época de mayor actividad y bajas temperaturas afectan el desarrollo del proceso de fermentación y provocan la saturación de las plantas beneficiadoras.
Los métodos y técnicas utilizadas en el desarrollo del proceso son muy rústicos, costumbres o propias de la agricultura, privilegiando la cantidad y no la calidad (16). Las características de los granos de cacao beneficiados adecuadamente son: Hinchados o gruesos, la testa se separa fácilmente, color marrón claro, naturaleza quebradiza, buen estriamiento o rayado profundo al corte longitudinal, sabor ligeramente amargo, aroma agradable a chocolate y sabor floral presente (13).
c) Secado.
7
2.1.4 Usos de los residuos de cacao.
En la explotación cacaotera solo se aprovecha únicamente el grano, los residuos se ha tornado en un gran problema ambiental por la presencia de olores fétidos, deterioro del paisaje y desechos generados (cáscara) esto puede ocasionar enfermedades por la acumulación de microorganismos como Phytopora spp López et al -citado por Barazarte et al. (3), en las empresas transformadoras representa un grave problema para deshacerse de los desechos generados durante el procesamiento industrial (18).
Como consecuencia de lo anterior, varios investigadores han efectuado trabajos para dar utilidad a estos residuos como: La cáscara se utiliza para la obtención de espumas de poliuretano para uso hortícola, para reducir la alta resistencia del poliuretano a la degradación debido a sus propiedades (poder de absorción de agua, alto contenido de lignina, celulosa y su biodegradabilidad), es la composición ideal para formar espumas (19), en la preparación de raciones para alimentación en ganado de carne o leche con un 60%, para animales monogástricos se puede sustituir su dieta con 10% en aves y 20% en cerdos (20).
Por su relativo bajo costo sugieren el uso de las pectinas de cáscara de cacao en conjunto con las gomas para la elaboración de compuestos adhesivos en la industria farmacéutica (3). La pulpa de cacao que tiene un delicioso sabor tropical, ha sido usada para hacer los siguientes productos: jalea de cacao, nata, pulpa procesada, alcohol y vinagre (18). Krishna y Rhao -citado por Kalvatchev et al. (18) reportó que las propiedades de suspensión de pulpa de cacao es superior al alginato de sodio, sodio carboxi-metilcelulosa, y metilcelulosa, efectiva en bajas concentraciones como un enlazador para píldoras farmacéuticas (21). Otro uso potencial para la goma de cacao incluye enlazadores para productos tales como alimentos para mascotas, emulsificadores y fijadores (21), en la obtención de pectinas para añadir a mermeladas e incrementar su aceptabilidad (3).
8
2.2 Antioxidantes.
En el ámbito de los alimentos se puede definir como antioxidantes aquellas sustancias que en bajas cantidades actúan previniendo o retardando la oxidación de materiales fácilmente oxidables, como las grasas Chipault -citado por Martínez (23). Los antioxidantes se clasifican en "primario”: con ruptura de la reacción en cadena, secuestradores de radicales libres, “secundario o preventivo” efectúan la desactivación de metales, inhibición de los
hidroperóxidos lipídicos interrumpiendo la producción de volátiles indeseables Gordon -citado por Martínez (23). Sobre la base de su solubilidad, los antioxidantes pueden ser clasificados en dos grupos: hidrofílicos (solubles en agua) como: compuestos fenólicos y ácido ascórbico y lipofílicos (solubles en grasas) como carotenoides y vitaminas, además los antioxidantes sintéticos que son compuestos con estructuras fenólicas de varios grados de sustitución y antioxidantes naturales como carotenoides, ácido ascórbico, tocoferoles, flavonoides etc. Larson –citado por Nava (24).
En el cacao los compuestos que mayormente prevalecen son los flavonoides que son pigmentos naturales presentes en los vegetales (25), proantocianidinas con un 58% (26) responsables del color en el grano de cacao (27), catequina o flavan-3-oles un 37% y antocianinas 4% (26). Del total de catequinas la principal es la (-)epicatequina que supone un 35% aproximadamente de polifenoles presentes en el cacao (26) responsables del color en el té (27) y son pigmentos solubles en agua responsables de color rojo en el vino (27), estos compuestos son de gran interés nutricional contribuyendo al mantenimiento de salud humana protegiendo al organismo del daño producido por agentes oxidantes, como los rayos ultravioletas, la polución ambiental y sustancias químicas presentes en los alimentos (25).
2.2.1 Cuantificación de la actividad antioxidante.
Para evaluar la actividad antioxidante de una muestra debemos combinar por lo menos dos métodos, basado en diferentes mecanismos de medición (28).
9
capacidad antioxidante del patrón (trolox) o de los componentes antioxidantes (polifenoles) de la muestra (26).
En el método basado en la inhibición del radical 2,2-difenil-1-picrilhidrazilo (DPPH), este radical puede disolverse en medio orgánico, la medida se realiza a 30 minutos en comparación con el método ABTS (7 minutos), supone una desventaja en su aplicación, en adición también su elevado coste. A pesar de las diferencias metodológicas, los resultados con los métodos ABTS y DPPH permiten alcanzar conclusiones similares (29).
10
OBJETIVOS
11
3.
Objetivos.
3.1General.
Generar conocimientos para el aprovechamiento de los residuos de cacao (Theobroma cacao L.) (cáscara y pulpa) de la variedad Complejo Nacional por Trinitario como fuente de antioxidantes.
3.2Especifico.
Valoración del potencial de los residuos industriales de cacao (Theobroma cacao
L.) como fuentes de antioxidantes, mediante la cuantificación de la actividad antioxidante y fenoles totales.
12
MATERIALES Y MÉTODOS
13
4.
Materiales y métodos.
4.1 Reactivos analíticos.
Los reactivos utilizados fueron: ácido 2,2‟-azino-bis(3-etilbenzotiazolin)-6-sulfónico (ABTS); 2,2-difenil-1-picrihidrazilo (DPPH); 2,4,6-tri-(2-piridil-s-triazina) (TPTZ); ácido-6-hidroxi-(2,5,7,8-tetrametilcromano-2-carboxílico) trolox; Folin-Ciocalteu; ácido clorhídrico 37%; ácido sulfúrico 95 - 97% adquiridos a la casa comercial Sigma-Aldrich Química. Persulfato de potasio; acetato de sodio trihidratado; hierro III (cloruro hexahidratado); ácido acético; acetona 99,8%; etanol al 99%; carbonato de sodio; hidróxido de sodio; éter de petróleo; pastilla Kjeldhal adquiridos a la casa comercial Merck. Ácido gálico monohidratado adquirido a la casa comercial Dr. Ehrenstorfer G. Metanol HPLC 99,99% a la casa comercial Fisher Scientific Company.
4.2 Equipamiento.
Se utilizó el espectrofotómetro (modelo 6400, Jenway, New York, USA) que cubre una gama de longitud de onda a partir del 320 a 950 nm, con una anchura de banda espectral de 5 nm. La precisión fotométrica de absorbancia a 1 Abs es de ± 0, 005 (32).
4.3 Muestras.
La investigación se realizó utilizando cacao (Theobroma cacao L.) de la variedad Complejo Nacional por Trinitario proveniente de los sectores de Taura y Cone, proporcionados por la empresa Transmar Commodity Group Ecuador.
Tabla 1. Descripción general de los sectores de estudio.
Sector Cantón Altura (msnm)
Pluviosidad (mm)
Temperatura (°C)
Humedad Relativa
(%)
Edad de cultivo
(años)
Taura Yaguachi 17 1.025 24 83 25
Cone Naranjal 20 1.289 24 83 75
Fuente: (33)
14
El 18 de marzo de 2010 se recibieron 150 mazorcas para el sector Cone y 155 para Taura, las mismas que fueron transportadas desde la ciudad de Guayaquil al laboratorio de investigación del CETTIA, al día siguiente se clasificó separando las mazorcas que se encontraban sobremaduras, cortadas y con presencia de animales extraños, quedando 105 mazorcas para Cone y 108 para Taura, se lavaron con una solución química de hipoclorito 0,1 N, con el objetivo de desinfectar y eliminar las impurezas extrañas (34). En la mazorca se midió el diámetro y largo mediante un calibrador (Fisher), pesó utilizando una balanza (modelo PA512, Ohaus, China) y color mediante la carta de colores Royal Horticultural Society (RHS), Inglaterra.
En la pulpa se determinó la acidez (AOAC 942,15 Acidez en frutas y derivados) utilizando NaOH, pH (AOAC 970,21 pH en productos derivados del cacao) con un pH-metro digital (modelo B417, Hanna, USA), sólidos solubles (INEN 380. Sólidos solubles) mediante el refractómetro e índice de madurez (°Brix/acidez) (9).
4.4 Preparación de las muestras.
Se llevó a cabo en base a la guía Beneficio del cacao de la Universidad Central de Venezuela con algunas modificaciones (15), proceso análogo al que realizan en la empresa Transmar Commodity Group Ecuador.
a) Separación de la cáscara.
Se realizó un corte transversal utilizando un cuchillo y se procedió abrir la mazorca de forma manual, se separó la cáscara del grano sin lastimar los granos.
Fotografía 2. Separación de la cáscara.
15
b) Fermentación.
Se realizó en recipientes de plástico (con fondo perforado), cubriendo los recipientes con fundas plásticas obscuras, la pulpa desprendida en este proceso fue recolectada en un balde plástico ubicado en la parte inferior del recipiente fermentador. El proceso duro siete días, se agitó cada día con el fin de aumentar la ventilación para lograr la uniformidad en la fermentación.
c) Secado.
Todos los residuos fueron deshidratados a 60 ºC (28), en estufa de convección forzada (modelo 5200-70, Cole Parmer, Chicago, USA), hasta obtener una humedad menor al 10% (15).
Fotografía 3. Secado del Cacao Nacional por Trinitario.
Fuente: Investigación de campo
Una vez secado el grano se realizó un tostado rápido en la misma estufa a 90 °C por 30 minutos (35) para realizar el descascarillado, el cual se realizó manualmente.
d) Molido y Tamizado.
Las muestras deshidratadas fueron molidas en un equipo (modelo 3010-014, Cyclone lab simple mill, U.S.A) y clasificadas según su tamaño, utilizando un juego de tamices con
mallas comprendidas entre la 250 a 2000 μm, seleccionando las partículas comprendida
entre los tamices de 500 a 750 μm, se ha comprobado que los valores de capacidad
16
e) Almacenamiento.
Las muestras se almacenaron por un mes y medio hasta su análisis en un lugar apartado y oscuro a temperatura ambiente en bolsas plásticas Ziploc (37).
4.5 Composición proximal de los residuos de cacao.
Con la finalidad de conocer las características de los residuos se determinó la composición proximal siguiendo los procedimientos descritos por la Asociación Oficial de Químicos Analíticos (AOAC) (38).
4.5.1 Humedad.
Para la determinación de humedad se utilizó el procedimiento descrito en la técnica AOAC. 931.04. Humedad en productos de cacao. Su principio se basa en la evaporación del agua por calentamiento en estufa de vacío (modelo 3608, Lab-line, U.S.A), calculando el valor de humedad en base a la pérdida de peso.
4.5.2 Cenizas.
Para la determinación de cenizas se utilizó el procedimiento descrito en la técnica AOAC. 940.26. Determinación de Cenizas en frutas y derivados, su principio se basa en la pérdida de todos sus componentes orgánicos por ignición a 525 °C utilizando una mufla (modelo 8000, Thermolyne, U.S.A), hasta la obtención de minerales totales.
4.5.3 Grasa.
17
4.5.4 Fibra Cruda.
Para la determinación de fibra cruda se utilizó el procedimiento descrito en la técnica AOAC. 962.09. Fibra cruda en alimentos para animales y alimentos para mascotas, método con características generales que puede ser utilizado en diferentes matrices. Su principio se basa en una serie de digestiones secuenciales de la muestra mediante un álcali y ácido utilizando el extractor de fibra (modelo 3000-100, Labconco, Kansas, USA), seguido de una ignición del residuo en una mufla (modelo 8000, Thermolyne, USA) obteniendo por diferencia la cantidad de fibra cruda.
4.5.5 Proteína.
Se utilizó el procedimiento descrito en la técnica oficial AOAC 970,22. Nitrógeno (total) en productos de cacao, su principio de basa en digerir la muestra con ácido sulfúrico concentrado, usando como catalizador pastilla Kjeldhal, se utilizó el equipo Kjeldhal (modelo 5136, Labconco, USA) para la digestión y destilación, se recogió el amoniaco liberado sobre una solución de ácido clorhídrico valorada. Con hidróxido de sodio valorado se determinó la cantidad de ácido sin neutralizar, procediendo a calcular el contenido de nitrógeno dela muestra a partir de la cantidad de amoníaco producido, se utilizó el factor de conversión de 6,25 para relacionar el contenido de nitrógeno con el de proteína.
4.5.6 Determinación de hidratos de carbono asimilables.
18
4.6 Obtención de extractos.
Se utilizaron dos opciones de extracción: etanol por ser utilizado en la producción de alimentos y de ingredientes alimentarios (40). Mezcla de solventes metanol / agua 50:50 y acetona / agua 70:30 descrita por Rojas et al. (9), con algunas modificaciones.
Extracción con metanol –acetona.
Mediante el método descrito por Rojas et al. (9), con algunas modificaciones, el cual emplea la mezcla de solventes metanol / agua 50:50 y acetona / agua 70:30, se pesó 5 g para cáscara y testa, 0,5 g para pulpa y 2,5 g para grano, estas variaciones se dieron en función de la concentración de cada residuo, las muestras se colocaron en tubos de centrifuga, se les adicionó 20 ml de solución de metanol / agua 50:50, (para pulpa se adiciono 5 ml), realizando la extracción mediante agitación por 1 hora, mediante el agitador (modelo M73535, Thermolyne, USA) a 120 r.p.m., se centrifugó a 2000 r.p.m. en el equipo (modelo 420101, Dynac, USA) durante 30 minutos, se separó el sobrenadante y al residuo se realizó el mismo procedimiento indicado pero con la mezcla de acetona / agua 70:30. Finalmente se mezcló los sobrenadantes, en los que se determinó la capacidad antioxidante y cuantificación de fenoles totales (Anexo 1).
Extracción con Etanol.
19
4.7 Cuantificación de la actividad antioxidante.
La actividad antioxidante total se determinó mediante tres métodos espectrofotométricos basados en la capacidad de reducción férrica (FRAP), inhibición del radical ácido 2,2`-azino-bis(3-etilbenzotiazolin)-6-sulfónico (ABTS), (2,2- Difenil-1-picrihidrazilo) (DPPH) y Fenoles Totales.
4.7.1 Método ABTS.
Se determinó siguiendo la metodología de Arnao et al. -citada y modificada por Thaipong et al. (42) con algunas modificaciones, se preparó una solución de ABTS 7,4 mM y una solución de persulfato de potasio 2,6 mM. Se mezclaron las soluciones en igual cantidad y se dejó reaccionar durante 12 horas a temperatura ambiente en la oscuridad. Para preparar la solución de trabajo, se mezcló 70 ml de metanol y 2 ml de solución ABTS, se realizó la lectura en el espectrofotómetro (modelo 6400, Jenway, New York, U.S.A) a una longitud de onda de 734 nm verificando que se obtenga una absorbancia de 1,105 ± 0,01. Para cada muestra se tomó 150 µl de extracto y 2850 µl de la solución de trabajo, dejando reaccionar durante 7 minutos antes de realizar la lectura. Se empleó una curva estándar con trolox
(20-800 μM). Los resultados fueron expresados en μmol equivalente de Trolox (TE) / g de
muestra en base seca (BS), reportándose el valor promedio de tres repeticiones y su desviación estándar (Anexo 3).
4.7.2 Método DPPH.
Se determinó siguiendo la metodología de Brand-Williams et al. -citada y modificada por Thaipong et al. (42) con algunas modificaciones, se preparó una solución stock disolviendo 0,024 g de DPPH en 100 ml de metanol, que se guardó en refrigeración hasta su uso. De la solución stock se tomaron 10 ml y se diluyo con 70 ml metanol. Verificando que se obtenga una absorbancia de 1,1 ± 0,01 a 515 nm. Para cada muestra se tomó 150 µl de
extracto y 2850 µl de la solución DPPH, dejando reaccionar durante 30 minutos,
20
μM). Los resultados son expresados en μmol TE / g BS, reportando el valor promedio de
tres repeticiones y su desviación estándar (Anexo 4).
4.7.3 Método FRAP.
Se determinó siguiendo la metodología de Benzie y Strain-citado y modificado por Thaipong et al. (42). Se utilizó una solución de acetato buffer 300 mM (3,1 g C2H3NaO2 _ 3H2O y 16 ml C2H4O2) lo cual debe tener un pH 3,6. Solución TPTZ con una concentración 10 mM utilizando HCl 40 mM como solvente y solución de cloruro de hierro hexahidratado 20 mM. La solución de trabajo fue preparada mezclando 25 ml acetato buffer, 2,5 ml de solución de TPTZ, y 2,5 ml de solución de cloruro de hierro hexahidratado, se calentó a 37 ºC antes de usar. Para cada muestra se tomó 150 µl de
extracto y 2850 µl de la solución FRAP, dejando reaccionar durante 30 minutos en la
obscuridad, procediendo a realizar las lecturas correspondientes en el espectrofotómetro (modelo 6400, Jenway, New York, USA) a una longitud de onda de 593 nm. Se empleó una curva estándar con Trolox (20-800 μM). Se expresó los resultados en μmol TE / g BS,
reportando el valor promedio de tres repeticiones y la desviación estándar (Anexo 5).
4.7.4 Determinación de Fenoles Totales.
La cuantificación de fenoles totales fue determinada por el método Folin-Ciocalteu adaptado por Swain and Hillis -citado por Thaipong et al. (42), Para cada muestra se tomó 150 µl de extracto, 2400 µl de agua destilada y 150 µl de la solución 0,25 N de
Folin-Ciocalteu, mezclando a temperatura ambiente por 2 minutos utilizando el agitador (modelo M73535, Thermolyne, USA) a 120 r.p.m., se dejó reaccionar por 3 minutos y se agregó 300 µl de carbonato de sodio 1 N, se agitó durante 2 minutos, dejando reaccionar durante 2
21
4.7.5 Muestra control.
Se utilizó el antioxidante sintético butil hidroxi tolueno (BHT) como muestra control, para lo cual se preparó una concentración 0,01 M disolviendo 0,055 g en 25 ml de metanol, a partir de esta solución se realizó las diferentes cuantificaciones ABTS, DPPH, FRAP y Fenoles Totales de manera análoga a los procedimientos descritos para los extractos.
4.7.6 Obtención del rendimiento.
Para determinar el rendimiento se realizó mediante la diferencia de la actividad antioxidante obtenida mediante los dos métodos de extracción metanol / agua 50:50 –
acetona / agua 70:30 y etanol tomando como referencia del 100% la extracción con metanol – acetona, expresando los resultados en porcentaje.
4.8 Análisis estadístico de los resultados.
22
RESULTADOS Y
DISCUSIONES
23
5.
Resultados y discusiones.
5.1Evaluación física de la mazorca de cacao.
[image:36.595.120.491.286.372.2]En la Tabla 2 se presentan los resultados del análisis físico de las mazorcas, resaltando una alta variación para cada sitio de estudio, con coeficientes de variación entre 15 a 34%, esta variación se puede atribuir a las diferentes prácticas agronómicas aplicadas en cada tipo de cultivo de acuerdo a la información facilitada por técnicos de Transmar Commodity Group Ecuador (43).
Tabla 2. Caracterización física.
SECTOR LARGO (cm) DIAMETRO (cm) PESO (g)
Taura 17,6 ± 3,2 26,2 ± 3,9 443,5 ± 152,2
Cone 17,5 ± 2,7 24,4 ± 2,9 412,3 ± 122,1
n Taura = 108
n Cone = 105
Fuente: Investigación experimental.
Elaboración: Las autoras.
El color más representativo para la mazorca encontrado mediante la carta de colores Royal Royal Horticultural Society para el sector Taura fue Yellow – Orange 15 A y para Cone fue Gleyel – Orange 168 A.
24
Tabla 3. Resultados de: pH, °Brix, acidez e índice de madurez. SECTOR pH °BRIX (%ácido cítrico) ACIDEZ ÍNDICE DE MADUREZ
Taura 4,3 ± 0,05 13,0 ± 2,40 3,4 ± 0,13 3,8 ± 0,82
Cone 4,4 ± 0,01 14,0 ± 2,22 3,3 ± 0,28 4,1 ± 0,67
n = 3
Fuente: Investigación experimental
Elaboración: Las autoras.
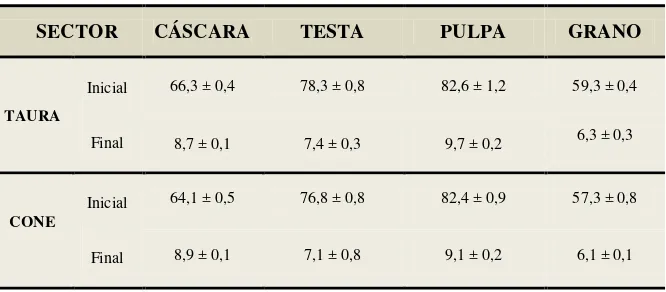
En la Tabla 4 se muestra el contenido de humedad inicial y final (después del beneficio) para los diferentes residuos.
Tabla 4. Humedad de los residuos de cacao.
SECTOR CÁSCARA TESTA PULPA GRANO
TAURA
Inicial
Final
66,3 ± 0,4 78,3 ± 0,8 82,6 ± 1,2 59,3 ± 0,4
8,7 ± 0,1 7,4 ± 0,3 9,7 ± 0,2 6,3 ± 0,3
CONE Inicial
Final
64,1 ± 0,5 76,8 ± 0,8 82,4 ± 0,9 57,3 ± 0,8
8,9 ± 0,1 7,1 ± 0,8 9,1 ± 0,2 6,1 ± 0,1
n = 3
Fuente: Investigación experimental.
Elaboración: Las autoras.
Resultados reportados en porcentaje.
5.2Composición proximal de los residuos de cacao.
[image:37.595.140.473.366.512.2]25
proteína de 0,4, grasa de 0,88 – 1,48 y fibra de 0,67 – 5,07 puntos porcentuales (ver tabla 5) para Taura y Cone respectivamente.
En la testa existe diferencia significativa, para los dos sectores de estudio en todos sus componentes. Al comparar con los datos reportados por Cardona et al. (45), tiene una variación para ceniza de 1,1 – 1,8, proteína de 1 – 1,4, grasa 2,5 – 2,6 y fibra cruda de 4,3 –
4,9 puntos porcentuales para Taura y Cone respectivamente, se debe considerar que Cardona et al. (45) reporta valores para la variedad criollo.
En pulpa existe diferencia significativa para el contenido de grasa y fibra, mientras que para cenizas y proteína no existe diferencia significativa entre los sectores de estudio. Al comparar con los datos reportados por Anvoh et al. (46) tienen una variación para cenizas de 1,74 – 1,84, grasa de 2,04 – 2,34, fibra 0,1 – 0,3 y proteína 2,04 – 2,34 puntos porcentuales, lo que explica lo mencionado por Graziani et al. (43) que dice que la diversidad genética tiene un papel resaltante en las características físico químicas de las mazorcas de cacao.
26
Tabla 5. Composición proximal de los residuos de cacao.
RESIDUO SECTOR %CENIZAS %PROTEINA %GRASA %FIBRA %HIDRATOS DE CARBONO
ASIMILABLES
Cáscara
Taura 9,9 ± 0,1 7,3 ± 0,1* 1,9 ± 0,1 32,9 ± 0,1 39,3
Cone 10,3 ± 0,1 7,3 ± 0,1* 2,5 ± 0,1 28,5 ± 0,1 42,4
Ref. 1 8,55 6,90 1,02 27,83 47,0
Testa
Taura 9,7 ± 0,1 17,0 ± 0,2 7,0 ± 0,3 16,7 ± 0,1 42,2
Cone 9,0 ± 0,1 16,6 ± 0,2 6,9 ± 0,3 16,1 ± 0,1 44,3
Ref. 2 7,9 15,6 4,4 21,0 45,10
Pulpa
Taura 5,5 ± 0,1* 3,8 ± 0,1* 1,2 ± 0,1 1,1 ± 0,1 78,7
Cone 5,6 ± 0,1* 3,8 ± 0,1* 1,5 ± 0,1 0,9 ± 0,1 79,0
Ref. 3 3,76 ± 0,84 4,4 3,54 ± 0,2 0,8 87,5
Grano
Taura 3,4 ± 0,1 14,3 ± 0,1* 50,8 ± 0,1 3,0 ± 0,1 22,2
Cone 2,7 ± 0,1 14,8 ± 0,1* 45,7 ± 0,1 2,7 ± 0,1 28,0
Ref. 4 3,32 ± 0,1 14,00 ± 0,07 56,00 ± 0,18 0,37 ± 0,02 19,94
n = 3
Fuente: Investigación experimental
Elaboración: Las autoras.
Ref. 1 (44)
Ref. 2 (45)
Ref. 3 Humedad, cenizas, grasa (46), proteína, fibra (49)
Ref. 4 (48)
*Valores donde no existe diferencia significativa al comparar entre los lugares de estudio.
5.3Actividad antioxidante en los residuos de cacao.
27
[image:40.595.38.552.159.454.2]resaltando que en la mayoría de los casos Taura presenta mayor concentración pudiendo atribuirse a su menor edad de cultivo.
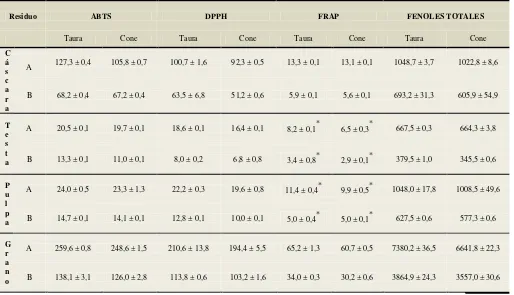
Tabla 6. Resultados de actividad antioxidante.
Residuo ABTS DPPH FRAP FENOLES TOTALES
Taura Cone Taura Cone Taura Cone Taura Cone
C á s c a r a
A 127,3 ± 0,4 105,8 ± 0,7 100,7 ± 1,6 92,3 ± 0,5 13,3 ± 0,1 13,1 ± 0,1 1048,7 ± 3,7 1022,8 ± 8,6
B 68,2 ± 0,4 67,2 ± 0,4 63,5 ± 6,8 51,2 ± 0,6 5,9 ± 0,1 5,6 ± 0,1 693,2 ± 31,3 605,9 ± 54,9
T e s t a
A 20,5 ± 0,1 19,7 ± 0,1 18,6 ± 0,1 16,4 ± 0,1 8,2 ± 0,1* 6,5 ± 0,3* 667,5 ± 0,3 664,3 ± 3,8
B 13,3 ± 0,1 11,0 ± 0,1 8,0 ± 0,2 6,8 ± 0,8 3,4 ± 0,8* 2,9 ± 0,1* 379,5 ± 1,0 345,5 ± 0,6
P u l p a
A 24,0 ± 0,5 23,3 ± 1,3 22,2 ± 0,3 19,6 ± 0,8 11,4 ± 0,4* 9,9 ± 0,5* 1048,0 ± 17,8 1008,5 ± 49,6
B 14,7 ± 0,1 14,1 ± 0,1 12,8 ± 0,1 10,0 ± 0,1 5,0 ± 0,4* 5,0 ± 0,1* 627,5 ± 0,6 577,3 ± 0,6
G r a n o
A 259,6 ± 0,8 248,6 ± 1,5 210,6 ± 13,8 194,4 ± 5,5 65,2 ± 1,3 60,7 ± 0,5 7380,2 ± 36,5 6641,8 ± 22,3
B 138,1 ± 3,1 126,0 ± 2,8 113,8 ± 0,6 103,2 ± 1,6 34,0 ± 0,3 30,2 ± 0,6 3864,9 ± 24,3 3557,0 ± 30,6
Al evaluar las dos metodologías de extracción se evidencia que existe diferencia significativa en la concentración de antioxidantes obtenidos, presentando mayor concentración en la mezcla de solventes, confirmando lo mencionado por Spino et al. citado por Uma et al. (51) que indican que se extrae mayor contenido de antioxidantes al realizar una mezcla de solventes, porque los antioxidantes difieren su solubilidad en diferentes solventes. La adición de agua incrementa la polaridad de los solventes ayudando a extraer sustancias de alta polaridad y baja polaridad (51), mientras que para los extractos n = 3
A = Empleando metanol - acetona; B = Empleando etanol
Fuente: Investigación experimental
Elaboración: Las autoras
Los resultados para ABTS, DPPH y FRAP están expresados en μmol TE / g BS (µmol trolox / g en base seca). Para fenoles totales los resultados están expresados en mg GAE / 100g BS.
28
con etanol según Martínez (23), en los extractos menos polares la solubilización de los compuestos polares es limitada.
En la Gráfica 1 los resultados muestran una diferencia en la actividad antioxidante comprendida entre el 37 al 46% para las dos metodologías de extracción utilizando ABTS como metodología de cuantificación, esta diferencia se le puede atribuir a la alta polaridad de los solventes utilizados, presentando mayor tendencia en poder reductor y actividad antirradical, resultado de la transferencia de electrones e hidrógenos con relativa facilidad (23) además la acetona y metanol son buenos sistemas de disolventes para la extracción de antioxidantes polares (52). Los extractos de etanol manifiestan menor concentración debido a que transfiere con mayor facilidad hidrógenos que electrones (23).
Gráfica 1. Rendimiento de extracción método ABTS
n = 3
A = Empleando metanol - acetona; B = Empleando etanol
Fuente: Investigación experimental
Elaboración: Las autoras.
Los resultados están expresados en µmol TE / g BS (µmol trolox / g en base seca).
39% 38%
37%
38% 46%
29
Se analizó la cantidad de sustancias solubles en etanol, obteniendo como resultado que existe diferencia significativa al comparar los pesos obtenidos para las diferentes muestras en estudio. Como se evidencia en la Gráfica 2, este resultado no se correlaciona con la concentración de antioxidantes encontrado. Los resultados nos muestran un bajo rendimiento en peso comprendido entre 2,5 y 3,4%, pero consideramos que las diferencias encontradas son propias de la metodología utilizada, debido a que se determina el punto final de la concentración de una manera visual, buscando obtener un volumen comprendido entre 1,0 – 1,5 ml de concentrado.
Grafica 2. Porcentaje de rendimiento de extracción en peso.
n = 3
Fuente: Investigación experimental
Elaboración: Las autoras.
Al comparar los diferentes métodos de cuantificación para la cáscara de cacao, se evidencia en la Gráfica 3, una mayor concentración de actividad antioxidante con ABTS, debido que este método mide la actividad antioxidante de varias sustancias, tanto de radicales en fase acuosa y en fase lípídica peroxilo (Rice-Evans, Miller, & Paganga; Robert
2,6 2,8
2,5
3,0
2,7
3,4
2,7 2,7
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0
Taura Cone Taura Cone Taura Cone Taura Cone
Cáscara Pulpa Testa Grano
30
et al.-citado por (53), lo que explica su mayor extracción de actividad antioxidante. Si se compara estos resultados con la actividad antioxidante en residuos de uva utilizando igual método de cuantificación es cinco veces mayor al valor reportado de 12,8 μmol TE / g
(54), En el método DPPH la presencia de color en los extractos debido a la oxidación de metabolitos secundarios, provoca interferencias al momento de llevar a cabo la lectura del DPPH, esto puede llevar a una disminución aparente de la actividad antioxidante de los extractos, lo que explica su menor concentración con respecto al ABTS, sin embargo los residuos de cacao presentan mayor actividad antioxidante que los datos reportados por Nepote et al. (55) para residuos de maní, que indica un valor de 18,5 μmol TE / g.
Gráfica 3. Comparación de los diferentes métodos de cuantificación antioxidante en cáscara de cacao.
n = 3
A = Empleando metanol - acetona; B = Empleando etanol
Fuente: Investigación experimental
Elaboración: Las autoras.
Los resultados están expresados en μmol TE / g BS (µmol trolox / g en base seca).
Según los resultados mostrados en la Gráfica 4 para la actividad antioxidante de los residuos de cacao cuantificada con la metodología ABTS, podemos observar que la
127,3 68,2 105,8 67,2 100,7 63,5 92,3 51,2 13,3 5,9 13,1 5,6 0,0 20,0 40,0 60,0 80,0 100,0 120,0 140,0
A B A B A B A B A B A B TAURA CONE TAURA CONE TAURA CONE
ABTS DPPH FRAP
31
actividad antioxidante de la cáscara tiene una concentración aproximadamente dos veces mayor, al compararla con respecto a la cáscara de manzana, existiendo igual diferencia al comparar con pulpa de mango y fresa que son frutas reconocidas por su potencial antioxidante, de igual manera si se compara con el BHT (butil hidroxi tolueno) es superior (ver gráfica 4), el cual es considerado por ser uno de los mejores antioxidantes sintéticos que tiene una actividad antirradical del 50% (23).
Gráfica 4. Comparación de la actividad antioxidante de los residuos de cacao con respecto a los residuos de otras frutas método ABTS extracción etanolica.
n = 3
Fuente: Investigación experimental
Cáscara de manzana (50) ; Pulpa de mango y fresa (29)
Elaboración: Las autoras.
Los resultados están expresados en μmol TE / g BS (µmol trolox / g en base seca).
Según los resultados mostrados en la Gráfica 5 para grano de cacao la actividad antioxidante es seis veces mayor que la concentración en guayaba. Al comparar la concentración de antioxidantes con guayaba y cacao las diferencias se repiten, según los resultados reportados por Kuskoski et al. (29) y Jonfia el al. (56) respectivamente.
68,2 67,2
14,7 14,1 13,3
11,0
18,4 20,8
13,2 12,0
0,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0
TAURA CONE TAURA CONE TAURA CONE Manzana Mango Fresa
Cáscara Pulpa Testa BHT Residuo Pulpas
32
Gráfica 5. Comparación de la actividad antioxidante en el grano de cacao con respecto a otras frutas extracción etanolica.
n = 3
Fuente: Investigación experimental
1 = Guayaba (42); 2 = Guayaba (42) ; 3 = Cacao (56)
Elaboración: Las autoras.
Los resultados están expresados en μmol TE / g BS (µmol trolox / g en base seca).
Como se visualiza en la Gráfica 6, los valores de fenoles totales correspondientes a los sectores de investigación se correlacionan con los resultados de actividad antioxidante mencionados anteriormente. Los valores para los residuos de cacao mediante extracción con etanol son dos veces mayor a los valores reportados por Peschel et al. (57), para residuos de manzana, fresa y cuatro veces mayor a los residuos de pera, los mismos que el autor sugiere su uso como ingredientes funcionales en la industria alimentaria por su actividad antioxidante, al comparar con el antioxidante sintético BHT las diferencias se repiten. 138,1 126,0 31,1 113,8 103,2
25,2 34,0 30,2
45,5 0,0 20,0 40,0 60,0 80,0 100,0 120,0 140,0 160,0
TAURA CONE 1 TAURA CONE 2 TAURA CONE 3
ABTS DPPH FRAP
33
Gráfica 6. Comparación de la concentración de fenoles totales de los residuos de cacao con residuos de frutas mediante extracción etanolica.
n = 3
Fuente: Manzana, fresa y pera (57) e Investigación experimental.
Elaboración: Las autoras.
Los resultados están expresados en mg GAE / 100 g BS (mg equivalentes de acido gálico / 100 g en base seca).
693,2
605,9
627,5
577,3
379,5
345,5
454,1
415,6
387,4
120,9
0,0 100,0 200,0 300,0 400,0 500,0 600,0 700,0 800,0
Taura Cone Taura Cone Taura Cone Manzana Fresa Pera
Cáscara Pulpa Testa BHT Residuos
m
g G
A
E
/
100
g
B
34
CONCLUSIONES Y
RECOMENDACIONES
35
6.
Conclusiones y Recomendaciones.
6.1 Conclusiones.
Del estudio realizado concluimos que la cáscara de cacao se puede considerar como una excelente fuente de antioxidantes, la misma que para una extracción etanolica presenta valores para ABTS de 68,2 ± 0,4 y 67,2 ± 0,4
µmol de TE / g BS para Taura y Cone respectivamente, superando en más de
cuatro veces la concentración para pulpas de mango y fresa reconocidas actualmente en la industria por su gran actividad antioxidante. La pulpa y testa no presentan diferencia significativa al compararlas con las referencias mencionadas, pero no las consideramos una buena fuente de antioxidantes debido a su baja proporción en peso con respecto a la mazorca, teniendo que por cada 1 kg de mazorca se obtiene únicamente 84 y 20 g para pulpa y testa respectivamente.
36
6.2 Recomendaciones.
Determinar la capacidad antioxidante de la cáscara de cacao al utilizando fluidos supercríticos como técnica de extracción.
Determinar los componentes que les confieren la actividad antioxidante a la cáscara de cacao, mediante el empleo de cromatografía de líquidos de alta eficacia acoplado a espectrometría de masas.
Determinar la presencia de compuestos tóxicos en la cáscara de cacao. Se conoce que el grano contiene cafeína y teobromina, los cuales posiblemente se encuentren en este residuo.
37
BIBLIOGRAFÍA
38
7
Bibliografía.
1. ICCO Quarterly Bulletin of Cocoa Statistics. (26-08-2010).
2. Furlán, A.; Bressani, R., Recursos vegetales con potencial de explotación agroindustrial de Guatemala. Caracterización química de la pulpa y la semilla de
Theobroma bicolor. Archivos Latinoamericanos de Nutrición. 1999, 49, (4), 373-378. 3. Barazarte, H.; Sangronis, E.; Unai, E., La cáscara de cacao (Theobroma cacao L.): una posible fuente comercial de pectinas. Archivos Latinoamericanos de Nutrición. 2008,
58, (1), 64-70.
4. Moyin, E.; Atoyosoye., B., Utilization of agricultural wastes for the growth, leaf and soil chemical composition of cocoa seedlings in the Nursery. J. Trop. Agric. Sci. 2002, (1), 53-62.
5. Rius, J. Nuevo producto de fibra de cacao a base de cáscara de cacao tostada. 1995. 6. Hossain, M. B.; Brunton, N. P.; Barry-Ryan, C.; Martín-Diana, A. B.; Wilkinson, M., Antioxidant activity of spice extracts and phenolics in comparison to synthetic antioxidants. Rasayan J. Chem. 2008, 1, (4), 751-756.
7. Wang, S. Y.; Zheng, W.; Galletta, G., Cultural system affects fruit quality and antioxidant capacity in strawberries. J. Agric. Food Chem. 2002, 50, (22), 6534-6542. 8. Valenzuela, A.; Sanhueza, J.; Nieto, S., Natural antioxidants in functional foods: from safety to health benefits. Grasas y Aceites. 2003, 54, (3), 295-303.
9. Rojas, D. R.; Narváez, C. E.; Restrepo, L. P., Evaluación del contenido de vitamina C , fenoles totales y actividad antioxidante en pulpa de guayaba (Psidium guajava L.) de las variedades pera, regional roja y regional blanca. Memorias *Red-Alfa Lagrotech*Comunidad Europea. 2008, pp 50-60.
10. Fukumoto, L.; Mazza, G., Assessing antioxidant and prooxidant activities of phenolic compounds. J. Agric. Food Chem. 2000, 3597-3604.
11. Gutiérrez, C. Y., Proyecto de desarrollo productivo cadena de valor frutícula.
Millennium Challence Corporation. 2009, 1-13.
12. Arévalo, G.; Zúñiga, C.; Baligar, V., Dinámica poblacional fungosa asociada a la rizosfera de un sistema tradicional de cultivo de cacao (Theobroma cacao L.) en Perú.
2007, 1-7.
13. Quingaísa, E.; Riveros, H., Estudio de caso: Denominación de origen "cacao arriba". In FAO-IICA: Quito, 2007; pp 2-70.
39
15. Rodríguez, N. Beneficio del cacao (Theobroma cacao L.); Universidad Central de Venezuela: Cáracas, 2006; pp 1-32.
16. Fundación, P.-T. A. C.; SAGARPA; UACH; COFUPRO, Programa estratégico de necesidades de investigación y transferencia de tecnología para la cadena agroindustrial cacao en Mexico. In Foro Nacional Cacaotero: Tabasco, 2005; pp 2-109.
17. Cano, C., El beneficio y características físico químicas del cacao (Theobroma cacao
L.). In FEDECACAO, Ed. Colombia, 2005; pp 4-32.
18. Kalvatchev, Z.; Garzaro, D.; Cedezo, F. G., Theobroma Cacao L.:Un nuevo enfoque para la nutrición y salud. Agroalimentaria. 1998, (6), 23-25.
19. Osorio., G., Nuevas soluciones para conservar el medio ambiente. Red de Revistas Cientificas de América Latina y el Caribe. 2007, pp 59-62.
20. Brenes, O., Posibilidades de la utilización de los subproductos del beneficio del cacao. In Ecnologia Poscosecha y Calidad Mejorada., Costa Rica, 1997; Vol. 1.
21. Figueira, A.; Janick, J.; BeMiller, J., New products from Theobroma cacao: seed pulp and pod gum J. Janick and J.E. Simon (eds.), New crops. Wiley. 1993, 475-478. 22. Murillo, I.; Jara, M. Evaluación de 2 dietas experimentales con diferentes niveles de cascarilla de cacao (Theobroma cacao L.) en las fases de crecimiento y acabado de cuyes (Cavia porcellus L.) de raza andina. Universidad Politécnica del Litoral, Ecuador, 2008. 23. Martínez, J. Evaluación de la actividad antioxidante de extractos orgánicos de las semillas de heliocarpus terebinthinaceus. Universidad Tecnológica de la Mixteca, México, 2007.
24. Nava, D. Estudio de cambios estructurales y en algunos compuestos fenólicos durante la elaboración de tesguino de maíz azul (zea mays). . Instituto Politécnico Nacional., México, 2009.
40
28. Pérez-Jiménez, J.; Saura-Calixto, F., Metodología para la evaluación de capacidad antioxidante en frutas y hortalizas. V Congreso Iberoamericano de Tecnología Postcosecha y Agroexportaciones. 2007, (S8-O131), 1150-1160.
29. Kuskoski, M.; Asuero, A. G.; Troncoso, A. M.; Mancini-Filho, J.; Fett, R., Aplicación de diversos métodos químicos para determinar actividad antioxidante en pulpa de frutas. Ciénc. Tecnol. Aliment. 2005, 25, (4), 726-732.
30. Benzie, I.; Strain, J., The ferric reducing ability of plasma (FRAP) as a measure of
„„antioxidant power‟‟: The FRAP assay. Analytical Biochemistry. 1996, 239, 70-76.
31. Roginsky, V.; Lissi, E., Review of methods to determine chain-breaking antioxidant activity in food. Food Chemistry. 2005, 92, 235-254.
32. Fall, M. J., Models 6400/6405. Espectrophotometers operating manual. In JENWAY, Ed. England, 2007.
33. Izquierdo, L., Información empresa Transmar Commodity Group Ecuador. In Guayaquil, 2008.
34. Forsythe, S. J.; Hayes, P. F., Higiene de los alimentos microbiologia y HACCP. 2 ed.; España, 2002; p 375.
35. Agostini, L. R.; Moron, M. J.; Ramón, A. R.; Ayala, A., Determinación de la capacidad antioxidante de flavonoides en frutas y verduras frescas y tratadas térmicamente.
Archivos Latinoamericanos de Nutrición. 2004, 54, (1).
36. Figuerola, F.; Hurtado, M.; Estévez, A.; Chiffelle, I.; Asenjo, F., Fibre concentrates from apple pomace and citrus peel as potential fibre sources for food enrichment. J. Agric. Food Chem. 2004, 36, (4), 1-7.
37. Sánchez, B. Caracterización físico química y funcional de la fibra dietética del fruto del níspero (Eryobotrya japonica) y de la cáscara de mango obo (Mangifera indica). Universidad Tecnologíca de la Mixteca, México, 2005.
38. Hortwíz, W.; Latimer, G. W., Official Methods of Analysis of AOAC international.
18 ed.; 2005; p 65.
39. Kuklinski, C., Nutrición y Bromatología. España, 2003.
40. Flowerdew, D. W., Additives. EU food law: a practical guide. K. Goodburn. England, Woodhead Publishing Limited and CRC Press LLC. 2001.
41. Prata, E.; Oliveira, L., Fresh coffe husks as potential sources of anthocyanins.
41
42. Thaipong, K. g.; Boonprakob, U.; Crosby, K.; Cisneros-Zevallos, L.; Byrne, D. H., Comparason of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts. Journal of Food Composition and Analysis. 2006, 19, 669-675. 43. Graziani., L.; Ortiz, L.; Parra, P., Características químicas de la semilla de diferentes tipos de cacao de la localidad de Cumboto, Aragua. Agronomía Tropical. 2003, 53, (2), 133-144.
44. Yegres, S.; Sánchez, J.; Belmar, M.; Riveros, W.; Belmar, D., Producción de enzimas pécticas ensayos preliminares. Saber. 2001, 13, (1), 55-59.
45. Cardona, M.; Sorza, J.; Posada, S.; Carmona, J.; Ayala, S.; Álvarez, O., Establecimiento de una base de datos para la elaboración de tablas de contenido nutricional de alimentos para animales. Rev Col Cienc Pec. 2002, 15, (2), 240-246.
46. Anvoh, K. Y. B.; Bi, A. Z.; Gnakri, D., Production and characterization of juice from mucilage of cocoa beans and its transformation into marmalade. Pakistan Journal of Nutrition. 2009, 8, (2), 129-133.
47. Enríquez, G. A., El cultivo orgánico del cacao bajo el concepto de calidad total. In INIAP, Ed. Conferencia presentada en el Seminario-taller: Normativa, procesos y tecnologías para la producción orgánica de cacao.: Ecuador, 2003; pp 1-27.
48. Álvarez, C.; Pérez, E.; Lares, M., Caracterización física y química de almendras de cacao fermentadas, secadas y tostadas cultivadas en la región de Cuyagua, estado Aragua.
Agronomía Trop. 2007, 57, (4), 249-256.
49. Wood, B. J. B., Microbiology of fermented foods. 1998; Vol. 1, p 852.
50. Kunradi, F. G.; Compelo, G. d. S.; Copetti, C.; Gonzaga, L. V.; Nunes, E. d. C.; Fett, R., Activity and contents of polyphenolic antioxidants in the whole friut, flesh and peel of three apple cultivars. Archivos Latinoamericanos de Nutrición 2009, 59, (1), 101-106. 51. Uma, D. B.; Ho, C. W.; Wan, W. M., Optimization of extraction parameters of total phenolic compounds from Henna (Lawsonia inermis) leaves. Sains Malaysiana. 2010, 39, (1), 119-128
52. Loganayaki; Rajendrakumaran, D.; Manian, S., Antioxidant capacity and phenolic content of different solvent extracts from banana (Musa paradisiaca) and mustai (Rivea hypocrateriformis).Food Sci. Biotechnol. 2010, 19, (5), 1251-1258
42
54. Xia, E.-Q.; Deng, G.-F.; Guo, Y.-J.; Li, H.-B., Biological activities of polyphenols from grapes. Int. J. Mol. Sci. 2010, 11, 622-646.
55. Nepote, V.; Grosso, N.; Guzman, C., Extraction of antioxidant components from peanut skins. Grasas y Aceites. 2002, 53, (4), 391-395.
56. Jonfia-Essien, W.; West, G.; Alderson, P.; Tucker, G., Phenolic content and antioxidant capacity of hybrid variety cocoa beans. FOod Chemistry. 2008, 108, 1155-1159.
57. Peschel, W.; Sánchez-Rabaneda, F.; Diekmann, W.; Plescher, A.; Gartzía, I.; Jiménez, D.; Lamuela-Ravento, R.; Buxaderas, S.; Codina, C., An industrial approach in the search of natural antioxidants from vegetable and fruit wastes. Food Chemistry. 2006,
43
SIMBOLOGIA.
MeOH: Metanol
N: Normalidad.
nm: Nanómetro.
rpm: Revoluciones por minuto.
V: Volumen
W: Peso.
µmol: Micromoles.
µl: Microlitro.
µM: Micromolar.
mM: Milimolar.
W Muestra: Peso de la muestra.
W i: Peso inicial del balón.
W f: Peso final del balón.
44
45
Anexos.
Anexo 1
. Obtención del extracto mediante metanol
–acetona.
Adicionar 20 ml metanol Agitar 1 hora
Centrifugar por 30 min, a 2000 r.p.m
Residuo sólido
Colocar 20 ml de acetona acuoso 70%. Agitar 1 hora
Sobrenadantes
MeOH acuoso 50%
Retirar el sobrenadante
Almacenamiento del extracto en refrigeración a 4 oC. Centrifugar por 30 min, a 200 r.p.m
W. Muestra
46
Anexo 2.
Obtención de extracto mediante etanol.
OBTENCIÓN DE EXTRACTO.
Pesar balón vacío (W i.) Pesar 2,5 g (W. Muestra)
Concentrar hasta que quede aproximadamente: 1-1,5 ml de extracto
Pesar el balón con el extracto (W ex.) Adicionar 50 ml de etanol absoluto
Agitar por 24 horas
47
Anexo 3.
Determinación de ABTS.
Pesar 0,0250 g de Trolox, aforar a 100 ml MeOH
Tomar alícuotas de 0.2; 2; 4; 6; 8 y aforar a 25 ml de MeOH
Tomar 150 µl de cada concentración
Dejar reaccionar 7 min en la obscuridad Leer a una absorbancia de 734 nm. * Adicionar 2,85 ml solución de trabajo ABTS
7,4 mM ABTS disuelto en 25 ml de H2O 2,6 mM K2S2O8 disuelto en 25 ml de H2O Reaccionar 12 horas a T. ambiente en la obscuridad
Tomar 2 ml solución Stock ABTS + 70 ml MeOH
Solución de trabajo ABTS Solución de trabajo ABTS
Abs. 1,105±0,01 (734 nm)
ESTANDARES MUESTRAS
Extracto
Tomar 150 µl de extracto
Adicionar 2,85 ml, solución de trabajo ABTS Dejar reaccionar 7 min en la obscuridad
Leer a una absorbancia de 734 nm. *
Metanol – Acetona Taura y Cone
Cáscara 20 ml Pulpa 10 ml Testa 10 ml Grano 20 ml
Etanol Taura y Cone
48
Anexo 4.
Determinación de DPPH.
*:
Encerar el espectrofotómetro con metanol.
0,0250 g de Trolox, aforar a 100 ml MeOH
Tomar alícuotas de 0.2; 2; 4; 6, 8 ml y aforar a 25 ml de MeOH Tomar 150 µl de cada concentración
Dejar reaccionar por 30 min en la obscuridad Leer a una absorbancia de 515 nm. * Adicionar 2,85 ml de la solución de trabajo DPPH
MUESTRAS
Extracto Tomar 10 ml de la solución Stock DPPH + 70 ml MeOH
Abs. 1,100 ± 0,01 (515 nm) Pesar 0,024 g DPPH en 100 ml MeOH
Solución de trabajo DPPH
ESTÁNDARES
Adicionar 2,85 ml de la solución de trabajo DPPH Dejar reaccionar por 30 min en la obscuridad
Leer a una absorbancia de 515 nm. * Tomar 150 µl de extracto
Metanol – Acetona Taura y Cone
Cáscara 20 ml Pulpa 10 ml Testa 10 ml Grano 20 ml
Etanol Taura y Cone
49
Anexo 5.
Determinación de FRAP.
*:
Encerar el espectrofotómetro con metanol
Pesar 0,0250 g de Trolox, aforar a 100 ml MeOH. Tomar alícuotas de 0, 2; 2; 4; 6; 8 ml y aforar a 25 ml MeOH
Tomar 150 µl de cada concentración
Dejar reaccionar por 30 min en la obscuridad Leer a una absorbancia de 593 nm. * Adicionar 2,85 ml de la solución de trabajo FRAP
MUESTRAS
Extracto 25 ml, 300 mM Buffer Acetato
Mezclar y llevar a una Temp. 37 oC
40 mM HCl 2,5 ml, 20 mM FeCl3 *6H2O
Solución de trabajo FRAP 2,5 ml, 10 mM
TPTZ
ESTÁNDARES
Tomar 150 µl de extracto
Adicionar 2,85 ml de la solución de trabajo FRAP Dejar reaccionar por 30 min en la obscuridad
Leer a una absorbancia de 593 nm. *
Metanol – Acetona Taura y Cone
Cáscara 10 ml Pulpa 10 ml Testa 10 ml Grano 20 ml
Etanol Taura y Cone