“RELACIÓN DEL ORTOSTATISMO CON LOS NIVELES DE HEMOGLOBINA
GLICOSILADA Y LA PRESENCIA DE DETERIORO COGNITIVO EN PACIENTES ADULTOS MAYORES CON Y SIN DIABETES MELLITUS TIPO 2,
PERTENECIENTES AL HOSPITAL ENRIQUE GARCÉS DE QUITO –
ECUADOR”
HOSPITAL DR. ENRIQUE GARCÉS QUITO – ECUADOR
DR. NELSON CEVALLOS DIRECTOR DE TESIS
DR. RENE BUITRÓN
ASESOR METODOLOGICO DE TESIS
AGRADECIMIENTOS
Este inmenso sueño que ahora es una realidad palpable para mí y mi familia, se lo debo a la extraordinaria bondad de Dios, al amor infinito de mi familia, al apoyo incondicional de mis padres y mis suegros. Sin olvidar a la Tía Marthy que cuido a mis hijos en las incansables jornadas de trabajo y estudio.
Tito Morales
Agradezco a mi familia, amigos y la persona que me acompaño durante todo este tiempo, la culminación de esta etapa de mi vida. De forma muy especial a mis profesores por ser la dirección a seguir y sobretodo a Dios por ser parte de mi vida.
TABLA DE CONTENIDOS
1. CAPITULO I: Introducción……….. 10
2. CAPITULO II: Revisión Bibliográfica……… 14
3. CAPITULO III: Métodos………. 46
4. CAPITULO IV: Resultados……….. 55
5. CAPITULO V: Discusión………. 77
Paginas Complementarias: Bibliografía……….. 86
LISTA DE CUADROS
• Tabla 1: Acciones de la insulina en tejidos específicos (Tomado y adaptado de:
KACSOH B. Endocrine Physiology. Primera Edición. Editorial McGraw-Hill. New York, 2000)
• Tabla 2: Criterios de inclusión y exclusión de los parámetros utilizado para la
selección de pacientes del presente estudio “Relación del ortostatismo con los niveles de hemoglobina glicosilada y la presencia de deterioro cognitivo en pacientes adultos mayores con y sin diabetes mellitus tipo 2, pertenecientes al Hospital Enrique Garcés de Quito – Ecuador”. Creado por: Ricardo Cortez y Humberto Morales.
• Tabla 3: Definición de variables utilizadas para la selección de pacientes del
presente estudio “Relación del ortostatismo con los niveles de hemoglobina glicosilada y la presencia de deterioro cognitivo en pacientes adultos mayores con y sin diabetes mellitus tipo 2, pertenecientes al Hospital Enrique Garcés de Quito – Ecuador”. Creado por: Ricardo Cortez y Humberto Morales.
• Tabla 4: Operacionalización de variables utilizadas para el desarrollo del presente
estudio “Relación del ortostatismo con los niveles de hemoglobina glicosilada y la presencia de deterioro cognitivo en pacientes adultos mayores con y sin diabetes mellitus tipo 2, pertenecientes al Hospital Enrique Garcés de Quito – Ecuador”. Creado por: Ricardo Cortez y Humberto Morales.
• Tabla 5. Frecuencia de presión arterial sistólica y diastólica en pacientes adultos
mayores con y sin diabetes mellitus tipo 2 en posición sentada
• Tabla 6. Frecuencia de presión arterial sistólica y diastólica en pacientes adultos
• Tabla 7: Frecuencia de Diabetes en pacientes adultos mayores del Hospital Enrique
Garcés – Quito
• Tabla 8: Frecuencia de Diabetes mellitus Tipo 2 en pacientes adultos mayores por
edad y por décadas.
• Tabla 9: Frecuencia de Diabetes mellitus Tipo 2 en pacientes adultos mayores por
nivel de instrucción.
• Tabla 10: Relación entre Minimental y Diabetes mellitus Tipo 2 en pacientes
adultos mayores
• Tabla 11: Relación entre Minimental y género en paciente en pacientes adultos
mayores
• Tabla 12: Relación entre Minimental y la edad en pacientes adultos mayores
• Tabla 13: Relación entre Minimental y la instrucción en paciente en pacientes
adultos mayores
• Tabla 14: Relación entre MMSE y hemoglobina glicosilada en pacientes adultos
mayores.
• Tabla 15: Relación entre MMSE y la presencia de comorbilidad en paciente adultos
• Tabla 16: Relación entre ortostatismo y género en pacientes adultos mayores
• Tabla 17: Relación entre ortostatismo y la edad en pacientes adultos mayores
• Tabla 18: Relación Entre Ortostatismo Y Presencia De Comorbilidad En Paciente
Adultos Mayores Con Y Sin Diabetes Mellitus Tipo 2
• Tabla 19. Regresión logística multinomial de los factores que explican demencia y
LISTA DE FIGURAS
• Gráfico 1. Distribución porcentual de hipertensión arterial en los pacientes adultos
mayores de 65 años del Hospital Enrique Gárces - Quito en posición sentada.
• Gráfico 2. Frecuencia de hipertensión arterial en pacientes adultos mayores en
posición de pie.
• Gráfico 3. Porcentaje de frecuencia cardiaca en los pacientes adultos mayores en
posición de pie.
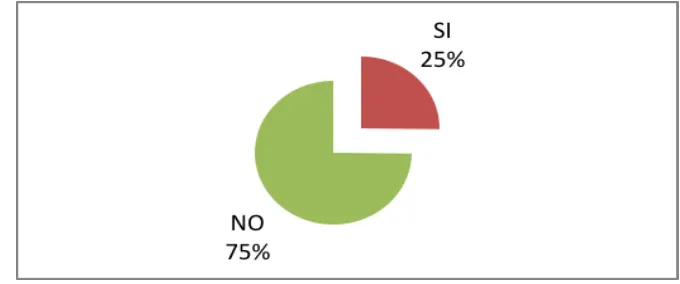
• Gráfico 4. Porcentaje de ortostatismo en los pacientes adultos mayores de 65 años
del Hospital Enrique Garcés - Quito.
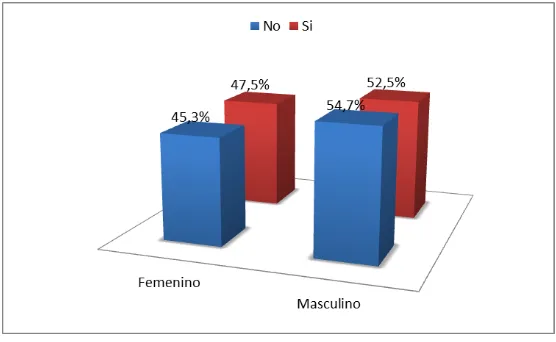
• Gráfico 5: porcentaje de presencia de diabetes mellitus tipo 2 en relación a género
en pacientes adultos mayores
• Gráfico 6: Relación entre ortostatismo en pacientes adultos mayores con y sin
Diabetes mellitus Tipo 2
• Gráfico 7: Relación entre el resultado de MMSE y la presencia de ortostatismo en
adultos mayores con y sin diabetes mellitus tipo 2.
• Gráfico 8: Relación entre niveles de hemoglobina glicosilada y ortostatismo en
RESUMEN Y ABSTRACT
El presente estudio se basó en un análisis de casos y controles pareados en pacientes mayores de 60 años pertenecientes al hospital Dr. Enrique Garcés (HEG) Quito – Ecuador; con el fin de determinar la relación entre el ortostatismo y la aparición del deterioro cognitivo temprano.
Se designó dos grupos: los casos eran pacientes con diagnóstico de diabetes mellitus tipo 2, que acuden a la clínica de diabetes del HEG; mientras que los controles fueron pacientes que no presentaron diabetes mellitus tipo 2 al momento de la recolección de los datos. Se determinó en ambos grupos la presencia de ortostatismo, basándose en la toma de presión arterial y frecuencia cardiaca en posición sentada y de pie; posteriormente se les realizo el test minimental (MMSE) obteniendo un puntaje corregido para la edad y su nivel de educación. Además se consideró los valores de hemoglobina glicosilada sérica de cada paciente y su relación con la presencia de algún nivel de deterioro cognitivo.
ABSTRACT
The present study is based on a case control analysis and involved patients over 60 years that seek attention in Dr. Enrique Garces (HEG) Hospital in Quito – Ecuador.
The aim of this study is to determinate the relation between orthostatism and the apparition of early cognitive inpairement
We designed two groups: the cases were patients with Type 2 Diabetes Mellitus, which assist to the diabetes clinic of the hospital; while the other, named as control group where patients that lacked such diagnosis at the moment of the data recollection.
We determinate in the two groups the presence of orthostatism, based on the arterial pressure and heart rate in sit and standing positions; afterwards we realized a minimental test (MMSE) obtaining a score corrected for the age and educational level. Also we considered the serum glicosilated haemoglobin of each patient and its relationship with the presence of any level of cognitive deterioration.
We used a sample of 258 with a mean of 74 years old; 46,1% were female, while 53,9% male 38,4% presented a diagnosis of type 2 diabetes mellitus, 31% had associated comorbilities (arterial hypertension with regular treatment), 66,5% of the population had a glicosilated haemoglobin less than 6.5%. The probable diagnosis of dementia based on the MMSE score was observed y 70 patients (27,13%; CI 95%; 21,8% - 32,9%) and 104 (40,3%; IC 95%; 34,2% - 46,5%) had values of 27 or less in the MMSE test, which suggest some level of cognitive deficit. 38,4% of the sample featured orthostatism plus diabetes vs 13.8% featured orthostatism alone (OR: 3,78, p: 0,0001). The largest percentage (62,86%; IC 95% 50,48% - 74,11%) of the values compatible with dementia based on the MMSE score where found in patients with type 2 diabetes (Cramer V of 0,49). Also the patients that didn’t featured orthostatism, presented a score within the expected for their age based on the MMSE (p: 0,0001). Of the 60 patients that showed orthostatism, 34,5% (IC 95%, 11,6% - 50%) had glycosilated haemoglobin over 6.5% (OR 2,47, p 0.0015).
CAPITULO I: INTRODUCCIÓN
Los estudios sobre adultos mayores están cada día afinando en las posibles relaciones entre
la salud física y las habilidades cognitivas de las personas. En este sentido, la diabetes ha
demostrado ser una enfermedad que sus secuelas se dirigen incluso a las áreas cognitivas y
sus consecuencias acaban siendo relevantes en la vida social y afectiva de los adultos mayores. La literatura científica es cada vez más ambiciosa respecto al tratamiento integral
de los adultos mayores por lo que los conocimientos que se generan están dirigidos a
prevenir y controlar las complicaciones. La diabetes es uno de estos ejemplos en los que los esfuerzos de la investigación y la intervención se interesan tanto en conocer más aspectos
de la propia enfermedad como a prevenir o evitar sus efectos en la vida cotidiana de las personas que la padecen. La diabetes es una de las enfermedades endocrinas sobre la que científicamente se tiene más datos, caracterizada por una secreción anormal, deficitaria y/o
resistencia periférica de la insulina. La consecuencia inmediata de esta secreción anormal
es la tendencia a mantener niveles de glucosa en sangre inapropiadamente elevados (hiperglicemia). Según cual sea el mecanismo por el que se produce la elevación de la
glicemia, se distinguen dos tipos de diabetes, la tipo 1 o la tipo 2. Estos son los dos tipos principales de diabetes pero existen cuadros muy variados de degeneración pancreática,
errores innatos del metabolismo, trastornos neuromusculares hereditarios, trastornos citogenéticos, obesidad, embarazo, síndrome de Cushing, síndrome de Down, etc.
La diabetes mellitus constituye un síndrome etiopatológicamente heterogéneo, en el que
influyen factores genéticos, hormonales y ambientales. Los factores genéticos apenas
marcador biológico ha resultado ser suficientemente fiable para saber quiénes serán
diabéticos o no a lo largo de sus vidas. En la actualidad se considera que parte de la
población porta un genotipo que desencadena insulinorresistencia1. Si en estas personas se
dan una serie de circunstancias ambientales como sedentarismo, alimentación abundante de
calorías, tabaquismo, alcoholismo, exceso de estrés y otros factores ambientales, la
insulinorresistencia provoca aumento crónico de insulina en sangre y se ponen en marcha
los procesos que conducirán a la obesidad androide, la diabetes tipo 2, la dislipidemia, la
hipertensión y la arteriosclerosis3.
No existe un tratamiento curativo de la diabetes y el objetivo debe estar relacionado con la prevención, por tanto, la sociedad debe centrarse en controlar los factores de riesgo. Existe
ciertos factores de riesgo que no pueden ser modificados como: antecedentes familiares de diabetes, ser mayor de 45 años, pertenecer a determinados grupos étnicos como los
afroamericanos e hispanoamericanos; y otros modificables como la hipertensión, la
obesidad, sufrir diabetes durante el embarazo, los niveles altos de triglicéridos y colesterol
en sangre4.
A pesar de que el objetivo inmediato del tratamiento es estabilizar los niveles de glucosa para poder eliminar los síntomas, el objetivo a largo plazo es prolongar y mejorar la calidad
de vida, aliviar los síntomas y prevenir las futuras complicaciones.
calcula que la diabetes reduce entre 5 y 20 años la esperanza de vida de quienes la padecen.
El deterioro cognitivo se considera una posible consecuencia de la diabetes y algunas investigaciones han estudiado a esta como factor de riesgo en el declive cognitivo y sobretodo en la Demencia tipo Alzheimer. Las alteraciones se han registrado en el lenguaje verbal, la memoria, la atención, las funciones ejecutivas, la eficacia psicomotora, etc. La
diabetes además afecta a la micro y macro circulación y por lo tanto a los vasos sanguíneos
que irrigan el cerebro, por lo que se ha planteado la relación entre la diabetes y la
degeneración del metabolismo, cambios estructurales y funcionales en el sistema nervioso
central (SNC)19,20.
En el presente trabajo se analizo la relación entre la presencia de ortostatismo, como
complicación de la Diabetes Mellitus Tipo 2 y la presencia del deterioro cognitivo
temprano en los pacientes adultos mayores, corroborado por múltiples estudios que
desarrollan el tema de las complicaciones crónicas de la diabetes y el aparecimiento de
demencia y enfermedad cerebro vascular; de esta forma es clara la asociación del mal
control de la diabetes y su correlación con enfermedades degenerativas del sistema
cardiovascular y cerebrovascular.
En un análisis de estudios se encontró la asociación entre el mal control de la diabetes y
enfermedad cerebrovascular. La enfermedad cerebrovascular se encuentra íntimamente
Varios estudios señalan a la disautonomía como factor de riesgo cardiovascular (Consenso
de San Antonio), ya que es considerada como una expresión de la enfermedad
cardiovascular secundaria a la Diabetes Mellitus Tipo 2. Esta es establecida mediante la diferencia entre la toma de frecuencia cardiaca, respiratoria y tensión arterial en posición
sentado y de pie, siendo de gran relevancia su determinación durante el examen físico.
El marcador para demostrar disautonomía puede encontrarse durante el examen físico,
pruebas de valsalva y correlación con tilt test, mesas basculante y holter cardiaco, todo esto
con el fin de establecer si existe enfermedad disautonómica en un paciente diabético y ser
indicativo del desarrollo de enfermedades neurodegenerativas.
El presente estudio tiene la relevancia de establecer la asociación entre la disautonomía
(Criterios de Consenso de San Antonio) expresada por el ortostatismo y su relación con
deterioro cognitivo (score de MMSE), en un mundo donde tenemos que prevenir el aparecimiento de enfermedades crónicas limitantes y su impacto al sistema de salud,
CAPITULO II: Revisión Bibliográfica.
Fisiología de la secreción de insulina
La insulina es una hormona proteica compuesta de dos cadenas peptídicas (cadena A, se
compone de 21 aminoácidos, mientras la cadena B de 30 aminoácidos), unidos por enlaces
disulfuro. El gen que codifica la insulina se localiza en el cromosoma 11p151.
Las células B de los islotes pancreáticos sintetizan insulina a partir de un precursor de
cadena única, la pre-proinsulina que después de su translocación a través de la membrana
del retículo endoplásmico rugoso, sufre el desdoblamiento en forma rápida de péptidos
señal N-terminal hasta formar la proinsulina1,2.
La proinsulina, esta empaquetada en su estructura con los factores de crecimiento afines a la insulina I y II, y con dos endopeptidasas dependientes de Calcio: PC2 y PC3, estos tienen dominios catalíticos relacionados con los de la subtilisina y causan desdoblamiento en las
secuencias de lisina-arginina o arginina-arginina, haciendo que la PC2 desdoble selectivamente la unión entre la cadena A y el péptido C, y la PC3 la unión de la cadena B
con el péptidos C. El momento de la conversión hacia insulina en el aparato de Golgi, se
elimina mediante proteólisis cuatro aminoácidos básicos y el conector restante o péptidos
C. Esto da a lugar a dos cadenas de polipéptidos A y B de la molécula de insulina, que
contiene un enlace disulfuro intrasubunidad y dos intersubunidad, dando como resultado un peso molecular total de 5800 Da. La transformación comienza en el aparato de Golgi,
este modo los gránulos secretores contienen insulina junto con pequeñas cantidades de
proinsulina. Cuando la célula beta pancreática es estimulada, cantidades equimolares de
péptido C y de insulina, hasta el 15% de proinsulina son liberadas hacia el fluido
intersticial por medio de exocitosis. El péptidos C no tiene una función biológica conocida,
pero sirve como índice de la secreción de insulina2.
El receptor de la insulina, es una tirosinquinasa. En otras palabras, funciona como una enzima que transfiere grupos fosfato desde el ATP (adenosin trifosfato) hacia los residuos tirosina en las proteínas objetivo intracelulares. Los receptores se encuentran en hígado,
músculo, grasa, las células beta del páncreas, y otros lugares no tan clásicos como las
células circulantes, cerebrales, y las gónadas1,2.
Como los receptores de otras hormonas proteicas, los receptores para insulina están en la
membrana plasmática.El receptor para insulina es una glicoproteína de cuatro
subunidades. Tiene dos subunidades alfa y dos subunidades beta unidas por uniones disulfuro.Las cadenas alfa son enteramente extracelulares, mientras que las beta son transmembrana y poseen una actividad tirosinproteincinasa.
Otros receptores que comparten este tipo de actividad incluyen a los del Factor de crecimiento epidérmico (EGF), Factor del crecimiento parecido a al insulina I, factor del
crecimiento derivado de plaquetas (PDGF), y el Factor estimulante de colonia I2.
La insulina se une a la porción N-terminal de la subunidad alfa y al hacerlo ocasiona un
kinasa del receptor. La unión de la insulina a las subunidades causa que las subunidades
beta se fosforilicen a si mismas (autofosforilación en 6 residuos de tirosina), activando de éste modo la actividad catalítica del receptor. Una vez que la insulina se une al receptor, los
receptores se agregan y se internalizan con rapidez, luego de lo cual pueden desintegrarse o reciclarse. En células intactas, el receptor también fosforila a residuos de serina y treonina,
por medio de la proteíncinasa C y la proteíncinasa dependiente del AMPc; este tipo de
fosforilación bloquea a la actividad de la tirosincinasa3.
La cinasa de receptor activada, fosforila a una proteína IRS-1 (sustrato de receptor de
insulina). La fosforilación de IRS-1, es el dique para otras proteínas que tienen los
dominios de homología Src2 (SH2). Una de ellas es la fosfoinositida 3 cinasa (PI3-cinasa),
que consta de dos subunidades; una catalítica (p110) y otra reguladora (p85), y esta a su vez
posee dos dominios SH2 y esta son los que se unen con IRS-1. Se cree que la adición de
fosfatos a fosfoinositidas, son las que tienen que ver en la transducción de señales. Hay
varios compuestos que estimulan la mitogénesis como: PDGF, EGF, la IL-4, y el encogen
Ras, que pueden activar a la PI3-cinasa2.
La regulación de la insulina, se basa en mantener concentraciones estables de glucosa en
la sangre, la misma que es no es solo regulada por hormonas pancreáticas, sino también
por la interacción de nutrimentos, hormonas gastrointestinales y neurotransmisores del
Favorecen la secreción de la insulina, la glucosa, los cuerpos cetónicos, aminoácidos y los ácidos grasos.
Los islotes de Langerhans, poseen receptores α2 adrenérgicos y β2 adrenérgicos. Los
receptores α2, producen una inhibición de la producción de insulina al igual que todo lo
que estimule el sistema autónomo como son: la hipoxia, hipotermia, cirugías y quemaduras.
En cambio, los receptores β2 estimulan la síntesis de insulina, al igual que varias de las
hormonas gastrointestinales, entre las mas potentes se encuentran el péptido inhibidor
gastrointestinal, péptidos parecido al glucagón 1, gastrina, colecistocinina, péptido
intestinal vasoactivo y el péptido liberados de gastrina.
El aumento de la concentración plasmática de glucosa causa la rápida liberación de los
gránulos de insulina almacenados en las células beta. Según los últimos estudios, la
insulina mantiene un patrón pulsátil de liberación, con pequeñas salvas de secreción que se
produce aproximadamente cada 10 minutos, superpuestas a oscilaciones de mayor amplitud de entre 80 y 150 minutos. La liberación de la insulina, estimulada por la glucosa, es
bifásica. La primera etapa, se da al minuto, pero posee corta duración; mientras que la
segunda fase, se inicia más tardíamente pero tiene una duración prolongada, se atribuye a
la secreción de insulina sintetizada de novo. Luego de 1,5 – 3 h. de secreción continua, los
valores de insulina caen a un 15 – 25% de los valores máximos, concentraciones que se
La glucosa entra a las células β mediante el GLUT2; la glucocinasa, que se encuentra solo
en el hígado y células pancreáticas, regula el metabolismo de la glucosa. La liberación de
la insulina depende de la concentración de calcio extracelular que exista, ya que durante su
metabolismo se produce una modificación entre la proporción de ADP y ATP, produciendo
la inhibición de los canales de K sensibles a ATP causando la despolarización de la célula,
pero la activación de los canales de calcio dependientes de voltaje favoreciendo así la
entrada de este al interior de la célula. Esta entrada de calcio produce la activación de las
fosfolipasas A2 y C, lo que lleva a la formación de ácido araquidónico, inositol polifosfato
y diacilglicerol. El inositol 1, 4, 5 trifosfato moviliza el calcio del retículo endoplasmático,
aumentando así las concentraciones intra-celulares de calcio y este calcio es el que actúa
como secretagogo de la insulina. También, las concentraciones de calcio libre se
incrementan cuando hay la estimulación de la fosfolipasa C por la acetilcolina y la
colecistocinina, así como por todas las hormonas que aumentan las concentraciones
intracelulares de adenilil ciclasa, enzima que sintetiza AMPc. Esta enzima queda activada por el glucagón, péptidos inhibidor gastrointestinal, péptidos parecido a glucagón-1 y se
bloquea por la somatostatina y los agonistas de los receptores α2adrenergicos.
Hay que tomar en cuenta, que la circulación pancreática llega primero a las células β, la
insulina puede actuar como hormona paracrina interfiriendo con la estimulación de las
La insulina, en la circulación se encuentra en forma de monómeros libres. El páncreas en
ayuno es capaz de secretar 40 ug (1 UI/h) de insulina, para alcanzar una concentración en la
vena porta de 2 a 4 ng/ml (50 a 100 uU/ml) y en circulación periférica de 0.5 ng/ml
(12uU/ml) 2,6.
La vida media de la insulina es de 5 a 6 minutos, mientras que el del péptido C es de 30
minutos. No hay que olvidar que también se libera conjuntamente con la insulina, la
proinsulina con una vida media de 17 minutos, representando solo el 10% de la insulina inmunorreactiva y el 2% de la potencia de esta.
La insulina se desintegra en el hígado, músculos y riñón mediante metaloproteinasas. Por
poseer un endotelio de tipo discontinuo, el hígado es el único órgano que es alcanzado
directamente por la insulina circulante en el plasma. En contraste, el endotelio capilar del músculo y el tejido adiposo es del tipo continuo, y la insulina penetra esta barrera mediante
un proceso lento de transcitosis no mediada por receptores
Aproximadamente, el 50% de la insulina que llega al hígado se destruye y nunca llega a la
circulación, además a nivel renal la insulina se filtra en los glomérulos renales y se
reabsorbe en los túbulos lo que también la desintegra4.
La desintegración a nivel hepático se da de manera primaria, después de la internalización
del receptor y la hormona, y en menor cantidad en la superficie celular. El complejo insulina-receptor se internalizar hacia los endosomas donde se inicia su desintegración,
Las acciones de la insulina, se producen en varios tejidos blanco, como el hígado,
músculo, grasa, entre otros.
La insulina estimula las acciones anabólicas, uso y almacenamiento, de la glucosa,
aminoácidos y ácidos grasos. Pero también bloquea los procesos catabólicos,
desintegración, de glucógeno, grasas y proteínas.
Además, regula la entrada de glucosa hacia músculo y tejido adiposo. Esta entra por
difusión facilitada mediada por la familia de los transportadores de glucosa GLUT 1 a 5. La
insulina estimula el transporte de glucosa, al favorece la translocación de las vesículas
intracelulares que poseen GLUT 4 y 1, previa fosforilación de glucosa3.
La glucosa se transforma a glucosa 6 fosfato mediante la acción de la hexocinasa (I-IV), la
hexocinasa IV denominada glucocinasa se encuentra relacionada con GLUT 2 en el hígado
y células pancreáticas β. Mientras que la hexocinasa II, se encuentra relacionada con
GLUT 4 en el músculo estriado, cardiaco y tejido adiposo2.
La glucosa-6-fosfato, posee varios caminos. Uno de los cuales es entrar a la vía de
glucolítica y generar ATP; también puede incorporarse en el glucógeno después de su
isomerización en glucosa 1 fosfato.
La insulina favorece el depósito de glucógeno por la síntesis aumentada de glucógeno
sintetasa, enzima que controla la velocidad en la síntesis de glucógeno, y al inhibir la
Otro de los efectos importantes de la insulina es la regulación de la transcripción de genes,
entre los ejemplos de esta acción se encuentra la inhibición de la trascripción de la
fosfoenolpirivato de carboxilasa, y esto explica porque la insulina tiene la capacidad de inhibir la gluconeogénesis y también nos dice porque el hígado comienza a producir
glucosa en grandes cantidades cuando se encuentra una insulinorresitencia.
Efecto Tejido blanco
Estimulación de la captación de glucosa Músculo, adiposito
Estimulación de la Na+/K+ ATPasa Músculo, adiposito
Inhibición de la glucogenólisis Hígado, músculo Estimulación de la síntesis de glucógeno Músculo, hígado
Inhibición de la gluconeogénesis Hígado
Estimulación de la síntesis de colesterol Hígado, corteza suprarrenal, gónadas
Inhibición de la lipólisis Adiposito, hígado
Estimulación de la síntesis y esterificación de ácidos grasos
Tejido adiposo, hígado
Aumento de la secreción de insulina inducida por glucosa
Célula beta pancreática
Estimulación de la lipoproteína lipasa Principalmente en los lechos capilares del tejido adiposo y el músculo esquelético Estimulación de la producción de leche Glándula mamaria
Supresión del apetito Captación de glucosa mediada por insulina en el hipotálamo ventral
Regulación de la expresión de aproximadamente 100 genes
Diferentes células blanco
Estimulación de la captación de aminoácidos Todas las células
Estimulación de la síntesis del ADN y la progresión del ciclo celular
Todas las células
[image:23.612.88.522.74.138.2]Inhibición de la apoptosis Todas las células
Tabla 1: Acciones de la insulina en tejidos específicos (Tomado y adaptado de: KACSOH B. Endocrine Physiology. Primera Edición. Editorial McGraw-Hill. New York, 2000)
Fisiopatología de la diabetes
La diabetes es una de los síndromes caracterizados por hiperglicemia, alteraciones del
metabolismo de lípidos, carbohidratos y proteínas consiguiendo con ellos aumentar el
riesgo de enfermedades vasculares.
Los últimos criterios de la American Diabetes Association (ADA: Diagnosis and
classification of diabetes mellitus. Diabetes Care. 2005;28:S37-S42 ), para el diagnostico de diabetes son:
1.Síntomas de diabetes más concentraciones de glucosa sanguínea al azar de mayor o
igual 200mg/dl.
O bien
2.Glucosa plasmática en ayunas mayor o igual 126 mg/dl.
O bien
3.Glucosa plasmática a las 2 horas mayor o igual a 200 mg/dl, durante una prueba de
tolerancia a la glucosa.
4.Hemoglobina Glicosilada mayor a 6.5%
Aunque existen muchas causas de la etiología de la diabetes, nosotros nos vamos a centrar
Esta se debe al decremento de la concentración de insulina en la circulación, conjuntamente
con una disminución de la respuesta de los tejidos periféricos a esta, llamada resistencia a
la insulina.
El glucagón juega un papel importante en la fisiopatología de la diabetes, ya que esta posee
la capacidad de realizar las acciones opuestas a la insulina sobre el hígado, ya que estimula
la gluconeogénesis, pero posee poco efecto sobre la utilización periférica de la glucosa3,4.
Si partimos del hecho que en los pacientes que poseen diabetes hay una disminución o
resistencia a la insulina, con un estado de hiperglucagonemia, va a existir algunos cambios:
1.Aumento de la producción de glucosa a nivel hepático
2.Disminución de la captación periférica de la glucosa
3.Disminución de la conversión de glucosa en glucógeno en el hígado.
4.Alteran el metabolismo de lípidos, proteínas y cetonas.
A concentraciones por debajo de las necesarias para estimular la captación de glucosa, la
insulina en el Tejido Adiposo, inhibe la lipasa sensible a hormona, con lo que consigue
bloquear la hidrólisis de los triglicéridos, esto además disminuye la concentración de
glicerol, con lo que consigue inhibir la gluconeogénesis. Y disminuye los ácidos grasos
libres, suprimiendo así la producción de cuerpos cetónicos. Cabe recalcar que estos
El hígado es capaz de producir cuerpos cetónicos. Lo que sucede es que los AGL se oxidan
a Acetil Co-A; esto se realiza mediante la acción de la acilcarnitintransferasa, que coge los
esteres de carnitina y el Co-A, y los transforma a Acetil Co-A y esta a su vez, en Acetoacetato y β-hidroxibutirato. Todo este sistema esta regulado por la Malonil Co-A, que se encuentra en la mitocondria, al aumentar la síntesis de los AGL aumenta la cantidad de
la Malonil y bloquea a la acilcarnitintransferasa2.
Normalmente, la insulina inhibe la lipólisis y esto estimula la síntesis de AGL, y como ya
hemos visto aumentan las cantidades de Malonil Co-A con la inhibición de la producción
de los AGL. En la diabetes, al haber un aumento del glucagón, hay aumento de la
oxidación de los AGL y una disminución de la Malonil-CoA aumentando así los valores de
cuerpos cetónicos.
Otra de la funciones de la insulina es aumentar la transcripción de lipoproteinlipasas a nivel
del endotelio, que hidrolizan a los triglicéridos (TG) de las lipoproteínas de muy baja
densidad y de los quilomicrones en lipoproteínas de moderada intensidad, estas a nivel
hepático son transformadas en lipoproteínas de baja densidad LDL, que tienen la
características de tener altas concentraciones de colesterol. En los diabéticos, hay estados
de hipertrigliceridemia al no haber este sistema5.
La insulina también interviene a nivel de las proteínas. Hay un aumento de la captación de
aminoácidos y de la síntesis de proteínas concomitantemente común bloqueo de la
aminoácidos en la circulación. Con la glutamina, la alanina es uno de los más importantes
precursores aminoacídicos. La insulina disminuye las concentraciones de alanina, con la
consiguiente disminución de la gluconeogénesis.
En parte, la velocidad de la aparición de las concentraciones de alanina se mantiene por la
transaminacíon de piruvato en alanina. La utilización de esta suele estar muy aumentada,
principalmente por el aumento de la captación y extracción fraccionaria hepática que hay,
en relación con su producción dando así una disminución periférica de los valores de
alanina.
En la diabetes, hay un aumento de los valores de alanina y de su transformación hacia
glucosa, la misma que aumenta la velocidad de gluconeogénesis y la elevada producción y
excreción de urea y amoniaco. Este efecto se debe principalmente por el aumento de la
circulación de proteínas ramificadas, dadas por el aumento de la proteólisis acompañada de
una disminución de síntesis proteica, y un aumento de la liberación hepática de
aminoácidos de cadena ramificada4.
Hay que tomar en cuenta que una de las complicaciones casi patognomónicas de la diabetes
es el engrosamiento de la membrana basal de los vasos, en especial se ven afectados los de poco calibre aunque también en menor medida los de gran calibre. Esto produce que la luz
del vaso se haga más estrecha y facilite así la disminución del flujo sanguíneo o que con
Insulinorresistencia y deterioro cognitivo en pacientes con diabetes mellitus
La Asociación Americana de Diabetes (ADA) define la insulinorresistencia como un estado
en el cual es necesaria una mayor cantidad de las concentraciones de insulina para lograr una respuesta biológica normal.
Estas respuestas, incluyen la facilidad para la entrada de glucosa en el músculo y células
grasas y la supresión por parte del hígado de la producción de glucosa (gluconeogénesis).
La intolerancia oral a la glucosa se define con valores entre 100 y 125 mg/dl de glucosa en ayunas; pero no se puede olvidar el hecho que hay muchos individuos con intolerancia a la glucosa, con niveles normales de glucosa en ayunas, lo que significa que son sus valores de insulina son ‘suficientes’ para mantener una normoglicemia en ayunas, pero en el momento
de desequilibra los mecanismos homeostáticos, como en la prueba de tolerancia a la
glucosa, estos no pueden mantenerse y sobreviene la intolerancia. Es por esto que otra definición de insulinorresistencia son valores mayores o iguales a 140 mg/dl hasta 200
mg/dl después de dos horas de la prueba de tolerancia. También se considera el valor de
110 mg/dl, cuando la muestra se toma a cualquier hora del día es decir al azar4.
Relación entre la insulina y la enfermedad neurodegenerativa
Se encuentra desde una asociación ancestral histológica común entre las neuronas y las
células B del páncreas, ya que a las primeras se les atribuye ancestros productores de
insulina. Además tanto en las neuronas como en los astrocitos poseen receptores de
insulina. La mayor cantidad de receptores y por lo tanto de acción de la insulina a nivel del
amígdala y septum. Y los receptores de insulina también se encuentran concentrados en la
sustancia nigra, ganglio basal y corteza cerebral19.
Antes de nada debemos destacar que la estructura mas relacionada con la memoria es el sistema límbico, ubicado en la parte central del cerebro, Al hipocampus situado en la
superficie media de del lóbulo temporal, le llega información del córtex, y a su vez envía
señales neuronales al hipotálamo y al área septal a través del fórnix.
Se ha observado que en lo ratones tanto la corteza media temporal y el hipocampo, se encuentran relacionadas con la disminución de la memoria. También, se pudo anotar que al
aumentar las concentraciones sanguíneas de insulina se puede obtener un a mejoría inicial
de la memoria, pero cuando la administración de esta es intranasal, va al hipocampo y al
hipotálamo para mejorar la memoria, pero sin alcanzar niveles plasmáticos altos19.
Se ha comprobado que las personas con diabetes tipo 2, poseen un menor aprendizaje conjuntamente con una disminución de la memoria verbal y visual. Estos cambios se han
asociado más a una hiperinsulinemia aguda20.
Al parecer la insulina no influencia el metabolismo global basal de la glucosa o su transporte hacia el cerebro, se sugiere efectos regionales específicos en el metabolismo de
la glucosa; es por ello que el hiperinsulinismo no afecta de manera global el metabolismo de la glucosa, sino a zonas especificas como son: amígdala basolateral, geniculado medio,
núcleo supraquiasmático, cuerpos supramamilares, locus ceruleus sin olvidar que las
concentraciones de insulina son menores a nivel de corteza21.
el cerebelo, corteza sensomotora, hipocampo, pituitaria e hipotálamo. Los transportadores
GLUT8, también conocidos como GLUTX1, se localizan en el hipocampo e hipotálamo.
Todo esto no lleva a la posibilidad de que la reacción insulina-glucosa se de en áreas
específicas como lo son el hipocampo y el hipotálamo.
La insulina modula un modelo molecular de aprendizaje, fenómeno conocido como potenciación a largo plazo. Esta potenciación a largo tiempo puede ser inducida por la
activación de los receptores N-metil de Aspartato (NMDA-receptor de glutamato), estos
están relacionados con el incremento del flujo neuronal de calcio. La concentración alta de
calcio presumiblemente activa a la α calcio calmodulina dependiente de kinasa II y otras enzimas dependientes de calcio, la cual tiene una gran asociación con la sinapsis neuronal.
Además se ha asociado a la insulina con la activación de varios componentes de esta
cascada, entre ellos el aumento de la expresión de NMDA a nivel de la membrana celular22.
También se asociado a la insulina con la concentración de algunos neurotransmisores, tal
como la acetilcolina y la norepinefrina, mismos que se encuentran asociados con la función
cognoscitiva. Adicionalmente, parece que la alteración en la regulación de la insulina posee
un papel en los procesos de envejecimiento23.
Se ha propuesto que hay un proceso de desensibilización del receptor neuronal de insulina,
las bajas concentraciones de insulina en el SNC, acompañadas de la disminución de los
decremento de flujo sanguíneo cerebral. Esta anormalidad da como resultado déficit
crónico y creciente del metabolismo oxidativo del cerebro.
Además esto, produce un incremento de la acidosis intracelular, en especial del aparato de
golgi y del retículo endoplasmático y a su vez hay alteración en el procesamiento de
algunas proteínas, entre ellas del PPA (proteína precursora del amiloide), y crea un
ambiente favorable para la creación de AB (beta amiloide), que como se explicará más
adelante tiene un papel fundamental en la génesis de déficits cognoscitivos, en especial en
la enfermedad de Alzheimer19.
Otro de los datos importantes, es que las concentraciones de insulina en el Líquido
Cefalorraquídeo LCR, se encuentran disminuidos lo que concuerda con la disminución de
las cantidades de insulina en el cerebro19.
La proteína precursora del amiloide, está localizado en el cromosoma 21, concretamente
dentro de la denominada "Región crítica"; esta denominación proviene de la relación con
el Síndrome de Down, ya que se ha visto que con que exista duplicación de esta región del
cromosoma 21 se da el fenotipo característico del síndrome de Down. La alteración de este
cromosoma es responsables de 5 a 20 % de los casos de enfermedad de Alzheimer (EA) familiar precoz, aunque su alteración se encuentra en mayor incidencia en EA, también se
han observado estos cambios en las personas con alteraciones cognoscitivas24,25
La proteína precursora del amiloide (PPA), es codificada por un gen localizado en el
proteínas de membrana, es decir, un segmento largo extracelular amino terminal y un corto
segmento, intracelular carboxilo terminal26.
Se piensa que interviene como un receptor ligado a proteínas G de membrana, por medio de
las cuales envía señales químicas al interior de la célula.
El beta amiloide (ßA), es un péptido de longitud variable (de 39-43 aminoácidos) y posee
un tamaño de 4-6 kDa. Es un producto natural del metabolismo de la proteína precursora
del amiloide (PPA).
La PPA se expresa en numerosas células y tejidos del organismo, incluidas: neuronas
(dendritas, cuerpos celulares y axones de neuronas), células musculares lisas de la pared
vascular y las plaquetas. Las isoformas, que se expresan en las neuronas (isoforma de PPA con 695, 714, 751 y 770 a.a) que contienen el exon 15, son más amiloidogénicas y liberan
mucho más péptido beta amiloide (ßA) que las isoformas no neuronales.
Una vez sintetizada en el retículo endoplásmico rugoso, la PPA, pasa por el aparato de
Golgi donde se glicosila y empaqueta en vesículas de transporte, atraviesa el citoplasma y,
por último, se inserta en la membrana celular. Allí es procesada mediante la acción de
diversas proteasas, siguiendo 2 procesos que compiten por la misma parte de la proteína.
En lo que es la vía más común, una proteasa, conocida como μ-secretasa, corta la PPA de
manera que libera un fragmento extracelular, soluble, de unos 695 aminoácidos. La parte
que queda integrada en la membrana es procesada después mediante la acción de una
posiblemente dentro de vesículas lisosomales para su posterior degradación. Esta vía es
conocida como vía no amiloidogénica, porque la acción de la μ-secretasa previene la
formación del péptido ßA, con lo que se impide la formación de depósitos.
Sin embargo, una parte de la PPA es procesada de manera diferente. Otra secretasa, ß
-secretasa, corta la PPA liberando un fragmento carboxilo terminal más largo, que tras ser
procesado por la g-secretasa, libera el péptido ßA. Existen dos tipos de g-secretasa que
reciben el nombre de presenilina-1 y presenilina-2, PS1 y PS1. Este péptido tiene una
solubilidad limitada y forma autoagregados que constituyen las fibrillas insolubles que se encuentran en las placas seniles. La acción de la ß-secretasa y g-secretasa produce diversos
tipos de péptidos24.
La forma más común, relativamente soluble, tiene 40 aminoácidos (ßA 40), mientras que
otras formas menores tienen una longitud de 42 o 43 residuos (ßA 42-43). Estas últimas
son mucho más insolubles que las primeras y forman fibrillas con características cinéticas
mucho más rápidas25.
Las células de la glia (astrocitos y microglía) intentan sin éxito la eliminación del β
-amiloide, generándose un proceso inflamatorio que, junto con el propio efecto tóxico del β
-amiloide, contribuye a lesionar a las neuronas.
Numerosas evidencias sugieren que los depósitos de ßA desencadenan la respuesta
inflamatoria y no que son subproductos de esta. Sin embargo, la liberación de citoquinas
durante la etapa inicial de esta respuesta conduciría a una mayor acumulación de ßA.
Las ßA desencadenan una reacción inflamatoria en el cerebro de los pacientes. Estas
incluyen25:
1.La unión específica del ßA a proteínas de fase aguda.
2.La capacidad del ßA para activar la cascada del complemento.
3.La inducción de respuesta en las células gliales en ausencia de pérdida neuronal.
4.La secreción y regulación de varios factores y citoquinas por células reactivas
estimuladas por el ßA.
5.La detección de anticuerpos circulantes que se producen en respuesta a los
cúmulos cerebrales de ßA.
También las BA tienen interacciones a nivel de neurotransmisores, lo más significativo es
la disminución en la inmunorreactividad ante la acetilcolintransferasa (ChAT) en la corteza
cerebral y el hipocampo, y una moderada pérdida neuronal en las estructuras del cerebro
basal.
Al igual, la BA, también se encuentra ligada con modestos incrementos en la secreción de
interleukina-8 (IL-interleukina-8) y una profunda reducción en los niveles de PPA procesada por la μ-secretasa (μ
PPA).
La reducción en la secreción de μ PPA se acompaña de un incremento en la PPA asociada
a la célula. Por lo tanto, la ßA disminuye la producción de μPPA que es neuroprotectora e
incrementando los niveles de PPA asociada a la célula, lo cual provee mayor sustrato para
la generación del péptido ßa27.
El amiloide se une a receptores celulares específicos en la neurona. Estos receptores se
encargan de interiorizar, para después digerir, proteínas extracelulares alteradas. La unión
de estas proteínas a los receptores induce la formación de radicales libres. Estos provocan
daños a la membrana neuronal y al ADN mitocondrial, además de hacer a las neuronas
más vulnerables a la disfunción provocada por el aminoácido excitatorio glutamato28.
Por si solo, la unión del ßA a las células microgliales provoca la liberación de radicales
libres y diversas citoquinas inflamatorias como el interferón g (IFN-g), factor de necrosis
tumoral μ (TNFμ) y diversas interleukinas, entre las que se encuentran: IL-1, IL-2, IL-3. Estas citoquinas desempeñan un importante papel, aumentando la producción de péptido ßA o por un efecto tóxico directo sobre la neurona. Además el IFN-g y el TNFμ parecen
Además la hiperinsulinemia exacerba la respuesta inflamatoria y aumenta los marcadores
de stress oxidativo consiguiendo la promoción de la formación de los aniones superoxidos,
inhibe la degradación de proteínas dañadas y aumenta la producción de ácidos grasos
poliinsaturados, que son vulnerables a la peroxidación lipídica.
También, la insulina regula la producción de prostaglandinas en el tejido adiposo, y esto
interfiere con los valores de los eicosanoides, en especial del F2 isoprostano. Las concentraciones de plasma de proteína C, IL-1B, IL-6 y TNF-alfa se incrementan con la
acción de la insulina28.
Los depósitos de amiloide están formados en su mayor parte por BA y otros constituyentes
presentes en menor cantidad, en particular la apolipoproteína E (ApoE) y distintos tipos de
proteoglicano. La ApoE se une firmemente al péptido BA, lo que favorece la formación de
las fibras amiloides. De hecho, muchos autores consideran la ApoE como un cofactor de la amiloideogénesis24.
La apolipoproteína E forma parte de los quilomicrones y de las lipoproteínas de muy baja
densidad (VLDL) presentes en el plasma. En el hígado, la ApoE se une a un receptor
específico, siendo esencial para el catabolismo de los ácidos grasos 29,30.
La ApoE es un polipéptido que contiene 317 aminoácidos y el gen que la codifica se
localiza en el cromosoma 19, asociado a los genes ApoC1 y ApoC2. Se conocen 3 isoformas de esta proteína denominados E2, E3, yE4, de acuerdo con su posición relativa
correspondientes alelos e2, e3 y e4. La ApoE más frecuente es la E3 que está presente en el
40-90% de la población. Las ApoE tiene la misión de reparar las neuronas aportando los
lípidos necesarios. En este sentido, la más eficaz es la ApoE2.
La mayor expresión de la ApoE4 suele ir asociada a una serie de demencias como la
enfermedad de Alzheimer esporádica, la demencia vascular, la demencia con cuerpos de
Lewy y la enfermedad bulbar de las neuronas motoras. Sin embargo, no todos los individuos que muestran un exceso de ApoE4 desarrollan demencia.
Los depósitos de amiloide aparecen ampliamente distribuidos en la materia gris cortical
observándose gránulos difusos tioflavina positivos. En muchos casos, el b-amiloide se
encuentra rodeando las arteriolas corticales y leptomeníngeas.
El amiloide parece lesionar progresivamente las neuronas, en particular las implicadas en las funciones intelectuales.
La proteína Tau, se encuentra en el cromosoma 17. Mutaciones en este gen provocan una
fosforilación irreversible de las proteínas que impiden su función normal y facilitan su auto
agregación, formando los ovillos neurofibrilares que es una de las características
histológicas más importantes de la EA. Se encuentran en el citoplasma neuronal y su
número está directamente relacionado con la severidad de la demencia19.
Los microtúbulos son unos de los 3 constituyentes mayores del citoesqueleto neuronal, los
infraestructura neuronal y participan en funciones como el transporte axonal de nutrientes y otras sustancias, así como el mantenimiento de la integridad estructural de la neurona.
La proteína τ normal forma los "puentes", es decir, facilitan la polimerización que
mantienen correctamente unidos los microtúbulos que conforman el citoesqueleto
neuronal19.
Normalmente, la insulina inhibe la fosforilación de la proteína T, a través de una reacción
mediada por la glicógeno sintasa guinasa 3B26
En los ovillos neurofibrilares, uno de sus constituyentes fundamentales es una forma anormalmente hiperfosforilada de la proteína τ, que causa el desensamblámiento del
citoesqueleto y da a lugar la degeneración neurofibrilar. Esta forma anómala, es conocida
como proteína Tau. La agregación de Tau se produce porque esta sufre una fosforilación
irreversible, que impide su función normal a la vez que facilita su autoagregación en
fibrillas. El efecto de estos eventos es la alteración de la estructura de los microtúbulos, que
junto con el empaquetamiento de la proteína Tau provocan afectaciones en el mecanismo
de transporte neuronal. Como consecuencia de esto, la neurona no puede transmitir señales
eléctricas ni transportar nutrientes siendo más importante el daño en el hipocampo y las
zonas adyacentes del lóbulo temporal, que son estructuras que tienen una gran importancia
en la función de la memoria25,26.
Los dos tipos de lesiones (placas neuríticas y ovillos neurofibrilares) se pueden encontrar
histopatológico es su cantidad y localización, correlacionándose su número y densidad con
la intensidad de la demencia en estos pacientes27.
La insulina interactúa con otros factores de crecimiento31, como el insulina-like growth
factor 1 (IGF-1).
Tanto el receptor de la insulina, como el IGF-1 poseen más del 50% de similaridad en la
secuencia de aminoácidos y son de la misma familia de receptores: tirosina-kinasa.
Además, los dos poseen una estructura similar con dos subunidades extracelulares y dos
subunidades transmembrana y un ligando que las une.
El IGF-1 y la insulina, pueden indistintamente unirse al receptor de insulina o al receptor de IGF-1 pero su afinidad normalmente es 100 veces mayor por su propio receptor.
En estados de hiperinsulinemia la reacción cruzada aumenta, la insulina se liga con mayor
avidez al receptor de IGF-1 lo que da como resultado el aumento de la actividad del sistema IGF-1, que posee un efecto mitogénico importante.
Además, ambos receptores pueden heterodimerizarse, la forma heterodimerizada del
receptor de la insulina posee una isoforma A la que le da la capacidad de ser activada tanto por la insulina como por la IGF-1.
La importancia de la IGF-1 consiste en que incrementa la eliminación de AB a nivel
cerebral hacia la periferia, aumentando la cantidad de proteínas transportadoras, como la
albúmina, desde la sangra hacia el LCR donde ligan y transportan a AB hacia el LCK y de
Por lo que se ha dicho hasta el momento se puede concluir que19: 1. Disminución del metabolismo cerebral de la glucosa.
2. Incremento de la inflamación.
3. Incremento del estres oxidativo.
4. Incremento de los productos avanzados de la glucosilación.
5. Incremento de la disfunción vascular.
6. Decremento de la neurogénesis.
7. Decremento de la reparación neuronal.
Disautonomía y la Enfermedad Cardiovascular.
La neuropatía autonómica cardiovascular (NACV) es una enfermedad que produce taquicardia al reposo y alteraciones en los reflejos cardiovasculares normales, esto debido al daño producido a nivel de las fibras nerviosas del sistema nervioso autonómico que
inerva el corazón y los vasos sanguíneos. A pesar de incrementar la morbimortalidad
cardiovascular de manera significativa no es reconocida con facilidad por ser generalmente asintomática. Entre las complicaciones más frecuentes se describen: reducción de la
tolerancia al ejercicio, hipertensión paradójica nocturna, incremento el riesgo de presentar
arritmias, intervalo QT prolongado, infarto de miocardio agudo silente y muerte súbita.
Los estudios sobre su prevalencia presentan un amplio rango de resultados, entre 17% a 44%, lo que en parte se explica porque no siempre se usan los mismos criterios para su definición ni los mismos métodos para su exploración. Para su diagnóstico se requiere
mediante las siguientes pruebas: maniobra de valsalva, arritmia sinusal respiratoria y la adaptación ortostática tanto de la frecuencia cardiaca (razón 30/15) como de la presión
arterial (hipotensión ortostática). Su uso ha sido aprobado por la Asociación Americana de
Diabetes y Academia Americana de Neurología. Con dos o más reflejos anormales se tiene
el diagnóstico de NACV. No existe consenso sobre incluir a la presencia de intervalo QTc
prolongado como prueba diagnóstica de esta enfermedad, se le considera más bien un
predictor independiente de morbimortalidad cardiovascular.
La neuropatía autonómica cardiovascular (NACV) es el tipo de neuropatía más estudiada y
la que tiene mayor implicancia clínica. Se le considera el predictor de mortalidad más
importante cuando se le compara con: presión arterial sistólica, pie diabético, índice de
masa corporal, proteinuria, neuropatía sensitiva y enfermedad macrovascular. Se puede
presentar en ambos tipos de diabetes y en cualquier grupo de edad, ya sea en pacientes jóvenes con diabetes tipo 1 o en adultos mayores con diabetes tipo 2. Se recomienda buscar
su presencia en todos los pacientes ya sea al momento del diagnóstico de diabetes tipo 2 o
después de cinco años en pacientes con diabetes tipo 1.
El diagnóstico de NACV se realiza con la aplicación de las pruebas recomendadas por el consenso de San Antonio sobre neuropatía diabética , las cuales son estandarizadas , reproducibles y específicas.
Las alteraciones en el tono autonómico se denominan disautonomías, y se caracterizan por
ser alteraciones transitorias ó permanentes en la respuesta local ó generalizada del sistema
nervioso autónomo (SNA). La relación normal entre la actividad simpática/parasimpática
Los trastornos de la función autonómica pueden abarcar desde la HTA grave a una
hipotensión extrema, y de la taquicardia al paro cardíaco [Banniester R., Mathias C.,
Autonomic Failure, 3rd.edit., Oxford University Press, 1992]
Clasificación de las Disautonomías
• Primarias
o Agudas: síncope neurocardiogénico.
o Crónicas: afecciones neurológicas (Síndrome de Shy-Drager)
* Son un grupo de enfermedades neurodegenerativas en las que las neuronas autonómicas centrales o las periféricas, o ambas, degeneran y mueren.
Clínicamente, se presentan como síndromes característicos: fallo
autonómico puro, cuando los pacientes sufren solamente síntomas
autonómicos; enfermedad de Parkinson, cuando los síntomas autonómicos
se combinan con un déficit extrapiramidal; demencia con cuerpos de Lewy,
cuando los síntomas autonómicos acompañan al déficit extrapiramidal y a la
demencia, y atrofia multisistémica , en la que los síntomas autonómicos se
combinan con un déficit extrapiramidal y cerebeloso.
o Drogas: antidepresivos, antineoplásicos (vincristina), alfa-metildopa,
antiparkinsonianos, terazosina. o Bebidas alcohólicas, nicotina.
o Enfermedades infecciosas (SIDA) o Enfermedad de Chagas.
o Cardiovasculares (prolapso de válvula mitral, miocardiopatía hipertrófica)
o Endócrinas (Diabetes mellitus, Feocromocitoma, Disfunción tiroidea)
o Metabólicas: Insuficiencia renal.
o Otras: Amiloidosis, Colagenopatías.
Otra de las clasificaciones que se pueden utilizar es la siguiente:
• Clasificación neuroquímica : Basado en el neurotransmisor deficitario , las enfermedades autonómicas pueden clasificarse en:
o Disautonomías puramente colinérgicas o adrenérgicas , y pandisautonomías, cuando las neurotransmisiones colinérgica y adrenérgica son deficientes.
• Clasificación según la distribución anatómica de las neuronas afectadas : Pueden
clasificarse en:
o Centrales (preganglionares)
o Periféricas (ganglionares o posganglionares), o Localizadas
Existen también síndromes autonómicos clínicos característicos secundarios a trastornos
focales del sistema nervioso central (SNC); ciertas enfermedades que afectan la inervación
autonómica específica de un órgano en particular la pupila y la piel (hiperhidrosis y
enrojecimiento facial), y los síndromes de dolor regional , en los que el sistema nervioso
autónomo podría estar afectados.
Síntomas:
Los síntomas son variados, pero se los puede clasificar por sistemas según su presentación
• Cardiovasculares: mareos, palpitaciones, disconfort torácico, ángor con cambios de
decúbito, hipotensión ortostática, HTA paroxística, presíncope, síncope,
intolerancia al ejercicio, IAM silente, muerte súbita.
• Neurológicos: cefaleas, temblor, trastornos visuales, pérdida de la visión nocturna,
convulsiones.
• Digestivos: náuseas, constipación, diarreas, dispepsia post-prandial.
• Respiratorios: obstrucción nasal.
• Génito-urinarios: impotencia sexual, disfunción vesical.
• Cutáneos: anhidrosis, alteraciones de la sensibilidad.
• Generales: debilidad, fatiga excesiva, cambios de humor.
Signos:
• Piel seca (anhidrosis)
• Facies particulares: parkinsoniana, IRC, make up Kabuki. • Taquicardia en reposo.
• Exagerado aumento de la frecuencia cardíaca con cambios posturales.
• Incompetencia cronotrópica (falta de incremento de la FC ante apremios)
• Hipotensión ortostática
Estudios Complementarios
Los estudios complementarios deben incluir exámenes cardiológicos y neurológicos:
• ECG en reposo: taquicardia, PR corto sin taquicardia, alteraciones del QT, QTc, QTd.
• Evaluación del Parasimpático (variación de la FC con respiración, Índice de
Valsalva, Índice 30/15).
• Evaluación del Simpático (cambios de la presión arterial con el cambio postural,
respuesta de la presión arterial al ejercicio isométrico).
• El valor de las pruebas del protocolo de Ewing reside en que son seguras, no invasivas, reproducibles y sirven para evaluar el estado de funcionalidad autonómico en cada paciente.
Referido el resultado a la experiencia de cada Centro, en la práctica de estos tests, sirve
para conocer cuál es el deterioro a nivel cardiovascular en el seguimiento de los pacientes
Por ejemplo en la población diabética, el buen manejo de esta permite disminuir el grado
de alteración autonómica aunque no la desaparición total del trastorno.
Recordemos que ya en el Consenso de San Antonio, capítulo de neuropatía en diabetes, la
alteración de las pruebas marca la gravedad del cuadro, es así como las anomalías de la
frecuencia cardíaca con la respiración marcarían un riesgo leve, la anormalidad en la
prueba de valsalva un riesgo moderado y la presencia de hipotensión ortostática un riesgo
grave, incluyendo el deterioro clínico que implican las caídas en los pacientes con esta última anomalía.
Hipotensión Ortostática:
De acuerdo al Consenso del año 1996 [The Consensus Committee of A: A: S, Neurology
1996, 46:1470] se diagnostica hipotensión ortostática al descenso de la presión arterial
sistólica de 20 mmHg o mas y/ó descenso de la presión arterial diastólica de 10mmHg o
más con el cambio postural.
Se pueden utilizar otros recursos para su diagnóstico y son los que se mencionan abajo:
• Control de PA. • Control de FC • Estudio Holter/24hs. • Presurometría ambulatoria.
• Estudio de variabilidad de la FC
• QT-QTc-QTD (dispersión del qt)
CAPITULO IV: Metodología
I. Problema de investigación.
Existe relación entre la presencia de ortostatismo y el deterioro cognitivo temprano
entre pacientes mayores de 60 años diabéticos tipo 2 controlados y no controlados
según niveles de hemoglobina glicosilada pertenecientes al hospital Dr. Enrique Garcés
de Quito – Ecuador .
II. Hipótesis
Existe relación entre disautonomía y deterioro cognitivo en pacientes mayores de 60
años diabéticos tipo 2 controlados y no controlados.
III. Diseño del estudio
Estudio de Casos y Controles:Los participantes del estudio cumplieron con los criterios de inclusión. Los casos eran pacientes mayores de 60 años, con diagnóstico de Diabetes
mellitus tipo 2 que acuden a la clínica de Diabetes del HEG.
Mientras que los controles fueron pacientes mayores de 60 años, que no presentaron
diagnostico de diabetes mellitus tipo 2 al momento de la recolección de los datos.
A los dos grupos se realizaron la toma de presión arterial y frecuencia cardiaca tanto en
posición sentada y de pie, para determinar ortostatismo; posteriormente se les realizaba el
educación de cada paciente. Se consideró además, los niveles de hemoglobina glicosilada
sérica de los paciente.
IV. Criterios de inclusión y exclusión
INCLUSIÓN EXCLUSIÓN
Edad:
Se tomara en cuenta a todos los pacientes mayores de 60 años que asistan a la Consulta Externa de la
Clínica de Diabetes, al servicio de Medicina Interna
del Hospital Dr. Enrique Garcés de Quito – Ecuador
Disautonomía
Se excluirá a los pacientes que tengan disautonomía
sin ser diabéticos.
Tiempo de Diagnóstico:
Pacientes con al menos 12 meses de tiempo de diagnóstico de diabetes mellitus tipo 2
Otras causas de deterior cognitivo:
Se excluirá a los pacientes que presenten otras causas
de deterioro cognitivo no relacionadas con DM2 (ej.: APP: TCE, ECV isquémico o hemorrágico, causas
genéticas, encefalopatía hepática)
Etnia:
Se incluirá a todos los pacientes sin importar su etnia
Enfermedad aguda
Se excluirá a todos los pacientes que presenten
cualquier enfermedad que comprometa su estado general basal al momento del estudio
Índice de masa corporal
Se incluirá a todos los pacientes con índice cualquier
índice de masa corporal
Paciente sin consentimiento:
Se excluirá a todos los pacientes que se nieguen de
[image:48.612.80.531.154.626.2]forma voluntaria a participar en el estudio
V. Definición de variables.
Deterioro cognitivo El deterioro cognitivo es cualquier déficit de las
llamadas funciones mentales superiores.
El más común es la pérdida de memoria. Múltiples
causas pueden ser las provocadoras de este tipo de problemas; es por esto que el deterioro cognitivo (no la demencia) se puede caracterizar como un síndrome
geriátrico, el cual debe ser evaluado para detectar
todos los componentes del mismo y, en su caso, hacer el diagnóstico de demencia. El diagnóstico se
establecerá en un inicio mediante el Minimental test,
cuyos resultados serán ajustados por la edad y el nivel