UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA
La Universidad Católica de Loja
ÁREA BIOLÓGICA Y BIOMÉDICA
TITULO DE BIOQUÍMICO FARMACÉUTICO
Aislamiento y evaluación de actividad antibacteriana de metabolitos
secundarios aislados de la planta medicinal
Cestrum racemosum
Ruiz
& Pav.
TRABAJO DE TITULACIÓN
AUTORA:
Carrión Benavides, María Auxiliadora.
DIRECTOR
: Ramírez Robles, Jorge Yandry, Ph.D.
LOJA-ECUADOR
ii
APROBACIÓN DEL DIRECTOR DEL TRABAJO DE TITULACIÓN
Ph.D.
Jorge Yandry Ramírez Robles. DOCENTE DE LA TITULACIÓN
De mi consideración:
El presente trabajo de titulación: Aislamiento y evaluación de actividad antibacteriana de metabolitos secundarios aislados de la planta medicinal Cestrum racemosum Ruiz & Pav. realizado por Carrión Benavides María Auxiliadora, ha sido orientado y revisado durante su ejecución, por cuanto se aprueba la presentación del mismo.
Loja, julio de 2016
iii
DECLARACIÓN DE AUTORÍA Y CESIÓN DE DERECHOS
“Yo, Carrión Benavides María Auxiliadora declaro ser autora del presente trabajo de titulación: Aislamiento y evaluación de actividad antibacteriana de metabolitos secundarios aislados de la planta medicinal Cestrum racemosum Ruiz & Pav. de la Titulación de Bioquímica y Farmacia, siendo el Ph.D. Ramírez Robles Jorge Yandry director del presente trabajo; y eximo expresamente a la Universidad Técnica Particular de Loja y a sus representantes legales de posibles reclamos o acciones legales. Además certifico que las ideas, conceptos, procedimientos y resultados vertidos en el presente trabajo investigativo, son de mi exclusiva responsabilidad.
Adicionalmente declaro conocer y aceptar la disposición del Art. 88 del Estatuto Orgánico de la Universidad Técnica Particular de Loja que en su parte pertinente textualmente dice: “Forman parte del patrimonio de la Universidad la propiedad intelectual de investigaciones, trabajos científicos o técnicos y tesis de grado o trabajos de titulación que se realicen con el apoyo financiero, académico o institucional (operativo) de la Universidad”
iv
DEDICATORIA
El actual trabajo de investigación lo dedico con mucho cariño:
A Dios y la Virgen Santísima por permitirme cumplir una meta más en mi vida y por llenarme de sabiduría para la realización de este estudio, acompañándome en cada paso, por su bondad y amor siendo mi refugio espiritual.
A mis padres Carlos Carrión y María Auxiliadora Benavides, que se han esmerado por darme siempre lo mejor, dándome la oportunidad de tener una excelente educación en el transcurso de mi vida, son mi fortaleza, mi orgullo y a quienes debo mi profesión; a mis hermanos Ma. De los Ángeles, Jamil, José Luis y Jorge, cuñado y cuñadas, a cada uno de ustedes por su apoyo, amor y entera confianza en cada reto que se me ha presentado sin dudar ni un solo momento de mi capacidad e inteligencia.
A mis sobrinos a quienes adoro y que cada semana me regalan su amor y sonrisas recargándome de energía para continuar.
A mis amigos quienes siempre tuvieron una palabra de aliento en los momentos de cansancio a lo largo de la carrera.
Todo el esfuerzo y dedicación para ustedes.
v
AGRADECIMIENTO
Primeramente agradezco a Dios por mantenerme con fe, conocimiento y fuerzas, permitiéndome terminar mi carrera universitaria.
A mi familia por su comprensión y apoyo incondicional
A mi director de tesis Ph.D Jorge Ramírez, quien a través de su paciencia y conocimientos, estuvo presto a guiarme para realizar el trabajo con éxito.
A cada uno de los tutores que a lo largo de la carrera han compartido e inculcado sus conocimientos.
Finalmente agradezco a la Universidad Técnica particular de Loja y al Departamento de Química por el apoyo y colaboración en la realización de mi trabajo de fin de titulación, facilitándome el uso de instalaciones y recursos.
Así mismo deseo expresar un sincero agradecimiento a todos quienes ya sea de manera directa o indirecta han hecho posible el cumplimiento de esta meta.
Gracias infinitas.
vi
ÍNDICE DE CONTENIDO
APROBACIÓN DEL DIRECTOR DEL TRABAJO DE TITULACIÓN ... ii
DECLARACIÓN DE AUTORÍA Y CESIÓN DE DERECHOS ... iii
DEDICATORIA ... iv
AGRADECIMIENTO ... v
ÍNDICE DE CONTENIDO ... vi
ÍNDICE DE ILUSTRACIONES ... ix
ÍNDICE DE TABLAS ... x
ÍNDICE DE ANEXOS ... xi
RESUMEN ... 1
ABSTRACT ... 2
INTRODUCCIÓN ... 3
CAPITULO I ... 4
1. MARCO TEÓRICO ... 4
1.1. Antecedentes ... 5
1.2. Biodiversidad en el Ecuador ... 5
1.3. Familia Solanaceae ... 6
1.3.1. Descripción del género Cestrum ... 6
1.3.2. Descripción de la especie Cestrum racemosum Ruíz & Pav ... 7
1.3.3. Descripción botánica de la especie Cestrum racemosum ... 7
1.4. Descripción de metabolitos secundarios y su clasificación. ... 8
1.5. Técnicas de separación, purificación e identificación de metabolitos secundarios ... 9
1.5.1. Maceración ... 9
1.5.2. Cromatografía de Columna ... 10
1.5.3. Cromatografía de Capa Fina ... 10
1.5.4. Factor de retención ... 11
1.5.5. Cromatografía de gases acoplada a espectroscopia de masas (CG-EM) .. 11
vii
1.6.1. Bacterias Gram Positivas ... 12
1.6.2. Bacterias Gram Negativas ... 13
CAPITULO II ... 17
2. MATERIALES Y MÉTODOS ... 17
2.1 Esquema de la metodología utilizada. ... 18
2.2. Recolección y selección del material vegetal ... 19
2.3. Tratamiento del material vegetal y obtención de los extractos. ... 19
2.4. Extracto Hexánico. ... 20
2.4.1. Partición líquido-líquido del extracto Hexánico. ... 20
2.4.2. Fraccionamiento en cromatografía de columna... 20
2.4.3. Cromatografía de Capa Fina ... 20
2.4.4. Purificación de fracción ... 21
2.5. Extracto de Acetato de Etilo. ... 21
2.5.1. Fraccionamiento en cromatografía de columna... 21
2.5.3. Cromatografía de Capa Fina ... 21
2.5.4. Purificación de fracción ... 22
2.7. Identificación de los Compuestos obtenidos. ... 23
2.7.1. Resonancia Magnética Nuclear ... 23
2.7.2. Cromatografía de Gases acoplada a espectroscopia de masas (CG-EM).. 24
2.8. Determinación de la Actividad Antimicrobiana ... 25
2.8.1. Microorganismos de prueba ... 25
2.8.2. Preparación de muestras ... 25
2.8.3. Preparación del cultivo overnight ... 25
2.8.4. Preparación de la suspensión del inóculo para bacterias. ... 25
2.8.5. Concentración mínima inhibitoria (CMI) antibacteriana ... 26
CAPITULO III ... 27
3. RESULTADOS Y ANÁLISIS ... 27
viii
3.2. Fraccionamiento del extracto de Hexano de la especie Cestrum racemosum 28
3.2.1. Fracción MA115/25... 28
3.3. Fraccionamiento del extracto de Acetato de Etilo de la especie Cestrum racemosum ... 29
3.3.1. Fracción MA068/15... 29
3.3.2. Fracción MA047/10... 33
3.4. Determinación de actividad antibacteriana ... 34
CONCLUSIONES ... 36
RECOMENDACIONES ... 37
BIBLIOGRAFÍA ... 38
ix
ÍNDICE DE ILUSTRACIONES
Ilustración 1. Fotografía de Cestrum racemosum Ruíz & Pav. ... 7
Ilustración 2. Fotografía de Cestrum racemosum. ... 8
Ilustración 3. Fórmula para calcular el Factor de Retención ... 11
Ilustración 4Staphylococcus aureus ... 13
Ilustración 5Echerichia coli. ... 13
Ilustración 6.Proteus vulgaris ... 14
Ilustración 7. Salmonella enteritidis ... 14
Ilustración 8.Pseudomona aeruginosa. ... 15
Ilustración 9. Klebsiella pneumoniae ... 15
Ilustración 10.Salmonella typhimurium ... 16
Ilustración 11. Esquema del desarrollo de la investigación. ... 18
Ilustración 12. Muestra botánica de Cestrum racemosum. ... 19
Ilustración 13. CCF de la unión de las fracciones del extracto Hexánico ... 20
Ilustración 14. CCF de la unión de las fracciones obtenidas a partir de la fracción MA100/24 ... 21
Ilustración 15. CCF de la unión de las fracciones del extracto de acetato de etilo. .... 22
Ilustración 16. CCF de la unión de las fracciones obtenidas a partir de la fracción MA004/4. ... 23
Ilustración 17. CCF de la fracción MA047/10 ... 23
Ilustración 18. Estructura molecular del triglicérido ... 29
Ilustración 19-Estructura molecular de α-amirina ... 31
Ilustración 20.Estructuras moleculares de la mezcla terpénica: (1) de α-amirina y (2) β-amirina ... 31
Ilustración 21. Espectro de CG-EM de α-Amirina. ... 32
Ilustración 22. Espectro de CG-EM de β-Amirina. ... 32
Ilustración 23. Estructura molecular del Ácido Esteárico ... 33
x
ÍNDICE DE TABLAS
Tabla 1. Clasificación taxonómica de la especie Cestrumracemosum Ruíz & Pav. ... 8
Tabla 2. Características de fracciones obtenidas a partir de MA005/4 ... 23
Tabla 3. Características de las columnas capilares. ... 24
Tabla 4. Parámetros operacionales del CG-EM de la columna DB-5MS. ... 24
Tabla 5. Condiciones de Incubación de medios de cultivo y sus bacterias. ... 25
Tabla 6. Peso y rendimiento de extractos obtenidos a partir de Cestrum racemosum.28 Tabla 7. Comparación de 13C RMN de la fracción MA115/25 (Triglicérido) ... 28
Tabla 8. Comparación de 13C RMN de la fracción MA068/15 (α-amirina) ... 30
Tabla 9. Mezcla de terpenos Identificados en la fracción MA068/15 ... 32
Tabla 10.Ácido graso identificado en la fracción MA 47/10 ... 33
xi
ÍNDICE DE ANEXOS
Anexo 1. Espectro de 1H RMN de la fracción MA115/25 ... 44
Anexo 2. Espectro 13C RMN de la fracción MA115/25. ... 45
Anexo 3. Espectro de 1H RMN de la fracción MA068/15 ... 47
Anexo 4. Espectro 13C RMN de la fracción MA068/15. ... 48
Anexo 5. Cromatograma de la fracción MA068/15 ... 52
1
RESUMEN
En la presente investigación, se realizó el estudio fitoquímico a partir de los extractos obtenidos en hexano y acetato de etilo de la especie medicinal Cestrum racemosum Ruíz & Pav. Mediante técnicas cromatográficas se aisló y caracterizó un triterpeno pentacíclico conocido como -amirina y un triglicérido aparentemente constituido por los ácidos: (DHA) docosahexaenoato, (EPA) eicosapentaenoato, (LA) ácido linoleico, una mezcla de triterpenos y amirina, y el ácido esteárico. Finalmente se evaluó la actividad antibacteriana de los extractos totales: hexánico y acetato de etilo, frente a bacterias patógenas mediante CMI, resultando negativo para: Staphylococcus aureus (ATCC 25923), Echerichia coli (ATCC 25922), Proteus vulgaris (ATCC 8427),
Salmonella enteritidis, Pseudomona aeruginosa (ATCC 27853), Klebsiella pneumoniae (ATCC 9997), Salmonella typhimurium (LT 2).
2
ABSTRACT
In this research, the phytochemical study was conducted from extracts obtained from hexane and ethyl acetate of medicinal species Cestrum racemosum Ruíz & Pav. Identification has been established by chromatographic techniques it was isolated and characterized a pentacyclic triterpene known as α-amyrin and a triglyceride apparently consisting acid (DHA) docosahexaenoate (EPA) eicosapentaenoate (LA) linoleic acid, a mixture of triterpenes α and β amyrin, and stearic acid. Finally the antibacterial activity of the total extracts was evaluated: hexane and ethyl acetate, against pathogenic bacteria by CMI, found negative for Staphylococcus aureus (ATCC 25923),
Escherichia coli (ATCC 25922), Proteus vulgaris (ATCC 8427), Salmonella enteritidis,
Pseudomonas aeruginosa (ATCC 27853), Klebsiella pneumoniae (ATCC 9997), Salmonella typhimurium (LT 2).
3
INTRODUCCIÓN
Las plantas medicinales son una cuestión muy arcaica, a pesar de ello, los conocimientos al respecto siempre han estado disgregados. Los efectos secundarios adversos de algunas drogas tanto sintéticas como naturales, así como la resistencia y los elevados costos en el tratamiento han incitado y orientado muy intensamente la investigación en la exploración y utilización de sustancias puras o extractos crudos de plantas (Quezada. 2008).
Ecuador al contar con centenares de plantas medicinales, debido a su alta diversidad biológica por unidad de superficie la cual se debe principalmente a la Cordillera de los Andes, la posición geográfica, las corrientes marinas, el endemismo, y las Islas Galápagos, instaura de esta forma una fuente natural trascendental para la búsqueda de compuestos desconocidos con actividades farmacológicas (De la Torre et al., 2008).
El género Cestrum, pertenece a la familia Solanaceae, familia que se caracteriza por la presencia de alcaloides, dentro de este género tenemos varias especies entre ellas
Cestrum racemosum, cuyas hojas se han utilizado contra la malaria, y contra las heridas infectadas o llagas por parásitos (sarna) en la forma de un yeso. El mismo uso se ha informado de otras Cestrum sudamericanas, Cestrum auriculatum L'Her., Cestrum strigillatum Ruiz & Pavon (Bourdy et al., 2004). Cestrum auriculatum L'Her posee buena actividad antifúngica, (Rojas et al., 2003), pero a pesar de ello no se ha reportado en la literatura, ningún leishmanicida o antiplasmodial como actividad de
Cestrum. Este género es conocido por su contenido en saponinas (Fouad et al., 2008) y esta clase de compuestos mostró una fuerte actividad in vivo contra leishmaniasis (Germonprez et al., 2005). Esta es la razón por la que consideramos esta planta como promisoria en esta y posteriores investigaciones.
4
CAPITULO I
5
1.1. Antecedentes
Antiguamente, los conocimientos eran transmitidos de manera oral por la carencia de escritura; con el desarrollo de la escritura apareció el papiro que fue un soporte para nuestros antepasados, en donde recogían informaciones considerándose como patrimonio para unos pocos dentro de las sociedades, de las cuales se han mantenido y pasado a la humanidad hasta nuestros días, en ellos revela que nuestros ancestros usaban plantas con atributos medicinales como medios para aliviar sus dolencia tanto físicas como espirituales, mediante rituales de sanación de manera empírica, diferenciando así las que curaban de las que mataban (Akerele, 1984).
A inicios de los años noventa, la Organización Mundial de la Salud identificó que el 80% de la población mundial recurre a la medicina tradicional para asistir problemas de salud, que implican el uso de extractos de plantas o de sus principios activos (OMS, UICN & WWF, 1993). En la actualidad existe un reconocimiento del empleo de fuentes naturales de medicamentos y en especial de la fitoterapia, justificado en muchos casos por razones económicas, disminución de efectos tóxicos crónicos muy frecuentes en sustancias químicas puras, con una tendencia en los países desarrollados al retorno del empleo de productos naturales en el tratamiento de diversas afecciones (Morin & Bastide., 1983). Por ello el conocimiento y validación de los usos populares de las plantas en sus diversos usos, es de gran importancia; para lo cual se cuenta con la participación de muchas ramas científicas afines a la Botánica y la Farmacología.
Dentro de estas se encuentra la Fitoquímica, la Farmacobotánica, entre otras disciplinas que se desprenden de la Farmacognosia, esta ciencia farmacéutica estudia las fuentes naturales de materia prima de interés farmacéutico, dentro de su estudio se encuentran los aspectos botánicos, químicos y biológicos de las drogas, destinadas bien sea al aislamiento de sus constituyentes bioactivos para la preparación de medicamentos, o la elaboración de productos fitoterapéuticos, estableciendo seguridad y eficacia de las plantas medicinales utilizadas en fitoterapia (Kinghorn, 2001).
1.2. Biodiversidad en el Ecuador
6
nuestro país es impresionante. Las razones para que esto sea así son varias, pero las más importantes son la posición tropical que genera un clima adecuado más o menos similar a lo largo del año ya que se encuentraubicado al noroeste de América Latina, sobre la línea ecuatorial, por lo que su territorio se encuentra en ambos hemisferios; la presencia de los Andes y otras montañas generan una escalera en cuyos peldaños se encuentran muchas más formas de vida y ecosistemas, las corrientes marinas que generan un clima más bien seco en la parte sur del litoral del país y las Galápagos, y muy húmedo en la parte norte, instaurando una gran biodiversidad.
En cuanto a la vegetación en el Ecuador existen al menos 3118 especies, pertenecientes a 206 familias de plantas usadas con fines medicinales. El 75% de estas especies son plantas nativas y el 5% endémicas, mientras que el 11% son introducidas. Las partes de las plantas más utilizadas son las hojas (30%), la planta entera (10%) y las flores o inflorescencias (6%) (De la Torre et al., 2008).
1.3. Familia Solanaceae
La familia Solanaceae es un grupo muy grande; contiene 96 géneros, divididos en unas 2297 especies, la mayoría de ellas clasificadas como espontáneas (D’Arcy, 1991). El nombre de esta familia de plantas proviene del latín solamen, que quiere decir confortar o calmar y se refiere a las propiedades sedativas de algunas de las especies. Una de las características de esta familia de plantas es la presencia de alcaloides que pueden estar presentes en: follajes y frutos en estado inmaduro. Estos compuestos pueden ser tóxicos para el hombre y los animales, causando envenenamientos y hasta la muerte de individuos que las hayan ingerido (Raddick, 1986).
1.3.1. Descripción del género Cestrum
7
Varias de las especies de este género presentan compuestos con actividad antibiótica, antifúngica y pesticida (Khan et al., 2011).
1.3.2. Descripción de la especie Cestrum racemosum Ruíz & Pav
Se lo conoce comúnmente como Sáuco o “Zorrillo”, se presenta como arbusto de 1-10 m de alto. Las ramas son glabras. Las hojas son lanceoladas o lance-oblongas de 7-23 cm de largo por 2-7 cm de ancho, las cuales tienen altos grados de fibra, la proteína contenida es similar a las leguminosas y posee un buen nivel de antioxidantes. Las nervaduras de las hojas son prominentes. Las inflorescencias racemosas pueden ser axilares o terminales. Flores pequeñas, sésiles, amarillo verduzcas (MacVean, 2007).
Es usada en la medicina tradicional en infusión de las hojas para curar gripes y temperatura corporal alterada, por lo que se cree que podría ayudar a fortalecer el sistema inmunitario, pero aún no existen estudios que los confirmen (D´Arcy, 2001). Además de presentar actividades leshmanicidas (Valadeau, 2009).
1.3.3. Descripción botánica de la especie Cestrum racemosum
Ilustración 1. Fotografía de Cestrum racemosum Ruíz & Pav.
8
Ilustración 2.Fotografía de Cestrum racemosum.
Fuente: La autora. 2016.
Tabla 1. Clasificación taxonómica de la especie Cestrum racemosum Ruíz & Pav.
Taxonomía
Reino: Plantae
Subreino: Tracheobionta
División: Magnoliophyta
Clase: Magnoliopsida
Orden: Solanales
Familia: Solanaceae
Género: Cestrum
Especie: C. rasemosum
RUIZ & PAV.
Fuente: (Catálogo taxonómico de especies de México. 2009)
1.4. Descripción de metabolitos secundarios y su clasificación.
9
procesos de crecimiento, desarrollo o reproducción (García & Pérez, 2009.). Por esta razón se presenta una distribución particular en el reino vegetal, es decir, no todos los metabolitos secundarios se encuentran en todos los grupos de plantas, sino más bien se sintetiza en pequeñas cantidades en un determinado género de plantas, una familia, o incluso a algunas especies. Según Goossens et al., 2003 hasta la fecha se conocen más de 100000 compuestos provenientes del metabolismo secundario.
Tomando en cuenta las vías biosintéticas que les dan origen, se ha agrupado a estos compuestos secundarios en cuatro grupos:
Los terpenos, entre los que se encuentran hormonas, pigmentos o aceites esenciales, estos constituyen el grupo más numeroso de metabolitos secundarios, suelen ser insolubles en agua y derivan todos ellos de la unión de unidades de isopreno.
Las sustancias fenólicas, en las que hallamos cumarinas, flavonoides, lignina y taninos, que poseen al menos un anillo aromático con un radical hidroxilo sustituyente en su estructura química.
Glicósidos conformados por saponinas, glicósidos cardiacos, glicósidos cianogénicos y glucosinolatos.
Alcaloides, esta gran familia de más de 15.000 metabolitos secundarios poseen tres características: son solubles en agua, contienen al menos un átomo de nitrógeno en la molécula, y exhiben actividad biológica (Bruneton, 2001).
1.5. Técnicas de separación, purificación e identificación de metabolitos secundarios
Para determinar los metabolitos secundarios presentes en la especie Cestrum racemosum se aplica una serie de técnicas tanto de extracción, separación, purificación y determinación estructural, se han desarrollado una serie de métodos para la detección preliminar de estos, basados en la extracción de los mismos mediante solventes apropiados.
1.5.1. Maceración
10
de partícula entre otros. Este proceso se lo puede realizar de dos maneras la clásica o estática que consiste en dejar en contacto el material vegetal con el disolvente por varios días con agitación ocasional, y la dinámica en la que el tiempo de operación es reducido drásticamente a horas aquí tanto la materia prima como el disolvente deben mantenerse en movimiento constante; durante la maceración ocurre un fenómeno de gran importancia, que es el hinchamiento del material vegetal, esto dará lugar a un aumento en la permeabilidad de la pared celular, mejorando la difusión del disolvente (Sharapin, 2000).
1.5.2. Cromatografía de Columna
Como su nombre lo dice se realiza en una columna que puede ser de vidrio o de plástico la misma que es rellenada de un adsorbente adecuado. El sistema es bañado por un solvente o una solución de un par de solventes que fluyen a través de la columna para comprobar el funcionamiento de la misma. Por la parte superior se introduce la sustancia a separar disuelta adecuadamente. Se deja fluir por la columna. Antes de que ésta quede totalmente seca se incorporan los disolventes de acuerdo con la solubilidad de las sustancias, sufriendo durante su arrastre interacciones de polaridad con el sólido adsorbente. Los eluatos son recogidos para su determinación posterior. Las separaciones se basan fundamentalmente en las diferencias de distribución de los solutos entre el adsorbente, un sólido poroso (fase estacionaria) y el disolvente (fase móvil). Los adsorbentes más utilizados, ordenados de mayor a menor actividad son: alúmina, sílice y carbonato cálcico. Generalmente este tipo de cromatografía se emplea para separación de sustancias en escala preparativa (Méndez, 2011).
1.5.3. Cromatografía de Capa Fina
11
manera de cuantificar es mediante el Rf el cual se lo obtiene de la relación entre la distancia recorrida por un compuesto y la distancia total recorrida por un disolvente desde el origen (Del Castillo et al, 2004).
1.5.4. Factor de retención
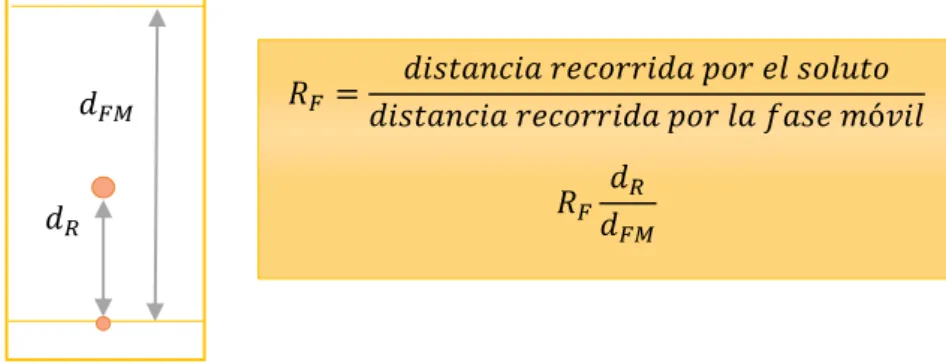
La relación de las distancias recorridas por el compuesto y por el disolvente, desde el punto de origen del cromatograma se denomina factor de retención (Ann, et al., 2000), el cual asigna un valor constante para cada compuesto en condiciones determinadas, sin embargo, es poco factible reproducir exactamente estas condiciones, así que se suele comparar una muestra con otra, eluyendo ambas dentro de la misma placa; la distancia que recorre el compuesto se mide desde el centro de la mancha, si dichas manchas son extremadamente grandes, el valor del Rf será erróneo, por lo cual se realizamos unas marcas en la placa donde depositaremos un mínimo de muestra. (Spangenberg, et al., 2011). El �� se calcula con la ecuación que se observa a continuación: (Ilustración 3).
Ilustración 3. Fórmula para calcular el Factor de Retención
Fuente: La autora 2016.
1.5.5. Cromatografía de gases acoplada a espectroscopia de masas (CG-EM)
Es la técnica analítica de separación más ampliamente utilizada, debido a su alta sensibilidad, aunque la cromatografía de gases acoplada a un espectrómetro de masas requiere sistemas especiales de conexión. En principio, se trata de dos técnicas que trabajan en fase gaseosa y necesitan poca cantidad de muestra para su análisis, por lo que son muy compatibles. Los compuestos se ionizan y se clasifican en función de su relación masa/carga (Valcárcel et al., 2000). El único obstáculo serio a la hora de realizar su acoplamiento es que el efluente que emerge de la columna cromatográfica sale a presión atmosférica y debe introducirse en el interior del espectrómetro de masas que trabaja a alto vacío. Actualmente, el acoplamiento directo
12
resulta fácil cuando se utiliza la cromatografía de gases capilar, que es el caso más habitual (Gutiérrez, 2002).
1.5.6. Resonancia magnética nuclear (RMN)
A través de la espectroscopía de Resonancia Magnética Nuclear (RMN) se pueden identificar moléculas, es una técnica muy potente que da gran información estructural. Como bien se conoce los átomos más abundantes en los compuestos orgánicos son el H y C, por lo que se pueden observar fácilmente en cantidades no muy grandes de muestra. Puesto que en cada caso se pueden sacar conclusiones sobre el entorno próximo e incluso lejano a cada átomo es decir, se puede llegar a conocer la estructura de dichos compuestos (McMurry, 2012). Esta técnica se basa en el momento angular intrínseco de espín y a las propiedades magnéticas de los núcleos atómicos. Cuando situamos un núcleo en un campo magnético tiene lugar una interacción entre el momento magnético del núcleo y el campo, resultando en un desdoblamiento energético (es el llamado efecto Zeeman). Mediante la absorción y emisión de fotones electromagnéticos con la frecuencia adecuada pueden producirse transiciones entre esos nuevos estados energéticos (Lambert & Mazzola, 1999).
1.6. Bacterias
Las bacterias son microrganismos unicelulares considerados como los más abundantes del planeta, constituyen una proporción significativa por lo que respecta al peso corporal de los diferentes hospederos (desde 0.5 kg hasta unos 2.5 kg) incluido el ser humano (Achtman et al., 2008).
En función de la estructura de su pared célular las bacterias se clasifican en dos grupos. Un grupo que sólo posee peptidoglicano, se le denomina gram positivas; el otro, que ha de más de poseer peptidoglicano presenta una membrana rica en lipopolisacáridos externa al peptidoglicano, se denominan gram negativas (Prats, 2008).
1.6.1. Bacterias Gram Positivas
Staphylococcus aureus
13
Ilustración 4 Staphylococcus aureus
Fuente: Centers for Disease Control and Prevention, 2014.
1.6.2. Bacterias Gram Negativas
Echerichia coli
Existen dos tipos de cepas de estos bacilos, las comensales y las patógenas. Las cepas comensales constituyen parte de la flora fecal en humanos sanos y también en otros mamíferos y aves. Las cepas patógenas intestinales por el contrario se encuentran raramente en la flora fecal de las personas sanas, estos son ingeridos, y en determinadas cantidades causan un cuadro perjudicial (Andreu, 2005). Constituyen un importante grupo de patógenos emergentes para los seres humanos capaces de provocar desde una diarrea no sanguinolenta hasta una colitis hemorrágica (CH), con el síndrome urémico hemolítico (SUH) o la púrpura trombocitopénica trombótica como complicaciones más habituales, principalmente en niños, ancianos y pacientes inmunodeficientes ( Sánchez, et al., 2010).
Ilustración 5Echerichia coli.
Fuente: Centers for Disease Control and Prevention, 2014.
Proteus vulgaris
14
gastroenteritis que en individuos sin esta afección, su papel patogénico en estos casos es incierto, sin embargo, la producción de ureasa por parte de las especies del género Proteus se considera de gran importancia para su patogenicidad y se relaciona con procesos de urolitiasis infectiva o cistitis alcalina incrustante en los que aparecen sedimentos urinarios asociados a la presencia de cálculos de estruvita (Cantón, et al. 2006).
Ilustración 6.Proteus vulgaris
Fuente: Microbiology on Pinterest, 2003.
Salmonella enteritidis
Es un bacilo no esporulado, reconocido como agente causal de brotes de Enfermedades Transmitidas por Alimentos (ETA), especialmente a través de alimentos de origen aviar, aunque no presenta un perfil hospitalario, se puede ostentar por ser originario de diarrea, fiebre y dolor abdominal de manejo ambulatorio (Fica, 2001).
Ilustración 7. Salmonella enteritidis
15 Pseudomona aeruginosa
Es un bacilo no fermentador, conocido como el principal causante de infecciones intrahospitalarias, afectando principalmente a pacientes con alteraciones locales o generales de los mecanismos de defensa frente a las infecciones, de ahí que pueda ser considerado de alguna forma como un patógeno oportunista (Vallés, 2005).
Ilustración 8.Pseudomona aeruginosa.
Fuente: Gschmeissner, 2013.
Klebsiella pneumoniae
Esta especie es la de mayor relevancia clínica dentro del género bacteriano Klebsiella, es un patógeno oportunista colonizador de piel y mucosas de pacientes hospitalizados que pueden presentar infecciones invasoras como bacteriemias o septicemias (Andrade, et al. 2004).
Ilustración 9. Klebsiella pneumoniae
16 Salmonella typhimurium
Pertenece al grupo de los serotipos más importantes de salmonelosis transmitida desde animales a seres humanos en la mayor parte del mundo. Por lo general, esas cepas causan gastroenteritis, que suele ser un trastorno sin complicaciones y no requiere tratamiento, aunque puede ser grave en los niños, los ancianos y los pacientes inmunodeprimidos (OMS, 2013).
Ilustración 10.Salmonella typhimurium
17
CAPITULO II
18
2.1 Esquema de la metodología utilizada.
Ilustración 11. Esquema del desarrollo de la investigación.
Fuente: La autora 2016.
Recolección y selección del material vegetal
Tratamiento del material vegetal
Secado trituración
Maceración
Filtración
Concentración Obtención de extractos totales
Hexano
Acetato de Etilo
Fraccionamiento de extractos
Purificación
Obtención de metabolitos secundarios
Identificación de metabolitos secundarios
RMN
CG-EM
19
2.2. Recolección y selección del material vegetal
Las partes aéreas de Cestrum racemosum, fueron recolectadas en estado de fructificación en el barrio La Libertad, de la Parroquia Fundochamba, Cantón Quilanga, en agosto de 2015 con coordenadas 4°21’10” S, 79°24’23” O. La especie fue caracterizada botánicamente por el Ph.D. Vladimir Morocho del Herbario del Departamento de Química. Una muestra botánica de la misma se encuentra depositada en el HUTPL con voucher númeroPPN-so-010.
Ilustración 12. Muestra botánica deCestrum racemosum.
Fuente: Herbario del Departamento de Química. UTPL 2016.
2.3. Tratamiento del material vegetal y obtención de los extractos.
El material vegetal recolectado fue secado en un secadero de bandejas a una temperatura de 34°C por 3 días. Se pesó 500g de la parte aérea de la planta, los cuales fueron triturados y a partir de esta cantidad de material vegetal, se realizó la extracción mediante la técnica de maceración durante 1 hora en combinación de: 55 minutos maceración estática y 5 minutos maceración dinámica por 3 veces cada disolvente; utilizando primero hexano y luego acetato de etilo.
20
2.4. Extracto Hexánico.
2.4.1. Partición líquido-líquido del extracto Hexánico.
El extracto hexánico, fue sometido a una partición líquido-líquido utilizando diclorometano : metanol-agua (80:20), en razón 1:1 obteniendo de esta manera dos fases: una fase hidroalcohólica compuesta por metanol/agua ( MA096/21) y una fase orgánica compuesta por diclorometano (MA095/21), la misma que fue concentrada, dando como resultado 1,3 g de extracto seco, el mismo que se empleó para el montaje de la columna.
2.4.2. Fraccionamiento en cromatografía de columna.
Se empleó 1,3 g del extracto en diclorometano y se sembró en Sílica Gel fase directa en una relación 1:100, se eluyó con disolventes Hexano y AcOEt en polaridad creciente, iniciando con 95:5 hasta llegar a AcOEt 100%, tomando un volumen de 200 ml por cada fracción, obteniendo 54 fracciones, las cuales se unió de acuerdo a su RF, teniendo un total de 10 fracciones (MA097/22 - MA106/22).
2.4.3. Cromatografía de Capa Fina
Para poder observar la separación de los compuestos que contiene el extracto se emplea la cromatografía de capa fina (CCF); con la ayuda de placas de Sílica Gel fase directa se sembró las 10 fracciones obtenidas anteriormente de la columna cromatográfica, usando la mezcla Hexano/AcOEt en relación (95:5). (Ilustración 13)
Ilustración 13. CCF de la unión de las fracciones del extracto Hexánico
Fuente: La autora 2016
MA 100/24 MA 100/24
Hex/AcOEt (95:5)
21
2.4.4. Purificación de fracción
Mediante cromatografía en columna en relación 1:100 se purifico la fracción MA100/24, para ello se pesó 13 g de Sílica Gel de fase directa y se sembró 124,1 mg de la muestra obtenida, y se empleó una mezcla de Hexano/AcOEt en relación 98:2 con Hex/AcOEt y unas gotas de Ácido acético (1gt/2mL), obteniendo 104 fracciones.
Posterior a lo cual se realizó (CCF) a las fracciones obtenidas y se las unió a las que presentaban igual RF, obteniendo 10 fracciones (MA107/25 – MA116/25) (Ilustración 14) de las cuales de la fracción MA 115/25 presento apariencia de polvo blanco, del cual se realizó RMN: 1H y 13C.
Ilustración 14. CCF de la unión de las fracciones obtenidas a partir de la fracción MA100/24
Fuente: La autora 2016
2.5. Extracto de Acetato de Etilo.
2.5.1. Fraccionamiento en cromatografía de columna.
Se empleó 0,5 g del extracto obtenido y se sembró en 50 g de Sílica Gel fase directa en una relación 1:100 y se eluyó con disolventes Hexano y AcOEt en relación (7:3), se recolectaron las fracciones en tubos de ensayo medianos, obteniendo 479 fracciones, las cuales se las unió según su RF, teniendo un total de 10 fracciones (MA003/4 – MA012/4).
2.5.3. Cromatografía de Capa Fina
Para observar la separación de los compuestos que contiene el extracto se emplea la cromatografía de capa fina (CCF); con la ayuda de placas de Silíca Gel fase directa se
Hex/AcOEt (99:1)
Hex/AcOEt (99:1)
22
sembró las 10 fracciones obtenidas anteriormente de la columna cromatográfica, usando la mezcla Hexano/AcOEt en relación (7:3). (Ilustración 15)
Ilustración 15. CCF de la unión de las fracciones del extracto de acetato de etilo.
Fuente: La autora 2016.
2.5.4. Purificación de fracción
La fracción MA004/4 se presenta como una mezcla relativamente pura, la misma se procede a purificar, para ello se pesó 2.5 g de Sílica Gel fase directa y se sembró 22 mg de la muestra obtenida, y se empleó una mezcla de Hexano/AcOEt en relación (95:5), obteniendo 155 fracciones. Posterior a lo cual se realizó (CCF) a las fracciones obtenidas y se unión de acuerdo a su RF, teniendo 10 fracciones como resultado de la unión (MA062/15 – MA071/15) (Ilustración 16) de las cuales la fracción MA 68/15 presentó características de un compuesto puro lo cual se analizó por CG-EM y RMN:
1H y 13C.
MA004/4 MA004/4
MA005/4 MA005/4
Hex/AcOEt (7:3)
MA068/15 MA004/4
Hex/AcOEt (95:5) Hex/AcOEt (95:5)
23
Ilustración 16. CCF de la unión de las fracciones obtenidas a partir de la fracción MA004/4.
Fuente: La autora 2016.
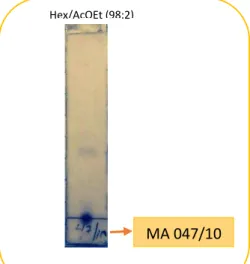
La fracción MA005/4 se presenta como una mezcla relativamente pura, por lo cual para purificar se empleó 5ml diclorometano como eluyente y se dejó precipitar a temperatura ambiente, se obtuvo dos fracciones (MA047/10, MA048/10) con las caracteristeicas que se aprecian en la (Tabla 2). Posterior a lo cual se realizó (CCF) a las 2 fracciones obtenidas, de las cuales la fracción MA 47/10 presentó características de un compuesto puro (Ilustración 17) lo cual se analizó por se realizaron RMN y CG-EM.
Tabla 2. Características de fracciones obtenidas a partir de MA005/4
Fracción Apariencia Peso
MA 047/10 Polvo blanco 48.7 mg
MA 048/10 Polvo amarillo 31.1 mg
Fuente: La autora 2016.
Ilustración 17. CCF de la fracción MA047/10
Fuente: La autora 2016.
2.7. Identificación de los Compuestos obtenidos.
2.7.1. Resonancia Magnética Nuclear
Mediante el equipo Varian N° de serie 21953 se obtuvo los espectros de cada compuesto, bajo condiciones de 400 MHz para 1H y 100 MHz para 13C, utilizando
3.
Hex/AcOEt (98:2)
24
2.7.2. Cromatografía de Gases acoplada a espectroscopia de masas (CG-EM)
Los compuestos aislados de las fracciones (MA068/15 y MA047/10) de la especie Cestrum racemosum se identificaron por medio de cromatografía de gases acoplada a espectroscopia de masas (CG-EM), el equipo utilizado para la realización de estos estudios fueron: cromatógrafo de gases Agilent serie 6890N acoplado a espectrómetro de masas Agilent serie 5973 inert, el cual cuenta con un sistema de datos MSD-Chemstation D.01.00 SP1, y dotado con un inyector automático split/splitles serie 7683. En la (tabla 3) observamos las características que presentan las columnas capilares del equipo.
Tabla 3. Características de las columnas capilares.
Columna Temperatura
(C°) Película (µm) Diámetro interno (mm) Longitud (m)
DB-5MS 350 0.25 0.25 30
Fuente: La autora 2016.
Durante el proceso se tuvo en cuenta parámetros operacionales, bajo las cuales el equipo trabajó, las cuales podemos observar en la (tabla 4).
Tabla 4. Parámetros operacionales del CG-EM de la columna DB-5MS.
COLUMNA
Columna capilar
Temperatura máxima
Modo
Flujo inicial
Presión inicial
Promedio de velocidad
Modelo Agilent 122-5532. DB-5ms, 0.25ms * 30m, * 0.25 µm 350°C Flujo constante. 2.0 mL/min 121.8 kPa 52 cm/sec INYECTOR Modo
Temperatura inicial
Radio de partición
Flujo de partición
Flujo total
Ahorro de gas
Tipo de gas
Split 250 C° 50:1 99.6 mL/min 104.3 mL/min Apagado Helio DETECTOR
Espectrómetro de masas
Temperatura
Tipo de gas
250 C° Nitrógeno
HORNO
Temperatura inicial
Temperatura máxima
60 C° 300 C°
25
2.8. Determinación de la Actividad Antimicrobiana
Micro dilución en caldo, fue la técnica aplicada para la determinación de Concentración Mínima Inhibitoria (CMI).
2.8.1. Microorganismos de prueba
Para la determinación de la actividad antimicrobiana se emplearon 7 microorganismos, de los cuales 1 es gram positiva y 6 gram negativas:
- Gram positivas:Staphylococcus aureus (ATCC 25923)
- Gram negativas: Echerichia coli (ATCC 25922), Proteus vulgaris (ATCC 8427), Salmonella enteritidis, Pseudomona aeruginosa (ATCC 27853),
Klebsiella pneumoniae (ATCC 9997), Salmonella typhimurium (LT 2).
2.8.2. Preparación de muestras
Para lo cual se efectuó una dilución de 10 mg de cada extracto de Hexano y AcOEt en 500µL de Dimetilsulfóxido (DMSO), quedando lista la dilución para CMI antimicrobiana.
2.8.3. Preparación del cultivo overnight
Se utilizó los microorganismos que se encuentran en reserva criogénica a -80°C, La incubación de cada medio y bacteria se detalla a continuación en la (Tabla 5). Una vez preparados y esterilizados los medios, se realizó el inóculo de cada bacteria.
Tabla 5. Condiciones de Incubación de medios de cultivo y sus bacterias.
Microorganismos Medios de Cultivo Condiciones de
Incubación
Klebsiella pneumoniae Caldo Tripticasa Soya 37°C por 14-16 h
Pseudomona aeruginosa Caldo Tripticasa Soya 37°C por 14-16 h Salmonella typhimurium Caldo Nutritivo Oxoid 37°C por 14-16 h Echerichia coli Caldo Tripticasa Soya 37°C por 14-16 h Proteus vulgaris Caldo Muller Hinton 37°C por 14-16 h Salmonella enteritidis Caldo Nutritivo Oxoid 37°C por 14-16 h Staphylococcus aureus Caldo Tripticasa Soya 37°C por 14-16 h
Fuente: La autora 2016.
2.8.4. Preparación de la suspensión del inóculo para bacterias.
26
2.8.5. Concentración mínima inhibitoria (CMI) antibacteriana
En este ensayo se utilizaron placas estériles de 96 pocillos. Se colocó 180 µL de caldo Muller Hinton en la primera fila de pocillos, excepto en la columna 10; y 100 µL a los pocillos restantes, luego se añade 20 µL del extracto diluido (200mg/mL), disuelto en 500 µl de DMSO en estudio, en pocillos de la fila A y se mezcló.
Se realizó diluciones seriadas tomando 100 µL de los pocillos de la fila A, para diluirlos en los pocillos de la fila B, hasta llegar a los pocillos de la fila H y se desechó los 100 µL sobrantes, seguidamente se efectuó las mismas diluciones en los pocillos de control de esterilidad (columna 10) /200 µL de caldo + 20 µL de extracto diluido) control negativo (columna 11) 180 µL de caldo + 20 µL de DMSO y control positivo (columna 12) 180 µL de caldo + 20 µL de Gentamicina para Klebsiella pneumonae,
Pseudomona aeruginosa, Echerichia coli, Proteis vulgaris, Staphylococcus aureus; y 20 µL de Ampicilina para Salmonella tiphymurium y Salmonella enteritidis a 1000ppm.
Ya preparadas las placas se inoculó con 100 µL de suspensión del inóculo, a excepción de los controles de esterilidad, completando los 200 µL de volumen final, ajustando así la población bacteriana a 5x105 UFC/mL, y la concentración final del
extracto de 2000 a 15625 µg/mL. Finalmente se sellaron las placas y se incubaron a 37°C durante 18 a 24 horas.
-27
CAPITULO III
28
3.1. Extractos obtenidos de la especie Cestrum racemosum
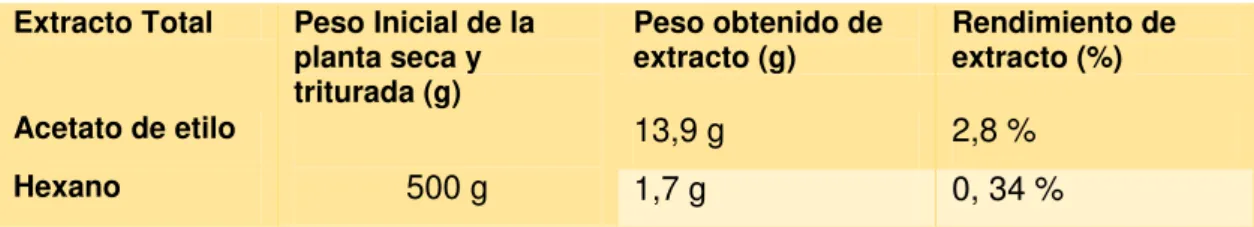
En la tabla 6 se muestra el peso y el rendimiento del extracto de Acetato de etilo y Hexano, a partir de 500 g de la muestra vegetal seca.
Tabla 6. Peso y rendimiento de extractos obtenidos a partir de Cestrum racemosum. Extracto Total Peso Inicial de la
planta seca y triturada (g)
Peso obtenido de extracto (g)
Rendimiento de extracto (%)
Acetato de etilo
500 g
13,9 g 2,8 %
Hexano 1,7 g 0, 34 %
Fuente: La autora 2016.
3.2. Fraccionamiento del extracto de Hexano de la especie Cestrum racemosum
3.2.1. Fracción MA115/25
Una vez analizados los espectros de RMN: 1H (Anexo 1) y 13C (Anexo 2), se comparó
con los datos reportados en (Echevarría, et al., 2014) (Tabla 7) y se determinó que se trata de un glicérido que se forma por la esterificación de los tres grupos OH por los ácidos grasos DHA: docosahexaenoato; EPA: eicosapentaenoato; LA: ácido linoleico concediéndole el nombre de «triglicérido». (Ilustración 18)
Tabla 7. Comparación de 13C RMN de la fracción MA115/25 (Triglicérido)
MA 115/15 Echevarría,
et al. 2014
0,88 0,88 A (t)
0,97 0,89 B (t)
1,25 1,19 C (ga)(LA)
1,61 1,61 D1(ga)
1,68 1,69 D2(ga) (EPA)
2,05 2,15 E(m)
2,31 2,26 F1(dt)(DHA)
2,77 2,77 G (t)
4,14 4,22 O (dd) (grupo glicerilo)
4,29 4,28 O (dd)
5,35 5,27 S (grupo glicerilo)
5,35 5,28 T (ga)
Abreviaturas: t: triplete; m: multiplete; DHA:
docosahexaenoato; EPA: eicosapentaenoato; LA: ácido linoleico; d: doblete: dd doble doblete
29
Ilustración 18. Estructura molecular del triglicérido
Fuente: La autora 2016.
Los triglicéridos son la principal forma de almacenamiento de energía en las células, este lípido formado por una molécula de glicerol esterificado con tres ácidos grasos poliinsaturados de cadena larga omega-3: DHA: docosahexaenoato; EPA: eicosapentaenoato; LA: ácido linoleico. El LA, el EPA y el DHA son importantes componentes estructurales de los fosfolípidos de las membranas y son el sustrato para la formación de una serie de derivados lipídicos, los cuales ejercen importantes acciones en el metabolismo celular (Serhan & Chiang, 2008). La evidencia clínica y
epidemiológica de múltiples estudios permite establecer que el consumo de EPA y el DHA, es eficaz en el tratamiento y prevención de variadas enfermedades, tales como cardiovasculares, neurodegenerativas, cáncer, enfermedad inflamatoria intestinal, artritis reumatoidea e injuria por isquemia/reperfusión (Valenzuela et al., 2011). Estos ácidos grasos participarían directamente en la modulación de la respuesta inmune, disminuyendo la inflamación y el daño anatomo - funcional generado por esta, demostrándose el efecto antiinflamatorio y citoprotector. Estudios en ratones y en cultivos de células han demostrado que las dietas que contienen EPA y DHA retrasan tanto el crecimiento, la metástasis de los tumores primarios y los implantes de carcinoma humano en células mamarias (Cavazos et al., 2011).
3.3. Fraccionamiento del extracto de Acetato de Etilo de la especie Cestrum racemosum
3.3.1. Fracción MA068/15
Una vez analizados los espectros de RMN: 1H (Anexo 3) y 13C (Anexo 4), se comparó
30
Tabla 8. Comparación de 13C RMN de la fracción MA068/15 (α-amirina)
MA 68/15
Pérez. (2014)
1H
5,14 5,13 1H, dd, J= 3.6, 3.3 Hz, H-12
3,23 3,23 1H, dd, J= 10.5, 5.4 Hz, H-3
1,07 1,07 3H, s, H-27
1,01 1,01 3H, s, H-26
1,00 1,00 3H, s, H-23
0,96 0,96 3H, s, H-25
0,91 0,92 3H, d, J=7.5 HZ, H-30
0,80 0,80 3H, s, H-28
0,79 0,79 3H, d, J=6.0 HZ, H-29
0,78 0,79 3H, s, H-24
13C
139,74 139,60 C-13
124,58 124,40 C-12
79,22 79,00 C-3
59,21 59,00 C-18
55,33 55,10 C-5
47,87 47,70 C-9
42,23 42,00 C-14
41,68 41,50 C-22
39,82 39,60 C-19, C-20
38,93 38,10 C-1, C-4, C-8
37,05 36,90 C-10
33,91 33,70 C-17
33,09 32,90 C-7
31,41 31,20 C-21
29,85 29,70 C-16
28,90 28,70 C-28
28,25 28,10 C-23
27,43 27,20 C-2
26,77 26,60 C-15
23,42 23,30 C-11, C-27
21,55 21,40 C-30
18,51 18,40 C-6
17,62 17,50 C-29
17,01 16,80 C-26
15,77 15,60 C-24, C-25
31
Ilustración 19-Estructura molecular de α-amirina
Fuente: La autora 2016.
Sin embargo por análisis CG-EM se pudo identificar una mezcla de 2 terpenos: (1) α -amirina siendo este el compuesto mayoritario y (2) β-amirina en menor proporción siendo imperceptible por RMN y detectable solamente por CG-EM (Anexo 5). Presentando un 98% de coincidencia con la base de datos del equipo.
Ilustración 20.Estructuras moleculares de la mezcla terpénica: (1) de α-amirina y (2) β-amirina
Fuente: La autora 2016.
Estos compuestos fueron confirmados mediante la comparación de su espectro con la literatura (Oliveira, et al., 2011). Y su índice de retención que fue calculado en base a su tiempo de retención y comparado con la base de datos del equipo (Willey 7n.1).
32
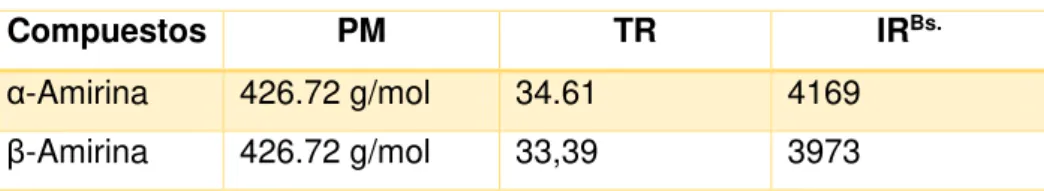
Tabla 9. Mezcla de terpenos Identificados en la fracción MA068/15
Compuestos PM TR IRBs.
α-Amirina 426.72 g/mol 34.61 4169
β-Amirina 426.72 g/mol 33,39 3973
PM: Peso molecular. TR: Tiempo de retención. IRBs. : Indice de retención de la base de datos.
Fuente: La autora 2016.
Ilustración 21. Espectro de CG-EM de α-Amirina.
Fuente: La autora 2016.
Ilustración 22. Espectro de CG-EM de β-Amirina.
Fuente: La autora 2016.
33
células escamosas (SCC-158) (Zilberstein et al., 2009), y exhiben anticoncepción dependiente de la dosis (Otuki et al. 2004).
3.3.2. Fracción MA047/10
El análisis del espectro de 1H RMN (Anexo 6) presentó señales características de un
ácido graso, mientras que por (GC-MS) se identificó que se trata del ácido esteárico (Ilustración 26) presentó un 87% de coincidencia, comparado con la base de datos del equipo (Willey 7n.1), mediante la comparación de su índice de retención siendo calculado en base a su tiempo de retención.
Ilustración 23. Estructura molecular del Ácido Esteárico
Fuente: La autora 2016.
Tabla 10.Ácido graso identificado en la fracción MA 47/10
Compuestos PM TR IRBs.
Ácido
esteárico u octadecanoico
284,47 g/mol 4,75 989,05
PM: Peso molecular. TR: Tiempo de retención. IRBs. : Indice de retención de la base de datos.
Fuente: La autora 2016.
Ilustración 24. Espectro de CG-EM del Ácido Esteárico
34
El ácido esteárico es un ácido graso saturado de cadena larga, las principales fuentes son, la carne, el pescado, los cereales, los lácteos, las grasas y los aceites. Se cree que tiene implicaciones muy bajas en el perfil lipídico a diferencia de los demás ácidos grasos saturados, casi no necesita de hidrogenación y por lo tanto no se producen ácidos grasos trans (Costa, 2004) lo cual beneficia la aplicación de biotecnología a los alimentos para la salud y alimentación humana (Santos et al., 2012). A nivel industrial presenta una alta demanda en el campo industrial, cosmético y farmacológico debido a sus propiedades emolientes y protectoras, que impide la desecación de la capa córnea de la piel, y que se absorbe fácilmente a través de ésta. Se utiliza como emulgente para la formación de cremas base, se emplea análogamente a la cera blanca para pomadas y ceratos, también se utiliza como lubrificante en la fabricación de comprimidos y cápsulas, y como recubrimiento entérico para píldoras y comprimidos gastrorresistentes y finalmente tiene aplicación como agente endurecedor en supositorios (Raymond et al. 2009).
3.4. Determinación de actividad antibacteriana
35 Tabla 11. Tabla actividad antibacteriana
Microorganismos Extractos totales Resultados
Positivo Negativo
Klebsiella pneumoniae Hexano Acetato de etilo X X
Pseudomona aeruginosa Hexano Acetato de etilo X X
Salmonella Typhimurium Hexano Acetato de etilo X X
Echerichia coli Hexano Acetato de etilo X X
Proteus vulgaris Hexano Acetato de etilo X X
Salmonella enteritidis Hexano Acetato de etilo X X
Staphylococcus aureus Hexano Acetato de etilo X X
36
CONCLUSIONES
El rendimiento de los extractos totales fueron: Acetato de etilo 2,8%, y Hexano 0,34%.
Del extracto de Acetato de Etilo se identificaron 3 compuestos, por medio de técnicas espectroscópicas α- Amirina, β- Amirina y Ácido Esteárico. Del extracto Hexánico un triglicérido.
37
RECOMENDACIONES
Continuar con el estudio de la especie Cestrum racemosum, enfocándose en el estudio y aislamiento de alcaloides, ya que esta planta pertenece a la familia Solanaceae, las misma que se caracterizan por presentarlos.
Realizar trabajos de investigación similares a otras especies del género Cestrum, el cual es rico en saponinas las cuales han mostrado una fuerte
38
BIBLIOGRAFÍA
- Achtman M, Wagner M. 2008. Microbial diversity and the genetic nature of microbial species. Nature Rev. Microbiol.
- Adams, R. 2009. Identification of Essential Oil Components by Gas Chromatography/Mass Spectometry. Estados Unidos. Allured Books.
- Akerele Olayiwola. 1984. WHO´s Traditional Medicine Programme: progress and perspectives. WHO Choronide, 38(2):76-81.
- Almeida, F. Torres, J. Rodrigues, B. Sousa, T. André, A. Anne, G. Chaves, M. Satyanarayana, V. 2012. Antihyperglycemic and hypolipidemic effects of α, β-amyrin, a triterpenoid mixture fromProtium heptaphyllumin mice.
- Andrade, V. Grupo de Resistencia Bacteriana, Silva, J. 2004. Characterization of SHV-5 β-lactamase-producing Klebsiella pneumoniae in an Intensive Care Unit. Salud Pública Mex
- Andreu, A. 2005. Pathogenesis of urinary tract infections. Enfermedades Infecciosas y Microbiología Clínica.
- Ann, M. Whitesell, J. 2000. Química Orgánica. México. Person Editorial.
- Bourdy, G., Chavez De Michel, L.R., Roca-Coulthard, A., 2004. Pharmacopoeia in a shamanistic Society: the Izoce˜no-Guaraní (Bolivian Chaco). Journal of Ethnopharmacology 91, 189–208.
- Bruneton, J. 2001. Farmacognosia, Fitoquímica, Plantas Medicinales. Segunda Edición. Acribia. Zaragoza.
- Brushi, M. L., S. L. Franco y M. P. 2003. Gremiao, Application of an HPLC method for analysis of propolis extract. Liquid Chromat. Related Tecnol., 26(14), 2399-2409
- Cantón, R. Paz, M. Morisini, M. 2006. Proteus penneri. Enfermedades Infecciosas y Microbiología Clínica.
- Cavazos, D. Price, R. Apte, S. Degraffenried, L. 2011. Docosahexaenoic acid selectively induces human prostate cancer cell sensitivity to oxidative stress through modulation of NF-kB. Prostate.
- CDC. 2014. Staphylococcus aureus. Echerichia coli. Klebsiella pneumoniae Salmonella typhimurium. Centers for Disease Control and Prevention
- Chízmar, C. 2009. Plantas comestibles de Centroamérica 1ª ed. -- Santo Domingo de Heredia, Costa Rica: Instituto Nacional de Biodiversidad, INBio,
39
- Costa, N. 2004. Biotecnologia aplicada ao valor nutricional dos alimentos. BC & D; 32: 47-54
- D´Arcy, W. G., 1991. The Solanaceae since 1976, with a review of its biogeography. In: J. G. Hawkes, R. N. Lester, M. Nee y N. Estrada (eds.). Solanaceae III: Taxonomy, Chemistry and Evolution. Great Britain: Royal Botanical Gardens, Kew, 75-137.
- D´Arcy, W. 2001. Solanaceae. In: Stevens, W.D.; Ulloa Ulloa, C.; Pool, A.; Montiel, O.M. (eds.). Flora de Nicaragua. Vol. III. Monogr. Syst. Bot. Missouri Bot. Gard. 85: 2376–2426.
- De la Torre, L. Navarrete, H. Muriel, P. Macía, J. & Balslev, H. 2008. Enciclopedia de las Plantas Útiles del Ecuador. Herbario QCA & Herbario AAU. Quito & Aarhus.
- Del Castillos, S., González, J., Prieto, S., Uquiola, A. 2004. Identificación fitoquímica de las hojas y ramas de las Helietta cubensis Monch-Modenke, especie endémica de Cuba. Revista Cubana de Farmacia.
- Echevarría, B. Goicoechea, E. Manzanos, M. Guillén, M. 2014. A method based on 1H NMR spectral data useful to evaluate the hydrolysis level in
complex lipid mixtures. Food Research International.
- Fica, A. 2001. Cambios epidemiológicos de las salmonelosis en Chile: Desde Salmonella typhi a Salmonella enteritidis. Revista Chilena de Infectología.
- Fouad, M. Mohamed, K. Kamel, M. Matsunami, K. Otsuka, H. 2008. Cesdiurins I–III, steroidal saponins from Cestrum diurnum L. NatureMedicine (Tokyo) 62, 168–173.
- Francesc, M. 2004. Infección por Staphylococcus aureus resistente a la meticilina. Ventana a otras especialidades.
- García, A. Pérez, E. 2009. Metabolismo secundario de plantas. Departamento de Biología Vegetal I (Fisiología Vegetal). Facultad de Biología. Universidad Complutense. Madrid.
- Germonprez, N. Maes, L. Van Puyvelde, L. Van Tri, M. Tuan, D. De Kimpe, N. 2005. In vitro and in vivo anti-leishmanial activity of triterpenoid saponins isolated from Maesa balansae and some chemical derivatives. Journal of Medicinal Chemistry 48, 32–37.
- Gil, M. 2000. Microbiology and Molecular fetures of methicillin resistant Staphylococcus aureus. Rev, Chi. Scielo.
40
2003. A fuctional genomics aprooach toward the understanding of secondary metabolism in plant cells.
- Gschmeissner, S. 2013. Pseudomonas Aeruginosa Bacteria. Fineartamerica. - Guamán, A. 2010. Aislamiento de alcaloides de 5 especies alicinógenas de la
familia Lycopodiaceae usadas en medicina ancestras por los Rikuyhapiyachak (visionarios) de la Etnia Saraguro-Ecuador. Tesis de Grado.
- Gutiérrez, M. Droguei, M. 2002. La cromatografía de gases y la espectrometría de masas: identificación de compuestos causantes de mal olor.
- Holanda, S. Pinto, L. Cunha, G. Chaves, M. Santos, F. Rao, V. 2008. Anti-inflammatory effect of alpha, beta-Amyrin, a pentacyclic triterpene from Protium heptaphyllum in rat model of acute periodontitis.
- Khan, M. Inayat, H. Saeed, M. Khan, I. Inayat-Ur-Rahman. 2011. Antimicrobial activities of the whole plan of Cestrum nocturnum against pathogenic microorganisms. Afr. J. Microbiol. Res. 5: 612-616
- Kinghorn, D. 2001. Pharmacognosy in the 21st century. Journal of Pharmacy and Pharmacology.
- Kunkel, D. 2008. Salmonella enteritidis. Scientific stock photography library of light microscope pictures and electron microscopy images featuring science and biomedical microscopy potos.
- Lambert, J., Mazzola, E. 1999. Nuclear Magnetic Resonance Spectroscopy: An introduction to Principles, Applications, and Experimental Methods; Pearson Prentice Hall, New Jersey
- León, L. Cueva, P. Aguirre, Z. Kvist L. 2006. Floristic composition, structure, endemic and ethnobotany in the native forest “El Colorado”, in Puyango, Province of Loja.
- MacVean. L. 2007. Ficha de Cestrum racemosum. Universidad Francisco Marroquín. Guatemala.
- Martínez, P. Muñoz, J. Gutiérrez, A. Arriola, P. Montero, E. Ezpeleta, C. Cisterna, R. De la Villa, F. 2007. Análisis de 182 episodios de bacteriemia por enterococo: estudio de la epidemiología, microbiología y evolución clínica. Enfermedades Infecciosas y Microbiología Clinica.
- McMurry, J. 2012. Química orgánica. Cengage Learning Editores. - Méndez, A. 2011. La Guía de Química. Cromatografia en columna. - Microbiology on Pinterest. 2003. Proteus Vulgaris.
41
- Morin, J.; Bastide, P. 1983. Aromatherapy. Pharmacie Hospitaliere Francaise, 63: 23-28.
- Oliveira, F. Chaves, M. Almeida, F. Lima, R. Silva, R. Maia, J. Brito, G. Santos, F. Rao, V. 2005. Protective effect of alpha- and beta-amyrin, a triterpene mixture from Protium heptaphyllum (Aubl.) March. trunk wood resin, against acetaminophen-induced liver injury in mice. Ethnopharmacol. Ceará, Brazil.
- Oliveira, M. Hamerski, L. Pinto, A. 2011. Semi-preparative separation ofαandβ-amyrin by high performance liquid chromatographic. Química. Nova vol.34 no.4 São Paulo
- OMS. 2013. Salmonella (no tifoidea)
- OMS, UICN & WWF. 1993. Directrices sobre Conservación de Plantas Medicinales. UICN, Gland.
- Otuki, M. Ferreira, J. Lima, F. Meyre, C. Malheiros, L. Cani, G. Santos, A. Yunes, R. Calixto, J. 2004. Antinociceptive Properties of Mixture of α-Amyrin and β-Amyrin Triterpenes: Evidence for Participation of Protein Kinase C and Protein Kinase A Pathways
- Prats, G. 2008. Microbiología Clínica. Madrid-España. Editorial Panamericana. - Pérez, A. 2014. Triterpenes and other Metabolites from Tibouchina urvilleana.
Sociedad Química de México. Coyoacán- D.F., México. 58(2), 218-222.
- Pérez, R. 2000. Estudio de validación de la Metodología para la determinación de Vitamina A en Alimentos infantiles instantáneos por Cromatografía Líquida de alto rendimiento (HPLC). Rev. Perú. Med. Exp. Salud Pública.
- Quezada, A. 2008. Las plantas medicinales. Ambiente y Salud. Revista Biocenosis
- Raddick, J. 1986. Steroidal Alkaloids of the Solanaceae, In: William G. D’Arcy (ed.) Solanaceae: Biology and Systematics, New York, Columbia University Press.
- Raymond, C. Sheskey, P. Quinn, M. 2009. Handbook of Pharmaceutical Excipients. Sixth edition. Pharmaceutical Press.
- Rojas, R. Bustamante, B. Bauer, J. Fernández, I. Albán, J. Lock, O. 2003. Antimicrobial activity of selected Peruvianmedicinal plants. Journal of Ethnopharmacology 88, 199–204.
- Sánchez, S. Martínez, R. Alonso, J. Rey, J. 2010. Clinical and pathogenic aspects of infections due to Escherichia coli O157:H7 and other verocytotoxigenic E. coli. Enfermedades Infecciosas y Microbiología Clínica.
42
- Serhan, C. Chiang, N. 2008. Endogenous pro-resolving and anti-inflammatory lipid mediators: a new pharmacologic genus. Br J Pharmacol. 153 Suppl 1:S200-15.
- Sharapin, N. 2000. Fundamentos de tecnología de productos fitoterapéuticos (vol 78).
- Spangenberg, B. Poole, C. Weins, C. 2011. Quantitative Thin-Layer Chromatography. Springer.
- Valadeau C., Pabon A. Deharo E., Alban J., Estevez Y., Lores A., Rojas R., Gamboa D., Sauvain M., Castillo D. 2009. Medicinal plants from the Yanesha (Peru): evaluation of the leishmanicidal and antimalarial activity of selected extracts Journal of ethnopharmacology .Database:.
- Vacárcel, M. Cárdenas, S. 2000. Automatización y Miniaturización en Química Analítica. Barcelona-España: Springer-Verlag Ibérica Editorial.
- Valadeau, V. Pabon, A. Deharo, E. Albán, J. Estevez, Y. Lores, A. Rojas, R. Gamboa. D. Sauvain, M. Castillo, D. Bourdy, G. 2009. Medicinal plants from the Yanesha (Peru): Evaluation of the leishmanicidal and antimalarial activity of selected extracts. Journal of Ethnopharmacology.
- Valenzuela, R. Tapia, G. González, M. 2011. Omega-3 fatty acids (epa and dha) and itsapplication in diverse clinical situations. Rev. chil. nutr. vol.38 no.3
- Vallés, J. Mariscal, D. 2005. Pneumonia due toPseudomona aeruginosa Enfermedades Infecciosas y Microbiología Clínica.
- Vanaclocha, B. & Cañigueral, S. 2003. Fitoterapia: vademecum de prescripción. Ed. Masson, Edició 4ª. Barcelona.
43