. .
- '/Nombre : RnIDo SANCHEZ MONICA ALEJANDRA Matrinili : 93329665
JLicencLtun: INGENfERlA DE LOS ALIMENTOS
UNIDAD IZTAPALAPA
/DIVISION CIENCIAS BIOuxilCAS Y DE LA SALUD.
Fecha i n i i .
,/Fecha de brainieióa :
Claw :
Nombre h y e c t o :
6.73.32.52 97-0
20 Horas
.
2 DE OCTUBREDE 1997. 2 DE ABFULDE 1998
1
IA056.97INTRODUCCION; ADAFl'AClON Y DESARROLLO DE LA "ECNOLWIA DEL CULTIVO DE LA
TA DE AGUA DULCE (Cherm quadncMn0fusl
Firma aiumno:- Pulid
i
cUib*<pdmpO
UNIVERSIDAD AUTÓNOMA METROPOLITANA
DiviSdN DE CIENCIAS BIOLÓGICAS
Y
DELA
SALUD Departamento de BiotecnologíaArea de Microbiologia
3 de Noviembre da 1998.
DR. JOSE
LUIS
ARREDONDO FIGUEROADIRECTOR, DIVISION CIENCIAS BIOLOGICAS
Y
DELA
SALUDP R E S E N T E
Por
medio de la presente, le comunicamos que la alumna Mónicn Alejandra Pulido Sánehez,matricula 93329665 de la carrera de Jngeniena de los Alimentos, desarrollo y concluyó satisfactoriamente el proyecto y reporte find del trabajo titulado: “CARACXERIZACION DE PEPTIDOS OBTENIDOS A PARTIR DE LA RECUPERACION DE PROTEMA DE SUBPRODUfXOS DE U INDUSTRU PESQUERA, MEDIANTE LA HIDRÓLISIS ENZIMATICA CON ALCALASA”. Dicho proyecto se realizó
en la planta piloto 4 del departamento de Biotecnología, bajo nuestra dirección y supervisión.
Así mismo, hacemos de su conocimiento que el retraso en la entrega del reporte h a l se debió a la necesidad de la repetición de ensayos durante el desarrollo del proyecto.
Sin otro particular, aprovechamos la ocasión para reiterar a usted nuestra más atenta consideración.
~
A T E N T A M E N T E ‘Tasa abierta al tiempo”
Dra. Li
Y
ia Arely Prado BarragánProfesor Titular Profesor Titular
UN I DAD IZTAPALAPA
UNIVERSIDAD AUTONOMA METROPOLITANA
DIVISION DE CIENCIAS BIOLOGICAS Y DE LA SALUD SERVICIO SOCIAL
8 '
A
QUIEN , , CORRESPONDA:I Por medio de la presente se hace constar que el (la):
DR. SERGIO HUERTA OCHOA del Departamento de BlOTECNOLOGíA
de la División de Ciencias Biológicas y de la Salud, asesoró el siguiente Servicio Social:
TITULO Caracterización de péptidos obtenidos a partir de la
recuperación de proteína de subproductos de la industria pesquera, mediante la hidrólisis enzimática con alcalase@
ALUMNO Pulido Sánchez Mónica Alejandra
MATR~CULA 93329665
LICENCIATURA Ingeniería de los Alimentos
PERIODO
Se extiende la presente para los fines que al interesado convengan, en la Ciudad de MBxico, D.F. a veinticinco de Noviembre de mil novecientos noventa y ocho.
A T E N T A M E N T E 'Cara Abierta al Tiempo"
Octubre 2, 1997 a Noviembre 3, 1998.
I
. , , .
P
s-
‘31.
N I C E
Pig.
INTRODUCCI~N ... I
*
CONCEPTOS GENERALES ... 1
&TODOS
DE OBTENCI~N DE HIDROLIZADOS DE PESCADO ... EL PROCESO DE HIDR~LISISY
su
CONTROL ... ... 8CARACTER~STICAS GENERALES DE LAS ENZIMAS ...
...
9PROTEAS AS.. ...
...
.... 11CII&TICA DE LAS REACCIONES CATALEADAS POR ENZIMAS ... 13
FUNDAMENTO DE UNA HIDR~LISIS ENZIMÁTICA 16 SELECCI~N DE LA ENZIMA A UTILIZAR ... 19
ELECTROFORÉSIS EN GEL DE UNA D~MENSI~N ... OBJETIVOS.. ... .<.. ... ... ... ... 23
MET
OD
O LOGí~
... ... 24ANÁLISIS BROMATOLÓGICO ... ... 24
PREPARACI~N DE SUSTRATOS ... ... ... 24
PREPARACI~N DE LA SOLUCI~N DE ENZIMA 24 ~ ... i
TRABAJOS PREVIOS
REALIZADOS
EN HEMOGLOBINA ... 24DETERMINACIÓN
DE L A CIh.ÉTiCA EKZIMÁTICA DE .ALCALASE @ UTiLIZANDO COMOSUSTRATO
DESECHO DE PESCADO ... MÉTODO ELECTROFORÉTICO ... 28OBJETIVOS Y METAS ALCANZADOS ... ... 30
... 31
RESULTADOS Y DISCUSIONES.. ... 31 ANÁLISIS BROMATOL~GICO ... CARACTERIZACI~N DE LA ENZIMA ALCALASE @ UTILIZANDO~~MO SUSTRATO ALTERNO
HEMOGLOBINA.,
... CARACTERIZACIÓN DE LA ENZIMA ALCALASE @UTILIZANDO
COMO ... 32 38 SUSTRATO DESECHO DE PESCADO ...MUESTRAS
DEHIDR~LISIS
EN
EL:GEL SDS-PAGE ... 5051
usos
ALTERNATIVOS DE LOSHIDROLIZADOS
DE PROTEÍNA DE PESCADO ... ... CONCLUSIONES ... ... 52RECOMENDACIONES.. ... 53
BIBLH)GRAF~. ... ... 54
INTRODUCCION
CONCEPTOS G~NERALES
PROTEiNAS
DE
ORIGENANIMAL
Los
productos de origen animal (came, pollo, pescado, lácteos y huevos),han
incrementadoen la dieta de los seres humanos desde un 5 0 9 ? en 1910 hasta UII 66%
en
1970, y elporcentaje se
ha
estabilizado en ese nivel (Altschul, 1981).
La proteína de origen animal es única como
una
fuente nutricional de proteína para el serhumano
E
l
consumo de proteína animal varía de menos de 10 g/cap/díaen
algunos paísesno industrialidos hasta más de 60 g en países indumialízados. Se vuelve entonces
indispensable asegurar para toda la población
la
alimentación adeeurdq por lo que se tieneque incrementar tiempo,
esfuerzo
y mejorar la tecnoiogk (Aitschut, 1981).Sin
embargo, en un estudio mundial sobre la alimentación y n u ~ c i ó n (NRC,1977) seha
observado que alrededor de 450 millones de
persona,
no reciben la alimentación suficiente.En algunas sociedades,
el
4O?h de los niños mueren antes dellegar
a los 5 añosprincipalmente
por
causas de mal nutriciónIMPACTO MJTRICIONAL DEL CONSUMO DE PROTEINA
El ser humano
posee
en su tracto gastrointestinal, enzimas proteolíticas (entre otras) quehidrolizan a las proteínas en sus constituyentes “aminoácidos”. Estos aminoácidos son
absorbidos por las células de la mucosa intestinal a través de un mecanismo selectivo.
En trabajos realizados por
Nasset
(1962), se demostró que antes de que las proteínas pudieran ser absorbidas por el tracto gastrointestinal, este debía secretar no solamenteenzimas digestivas, sino también mucoproteínas y mezclas de aminoácidos que constituyen una “matriz molecular” a través de la cual las proteínas provenientes de la dieta pueden ser absorbidas
Así,
las proteínas endógenas aparentemente regulan la concentración deaminoácidos disponibles para la absorción de las proteínas ingeridas. Mediante este mecanismo el ser humano se provee de las cantidades y concentraciones óptimas de aininoácidos para la &tesis de otias proteínas biológicas, sin embxgo, se ve modificado por el estado de salud 5 el estado nutricional del organismo
Urn mgestión de mezclas incompletas de proteína de bajo valor biológico, trae como consecuencia una mala absorción de las mismas por el tracto gastrointestinal (Harper,1974) El consumo de “cantidades adecuadas de proteína animal” es una ventaja
nutncional ya que se pueden sintetizar
hormonas
y &mas. Después de que los aminoácidos son canalizados al hígado, comienzauna
síntesis de un gran complejo de proteínas y lipoproteínas,las
d e sson
utilizadas por el organismo para la formacibn decéluias nuevas
y para reemplazarlas
células viejas’
VALOR
3IOLÓGICODE
LAS
PROTEINASd
.
Para poder apreciar
la
contribución de la proteína animal en la nutrición, debemosconsiderar el
concepto
de valorbiológica
delas
pmiehs.E
l
valor biológico deuna
proteína se expresa como el porcentaje de nitrógeno absorbidoretenido por el organismo para el mantenimiento de los tejidos y la integridad de
los
órganos
El valor biológico
es
funciónde
la composición de aminoicidos (Gutbrie, 1979). Mientras más aminokidos esenciales pmea un alimento, mayor será su valor biológico (Albanesc yOrto, 1973) En la tabla I se representa el valor biológico de fuentes de proteína animal Así, el consumo de protei^ animal, combmadas adecuadamente con otros nutrienies (proteínas de ongen vegetal) provee de los aminoácidos d o s para O p t ¡ las condiciones fisiológicas y metabólicas (Finot, 1973)
TABLA
I.Valor
biológico de proteínas representativas.‘
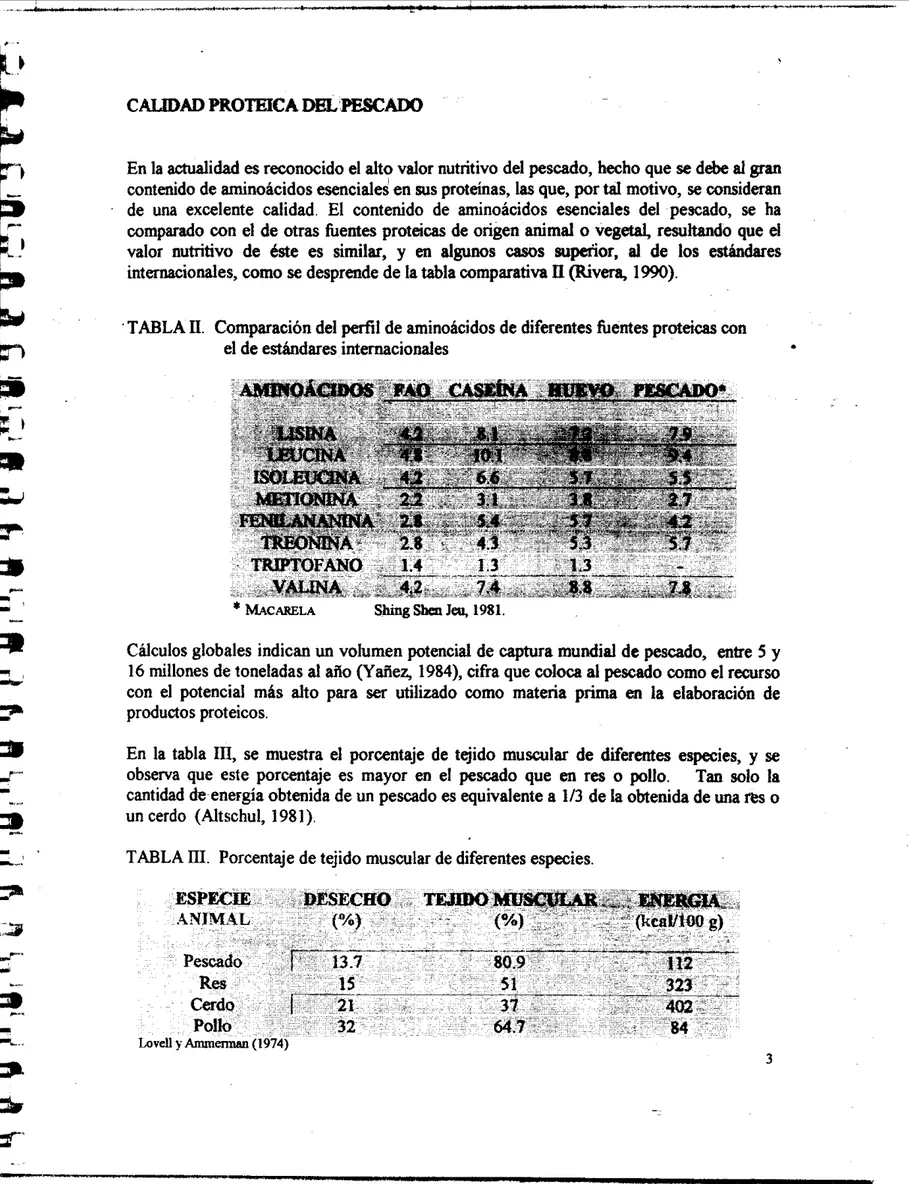
CALDDAD PROTEICA DEL PEsCADo
En la d i d a d
es
reconocido el alto vaior nutritivo del pescado, hecho que se debe al gran contenido de aminoácidos esenciales en sus proteínas, las que,por
tal motivo, se consideran deuna
excelente calidad El contenido de aminoácidos esenciales del pescado, se hacomparado con el de otras fuentes proteicas de origen animal o vegetal, resultando que el valor nutritivo de &e
es
similar, y en algunos casos supefior, ai de los estándares internacionales, como se desprende de la tabla comparativail
(Rivera, 1990)' TABLA
ii.
Comparación del perfil de aminoácidos de diferentes fuentes proteicas conel de estándares internacionales
.
*
MACARELA Shing Sbm Jey 1981Cálculos globales indican
un
volumen potencial de captura mundial de pescado, entre 5 y16 millones de toneladas al año (Yañez, 1984), cifra que coloca al
pescado
como elrecurso
con el potencial más alto para ser utilizado como materia prima en la elaboración de productos proteicos.En la tabla III, se muestra el porcentaje de tejido muscular de diferentes especies, y se observa que este porcentaje es mayor en el pescado que en
res
o pollo. Tan solo la cantidadde
energía obtenida de un pescado es equivalente a 113 de la obtenida de unares
o un cerdo (Altschul, 1981)TABLA iii. Porcentaje de tejido muscular de diferentes especies.
ESPECIE DESECEO
TEdIDo
MUSCULAR.-,.;
.4
NI
M .4 L("A)
("/I
(keaü100 g). ....
Pescado
f"'
13.7
-- 80.9 I12Cerdo
I
- 7 1 31 402._
. . . 51 - 323
ReS 15
Pollo 32 64.7 84
. . . .. ..
lavcllyAmmrrmao(1974)
La
cantidad de proteha contenida en el pescado varíade
d oa
las divasas especies, como se desprende de la composición bromatológica que se presenta aila
tablaN.
TABLA
N
Análisis bromatológico de algunas especies de pescado.
De una pesca mundial anual de 71 millones de toneladas, 20 millones son capturados
específicamente para su conversión en harina de pescado y el resto, posiblemente mfmos del SO??, es actualmente usado en fiesm para la alimentación humana. Muchas especies de pescado usadas para la manufactura de harina, están limitadas al
uso en
la formulación de alimentos para animales, ya que la harina no posee lascaracterísticas
funcionales y organolépticas necesarias para ser incorporada en la alimentación humana, o enla
manufactura de otro tipo de productos enlos
que se usen materiales proteicos, además de que no es soluble, ni dispersable en agua, y de poseer un olor desagradable y un bajo valoragregado en general
A nivel internacional, al igual que en México, se han planteado alternativas para la industrialización deespecies de pescado no utilizadas, así
como
de los desechos del mismoEn
nuestro país, se pueden señalar los intentos de Productos Pesqueros Mexicanos, S A de CV
(1979) para introducir en el mercado nacional pulpa de pescado para consumo inmediato, tambiénse
ha intentado producir pastas de pescado en las que se usa como materia prima principal la pulpa de pescado, a la que se le adiciona sazonadores yaglutinantes, i.palmente se ha intentado introducir pastel de pescado, salchichas de prwdo, jamón de pescado (Bojorquez, 1979), sin obtener el éxito esperado al encontrar
como barrera el rechazo de estos productos por parte del consumidor, debido a los habitos
Por io ant& se
&ve
necesario busur altanativaspan
el mejor tprovscbrm#ai.
odeeste recurso, lo cual se puede lograr a través del desarrollo básico
de
tecnobgh quepermitan obtener un producto de mayor valor agregado y con una gama de aplicaciones más amplia y novedosa que los intentados hasta ahora (Rivera, 1990), una posibilidad
atractiva es la abstención de hidrolizados de pescado con
las
cualidades nuttitivas,organolépticas y funcionales necesarias para su adecuado aprovechamiento
HIDROLIZADOS DE PROTE~NA
d
Las proteínas al ser hidrolizadas, forman agregados de diferentes
pesos
moleculares (tabla.V),
entre los que se encuentran péptidos, mezclas de péptidodamino8cidos, mezclas de aminoácidos libres (Braun, 1994)TABLA
V.
Productos del hidrolizado de proteína'Rotdos&suao bHiQoliLadourmaculpodunQpg.DatowSpeQihta,NY
= p e s o m o l & d € i ~ p G l H P L c
Los
hidrolizados de proteína poseen un gran número de propiedades funcionales, lo cual loshace atractivos
como
una fuente de proteína para la nutrición de los seres humanos (SvenFr~kjaer, 1994)
La proteína del pescado ha sido puesta a pnieba,
en
diferentes estudios como matexia prima parala
producción de hidrolizados (Lalasidis, 1978) Los hidrolizados de proteínade
pescado podrían ser incorporados en alimentos tradicionalmente consumidos por el ser
humano, podrían ser utilizados en la formulación de alimento para el ganado, para la
agricultura
Así
mismo, podrían ser usadosen
la formulación de.medios de cultivo paramicroorganismos, como sustrato en proceso fermentativos, en medios para el cultivo de tejidos, en la estabilización de vacunas,
en
productos veterinarios, como atrayentes deinsectos, en cosmetología y en la elaboración de dietas especiales para pacientes con
pru'.iemas de absirición intestinal o para fenilcetoníiricos (Rivera, 1390)
Sin embargo, si se pretende utilizar los hidrolizados proteicos en la industria alimentaria,
estos deben ser preparados por métodos que conserven sus cualidades nutritivas, por esta razón el proceso de hidrólisis debe realizarse en condiciones controladas @vera, 1990).
MÉTODOS
DE
OBTENClbNDE
HlDROLIZADOSDE
PESCADOLos
procesos tradicionales para solubilizar proteína de pescado involucran el colocar el pescado en contacto con altas concentraciones de sal en grandes tanques de concreto, en donde la proteólisis ocurre espontáneamente por acción de las enzimas presentes en elpescado, lográndose que aproximadamente el 50% de la proteína sea convertida a su forma
soluble, estos procesos tienen una duración aproximada de un año
en
promedio dando como r e d d o un líquido café claro el cual es separado del material sólido residual (Rivera,1990)
Las desventajas de estos proceso son la siguientes
a) Por ser necesario una largo periodo
de
fermentación, los costosde
producción son elevados,b) Se tienen bajos rendimientos (5Ph de hidrólisis);
c) Una gran cantidad de proteína es desperdiciada por la baja eficiencia del proceso; d)
La
producción delos
compuestos quedam
el sabor y aroma noes
controlada; e)No
son utilizados pescados que son considerados de desecho, yf)
Es
necesario utilizar altas concentraciones de sal para evitarla
contaminación microbiana.
a) HIDR~LISIS QU~MICA
Se ha intentado solubilizar la proteína de pescado por medios químicos (Tannembaum,
1970), se ha visto que los productos obtenidos les falta el sabor característico de los fermentados tradicionales, por lo que no son aceptables.
La
hidrólisis ácida o alcalina-
quees un método puramente químico
-
puede destruir los aminoácidos con forma “L“produciendo D- aminoácidos, e incluso formar sustancias tóxicas como la lisino-alanina.
(Lahl y Grindstaff, 1989). Esto es especialmente perjudicial para los hidrolizados.de
proteína, donde las proporciones de aminoácidos, dipéptidos, y-tripéptidos, son críticas para obtener una absorción efectiva de los mismos (Matthews et al, 1976). Tanto en los
procesos ácidos como alcaiinos la principal desventaja, es el hecho de que posteriormente es necesario neutralizar el sobrenadante obtenido,
lo
que provoca quelos
‘costos se eleven(Rivera, 1990). Un hidrolizado obtenido por métodos químicos presenta una composición de aminoácidos diferente a la de la proteína de la cual deriva, esto es por que se da una racriniz~zción y des?mcción de alpnos aminoácidos (serina, cisteína; metionina, trionina)
(BaSo~i, 1976) Este efecto es
nihs
pronunciado con la presencia de otros conlpuestos, especialmente carbohidratos. Después de una hidrólisis ácida, la glutamina y asparagina seconvierten en sus respectivos ácidos (Finot, 1973).
I
b) HlDR6LISIS ENZIMATICA
Considerando los problemas que se suscitan con la hidrólisis química, Roe1 en 1969 evaluó la posibilidad de realizar la solubilización directa de un coflcentrado protéico de pescado con ayuda de microorganismos. En el mismo año, Hale estudió el comportamiento de 20
&mas proteolíticas comerciales en la hidrólisis de proteína de pescado, encontrando que, la más activa &e la pepsina.
En 1973 Ar8er observó, en un sistema de
hidrólisk
de proteína de pescado, conuna
proteasa de Bacillus subtilis, que .el aumento de la cuenta microbians podía controlarse modificando el pH, encontrando que en condiciones de aidkidad el crecimiento microbian0 se detuvo totalmente.Ante el hecho de que
en
varios sistemas involucran la interacción deuna
enzima soluble y un sustrato insoluble,la velocidad de reacción es proporcional
a la cantidad deenzima
absorbida, Archer evaluó sí esto se presentaba en d sistema con
&lo
de pescado, encontrando quela
enzima interacciona con el sustrato a b s o r b i i rápidamente en las partículas sólidas, dando como resultado la solubilizaci6n de la prokina y posteriormente la proteolísis de los fragmentos de proteína en solución.La hidrólisis enzimática es un método válido para la recuperación de proteína de subproductos de la industria alimenticia. Ésta tiene diversas ventajas sobre la hidrólisis química, ya que gracias a UM proteólisis controlada, es posible obtener perfiles de péptidos
bien definidos, pues se puede manipular la hidr6lisis y las
propiedades
de los prdluctos resultantes (Lahi, 1994).La hidrólisis enzimática de proteinas es un proceso complejo que depende de la temperatura, pH, agitación, concentración de enzima y de proteína
Varias
enzimas son ahora conocidas comercialmente con variablespH
óptimos, desde pH 2de la pepsina hasta pH 8.5 de Alcalase (3.
La
pepsina y la bromelina son activadas óptimamente a pH neutro y a temperatura de 7PC, una temperatura arriba de la temperatura de sobrevivencia de muchas bacterias.En general, el pescado es mezclado con la enzima en el recipiente de digestión, después se adiciona un volumen igual de agua, una vez que la hidrólisis ha sido completada la mezcla es calentada a IOPC para inactiva la enzima y para esterilizar la suspensión.
Los
huesosson removidos por un tamiz. Esta suspensión contiene residuos insolubles en una solución
de aniinc.kidos y péptidoc la cual es coiicenlrada y secada. Aiternativmente la sucpención puede ser separada en una fiacción soluble y una insoluble por centrifugación. La fracción
soluble obtenida es concentrada y secadawvera, 1989).
~~
En condiciones de digestión
para
la enzima, el tejidodd
pescado convertido rápdamentede
una
mezcla viscosaa
un líquido libre fluido después de unos pocos minutos. Subsecuentemente la proporción de hidrólisis disminuye entrandoa
unafase
estacionaria sin UM hidrolisis aparente,tal
cinéticaes
típica del hidrolizado del músculo de pescado(Rivera, 1989)EL PROCESO DE HIDR~LISIS Y
su
CONTROLd
La
hidrólisis de proteína a escala comercial, generalmente se lleva acabo
en procesos "Batch, utilizando grandes recipientes en donde existe la mezcla del sustrato con la-
enzima.El proceso puede
ser
controlado a través de los parámetros de hidrólisis.En
laproducción comercial, los parámetros críticos a controlar son-nincipalmente tempenaira, tiempo, pH y grado de hidrólisis. I& condiciones de hidrólisis son controladas
con
el
fin de obtener características específicas tales como son distribuciónde
aminoácidos, distribución de pesos moleculares, y la cantidad de proteína resimial intacta. La tempemtun de procesamiento se selecciona normalmente para OptimUar la cinética de la enzimaseleccionada.
El
pH de operación también es determinadopara
encontrar un rango óptimo en donde la enzima tenga una máxima actividad.La
elección deuna
enzima, tmbién esta determinada porla
combinación de su eficacia y economía. Una concentración elevada de enzima puede ser utilizada para incrementar la velocidad del proceso de hidrólisis(Lahl, 1994).
Otra consideración que se tiene que tomar en cuenta durante la hidrólisis, es el crecimiento
de microorganismos. Actualmente el problema de UM infección es controlada con
procesos más rápidos, con un mayor control en la temperatura y pH, y una mayor atención a
las
condiciones sanitarias (Braun, 1994).El material
y condiciones de hidrólisis deben ser también controlados para cuidar el sabor, solubilidad y ciertas propiedades físicas del hidrolizado.U
sabor de los hidrolizadosproteicos enzimáticos se caracteriza por un sabor amargo el cual se asocia a la presencia de péptidos cuyos procesos moleculares son bajos y cuyas -denas tienen grupos aminoácidos hidrofóbicos (Nagodawithana, 1993). Según la regla Q,.formulada por Ney en 1971, un péptido presentará un sabor más amargo si su hidrofobicidad (Q) se encuentra por arriba de
1400 caUmol, y por el contrario, no presentará un sabor amargo, si este valor se encuentra
por debajo de 1300 cal/mol.
'
Eyisten, al menos, 5 variables que influyen en la obtención de péptidos amargos [Adier-
Nissen, 1986):
1.
La
hidrofobicidad del sustrato;2.
El
grado de hidrólisis, el cual influye en la concentración y longitud de los pkptidoshidrofóbicos solubles;
3.
La
enzima, la a>alen
combinación conel
grado de hidrólisis influyeen
la distnaucón de los péptidos hidrofóbicos;4
La
especificidad de la enzima, ya que influye en cierto grado en la posición de las cadenas hidrofóbicas (teminales o no terminales); y5 Cualquier método de separación involucrado en el proceso de hidrólisis' (Nagodawithana, 1993).
CARACTEI~STICAS C E N E ~ L E S
-
DE
LAS ENZIMASUna enzima se define como un polipéptido, que cataba una reacción con cierto grado de. especificidad (Nagodawithana, 1993)
Todas
las
enzimas son proteínasLa
funcionalidad de las enzimases
consecuencia directa de la secuencia de aminoácidos de la proteína (estructura primaria), del doblamiento del polipéptido (estmctura secundaria), de las interacciones entrelos
aminoácidos de las cadenas por fuems electrostáticase
hidrofóbicas ypor
puentes disulfuro (estructura terciaria) y del arreglo espacial de las subunidades de proteína (estructura c u a t k a )E
l
tamaño molecular de las enzimas varia, aproximadamente, de entre 13,000a
varios millones de Daltons, sin embargo la mayona de ellas presenta un peso molecular entre 30,000 y 50,000 Daltons (Page, 1987)A pesar de que las enzimas son proteínas que contienen cientos de residuos de
aminoácidos, sólo unos pocos residuos están involucrados directamente en la unión
con
susSustrato
La
naturaleza de la reacción que es catalizada por una enzima es dependiente del reconocimiento de los aminoácidos que constituyen el sitio activo Estos residuos determinan la especificidad de la reacción y su mecanismoL o s
otros residuos de aminoácidos dela
cadena de polip6ptido dan la adecuada orientación espacial entre el sitio activo y el sustrato (Nagodawithana, 1993)Una de las principales características de las enzimas es que son catalizadores de reacciones
La
catálisis se define como la aceleración de un proceso que podríaser
más lento, bajo ciertas condiciones Esta propiedad junto con la de especificidad, son de los principales critenos para seleccionar una enzima Los mecanismos de acción más comunes en la catálisis enzimática, comprenden comportamiento ácido-base, neutralización de cargas, ataque nucleofilico y electrofilico, entre otrosLos
mecanismos de las reacciones hidrolíticas involucran la formación de un intermediario enzima-sustrato (Nagodawithana,1993)
La especificidad de una reacción enzirnática es consecuencia directa de la estructura del sitio activo y del sustrato (Page, 1987).
La
estructura o forma del sustrato, son muy importante para que la enzima lo reconozca.Los
residuos de aminoácidos cercanos al sitio activo, pen, que no están involucrados directamente en la catálisis, también juegan un papel importante en proveer el acceso al sustrato.REPRESPTTACIÓN
ESQUEMA’IICA DE UNA ENZlMAUPARIE
SOMBREADAC0RREs”DE
ALSITIOACTIVO
EFECTO DEL ENTORNO EN LA ACTIVIDAD ENZIMÁTICA
.
Las
reacciones catalizadas por enzimas dependen de las reacciones del entorno, estas características son importantes en sistemas y procesos alimenticios,en
los cuales, existe un amplia gama de condiciones El conocimiento de cómo una reacción enzimática es afectadapor su entorno, es indispensable para poder optimizar o controiar cuaiquier proceso
enzimático (Nagodawithana, 1993)
Los principales factores que afectan la actividad enzimática son pH, temperatura y fuerza
iónica
El efecto del pH en las reacciones enzimáticas, es causado por
una
ionización reversible del sustrato o los aminoácidos de la enzima, estos efectos se manifiestan como cambios en la actividad enzimática, estabilidad o comoun
cambio en el equilibrio de la reacción.Los
efectos del pH en las enzimas, también dependen de la presencia oausencia
de iones específicos, temperatura, constantes dieléctricas y fuerza iónica.El
pH óptimo de las enzimas puede variar en un amplio rango, así por ejemplo podemos encontrar enzimas cuyo pH óptimo sea 2 (pepsina) y otras cuyo pH es 10 (fosfatasa alcalina), sin embargo laiiia) oria de l a s eiiziiiias presenian tin pH óptimo neutral (Whitaker, 1994)
.
.,Los
efectos espcdficosde
los dectroliios dependen de las conaatracicmeSde
i0r wptcs que estabilizan, activan, inactivan, o inhiben una &ma particular Los iones metálicos sonmuy importante ya que ellos son cofactores o cosustratos para
las
reacciones enzimáticas, y otros pueden inactivar a las enzimas (Nagodawithana, 1993)La temperatura es un factor importante en la actividad enzimática
En
general, la velocidad de la reacción incrementará con la temperaturaLa
energía de activación deun
proceso
puede ser calculada según la ecuación de Arrhenius. Con un incrementoen
la temperahira, la movilidad de los segmentos de proteína aument* mientras la fuerza de las interaccioneshidrofóbicas disminuirá Esto trae como consecuencia un decremento en la actividad catalitica, y si aumentamos más la temperatura habrá
una
desactivación La desnaturalización térmica de una proteína trae consigo una agregación dela
misma la cual.
no es siempre reversible La temperatura óptima de operaciónes
menor si el tiempo de reacciónes
mayor (Draw, 1995)PROTEAS AS
Las proteasas utilizadas para procesos alimenticios, catalizan la degradación de p&nas, que provienen de las siguientes fuentes principalmente
Pueden estar presentes en el alimento,
Pueden ser excretadas por microorganismos que se encuentren en el alimento,
Las proteasas se clasifican de acuerdo a
su
fuente (animal, vegetal, microbiana),su
accióncatalítica
(endopeptidasas o exopeptidasas), y la naturaleza del sitio catdítico.En
lanomenclatura internacional,
las
proteasas (o hidrolasas peptidicas) se encuentran en la subclase 3 4, la cual se divide en 3 4 11-19 para las exopeptidasas, yen
3 4 21-24 para lasendopeptidasas
Las endopeptidasas son
las proteasas más utilizadas enlos
proctsos alimenticios.Las
endopeptidasas rompen las cadenas de polipéptidosen
al@ enlacedistribuido
a
lo largo de la cadena, mientras quelas
exopeptidasas hidroh los aminoácidos terminales-
1. Endopeptidasas
Las 4 principales clases de endopeptidasas son serin proteasas (EC3 4 2i), cistein proteasas
(EC3 4 22), pioteasas aspárticas (EC 3
4
23)). metaloproteasas (EC 3 4 24)Como
su nombrelo
indica, las proteasas serin, cistein y aspática, tienen en su cadena lateral serina, cisteina y ácido aspártico, como parte esencial del sitio activo Una modificación o bloqueo de esta cadena lateral, trae como consecuencia una inactivación total de la enzima.. !
Las
serinproteasas
preaentan
una actividad máxima apH's akalinos;las
cistein pmteam,sin embargo, presentan una actividad máxima a pH neutral
Las
proteasas aspbths,"en
cambio, presentan una actividad catalítica máxima, a pH's ácidos . I '
Las
metaloproteasas contienen un metal (generalmente Zn) y tienenuna
actividad óptima a un pHcerca
del neutro.Los
iones calcio generalmente estabilizan a estas enzimas y soninhibidas por agentes qdantes como
lo
es elEDTA.
2. Exopeptidasas.
.
Las
exopeptidasas son importantes en el procesamiento de alimentos, ya que quitan losresiduos amargos
a
los hidrolizados proteicos, en esteaspecto
Ins gminopePtidasas y carbopeptidasas, pueda ser aplicadas con gran éxito (Nag&* 1993).En
cuanto a su clasificación en comparación de su sitio activo, mecanismode
acción y estructura tridimensional, seconocen
4 clases reconocidas por la UNÓn Internacional de Bioquímica, y juntocon
es& clases existen 6 familias de proteasas reconodas. Cadafamilia tiene su caracterísiica o residuo de aminoácido funcional el cual está situado en
una
configuración particular del sitio activo. (Tabla i)(Beyond,l989)TABLA
VI.
Familia de enzimas proteoliticas.La
actividad de las proteasas debería ser dada en unidades internacionales (iü), es decir, como los microequivalentes de enlaces peptídicos rotos por minuto. Sin embargo, porrazones históricas existe una amplia gama de unidades arbitrarias según los ensayos
-
I.
tiempo Por ejemplo, la actividad de las proteasas neutras o aidinas es comúnmente
determinada por el
ensayo
propuesto por Anson (1939) En este método, la hemoglobinadesnaturalizada es digerida a pii 7 5 y a 2 f C por 10 min
La
cantidad de producto solubleen
TCA es determinado con el reactivo de Folin y CiocakeauEn
contraste, una unidadAnson (AU) es la cantidad de enzima que digiere a la hemoglobina a tal grado que la cantidad de producto soluble en TCA liberado por minuto da el mismo color que 1 mmol
de tirosina
La
actividad especifica de una preparación enzimática esta dadaen
Unidades Anson por gramo de preparación (Nagodawithana, 1993)Las
preparaciones de proteasas, así como las de otras enzimas, debenser
almacenadas en lugares secos yfnos
o en refngeración, de acuerdo a las instrucciones dadas por elproveedor A nivel industrial, las preparaciones enzimáticas deben ser preparadas al momento de utilizarse, y no deben ser mezcladas o diluidas con otros reactivos antes de ser
utilizadas En
los
experimentos de laboratorio, sin embargo,es
necesariorealizar
algunas diluciones debido a las pequefías cantidades que se wesitan, yem
este caso, la solucióndiluida debe ser preparada inmediatamente antes de
ser
utilizada Seha
demostrado, que las proteasasen
solución pueden perder mucha actividad, a pesarde
permanecer solo unos pocos días en el refrigerador, debido a que las proteasas son susceptibles a la inactivacionpor autólisis o,
como
en
el caso de las cistein proteasas, a la inactivacion por oxidacibn (Nagodawithana, 1993)d
CmÉTICA DE LAS REACCIONES CATALIZADAS
POR
ENZIMAS.ECUACI~N DE MICHAELIS WEN.
Es necesario conocer
las
caractensticas cinéticas de una reacción enzimática para poder modificar enzimáticamente cualquier alimento. La cinética enzimática es la rama de la enzimología que tiene que ver con los factores que afectan las reacciones cataiizadas por enzimas. Los factores más importantes .wn la concentración de enzima, de sustrato, pH y temperatura. Cuando todos estos factores se analizan adecuadamente,es
posible conocer mucho acerca de la naturaleza de la enzima. Así por ejemplo, ai variar la concentración desustrato es posible deducir los mecanismos cinéticos de la reacción, es decir, el orden en el cuál el sustrato se une a su enzima.
Un
estudio del efecto de la variación depH
y temperatura en las constantes cinéticas, da información a cerca de da identidad de los aminoácidos del sitio activo (Segel, 1993).La primera ecuación general para reacciones que involucran enzimas fie descrita en 1903
por Henri. ILa ecuación de Henri indica que la velocidad inicial es dii-ecjamente yroporciunai a la concentración de enzima, pero incrementa de una forma no lineal cuando se incrementa la concentración de sustrato amba de la velocidad máxima.
La
derivación de la ecuación de Henri, sebasó
enlos
siguientes puntosLa
enzima es un catalizadorLa enzima y el sustrato reaccionan rápidamente para formar un complejo enzima- sustrato
Solamente existe un sustrato y un complejo enzima-sustrato, el cual al romperse forma enzima libre y producto
La enzima. sustrato y complejo enzima-sustrato, están en equilibrio,
Ib decir, la
velocidad a la cual ES se disocia a E + S es más rápida que la velocidad a la cual ES serompe para dar
E
+ PLa concentración de sustrato es mucho más grande que la concentración de enzima, por lo que la formación del complejo
ES
no altera la concentración de SLa velocidad de la reacción
es
limitada porel
rompimiento deES
para dar enzima libre y productoLa
velocidades
medida durante las etapas iniciales de la reacción, en donde las reacciones reversibles son insignificantes.
La
ecuación de Henri es v1+[S1
ks
donde: [SI= Concentración de sustrato.
v = velocidad inicial a una concentración de sustrato dada.
Ks=
la constante de disociación del complejo ES.K=
constante característica de la enzima.Michaelis y Menten, posteriormente hicieron una modificación a la ecuación de Henrt
v =
K s + S
Si
puede ser observada cuando toda l a enzima esta presente como
ES
r- - 1 -,.
Los principios generales de la cinética de las reacciones químicas, son aplicables a las reacciones catalizadas por enzimas; pero éstas muestran un razgo característico. la
I saturación con el sustrato.
Si examinamos la curva de
Vo
vs. ‘[Sustrato], encontramos tres regiones distintas, donde la velocidad responde de una forma característica al increment.0 de la concentración de sustrato (fig. (a)). A muy bajas concentraciones de sustrato ([S]<O.OiKm) la curva Vo vs. [Sustrato] es esencialmente lineal, esto es, la velocidad es directamente proporcional a& concentración de sustrato (fig.e)).
Esta es la región de cinética de primer orden. A muyaltas concentraciones de sustrato ([S]>lOOKm), la velocidad es esencialmente independiente de la concentración de sustrato, y se aproxima asintóticamente a una velocidad constante. Esta es la región de cinética de orden cero (fig. (c)). A
concentraciones intermedias de sustrato, la relación entre Vo y [SI no sigue una reacción de primer orden ni una de orden cero. (Segel,1993).
’
Fig 1. -0 de la mncenbaci6n de
sumato sobre la velocidad de una reaa2ón catalizada enzimáticamene.
La teoría de Michaelis Menten supone que la enzima
E,
se combina en primer lugar con el sustratoS,
para formar el complejo enzima-sustrato ES, a continuación este último se escinde en una segunda etapa, para formar enzima libre y producto P. Se supone que estas reacciones son reversibles.La ecuación de Michaelis Menten es la ecuación
de
velocidad para las reacciones catalizadas por enzimas que sólo actúan sobre un sustrato; relaciona la velocidad inicial, la velocidad máxima y la concentración inicial del sustrato a través de una constante llamada ‘Constante de Michaelis Menten”.15
!
U'
14
La
ecuación de Michaelis Menten puede transformarse algebraicamente en otras formasque son más útiles para la expresión de los datos experimentales Una de las transformaciones más usuales se obtiene, tomando los recíprocos de ambos miembros de la
ecuación de Michaelis Menten obteniendo
.
Esta ecuación es la de Linewaver-Burk. Cuando 1No se representa fiente a
l/[S].
se obtieneuna
línea recta. La pendiente de la recta es KmN- y la interUecci6n sobre el eje ]No,es
IN&; la intersección del ejei/[S]
es
-]/Km. Tal representación tiene la ventajade que permite una detenninación mucho más exacta del valor
de
Vmáx, ya que la representación sencilla de Vo frente[SI
d o se obtiene un valor aproximado.FUNDAMENTOS DE UNA EIDR~LISIS ENZIMATICA
Lac: proteasas catalizan In degradacih hidrolítica de la cadena de péptidcs
Ri H H H R1 H H U
I I I PROTEASA I I 1 I
- C - C - N - C f & N - C
-
-
C - C - N - C+
H2N-Cse muestren los
En la
figura,
no se observas losmecanismos
de
lacatatisis,
unmmatc
productos y reactantes netos
De
acuerdo a Svendsen (1976)la
catálisis de las serin proteasas (la principal clase de proteasas) ocurre en 3reacciones
consecutivas (1) Formación del complejo de Mochales entre la cadena de péptido original (el sustrato) y la enzima (2) Rompimiento del puente péptidico para liberar uno de los 2 péptidos resultantes (3) Un ataque nucleofilico ai complejo péptidico sobrante para liberar asi a la enzima., .
Si
el sustratolo
simbolizamos como S y a los péptidosresultantes,
P
yF,
y si lareacción ocurre en un sistema acuoso el cual impida que
la
reacción será reversible, la reacción hidrolítica puede ser simplificada por el esquema siguiente:.
K+1 K+2 K+3
2
E
+
S,
ES-EP+
E-P’ -E+P-OH+
E-P’K-1 +
n2o
De esta serie de reacciones, la segunda de las tres,
es
la deteminan& . Esto significa que la reacción total es determinada porK
+2 y queKm
es aproximadamente igual a lacontante de disociación, K-IíK+l, En otras palabras, se lleva a cabo
una
cinética clásica de Michaelis-Menten.En la reacción anterior, no solo el agua, sino también los grupos amino libres pueden
reaccionar como nucleófilos, mientras Ocurre la siguiente reacción de transpeptidación.
R~ H
n
holW~ Rin
I I I I I
- C - C - N - C -
+
HzO, \-C-CoO-+
&Pi- C -II I I I
n o
r4 H RzExiste una competencia entre el agua y el HzN-, y
a
pesar de que la hidrólisis se vefavorecida por el alta concentración de H20, el ataque nucleoflico del HzN- a menudo ocurre más rápido
El grupo carboxil libre y el grupo amino libre formados después de la hidrólisis serán de
una forma más o de una forma menos ionizables dependiendo del pH de la reacción Los
\alore$ de pk (25°C) de -COO13 y +HIN- en los polipeptidos se estima que son 3 1
-
3 6y 7 5
-
7 8 respectivamenteEl grupo carboxilo estará
.
.
.
No
Parcialmente disociado a pH 2 disociado debajo de pH 2-
5El grupo amino estará
.
Completamente protonado debajo de pH 6 1 Parcialmente protonado a pH 6-
9 5.
No
protonado arriba de pH 9 5Por lo anterior se puede observar que en la
hidróiisis
de la proteína seda
una liberación o toma de H+ Esto quiere decir que el pH cambiará durantela reacción
de hidrólisis, excepto en la región alrededor de pH 5-6, donde la toma y liberación de protones secancelan una a
la
Otra Debajo de pH 3 1-
3 6 el grupo carboxilo estará menos de la mitaddisociado y el grupo amino estará completamente protonado, y si
no
se umiroia el pH. habrá un incremento del mismo, ya que se tendrh UM tomade
H+
de
alrededor de 0.5 a 1equivalente por cada puente W d i c o hidrolizado Por el contrario, a valores de pH arriba de 7 5
-
7 8 (25°C) el grupo amino estará menos de la mitad protonado pero el grupocarboxilo estará completamente disociado,
lo cual
permitirá una iibgpción de H+ de 0.5 a1 equivalente por cada puente péptidico hidrolizado, y como consxuencia el pH d d si no es controlado
Siempre que se lleve a cabo una hidrólisis con
un
sustrato yuna
enzima determinada, se tendrá que describir, bajo los llamados “parámetrosde
hidróüsis”, los cuales sonconcentración de sustrato, proporción enzima-sustrato, pH y temperatura Estos cuatro parámetros de hidrólisis son determinantes
en
cuanto a que tan rápido proceda la reacción, así como para otras características del procesoLa
concentración de sustrato se abrevia con una S, y es usualmente dada como un porciento en peso de la masa total de la mezcla de reacción cuando esta se inicia.
La
proporción enzima-sustrato, es usualmente más característica de la velocidad de la reacción que la concentración por si misma de enzima Esto es porque el proceso de hidrólisis sellevan a cabo a menudo a altas concentraciones de sustrato donde prevalece
una
saturación del mismoLas condiciones iniciales de la reacción son declaradas, ai tener bien definidos al sustrato,
la enzima y los parámetros de hidrólisis. Durante la reacción estos parámetros tenderán a
cambiar de sus valores iniciales. En el curso de la reacción, el grado de hidrólisis
,
el cuales una medida de que tanto se ha dado la degradación hidrolítiq incrementa de cero y
usualmente sigue una curvatura ligera. Esta curva, la cual desnibe el grado de hidrólisis
en función del tiempo, se llama curva de hidrólisis (Adler-Nissen, 1986).
SELECCI~N
DE
LA
ENZIMA A UTILIZARLa hidrólisis enzimática al representar una alternativa para la recuperación de proteína, y
en
vista del
interés
económico ynutritional
hacia el aprovechamiento de proteína desubproductos de la industria pesquera, es necesario la selección de U M enzima que
produzca los péptidos con las características nutricionales y funCional~ requeridas
Se han realizado varios estudios utilizando enzimas de diferente origen para soiubilizar la proteína del pescado
Las
enzimas más exitosas han sido a) origen animal pepsina ympsina, b) origen vegetar bromelina y papaina y, c) origen microbiauo. Se
han
u t i l i 0enzimas de Asoernillus flavus, Actinomices fiadiac,
Therm
oactinomices vulgaris, Streptomices miceus, Bacillus licheniformis, Bacillus wlvmma y Bacillus subtillisA nivel nacional
las
enzimas de origen animal tiene precios elevados,ya
que su produwiónse ve reducida a niveles muy bajos por ser
un
subprodudo delos
procesos implementados con el fin de obtener carne, además es necesarioimportarias;
por
ello su utiiiiión se.ve
reducida a la industria farmacéutica, la que requiere voiúatmes
muy
pequeñosde
enzimaCon las enzimas de origen vegetal se presenta el problema
de
que las plantas delas
que seobtienen, &n sujetas a factores climatológicos y ciclos de producción que limitan su disponibilidad, e igualmente son importadas Además de que ser cultivos cuyos h t o s se
destinan para consumo humano, lo que hace más crítica la situación
En este sentido las enzimas proteolíticas de origen microbiano, poseen un gran potencial,
ya que pueden generarse anualmente grandes cantidades, sin necesidad de
extensas
áreas decultivo, ni de ciclos de producción ni variaciones climatológicas
Por otro lado, como ya se ha mencionado, uno de los principales problemas en la hidrólisis
de proteínas, es la formación de compuestos que generan
sabores
amargos, debido al altocontenido de aminoácidos hidrofóbicos en el
hidrolizado
Además seha
observado que eltipo de enzima usada para la hidrólisis tiene influencia en la presencia de sabores amargos
. .
Además, considerando lascaracterísticas de las proteasas animales y vegetales antes mencionadas, las proteasas microbianas pueden y deben ser utilizadas para desarrollar
proceso dirigidos a la producción de concentrados de péptidos solubles y aminoácidos.
Las enzimas se caracterizan por sus curvas de actividad de pH y temperatura. Estas curvas junto
c m
las wnw de estabilidad son indicadores útiles para definir las condiciones bajolas ciraies una enzima debe ser aplicada.(Kivera, 1990)
La enzima ALCALASE
8,
es una proteasa grado alimenticio.Es
una proteasa del tiposenna, caracterizada por un excelente rendimiento a temperaturas elevadas y aldinidad
moderada para un substrato alterno de cam'na, se produce mediante fermentación
sumergida de una cepa seleccionada de Bacillus licheniformis. La enzima Alcalase @ se
presenta en diferentes productos granulados y líquidos, su actividad proteolítica se
19
expresa
en Unidades Anson (AV), su actividad óptima se presenta a pH's aicrlinos y ea un rango de temperatura entre 55 y 65" C, dando también homogeneidad en la hidróiisis de losdesechos de la industria pesquera
Alcalase @ es fácilmente. soluble en los líquidos detergentes a cualquier concentración, temperatura e índice de pH de
uso
normal. En cuanto a su toxicología, ésta se produce a base de microorganismosno
toxicogénicos y no patógenos porlo
que esta clasificada como no tóxica, y es fácilmente biodegradable.Alcalase @ está clasificada en "Chemical Abstract Service" como una "wbtilisina" (CAS
núm. 9014-01-1) . El ' número correspondiente de "Enzyme Classification" (Unión Internacional de Bioquímica)
es
EC núm. 3.4.21.62.*
DETERMINACI~N DE PROTE~NA
POR
ELMÉTODO
DE UIWRY.Dentro de los métodos más utilizados para la determinación de proteína, se encuentra el método de Lowry. El constituyente activo del reactivo de Folin Ciocaiteu,
es
el ácidofosfomoiibdico-tungstico. Este ácido se reduce por acción de ciatas proteinas, dando un sin
número de especies reducidas,
las
cuales se caracterizan por tener un color azui.Los
iones de cobre presentes en el reactivo, quelan con el puente peptídico y esto facilita la transferencia de electrones entre el constituyente activo y la proteína, dando así laformación de un cromógeno.
La
reacción tiene que realizarse en condiciones aidinas. Los residuos de aminoácidos con los que reacciona son tnptofano, tirosina, cisteina, cistina, histidinaLa
principal ventaja del método de Lowry es su gran sensibilidad, y su principal desventajaes el número de sustancias que interfieren. El rango sobre el cual el
color es
lineal es limitado, pero esto se puede solucionar utilizando diluciones. Entre una de las alternativas para eliminar trasferencias, se encuentra la precipitación delas
proteínascon
al ácido tricloroacético(TCA),
dejando a la sustancia que interfiere en solución (Sterens, 1980).ELECTROFORESIS EN GEL DE UNA DIMENSIdN
SDS-PAGE
(gel de electroforesis duodecil sulfato de sodio-poliacrilarnida), es un método?\relente pare! identificar, nionitorear, cuantificar y aislar proteinas especificas en mezclas
complejas. SDS-PAGE es utilizado comúnmente para la estimación de pesos nioleculares de subunidades de proteína y para determinar su composición.
En una separación electroforética, se induce a que las partículas cargadas, migren hacia el electrodo de signo opuesto bajo la influencia de un
campo
eléctrico externo. Elmovimiento de las partículas se retarda por la interacción de la matriz del gel, en donde
están suspendidas, las cuales actúan como filtros moleculares. Debido a que la fuerza
eléctrica y el filtro molecular son fuerzas opuestas, dan como resultado una migración
diferente para
las
proteínas que constituyen la muestraEn general, la separación por electroforesis en gel, se basa
en
el tamafio, forma y cargasnetas de las macromolkulas Durante la preparación de las muesíras, las proteínas se tratan
con
SDS
caliente El detergente aniónico se une fuertemente a la mayoría de las proteínas(1 4 mg de SnS/mg protelna) impartiéndoles
una
carga negativa al complejo resultanteLa
interacción c o g D S rompe todos las proteínas unidas por enlaces no covalentes, causando que la molécula se desdoble Si se realiza un tratamiento paralelo con un agente redudor,
como lo es el 2-mercaptoetan01, la proteína sufke una mayor desnaturahción, por lo que se rompe en sus subunidades constituyentes
La migración de los complejos del
SDS
es hacia el ánodo y la velocidad es inversamenteproporcional al iogaritmo de sus
pesos
moleculares Los poiipéptidosSDS
se mueven através de los geles de una manera predecible, los complejos
con
bajo pesomolecular
migran más rápido que los más grandes
Lo
que significa que el peso molecular deuna
proteína puede estimarse por su movilidad en el gd SDS-PAGE
La mayoría de las electroforesis se realizan en cámaras verticales, en un gel que se forma
entre dos platos de vidrio En el gel se pueden
corren
diferentes muestrasU
espesordd
gel se logra por espaciadores que se colocan entre los platos de vidrio.
Los
gelesconvencionales son del orden de 16 a 20
cm
de longitud, 16 cm de ancho y O 5-3 O mm deespesor, y pueden llegar a albergar hasta 25 muestras
.
Los
geles de poliacrilamida se forman por la copoiimerizaciónde
un monómero deacrilamida CHz%H-CO+J"H, y por la unión con
N,N'
metilenbisacrilamidaCH2=CH=CO-NH-CHz-NH-CO-CH=CH2.
El mecanismo de la formación del geles
porU M polimerización catalizada por un sistema generador de radicales libres compuesto de
persulfato de amonio (el iniciador) y un acelerador, tetrametiletilen-diaina (TEMED). TEh4ED provoca la formación de radicales libres del persulfato y cataliza la polimerización. El oxígeno interfiere con la polimerización (secuestra radicales), por io
que es necesario una adecuada desaereación para remover el oxígeno disuelto de la solución de acrilamida y obtener un gel adecuado:
Las propiedades filtrantes del gel se establecen por la matriz formada por las cadenas de
poliacrilamida. Al incrementar la concentración de acnlamida en un gel, el tamaño de poro
disminuye. El tamaño de poro efectivo en un gel, se define por sus propiedades fikrantes,
es decir, por la resistencia que imparte a la migración de las moléculas de proteína. Un dr:erminado pel, esta caracterizado fisicatnente por un par de f i p r a s
(%T,
% C), donde%T
es el peso en porcentaje del monómero (acrilamida+ ligador, en gramos por 100
A),
y %Ces la proporción del ligador (como % del monómero total) en el gel.
Los
límites prácticos1
E!l
uao
de resctivos de aha Calidad w un pre-requisitopara
obtaia geies reproduQbla deaita resolución, principalmente para la acrilamida la cual constituye el componente mas abundante en la mezcla del gel-monómero Los componentes del buffer deben de ser de
grado readivo y solo debe utilizarse agua destilada o desionizada para preparar las soluciones
El método de electroforético mas popular
es
el sistemaSDS-PAGE
desarrollado porLaemmli (1979) Este es un sistema discontinuo que consiste en dos geles Contiguos
pero
diferentesun
gel para resolver o “separating” (inferior) y un gel “stacking” (superior) Estos geles tienen diferentes poroBades, pH y fuerza iónica, aunado a esto se utilizandiferentes iones moviles en los buffers de gel y de electrodo.
La
discontinuidad del bufferactúa para concentrar grandes volúmenes de muestra en el gel “stacking”, obteniendo así
una mayor resolución @eutscher, 1990)
.
OBJETIVOS
GENERAL
Obtención y caracterización, en base al
peso
molecular, de péptidos obtenidos a uartk de la recuucración de ~ k e i m de SubDroductos de la 'ndustna -peSquera mediante la ahidrólisis e&mhtica conAl
A
ase8ESPECÍFICOS:
.
Caracterización enzimática de ALCALME @ en términos
de
pii,temperatura y
tiempo,
utilizando como substrat0un
homogeneizado de desechos de la industria pesquera.Caracterización bromatológica general de un homogeneizado de desechos de la industria pesquera.
Separación y caracterización en base a pesos moleculares de los péptidos obtenidos.
Proponer usos alternativos para las diferentes fracciones peptídicas
ME TO DO LOG^
ANALISIS BROMATOL~GICO
El
análisis bromatológico de las muestras de desecho de pescado (DP), se efectuaron deacuerdo a métodos oficiales Los análisis practicados fueron determinación de Nitrógeno Total por el método de weldah1 de acuerdo con el A O A C (1970); c o a i d o de grasa de
acuerdo a la norma de calidad NMX-F-89-S-1978,
cenizas
con la NMX-F-66-S-1978, yhumedad con la norma NMX-116-SSAI-1994
.
PREPARACIÓN DE
SUSTRATOS:
a) Hemoglobina
como
sushato alternoSe preparó una solución de hemoglobina ai 2%, disolviendo con agitación suave, 5 g de
hemoglobina (Worthington Biochemical Corp ) en una solución de 80 g de
urea
en 80ml
de agua Posteriormente se incubo a 37°C por 1 h, se ajusto el pH
según
el experimento arealizar, con buffer universal O O5
My
se aforó a un volumen de 250mL
(Beynon,1989)b) Desecho de pescado:
Se
fileteb
athobtenido
en la Central de Abastos de la Nueva Viga.El
desecho del fileteado fue triturado y homogenizado en una picadora Osteiizer, empacado ai vacío (lotes200 g) y congelado (-ZOOC) hasta su uso
PREPARACIÓN DE LA SOLUCI()N DE ENZIMA:
La solución enzimática se preparó diluyendo en agua destilada la enzima Alcaiase @,
obtenida de las industrias Novo Nordisk, en una presentación granular con una actividad declarada de 3.0 AU/g.
1. TRABAJOS PREVIOS REALE.4DOS
EN
HEMOGLOBMATodos los análisis fueron realizados por triplicado.
1 .-