UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA
La Universidad Católica de Loja
ÁREA BIOLÓGICA
TÍTULO DE INGENIERO QUÍMICO
Evaluación y determinación de la calidad del agua en las piscinas de la
camaronera Boca Salima, para el mejoramiento de la producción de
Camarón.
TRABAJO DE TITULACIÓN
AUTOR:
Ramírez Mora, Ana Gabriela
DIRECTOR:
Aguilar, Silvio David, Mgtr
Esta versión digital, ha sido acreditada bajo la licencia Creative Commons 4.0, CC BY-NY-SA: Reconocimiento-No comercial-Compartir igual; la cual permite copiar, distribuir y comunicar públicamente la obra, mientras se reconozca la autoría original, no se utilice con fines comerciales y se permiten obras derivadas, siempre que mantenga la misma licencia al ser divulgada. http://creativecommons.org/licenses/by-nc-sa/4.0/deed.es
ii
APROBACIÓN DEL DIRECTOR DEL TRABAJO DE TITIULACIÓN
Magister.
Silvio David Aguilar.
DOCENTE DE LATITULACIÓN
De mi consideración:
El presente trabajo de fin de titulación: Evaluación y determinación de la calidad del agua en las piscinas de la camaronera Boca Salima, para el mejoramiento de la producción de camarón, realizado por Ramírez Mora Ana Gabriela, ha sido orientado y revisado durante su ejecución, por cuanto se aprueba la presentación del mismo.
Loja, Diciembre de 2015.
iii
DECLARACIÓN DE AUTORÍA Y CESIÓN DE DERECHOS
“Yo Ana Gabriela Ramírez Mora declaro ser autora del presente trabajo de fin de titulación: “Evaluación y determinación de la calidad del agua en las piscinas de la camaronera Boca Salima, para el mejoramiento de la producción de camarón”, de la Titulación de Ingeniería Química, siendo Mgtr. Silvio David Aguilar director del presente trabajo; y eximo expresamente a la Universidad Técnica Particular de Loja y a sus representantes legales de posibles reclamos o acciones legales. Además certifico que las ideas, conceptos, procedimientos y resultados vertidos en el presente trabajo investigativo, son de mi exclusiva responsabilidad.
Adicionalmente declaro conocer y aceptar la disposición del Art.88 del Estatuto Orgánico de la Universidad Técnica Particular de Loja que en su parte pertinente textualmente dice: “Forman parte del patrimonio de la Universidad la propiedad intelectual de investigaciones, trabajos científicos o técnicos y tesis de grado que se realicen a través, o con el apoyo financiero, académico o institucional (operativo) de la Universidad”
1
DEDICATORIA
Quiero dedicarles este trabajo a mis Padres por apoyarme incondicionalmente
durante estos largos años de estudio. En especial a mi esposo e hijos por su ayuda y
constante cooperación, a mis hermanos Tayron y Josué, por su compañía, ya que sin el apoyo
y esfuerzo de ellos no hubiese sido posible cumplir esta meta.
2
AGRADECIMIENTO
A Dios por haberme dado vida, la fortaleza y sabiduría para culminar con mis estudios. A mis
padres, hermanos y esposo por haber sido el pilar fundamental con sus sabios consejos y
principios para ser una persona de bien.
Al Mgtr. Silvio Aguilar, Ing. Miguel Guamán y al Biol. Francisco Romero por cooperar de
manera significativa con sus consejos y sugerencias, los cuales me sirvieron mucho en la
elaboración de mi proyecto.
3
INDICE DE CONTENIDOS
UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA ... i
APROBACIÓN DEL DIRECTOR DEL TRABAJO DE TITIULACIÓN ... ii
DECLARACIÓN DE AUTORÍA Y CESIÓN DE DERECHOS ... iii
DEDICATORIA ... 1
AGRADECIMIENTO ... 2
INDICE DE CONTENIDOS ... 3
ANEXOS. ... 6
ÍNDICE DE FIGURAS. ... 7
ÍNDICE DE TABLAS ... 8
ABREVIATURAS ... 10
RESUMEN ... 11
ABSTRACT ... 12
INTRODUCCIÓN. ... 13
OBJETIVO GENERAL. ... 14
OBJETIVOS ESPECÍFICOS. ... 14
CAPÍTULO I ... 15
1.1. Fertilización. ... 16
1.1.1. Fertilizantes Inorgánicos. ... 16
1.1.2. Fertilizantes Orgánicos. ... 17
1.2. Bacterias más comunes en el agua de piscinas camaroneras. ... 17
1.3. Parámetros a considerar para el cultivo de camarón... 18
1.3.1. Nitritos y Nitratos. ... 18
1.3.2. Oxígeno Disuelto. ... 18
1.3.3. Amonio. ... 18
1.3.4. Calcio. ... 19
1.3.5. Magnesio. ... 19
1.3.6. Manganeso. ... 19
1.3.7. Cobre. ... 19
1.3.8. Potasio. ... 19
1.3.9. Plomo. ... 20
1.3.10. Fósforo. ... 20
1.3.11. pH:... 20
1.4. Alimentación. ... 21
4
2.1. Área de Estudio. ... 23
2.2. Procesos Operativos. ... 26
2.3. Metodología. ... 26
2.3.1. Preparación de las Piscinas. ... 26
2.3.2. Fertilización. ... 27
2.3.3. Siembra. ... 28
2.3.4. Control de Análisis Químicos de Agua. ... 29
2.3.5. Alimentación. ... 30
2.3.6. Muestreo. ... 32
2.3.6.1. Muestreo de Crecimiento de camarón. ... 32
2.3.6.2. Muestreo de Sobrevivencia. ... 32
2.3.7. Determinación de la Biomasa. ... 33
2.3.8. Control de Depredadores. ... 34
2.3.9. Cosecha. ... 34
2.4. Análisis Microbiológico. ... 35
2.4.1. Recuento de microorganismos empleando el Sistema Petri film. ... 35
2.4.2. Recuento de Microorganismos. ... 36
2.5. Materiales. ... 36
2.6. Equipos e Instrumentos. ... 37
2.7. Reactivos. ... 37
2.8. Recursos Informáticos y Estadísticos. ... 37
2.9. Preparación de las Muestras. ... 37
CAPÍTULO III ... 40
3.1. Caracterización microbiológica y físico-químico del agua de las piscinas camaroneras A, B, C. ... 41
3.1.1. Análisis del agua por Etapas ... 41
3.1.1.1. Larvaria. ... 41
3.1.1.2. Juvenil. ... 42
3.1.1.3. Engorde... 42
3.1.1.4. Cosecha. ... 43
3.1.2. Análisis microbiológico del agua en las piscinas camaroneras. ... 43
3.1.3. Recuento de microorganismos mediante los dos tratamientos empleados en la piscina con Fertilizante Orgánico e inorgánico. ... 44
5
3.2. Análisis de Producción. ... 62
3.3. Relación Costo- beneficio. ... 64
3.4. Análisis comparativo de Resultados con los Límites permitidos de acuerdo a la Fundación Sociedad Latinoamericana de Acuacultura. ... 66
CONCLUSIONES. ... 70
RECOMENDACIONES. ... 71
BIBLIOGRAFÍA. ... 72
6
ANEXOS.Anexo 1. Espectrofotómetro de absorción atómica. ... 75
Anexo 2. Focos Utilizados para cada elemento. ... 75
Anexo 3.Análisis de la Solución estándar. ... 76
Anexo 4.Análisis de la solución de la muestra de agua proveniente de la camaronera. ... 76
Anexo 5. Encerado mediante agua destilada. ... 77
Anexo 6. Espectrofotómetro UV-visible. ... 77
7
ÍNDICE DE FIGURAS.
FIGURA 1. Ubicación de las piscinas donde se realizó las prácticas. ... 23
FIGURA 2: Piscina 1 Con Fertilizante Orgänico ... 24
FIGURA 3: Piscina 2 Con Fertilizante Inorganico ... 25
FIGURA 4: Piscina 3 Control. ... 25
FIGURA 5. Proceso Operativo. ... 26
FIGURA 6. Recuento de Aerobios Totales en los 2 tratamientos. ... 45
FIGURA 7. Recuento de Coliformes Totales en los 2 tratamientos. ... 45
FIGURA 8. Recuento de Enterobacterias totales y Escherichia coli en los 2 tratamientos ... 46
FIGURA 9.Recuento de Escherichia coli en los 2 tratamientos. ... 47
FIGURA 10. Recuento de Mohos y Levaduras en los 2 Tratamientos. ... 48
FIGURA 11.Recuento de Pseudomonas aeruginosa en los 2 Tratamientos. ... 48
FIGURA 12. Variación de Nitritos. ... 50
FIGURA 13. Análisis de variación de Nitratos. ... 51
FIGURA 14. Variación de Amonio. ... 52
FIGURA 15. Variación de Oxígeno Disuelto. ... 53
FIGURA 16. Variación de Calcio. ... 54
FIGURA 17. Variación de magnesio. ... 55
FIGURA 18.Variación de Manganeso. ... 56
FIGURA 19. Variación de Cobre. ... 57
FIGURA 20.Variación de Potasio. ... 58
FIGURA 21. Variación de Plomo. ... 59
FIGURA 22. Variación de Fósforo. ... 60
FIGURA 23. Variación de pH. ... 61
FIGURA 24. Rendimiento. ... 63
FIGURA 25. Rendimiento en porcentaje Camarón. ... 65
8
ÍNDICE DE TABLAS
Tabla 1. Condiciones de crecimiento sugeridas y color de las colonias de algunos
microorganismos indicadores de contaminación. ... 18
Tabla 2. Composición porcentual de fertilizantes inorgánicos utilizados en la acuacultura. . 28
Tabla 3. Análisis a realizar en las dos piscinas ... 30
Tabla 4. Alimentación. ... 31
Tabla 5. Condiciones estándar recomendadas para determinación de absorbancia mediante espectrofotometría de absorción atómica. ... 38
Tabla 6. Análisis del agua en etapa Larvaria. ... 41
Tabla 7. Análisis en etapa juvenil ... 42
Tabla 8. Análisis en etapa de engorde ... 42
Tabla 9. Análisis de la etapa de cosecha. ... 43
Tabla 10. Positivos para presencia de microorganismos en las muestras de agua provenientes de la camaronera con fertilizante Orgánico. ... 43
Tabla 11. Positivos para presencia de microorganismos en las muestras de agua provenientes de la camaronera con Fertilizante Inorgánico. ... 44
Tabla 12. Recuento de Aerobios Totales y Coliformes Totales. ... 44
Tabla 13. Recuento de Enterobacterias Totales y Escherichia Coli. ... 46
Tabla 14. Recuento de Mohos y levaduras y Pseudomonas aeruginosa. ... 47
Tabla 15. Variación de Nitritos ... 50
Tabla 16. Análisis de Nitratos. ... 51
Tabla 17. Análisis de Amonio. ... 52
Tabla 18. Variación de Oxígeno Disuelto. ... 53
Tabla 19. Variación de Calcio. ... 54
Tabla 20. Variación de Magnesio. ... 55
Tabla 21. Variación de Manganeso. ... 56
Tabla 22. Variación de Cobre. ... 57
Tabla 23. Análisis de Potasio. ... 58
Tabla 24. Variación de Plomo. ... 59
Tabla 25. Variación de Fósforo. ... 60
Tabla 26. Variación de pH. ... 61
Tabla 27. Rendimiento semanal de acuerdo al peso en libras de los camarones. ... 63
Tabla 28: Rendimiento en Porcentaje del Camarón. ... 64
9
10
ABREVIATURAS
TAN Total de Nitrógeno Amoniacal. pH Potencial de hidrogeno.
UPS Unidades Prácticas de Salinidad.
Ca Calcio
Mg Magnesio
Fe Hierro
Mn Manganeso
Cu Cobre
k Potasio
Pb Plomo
P Fosforo
CENAIM Centro Nacional de Acuicultura e Investigaciones Marinas
FAO Organización de las naciones Unidas para la Alimentación y la Agricultura
UFC/mL Unidades formadoras de colonia por mililitro N-NO2 Nitritos
N-NO3 Nitratos
UO Unidad Observacional
TS-FF-AAS Thermospray flame furnace atomic absorption spectrometry OD mg/Lt Oxígeno Disuelto (miligramos por litro)
11
RESUMENEl objeto de este trabajo de tesis fue realizar el análisis y control de la calidad del agua y su relación con la producción de camarón. Para este estudio se seleccionaron tres piscinas camaroneras de Boca Salima, ubicadas en la Parroquia Salima, Cantón Muisne, Provincia de Esmeraldas, estas piscinas cuentan con una superficie de dos hectáreas en las cuales, a la primera se le aplicó un tratamiento de fertilización orgánica, una segunda con un tratamiento de fertilización inorgánica y la tercera piscina control sin ningún tipo de tratamiento. Se realizó la medición de parámetros físico-químicos y microbiológicos del agua y la evaluación de crecimiento, durante los 120 días del ciclo de cultivo del camarón con una frecuencia quincenal de los parámetros considerados. Como resultado de este estudio se determinó que la aplicación de fertilizantes a las piscinas produce cambios muy importantes en la calidad del agua y producción del camarón lográndose incrementar en un 38% la producción con la aplicación de fertilización inorgánica y 107% cuando se aplicó fertilización orgánica.
12
ABSTRACTThe purpose of this thesis was the analysis and control of water quality and its relation to shrimp production. For this study, three shrimp ponds Boca Salima, located in Salima, Canton Muisne, Esmeraldas Province, Parish these pools have a surface of two hectares in which, the first was applied a treatment of organic fertilization were selected, a second treatment with inorganic fertilizer and the third pool control without any treatment. Measurement of physical, chemical and microbiological parameters of the water and the growth assessment was performed during the 120-day cycle of shrimp farming fortnightly parameters considered. As a result of this study it was determined that the application of fertilizers pools produce major changes in water quality and shrimp production being achieved increase by 38% the production with the application of inorganic fertilizer and 107% when organic fertilizer was applied .
13
INTRODUCCIÓN.
El cultivo de camarón ha sido y es una de las actividades más importantes para la economía del Ecuador, Sin embargo, dada la extensión de la actividad, se ha visto colapsada por problemas de diversa índole, considerando actualmente factores prioritarios: las enfermedades del camarón durante el cultivo y el manejo de la calidad del agua y suelo (Cruz-Barreras, 1998).
Sin embargo, a pesar de la amplia conciencia sobre la producción eficiente de camarones, que depende de un medio ambiente de alta calidad, los productores por lo general no tienen un adecuado conocimiento de la buena calidad del agua, ni de cómo manejar las piscinas camaroneras, a fin de prevenir o reducir estos problemas (Boyd y Tucker, 1992). Lo que no ha permitido alcanzar los niveles de calidad y cantidad que son particulares en el camarón ecuatoriano.
Esta falta de información sobre relaciones físico-químicas del agua con producción dificultan muchas veces la interpretación de análisis químicos del agua (Boyd, 1995). Los suelos del fondo de las piscinas son depósito de muchas sustancias que se acumulan en el ecosistema de un cultivo y la concentración de las mismas se encuentra influenciada por las prácticas de manejo (fertilización orgánica e inorgánica), concentración de sales y otros compuestos que ingresan con el agua de llenado. Las variables de suelo que han sido mayormente estudiadas y sobre las cuales se conoce el efecto directo de estos sobre la calidad de agua y salud del cultivo son la concentración de azufre total, nitratos, nitritos y pH.
14
FIN DEL PROYECTO:Contribuir con la comunidad del sector camaronero a mejorar los niveles de producción determinando la influencia de los fertilizantes en la calidad del agua.
OBJETIVO GENERAL.
Evaluar la calidad del agua y la producción de camarón en piscinas de cultivo comparando la diferencia utilizando fertilización orgánica frente a fertilización inorgánica en la camaronera Boca Salima, ubicada en la Parroquia Salima, Cantón Muisne, Provincia de Esmeraldas.
OBJETIVOS ESPECÍFICOS.
Determinar la calidad del agua en los sistemas con respecto al ciclo de vida del camarón.
Comparar la producción de camarón en piscinas con fertilización orgánica vs fertilización inorgánica.
16
1.1. Fertilización.Una de las metas de la fertilización tanto orgánica como inorgánica es incrementar la producción de animales acuáticos a través del mejoramiento de la actividad autotrófica y heterotrófica, manteniendo Fito planctónicos para promover adecuados niveles de oxígeno (Lin et al. 1997) Fósforo y Nitrógeno son los elementos más importantes para aumentar la abundancia de micro algas. Smith (1984). Indicó que la fertilización con nitrógeno a menudo es considerada más importante en aguas salobres que en aguas dulces. Daniels y Boyd (1993) señalaron que altas tasas de N: P en fertilizantes favorecen la producción de diatomeas en las comunidades Fito planctónicas de agua salobre sin influir en la abundancia total y no mostró diferencias en las concentraciones de amonio debido posiblemente a procesos de nitrificación, de nitrificación y volatización (Cervigon, 1983, pág. 123).
En Ecuador, es común la utilización de fertilizantes de tipo inorgánicos los cuales son compuestos que contienen nitrógeno, fosforo y potasio y metales pesados, solos o en combinación. Otra forma de fertilizantes son las excretas de animales y desechos de agricultura que son principalmente materia orgánica con bajos porcentajes de nutrientes (Boyd 1989).
Los fertilizantes utilizados con mayor frecuencia son; urea, nitrato de sodio y nitrato de amonio como fuente de nitrógeno y superfosfatotriple como fuente de fósforo. Las tazas de fertilización oscilan entre 10 y 20 kg/ha/ciclo para nitrógeno y 1-4 kg/ha/ciclo para fósforo. De forma general las piscinas son fuertemente fertilizadas en un inicio para favorecer el establecimiento de comunidades fitoplanctonicas.
Es importante considerar ¿para qué fertilizamos?, pues cuando aumentamos la productividad primaria, directa o indirectamente se aumenta la alimentación del camarón. Los fertilizantes son aplicados a las piscinas, para incrementar la concentración de nutrientes inorgánicos, favorecer el crecimiento de fitoplanton y así aumentar la producción de camarón.
1.1.1. Fertilizantes Inorgánicos.
17
1.1.2. Fertilizantes Orgánicos.Son compuestos orgánicos que aportan Nitrógeno, Fósforo, Potasio como fertilizante para las algas, liberando gradualmente nutrientes que sirven de alimento directo al zooplancton. Dentro de este grupo, se incluyes también al alimento balanceado; el cual indirectamente (ya sea como la porción no consumida o como la excreta del camarón) sirve como fertilizante.
La fertilización tanto orgánica como inorgánica puede aumentar considerablemente la producción de camarones. En las piscinas de cultivo semi-intensivo o intensivo el camarón utiliza una considerable parte de alimento natural. Aunque no está totalmente claro que porcentaje del crecimiento del camarón proviene del medio ambiente natural (Boyd 1989), se asume en general que la mayor parte de las vitaminas y minerales, así como algunos de los aminoácidos esenciales y ácidos grasos El análisis microbiológico forma parte de la bromatología, ciencia que también está integrada por el análisis toxicológico y el análisis químico. La investigación microbiológica que se realiza en torno a los alimentos, y calidad de agua que se destinan al consumo animal también es aplicada a la materia prima que se usa con el mismo fin, por lo que su funcionalidad e importancia es hoy en día imprescindible en esta industria.
El manejo adecuado de la calidad de agua de las piscinas, representa un papel fundamental para el éxito de las distintas operaciones para la crianza de camarón. Cada elemento que incide en la calidad del agua de forma individual puede afectar directamente en la salud del camarón; consecuentemente, la exposición de camarones a niveles inadecuados de oxígeno disuelto, amoníaco, nitritos o sulfuro de hidrógeno conlleva a enfermedades y estrés.
1.2. Bacterias más comunes en el agua de piscinas camaroneras.
Las bacterias predominantes en aguas de piscinas camaroneras son de género Vibrio como el Vibrio parahaemolyticus, Vibrio Harvey y alginotycus y los géneros Aeromonas y Pseudomonas (Sung et al., 1999.) Estas bacterias se encuentran en aguas con amplios rangos de salinidad, en el suelo o dentro de la flora intestinal de los camarones. En Ecuador, Bayot et al. (2011) reportan concentraciones de bacterias totales en la columna de agua de piscinas con P. vannamei de 1x104 a 1x106 UFC/100mL y datos no publicados del CENAIM
18
UFC/100mL. Normalmente, las concentraciones bacterianas son más altas en los sedimentos debido a un mayor contenido de materia orgánica (Rao y Karunsagar, 2000).
Tabla 1. condiciones de crecimiento sugeridas y color de las colonias de algunos microorganismos indicadores de contaminación.
Microorganismos Medio de
Cultivo
Temperatura incubación
Tiempo de incubación
Color de las Colonias
Coliformes totales Endo 35°C 24 h
Rojo con brillo metálico en
superficie
Coliformes fecales MacConkey 44.5°C 24 h Matices de azul
Enterococcus faecalis MacConkey 41°C 48 h Marrón
Escherichia coli BRILA Caldo 44.5°C 24 h Blanco Crema
Pseudomas
aeruginosa Cetrimida 37°C 72 h Verde
Fuente: (Araujo, 2008)
1.3. Parámetros a considerar para el cultivo de camarón.
1.3.1. Nitritos y Nitratos.
Los fertilizantes a base de nitratos tienen la ventaja de no causar una reacción ácida en el agua ni consumir oxígeno en la nitrificación, además de que no incrementan inmediatamente el amonio en el agua. Su desventaja principal es el mayor costo por unidad de nitrógeno, Los rangos para nitritos deben estar por debajo de 0,1 ppm, y de nitratos entre 1,70 y 3,10 ppm (Boyd, C.E. 1990).
1.3.2. Oxígeno Disuelto.
Es uno de los parámetros más importantes en la cría de camarones; el grado de concentración de este elemento es una variable dependiente tanto de la temperatura, salinidad y materia orgánica e inorgánica. La concentración mínima de oxígeno disuelto que puede ser tolerada por un camarón varía con la talla y el tiempo de exposición. Rangos de 3 a 9 partes por millón medidos en horas de la madrugada y de la tarde respectivamente.
1.3.3. Amonio.
19
(en la presencia de oxígeno) y anaeróbicas (en la ausencia de oxígeno), los cuales son descompuestos principalmente por bacterias
1.3.4. Calcio.
El aplicar carbonato de calcio en aguas de piscinas para solucionar problemas del agua no es una buena medida. El carbonato de Calcio no se disuelve con alcalinidades mayores a 60 mg/l (Boyd & Daniels, 1993, Boyd 1995), e incluso con alcalinidades menores no se disuelve a salinidades mayores a 1ppt (Boyd, 1995),
1.3.5. Magnesio.
El magnesio se encuentra en las aguas naturales como Mg2+, y junto con el calcio contribuye a la dureza del agua. El magnesio procede principalmente de la meteorización de las rocas que contienen minerales de ferro magnesio y carbonatos. El magnesio también se presenta como un compuesto órgano-metálico puesto que es un elemento esencial para los organismos vivos. (Monserrate, 2003.)
1.3.6. Manganeso.
Requeridos en pequeñas cantidades para el crecimiento de las algas como son Calcio, Magnesio, Azufre, Boro, Hierro, Cobre, Manganeso, Zinc, Cobalto y Molibdeno, pero estos generalmente se encuentran en suficiente cantidad en el agua estearina (Boyd, 1995).
1.3.7. Cobre.
Se usa como tratamiento químico para el control de infestaciones de caracoles. De esta manera, la evaluación de su efecto a diferentes dosis que van desde los 5 hasta los 25 kg/ha de sulfato de cobre.
1.3.8. Potasio.
20
1.3.9. Plomo.Boyd y Daniels (1993) encontraron mayor porcentaje de diatomeas en tanque de agua salobre fertilizadas con urea que en las que se usó cloruro de amonio o nitrato de plomo.
.
1.3.10. Fósforo.
Es el nutriente más limitante. En agua dulce generalmente el fosfato es el nutriente limitante, mientras que en aguas salobres lo es el Nitrógeno. Villalón (1991) recomienda concentraciones de nitrógeno de 1.3 ppm y de fósforo de 0.15 ppm
1.3.11. pH:
Es una medida de la concentración de iones de hidrógeno e indica si el agua es ácida o básica. El rango óptimo para el camarón fluctúa de 7.2 a 8.2 esto no significa que valores menores o mayores sean letales en una piscina. Una disminución o aumento del pH, está relacionada con cambios en el ambiente físico o biológico de la piscina. (Cervigon, 1983, pág. 123)
Hasta el año 2006 se reportaban 175.748 hectáreas de cultivo de camarón, repartidas en las cuatro provincias costeras del Ecuador (El Oro, Guayas, Manabí y Esmeraldas), actualmente y según datos de la Cámara de Acuacultura, en el primer trimestre del 2014 se exportaron alrededor USD 600 millones de dólares de este crustáceo (Càmara Nacional de Accuacultura, 2014)
21
La acuicultura es el cultivo de organismos acuáticos tanto en zonas costeras como del interior que implica intervenciones en el proceso de cría para aumentar la producción de los mismos, además, constituye probablemente el sector de producción de alimentos de mayor y más rápido crecimiento; actualmente representa casi el 50 % del pescado destinado a la alimentación a nivel mundial (FAO, 2014). Ecuador figura entre los países principales productores del camarón (Penaeus vannamei); de hecho, la industria camaronera ecuatoriana dentro de la actividad económica productiva general, es una de las más importantes junto con la del banano y el petróleo (Gillet, 2010)
1.4. Alimentación.
Las fincas camaroneras tratan de establecer su programa alimenticio evitando tener factores de conversión superiores a 2:1 es decir dos libras de alimento concentrado para obtener una libra de camarón. (Newmark, y otros, 2009). Para tal efecto el factor debe irse ajustando según lo indique el muestreo de crecimiento. Se considera que el camarón debe crecer en forma ideal un gramo por semana, al inicio del ciclo de cultivos menos de 1 gramo/semana; y al final mayor de un gramo/semana; valores promedios de 0.60 gramos /semana nos indica un mal crecimiento(Naranjo, 2006)
23
2.1. Área de Estudio.Figura 1. ubicación de las piscinas donde se realizó las prácticas. Fuente: google earth.
La Camaronera “BOCA SALIMA”, se encuentra ubicada en Boca de Salima – Salima - cantón Muisne, provincia de Esmeraldas en las coordenadas 0.309731 latitud sur y 79.982194 longitud occidental, (Fig. 1). Con una extensión de 12 hectáreas, cuyas instalaciones están ubicadas para facilitar un adecuado control y supervisión, mismas que se enuncian a continuación:
Tres piscinas camaroneras
Un reservorio
Una edificación central
Estación de bombeo
Área de mantenimiento
Área de bodega.
Área administrativa con sus respectivos dormitorios
24
Departamento de seguridad
Cocina central.
[image:28.595.86.556.293.581.2]Para la presente investigación se utilizaron una con fertilizante orgánico “piscina A” y la otra con fertilizante inorgánico “piscina B”, frente a la piscina Control “piscina C”. Cuya superficie total es de 6 hectáreas, el área de cada piscina es de 2 hectáreas cada una (20 m de ancho x 1000 m de largo), con una profundidad aproximada de 1 a 2 m.
25
Figura 3: piscina b 2 con fertilizante inorgánico Fuente: el autor. [image:29.595.86.558.416.674.2]26
2.2. Procesos Operativos.Los procesos operativos que se realizan en la camaronera “Boca Salima”, la cual produce camarones destinados al mercado internacional, debido a la calidad de los mismos, cuenta con los siguientes procesos:
Fuente: el autor
2.3. Metodología.
2.3.1. Preparación de las Piscinas.
Las piscinas de la camaronera para el presente estudio comprenden un tamaño de dos hectáreas cada una, con una profundidad de 0,6 a 0,8 m, con capacidad por período de crianza de 600.000 larvas, de las cuales, un determinado porcentaje, muere debido a algunos factores no controlables.
INICIO
Preparación de piscinas
FERTILIZACION A FERTILIZACION B
SIEMBRA
MUESTREO DE CRECIMIENTO Y SOBREVIVENCIA
CONTROL DE ANALISIS QUIMICOS DE AGUA
ALIMENTACIÓN
DETERMINACIÓN DE LA BIOMASA
CONTROL DE DEPREDADORES
[image:30.595.203.446.191.580.2]COSECHA
27
Inicialmente los fondos de las tres piscinas son sometidos al proceso de rastrillado, secado y desinfección con cal, para asegurarse que estén libres de microorganismos depredadores o competidores del camarón y vegetación. Si quedan posas de agua, estas deberán ser tratadas con cal en una concentración de 1 saco por cada 10 m2.
2.3.2. Fertilización.
Para el presente estudio se trabajará con dos piscinas una con aplicación de fertilizantes orgánicos y la otra con fertilización inorgánica
.
a. Fertilizantes Orgánicos: Se Utilizó estiércol de gallinas, cerdos, ganado. A salinidades (34.1-34.4 UPS) se recomienda niveles de fertilizantes orgánicos de 100 kilogramos/hectárea.
La fertilización con fertilizantes orgánicos debe realizarse del siguiente modo:
Se seca el fondo de la piscina hasta que se agriete.
Se pasa una rastra en el fondo para removerlo.
Se incorpora el fertilizante. (estiércol de gallina, cerdos y ganado)
Se sube el nivel de agua entre 10 y15 centímetros para que se lleven a cabo las reacciones necesarias de descomposición y liberación de nutrientes.
Después de un tiempo prudencial, 5 días más o menos, se sube a 30 centímetros el nivel.
Cabe recalcar que esta fertilización se aplicará a la piscina A, posteriormente se agregará la bacteria, quedando listas la piscina para la siembra.
Preparación de la Bacteria. En un tanque con 1.000 litros de agua, se agrega la bacteria Bc7 en polvo, luego adiciona un tanque de 20 litros de melaza, posteriormente se agrega 5 kilos de Nutrilake y finalmente se tapa con plástico totalmente hasta que la bacteria se active por un período de 48 horas.
28
Tabla 2. composición porcentual de fertilizantes inorgánicos utilizados en la acuacultura. COMPOSICION DE MATERIALES DE FERTILIZANTES INORGANICOS. Sustancia CONTENIDO EN PORCENTAJE Nombre Comercial
Nitrato de Amonio 20 Nitrato de amonio
Sulfato de Amonio 15 Sulfato de Amonio
Nitrato de Calcio 13 Nitrato de calcio soluble
Fosfato de Amonio 10 Fosfato difásico de amonio
Nitrato de sodio 12 Nitrato de sodio
Supertrifosfato 30 Superfosfato triple
Fuente: (El autor)
La fertilización inorgánica se realiza del siguiente modo:
Se seca el fondo de la piscina hasta que éste se agriete.
Posteriormente se pasa una rastra en el fondo de la piscina para removerlo.
Se incorpora el fertilizante inorgánico mostrado en la tabla 3 en la piscina B. Aplicando generalmente cada dos semanas (Superfosfato triple 20 Kg./Ha; cada dos semanas, Nitrato, sulfato y fosfato de amonio, 15 - 25 Kg. /Ha; cada dos semanas, Nitrato de calcio, 20 Kg. /Ha más y nitrato de sodio, 15 Kg. /Ha; cada semana)
El nivel de agua se sube entre 10 y 15 centímetros para que se lleven a cabo las reacciones necesarias de descomposición y liberación de nutrientes.
Después de un tiempo prudencial, 5 días más o menos, se sube a 30 centímetros el nivel del agua.
2.3.3. Siembra.
El proceso de siembra comprende el depósito de las larvas en las piscinas, sin embargo, en esta etapa se puede presentar una pérdida del producto, ya que, no todas las larvas que se “siembran” llegan a la edad adulta, antes de realizar la siembra en cada piscina, se realiza un análisis físico-químicos del agua y luego de la siembra se realiza un monitoreo de los parámetros con una periodicidad semanal, hasta cumplir con el periodo de cosecha.
29
piscinas A, B y C respectivamente, las cuales fueron fertilizadas con anterioridad, adicionalmente se calculó el sistema volumétrico según la densidad deseada:
�ú � �� � =�ú � � �× �
Para lo cual se utiliza 600.000 larvas para cada piscina, considerando que sufren en promedio, un nivel del 26% de mortalidad. Además se registra en un informe de siembra el nombre del laboratorio de donde se obtiene la semilla, los parámetros físicos- químicos de las piscinas, así como la hora inicial y final de siembra, El registro técnico de dichos detalles es importante para el estudio posterior de la piscina en cultivo.
2.3.4. Control de Análisis Químicos de Agua.
En esta fase es recomendable medir los parámetros de oxígeno, Salinidad, Temperatura, turbidez y el pH diariamente. Las lecturas de oxígeno se realizan entre las 5:H00 y 6:H00 de la mañana, 12:H00 del día 16H00 y 17:H00 de la tarde, para poder registrar los máximos y mínimos niveles. La calidad del agua de las piscinas para cultivo de camarones, es quizás la parte más importante y a la vez la que más se desconoce. Se tomó una muestra inicial antes de colocar las larvas de camarón con el objetivo de conocer las características del agua en condiciones normales. Se tomó como referencia las diferentes etapas del ciclo de vida del camarón para el muestreo y se tomaron muestras de agua en cada una de ellas. Es decir se tomaron muestras a los 0, 40, 80 y 120 días.
La toma de muestras para el análisis de laboratorio se realiza de cada una de las piscinas de estudio, en una de las cuales se utiliza fertilizante orgánico y en la otra, fertilizante inorgánico, con el fin de determinar la calidad del agua de la camaronera Boca Salima. Además, se realizó un monitoreo de los parámetros: pH, Nitritos, Nitratos, Amoniaco, Amonio, OD, Mn, Cu, K, Pb, P, Ca, Mg. tendrán una frecuencia semanal o quincenal dependiendo del análisis requerido. Para el análisis microbiológico se utiliza las placas Petri film que son placas preparadas, es decir no requiere más que la inoculación de la muestra, incubación y lectura. En esta ocasión, se emplearán para el recuento de coliformes y Escherichia coli.
30
Tabla 3. análisis a realizar en las tres piscinas a, b, cParámetro Método Analítico
Nitritos Standard Methods, Ed 20 (4500-NO2 B)
Nitratos Standard Methods, Ed 20(4500-NO3 B)
OD Yodo métrico
Amonio Standard Methods, Ed 20 ( 3500 Fe-B )
Calcio Standard Methods, Ed 20 ( 3113 B )
Magnesio Standard Methods, Ed 20 ( 3113 B )
Potasio Standard Methods, Ed 20 (3111 B)
Manganeso Standard Methods, Ed 20 ( 3113 B y C)
Cobre Standard Methods, Ed 20 ( 3113 B )
Plomo Standard Methods, Ed 20 ( 3111 B y C )
Fosforo Standard Methods, Ed 20(4500-NO3 B)
pH Standard Methods, Ed 20 (4500HB)
Aerobios Totales Standard Methods, Ed.20 (9215B)
Coliformes Totales Standard Methods, Ed.20 (9222B y 9223)
Entero bacterias Totales Standard Methods, Ed.20 (9215B)
E. Coli Standard Methods, Ed.20 (9223)
Mohos Standard Methods, Ed.20 (9222D y 9222G)
Levaduras Standard Methods, Ed.20 (9222D y 9222G)
Pseudomonas aeruginosa Standard Methods, Ed.20 (9213F) y Norma UNIT 942:1994,
943:1994 Fuente: el autor
2.3.5. Alimentación.
El cultivo comercial del camarón se basa en el sistema extensivo, en este caso los camarones se siembran a bajas densidades, se aprovecha todo el alimento natural con que cuenta la piscina para soportar la población, sin embargo, con el propósito de aprovechar aún más el espacio y aumentar la producción con el uso de alimentación complementaria en forma de pellets. Un buen alimento paletizado debe ser estable y demorar en disolverse en el agua para que el camarón lo pueda aprovechar. En este sentido se seleccionó 6 unidades de muestreo de cada piscina es decir de cada tratamiento. Dos de ellas cercanas a los bordes de la piscina, otras dos cercanas a los cúmulos donde se coloca el alimento para los camarones y finalmente dos de ellas en zonas intermedias entre las anteriores a una profundidad considerable, que varió entre 1 y 2 metros de profundidad.
31
Tabla 4. alimentación.Elaborado por: el autor
CHAMP= Balanceado marca Champion.
Ha= Hectárea
El alimento va desde 20 - 22 - 27 - 28 - 32 - 35 % de proteína. Esto sería en la primera semana ½ kg por hectárea, en la segunda semana 1 kg por hectárea, en la tercera semana 2kg por hectárea, en la cuarta semana 4 kg por hectárea etc. Cuando el camarón pese de 7gr en adelante se debe subministrar el 27% de balanceado de engorde.
El método que se utiliza para determinar la cantidad de alimento se basa en un porcentaje del peso corporal de la biomasa de camarones en las piscinas Este porcentaje inicialmente es de 25% para los juveniles y disminuye el 3% al momento de la cosecha. El programa de alimentación inicia una semana después de sembrado la piscina, pero si la misma ha sido previamente fertilizada, entonces el muestreo de crecimiento indicara cuando comenzar a alimentar con una ración balanceada.
Por tanto, se evita tener factores de conversión superiores a 2:1 es decir dos libras de alimento concentrado para obtener una libra de camarón. Para tal efecto el factor debe irse ajustando según lo indique el muestreo de crecimiento.
�� � � � � � � � �
= �ú a� × Pe�o ��omed�o del al�men�o × % de ��o�eína.
Densidad: Hectárea 600.000 2 Larvas Ha. Edad En días Peso de larvas (gr) Sobrevivencia en (%) Biomasa Actual (kg) Tipo de alimento Consumo de alimento (Kg/día) Crecimiento semanal (gr)
1 0,006 100,0 0,60 CHAMP. 0,72
7 0,03 95,0 1,90 CHAMP. 2,74 0,020
15 0,50 85,0 42,50 CHAMP. 102,00 0,235
30 1,50 70,0 105,00 CHAMP. 104,00 0,350
40 4,00 65,0 260,00 CHAMP. 145,60 0,710
50 5,50 62,5 343,75 CHAMP. 108,28 0,780
60 6,70 60,0 402,00 CHAMP. 88,44 0,784
70 7,90 57,0 454,25 CHAMP. 92,21 0,790
80 9,10 55,0 500,50 CHAMP. 95,59 0,796
90 10,30 52,5 540,75 CHAMP. 98,43 0,800
100 11,50 50,0 575,00 CHAMP. 96,70 0,806
32
Ejemplo:Número de Camarones: 600.000 larvas. Peso Promedio: 0.006 gr
% de proteína = 20 %
�� � � � � � � � � = . × . ×
�� � � � � � � � � = � = . � � .
2.3.6. Muestreo.
2.3.6.1. Muestreo de Crecimiento de camarón.
El muestreo se inicia a los 15 días de sembrado totalmente, con un muestreo previo de especies, con el fin de determinar los porcentajes de población de cada piscina y la biomasa del camarón. Para ello se emplea una red de amarre de 10 a 15 pies de largo, con ojo de malla no mayor de 1/20” hasta que la población más chica alcance 1.5 gramos y pueda entonces ser atrapada por la atarraya. Se lleva a cabo en cuatro diferentes puntos de las piscinas tratando de obtener camarones que representen las diferentes categorías de tamaños (sub .poblaciones) de las especies presentes en las piscinas. La cantidad de camarones recomendada para el muestreo de crecimiento va de 20 a 25 por piscina. Los muestreos de crecimiento se realizan de forma constante, es decir, cada 15 días.
2.3.6.2. Muestreo de Sobrevivencia.
Este muestreo se lo realiza en las primeras etapas del cultivo con ayuda de una malla fina. La mayoría de las opiniones coinciden en que el primer muestreo de sobrevivencia debe realizarse de los 20 a los 30 días de sembrado totalmente la piscina. La atarraya tiene un peso de 4 libras en plomo, una dimensión aproximada de 90cm. y la parte más importante el ojo de la malla debe ser de ¼ de pulgada. Donde realizaré de 6 a 7 atarrayadas por hectárea.
33
� = � �Dónde:
A = área de la atarraya
� = Pi, constante igual 3.1416
r² = Dimensión del radio de la atarraya al cuadrado y expresado en metros.
2.3.7. Determinación de la Biomasa.
En este caso la biomasa se refiere al peso estimado de camarones en las piscinas A y B en función del crecimiento del camarón, esta determinación se realiza semanalmente desde la etapa de larvas hasta adultos durante 13 semanas y excluye a todas las demás especies ya sea peces y otros organismos que pudiesen estar en las piscinas. Para la estimación de la biomasa del camarón se utiliza la siguiente formula:
B = C x Ppi
Dónde:
B: Es la biomasa expresada en kilogramos o en libras. C: Es el número total de camarones.
Ppi: Es el peso promedio por especie.
Crecimiento: Se lanza la atarraya desde los muros de la piscina hasta completar alrededor de 50 camarones para luego analizar.
Peso promedio.
Salud.
Características generales (muda y similares)
Enfermedades, lesiones, anormalidades.
Poblacional: Se divide la hectárea en 4 o 8 imaginariamente y se lanza como una vez por cuadrícula para analizar los datos obtenidos.
Número de sobrevivientes
Distribución en la piscina
34
2.3.8. Control de Depredadores.La forma principal de controlar estos animales depredadores en la piscina es a través de un sistema de mallas que impida la entrada de especies indeseables. Al iniciar el periodo de cultivo, las mallas deben tener un máximo de 1/16” de abertura y ser colocadas en número no inferior a dos, tanto en la compuerta de entrada como en la salida, de tal forma que no escape el camarón ni entren competidores o depredadores. Las mallas deben ser limpiadas regularmente para facilitar el recambio de agua, además deben poseer un refuerzo para evitar que la presión de agua las rompa. De igual modo, deben ser reemplazadas en caso de roturas, las mallas pueden ser sustituidas por otras de mayor abertura a medida que el camarón va creciendo; esto se hace con el objeto de agilizar el paso del agua hacia y desde la piscina Los depredadores más importantes son algunos pájaros, como las garzas y el Martín pescador. Se pueden utilizar mallas especiales para proteger las piscinas de la depredación por pájaros. Por el elevado costo de compra e instalación de estas mallas, son útiles solamente en cubrir piscinas pequeños, no más de unos pocas hectáreas de extensión (Naranjo, 2006)
2.3.9. Cosecha.
La cosecha se la efectúo en base a las mareas y la cúspide del aguaje, tratando de que el vaciado sea completo de las piscinas de modo que todo el camarón salga por gravedad y no se tenga que recurrir a atarrayas, es importante tomar en cuenta que el camarón biológicamente preparado para la cosecha e independientemente del tamaño del mismo, debe presentar un caparazón duro es decir, que no esté pasando por el estado de muda, ya que el mismo “pierde” su valor comercial. Para evitar esta situación se realiza un muestreo antes de cosechar las piscinas. Si en este muestreo se presenta camarón con caparazón suave, dicha piscina debe continuar su periodo de ceba hasta que logre recuperarse y esté en condiciones de ser cosechado.
35
2.4. Análisis Microbiológico.2.4.1. Recuento de microorganismos empleando el Sistema Petri film.
1) Se Prepara el homogenizado y las diluciones de la muestra, colocando 10 mL de agua proveniente de cada piscina de camaronera con su respectivo tratamiento con 90 mL de agua de peptona.
2) Se realiza diluciones seriadas 10-1, 10-2 y 10-3, tomando 10mL de la dilución
preparada y agregándose 90 mL de agua de peptona.
3) Se Inocula por duplicado, alícuotas de 1 ml de las diluciones 10-1, 10-2 y 10-3 de las
muestras de agua de las piscinas de camaronera con cada tratamiento en las placas de Petri film respectivas, siguiendo el procedimiento descrito a continuación:
Se coloca la placa Petri film sobre una superficie plana y se levanta la lámina plástica superior.
Con la pipeta en posición perpendicular a la placa, se deposita 1 ml en el centro de la lámina inferior de la placa Petri film.
Se baja la lámina superior evitando introducir burbujas de aire. No dejar caer.
Con la cara lisa hacia abajo, se coloca el aplicador en la lámina superior sobre el inóculo. Con cuidado, se ejerce una presión sobre el aplicador para repartir el inóculo sobre el área circular. No se debe girar ni deslizar el aplicador.
Se levanta el aplicador.
Se espera un minuto antes de su incubación.
Se incuba las placas cara arriba.
Las condiciones de incubación varían de acuerdo al tipo de análisis que se desea realizar
Para el caso de Mohos y Levaduras, se incuba las placas durante 5 días de 20 a 25ºC.
Para el caso de Entero bacterias se incuba a 35-37ºC durante 24±3 horas.
Para el caso de Coliformes totales y E. Coli: 35ºC durante 24 horas.
4) Lectura de placas. Se contabiliza como E. coli las colonias azules con gas.
36
Se empleó para el recuento las placas con una gama de colonias situada entre 15 y 150.
2.4.2. Recuento de Microorganismos.
Se calculó el número de unidades formadoras de colonias (ufc) de microorganismos por 100 ml de muestra. De la siguiente manera:
Se seleccionó las placas de la dilución cuyo número de colonias oscile entre 25 y 150 UFC.
Se contó el número de colonias con ayuda de contador de colonias con registro automático (Rotulador).
Se multiplicó el promedio por el inverso de la dilución para obtener las UFC/100ml de muestra.
Se promedió el número de colonias de las cajas de las tres repeticiones realizadas.
Para el desarrollo de los cálculos respectivos, se debe tener en cuenta que en la presente investigación, el inóculo es de 0.1 ml, por lo tanto se debe multiplicar el resultado por 10 cuando es 10 -1, por 100 cuando es 10-2 y por 1000 cuando es 10-3.
2.5. Materiales.
A continuación se describe los materiales a utilizar para el desarrollo del presente trabajo investigativo:
Larvas (Pl 12)
Multiparámetro
Atarraya
Recipientes para recolección de muestras
Mechero
Placas Petri film específicas para:
- Aerobios
- Coliformes
- Entero bacterias
- E. Coli
- Mohos y Levaduras
37
Pipeta serológica y puntas.
Cajas Petri
Matraces y Vasos de Precipitación.
2.6. Equipos e Instrumentos.
Balanza analítica
Espectrofotómetro de absorción atómica
Espectrofotómetro de luz UV-visible
Microscopio
Incubadora
Refrigerador
Cámara de Flujo Laminar
pH-metro
Contador de colonias con registro automático o rotulador.
Autoclave
2.7. Reactivos.
Agar TCBS
Agar TSA
Agar CETRIMIDE
ClNa2.8. Recursos Informáticos y Estadísticos.
Excel
Word
Project
CAP Comunnity Analysis Package.
2.9. Preparación de las Muestras.
Se tomó muestras de acuerdo al diseño experimental.
Se colocó las muestras en recipientes cerrados y se transportó al laboratorio evitando cambios bruscos de temperatura.
38
Se dejó en agitación durante 1 hora para re suspender los microorganismos adheridos a las paredes de los recipientes.
Se preparó diluciones seriadas a partir de la anterior hasta la dilución 10-3.
Características técnicas de los Equipos para la determinación analítica de la concentración de minerales se empleó el análisis mediante espectrofotometría de absorción atómica. La metodología analítica utilizada fue TS-FF-AAS para la determinación de la absorbancia. Las soluciones patrones o estándar de los minerales se prepararon a partir del kit Merck de 1000 mg.L-1. Se empleó un espectrofotómetro de absorción atómica modelo GBC 902 y un
espectrofotómetro de absorción atómica Perkin-Elmer “Analyst 300”. Las mediciones se realizaron conforme a las condiciones estándar recomendadas por el manual del espectrofotómetro. Tomando en cuenta la longitud de onda tipo de llama y de gas para cada elemento. En todas las mediciones se empleó como corrector de fondo una lámpara de deuterio. El margen de error en la medición de absorbancia se estimó en ±0.02 ug.
Tabla 5. condiciones estándar recomendadas para determinación de absorbancia mediante espectrofotometría de absorción atómica.
Elemento Longitud de onda
(nm) Condiciones de llama Referencia
Cobre 324,8 Aire-C2H2 oxidante (azul) Manual Analyst 300.
Perkin-Elmer.
Hierro 248,3 Aire-C2H2 oxidante (azul) Manual Analyst 300.
Perkin-Elmer.
Manganeso 279,5 Aire-C2H2 oxidante (azul) Manual Analyst 300.
Perkin-Elmer.
Plomo 283,3 Aire-C2H2 oxidante (azul) Manual Analyst 300.
Perkin-Elmer. Elaborado Por: el autor
Análisis de concentración de Fósforo mediante espectrofotometría UV-visible.
Para el análisis de la cantidad de fósforo se empleó espectrofotometría UV-visible, las soluciones patrones o estándar de los minerales se prepararon a partir del kit Merck de 1000 mg.L-1 el equipo utilizado fue un Espectrofotómetro UV-VIS 3000 pantalla y e. Cecil I.C.T,
39
Análisis de concentración nitritos y nitratos por Colorimetría.
Para la determinación de la cantidad de nitritos y nitratos se empleó el análisis colorimétrico se realizó el siguiente procedimiento:
Preparación del Reactivo colorante:
Se agregó a 800 ml de agua destilada 100 ml de ácido fosfórico (Ac 17) al 85% y 10 g de sulfanilamida (A 13). Tras disolver completamente la sulfanilamida, se añadió 1 g de di clorhidrato de N-(1-naftil)-etilendiamida (NED) (OT 10). Se mezcló para disolver, y se aforó con agua destilada hasta 1 L.
Se preparó la Solución madre de nitritos de 200 ppm, disolviendo 300 mg de nitrito sódico (NaNO2) en agua destilada, y aforándose hasta 1 L. Para la conservación se utilizó 1 ml de CHCl3. Se preparó la Solución patrón de nitritos de 200 ppm, tomando 10 ml de la disolución anterior y diluyéndose en un litro.
Se filtró la muestra para eliminar los sólidos en suspensión. Se ajustó el pH a un valor comprendido entre 5 y 9 añadiendo HCl. Se tomó 25 ml de agua muestra, y otros 25 ml de agua destilada para el blanco. Se añadió 1 ml del reactivo colorante, se mezcló y se dejó desarrollar el color durante una hora.
Se realizó la lectura en el espectrofotómetro a 543 nm de longitud de onda.
Se determinó si la absorbancia coincide con el protocolo empleado a la longitud de onda señalada. En caso de no hallar coincidencia con los rangos se realizó una nueva dilución.
Los valores obtenidos de absorbancia se incluyeron en la respectiva curva de calibración en la cual se incluye la concentración y absorbancia de las respectivas muestras estándar preparadas.
41
3.1. Caracterización microbiológica y físico-químico del agua de las piscinas camaroneras A, B, C.
3.1.1. Análisis del agua por Etapas
Los resultados obtenidos en los análisis de laboratorio para cada uno de los parámetros evaluados se detallan en la Tabla 6, 7, 8 ,9. Los valores tomados como referencia son los que se presentan por la Fundación Sociedad Latinoamericana de Acuacultura (FSLA).
3.1.1.1. Larvaria.
Tabla 6. análisis del agua en etapa larvaria.
PARÁMETROS Unidades Piscina 1 F O Piscina 2 F I Control FSLA
Nitritos ppm 0,0024 0,0022 0,0023 0,003 - 0,660
Nitratos ppm 1,87 1,84 1,85 1,70 - 3,10
Amonio ppm 0,015 0,014 0,015 0,00 – 0,26
Oxígeno
Disuelto ppm 8,2 7,9 8 1,5 – 10
Calcio ppm 190 196 195 80 – 450
Magnesio ppm 782 786 788 800 – 3500
Manganeso ppm 0,0055 0,0061 0,0062 0,00 - 0,04
Cobre ppm 0,008 0,0076 0,0076 0,00 - 0,60
Potasio ppm 146 147 145 30 – 375
Plomo ppm 0,002 0,004 0,004 0,00 - 0,03
Fósforo ppm 0,005 0,006 0,006 0,01 - 0,20
Ph Adimensional 7,4 7,5 7,5 7,5 - 8,5
Elaborado por: el autor
42
3.1.1.2. Juvenil.Tabla 7. análisis en etapa juvenil
PARÉMETROS Unidades Piscina 1 F O Piscina 2 F I Control FSLA
Nitritos ppm 0,096 0,112 0,0022 0,003 - 0,660
Nitratos ppm 1,95 2,01 1,89 1,70 - 3,10
Amonio ppm 0,018 0,018 0,017 0,00 – 0,26
Oxígeno
Disuelto ppm 7,9 7,6 7,8 1,5 – 10
Calcio ppm 203 198 197 80 – 450
Magnesio ppm 793 802 790 800 – 3500
Manganeso ppm 0,0059 0,0069 0,0064 0,00 - 0,04
Cobre ppm 0,096 0,099 0,079 0,00 - 0,60
Potasio ppm 145 138 144 30 – 375
Plomo ppm 0,004 0,008 0,005 0,00 - 0,03
Fósforo ppm 0,009 0,011 0,007 0,01 - 0,20
Ph Adimensional 7,2 7,3 7,5 7,5 - 7,8
Elaborado por: el autor
FO=Fertilizante Orgánico FI= Fertilizante Inorgánico
3.1.1.3. Engorde.
Tabla 8. análisis en etapa de engorde
PARÁMETROS Piscina 1
F O Piscina 2 F I Control FSLA
Nitritos Ppm 0,118 0,186 0,002 0,003 - 0,660
Nitratos Ppm 2,04 2,46 1,92 1,70 - 3,10
Amonio Ppm 0,022 0,023 0,019 0,00 – 0,26
Oxígeno
Disuelto Ppm 7,5 7,2 7,6 1,5 – 10
Calcio Ppm 219 214 198 80 – 450
Magnesio Ppm 799 815 791 800 – 3500
Manganeso Ppm 0,0066 0,0075 0,0067 0,00 - 0,04
Cobre Ppm 0,12 0,19 0,081 0,00 - 0,60
Potasio Ppm 138 126 142 30 – 375
Plomo Ppm 0,006 0,012 0,005 0,00 - 0,03
Fósforo Ppm 0,012 0,019 0,007 0,01 - 0,20
Ph Adimensional 7 7,2 7,4 7,5 – 8,5
Elaborado por: el autor
43
3.1.1.4. Cosecha.Tabla 9. análisis de la etapa de cosecha.
PARÁMETROS Piscina 1
F O Piscina 2 F I Control FSLA
Nitritos Ppm 0,296 0,366 0,0019 0,003 - 0,660
Nitratos Ppm 2,58 3,15 1,94 1,70 - 3,10
Amonio Ppm 0,029 0,03 0,022 0,00 – 0,26
Oxígeno
Disuelto Ppm 6,8 6,6 7,5 1,5 – 10
Calcio Ppm 268 249 201 80 – 450
Magnesio Ppm 826 876 798 800 – 3500
Manganeso Ppm 0,0071 0,0096 0,0071 0,00 - 0,04
Cobre Ppm 0,17 0,31 0,083 0,00 - 0,60
Potasio Ppm 113 81 138 30 – 375
Plomo Ppm 0,009 0,018 0,006 0,00 - 0,03
Fósforo Ppm 0,019 0,022 0,009 0,01 - 0,20
pH Adimensional 6,7 7,1 7,4 7,5 – 8,5 elaborado por: El Autor
FO=Fertilizante Orgánico FI= Fertilizante Inorgánico
3.1.2. Análisis microbiológico del agua en las piscinas camaroneras.
En las tablas 10 y 11 que se presentan a continuación se presentan los resultados del análisis cualitativo realizado al agua de las piscinas en estudio las cuales nos permiten tener una visión general del tipo de microorganismos presentes como indicadores de contaminación.
Tabla 10. positivos para presencia de microorganismos en las muestras de agua provenientes de la camaronera con fertilizante orgánico.
Microorganismos Etapa
Larval Etapa Juvenil Etapa Engorde Etapa Cosecha
Aerobios Totales + + + +
Coliformes Totales + + + +
Entero bacterias Totales + + + +
E. Coli + + + +
Mohos y Levaduras + + + +
Pseudomonas aeruginosa + + + +
44
Tabla 11. positivos para presencia de microorganismos en las muestras de agua provenientes de la camaronera con fertilizante inorgánico.
Microorganismos Etapa
Larval Etapa Juvenil Etapa Engorde Etapa Cosecha
Aerobios Totales + + + +
Coliformes Totales + + + +
Entero bacterias Totales + + + +
E. Coli + + + +
Mohos y Levaduras + + + +
Pseudomonas aeruginosa + + + +
Elaborado por: el autor
En las tablas 12, 13, 14 se puede observar los resultados del análisis microbiológico cuantitativo realizado a las piscinas en estudio, en las cuales podemos observar concentraciones elevadas de indicadores de contaminación del agua tanto en el sistema con tratamiento orgánico como en la piscina con tratamiento inorgánico.
3.1.3. Recuento de microorganismos mediante los dos tratamientos empleados en la piscina con Fertilizante Orgánico e inorgánico.
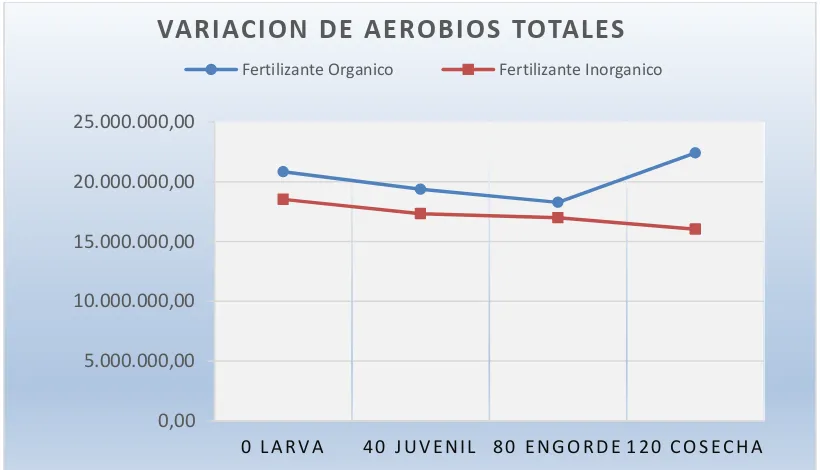
Tabla 12. recuento de aerobios totales y coliformes totales.
Etapa De Muestreo
Método de Placas Petrifilm (UFC/100 ml)
Fertilización Orgánico Fertilización Inorgánica Aerobios Totales Aerobios Totales Coliformes Totales Coliformes Totales
Larva 20,83E+06 18,53E+06 9,95E+06 11,74E+06
Juvenil 19,37E+06 17,33E+06 9,32E+06 11,63E+06
Engorde 18,28E+06 16,98E+06 10,03E+06 12,07E+06
Cosecha 22,41E+06 16,03E+06 11,12E+06 13,09E+06
45
Figura 6. recuento de aerobios totales en los 2 tratamientos.Elaborado por: El Autor
En la figura 6 se puede observar que los aerobios totales conforme pasa el crustáceo de una etapa a otra los aerobios totales van disminuyendo, esto sucede hasta la etapa 3 en la piscina con fertilización orgánica ya que luego de esta etapa da un aumento a diferencia de la piscina con fertilización inorgánica que sigue en descenso.
.
Figura 7. recuento de coliformes totales en los 2 tratamientos. Elaborado por: el autor
0,00 5.000.000,00 10.000.000,00 15.000.000,00 20.000.000,00 25.000.000,00
0 L A R V A 4 0 J U V E N I L 8 0 E N G O R D E 1 2 0 C O S E C H A
VARIACION DE AEROBIOS TOTALES
Fertilizante Organico Fertilizante Inorganico
0,00 2.000.000,00 4.000.000,00 6.000.000,00 8.000.000,00 10.000.000,00 12.000.000,00 14.000.000,00
0 L A R V A 4 0 J U V E N I L 8 0 E N G O R D E 1 2 0 C O S E C H A
VARIACION DE COLIFORMES TOTALES
[image:49.595.86.494.445.739.2]46
[image:50.595.92.541.258.727.2]La presencia elevada de aerobios totales y coliformes totales desde la etapa inicial es un indicador de contaminación proveniente del agua de la piscina. En el caso de aerobios se observa que existe un descenso de la cantidad de microorganismos en las etapas de larva y juvenil del camarón pero se produce un incremento en la etapa de engorde. Para el caso de los coliformes totales en la primera etapa se mantiene con poca variación y posteriormente en estado juvenil y de engorde se produce un leve incremento de la cantidad de unidades formadoras de colonia.
Tabla 13. recuento de entero bacterias totales y escherichia coli.
Etapa De Muestreo
Método de Placas Petrifilm (UFC/100 ml)
Fertilización Orgánico Fertilización Inorgánica Entero bacterias Totales Entero bacterias Totales Escherichia Coli Escherichia Coli
Larva 8,25E+06 10,35E+06 4,53E+06 6,53E+06
Juvenil 7,46E+06 9,93E+06 2,21E+06 4,21E+06
Engorde 8,65E+06 10,57E+06 2,13E+06 4,13E+06
cosecha 8,48E+06 10,85E+06 3,69E+06 5,69E+06
Elaborado por: el autor
Figura 8. Recuento de Entero bacterias totales y Escherichia coli en los 2 tratamientos Elaborado por: El Autor
0,00 2.000.000,00 4.000.000,00 6.000.000,00 8.000.000,00 10.000.000,00 12.000.000,00
0 L A R V A 4 0 J U V E N I L 8 0 E N G O R D E 1 2 0 C O S E C H A
VARIACION DE ENTEROBACTERIAS TOTALES
47
Figura 9.recuento de escherichia coli en los 2 tratamientos. Elaborado por: el autor [image:51.595.86.501.85.326.2]La cantidad de entero bacterias totales se mantiene sin mayores variaciones, por lo tanto se puede asumir que el ciclo de vida del camarón no interactúa con el crecimiento de estos microorganismos. Para el caso de E. coli se puede apreciar que en etapas de larva y juvenil existió un descenso en la cantidad de UFC, esto debido a la capacidad del camarón de degradar los desechos de otros animales. En la etapa final del ciclo productivo se observó un incremento en la cantidad de microorganismos, lo cual se puede atribuir al descenso en la velocidad del metabolismo del camarón en esta etapa.
Tabla 14. Recuento de mohos y levaduras y pseudomonas aeruginosa.
Etapa De Muestreo
Método de Placas Petrifilm (UFC/100 ml)
Fertilización Orgánico Fertilización Inorgánica Pseudomonas Aeruginosa Pseudomonas Aeruginosa Mohos y levaduras Mohos y levaduras
Larva 12,36E+06 14,23E+06 97,0E+04 1,73E+06
Juvenil 13,54E+06 15,25E+06 35,0E+04 59,0E+04
Engorde 13,94E+06 14,77E+06 49,0E+04 96,0E+04
cosecha 12,17E+06 14,52E+06 66,0E+04 84,0E+04
Elaborado por: el autor 0,00 1.000.000,00 2.000.000,00 3.000.000,00 4.000.000,00 5.000.000,00 6.000.000,00 7.000.000,00
0 L A R V A 4 0 J U V E N I L 8 0 E N G O R D E 1 2 0 C O S E C H A
VARIACION DE E. COLI
48
Figura 10. recuento de mohos y levaduras en los 2 tratamientos. Elaborado por: el autor
Figura 11.recuento de pseudomonas aeruginosa en los 2 tratamientos. Elaborado por: el autor
En el recuento de Mohos y levaduras se observó una cantidad muy baja de microorganismos y en el recuento de Pseudomonas aeruginosa casi nula. Para los dos casos se puede apreciar que no existió mayor variación en cuanto a las cantidades de UFC
0,00 2.000.000,00 4.000.000,00 6.000.000,00 8.000.000,00 10.000.000,00 12.000.000,00 14.000.000,00 16.000.000,00 18.000.000,00
0 L A R V A 4 0 J U V E N I L 8 0 E N G O R D E 1 2 0 C O S E C H A
VARIACION DE MOHOS Y LEVADURAS
Fertilizante Organico Fertilizante Inorganico
0,00 200.000,00 400.000,00 600.000,00 800.000,00 1.000.000,00 1.200.000,00 1.400.000,00 1.600.000,00 1.800.000,00 2.000.000,00
0 L A R V A 4 0 J U V E N I L 8 0 E N G O R D E 1 2 0 C O S E C H A
VARIACION DE PSEUDOMONAS AERUGINOSAS
[image:52.595.86.504.428.682.2]49
por lo cual asumimos que el ciclo productivo del camarón no tuvo incidencia en el crecimiento de estos microorganismos.
Al realizar el recuento de microorganismos observamos presencia de aerobios totales desde la etapa inicial en cantidades mayores a las observadas en el Tratamiento Orgánico, por lo tanto el Tratamiento Inorgánico resultó más contaminante en relación a este tipo de microorganismos, no así en relación a los coliformes totales donde se dio lo contrario. Durante el ciclo productivo se observó un incremento de los coliformes totales, mientras que la cantidad de aerobios totales descendió.
Tanto entero bacterias como E. coli presentaron mayor cantidad de UFC en relación al tratamiento orgánico, por lo cual se deduce que el Tratamiento Inorgánico contribuye a la contaminación del agua por este tipo de microorganismos. Al igual que en el caso del tratamiento orgánico, la cantidad de entero bacterias totales se mantiene sin mayores variaciones, por lo tanto se asume que el ciclo de vida del camarón no afectó al crecimiento de estos microorganismos. De igual manera para el caso de E. coli se puede apreciar que en etapas de larva y juvenil existió un descenso en la cantidad de UFC y un incremento en la cantidad de microorganismos en etapa de engorde.
Al igual que en el tratamiento orgánico el recuento de Mohos y levaduras evidenció una cantidad muy baja de microorganismos y en el recuento de Pseudomonas aeruginosa casi nula. Pero en ambos casos los valores del tratamiento inorgánico fueron mayores. Para los dos casos se observa que no existió alteración notoria en cuanto a las cantidades de UFC por lo cual asumimos que el ciclo productivo del camarón no incidió en el crecimiento de estos microorganismos.
Se determinó la presencia elevada de microorganismos incluso en tiempo larvario, esto se lo toma como una evidencia de la riqueza biológica existente en los suelos de la camaronera.
50
[image:54.595.85.528.326.639.2]3.1.4. Análisis Físico Químico del agua en las piscinas camaroneras, con respecto a los valores tomados como referencia son los que se presentan por la Fundación Sociedad Latinoamericana de Acuacultura (FSLA).
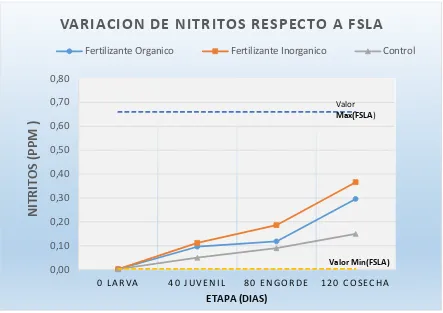
Tabla 15. variación de nitritos
Etapas Fertilizante Orgánico Fertilizante Inorgánico Control Valor Min (FSLA) Valor Max( FSLA) 0 Larva 0,0024 0,0022 0,0023 0,003 0,66
40 Juvenil 0,096 0,112 0,05 0,003 0,66
80 Engorde 0,118 0,186 0,09 0,003 0,66
120 Cosecha 0,296 0,366 0,15 0,003 0,66 Elaborado por: el autor
FSLA: Fundación Sociedad Latinoamericana.
Figura 12. variación de nitritos. Elaborado por: el autor
FSLA: Fundación Sociedad Latinoamericana.
En la figura 9, se evidencia un aumento significativo de los nitritos a lo largo de todo el proceso de cultivo del camarón, en este caso el tratamiento con fertilizante inorgánico presenta mayor preferencia con un aumento que va de 0,0022 a 0,366ppm seguido del
0,00 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80
0 L A R V A 4 0 J U V E N I L 8 0 E N G O R D E 1 2 0 C O S E C H A
NI
TRI
TOS
(PPM
)
ETAPA (DIAS)VARIACION DE NITRITOS RESPECTO A FSLA
Fertilizante Organico Fertilizante Inorganico Control
Valor Max(FSLA)