Evaluación de recursos vegetales biocidas en el control de estadios inmaduros de aedes aegypti l Trujillo, la libertad, Perú, 2006 2007
Texto completo
(2) DEDICATORIA. A m i s P adr e s : Josefina y Constante, porque saben que el camino de la vida es gratificante y la recompensa es la felicidad. Amor a ustedes.. A mis Hermanas: Haydee, Lucia y Linda Por su paciencia y comprensión.. A Fátima: Por ser la luz de mis sacrificios. A Juan Luis Joseph: Por ser la bendición de mi vida. ii2.
(3) PRESENTACION. Señores Miembros del Jurado Dictaminador:. Dando cumplimiento con lo dispuesto en el Reglamento de la escuela de Postgrado de la Universidad Nacional de Trujillo, pongo a consideración el presente Informe de Tesis titulada:. “EVALUACIÓN DE RECURSOS VEGETALES BIOCIDAS EN EL CONTROL DE ESTADIOS INMADUROS DE Aedes aegypti L. TRUJILLO, LA LIBERTAD, PERU, 2006-2007”. para obtener el Grado Académico de Doctor en Ciencias Ambientales.. Dejo a criterio vuestro la presente investigación para su respectiva aprobación.. Trujillo, 02 de Enero de 2008. M. Sc. Miguel Constante Bobadilla Alvarez. iii3.
(4) AGRADECIMIENTOS. Al Consejo Nacional de Ciencia, Tecnología e Innovación Tecnológica (CONCYTEC), por el soporte económico de los cuatro ciclos de estudios del programa Doctoral en Ciencias Ambientales y de la presente tesis.. Al Dr. José Mostacero León, por su permanente asesoría y orientación en el desarrollo del presente informe de tesis.. A la Dra. Jeanette González Castro y Manuel Sisniegas Gonzales, por las directrices alcanzadas respecto al proceso estadístico de la presente investigación.. A Judith Vidal, Fernando Valderrama, Karen Ahumada, así como a Glauco y Jefferson, personal investigador asociados a la presente tesis.. iv4.
(5) JURADO DICTAMINADOR. Dra. Rosa Ramírez Vargas Presidente. Dr. Darío Medina Castro Secretario. Dr. José Mostacero León Vocal. v5.
(6) INDICE. Dedicatoria. ii. Presentación. iii. Agradecimientos. iv. Jurado Dictaminador. v. Resumen. 7. Abstract. 8. Introducción. 9. Material y Métodos. 14. Resultados. 22. Discusión. 49. Propuesta. 54. Conclusiones. 56. Referencias Bibliográficas. 57. Anexos. 68. 6.
(7) RESUMEN. Aedes aegypti L. es el vector causante del dengue y fiebre amarilla en el Perú y el mundo. Su control se lleva a cabo mediante el empleo de insecticidas químicos, controladores biológicos y extractos de plantas. Se propone una alternativa en el control de larvas y pupas del mosquito empleando extractos foliares acuosos y orgánicos de diez plantas biocidas que vegetan en la ciudad de Trujillo, para rescatar y validar su uso por la comunidad propensa a brotes estacionales de dengue. Los resultados muestran un 100% de control en larvas del IV estadio y pupas desde las 24 horas de exposición a las concentraciones de 10% y 5% de los extractos foliares orgánicos de Nicotiana tabacum L. “tabaco”, Annona cherimola Mill. “chirimoya”, A. muricata L. “guanábana”, Ricinus communis L. “higuerilla” y Argemone subfusiformis G. B. Ownbey “cardosanto” y en menor proporción, del orden del 85%, los extractos foliares acuosos de Ruta graveolens L. “ruda” Schinus molle L. “molle” y Verbena litoralis “verbena” H.B.K., Chenopodium. ambrosioides. L.. “paico”. y Tagetes. minuta. L.. “huacatay”.. Las. concentraciones letales medias indican una relación similar de toxicidad hacia ambos estadios con mayor efectividad por los extractos orgánicos de todas las especies señaladas. Todos los extractos foliares acuosos y orgánicos de las 10 especies vegetales muestran control larvicida y pupicida en condiciones de laboratorio y campo simulado, siendo las más efectivas A. subfusiformis, N. tabacum, A. muricata, A. cherimola y V. litoralis y menos efectivas Ch ambrosioides, R. communis, R. graveolens S. molle y T. minuta con mortalidades superiores a 32% desde las 24 horas de exposición. Palabras clave: Extractos foliares vegetales, larvas, pupas, condiciones de laboratorio, condiciones de campo simulado.. 7.
(8) ABSTRACT. In Peru and around the world the most important disease-borne vector which causes dengue fever and yellow fever is Aedes aegypti L. The control measures during its cycle of life involve the use of conventional chemical insecticides, biologic control and botanical extracts. With the aim to rescue a validation of biocide plants in the Trujillo community population to avoid the seasonal raise of dengue fever in summer months, a control on fourth instar larvae and pupae of this mosquito using leaves of inorganic and organic botanical extracts from ten biocide plants, which are available along Trujillo city, were evaluated under laboratory and simulated field condictions. Results indicate that Nicotiana tabacum L. “tabaco”, Annona cherimola Mill. “chirimoya”, A. muricata L. “guanábana”, Ricinus communis L. “higuerilla” and Argemone subfusiformis G. B. Ownbey “cardosanto” organic leaves extracts at 10% and 5% concentrations from 24 hours of exposure were a mortality index of 100% against fourth instar larvae and pupae, while Ricinus communis L. “higuerilla”, Ruta graveolens L. “ruda” Schinus molle L. “molle”, Verbena litoralis “verbena” H.B.K., Chenopodium ambrosioides L. “paico” and Tagetes minuta L. “huacatay” aqueous leaves extracts were a mortality index of 85%. A similar toxicity relation concerning media lethal concentration to 50% was shown in every plant species against larvae and pupae in all organic biocide extracts. Leaves inorganic and organic extracts from 10 plant species shown pupicide and larvicide control under laboratory and simulated field conditions, being the most effective A. subfusiformis, N. tabacum, A. muricata, A. cherimola and V. litoralis than Ch ambrosioides, R. communis, R. graveolens S. molle and T. minuta with mortality values over 32% from 24 hours of exposure.. Key words: Botanical extracts, larvae, pupae, laboratory conditions, field simulated conditions.. 8.
(9) INTRODUCCIÓN. La diversidad biológica se puede definir como la variedad de formas de vida así como sus interacciones entre si y con el ambiente físico. La diversidad biológica, se distribuye espacialmente de manera diferencial entre los continentes y países, de tal manera que existen regiones con mayor diversidad biológica, debido principalmente a cuestiones históricas y a factores abióticos. Las amenazas contra la diversidad biológica, son causadas principalmente por el crecimiento poblacional humano. La mayor destrucción de comunidades biológicas ha ocurrido en los últimos 150 años, durante los cuales el crecimiento poblacional humano ha ido de 1000 millones en 1850 a 6200 millones a inicios del 2002, y se proyecta que será de 10 000 millones para 2050. Se ha argumentado que tales cifras son incompatibles con los procesos ecológicos y evolutivos naturales principalmente de grandes depredadores, migración de aves, protección y manutención de ambientes naturales nativos (Monroy-Vilchis, 2005). Las modificaciones del ambiente, producto de la actividad humana, afectan a las poblaciones de animales estimulando su crecimiento o disminución, o bien modificando sus hábitos. Algunas especies pueden adaptarse y colonizar nuevos lugares al ser eliminados los sitios naturales de cría. El proceso de adaptación al ambiente humano, o antrópico, ha quedado demostrado por la presencia de especies que, por ejemplo, se crían tanto en su medio natural como en ambientes urbanos (Rossi, 2004).. La historia de los descubrimientos y de las guerras proporciona ejemplos de como la penetración por el hombre en diferentes hábitats, o los movimientos masivos de personas, traen aparejadas alteraciones que contribuyen a la aparición o incremento de enfermedades infecciosas. Los cambios demográficos registrados en la segunda mitad del presente siglo, generados en parte por los fenómenos de urbanización, han introducido cambios en los estilos de vida de los habitantes de diferentes regiones. Así se han invadido reductos de otras especies, poniendo al hombre en contacto con roedores o. 9.
(10) insectos vectores a veces incrementados por cambios climáticos y con un costo social muy alto demostrado mediante la emergencia y reemergencia de enfermedades trasmisibles (Weissenbacher et al., 1998).. Los objetivos de desarrollo del milenio han establecido un nuevo derrotero en los planes de desarrollo mundial situando a la salud como punto de partida. Tal es así que tres de los ocho objetivos se refieren explícitamente a los temas de salud, mientras que siete de las 18 metas más concretas son responsabilidad del sector salud. Este énfasis refleja un nuevo consenso mundial en el que la salud no sólo es un resultado del desarrollo, sino también uno de los principales factores determinantes para lograrlo (Kickbusch, 2004).. Entre las enfermedades que afectan al hombre se encuentra la fiebre del dengue (FD) y fiebre hemorrágica del dengue (FHD) en términos de morbilidad y mortalidad. Ambas se han convertido en un problema creciente de salud en el mundo tropical y subtropical. El dengue es una enfermedad viral reemergente cuyo agente etiológico pertenece a la familia Flaviviridae con sus cuatro serotipos antigénicamente distintos conocidos como DEN-1, DEN-2, DEN-3 y DEN-4. La infección ocasiona, además de dengue clásico (DC), formas severas de la enfermedad como el dengue hemorrágico (DH/FHD) y síndrome de shock por dengue (SSD), que pueden comprometer la vida del paciente (Cáceres, 2003). La enfermedad es endémica, de gran impacto epidemiológico y un problema creciente de salud pública mundial presente en más de 100 países del Sudeste Asiático y Pacífico Occidental, las Américas, África y Mediterráneo Oriental (Guzmán, 2002).. El número de casos de dengue en las Américas ha ido en progresivo aumento desde 1980 con 66 011 casos a 1998 con 717 024 casos de la enfermedad. Nuestro país posee una población de áreas de riesgo de transmisión de dengue estimado en 3,4 millones de habitantes, confirmándose la circulación de los 4 serotipos (Organización. 10.
(11) Panamericana de la Salud, 1999). En 2005, el dengue clásico se notificó en 23 direcciones de salud comprometiendo a 69 provincias, 233 distritos y 12 761 059 habitantes en riesgo de enfermar. Actualmente es endémico en aéreas correspondientes a las direcciones de salud de Tumbes, Piura, Lambayeque, La Libertad, Loreto, Junín y Huánuco y epidémico en Loreto, San Martín, Ucayali, Pasco y Madre de Dios. En 2006, la Red Nacional de Epidemiología (RENACE) notificó hasta la semana epidemiológica (SE) 35 (27 de agosto al 02 de setiembre) la circulación de los serotipos DEN1, DEN3, DEN4 con 15 casos probables de dengue clásico con uno procedente de la DIRESA La Libertad, siendo el acumulado del año en 4668, con 593 (12,7%) confirmados por laboratorio y 5 registrados para nuestro departamento (Dirección General de Epidemiologia/Ministerio de Salud, 2006). Dicha situación confirma la tendencia de incremento y extensión de la enfermedad a un 75% del territorio nacional con una población en riesgo de 8 574 911 habitantes (Oficina de Epidemiologia/Ministerio de Salud, 2007) tal y como lo afirma Rodríguez (2007), reportando 6263 casos (entre confirmados y probables), es decir 70% más que en el mismo periodo de 2006, encabezando La Libertad en 24% con 11 enfermos de dengue hemorrágico y 2 fallecimientos (Dirección General de Epidemiologia, 2007).. En un programa integral de prevención y control del dengue, el uso de químicos juega un papel importante en programas de vigilancia entomológica regional. Dichas estrategias regionales recomiendan el uso de químicos sintéticos para prevenir y controlar el desarrollo de larvas en los depósitos de agua como parte esencial de la gran mayoría de programas nacionales en las Américas (Lloyd, 2003) y es aplicable actualmente en las macro regiones oriente y centro del país junto con labores integrales que involucran el recojo y eliminación de inservibles (Ministerio de Salud/Dirección General de Salud Ambiental, 2005). No obstante, investigaciones recientes demuestran la resistencia alcanzada por las larvas del vector al insecticida temefós, registrado comercialmente como Abate, dentro de nuestra provincia (Chávez, et al., 2005) con antecedentes en otras latitudes del continente americano y del mundo a dicha. 11.
(12) resistencia, debido a un manejo inadecuado del químico (Brogdon & McAllister, 1998; Bisset, 2002; Bisset et al., 2003; Pereira, 2003; Ponlawat, 2005).. Frente al incremento de la resistencia a los insecticidas químicos, el alcance de la muy reconocida valoración medicinal de muchos recursos vegetales amerita ahora ampliarse hacia otro enfoque localmente aun no muy rescatable: Su validación como biocidas. Dicha validación se centrará en la capacidad de aceptación, asimilación, culturalidad, predisposición, nivel de conocimiento y praxis de la población beneficiaria dentro de un contexto de constante interrelación macrosocial (Mejía, 2004) con su entorno, abordando conceptos de participación comunitaria de identificación de necesidades, implementación y evaluación de estrategias acerca del nuevo enfoque propuesto, resaltando la validación histórica y social de la relación planta-problema de salud y eficacia fármaco-biocida (Pérez, 2002; Toledo-Romani et al., 2006).. No obstante, los grandes esfuerzos del Ministerio de Salud en señalar como meta una disminución sostenida y significativa de la incidencia de dengue y malaria, preponderantemente en aquellas poblaciones afectadas por estas enfermedades para el año 2006 (Ministerio de Salud, 2002), y con resultados poco convincentes, es prioritario integrar otras propuestas dentro del sistema de manejo de vectores. En estudios de enfermedades tropicales, la Iniciativa del Programa sobre Enfoques Ecosistémicos en la Salud Humana del Centro Internacional de Investigación para el Desarrollo (CIID) propone una estrategia en el manejo integrado del medio ambiente y un enfoque global y ecológico para la promoción de la salud. Tal alcance promueve la salud humana a través de la gestión del ecosistema con relación a los recursos naturales (Feota, 2002), propuesta dada por la Organización Panamericana de la Salud (2001) que considera el uso de recursos disponibles en la comunidad, con el propósito de adaptarlos y adecuarlos como posibles medidas en el control selectivo de vectores. Dichos enfoques deben aplicarse, inicialmente, evaluando aquellos potencialmente efectivos en vectores.. 12. recursos. vegetales. biocidas.
(13) Bajo estas consideraciones la presente investigación evaluó en condiciones de laboratorio y campo simulado el control de larvas del IV estadio y pupas de Aedes aegypti empleando extractos orgánicos e inorgánicos foliares de plantas biocidas de mayor recurrencia en la provincia de Trujillo.. 13.
(14) MATERIAL Y MÉTODOS. 1. FASE PRE EXPERIMENTAL. 1.1. CAPTURA DE ZANCUDOS ADULTOS A. aegypti. Adultos hembras y machos de A. aegypti se colectaron en 2 viviendas de los distritos de El Porvenir y Florencia de Mora de la provincia de Trujillo, (8º 08º S; 79º 04’ W) departamento de La Libertad. Las capturas se realizaron entre las 8:00 y 14:00 horas en ambientes intradomiciliarios, utilizando un tubo capturador de vidrio (Anexo 1). Dichos zancudos se introdujeron en frascos colectores de plástico de 250 mL. de capacidad debidamente etiquetados junto con una solución de sacarosa al 10% embebida en algodón. Para el embalaje y traslado de los frascos colectores al laboratorio de crianza masal se empleó un “termocooler” Igloo (Ogozuko, 2002; Cruz et al., 2004).. 1.2. OBTENCION DE HUEVOS DE A. aegypti. La crianza de zancudos adultos se realizó en el Laboratorio de Entomología de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo (Anexo 2). En la oviposición, las hembras de A. aegypti se colocaron en un insectario de 50 x 50 x50 cms con un depósito de plástico de 250 mL. sobre el cual se colocó papel filtro mojado con agua potable para inducir la oviposición (Anexos 3 y 4). Los huevos obtenidos se transfirieron a recipientes de plástico de 13 x 10 x 5 cms. con 100 mL de agua para su posterior eclosión (Anexo 5) dentro de un rango de temperatura de 23º C ± 3º, humedad relativa 60% ± 10 % y un fotoperíodo de 16 horas luz y 8 horas de oscuridad (16HL=8HO) (Zerpa, 1998).. 14.
(15) 1.3. CRIANZA DE LARVAS, PUPAS Y ADULTOS DE A. aegypti. 1.3.1.. Crianza de larvas de A. aegypti. Las larvas recién emergidas se colocaron en fuentes de porcelana de 40 x 28 x 5 cm. a razón de 2.5 litros de agua destilada para 300 individuos en promedio (Anexo 6). Se añadieron 100 mg/día de alimento balanceado a base de hígado de pollo y res (proporción 1:1) (Anexo 7), aumentándose la ración en 10 mg. según el estadio larval. Dicho alimento se esterilizo y empacó en papel de aluminio en una estufa a 80º C por 30 minutos. El agua de crianza se recicló interdiariamente evitando así el desarrollo de patógenos (Ventosilla et al, 2001, Rojas et al., 2002).. 1.3.2.. Crianza de pupas de A. aegypti .. Las pupas provenientes del stock de larvas, se retiraron con pipetas de plástico de 5 mL. para luego colocarlas en recipientes de plástico cubierto con un tul mas 150 mL. de agua potable declorinada (Anexo 8) hasta emergencia de los adultos (Ventosilla, et al., 2001; Uruyakorn, et al., 2005).. 1.3.3.. Crianza de adultos de A. aegypti. Se repartieron 1000 pupas de A. aegypti entre 5 insectarios cúbicos hechos de tul y marcos de madera de 50 cms de lado (Anexo 9) hasta la emergencia de los adultos. Dentro de cada insectario se colocaron frascos de 10 3. cm de solución de sacarosa al 10% en contacto con tiras de papel de filtro para la alimentación del zancudo macho, o en su defecto, se dispuso de trozos de manzana bañadas con sacarosa al 20% (Anexo 10). Dichas soluciones se renovaron diariamente. La alimentación para las hembras se realizó con sangre. 15.
(16) humana (Anexo 11) en horas diurnas con intervalos de 2 días. Los parámetros ambientales de crianza se mantuvieron en un rango de temperatura de 23º C ± 3º, humedad relativa 60% ± 10 % y un fotoperíodo de 16 horas luz y 8 horas de oscuridad (16HL=8HO) (Consoli, 1994; Choochote et al., 2004; Arruda et al., 2003).. 1.4. MATERIAL VEGETAL. 1.4.1. Colección e identificación taxonómica. Todo el material vegetal se obtuvo de zonas aledañas a los distritos de mayor incidencia de la enfermedad y del vector en los últimos 5 años dentro de la Provincia de Trujillo. La identificación taxonómica de las plantas biocidas se realizó en el Herbarium Truxillensis de la Universidad Nacional de Trujillo (Rodríguez, 2006).. 1.4.2. Selección de biocidas. Las plantas y la parte vegetal trabajadas fueron las siguientes (Vilcapoma, 2000):. 16.
(17) Nombre. Parte. Nombre científico. Familia vulgar. vegetal. 1.. Annona cherimolia Mill.. “chirimoya”. Annonaceae. Hojas. 2.. Annona muricata L.. “guanábana”. Annonaceae. Hojas. 3.. Argemone subfusiformis G. B. Ownbey. “cardo santo”. Papaveraceae. Hojas. 4.. Chenopodium ambrosioides L. “paico”. Chenopodiaceae. Hojas. 5.. Nicotiana tabacum L.. “tabaco”. Solanaceae. Hojas. 6.. Ricinus communis L.. “higuerilla”. Euphorbiaceae. Hojas. 7.. Ruta graveolens L.. “ruda”. Rutaceae. Hojas. 8.. Schinus molle L.. “molle”. Anacardiaceae. Hojas. 9.. Tagetes minuta L.. “huacatay”. Asteraceae. Hojas. 10. Verbena litoralis H.B.K.. “verbena”. Verbenaceae. Hojas. 1.4.3. Recolección de la muestra. El muestreo de hojas se realizó tomando, para el caso de arboles, 15 submuestras de hojas de diferentes ramas (Anexo 12) y, para el caso de hierbas, varias plantas individuales. A partir de esta mezcla se extrajo al azar una sola muestra homogénea con el peso necesario. Luego de lavar, secar bajo sombra a 23º C por 10 días (Anexo 13) y moler finamente la muestra con un molino casero (Anexo 14), se procedió a realizar la extracción con los respectivos solventes (Hoss, 1992).. 1.4.4. Extracción y preparación de los extractos foliares. En la extracción se utilizó 2 kg. de hojas secas por cada especie, considerando una dimaceración en 2000 mL (2 x 1000 mL.) de agua, etanol 96% y cloroformo q.p., respectivamente, durante 5 días a temperatura y humedad o. ambientales. Cada macerado se filtró en papel whatman N 1 para eliminar restos. 17.
(18) de partículas vegetales. De cada filtrado se obtuvieron los extractos foliares secos empleando un rotaevaporador bajo una temperatura de 40º C y presiones de 72, 175, 474 mbar. para el agua, etanol 96% y cloroformo q.p., respectivamente, según las especificaciones técnicas del manual de instrucciones Büchi (1995). A partir del peso de cada extracto seco foliar se obtuvieron los caldos biocidas mediante una redisolución con agua destilada a 40º C en una pera de decantación a la misma temperatura de evaporación del solvente (Ventosilla et al., 2001; Bobadilla et al., 2005) (Anexo 15).. 2. FASE EXPERIMENTAL EN LABORATORIO:. 2.1. BIOENSAYOS. 2.1.1. Concentraciones estándar.. A partir de los caldos biocidas del extracto foliar acuoso (ExAc), extracto foliar etanólico (ExETOH) y extracto foliar clorofórmico (ExCHCl3) se obtuvieron, a partir de su respectiva solución madre acuosa al 100% (peso/volumen), las concentraciones de 10%, 5%, 1%, 0.5%, 0,1%, 0.05% (Mc Laughlin et al., 1998; World Health Organization, 2005) (Anexo 4).. 2.1.2. Bioensayos larvicidas. Se tomaron los 3 tipos de extractos de las 10 plantas respectivamente, cada uno con sus 6 grupos experimentales (concentraciones). Cada concentración aforada a 250 mL. de la solución biocida en vasos de tecnopor de 300 mL. de capacidad, se dispuso en cuatro repeticiones con 25 larvas por repetición. Se consideró un grupo testigo por tipo de extracto de cada planta evaluada, de igual manera, con 25 individuos en 250 mL. de agua potable declorinada. Todos los grupos se mantuvieron con un rango de temperatura de 23 a 26º C y humedad. 18.
(19) relativa de 75 á 80%. Las lecturas de mortalidad se realizaron a las 24 y 48 horas. Las larvas se consideraron muertas cuando no reaccionaban al momento de ser tocadas en la región cervical con un puntero punta roma. Para un mejor orden de la toma de datos, se utilizó una hoja técnica estándar propuesta por la World Health Organization para el registro y evaluación del bioensayo (Consoli, 1994; World Health Organization, 2005; Macêdo, 1997) (Anexo 16 y 17).. 2.1.3. Bioensayos pupicidas. Se realizó en base el protocolo estándar de los bioensayos larvicidas. De la misma manera se tomaron los 3 tipos de extractos de las 10 plantas respectivamente, cada uno con sus 6 concentraciones. Cada concentración aforada a 250 mL. de la solución biocida en vasos de tecnopor de 300 mL. de capacidad, se dispuso en cuatro repeticiones con 25 pupas por repetición. Se consideró un grupo testigo por tipo de extracto de cada planta evaluada, de igual manera, con 25 individuos en 250 mL. de agua potable declorinada. Todos los grupos se mantuvieron con un rango de temperatura de 23 a 26º C y humedad relativa de 75 a 80%. Las lecturas de mortalidad se realizaron a las 24 y 48 horas. Las pupas se consideraron muertas cuando mostraban distensión y desequilibrio corporal en la superficie de la solución del vaso. También se utilizó una hoja técnica estándar propuesta por la World Health Organization para el registro y evaluación del bioensayo (World Health Organization, 2005, Bobadilla et al., 2003) (Anexo 16 y 17).. 2.1.4. Análisis estadístico. Se empleó el Software StatPlus 2007 Profesional Ver. 4.5.0.0 para el cálculo de la concentraciones letales al 50% (CL50) mediante la transformación probit con el método Finney.. 19.
(20) 3. FASE EXPERIMENTAL EN CAMPO SIMULADO. 3.1.1. SELECCIÓN DE ESPECIES VEGETALES. Se seleccionaron cinco plantas y un tipo de extracto con mayor efecto tóxico sobre larvas y pupas.. 3.1.2. ELECCIÓN DE UNIDADES EXPERIMENTALES. Se tomaron como patrón de referencia a depósitos artificiales tipo baldes de 15 litros de capacidad de marca Q-Plast® y Duraplast® La elección del tratamiento por cada unidad experimental y del control se realizó empleando una tabla de números aleatorios. A los baldes prueba y control se les asignó un código en base a un muestreo sin reposición, donde un código solo puede ser elegido una vez con la misma probabilidad de ser elegidos. En esta asignación el primer código (letras del alfabeto) escrito en papel, fue el indicado para el grupo control y el resto para los experimentales [Ventosilla, 2001 (Modificado en parte por el autor); World Health Organization, 2005].. 3.1.3. BIOENSAYOS. Los bioensayos se realizaron según los resultados del ensayo en laboratorio, teniendo en cuenta el empleo de un solo tipo de extracto foliar y la mayor concentración de las 5 pIantas con los más altos índices de mortalidad para ambos estadios. Inicialmente los baldes se desinfectaron con lejía al 20%. Luego de enjuagar con abundante agua, se colocó 10 litros de agua de grifo (18 centímetros de altura) para reposarla por tres días antes de la aplicación de los extractos. Posteriormente, se incorporaron unas 100 larvas y 100 pupas para aclimatación de 3 horas y se añadieron sólo a los depósitos de larvas, unos 500 mg de alimento. Finalmente, la concentración correspondiente se aplicó al. 20.
(21) mediodía, homogenizando bien la mezcla con una pipeta de vidrio. Los tiempos de evaluación a considerar fueron a las 24 y 48 horas, empleando 4 repeticiones por concentración y por extracto Para un mejor orden de la toma de datos, se utilizó una hoja técnica estándar propuesta por la World Health Organization (2005) (Anexo 18).. 3.1.4. PARÁMETROS FÍSICOS. Durante el proceso de evaluación a las 24 y 48 horas, se registraron los valores de pH, temperatura ambiental y temperatura del agua (World Health Organization, 2005).. 3.1.5. ANÁLISIS ESTADÍSTICO. Se empleó el Software StatPlus 2007 Profesional Ver. 4.5.0.0 para el cálculo de la concentraciones letales al 50% (CL50) mediante la transformación probit con el método Finney (Ostle, 1990; World Health Organization, 2005).. Además, se empleó un análisis de varianza para un experimento bifactorial con arreglo combinatorio en diseño completamente aleatorizado con submuestreo y el Test de Duncan para hallar diferencias de tratamientos mediante el programa SPSS Ver. 12.. 21.
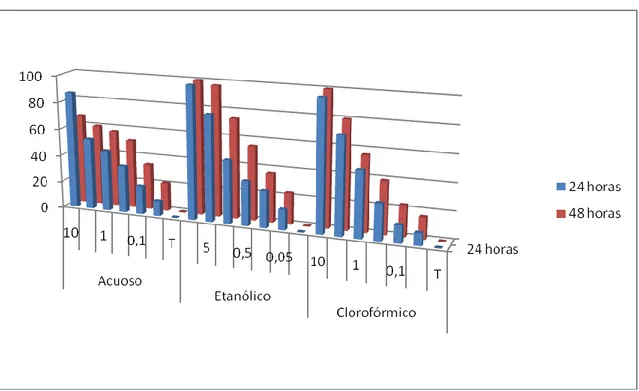
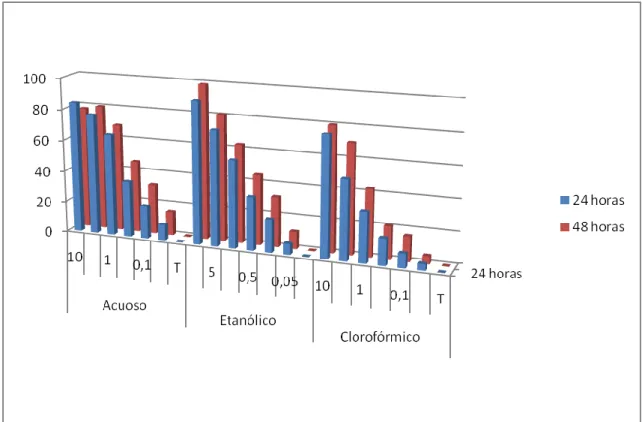
(22) RESULTADOS:. BIOENSAYO EN LABORATORIO:. Las tablas 1 á 5 muestran el porcentaje de mortalidad de larvas, en tanto que las tablas 6 a 10, la mortalidad en pupas por efecto de los extractos foliares acuoso, etanólico, clorofórmico de las 10 especies vegetales.. El ExETOH y ExCHCl3 de A. cherimola y A. muricata muestran un patrón de mortalidad larvaria superior al 65% con el 5% de concentración a las 24 horas (Tabla 1). La tendencia es similar si comparamos los resultados de la mortalidad en pupas, del orden del 100% a la misma concentración y tiempo (Tabla 6). De igual manera, A. subfusiformis (Tabla 2), N tabacum, R. communis (Tabla 3), S. molle (Tabla 4) y V. litoralis (Tabla 5) denotan mayor mortalidad en dichos extractos, superior al 72% y 80% en larvas y pupas (Tablas de 6 a 10), respectivamente, a la misma concentración y tiempo.. Los ExAcs registran valores de mortalidad en larvas y pupas relativamente inferiores a ExEtOH y ExCHCl3 de las 10 plantas del orden de 76% y 100 en A. cherimola, 65% y 100% en A. muricata, 100% y 88% en A. subfusiformis, 23% y 27% en Ch. ambrosioides, 92% y 90% en N. tabacum, 53% y 77 en R. communis, 77% y 78% en R. graveolens, 63% y 62% en S. molle, 17% y 33% en T. minuta y 99% y 42% en V. litoralis, respectivamente, a la misma concentración y tiempo.. Los mismos resultados se muestran en las figuras 1 á 20 con gráficos tridimensionales que reflejan comparativamente la tendencia de la mortalidad de los extractos foliares de las diez plantas en ambos tiempos de exposición.. Las tablas 11 relacionan los valores de concentraciones letales al 50% de los extractos foliares de las diez plantas por ambos tiempos, en larvas del mosquito,. 22.
(23) respectivamente. En general, A. subfusiformis, V. litoralis y A. muricata muestran la mayor eficiencia de control a las 24 y 48 horas en los tres tipos de extractos foliares, sin embargo, R. graveolens, T. minuta y Ch. ambrosiodes muestran poca eficiencia. Aquellas emplean 0.09%, 0,21% y 0.38% de ExETOH, respectivamente mientras que las tres últimas emplean 0,87%, 7.23% y 9.12% del mismo extracto y a la vez, son comparativamente más efectivas que ExAc y ExCHCl3.. Las tablas 12 relacionan los valores de concentraciones letales al 50% de los extractos de las diez plantas por ambos tiempos, en pupas del mosquito, respectivamente. Según se observa, A. cherimola, V. litoralis y A. muricata muestran la mayor eficiencia de control a las 24 y 48 horas en los tres tipos de extractos foliares, sin embargo, R. graveolens junto a S. molle, Ch. ambrosiodes y T. minuta muestran poca eficiencia. Aquellas emplean 0.07%, 0,13% y 0.14% de ExETOH, respectivamente mientras que las cuatro últimas emplean 0,30%, 8.16% y 8.62% del mismo extracto y a la vez, son comparativamente más efectivas que ExAc y ExCHCl3.. 23.
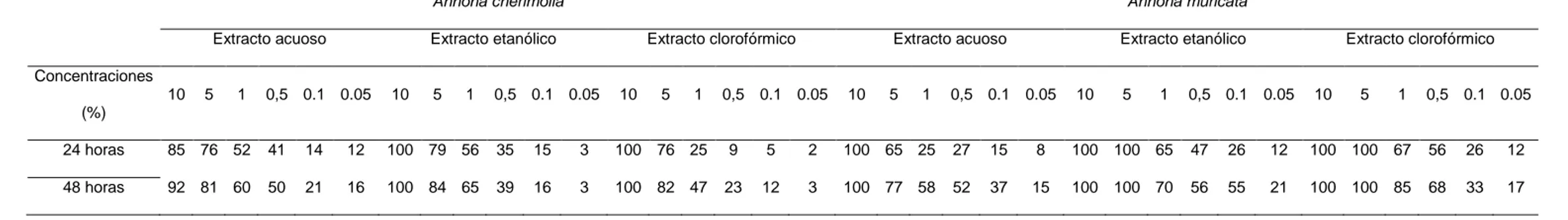
(24) Tabla 1. Porcentaje de mortalidad larvaria de los extractos foliares acuoso, etanólico y clorofórmico de Annona cherimola y A. muricata. Annona cherimolia Extracto acuoso. Annona muricata. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10. 5. 1. 0,5 0.1 0.05. 10. 5. 1. 0,5 0.1 0.05. 10. 5. 1. 0,5 0.1 0.05. 10. 5. 1. 0,5 0.1 0.05. 10. 5. 1. 0,5 0.1 0.05. 10. 5. 1. 0,5 0.1 0.05. (%) 24 horas. 85 76 52. 41. 14. 12. 100 79 56. 35. 15. 3. 100 76 25. 9. 5. 2. 100 65 25. 27. 15. 8. 100 100 65. 47. 26. 12. 100 100 67. 56. 26. 12. 48 horas. 92 81 60. 50. 21. 16. 100 84 65. 39. 16. 3. 100 82 47. 23. 12. 3. 100 77 58. 52. 37. 15. 100 100 70. 56. 55. 21. 100 100 85. 68. 33. 17. Tabla 2. Porcentaje de mortalidad larvaria de los extractos foliares acuoso, etanólico y clorofórmico de Argemone subfusiformis y Chenopodium ambrosioides. Argemone subfusiformis Extracto acuoso. Chenopodium ambrosioides. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05. 10 5. 1. 0,5 0.1 0.05 10 5. 1. 0,5 0.1 0.05 10 5. 1. 0,5 0.1 0.05. (%) 24 horas. 100 100 77. 61. 38. 15. 100 100 86. 77. 48. 45. 100 100 85. 67. 47. 34. 36 23 15. 3. 0. 0. 56 43 25. 13. 2. 0. 55 39 22. 10. 4. 1. 48 horas. 100 100 85. 68. 52. 23. 100 100 91. 84. 74. 56. 100 100 93. 82. 65. 54. 45 34 22. 5. 0. 0. 70 54 35. 18. 8. 1. 73 51 32. 14. 5. 2.
(25) Tabla 3. Porcentaje de mortalidad larvaria de los extractos foliares acuoso, etanólico y clorofórmico de Nicotiana tabacum y Ricinus communis. Nicotiana tabacum Extracto acuoso. Ricinus communis. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10. 5. 24 horas. 100. 48 horas. 100. 1. 0,5. 0.1. 0.05. 10. 5. 92 73. 52. 40. 36. 94. 98 85. 75. 54. 47. 98. 1. 0,5. 0.1. 0.05. 10. 5. 73 62. 41. 14. 9. 96. 85 74. 57. 20. 18. 97. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. 88 75. 61. 45. 32. 87. 53. 45 35. 21. 11. 99. 79. 47. 33. 27. 15. 97. 72. 49. 27. 13. 9. 93 79. 73. 51. 49. 97. 60. 57 51. 34. 21. 100. 97. 74. 55. 36. 23. 100. 80. 56. 39. 23. 16. (%). Tabla 4. Porcentaje de mortalidad larvaria de los extractos foliares acuoso, etanólico y clorofórmico de Ruta graveolens y Schinus molle. Ruta graveolens Extracto acuoso. Schinus molle. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10. 5. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. 24 horas. 78. 77. 65. 36. 21. 10. 91. 74. 56. 34. 21. 7. 67. 51. 32. 17. 9. 4. 76. 63. 46. 29. 21. 12. 97. 81. 75. 42. 27. 12. 90. 86. 74. 54. 29. 10. 48 horas. 84. 80. 69. 46. 32. 15. 99. 81. 63. 45. 32. 11. 82. 70. 43. 21. 16. 5. 88. 81. 64. 43. 38. 24. 100. 99. 93. 77. 53. 46. 97. 89. 80. 61. 49. 21. (%). 25.
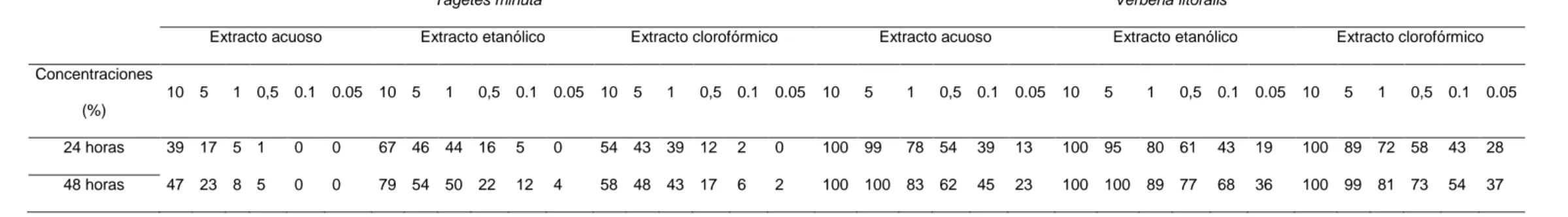
(26) Tabla 5. Porcentaje de mortalidad larvaria de los extractos foliares acuoso, etanólico y clorofórmico de Tagetes minuta y Verbena litoralis.. Tagetes minuta Extracto acuoso. Verbena litoralis. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10 5. 1 0,5 0.1 0.05. 10 5. 1. 0,5 0.1 0.05. 10 5. 1. 0,5 0.1 0.05. 10. 5. 1. 0,5 0.1. 0.05. 10. 5. 1. 0,5. 0.1 0.05. 10. 5. 1. 0,5 0.1. 0.05. (%) 24 horas. 39 17 5 1. 0. 0. 67 46 44 16. 5. 0. 54 43 39 12. 2. 0. 100. 99. 78 54. 39. 13. 100. 95. 80 61. 43. 19. 100. 89. 72 58. 43. 28. 48 horas. 47 23 8 5. 0. 0. 79 54 50 22. 12. 4. 58 48 43 17. 6. 2. 100. 100. 83 62. 45. 23. 100. 100. 89 77. 68. 36. 100. 99. 81 73. 54. 37. Tabla 6. Porcentaje de mortalidad en pupas de los extractos foliares acuoso, etanólico y clorofórmico de Annona cherimola y A. muricata. Annona cherimola Extracto acuoso. Annona muricata. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05. (%) 24 horas. 100 100 91 72. 55. 25. 100 100. 95. 81. 58. 45. 100 100 100. 82. 56. 39. 100 100 85. 71. 56. 44. 100 100 87. 65. 49. 30. 100 100 77. 62. 48. 39. 48 horas. 100 100 99 97. 68. 39. 100 100 100. 96. 75. 70. 100 100 100. 95. 71. 52. 100 100 95. 84. 65. 57. 100 100 99. 82. 53. 43. 100 100 88. 72. 60. 55. 26.
(27) Tabla 7. Porcentaje de mortalidad en pupas de los extractos foliares acuoso, etanólico y clorofórmico de Argemone subfusiformis y Chenopodium ambrosioides.. Argemone subfusiformis Extracto acuoso. Chenopodium ambrosioides. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10. 5. 1. 0,5 0.1 0.05. 10. 5. 1. 0,5 0.1 0.05. 10. 5. 1. 0,5 0.1 0.05. 10 5. 1. 0,5 0.1 0.05. 10 5. 1. 0,5 0.1 0.05. 10 5. 1. 0,5 0.1 0.05. (%) 24 horas. 97. 88 60. 44. 32. 23. 100 100 80. 67. 48. 21. 100. 99. 80. 65. 34. 20. 38 27 12. 3. 0. 0. 65 37 21. 13. 3. 0. 50 36 12. 7. 0. 0. 48 horas. 100 97 71. 53. 49. 31. 100 100 96. 81. 70. 31. 100 100 91. 79. 55. 30. 53 52 19. 6. 0. 0. 86 50 27. 22. 4. 0. 57 46 20. 13. 0. 0. Tabla 8. Porcentaje de mortalidad en pupas de los extractos foliares acuoso, etanólico y clorofórmico de Nicotiana tabacum y Ricinus communis. Nicotiana tabacum Extracto acuoso. Ricinus communis. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05. 88. 92. (%) 24 horas. 100 90 76. 46. 39. 11. 100 100 82. 65. 49. 32. 100 100 89. 71. 34. 20. 90. 77 47. 32. 14. 8. 100. 62. 34. 21. 6. 100. 83. 54. 22. 16. 48 horas. 100 95 82. 55. 40. 19. 100 100 96. 76. 61. 49. 100 100 95. 82. 48. 31. 100 84 58. 45. 27. 19. 100 100 71. 60. 35. 14. 100 100 90. 61. 41. 23. 27.
(28) Tabla 9. Porcentaje de mortalidad en pupas de los extractos foliares acuoso, etanólico y clorofórmico de Ruta graveolens y Schinus molle.. Ruta graveolens Extracto acuoso. Schinus molle. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05 10. 5. 1. 0,5 0.1 0.05. (%) 24 horas. 98. 78 54. 25. 18. 9. 100. 98. 61. 45. 38. 24. 100 100 73. 60. 43. 20. 80 62 45. 23. 12. 8. 100 95 76. 54. 33. 12. 100. 99. 81. 54. 40. 27. 48 horas. 100 89 60. 47. 22. 15. 100 100 77. 58. 57. 30. 100 100 84. 69. 62. 35. 95 88 72. 39. 27. 15. 100 98 83. 68. 47. 23. 100 100 92. 72. 56. 34. Tabla 10. Porcentaje de mortalidad en pupas de los extractos foliares acuoso, etanólico y clorofórmico de Tagetes minuta y Verbena litoralis.. Tagetes minuta Extracto acuoso. Verbena litoralis. Extracto etanólico. Extracto clorofórmico. Extracto acuoso. Extracto etanólico. Extracto clorofórmico. Concentraciones 10 5. 1. 0,5. 0.1. 0.05. 10 5. 1. 0,5. 0.1. 0.05. 10 5. 1. 0,5. 0.1. 0.05. 10 5. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. 10. 5. 1. 0,5. 0.1. 0.05. (%) 24 horas. 42 33 13. 3. 0. 0. 65 22. 9. 4. 0. 0. 74 51 26. 3. 3. 0. 90 75. 51. 33. 21. 12. 100. 90 72. 68. 41. 36. 100. 80. 61. 34. 21. 10. 48 horas. 52 46 16. 7. 0. 0. 74 39 15. 6. 0. 0. 86 59 35. 9. 5. 0. 97 86. 58. 45. 38. 20. 100. 97 85. 71. 58. 45. 100. 100. 70. 49. 32. 19. 28.
(29) Figura 1. Porcentaje comparativo de la mortalidad de extractos foliares de Annona cherimolia sobre larvas del IV estadio de Aedes aegypti. Figura 2. Porcentaje comparativo de la mortalidad de extractos foliares de Annona muricata sobre larvas del IV estadio de Aedes aegypti.
(30) Figura 3. Porcentaje comparativo de la mortalidad de extractos foliares de Argemone subfusiformis sobre larvas del IV estadio de Aedes aegypti. Figura 4. Porcentaje comparativo de la mortalidad de extractos foliares de Chenopodium ambrosioides sobre larvas del IV estadio de Aedes aegypti. 30.
(31) Figura 5. Porcentaje comparativo de la mortalidad de extractos foliares de Nicotiana tabacum sobre larvas del IV estadio de Aedes aegypti. Figura 6. Porcentaje comparativo de la mortalidad de extractos foliares de Ricinus communis sobre larvas del IV estadio de Aedes aegypti. 31.
(32) Figura 7. Porcentaje comparativo de la mortalidad de extractos foliares de Ruta graveolens sobre larvas del IV estadio de Aedes aegypti. Figura 8. Porcentaje comparativo de la mortalidad de extractos foliares de Schinus molle sobre larvas del IV estadio de Aedes aegypti. 32.
(33) Figura 9. Porcentaje comparativo de la mortalidad de extractos foliares de Tagetes minuta sobre larvas del IV estadio de Aedes aegypti. Figura 10. Porcentaje comparativo de la mortalidad de extractos foliares de Verbena litoralis sobre larvas del IV estadio de Aedes aegypti. 33.
(34) Figura 11. Porcentaje comparativo de la mortalidad de extractos foliares de Annona cherimolia sobre pupas de Aedes aegypti. Figura 12. Porcentaje comparativo de la mortalidad de extractos foliares de Annona muricata sobre pupas de Aedes aegypti. 34.
(35) Figura 13. Porcentaje comparativo de la mortalidad de extractos foliares de Argemone subfusiformis sobre pupas de Aedes aegypti. Figura 14. Porcentaje comparativo de la mortalidad de extractos foliares de Chenopodium ambrosioides sobre pupas de Aedes aegypti. 35.
(36) Figura 15. Porcentaje comparativo de la mortalidad de extractos foliares de Nicotiana tabacum sobre pupas de Aedes aegypti. Figura 16. Porcentaje comparativo de la mortalidad de extractos foliares de Ricinus communis sobre pupas de Aedes aegypti. 36.
(37) Figura 17. Porcentaje comparativo de la mortalidad de extractos foliares de Ruta graveolens sobre pupas de Aedes aegypti. Figura 18. Porcentaje comparativo de la mortalidad de extractos foliares de Schinus molle sobre pupas de Aedes aegypti. 37.
(38) Figura 19. Porcentaje comparativo de la mortalidad de extractos foliares de Tagetes minuta sobre pupas de Aedes aegypti. Figura 20. Porcentaje comparativo de la mortalidad de extractos foliares de Verbena litoralis sobre pupas de Aedes aegypti. 38.
(39) Tabla 11. Concentraciones letales al 50% de 10 plantas biocidas a las 24 y 48 horas de exposición de larvas del IV estadio de A. aegypti en tres tipos de extractos.. CL50 (%) Plantas. Tiempos de evaluación 24 horas. 48 horas. Extracto. Extracto. Extracto. Extracto. Extracto. Extracto. acuoso. etanólico. clorofórmico. acuoso. etanólico. clorofórmico. Annona cherimola. 0.92. 0.80. 1.75. 0.54. 0.64. 1.00. Annona muricata. 1.42. 0.38. 0.34. 0.42. 0.19. 0.21. Argemone subfusiformis. 0.23. 0.09. 0.13. 0.14. 0.03. 0.04. Chenopodium ambrosioides. 16.43. 9.12. 8.67. 13.16. 4.20. 4.81. Nicotiana tabacum. 0.20. 0.77. 0.17. 0.07. 0.37. 0.07. Ricinus communis. 1.42. 0.68. 1.03. 0.89. 0.24. 0.57. Ruta graveolens. 0.78. 0.87. 3.90. 0.53. 0.47. 1.58. Schinus molle. 1.57. 0.46. 0.41. 0.40. 0.04. 0.19. Tagetes minuta. 13.44. 7.23. 8.28. 11.87. 1.05. 5.98. Verbena litoralis. 0.26. 0.21. 0.21. 0.16. 0.08. 0.10. 39.
(40) Tabla 12. Concentraciones letales al 50% de 10 plantas biocidas a las 24 y 48 horas de exposición en pupas de A. aegypti en tres tipos de extractos.. CL50 (%) Plantas. Tiempos de evaluación 24 horas. 48 horas. Extracto. Extracto. Extracto. Extracto. Extracto. Extracto. acuoso. etanólico. clorofórmico. acuoso. etanólico. clorofórmico. Annona cherimola. 0.12. 0.07. 0.08. 0.06. 0.02. 0.04. Annona muricata. 0.08. 0.14. 0.13. 0.04. 0.08. 0.06. Argemone subfusiformis. 0.38. 0.17. 0.21. 0.18. 0.08. 0.10. Chenopodium ambrosioides. 14.73. 8.16. 10.08. 4.39. 5.07. 8.08. Nicotiana tabacum. 0.32. 0.14. 0.18. 0.23. 0.14. 0.11. Ricinus communis. 1.04. 0.60. 0.31. 0.45. 0.26. 0.17. Ruta graveolens. 0.85. 0.30. 0.20. 0.46. 0.14. 0.10. Schinus molle. 1.81. 0.30. 0.19. 0.44. 0.16. 0.10. Tagetes minuta. 11.28. 8.62. 5.31. 9.70. 7.19. 4.17. Verbena litoralis. 0.88. 0.13. 0.64. 0.38. 0.06. 0.30. 40.
(41) BIOENSAYO EN CAMPO SIMULADO:. Las tablas 13 y 14 muestran el porcentaje de mortalidad de larvas por el extracto foliar etanólico de las 5 especies catalogadas como más efectivas según el bioensayo en laboratorio. Se muestra que a las 48 horas la máxima concentración se obtiene un 44%, 66%, 67%, 69% y 70% de mortalidad en V. litoralis, A cherimola, A muricata, N. tabacum y A. subfusiformis, respectivamente, y a concentraciones inferiores a 0.5% la mortalidad no sobrepasa el 19%.. Las tablas 15 y 16 registran la mortalidad en pupas, de igual manera, bajo un solo extracto foliar etanólico de las cinco especies más efectivas según el bioensayo de laboratorio. A las 48 horas se obtiene 49 54 56, 60 y 96% de mortalidad en V. litoralis, A cherimola, A muricata, N. tabacum y A. subfusiformis, respectivamente, en tanto que a concentraciones a 0.5% la mortalidad no pasa del 15%.. Alternativamente, las figuras 21 y 22 muestran comparativamente en gráficos tridimensionales, la tendencia de la mortalidad desde las 24 hasta las 48 horas de exposición.. Las tablas 17 y 18 relacionan los valores de concentraciones letales al 50% del extracto etanólico de dichas plantas por ambos tiempos en larvas y pupas del mosquito, respectivamente. La tabla 17, correspondiente a larvas, muestra la efectividad de A. subfusiformis con 7.23% y 4.76%, mientras que V. litoralis presenta 17,9% y 12.13% a las 24 y 48 horas, respectivamente. De otro lado, La tabla 18, correspondiente a pupas, muestra la efectividad de N. tabacum con 4.41% y 1.72%, mientras que V. litoralis muestra 13,08% y 10.66% a las 24 y 48 horas, respectivamente.. La tabla 19 muestra los parámetros físicos (temperatura ambiental, temperatura del agua y pH del agua) dentro del tiempo de duración del bioensayo en campo simulado.. 41.
(42) Tabla 13. Porcentaje de mortalidad larvaria del extracto foliar etanólico de Annona cherimola, A.muricata y Argemone subfusiformis a las 24 y 48 horas de exposición.. Extracto etanólico Annona cherimola. Annona muricata. Argemone subfusiformis. Concentración 10. 5. 1. 0.5. 0.1. 0.05. Testigo. 10. 5. 1. 0.5. 0.1. 0.05. Testigo. 10. 5. 1. 0.5. 0.1. 0.05. Testigo. 24 horas. 54. 42. 29. 7. 0. 0. 0. 59. 43. 23. 7. 0. 0. 0. 61. 46. 34. 4. 0. 0. 0. 48 horas. 66. 48. 37. 15. 0. 0. 0. 67. 52. 33. 8. 0. 0. 0. 70. 55. 44. 19. 0. 0. 0. (%).
(43) Tabla 14. Porcentaje de mortalidad larvaria del extracto foliar etanólico de Nicotiana tabacum y Verbena litoralis a las 24 y 48 horas de exposición.. Extracto etanólico Nicotiana tabacum. Verbena litoralis. Concentración 10. 5. 1. 0.5. 0.1. 0.05. Testigo. 10. 5. 1. 0.5. 0.1. 0.05. Testigo. 24 horas. 47. 45. 17. 5. 0. 0. 0. 32. 21. 3. 0. 0. 0. 0. 48 horas. 69. 60. 46. 7. 0. 0. 0. 44. 26. 5. 0. 0. 0. 0. (%). 43.
(44) Tabla 15. Porcentaje de mortalidad en pupas del extracto foliar etanólico de Annona cherimola, A.muricata y Argemone subfusiformis a las 24 y 48 horas de exposición. .. Extracto etanólico Annona cherimola. Annona muricata. Argemone subfusiformis. Concentración 10. 5. 1. 0.5. 0.1. 0.05. Testigo. 10. 5. 1. 0.5. 0.1. 0.05 Testigo. 24 horas. 50. 18. 5. 0. 0. 0. 0. 49. 41. 18. 1. 0. 0. 48 horas. 56. 32. 7. 0. 0. 0. 0. 54. 53. 32. 3. 0. 0. 10. 5. 1. 0.5. 0.1. 0.05. Testigo. 0. 76. 50. 34. 8. 0. 0. 0. 0. 89. 60. 41. 12. 0. 0. 0. (%). 44.
(45) Tabla 16. Porcentaje de mortalidad en pupas del extracto foliar etanólico de Nicotiana tabacum y Verbena litoralis a las 24 y 48 horas de exposición.. Extracto etanólico Nicotiana tabacum. Verbena litoralis. Concentración 10. 5. 1. 0.5. 0.1. 0.05. Testigo. 10. 5. 1. 0.5. 0.1. 0.05. Testigo. 24 horas. 82. 53. 23. 9. 1. 0. 0. 40. 23. 14. 0. 0. 0. 0. 48 horas. 96. 72. 46. 15. 3. 0. 0. 49. 30. 18. 2. 0. 0. 0. (%). 45.
(46) Figura 21. Porcentaje comparativo de la mortalidad de larvas del IV estadio de Aedes aegypti por el extracto foliar etanólico de Annona cherimola, A. muricata, Argemone subfusiformis, Nicotiana tabacum y Verbena litoralis.. Figura 22. Porcentaje comparativo de la mortalidad en pupas de de Aedes aegypti por el extracto foliar etanólico de Annona cherimola, A. muricata, Argemone subfusiformis, Nicotiana tabacum y Verbena litoralis..
(47) Tabla 17. Concentraciones letales al 50% del extracto etanólico de 5 plantas biocidas a las 24 y 48 horas de exposición de larvas del IV estadio de A. aegypti.. Extracto etanólico Plantas CL50 (%). 24 horas. 48 horas. Annona cherimola. 8.91. 5.45. Annona muricata. 9.08. 4.92. Argemone subfusiformis. 7.23. 4.76. Nicotiana tabacum. 12.16. 3.78. Verbena litoralis. 17.90. 12.13. Tabla 18. Concentraciones letales al 50% del extracto etanólico de 5 plantas biocidas a las 24 y 48 horas de exposición en pupas de A. aegypti.. Extracto etanólico Plantas CL50 (%). 24 horas. 48 horas. Annona cherimola. 10.03. 9.33. Annona muricata. 10.89. 4.70. Argemone subfusiformis. 5.11. 3.92. Nicotiana tabacum. 4.41. 1.72. Verbena litoralis. 13.08. 10.66. 47.
(48) Tabla 19. Parámetros físicos del bioensayo en campo simulado. En todos los casos se registran el promedio de los datos posteriores al bioensayo alrededor del mediodía. Meses de evaluación Parámetros físico. Abr.. May.. Jun.. Jul.. Agos.. Set.. Oct.. Nov.. Dic.. Promedio. Temperatura ambiental. 23. 22. 17. 16. 17. 18. 18. 19. 21. 19. 19. 18. 17. 15. 16. 16. 17. 18. 18. 17.1. 6.5. 6.5. 7.0. 7.0. 7.0. 6.5. 7.0. 7.5. 7.0. 6.9. (°C) Temperatura del agua (°C) pH del agua.
(49) DISCUSIÓN. Tal como documentan Firn & Jones (2003); Medappa (2003) y Spainhour (2005) los productos naturales poseen una amplia gama de compuestos químicos conocidos como terpenoides, flavonoides, alcaloides, aceites esenciales, entre otros, que provienen de plantas, suplementos dietéticos o medicina alternativa de origen microbiano, vegetal o animal con efecto biológico determinado. Por ello, las bioactividades de dichos fitoconstituyentes, han sido investigadas particularmente en el campo agrícola por Andersson (2003), Rahman et al. (2003), Cestari et al. (2004), Chiasson et al. (2004), en el campo de la salud pública por Green et al. (1993), Ioset et al. (2000), Awad (2003), Ramos et al. (2006), Rongsriyam et al. (2006) y a través de antecedentes históricos que han revelado el potencial de muchas plantas como insecticidas naturales para combatir mosquitos de importancia en salud pública (Choochote et al., 2004; World Health Organization, 1997; Tamez, et al., 2001) utilizando especies de diversos grupos taxonómicos (Pohlit, 2004) o partes vegetales (Sing, 2003) procesadas como extractos acuosos, orgánicos o compuestos puros (Young-Su, 2002; George, 2005).. Los conocimientos ancestrales acerca de los extractos botánicos y sus principios activos, tienen como base las fracciones hidroalcohólicas de uso muy ampliado en etnomedicina (Rodríguez, 1996; Thacker, 2002). Es por eso que se trabajó separadamente tres tipos distintos de fracciones, la acuosa, la etanólica y la clorofórmica y con la obtención de los principios activos en resuspensión con agua destilada, se descartó el efecto tóxico de aquellos solventes orgánicos tal como lo ensayó Bobadilla et al. (2005) con buenos resultados. Estudios basados en el aislamiento y sustancias de diferentes especies vegetales muestran que las fracciones biodirigidas son de característica primordial en la evaluación de tales extractos tóxicos botánicos, y emplean a A. aegypti entre otros invertebrados como bioindicadores (Hostettmann, 1997; Mc Laughlin, 1998).. Investigaciones llevadas a cabo a nivel nacional e internacional (Pushpalatha et al., 1999; Trujillo, 2001; Bobadilla et al., 2003; Iannacone, 2003; Bobadilla et al, Pérez, 2006; Bobadilla et al, 2007) respaldan el potencial larvicida y pupicida (Nayar & Ali, 2003) de las.
(50) plantas consideradas en esta investigación, pero en adelante, dirigido a la búsqueda de alternativas complementarias que disminuyan los niveles de incidencia del vector del dengue en centros poblacionales con libre disponibilidad de acceso de estos u otros vegetales, según lo manifiestan la Organización Panamericana de la Salud, (2001) y Bermúdez et al. (2005). Bajo este contexto inicial, los extractos foliares de las 10 especies vegetales analizadas han permitido constatar que en la mayoría de casos el efecto radica en la fracciones apolares tal y como lo demuestran los resultados en larvas y pupas de las tablas 1 á 10 y figuras 1 á 20 del bioensayo en laboratorio, con eficacia superior al 50% a las 24 horas, y las tablas 13 á 16 y figuras 21 y 22 en campo simulado, con mortalidad superior a 80% a las 24 horas, tal y como lo reportan Pérez (2002); Bobadilla et al. (2003). Sin embargo, dichos resultados son relativamente semejantes con las fracciones polares, a pesar que la fracción apolar fue difícil rediluir el extracto seco debido a la obtención de compuestos clorofílicos propios de las hojas, o a los compuestos químicos altamente metoxilados dentro del mismo grupo taxonómico vegetal, (Bruneton, 2001). Un detalle es observar en el bioensayo en laboratorio, que A. subfusiformis que emplea 0.09% (24 horas/ExETOH) y 0.03% (48 horas/ExETOH), N. tabacum 0.20% (24 horas/ExAc) y 0.07% (48 horas/ ExAc y ExCHCl3), V. litoralis 0.21% (24 horas/ExETOH y ExCHCl3) y 0.08% (48 horas/ExETOH) y A. muricata 0.34% (24 horas/ExCHCl3) y 0.19% (48 horas/ExETOH), con relación a Ch. ambrosioides que necesita de 8.67% (24 horas/ExCHCl3) y 4.20% (48 horas/ExETOH) así como T. minuta que emplea 7.23% (24 horas/ExETOH) y 1.05% (48 horas/ExETOH)(Tabla 11). Tendencia similares se observan en la tabla 12 para el control en pupas, que indican a A. cherimola emplear 0.07 % (24 horas/ExETOH) y 0.02% (48 horas/ExETOH), A. muricata 0.08% (24 horas/ExAc) y 0.04% (48 horas/ExCHCl3) y A. subfusiformis 0.17% (24 horas/ExETOH) y 0.08% (48 horas/ExETOH), mientras que R. communis y R. graveolens, requieren de 0.31% (24 horas/ExCHCl3) a 0.17% (48 horas/ExCHCl3) y 0.20% (24 horas/ExCHCl3) a 0.10% (48 horas/ExCHCl3), respectivamente. Según Joy et al. (1998), la fundamentación de estos resultados radica en el tipo de principios activos o metabolitos secundarios de las anonáceas, papaveráceas, asteráceas respecto de las euforbiáceas, chenopodiáceas, anacardiáceas y rutáceas, pues los hallazgos sugieren un. 50.
(51) patrón de formulación medicinal efectiva muy reconocida cuya tendencia puede repetirse ahora pero desde el punto de vista de la acción biocida sobre larvas y pupas de A. aegypti u otros vectores de importancia medica, tal y como lo han demostrado Perich et al. (1995); Kumar et al. (2000); Jaswanth et al., (2002); Pérez (2002); Pérez et al. (2004) y Chiasson et al. (2004).. Igualmente, en campo simulado, el cual se realizó únicamente con el extracto foliar etanólico, la diferencia no es muy amplia a pesar de la influencia de los parámetros físicos de pH y temperatura como factores fundamentales que intervienen en la biodegradación de muchas sustancias naturales (Vythilingam, 2005; World Health Organization, 2005). A las 24 horas A. subfusiformis controla al 50% larvas con 7.23% y V. litoralis con 17.90%, mientras que N. tabacum controla al 50% de pupas con 4.41% y V. litoralis con 13.08% del extracto. En tanto que en larvas a las 48 horas, N. tabacum controla con 3.78% y V. litoralis con 12.13%, mientras que en pupas, N. tabacum controla con 1.72% y V. litoralis con 10.66% (Tablas 17 y 18). Dichos resultados evidencian el efecto de la temperatura del aire, agua y pH, los cuales no mostraron cambios significativos durante todo el tiempo de evaluación (Tabla 19), pero modificaron la intensidad de acción de los principios activos de las cinco plantas sobre la mortalidad de larvas y pupas (Tablas 14 á 16) en relación a los realizados en laboratorio. Por ejemplo, en larvas en condiciones de laboratorio, a un 10% de concentración se obtiene un 100% de mortalidad a las 24 horas con A. cherimolia; en tanto que en campo simulado se tiene un 54% de control. La misma tendencia se observa en A. muricata, con un 100% de mortalidad al 10% y 5% mientras que en campo simulado se llega al 59% y 43%, respectivamente (Tablas 1-5 y 13-14). La acción es muy parecida cuando se comparan a las mismas concentraciones el efecto sobre las pupas (Tablas 6-10 y 15-16).. De otro lado, las tablas 11-12 y 17-18 registran los valores de concentraciones letales medias (CL50) del bioensayo sobre larvas y pupas en laboratorio y campo simulado respectivamente, ambos, con un nivel de significación del 0.05. La efectividad frente a ambos estadios se ha podido analizar en función al empleo de la menor o mayor cantidad efectiva de los extractos foliares orgánicos o inorgánicos versus el tiempo de evaluación capaz de controlar al 50% de los individuos expuestos, parámetros fundamentales en estudio de toxicidad de. 51.
(52) vegetales. Esto hace referencia a que las plantas desarrollan una mayor actividad cuando emplea menos extracto en un tiempo determinado. Al considerar la relación tiempo, planta, tipos de extracto y condiciones del bioensayo argumentamos como posibles causales de mortalidad los principios activos, parámetros físicos ambientales y capacidad de degradación (detoxificación) de los organismos de prueba (Tormo et al, 1999). Según Alvarez et al. (1996); Silva et al. (2002); Casida (2002) y Bermúdez et al. (2005) la toxicidad ejerce efecto por contacto e ingesta, desacoplando complejos enzimáticos de la cadena respiratoria, sistema nervios, sistema respiratorio, desorganización de la membrana peritrófica o inhibición de síntesis de proteínas, aunque faltan de mayores elementos experimentales en esta investigación para validar dichas hipótesis.. En definitiva y tal como indican los resultados anteriores, es muy claro y lógico el fraccionamiento químico así como las condiciones de laboratorio y campo simulado respecto a la mayor o menor efectividad de los principios activos para evaluar indirectamente un patrón comparativo de degradación y permanencia en el tiempo de las sustancias capaces de mostrar su acción biológica (Jacobson, 1958; Stoll, 1989; Rodríguez, 2000), pero desde el punto de vista integral, con el empleo de diez plantas biocidas fraccionadas con agua (ExAc), etanol (ExETOH) y cloroformo (ExCHCl3), esta investigación constituiría en un real, concreto y inédito aporte en cuanto a la valoración botánica biocida de plantas aún no realizado dentro del ámbito local, regional y nacional.. Según Alali et al (1999); Ware (1999); Buss & Park-Brown (2002), las distintas variedades de principios activos actuarían bajo un efecto sinérgico en dos frentes sobre cada estadio, dado por el ataque de contacto e ingesta y en directa relación con la calidad y cantidad de principios activos los cuales variarán con el solvente de extracción, forma de redisolución, especie vegetal, estado fisiológico del insecto (larva o pupa) y condiciones de realización de los ensayos biológicos, lo cual es corroborado por las investigaciones muy bien realizadas por Adams (1983), Lagunes (1994), Leatemia (2004) y Shaalan et al. (2006) y que en grado elevado se explica con los resultados del presente estudio.. 52.
(53) Estrategias alternativas de uso de plantas para controlar al vector A. aegypti requieren de mayores evaluaciones en laboratorio y en campo definitivo. En esta investigación se destacó el principio fundamental de adaptación-adecuación, en el sentido de rescatar aquellos recursos naturales biocidas bajo la forma de hierbas, arbustos y árboles disponibles en zonas de emergencia con alta incidencia de dengue como la provincia de Trujillo y otros centros urbanos de la costa norte y central del Perú, para validar su utilidad y aplicarlos estratégicamente en futuras campañas de erradicación del vector, siendo necesario un enfoque de educación ambiental para denotar actitudes y disposición por contribuir a nuevos e innovadores programas en salud publica.. 53.
(54) PROPUESTA:. Teniendo en cuenta que A. aegpyti es un vector establecido en la región y a nivel nacional, investigaciones como la presente son el resultado de experiencias previas realizadas en el contexto de plagas agrícolas, la razón principal, ahora, es aplicar biocidas vegetales dentro de los lineamientos de búsqueda de alternativas locales en el control de artrópodos transmisores no solo de dengue, sino de fiebre amarilla y malaria, enfermedades causantes de grandes epidemias que atentarían en contra de la economía de los pueblos en deterioro de su desarrollo y calidad de vida. Por ello, los resultados del presente estudio permiten proponer:. 1. Continuar con mayores elementos de juicio analítico-experimentales, que se constituirá en la base inicial respecto a la gran ventaja en el uso de extractos orgánicos o inorgánicos de plantas biocidas de mayor recurrencia en la provincia de Trujillo en el control de estadios inmaduros de Aedes aegypti a libre elección del hipotético usuario, por emplear la planta de mayor alcance, el solvente (extracto) económicamente más conveniente y el tiempo de control apropiado, según sus necesidades.. 2. Elaborar preliminarmente “moños de plantas” para ensayarlos en campo simulado y en campo definitivo, previa evaluación de flora y fauna benéfica, como modelo comparativo con los insecticidas órganosfosforados en el control de estadios inmaduros del vector.. 3. Potenciar y masificar el empleo de extractos botánicos con el desarrollo de procedimientos de bioconservación y estabilización de principios activos sobre organismos meta, en laboratorio, campo simulado y campo definitivo.. 4. Ampliar la frontera de salud en acción por las autoridades competentes, condicionando el soporte etnobotánico hacia la toma de nuevas experiencias facultativas que demuestren y modelen un cambio de paradigmas en el contexto sociocultural local y regional acerca de la vasta utilidad de nuestra biodiversidad vegetal.. 54.
(55) 5. Poner en marcha por parte de los gobiernos locales y regionales, particularmente de la Dirección Regional de Salud, una futura educación ambiental en el ámbito no formal como paso inicial para la ampliación de una línea base que trace tareas correspondientes a una educación ambiental en el ámbito formal.. 55.
(56) CONCLUSIONES:. . Los extractos acuosos y orgánicos de las 10 especies vegetales evaluadas tanto en laboratorio como de las 5 especies evaluadas en campo simulado, muestran control sobre larvas del IV estadio y pupas de A. aegypti.. . En condiciones de laboratorio, los extractos foliares orgánicos de A. subfusiformis, N. tabacum, A. muricata, A. cherimola y V. litoralis muestran mayores niveles de control en larvas y pupas desde las 24 horas con un 100% de mortalidad y comparativamente menor en relación a Ch ambrosioides, R. communis, R. graveolens S. molle y T. minuta, del orden de 80%, con sus respectivos extractos acuosos.. . En condiciones de campo simulado, el extracto foliar etanólico de A. subfusiformis, N. tabacum, A. muricata, A. cherimola y V. litoralis muestran niveles de control en larvas superiores a 32% y pupas superiores a 40% desde las 24 horas de exposición.. . Dicho control es variable en proporción directa a las condiciones físicas del bioensayo, especies vegetales, concentraciones, tipos de extracto, tiempos de exposición y estado de desarrollo del vector.. 56.
(57) REFERENCIAS BIBLIOGRÁFICAS. Adams, R. 1983, Plants: The Potentials for Extracting Protein, Medicines, and Other Useful Chemicals–Workshop Proceedings (Washington, D. C.: U.S. Congress, Office of Technology Assessment, OTA-BP-F-23.).. Alali, F., Liu, X. & Mc Laughlin, J. 1999, Annonaceous acetogenins: Recent progress, J Nat Prod.; 62(3): 504-540. Álvarez, D., De la fuente, J.L., Villarrubia, O., Menéndez, J.C. y Ortiz, E. 1996, Actividad biológica de Ricinus communis sobre mosca doméstica (Musca domestica); Rev cubana med trop 48(3): 192-194.. Arruda, W., Cavasen, G. e Garcia, I. 2003, Toxicidade do extracto etanólico de Magonia pubescens sobre larvas de Aedes aegypti, Rev Soc Bras Med Trop; 36(1): 17-25.. Awad, O. & Shimaila, A. 2003, Operational use of neem oil as an alternative anopheline larvicide. Part A: Laboratory and field efficacy, Eastern Mediterranean Health Journal; 9(4): 637-645.. Andersson, Ch., Wennström, P. & Gry, J. 2003, Nicotine alkaloids in Solanaceous food plants, Nordic Council of Ministers, Copenhagen.. Bermúdez, A., Oliveira, M. & Velásquez, D. 2005, La investigación etnobotánica sobre plantas medicinales: Una revisión de sus objetivos y enfoques actuales, Interciencia; 30 (8): 453-459.. Bisset, J. 2002, Uso correcto de insecticidas: Control de la resistencia, Rev Cubana Med Trop; 54(3):202-219.. 57.
(58) Bisset, J., Rodríguez, M. y Cáceres, L. 2003, Niveles de resistencia a insecticidas y sus mecanismos en 2 cepas de Aedes aegypti de Panamá, Rev Cubana Med Trop; 55(3):191-195.. Bobadilla, M., Zavala, F., Sisniegas, M., Zavaleta, G. y Pollack, L. 2003, Evaluación tóxica comparativa de las semillas de Annona cherimolia, Annona muricata y Cucurbita maxima sobre larvas y pupas de Anopheles, REBIOL; 23 (1-2): 51-58.. Bobadilla, M., Zavala, F., Sisniegas, M., Zavaleta, G., Mostacero, J. y Taramona, L. 2005, Evaluación larvicida de suspensiones acuosas de Annona muricata Linnaeus “guanábana” sobre Aedes aegypti Linnaeus (Diptera, Culicidae) Rev. peru. Biol; 12(1): 145-152.. Bobadilla, M., Mostacero, J., Zavala, F., Castillo, F. y Gonzales, J. 2007, Control de larvas y pupas de Aedes aegypti L. con extractos foliares biocidas, Trujillo-Perú, Libro de resúmenes del IV Congreso Peruano de Ecología, Arequipa, Perú.. Brogdon, W. & Mcallister, J. 1998, Insecticide resistance and vector control, Emerging Infectious Diseases 4(4): 605-613.. da. Bruneton, J. 2001, Elementos de Fitoquímica y de Farmacognosia, 2. Edic., edit. Acribia,. España.. Büchi.1995, Manual de instrucciones para el uso de un rotavapor R-3000, Switzerland.. Buss, E & Park-Brown, S. 2002, Natural Products for Insect Pest Management, Institute of Food and Agricultural Sciences, University of Florida, Miami.. Cáceres, O. 2003, Detección rápida de los serotipos del virus dengue en el mosquito Aedes aegypti, Rev Peru Med Exp Salud Pública; 20 (3): 156-158.. 58.
(59) Casida, J. 2002, Botanical insecticides: Reflections and perspectives, Abstract book, International Congress Biological Products: Which guarantees for the consumers, Milan.. Cestari, I., Sarti, S., Waib, C. & Branco, A. 2004, Evaluation of the Potential Insecticide Activity of Tagetes minuta Asteraceae) Essential Oil Against the Head Lice Pediculus humanus capitis (Phthiraptera: Pediculidae), Neotropical Entomology; 33(6):805807. Consoli, R. y Lourenço de Oliveira, R. 1994, Principais mosquitos de importância sanitária no Brasil, Edit. Fiocruz, Rio de Janeiro.. Chávez, J., Córdova, O. y Vargas, F. 2005, Niveles de susceptibilidad a temefós en el vector transmisor del dengue en Trujillo, Perú, An Fac Med; 66(1): 53-56.. Chiasson, H., Vincent, C. & Bostanian, N. 2004, Insecticidal Properties of a ChenopodiumBased Botanical. J. Econ. Entomol; 97(4): 1378-1383. Choochote, W., Tuetun, B., Kanjanapothi, D., Rattanachanpichai, E., Chaithong, U., Chaiwong, P., Jitpakdi, A., Tippawangkosol, P., Riyong, D. & Pitasawat, B. 2004, Potencial of seed extract of celery, Apium graveolens L., against the mosquito Aedes aegypti (L.)(Diptera: Culicidae), J Vect Ecol; 29(2): 340-346.}. Cruz, C., Valle, J. y Ruiz, A. 2004, Determinación de los hábitos de Anopheles pseudopunctipennis y An. calderoni en dos localidades del Valle de Chao, La Libertad, Perú, Rev Peru Med Exp Salud Pública; 21(4): 223-230.. Dirección General de Epidemiología/Ministerio de Salud, Perú. Dengue y dengue hemorrágico, 2006, Boletín Epidemiológico; 15 (02).. 59.
(60) Dirección General de Epidemiologia, 2007, Tendencia de las enfermedades y daños, Bol. Epidemiol. (Lima) 16 (49).. Feota, G. y Bazzani, R. 2002, Desafíos y estrategias para la implementación de un enfoque ecosistémico para la salud humana en los países en desarrollo, CIID/PNUD, Montevideo.. Firn, R. & Jones, C. 2003, Natural products–a simple model to explain chemical diversity, Nat. Prod. Rep., 20, 382–391.. George, S. & Vincent, S. 2005, Comparative efficacy of Annona squamosa Linn. and Pongamia glabra Vent. to Azadirachta indica A. Juss against mosquitoes. J Vect Borne Dis 2005; 42: 159–163.. Green, M., Singer, M., Sutherland, D. & Hibben, C. 1993, Larvicidal activity of Tagetes minuta (marigold) toward Aedes aegypti, J. Am. Mosq. Control Assoc; 7: 282-286.. Guzmán, M. 2002, El dengue y el dengue hemorrágico ¿Una entidad olvidada?, Rev Cubana Med Trop; 54(3):169-170.. ta. Hernández, R., Fernández, C. y Baptista, P. 2006, Metodología de la investigación. 4 . Edic. Edit. Mc Graw Hill. México D.F.. Hoss, R. 1992, Guía metodológica: Uso de extractos vegetales en la Regulación de Plagas. Cuaderno de Trabajo Nº 01, Red de Acción en Alternativas al Uso de Agroquímicos, Lima.. Hostettmann, K. 1997, Strategy for the Biological and Chemical Evaluation of Plant Extracts, International Conference on Biodiversity and Bioresources: Conservation and Utilization, Phuket, Thailand.. 60.
(61) Iannacone, J., Lamas, G. 2003, Efecto insecticida de cuatro extractos botánicos y del cartap sobre la polilla de la papa Phthorimaea operculella (Zeller) (Lepidoptera: Gelechiidae), en el Perú, Entomotropica; 18(2): 95-105.. Ioset, J.-R., Marston, A., Gupta, M. & Hostettmann, K. 2000, Antifungal and larvicidal cordiaquinones from the roots of Cordia curassavica, Phytochemistry; 53 (2000): 613-617.. Jacobson, M. 1958, Insecticides from plants. A review of the literature (1941-1953), Agriculture Mined Book N° 154. US Government Printing Office, Washington.. Jaswanth, A., Ramanathan, P. & Ruckmani, K. 2002, Evaluation of mosquitocidal activity of Annona squamosa leaves against filarial vector mosquito, Culex quinquefasciatus Say.; Indian J Exp Biol.; 40(3): 363-365.. Joy, P., Thomas, J., Mathew, S. & Skaria, B. 1998, Medicinals plants, Kerala Agricultural University, India.. Kickbusch, I. 2004, La nueva agenda de salud. En: Perspectivas de salud, Revista de la Organización Panamericana de la Salud; 9 (2): 8-13.. Kumar, A, Dunkel, F., Broughton, M. & Sriharan, S. 2000, Effect of Root Extracts of Mexican Marigold, Tagetes minuta (Asterales: Asteraceae), on Six Nontarget Aquatic Macroinvertebrates, Environ. Entomol.; 29(2): 140-149. Lagunes, A. y Vásquez, M. 1994, El bioensayo en el manejo de insecticidas y acaricidas. Colegio de Post graduados en Ciencias Agrícolas, México.. 61.
(62) Leatemia, J., & Murray, B. 2004, Toxicity and antifeedant activity of crude seed extracts of Annona squamosa (Annonaceae) against lepidopteran pests and natural enemies, Journal of Tropical Insect Science; 24 (1) 150–158.. Lloyd, L. 2003, Mejores prácticas para la prevención y el control del dengue en las Américas. Environmental Health Project; Reporte Estratégico 7.. Macêdo, M., Consoli, R., Grande, T., dos Anjos, A., de Oliveira, A., Mendes, N., Queiróz, R. & Zani, C. 1997, Screening of Asteraceae (Compositae) plant extracts for larvicidal activity against Aedes fluviatilis (Diptera: Culicidae), Mem. Inst. Oswaldo Cruz; 92 (4): 565-570.. Mc Laughlin, J., Lingling, R. & Jon, A. 1998, The use of biological assays to evaluate botanicals. Drug Information Journal; 32:513-524.. Medappa, N. 2003, Prospects of using herbal products in the control of mosquito vectors. Indian Council of Medical Research; 33 (1): 1-10.. Mejía, J. 2004, Sobre la investigación cualitativa. Nuevos conceptos y campos de desarrollo, Investigaciones Sociales; 8 (13): 277-299.. Ministerio de Salud, 2002, Lineamientos de Política Sectorial para el Período 2002-2012 y da. Principios Fundamentales para el Plan Estratégico Sectorial del Quinquenio, 2 . Edic., Ministerio de Salud, Lima.. Ministerio de Salud/Dirección General de Salud Ambiental 2005. Vectores de salud pública sujetos a vigilancia y control; Informativo Entomológico N° 001-05/DESB/DIGESA.. 62.
Figure


Outline
Documento similar
que hasta que llegue el tiempo en que su regia planta ; | pise el hispano suelo... que hasta que el
Abstract: This paper reviews the dialogue and controversies between the paratexts of a corpus of collections of short novels –and romances– publi- shed from 1624 to 1637:
Los ensayos de control de calidad de los extractos hidroalcohólicos permitieron diferenciar los extractos, teniendo en cuenta las características evaluadas, ambos extractos
Fuente de emisión secundaria que afecta a la estación: Combustión en sector residencial y comercial Distancia a la primera vía de tráfico: 3 metros (15 m de ancho)..
La campaña ha consistido en la revisión del etiquetado e instrucciones de uso de todos los ter- mómetros digitales comunicados, así como de la documentación técnica adicional de
Así, antes de adoptar una medida de salvaguardia, la Comisión tenía una reunión con los representantes del Estado cuyas productos iban a ser sometidos a la medida y ofrecía
La siguiente y última ampliación en la Sala de Millones fue a finales de los años sesenta cuando Carlos III habilitó la sexta plaza para las ciudades con voto en Cortes de
Ciaurriz quien, durante su primer arlo de estancia en Loyola 40 , catalogó sus fondos siguiendo la división previa a la que nos hemos referido; y si esta labor fue de