GUÍA DEL DOLOR
ÍNDICE
1. EVALUACIÓN DEL DOLOR EN CUIDADOS PALIATIVOS
Juan Sanmartin Moreira (Servicio Cuidados Continuos – Paliativos CHJ Canalejo). A Coruña
Feliciano Sánchez Domínguez (Unidad de Cuidados Paliativos Domiciliarios AECC-SACYL). Salamanca
2. MANEJO DE OPIOIDES POTENTES EN ENFERMOS TERMINALES
Raúl Sánchez Posada (Equipo de Soporte de Cuidados Paliativos del Área de Salud de Coria Hospital Ciudad de Coria). Coria - Cáceres
3. ADYUVANTES ANALGESICOS
Mª Paz Varillas López (Equipo de Soporte de Cuidados Paliativos Hospital Virgen del Puerto). Plasencia - Cáceres
4. TÉCNICAS INVASIVAS EN CUIDADOS PALIATIVOS
Francisco José Vara Hernando (Servicio de Cuidados Paliativos Hospital Los Montalvos). Salamanca
5. DOLOR NEUROPÁTICO
Francisco José Vara Hernando (Servicio de Cuidados Paliativos Hospital Los Montalvos). Salamanca
6. DOLOR ÓSEO EN CUIDADOS PALIATIVOS
Carlos Fernandez Fraga (Centro de Salud de Burela). Lugo
Juan Sanmartin Moreira (Servicio Cuidados Continuos – Paliativos CHJ Canalejo). A Coruña
7. TRATAMIENTO NO FARMACOLÓGICO DEL DOLOR
Pilar Aguirán Clemente (Psicóloga de la Unidades de Cuidados Paliativos
Domiciliarios de la AECC-SALUD en el Hospital Clínico Universitario y Hospital Universitario Miguel Server). Zaragoza
8. PAPEL DE LA ENFERMERA EN LA GESTIÓN DEL DOLOR EN UNIDADES DE CUIDADOS PALIATIVOS
EVALUACIÓN DEL DOLOR EN CUIDADOS
PALIATIVOS
JUAN SANMARTIN MOREIRA
Servicio Cuidados Continuos – Paliativos CHJ Canalejo. A Coruña FELICIANO SÁNCHEZ DOMÍNGUEZ
Unidad de Cuidados Paliativos Domiciliarios AECC-SACYL (SALAMANCA)
Definición:
La IASP (Internacional Association for the Study of Pain) define el dolor como una experiencia desagradable, sensorial, y emocional, asociada a una lesión tisular real o potencial o que se describe como ocasionada por esa lesión. Es siempre un fenómeno subjetivo y el paciente es el mejor informador de su dolor. La verbalización del dolor se aprende y la expresión de la experiencia desagradable está modulada por el aprendizaje en el medio en que crece el sujeto. No siempre es posible determinar daño tisular pudiendo existir razones estrictamente psicológicas.
Evaluación:
La evaluación completa del dolor debe incluir su inicio y localización. Factores que lo mejoran y lo empeoran. Su curso temporal (episódico o constante) y su calidad: como pinchazo, pursátil, urente… Se incluye la irradiación y su intensidad tanto basal como en crisis. Se toma nota de la respuesta a tratamientos previos.
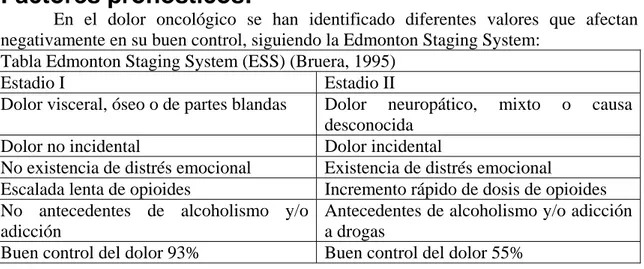
Factores pronósticos:
En el dolor oncológico se han identificado diferentes valores que afectan negativamente en su buen control, siguiendo la Edmonton Staging System:
Tabla Edmonton Staging System (ESS) (Bruera, 1995)
Estadio I Estadio II
Dolor visceral, óseo o de partes blandas Dolor neuropático, mixto o causa desconocida
Dolor no incidental Dolor incidental
No existencia de distrés emocional Existencia de distrés emocional
Escalada lenta de opioides Incremento rápido de dosis de opioides No antecedentes de alcoholismo y/o
adicción
Antecedentes de alcoholismo y/o adicción a drogas
Buen control del dolor 93% Buen control del dolor 55%
MEDICION
El dolor puede describirse por su intensidad, pero existen limitaciones.. El dolor agudo
comportamiento o conjunto de manifestaciones observables, cómo irritabilidad, hostilidad, ira, inactividad, etc.
La entrevista clínica y las escalas de medida son los medios que disponemos para obtener información subjetiva, y la observación de la conducta, instrumentos que miden las respuestas autonómicas del paciente
Los INSTRUMENTOS diseñados para medir el dolor son subjetivos, y pueden ser unidimensionales y pluridimensionales:
Unidimensionales
Pretenden medir el grado de dolor que tiene el paciente. Los resultados se obtienen después de pedir que nos describa la intensidad de su dolor. Las más utilizadas son las siguientes:
• ESCALA NUMERICA
Es muy elemental. El paciente asigna al dolor un valor numérico entre dos extremos que son el 0 y el 10, siendo 0 ausencia de dolor y 10 el dolor de máxima intensidad
• ESCALA DESCRIPTIVA SIMPLE VERBAL
Son sencillas. Consisten en un listado de adjetivos que se refieren a los distintos niveles de intensidad del dolor, entre los cuales el paciente elige uno. La más empleada, por orden de menor a mayor intensidad, es la siguiente:
¾ no dolor
¾ dolor leve
¾ dolor moderado
¾ dolor intenso o severo
¾ dolor insoportable o muy severo
• ESCALA VISUAL ANALÓGICA (VAS, EVA)
Es una línea horizontal orientada de izquierda a derecha de 10cm de longitud en cuyos extremos se señalan el mínimo y el máximo nivel de dolor. El paciente señala en la línea la intensidad con la que percibe su dolor. La recogida de puntuaciones debe ser siempre muy precisa y exacta, y la anotación se debe realizar en milímetros. Un valor por encima de 30mm se correlaciona con un dolor tipo moderado en la escala categórica verbal, y por encima de 54, con un dolor severo. Es una escala más sensible y reproducible que la anterior y es la más utilizada en la clínica.
• ESCALA DE EXPRESIÓN FACIAL
Es una escala de rostros faciales que se emplea en niños y en personas con trastornos del lenguaje o enfermedades mentales
Estas escalas tienen la ventaja de proporcionar una evaluación cuantitativa y también cualitativa de la experiencia dolorosa. Las más interesantes son las siguientes:
• WISCONSIN BRIEF PAIN QUESTIONNAIRE (BPI): es un método
autoadministrado, de fácil compresión y breve. Se evalúan los antecedentes del dolor y su relación con la enfermedad del paciente. Posteriormente si los pacientes admiten haber tenido dolor en el último mes, responderan a las manifestaciones actuales del dolor. Si no tienen dolor, pasan al final del cuestionario para completar la información demográfica. En el caso de pacientes con dolor, se proporciona el dibujo de una figura humana, y sombrea la zona en la que siente dolor. Se emplean
escalas numéricas para medir la intensidad del dolor y finalmente se solicita que indiquen cuanto interfiere el dolor con el estado de ánimo, las relaciones con otras personas y con la capacidad funcional (caminar, trabajar, dormir, divertirse). Este inventario ha sido traducido a varios idiomas y ha sido utilizado para evaluar el dolor de pacientes oncológicos en ámbitos tan diferentes como México, Vietnam, Filipinas, etc, con respuestas muy similares en lo que respecta a la calificación del dolor y a la interferencia que produce en su vida diaria. También se ha empleado en pacientes con artritis reumatoide.
Esta escala ha sido validada en Enero 2003 en España denominándose
Cuestionario Breve del dolor o CBD. (cita bibliografica)
• MC GILL PAIN QUESTIONNAIRE, MPQ, propuesta por Melzack. Es un
• MEMORIAL PAIN ASSESSMENT CARD, o escala del Memorial Sloan
Kettering Cancer Center. Es un instrumento validado, sencillo, y rápido. Incluye cuatro variables: EVA de intensidad, EVA de alivio del dolor, EVA del estado de ánimo, y un cuadro de adjetivos descriptores verbales, de los que el paciente debe elegir uno. Para obtener una mejor objetivación del grado de dolor del paciente, algunos centros añaden una EVA sobre calidad del sueño. La tarjeta está doblada a la mitad, de tal forma que los cuatro lados pueden ser presentados rápidamente al paciente. Las instrucciones son sencillas y fáciles de comprender, y un paciente puede completar las cuatro pruebas en menos de 20 segundos.
• ESCALA DE DOLOR DE LANSS o escala para la evaluación de síntomas
neuropáticos de Leeds. Es una herramienta de reciente introducción en la clínica que se basa en el análisis de la descripción sensorial y la exploración de la disfunción sensorial a la cabecera del paciente. Utiliza los descriptores asociados al dolor por afectación del sistema nervioso. Los más utilizados por los pacientes con dolor neuropático son “descarga eléctrica”, quemazón, frío, picazón, hormigueo y comezón. Esta escala consta de dos apartados:
A. Cuestionario sobre el dolor: en este apartado se indica al paciente que piense cómo ha sido el dolor en la última semana e indique si algunas de las descripciones que se le relacionan se corresponden con el dolor que siente. Incluye si tiene sensaciones extrañas y desagradables en su piel, si la zona dolorida tiene un aspecto diferente, si la piel afectada tiene una sensibilidad anormal al tacto, si el dolor es e ráfagas y aparece repentinamente sin razón aparente o si el dolor le hace sentir cómo si la temperatura de la piel en la zona dolorida hubiera cambiado de forma anormal
el umbral en comparación con las zonas no doloridas es muy alto o el pinchazo no se siente o se nota cómo romo.
ESCALERA ANALGÉSICA DE LA OMS
La adecuada elección de un analgésico depende de la valoración del dolor, su etiología, y el paciente individual. La escalera analgésica de la OMS es una excelente herramienta para la utilización escalonada de los fármacos analgésicos, coanalgésicos y coadyudantes. Se compone de tres peldaños, secuenciales según la intensidad del dolor y la respuesta del paciente. Se utilizan analgésicos, co-analgésicos y/o coadyudantes y fármacos que previenen y tratan los efectos secundarios de los opiáceos. Son fármacos del primer escalón los AINES, del segundo, los opioides débiles, asociados o no a AINES y a coanalgésicos y coadyudantes, y en el tercero, los opioides potentes, solos o asociados también a AINES y a coanalgésicos y coadyudantes. Hoy se piensa que no siempre es adecuada esta estrategia, y que en determinadas situaciones puede suponer un retraso en el control del dolor en un paciente. La propuesta actual es sustituir el concepto de escalera por el de “ascensor analgésico”, y utilizaremos el fármaco necesario de acuerdo con su intensidad, sin necesidad de escalonamiento. Es decir, ante un dolor severo, el tratamiento se hará directamente con fármacos opioides.
Escalera Analgésica de la OMS Paracetamol
AINEs Metamizol
Codeína
Dihidrocodeína Tramadol
Tramadol + Paracetamol
Morfina Fentanilo Metadona Oxicodona Buprenorfina
Opiáceos Potentes por vía ESPINAL
Escalón I
Escalón II
Escalón III
Escalón IV
Los principales cuadros de dolor agudo donde hay indicación de los AINES son aquellos de intensidad leve-moderada, o moderada-severa asociados a opioides débiles o potentes: analgesia en dolor cólico, politraumatizados o quemados. Es preferible la vía e.v. en dolor agudo por la peor variabilidad de absorción y tiempo de latencia de las vías im y sc.. En dolor crónico los AINES constituyen el primer escalón de tratamiento, aunque pueden utilizarse en el segundo y tercero asociados a opioides débiles y potentes respectivamente.
Primer escalón
1.- Analgésicos no opioides
Constituyen un grupo amplio de medicamentos, químicamente heterogéneos, con diversos grados de actividad analgésica, antiinflamatoria y antipirética. Tienen techo terapéutico, es decir, una dosis máxima diaria por encima de la cual no se consigue un mayor efecto analgésico. No existe una evidencia clara que demuestre eficacia superior de un AINE respecto a otro. Se recomiento gastroproteccion con omeprazol, ranitidina o misoprostol. Es preciso ajuste de dosis en ancianos y pacientes con insuficiencia renal.
Indicaciones:
• Dolor de intensidad leve o moderada con afectación ósea o músculo-tendinosa y en la compresión mecánica de pleura o peritoneo.
• Potencian la acción analgésica de los opioides en el dolor moderado e intenso.
Paracetamol
• Dosis inicial: 650-1000 mg cada 4-6 horas por vía oral o rectal
• Dosis máxima: 1000 mg/ 4 horas
• Potencia analgésica: similar al Ácido acetilsalicílico.
Efectos secundarios:
• Otros: desorientación, mareos, nefritis intersticial...
Tabla. Analgésicos no opioides Medicamento Dosis
(mg)
Intervalo (horas)
Vía administración
Dosis máxima
diaria (mg)
Potencia equialgésica con 650 mg de
AAS (mg)
Comentario
Paracetamol 1000 6-8 Oral, rectal, endovenosa
4000 500
Ácido
acetilsalicílico
500-1000
4-6 Oral 1000 --
Ibuprofeno 400-600
4-6 oral, rectal 2400 400 Efecto
antiinflamatorio más débil. Menor incidencia de efectos
secundarios gastrointestinales
Naproxeno 250-500
8-12 oral, rectal 1500 mg 500
Diclofenaco 50 6-8 oral, rectal 200 mg 25 Baja incidencia de gastrolesividad
Metamizol 500-2 000
6-8 oral, rectal, parenteral
8 000 Por su actividad espasmolítica es útil
en los dolores viscerales
Efectos secundarios AINEs:
• Gastrointestinales: dispepsia, pirosis, úlcera gastroduodenal, hemorragia y perforación.
• Renales: insuficiencia renal, nefritis intersticial, síndrome nefrótico, necrosis papilar.
• Pulmonares: broncoespasmo.
• Reacciones de hipersensibilidad: shock anafiláctico, urticaria.
Segundo Escalón
2.- Analgésicos opioides débiles
-Tramadol
Uso clínico:
• Dosis inicial: 50 mg cada 6-8 horas
• Dosis máxima: 400 mg diarios repartidos cada 6-8 horas
• Vía: Oral, rectal, subcutánea, intramuscular o intravenosa. Por vía intravenosa el contenido de la ampolla debe ser diluido en 10 ml de suero fisiológico e
inyectarlo lentamente. Una vez conseguido el control del dolor es aconsejable utilizar las presentaciones de liberación retardada, que son equipotentes (Ej.: 50 mg cada 6 horas equivalen a 100 mg cada 12 horas retardada)
• Potencia analgésica: 10 mg de Tramadol oral equivalen a 2 mg de Morfina oral.
• Precaución: Es prudente evitar el tramadol en pacientes predispuestos a sufrir ataques epilépticos (Ej. Pacientes con tumores o metástasis cerebrales).
Efectos secundarios: Sus efectos secundarios son similares a los de la Codeína, el estreñimiento es menos frecuente.
-Codeína
Uso clínico:
• Dosis inicial: 30 mg cada 4-6 horas
• Vía: oral o rectal
• Potencia analgésica: 30 mg equivalen a 650 mg de AAS.
• Precaución: en insuficiencia hepática.
Efectos secundarios:
• Estreñimiento, es el más frecuente. Se debe usar siempre acompañada de un laxante.
• Náuseas y vómitos, sobre todo a dosis elevadas. Disminuyen después de varios días de tratamiento. Se tratan con antieméticos.
• Somnolencia, se presenta habitualmente con dosis altas.
-Dihidrocodeína
Es un preparado de liberación retardada, los comprimidos tienen que tragarse enteros, sin masticar, fraccionar ni machacar.
Uso clínico:
• Dosis inicial: 60 - 90 mg cada 12 horas
• Dosis máxima: 120 mg cada 12 horas
• Vía: Oral
• Potencia analgésica: Ligeramente superior a la Codeína.
Efectos secundarios: Similares a los de la Codeína.
3.- Tercer Escalón (Véase guía de Opioides potentes)
Los OPIOIDES tienen indicación en el dolor agudo moderado-severo nociceptivo, solos o asociados con AINES, sobre todo en el dolor visceral. En dolor crónico no oncológico su indicación es el dolor intenso refractario a otros tratamientos. La eficacia de los opioides en este caso puede evaluarse desde tres puntos de vista: variabilidad en la respuesta, tolerancia e idoneidad del tratamiento.
¾ Evaluación psicofísica previa, descartando historial adictivo previo
¾ Confirmar que no se trata de un dolor psicógeno
¾ Intensidad moderada-severa o muy severa
¾ Dolor refractario a otros tratamientos o imposibilidad de utilizar otros analgésicos
En el dolor crónico oncológico los opioides ocupan lugar en el segundo y tercer escalón de la OMS, en dolor moderado y severo respectivamente.
En Medicina Paliativa es importante controlar el DOLOR EPISÓDICO.
Es un dolor transitorio que aparece sobre un dolor basal controlado. Puede ser de tres tipos:
Incidental, que aparece cuando hay un estímulo desencadenante, por ejemplo con el movimiento o la tos en un paciente con metástasis óseas
Fin de dosis, antes de recibir la correspondiente dosis pautada del analgésico Irruptivo, “breakthrough pain”, cuando el dolor aparece sin estímulo aparente En el dolor “fin de dosis” debemos ajustar la dosis administrada , porque hay una infradosificación. En el dolor irruptivo se dará dosis de rescate. Siempre debe disponer el paciente de medicación para utilizar en caso de necesidad.
Los efectos secundarios más frecuentes de los opioides en el dolor crónico son el estreñimiento, las naúseas y/o vómitos, la sedación, y la boca seca. Hay que prevenir la aparición del estreñimiento desde el inicio del tratamiento, utilizando laxantes, preferiblemente mezcla de estimulantes y ablandadores de heces: senósidos(12 a72mg/día), lactulosa(20 a 90cc/día) y parafina líquida(15 a 45mg/día). Los vómitos pueden ser tratados con metoclopramida (10-20mg c/6-8 horas oral o sc) o haloperidol(3-15mg/día, vía oral o sc.).
BIBLIOGRAFÍA
1. Porta J, Gómez-Batiste X, Tuca A: Manual Control de Síntomas en cacientes con cáncer avanzado y Terminal: Dolor. Pág 33. Arán Ediciones S.L. 2004. 2. Bilbeny N. Medición del dolor en clínica. En Paeile C, Saavedra A (Eds). El
Dolor. Aspectos Básicos y Clínicos. Santiago: Mediterráneo, 1990: 87-101. 3. Bugedo G, Dagnino J, Muñoz H, Torregrosa S. Escala visual análoga:
Comparación de seis escalas distintas. Rev Chil Anestesia 1989; 18: 132.
5. Huskisson EC. Measurement of pain. Lancet 1974; ii:1127-1131.
6. Katz J, Melzack R. Measurement of pain. Anesth Clin North Am1992; 10: 229-246.
7. Melzack R. The McGill pain questionnaire: Major propertiesand scoring methods. Pain 1975; 1:277-282.
8. Lizán L; Benítez MA; Cabedo VR; Astudillo W. Protocolo de cuidados paliativos. FMC 1997.
9. Raja MI; Martín MR. Cuidados paliativos en Atención Primaria. Cuadernos de Formación Continuada, 2004; 4: 4-31.
10.Doyle D; Woodruff R. The IAHPC Manual of Palliative Care. 2nd Edition. Published by IAHPC Press, 2004. ISBN 0-9758525-1-5.
11.Català E, Duque A, Gómez X, González M, Reig E, Sanz J. Tratamiento del dolor en el paciente oncológico: visión integral. 2.ª Edición. Madrid. SANED, S.A., 1999.
MANEJO DE OPIOIDES POTENTES EN
ENFERMOS TERMINALES
Raúl Sánchez Posada
Equipo de Soporte de Cuidados Paliativos del Área de Salud de Coria Hospital Ciudad de Coria
Coria (Cáceres)
INTRODUCCIÓN
Recomendaciones de la OMS
El 80% de los pacientes con cáncer van a presentar algún tipo de dolor a lo largo de su enfermedad(1) y es posible que necesiten analgésicos opioides para su control. El tratamiento actual del dolor oncológico se basa en una serie de recomendaciones realizadas por la Organización Mundial de la Salud (OMS),(2) siendo los opioides potentes la base del tercer escalón de la “escalera analgésica” secuencial de fármacos recomendada.
Tipos
La acción analgésica de los opioides viene establecida por su unión a una serie de receptores distribuidos por el sistema nervioso central y periférico, denominados receptores opioides. Se han identificado varios tipos receptores opioides, de los cuales los mejor conocidos son los µ, δ y κ. Cualquier agonista de estos receptores provoca analgesia, pero son los receptores µ los más numerosos y, por esto, los agonistas µ son los que consiguen una mayor intensidad analgésica. De acuerdo con la mayor afinidad por uno u otro receptor, y teniendo en cuenta su relevancia para la práctica clínica, los distintos fármacos se pueden clasificar en:(3)
• Agonistas puros: Opioides agonistas exclusivos y totales sobre receptores µ con máxima actividad intrínseca. Incluidos en este grupo están la morfina, metadona, fentanilo y oxicodona entre otros.
• Agonistas-antagonistas mixtos: Opioides con acción agonista sobre receptores κ y antagonista o agonista parcial sobre receptores µ, como la pentazocina.
• Agonistas parciales: Su acción es agonista parcial de receptores µ, por lo que su actividad intrínseca es inferior a la máxima y por tanto no podrán alcanzar el efecto de un agonista puro y tendrán efecto techo terapéutico. Además si se administra junto a un agonista puro podría desplazarlo y manifestar cierto antagonismo. En este grupo se incluye la buprenorfina.
• Antagonistas puros: Presentan afinidad por todos los tipos de receptores opioides pero carecen de actividad intrínseca. Son la naloxona y la naltrexona.
Tolerancia
conseguir el mismo efecto analgésico.(4) Esta se produce tanto para el efecto analgésico como para los efectos adversos y es debido a que los receptores tienen diferente afinidad por cada opioide y por tanto una distinta respuesta a la analgesia y al desarrollo de efectos secundarios.(5) Además cada opioide tiene igualmente distinta afinidad a diferentes niveles del receptor. Esta variabilidad en la respuesta del receptor a los distintos opioides se debe a la tolerancia cruzada incompleta entre opioides.(6) El receptor N-Metil D-Aspartato (NMDA) se ha relacionado con el desarrollo de tolerancia, por lo que su bloqueo puede ser efectivo en estos casos.(7)
MORFINA
La morfina es el opioide más comúnmente usado para el tratamiento del dolor por cáncer moderado-severo, el recomendado como de primera línea analgésica(2) y frente al que se evalúan otros analgésicos. Teniendo en cuenta que posiblemente se necesite tratamiento durante un largo periodo de tiempo, que la mayoría de los pacientes toleran bien la administración oral y que hay una gran diversidad de formulaciones que permiten flexibilidad en las dosificaciones, es de elección su administración por vía oral.(8) Las alternativas a la vía oral son la subcutánea, la rectal y la intravenosa.
Farmacología
Es un opioide natural obtenido de la Papaver somniferum, muy hidrofílico y con rápida distribución en los tejidos. El aclaramiento plasmático se realiza en su mayoría por metabolismo hepático, dando lugar principalmente a dos metabolitos, la morfina–3-glucurónido (el más abundante y el responsable de los efectos adversos neurotóxicos) y la morfina-6-glucurónido (causante de la acción analgésica y de los efectos adversos clásicos), que se eliminan por vía renal. La semivida de eliminación en pacientes con función renal normal está en torno a las 3 horas con una gran variabilidad interindividual. El pico máximo en sangre tras administración oral se consigue a los 30-90 minutos y a los 15-20 minutos si se aplica por vía intramuscular o subcutánea.(9) Su acción analgésica es de 4-6 horas. La administración oral provoca un alto grado de extracción hepática con una baja biodisponibilidad (15-64%) que varía entre un individuo y otro.(10-12)
Efectos adversos
El manejo de estos incluye:(10,15,16)
• Reducir la dosis del opioide si hay un buen control analgésico, o bien asociar un coanalgésico o un adyuvante cuando el dolor no está controlado. (17)
• Usar fármacos específicos para contrarrestarlos
o Laxantes de forma rutinaria profilácticos y mantenerlos durante la
terapia opioide.
o Informar de la posibilidad de nauseas o vómitos y administrar
antieméticos en caso de aparecer. Dosis bajas de haloperidol o metoclopramida pueden ser necesarias durante el inicio del tratamiento.
o La somnolencia puede aparecer al inicio o al incrementar dosis.
Suele desaparecer en pocos días pero si persiste puede asociarse metilfenidato (5-10 mg/día) para controlarla.(18)
• Cambio de vía de administración de la morfina.(15,19)
• Cambio de opioide (ver rotación opioide).
Merece mención especial la presencia de toxicidad neurológica, que englobada en el Síndrome de Neurotoxicidad inducida por opioides (NIO) incluye delirium, alucinaciones, mioclonias, convulsiones e hiperalgesia. En su tratamiento se debe contemplar la rotación de opioide, reducción de dosis, modulación circadiana, hidratación y uso de psicoestimulates(20).
Tabla1: Efectos adversos de los opioides
• Gastrointestinales
o Nauseas o Vómitos o Estreñimiento
• Sistema nervioso autónomo
o Xerostomia
o Retención urinaria o Hipotensión postural
• Sistema nervioso central
o Somnolencia
o Alteración cognitiva o Alucinaciones o Delirium
o Depresión respiratoria o Mioclonias
o Hiperalgesia
• Cutáneo
o Prurito o Sudoración
Inicio de administración
Se recomienda, al inicio del tratamiento y durante la fase de ajuste de la dosis, comenzar con morfina de liberación normal (MLN), a dosis de 5 mg cada 4 horas para pacientes en los que se ha omitido el paso por el segundo escalón de la escala analgésica, ancianos y con insuficiencia renal. En pacientes con exposición previa a opioides pautaremos 10 mg cada 4 horas. Durante la fase de ajuste debe dejarse una dosis de rescate, a demanda del paciente, cada 1-2 horas igual a la pautada cada 4 horas para prevenir episodios de dolor no controlado y como método simple de ajuste de dosis.(8,10)
Esta presentación de MLN tiene un inicio de analgesia en torno a los 20 minutos con un pico máximo de concentración plasmática a la hora de la administración y una duración del efecto de 4 horas.(21)
Transcurridas al menos 24 horas(22)desde el inicio del tratamiento se debe evaluar al paciente y ajustar la dosis, sumando la dosis total diaria administrada (la pautada más los rescates) dividiéndola entre seis y pautarla cada 4 horas. Se dejarán nuevamente rescates como comentamos anteriormente.(8,10)
Cuando el dolor está controlado con dosis estables se puede transformar la dosis total diaria administrada en morfina de liberación controlada (MLC), dividiéndola entre dos y pautándola cada 12 horas, consiguiendo el mismo control analgésico que con la morfina de liberación normal.(23) Lo mismo sucede con las preparaciones de liberación controlada de 24 horas.(24)
No es necesario hacer coincidir la primera dosis de morfina de liberación controlada con la última de liberación normal en pacientes con dolor controlado y dosis estables.(25)
En pacientes con dolor moderado y que no necesitan una titulación rápida de dosis es igual de efectivo iniciar el tratamiento con MLC.(26,27)
Las presentaciones de MLC cada 12 horas presentan inicio de acción en 1-2 horas tras su administración, un pico plasmático máximo a las 2-6 horas y una duración de acción de 12-24 horas.(28)
En pacientes con dolor severo es posible iniciar dosis con bolos morfina intravenosa consiguiéndose un alivio del dolor más rápido que con morfina de liberación normal.(29)
Tabla 2: Pesentaciones de Morfina
LIBERACIÓN
NORMAL LIBERACIÓN CONTROLADA
ORAL Sevredol
® 10 mg
Sevredol® 20 mg
MST Contunus®: 5, 10, 15, 30, 60, 100 y 200 mg(1)
Oglos®: 10, 30, 60, 100 y 200 mg(1)
Skenan®: 10, 30, 60, 100 y 200 mg(2)
MST Unicontinus®: 30, 60, 90, 120 150 y 200 mg(3)
PARENTERAL
Cloruro Mórfico: Ampollas 1% ⇒ 1cc ⇒ 10 mg (1cc = 10 mg) Ampollas 2% ⇒ 2cc ⇒ 40 mg (1cc = 20 mg) Viales 2% ⇒ 20cc ⇒ 400 mg (1cc = 20 mg)(1)
(1) Uso Hospitalario.
Titulación
En caso de dolor no controlado es necesario un ajuste de la dosis pautada. Aumentaremos la dosis de la MLC diaria un 30-50% hasta que consigamos control analgésico o nos limiten los efectos secundarios, pero no debe hacerse con una frecuencia superior a una vez cada 48 horas.(10)
Se recomienda dejar dosis de rescate con MLN para controlar la aparición de dolor episódico. Puede administrarse a demanda del paciente cada 1-2 horas y será 1/6 de la dosis total diaria ajustándola según las necesidades del paciente.(8,10)
El citrato de fentanilo transmucoso es una alternativa para el control del dolor episódico y se ha demostrado más efectivo que la morfina de liberación normal.(30)
Pérdida de vía oral
Si la situación del paciente impide la administración de morfina por vía oral, la vía alternativa preferente en dolor moderado o severo es la subcutánea.(8,31) Se ha observado como en perfusión continua subcutánea es tan efectiva en el control del dolor como en perfusión continua intravenosa,(32,33) y puede mantenerse durante largo periodo de tiempo. Para mantener el confort del lugar de infusión, esta no debe superar los 5 ml/h.(10) La perfusión intravenosa puede ser la mejor opción en pacientes con vía venosa permanente, edemas generalizados, alteración de la coagulación, abscesos estériles con la administración subcutánea o con mala circulación periférica.(8,10)
La potencia equianalgésica entre morfina oral y subcutánea está entre 2:1 y 3:1 para pacientes a los que se les administra de forma crónica, presentando variaciones interindividuales que pueden hacer necesario ajuste de dosis.(8,10,34) La misma potencia relativa se ha observado entre morfina oral y morfina intravenosa, con medias entre 2:1 y 3:1.(35)
Actualmente no hay indicación para la utilización de morfina por vía sublingual, bucal o nebulizada.(8,36)
Otra alternativa a la pérdida de la vía oral es la utilización de fentanilo transdérmico (ver apartado de fentanilo).
FENTANILO
Farmacología
El fentanilo es un opioide semisintético con una alta afinidad por el receptor µ
media de eliminación es de 3-12 horas, sufre metabolización hepática transformándose en metabolitos aparentemente inactivos farmacológicamente que se eliminan por vía renal. Tras su administración intravenosa tiene una corta duración de acción de 0.5-1 hora.(7,10)
Su administración transdérmica permite un control analgésico durante 72 horas mediante liberación continua del fármaco. Tras la colocación del parche la concentración plasmática aumenta progresivamente hasta estabilizarse a las 12-24 horas. Tras la retirada la concentración se reduce al 50% en torno a las 17 horas.(37) Es posible que se produzca un aumento de la absorción en pacientes con fiebre, por lo que deben vigilarse la aparición de efectos adversos.
El preparado de citrato de fentanilo transmucoso (CFTM) destaca por su rapidez de acción, comparable con la administración de fentanilo parenteral.(10) Tras su aplicación un 25% se absorbe rápidamente logrando respuesta analgésica a los 5-10 minutos y del resto otro 25% se absorbe lentamente por la mucosa gástrica durante los siguientes 90 minutos.(38) La máxima concentración plasmática se consigue en veinte-cuarenta minutos y la duración de acción es de una a tres horas.
Efectos adversos
Los efectos secundarios del fentanilo son los mismos que el resto de los opioides potentes. En algunos estudios se ha observado que produce menos estreñimiento, menos somnolencia diurna y ligeramente mayor incidencia de nauseas que la morfina.(39-42)
Indicaciones
El fentanilo transdérmico (FTD) es una alternativa eficaz a la morfina, y se ha mostrado bien tolerado, efectivo y seguro para el control del dolor en pacientes terminales.(39,40)
Su principal recomendación de uso es en pacientes con dolor crónico y requisitos estables de opioides que presentan intolerancia a la medicación oral, falta de adherencia al tratamiento oral y como alternativa a la morfina subcutánea. Por tanto no estaría recomendado su uso en pacientes con dolor severo no controlado que precisen titulación rápida de opioides.(8,10)
Administración
Se recomienda iniciar el tratamiento convirtiendo la dosis de morfina oral en 24 horas en la equivalente de FTD (ver rotación opioide) o con un parche de 25µg/h en pacientes que no estaban tratados con otro opioide potente. Cubrir la analgesia de las primeras 12 horas con MLN (o hacer coincidir la colocación del parche con la dosis de MLC) y sustituir el parche a las 72 horas rotando la zona de colocación (en algunos pacientes puede ser necesario hacerlo a las 48 horas). En caso de necesitar más de tres o cuatro rescates al día por dolor episódico aumentar la dosis en 25 µg/h.(10,43,44)
Estos rescates se dejarán a demanda del paciente para cubrir la aparición de dolor episódico, y pueden ser de morfina (oral o subcutánea) o de CFT.(30) Las
El CFT se debe iniciar, independientemente de la dosis pautada de opioides, con la presentación de 200 µg frotándolo por la mucosa geniana hasta un adecuado control del dolor o hasta agotarlo. Si esta dosis no es eficaz se puede ir subiendo progresivamente hasta 1600 µg.(45,46)
Presentaciones de Fentanilo
PARENTERAL Fentanest®:
TRANSDERMICO Durogesic Matrix®: 25, 50, 75 y 100 µg/h
TRANSMUCOSO Actiq: 200, 400, 600, 800, 1200 y 1600 µg
METADONA
Farmacología
La metadona es un opioide sintético sin metabolitos neuroactivos conocidos que se acumulen en insuficiencia renal, una vida media larga, alta liposolubilidad, y una excelente absorción por vía oral y rectal. Además de ser un potente agonista µ opioide, responsable principal de la respuesta analgésica, se comporta como antagonista del receptor NMDA, presenta actividad en el receptor opioide δ y posiblemente evita la recaptación de monoaminas en el tronco cerebral (5-hidroxitriptamina y noradrenalina), produciendo un efecto similar a los antidepresivos tricíclicos. Tiene el inconveniente de presentar una farmacocinética impredecible con gran variabilidad interindividual y, cuando se administra de manera reiterada, también dentro del mismo sujeto. Su biodisponibilidad oral está en torno al 80% (41-99%). Tras alcanzar la circulación general tiene una fase de distribución rápida (vida media 2-3 h) seguida de una fase de eliminación lenta (15-60 h), lo que permite administrarla con buen control analgésico cada 8-12 horas. A diferencia de la morfina, la metadona es metabolizada por el citocromo p-450 lo que supone gran cantidad de interacciones medicamentosas (antidepresivos tricíclicos, antirretrovirales, antiepilépticos, neurolépticos, benzodiacepinas, ISRS...).(47,48)
Efectos adversos
Los efectos secundarios vienen determinados por su acción agonista µ y son los mismos que el resto de los opioides. Se ha relacionado con menos estreñimiento y menos efectos neurotóxicos, como alucinaciones o mioclonias, que la morfina.(47,49)
Indicaciones
Administración
Por su particular farmacocinética se recomienda que su iniciación y titulación se realice por médicos con experiencia en su manejo,(54) aunque hay estudios que expresan la seguridad de su utilización domiciliaria tanto en rotación(55) como en primera línea analgésica.(53)
Se puede administrar por vía oral, rectal, subcutánea o intravenosa con una relación equianalgésica oral:parenteral 2:1.(47) Aunque habitualmente se ha comentado la irritación que produce su administración subcutánea(56) hay referencias de su indicación en pacientes con pérdida de vía oral.(57)
No hay claras dosis de inicio utilizándola como opioide de primera línea. En estudios se referencian dosis de 7.5-15 mg/día por vía oral repartidos en dos o tres tomas con rescates de 2.5-5mg de metadona por dolor.(53,55,58)
Presentaciones de Metadona
PARENTERAL Metasedin®: 10 mg ⇒ 1cc
ORAL Metasedin®: 5, 30(1)y 40(1) mg
(1) Uso hospitalario
OXICODONA
Farmacología
La oxicodona es un opioide semisintético muy similar a la morfina con afinidad por el receptor µ y en mayor medida por el κ.(59) A pesar de su metabolización
hepática presenta una alta biodisponibilidad (60-90%), que aumenta en ancianos e insuficiencia renal.(60)
Hay preparados para su administración por vía oral (liberación inmediata y controlada), rectal, nasal y parenteral. La presentación de liberación controlada (única comercializada actualmente en España) presenta una acción analgésica en dos fases: una rápida con vida media de absorción de 30 minutos e inicio de acción en la primera hora y otra prolongada (vida media 7 horas) que permite analgesia durante 12 horas.(59,61)
Efectos adversos
Los efectos secundarios son similares al resto de agonistas µ, pero se ha evidenciado menor incidencia de nauseas, vómitos, alucinaciones y prurito, y mayor estreñimiento que en los pacientes tratados con morfina.(60,62,63)
Indicaciones
La oxicodona se ha demostrado tan eficaz y segura como la morfina en el control del dolor por cáncer.(60,63,64)
Inicio
Los rescates por dolor episódico se realizarán a demanda del paciente con morfina de liberación inmediata, ya que se ha comprobado sinergismo entre oxicodona y morfina. Su administración conjunta reduce las dosis de MLN de rescate si se compara con pacientes que recibieron morfina en monoterapia.(65)
Presentaciones de Oxicodona
ORAL Oxycontin®: 10, 20, 40 y 80 mg
Administrarlo cada 12 horas entero, sin machacar ni partir. Actualmente solo comercializada esta presentación.
HIDROMORFONA
Farmacología
La hidromorfona es un opioide potente similar a la morfina con una variable biodisponibilidad del 35-80%. Tiene una vida media de 1,5-3 horas y una corta duración de acción. Se elimina sin cambios por orina y es parcialmente metabolizada en el hígado a 3-glucurónido, metabolito con actividad neurotóxica. Se puede administrar por vía oral, rectal, parenteral y espinal. . La relación equianalgésica entre la administración oral y parenteral es 5:1.(10,66,67)
Debido a su alta solubilidad y a la posibilidad de obtener altas concentraciones, es un fármaco óptimo para la administración subcutánea y se ha demostrado tan efectiva como la morfina.(68)
Tras la administración de la formulación oral de liberación inmediata se aprecia inicio de acción a los 30 minutos con una duración de acción de 4 horas. La de las fórmulas de liberación controlada es de 12 ó 24 según la presentación,(67) y se han demostrado tan seguras y eficaces como las de liberación inmediata.(69)
Por vía intravenosa tiene inicio de acción a los 5 minutos con efecto máximo a los 8-20 minutos.(70)
Efectos adversos
Los efectos secundarios son similares al resto de agonistas µ.(67,71)
Indicaciones
La hidromorfona se ha demostrado tan eficaz y segura como la morfina y, aunque no se ha encontrado superioridad clínica sobre otros opioides potentes, es una alternativa a esta para el control del dolor por cáncer.(71)
BUPRENORFINA
Farmacología
La buprenorfina es un opioide semisintético, altamente lipofílico, agonista parcial del receptor µ y antagonista del κ, aunque con dosis bajas (hasta de 3-4 mg/día) se comporta como agonista µ puro. Su alta afinidad por los receptores y lenta disociación de estos permite una larga duración de la analgesia, pero podría ser un problema a la hora de revertir los efectos adversos graves. Como agonista parcial tiene efecto techo terapéutico a dosis de 16-22 mg. Tiene gran eficacia al aumentar las dosis en rangos bajos pero partir de dosis altas el efecto analgésico disminuye al incrementarlas. Presenta metabolismo hepático y eliminación inalterada por heces, principalmente, y orina. Las vías de administración eficaces son la parenteral, sublingual y transdérmica La biodisponibilidad sublingual es del 50-60% y tras su administración tiene un inicio de efecto a los 30-60 minutos, máximo efecto a las 2 horas y duración analgésica de 6-9 horas. Su administración transdérmica permite analgesia durante tres días, alcanzando dosis mínima eficaz a las 13-31 horas (presentación de 70 y 35 µg/h respectivamente) y consiguiendo dosis estables a partir del uso del segundo parche. Tras su retirada persisten concentraciones del fármaco durante 27 horas.(10, 11,72)
Efectos adversos
Los efectos secundarios son similares al resto de los opioides potentes y su incidencia es similar a la morfina. Hay que tener en cuenta que en caso de depresión respiratoria provocada por buprenorfina la naloxona no es claramente efectiva para revertirla.(10,73)
Indicaciones
La buprenorfina se ha demostrado eficaz en el control del dolor moderado-severo en pacientes con cáncer.(74-75)
Inicio
Se recomienda iniciar tratamiento con parches de 35µg/h cada 72 horas dejando rescates de buprenorfina sublingual por dolor. La dosis se ajustará según el control analgésico del paciente.(74-75)
Presentaciones de Buprenorfina
PARENTERAL Buprex®: 0,3 mg ⇒ 1cc
SUBLINGUAL Buprex
®: 0,2 mg
Subutex®: 2 y 8 mg(1)
TRANSDERMICO Transtec®: 35, 52,5 y 70 µg/h
ROTACIÓN OIPIOIDE
La rotación de opioides consiste en el cambio de un opioide potente por otro con la finalidad de conseguir un adecuado control analgésico en pacientes en los que los efectos adversos (principalmente NIO) limitan el aumento de dosis o necesitan cambio de vía de administración por diversas causas. En casos de pacientes con NIO la rotación permite eliminar los metabolitos neurotóxicos acumulados y disminuir la dosis equivalente utilizada del nuevo opioide por presentar menor tolerancia cruzada a la analgesia que a los efectos secundarios, con adecuado control analgésico.(6,15,20,76)
La rotación debe realizarse de acuerdo con unas dosis equianalgésicas. Para esto se han desarrollado una serie de tablas dentro de estudios que no reflejan la realidad de la clínica diaria, ni tienen en cuenta el desarrollo de tolerancia.(77) Por este efecto tolerancia algunos autores recomiendan una reducción de la dosis equianalgésica entre un 20-50%.(6,20)
A continuación describen las principales rotaciones entre opioides:
Morfina:Metadona
La rotación de morfina a metadona resulta beneficiosa en pacientes con dolor moderado o severo y presencia de efectos neurotóxicos. La principal particularidad es que las relaciones equianalgésicas varían dependiendo de las dosis previas de opioide.
Hay diferentes propuestas para realizarla:
Cambio progresivo en tres días(78): En pacientes con dosis de morfina oral diaria >100 mg, partiendo de equianalgesia oral fija morfina:metadona 10:1 se reduce 1/3 de la dosis total diaria de morfina y se pauta 1/3 de la dosis total diaria de metadona cada 8 horas. Cada día se retira y aumenta el tercio correspondiente si hay control analgésico hasta dejar solamente la metadona cada 8horas. Se dejan rescates de opioide de liberación normal los días de la rotación y posteriormente el 10% de la dosis total diaria de metadona. Con dosis bajas de morfina se suspende esta y directamente se pauta metadona 5 mg/8h, dejando rescates de 5 mg/2 horas si dolor.
Rotación en 1 día(79): Se suspende la morfina y se inicia directamente la metadona cada 8 horas, partiendo de equianalgesia oral morfina:metadona 5:1 y dejando rescates de metadona por dolor. En este estudio la mayoría de los pacientes tenían dosis de morfina previa < 90 mg/día y fue necesario ajustar la dosis al alza y los casos de dosis > 90mg/día fue necesario bajarlas.
dosis diariamente según control analgésico. Las dosis equianalgésicas obtenidas se muestran en la siguiente tabla:
Dosis morfina oral Equianalgesia
morfina:metadona
30-90 mg/día 4:1
90-300 mg/día 8:1
> 300 mg/día 12:1
Morfina:Fentanilo
La dosis equianalgésicas aportadas por los fabricantes nos sugieren una relación morfina subcutánea:fentanilo subcutáneo 100:1, aunque en otros estudios la media sea 68:1 (mediana 85:1) (77). La relación fentanilo sc:fentanilo transdérmico es 1:1(81). La dosis equianalgésica fentanilo transdérmico:morfina oral 100:1 es la que recomiendan guías de actuación(43,82) y en la que se basan algunos estudios(83). Para hacer el cálculo multiplicamos la dosis total diaria de morfina oral por 10 y dividimos entre 24. Así 60 mg de morfina oral/día equivaldrían a un parche de 25µg/h. Es aconsejable hacer coincidir la última dosis de morfina de liberación controlada con la colocación del parche para cubrir el inicio de acción de éste(6).
Morfina:Oxicodona
Las dosis equianalgésicas de morfina:oxicodona oscilan entre 1.5-2:1 por vía oral y 0.7-1 por vía intravenosa(35,64,84). Así 60 mg de morfina oral/día
equivaldrían a 40 mg de oxicodona oral/día.
Morfina:Hidromorfona
La dosis equianalgésica entre morfina:hidromorfona por vía oral se establece en 5:1. Tener en cuenta que en la equianalgesia hidromorfona oral:morfina oral es 1:3.5(85,86).
Fentanilo:Morfina
Se recomienda utilizar las mismas dosis equianalgésicas que en el caso inverso, teniendo en cuenta que debemos iniciar la morfina al menos 12 horas después de la retirada del parche(6). Calcularemos la dosis total diaria de fentanilo (dosis del parche por 24) y la dividimos entre 10.
Fentanilo:Metadona
BIBLIOGRAFÍA
1.- Foley K. The treatment of cancer pain. N Engl J Med.1985;313:84-95.
2.- World Health Organization. Cancer pain relief. Geneva: World Health Organization, 1986. 3.- Florez j, Faua C.C. Farmacología de los analgésicos opioides. Tratamiento del dolor teoría y práctica. Segunda edición.2002. Cap. 8;85-111.
4.- Mercadante S. Opioid rotation for cancer pain. Cancer.1999;86:1856-66.
5.- Rusell RD, Chang KJ. Alternated delta and mu receptor activation: a stratagem for limiting opioid tolerance. Pain.1989;36:381-9.
6.- De Santiago A, Bruera E. Rotación de opioides: cuándo y cómo. Med Pal 2004;11:180-193. 7.- Price DD, Maer DJ, Mao J, Caruso FS. NMDA receptor antagonists and opioid receptor interactions as related to analgesia and tolerance. J Pain Symptom Managenent 2000;19(supl.1):s7-s11.
8.- Hanks G, De Conno F, et al. Morfina y opiáceos alternativos para el tratamiento del dolor oncológico: recomendaciones de la EAPC. Med Pal 2002: Vol 9. 22-29.
9.- Glare PA, Walsh TD. Clinical pharmacokinetics of morphine. Ther Drug Monit.1991;13(1):1-23.
10.- Hanks G, Cherny N, Fallon M. Opioid analgesic therapy. In Oxford textbook of palliative medicine. 2004 third edition. 316-341.
11.- Herrera J, Rodríguez J, Vara F. Utilización de los opioides orales y transdérmicos en el dolor oncológico. En Manual práctico sobre utilización de opiáceos potentes en el tratamiento del dolor crónico. SED editorial. 2003. pp. 77-108.
12.- Penson R, Joel S, et al. The bioavailability and pharmacokinetics of subcutaneous, nebulized and oral morphine-6-glucuronode. Br J Clin Pharmacol 2002 ;53:347-354.
13.- Osborne R, Joel S, Trew D, Slevin M. Morphine and metabolite behavior after different routes of morphine adminstration: demostration of the importance of active metabolite morphine-6-glucurónide. Clin Pharmac Ther 1990;47:12-19.
14.- Cherny N, et al. Strategies to manage the adverse effects of oral morhine: an evidence-based report. J Clinical Oncology.2001;19:2542-54.
15.- Mercadante S, Portenoy RK. Opioid poorly-responsive cancer pain. Part 3. Clinical strategies to imrove opioid responsiveness. J Pain Symptom Manage 2001;21:338-354.
16.- Mercadante S, Casuccio A, et al. Switching from morphine to methadone to improve analgesia and tolerability in cancer patients: a prospective study. J Clin Oncol 2001;19:2898-2904.
17.- Lussier D, Huskey A, Portenoy R. Adyuvant analgesics in cancer pain management. The Oncologyst 2004;9:571-591.
18.- Wilwerding MB, Loprinzi CL, et al. A randomized, crossover evaluayion of methylphendate in cancer patients receiving strong narcotics.Support care cancer. 1995;3(2):135-8 (226). 19.- Portenoy RK, Coyle N. Controversies in the long-term management of analgesic therapy in patients with advancer cancer. J Palliat Care 1991;7:13-24.
20.- Centeno C, Bruera E. Tratamiento y prevención del síndrome de neurotoxicidad inducida por opioides. Med Pal 1999:Vol.6:56-66.
21.-Hoshn PL, Hanks GW, Chapman D, Linleton P, Filshie I. The bioavailability and pharmacokinetics of morphine after intravenous, oral and buccal administration in healthy volunteers. Br J Clin Pharmacol 1989;27:499-505.
22.- Säwe J, Dahlström B, Rane A. Steady state kinetics and analgesic effect of ral morphine in cancer patients. Eur J Clin Pharmacol 1983;24:537-42.
23.- Deschamps M, Band PR, Hislop TG, el al. The evaluation of analgesic effects in cancer patients as exemplifield by a double-blind, crossover study of immediate-release versus controlled-release morphine. J Pain Simptom Maneg 1992;7(7):384-92.
24.- Hagen NA, Thirlwell M, Eisenhoffer J, et al. Efficacy, safety and steady-state pharmacokinetics of once-a-day controlled-relesease morphine (MS Contin XL) in cancer pain. J Pain Simptom Manage. 2005;29(1):80-90.
25.- Hoskin PJ, Poulain P, Hanks GW. Controlled release morphine in cancer pain. Is a loading dose required when the formulation is changed?. Anaesthesia 1989;44:897-901.
26.- Immediate or sustained-release morphine for dose finding during start of morphine to cancer patients: a randomised, double-blind trial. Pain 2003;101(1-2):193-198.
28.- Gourlay GK, Cherry D, Oniey MM, et al. Pharmacokinetics and pharmacodynamics of twenty-four-hourly Kapanol compared to twlve-hourly MS Contin in the treatment of severe cancer pain. Pain 1997;69:295-302.
29.- Harris JT, Suresh Kumar K, Rajagopal MR. Intravenous morphine for rapid control of severe cancer pain. Palliat Med. 2003;17(3):248-256.
30.- Coluzzi PH, Schwartzberg L, Conroy JD, et al. Breakthrough cancer pain: a randomized trial comparing oral transmucosal fentanyl citrate and morphine sulfate immediate release. Pain 2001;91(1-2):123-130.
31.- Control of pain in patients with cancer. A national clinical guideline. Scottish Intercollegiate Guidelines Network. 2002.
32.- Moulin DE, Johnson NG, Murray-Parsons N, et al. Subcutaneous narcotics infusions for cancer pain : treatment outcome and guidelines for use.CMAJ 1992;146:891-897.
33.- Nelson KA, Glare PA, Wals D, et al. A prospective, within-patient, crossover study of continuous intavenous and subcutaneus morphine for chronic cancer pain. J Pain Symptom Manage 1997;13:262-267.
34.- Twycross RG. The terapeutic equivalence of oral and subcutaneous/intramuscular morphine sulphate in cancer patients. J Palliat Care 1988;4:67-68.
35.- Kalso E, Vainio A. Morphine and oxicodone hydrochloride in the management of cancer pain. Clin Pharmacol Ther. 1990;47:639-64.
36.- Ripaminti C, Bruera E. Rectal, bucal and sublingual noarcotics for the manegement of cancer pain. J Paliat Care 1991;7(1):51-52.
37.- Portenoy RK, et al. Transdermal fentanyl for cancer pain: repeated dose pharmacikinetics. Anesthesiology 1993;78:36-43.
38.- Streisand JB, Varvel JR, Stanski DR, et al. Absorption and bioavailability of oral transmucosal fentanyl citrate. Anesthesiology 1991;75:223-229.
39.- Ahmedzai S, Brooks D. Transdermal fentanyl versus sustained-release oral morphine in cancer pain: preference, efficacy, and quality of life. J Pain Sympt Manage. 1998;16(3):141-144. 40.- Wong JO, Chiu GL, Tsao CJ, Chang CL. Comparasion of oral controlled-release morphine with transdermal fentanyl in terminal cancer pain. Acta Anaesthesiol Sin. 1997;35(1):25-32. 41.-Megens AA, Artois K, Vermeire J, et al. Comparision of the analgesic and intestinal effects of fentanyl and morphine in rats. J Pain Symptom Manege. 1998;15(4):253-257.
42.- Allan L, Hays H, Jensen NH, et al. Randomised crossover trial of transdermal fentanyl and sustained release oral morphine for treating chronic non-cancer pain. BMJ 2001;322:1154-8. 43.- Back I. Palliative medicine handbook. 3rd edition. 2001.
44.- Gomez-Sancho M, Bertolino M, Gomez Batiste J, Sanz Ortiz J. Guías para el uso de opioides en enfermos con patologías terminales. En Avances en cuidados paliativos, tomo II. Ed. GAFOS 2003. pp.371-401.
45.- Christie JM, Simmonds M, Pat R, et al. Dose-titrataion, multicenter study of oral transmucosal fentanyl cirate for the treatment of breakthrough pain in cancer patients using transdermal fentanyl for persistent pain. J Clin Oncol. 1998;16(10):3238-45.
46.- Portenoy RK, Payne R, Coluzzi P, et al. Oral transmucosal fentanyl citrate for the treatment of breakthrough pain in cancer patients : a controlled dose titation study. Pain 1999;79(2-3):303-309.
47.- Davis MP, Wals D. Methadone for relief of cancer pain: a review of pharmacokinetics, pharmacodymanics, drug interactions and protocols of administration. Support Cre Cancer 2001;9:73-83.
48.- Scimeca MM, Savage SR, Portenoy R, Lowison J. Treatment of pain in methadone-maintained patients. Mount Sinai J Med. 2000;67(5-6):412-422.
49.- Daeninck PJ, Bruera E. Reduction in constipation and laxative requirements following opioid rotation to methadone: a report of four cases. J Pain Symp Manag.1999;18(4):303-309. 50.- Mercadante S, Casuccio A, Fulfaro F, Groff L, Boffi R, Villari P, Gebbia V, Ripamonti C. Switching from morphine to methadone to improve analgesia and tolerability in cancer patients: a prospective study. J Clin Oncol. 2001;19(11):2898-904.
51.- Centeno C, Sánchez Posada R, Vara F. Metadona en el tratamiento del dolor cáncer: experiencia del Hospital Los Montalvos, Salamanca. Med Pal. 2004;11:157-163.
54.- Nicholson AB. Methadone for cancer pain. Cochrane Database Syst Rev. 2004;(2):CD003971.
55.- Mercadante S, Casuccio A, Agnello A, Barresi L. Methadone response in advanced cancer patients with pain followed at home. J Pain Symptom Manage. 1999;18(3):188-92.
56.- Bruera E, Fainsinger R, Moore M, et al. Local toxicity with subcutaneous methadone. Experience of two centers. Pain 1991;45:141-145.
57.- Centeno C, Cambero M, Vara F. Subcutaneous methadone: a valid alternative in the treatment of cancer pain. Eur J Pall Care. Abstract book of the 8th congress of the EAP
2003;p.93.
58.- Bruera E, Lynn J, Bosnjak S, et al. Methadone versus morphine as a first-line strong opioid for cancer pain: a randomized double-blind study. J Clin Oncol. 2004;22(1):185-192.
59.- Domínguez Castillejos G, Gómez Sancho M, Berd M, et al. Oxicodona, una opción en el manejo del dolor desde 1917 (14 hidroxi-7,8-dehidrocodeina). Med Pal. 2004;11(4):246-263. 60.- Kalso E, Vanio A. Morphine and oxycodone hidrochloride in the manegement of cancer pain. Clin Pharmacol Ther. 1990;47(5):639-646.
61.- Parr RB. Using controlled-release oxycodone for the management of chronic cancer and non-cancer pain. American Pain Society 1996;6(4):6.
62.- Ripamonti C, Bruera E. CNS adverse effects of opioids in cancer patients. Guidelnes for treatment. CNS Drugs 1997;8(1):21-37.
63.- Heiskanen T, Kalso E. Controlled-release oxycodone and morphine in cancer related pain. Pain 1997;73(1):37-45.
64.- Bruera E, Belzile M, Pituskin E, et al. Randomized, double-blind, cross-over trial comparing safety and efficacy of oral controlled-release oxycodone with controlled-release morphine in patients with cancer pain. J Cil Oncol. 1998;16(10):3222-9.
65.- Lauretti GR, Oliveira GM, Pereira NL. Comparison of sustained-release morphine with sustained-release oxycodone in advanced cancer patients. BJC 2003;89(11):2027-2030. 66.- Murray A, Hagen NA. Hydromorphone. J Pain Symptom Manage. 2005;29(5 Suppl):57-66. 67.- Sarhill N, Walsh D, Nelson KA. Hydromorphone: pharmacology and clinical applications in cancer patients. Support Care Cancer 2001;9(2):84-96.
68.-Miller MG, McCarthy N, O'Boyle CA, Kearney M. Continuous subcutaneous infusion of morphine vs hydromorphone: a controlled trial. J Pain Symptom Manage.1999;18(1):9-16. 69.- Bruera E, Sloan P, Mount B, et al. A randomised, double-blind, double-dummy, crossover trial comparing the safety and efficacy of oral sustained-release hydromorphone with immediate-release hydromorphone in patient with cancer pain. J Clin Oncol 1996;14(5):1713-7. 70.- Coda B, Tanaka A, Jacobson RC, et al. Hydromorphone analgesia after intravenous bolus administration. Pain 1997;71(1):41-48.
71.- Quigley C. Hydromorphone for acute and chronic pain. Cochrane database Syst Rev 2002(1):CD003447.
72.- López JL, Ordoñez A, Martinez N. Vía trandérmica de administración de opioides. En Dolor y Cáncer, hacia una oncología sin dolor. Médica Panamericana 2003. 217-228.
73.- Gal TJ. Naloxone reversal of buprenorphine-induced respiratory depresión. Clin Pharmacology and therapeutics 1989;45:6-71.
74.- Muriel C, Failde I, Mico JA, et al. Effectiveness and tolerability of the buprenorphine transdermal system in patients with moderate to severe chronic pain: a multicenter, open-label, uncontrolled, prospective, observational clinical study. Clin Ther. 2005;27(4):451-62.
75.-Sorje J, Sittl R. Transdermal buprenorphine in the treatment of chronic pain: results of a phase III, multicenter, randomized, double-blind, placebo-controlled study. Clin Ther. 2004;26(11):1808-20.
76.- Mercadante S. Opioid rotation for cancer pain: rationale and clinical aspect. Ancer 1999;86(9):1856-66.
77.- Pereira J, Lawlor P, Vigano A, Dorgan M, Buera E. Equianalgesic dose ratios for opioids: A critical review and proposals for long-term dosing. J Pain Symptom Management 2001;22(2):672-687.
79.- Mercadante S, Casuccio A, Calderone L. Rapid switching from morphine to methadone in cancer patients with poor response to morphine. J Clin Oncol. 1999;17(10):3307-3312.
80.- Ripamonti C, Brunelli C, Plastri D, et al. Switching from morphine to oral methadone in treating cancer pain : what is the equianalgesic dose ratio ? J Clin. Oncol. 1998;16(10):3216-3221.
81.- Wantabe S, et al. Fentanyl by continuous subcutaneous infusion for the management of cancer pain: a retrospective study. J Pain Symptom management 1998;16:323-326.
82.- Porta J, Rodríguez D, Sala C. Dolor. En Manual de control de síntomas en pacientes con cáncer avanzado y terminal. Ed. ARAN 2004. pp. 33-89.
83.- Benitez-Rosario MA, Feria M, Salinas-Martin A, et al. Opioid swithching from transdermal fentanyl to oral methadone in patients with cancer pain. Cancer 2004;101:2866-73.
84.- Heiskanen T, Kalso E. Controlled-release oxycodone and morphine in cancer related pain. Pain. 1997 Oct;73(1):37-45.
85.- Lawlor P, Turner K, Hanson J, Bruera E. Dose ratio between morphine and hydromorphone in patients with cancer pain: a retrospective study. Pain.1997;72(1-2):79-85.
ADYUVANTES ANALGESICOS
Mª Paz Varillas López
Equipo de Soporte de Cuidados Paliativos Hospital Virgen del Puerto, PLASENCIA (CACERES)
INTRODUCCION
Los Analgésicos adyuvantes se definen como un grupo de fármacos cuya indicación principal no es el control del dolor pero tienen actividad analgésica en determinadas situaciones o síndromes dolorosos.
Los principales fármacos que pertenecen a este grupo: Antidepresivos
Anticonvulsionantes Corticoides
Antagonistas NMDA Bifosfonatos
Pueden ser utilizados solos, pero habitualmente se administran con analgésicos de primera línea (habitualmente opioides) en el tratamiento del dolor por cáncer. Se utilizan en casos de dolor refractario a los analgésicos habituales, para reducir la dosis y efectos secundarios de estos (1).
Consideraciones generales en el uso de adyuvantes (1-3)
1. Considerar optimizar terapia con opioide antes de introducir adyuvantes.
2. Existen pocos ensayos comparativos y la elección del adyuvante más apropiado no está basado en diferencias de eficacia; sino en factores relacionados con la valoración del paciente en cuanto a comorbilidad y características del dolor (etiología, fisiopatología, tipo, intensidad e impacto en la calidad de vida).
3. Seleccionar el adyuvante que presente mejor relación riesgo-beneficio, teniendo en cuenta principalmente sus efectos adversos.
4. Se aconseja no iniciar con varios adyuvantes al mismo tiempo y considerar asociarlo con otros individualizando los casos.
Antidepresivos
Los antidepresivos incluyen fármacos de distinta estructura (tabla1), de los cuales los de estructura tricíclica son los más comúnmente utilizados en la terapia del dolor por presentar mayor evidencia de actividad analgésica; y dentro de este grupo el fármaco más utilizado es la Amitriptilina.
A pesar del amplio uso de los antidepresivos en el tratamiento del dolor, el mecanismo de acción a través del cual ejercen su acción analgésica no ha sido adecuadamente demostrado.
Indicaciones
Tabla I
Heterociclicos
Dosis/rango terapéutico Efectos secundariosTriciclicos mg/día 1. Amitriptilina 10-25 (25-150 ) 2. Clormipramina 10-25 (25-200) 3. Imipramina 25 (25-150) 4. Nortriptilina 10 (25-150) 5. Doxepina 12,5 (25-150) Tetraciclicos
1. Mianserina 30-40 (30-90) 2. Maprotilina 25-50 (50-100)
Atípicos
1. Trazodona 25 (150-300)
IRS .IRSNR
Inh Recp Serotonina
1. Paroxetina 20 (20-50) 2. Fluoxetina 20 (20-60) 3. Fluvoxamina 25-50 (100-300) 4. Citalopram 20 (20-60) 5. Sertralina 25-50 (50-200) Inh Recp Serotonina y Noradrenalina
1. Venlafaxina 37,5 (37,5-300)
A. TRICÍCLICOS
Loa Antidepresivos Tricíclicos (ADT) han sido ampliamente estudiados y existe
evidencia significativa de las propiedades analgésicas en el dolor crónico no maligno, sin que se evidenciasen diferencias de control de dolor entre los distintos fármacos de este grupo. (4-7) Por otro lado, existen ensayos clínicos que evalúan los efectos analgésicos de éstos en pacientes con dolor oncológico y amplia experiencia clínica que apoyan estos resultados.(8,9,10). Como ya se ha mencionado antes, la Amitriptilina es el más frecuentemente utilizado, seguida de Imipramina y Clomipramina.
La Amitriptilina puede incrementar la biodisponibilidad de la morfina (11,12) con lo que se podría reducir la dosis de opioides y por tanto la incidencia de efectos secundarios de estos.
La dosis de inicio de es de 25 mg/día (10 mg en ancianos, debilitados e insuficiencia renal) administrados en toma única nocturna. El incremento de dosis se hará aumentando 25 mg de forma gradual (cada tres o cuatro días) hasta conseguir control analgésico o aparición de efectos adversos.
Retención urinaria, sequedad mucosas, visión borrosa,
somnolencia, sedación, taquicardia, hipotensión ortostática mareo, alteraciones en la conducción cardiaca ...
Aunque el efecto analgésico se puede obtener con dosis menores y el inicio de acción es más rápido que en el tratamiento de la depresión (13-15) en algunos pacientes se ha observado que no se alcanza beneficio hasta alcanzar dosis de 100-150 mg/día.(1,16)El efecto analgésico se presenta aún en ausencia de depresión(5,15)
Los principales efectos secundarios (tabla 1) observados son los derivados de su acción anticolinérgica, como sequedad de boca, estreñimiento, visión borrosa, retención urinaria. Igualmente puede producir alteraciones en la conducción cardiaca. Contraindicados en pacientes con glaucoma agudo. Precaución cuando se asocian con otros fármacos con efecto anticolinérgico.
Dentro del grupo tricíclico, las aminas secundarias (Nortriptilina y Desiparamina) tienen menos efectos secundarios (sobretodo menos sedación) que las terciarias.
Con la Trazodona no existen evidencias que demuestren propiedades analgésicas. ISRS
Los estudios realizados con los Inhibidores Selectivos de la Recaptación de Serotonina (IRSS) para el control del dolor crónico benigno no son concluyentes y no se han encontrado referencias en dolor por cáncer (2).
Comparativamente, los antidepresivos tricíclicos han demostrado ser más efectivos que los IRSS en dolor crónico benigno (22-24). La ventaja de los IRSS es su favorable perfil de efectos secundarios.(25)
IRSNR
La Venlafaxina es un fármaco que presenta interés ya que su perfil neurotrasmisor es muy semejante a los triciclicos y porque su estructura es similar al Tramadol (18)
Recientemente existen estudios con resultados positivos en cuanto a propiedades analgésicas en pacientes con cáncer. (19-21,29)
ANTICONVULSIONANTES
A este grupo pertenecen fármacos, con diferentes mecanismos de acción, que son utilizados, aparte de la epilepsia, en el tratamiento de distintos síndromes doloroso con características neuropáticas.
Existe buena evidencia de la efectividad de estas drogas en el tratamiento del dolor neuropático.(30-32)
Los Anticonvulsivantes (ATC) de primera generación (Carbamazepina, Fenitoina, Valproato) utilizadas durante décadas están siendo remplazadas por nuevos grupos de anticonvulsionantes; estos de segunda generación Gabapentina, Pregabalina, Lamotrigina, Topiramato) son mejor tolerados por producir menos sedación y otros efectos a nivel del sistema nervioso central. Actualmente existe consenso en la utilización de estos fármacos independientemente de las características que acompañen al dolor neuropático.
Tabla II
Gabapentina
Amplia eficacia probada en tipos de dolor neuropático no maligno (33-36)y hay estudios que demuestran su eficacia en el dolor neuropático relacionado con cáncer.(37-38)
Actualmente es recomendada como fármaco de 1ª línea (fármaco de elección) en el tratamiento del dolor neuropático de diversa etiología debido a su probado efecto analgésico, buena tolerancia y poca interacción con otros fármacos (principalmente con antiácidos) (3)
Dosis de inicio 300 mg dosis nocturna pudiendo ir aumentando cada 2-3 días hasta dosis máximas (3600 mg \día; aunque se ha observado que algunos pacientes obtienen beneficios con dosis más altas.( tabla II)
Hay estudios que comparan su efectividad con la Amitrptilina sin resultados concluyentes. (65-67)
FARMACO DOSIS( mg) E. ADVERSOS
1ª Generacion
Carmazepina 100mg\12 h. sedación, dipoplia
Incrementando 200 mg cada semama mareo,nauseas,vertigo, hasta 400\12 h. ( Dmax 1200 mg\día) retención hídrica…
Toxicidad hematológica (anemia aplasica)
Fenitoina 100mg\día
Incrementando semanalmente Trastornos motores,
Hasta 500 mg\día confusión, eritema… Toxicidad hepática
2ª Generación
Gabapentina 300mg\noche Somnolencia, fatiga
Incremento 300 mg\ 3 dias mareo, aumento peso.
hasta 1800-3600mg\día repartido menos común: temblor,
en tres tomas vértigo…eritema(raro)
Pregabalina 150mg\noche(Neurop diabetica) Somnoliencia, vertigo... 300mg dos veces al día (N.Postherp)
Lamotrigina 50 mg\día. Mareo, ataxia..
Incremeto 50 mg cada semana rush cutáneo
Hasta 300mg\día (150\12h) sd. Steven Jonson (raro)
Topiramato 50 mg\día Astenia, anorexia
D.Máx 200mg\12 h litiasis renal,
Si se titula cuidadosamente es bien tolerada, aunque en algunas ocasiones la somnolencia puede ser un factor limitante. Se recomienda la suspensión de forma gradual ya que podría precipitar episodios convulsivos.
Se contempla la utilización de otras nuevos ATC en caso de no respuesta satisfactoria, contraindicaciones o no tolerancia de algún efecto adverso de la Gabapentina.
Lamotrigna
Existen estudios donde demuestran beneficio en el dolor neuropático no maligno (40-43)
Algún estudio ha sugerido su beneficio en dolor oncológico (26) aunque faltan más estudios concluyentes. Sus efectos secundarios hacen que se tenga que titular muy lentamente y que su uso sea limitado.
Pregabalina es un nuevo anticonvulsivante con mecanismo de acción semejante a la Gabapentina y recientes estudios confirman fuerte evidencia analgésica en el dolor neuropático no maligno (44,58-59). Presenta inicio de acción rápido y escasa interacción con otros medicamentos.
Topiramato faltan estudios concluyentes. Solo algún estudio demuestra resultados positivos en neuropatía diabética (27)
De los anticonvulsivantes de primera generación la mejor evidencia es para la Carbamazepina (30)y Fenitoina (49). La eficacia analgésica de la Carbamazepina ha sido demostrada en neuralgia del trigémino, neuralgia posherpética, neuropatía diabética y otros tipos de dolor neuropático. Existe experiencia como analgésicos en el dolor neuropático con Clonacepan y Valproato. (48) La frecuencia de efectos secundarios y de interacciones medicamentosas asociados a estos fármacos limitan su uso, declinándose por los nuevos anticonvulsionantes. Se recomienda iniciar con dosis bajas. (Tabla II) Empiezan a surgir nuevos ATC, aunque no hay estudios comparativos y su experiencia en el cáncer es limitado.
Debido a que la eficacia en el dolor neuropático entre Antidepresivos Triciclicos y Anticonvulsivantes es semejante,(46,47) la elección estará basada en los efectos secundarios del fármaco, contraindicaciones, coexistencia de otros síntomas y coste económico del fármaco si esto último fuera un factor importante. Podemos establecer unas recomendaciones generales a la hora de elegir adyuvante(3).
Tabla 5.
• Como terapia inicial elegiremos ADT si el paciente padece insomnio, ansiedad, depresión o si el coste económico
• ATC (Gabapentina)si el paciente no tolera los efectos adversos o tiene alguna contraindicación para ATC (alteración conducción cardiaca) o si es anciano • Titular la medicación seleccionada hasta alcanzar el efecto clínico o máxima
dosis tolerada(ej, si con la Gabapentina no se consigue efecto con dosis de 1800 mg al día suspender el tratamiento; si tiene un efecto parcial titular el fármaco hasta 2400-3600 mg/día)
• Si la monoterapia es tolerada pero es parcialmente efectiva combinar ADT con ATC