INSTITUTO TECNOLÓGICO Y DE ESTUDIOS SUPERIORES DE MONTERREY
PRESENTE.-, e n los sucesivo LA O B R A PRESENTE.-, en virtud de lo cual autorizo a el Instituto T e c n o l ó g i co y de Estudios Superiores de Monterrey (EL INSTITUTO) para que efectúe la divulgación, publicación, comunicación pública, distribución, distribución pública y reproducción, así c o m o la digitalización de la misma, con fines a c a d é m i c o s o propios al objeto de EL INSTITUTO, dentro del círculo de la c o m u n i d a d del Tecnológico de Monterrey.
El Instituto se c o m p r o m e t e a respetar en todo m o m e n t o mi autoría y a o t o r g a r m e el crédito correspondiente en todas las actividades mencionadas anteriormente d e la obra.
De la m i s m a manera, manifiesto que el contenido académico, literario, la edición y en general cualquier parte de LA O B R A son de mi entera responsabilidad, por lo que deslindo a EL I N S T I T U T O por cualquier violación a los d e r e c h o s de autor y/o propiedad intelectual y/o cualquier responsabilidad relacionada con la O B R A que cometa el suscrito frente a terceros.
Por medio de la presente hago constar que soy autor y titular de la obra d e n o m i n a d a
Efecto Hipocolesterolémico del Germinado de Brócoli (Brassica
Oleracea Var. Italica) y Extractos del mismo (Glucosinolato y
Sulfurafano) en un Modelo Animal (Hámster)-Edición Única
Title
Efecto Hipocolesterolémico del Germinado de Brócoli
(Brassica Oleracea Var. Italica) y Extractos del mismo
(Glucosinolato y Sulfurafano) en un Modelo Animal
(Hámster)-Edición Única
Authors
Laura Nelly Rodríguez Cantú
Affiliation
Tecnológico de Monterrey, Campus Monterrey
Issue Date
2008-12-01
Item type
Tesis
Rights
Open Access
Downloaded
19-Jan-2017 01:30:29
INSTITUTO TECNOLÓGICO Y DE ESTUDIOS
SUPERIORES DE MONTERREY
CAMPUS MONTERREY
D I V I S I Ó N DE B I O T E C N O L O G Í A Y A L I M E N T O S P R O G R A M A D E G R A D U A D O S E N B I O T E C N O L O G Í A
TECNOLÓGICO
DE MONTERREY®
Efecto hipocolesteroiémico del germinado de brócoli
(Brassica olerácea var. Itálica)
y extractos del mismo
(glucosinolato y sulfurafano) en un modelo
animal (hámster)
T E S I S
PRESENTADA COMO REQUISITO PARCIAL
PARA OBTENER EL GRADO ACADÉMICO DE:
MAESTRO EN CIENCIAS
CON ESPECIALIDAD EN BIOTECNOLOGÍA
POR:
LAURA NELLY RODRÍGUEZ CANTU
INSTITUTO TECNOLÓGICO Y DE ESTUDIOS
SUPERIORES DE MONTERREY
CAMPUS MONTERREY
DIVISIÓN DE BIOTECNOLOGÍA Y ALIMENTOS PROGRAMA DE GRADUADOS EN BIOTECNOLOGÍA
T E C N O L Ó G I C O
D E M O N T E R R E Y
Efecto hipocolesterolémico del germinado de brócoli
(Brassica oleracea var. Italica)
y extractos del mismo
(glucosinolato y sulfurafano) en un modelo animal (hámster)
TESIS
PRESENTADA COMO REQUISITO PARCIAL PARA OBTENER EL GRADO ACADÉMICO DE:
MAESTRO EN CIENCIAS
CON ESPECIALIDAD EN BIOTECNOLOGÍA
POR:
LAURA NELLY RODRÍGUEZ CANTU
I N S T I T U T O T E C N O L Ó G I C O Y D E E S T U D I O S S U P E R I O R E S D E M O N T E R R E Y
CAMPUS MONTERREY
DIVISIÓN DE BIOTECNOLOGÍA Y ALIMENTOS PROGRAMA DE GRADUADOS EN BIOTECNOLOGÍA
Los miembros del comité de tesis recomendamos que el presente proyecto de tesis presentado por la Lic. Laura N e l l y Rodríguez Cantú sea aceptado como requisito parcial para obtener el grado académico de:
MAESTRO EN CIENCIAS
CON ESPECIALIDAD EN BIOTECNOLOGÍA
Comité de Tesis:
Dr. Sergio O. Serna Saldívar
ASESOR
D E D I C A T O R I A
A Dios, por todas las bendiciones recibidas, por fortalecer mi corazón e iluminar mi mente y haber puesto en mi camino a las personas que han sido mi soporte y compañía a lo largo de la maestría y por permitirme llegar a feliz termino con esta etapa de mi vida.
Espíritu Santo, gracias por los dones recibidos.
A Marquito, por ser mi compañero en las buenas y en las malas, por su impulso a emprender esta meta al fin lograda, por su fe en mí, por caminar junto a mí hacia una misma dirección y por muchas cosas más.. .gracias mi amor.
A mis padres a quienes agradezco de todo corazón por su amor, cariño, comprensión y
apoyo en todo momento. Les agradezco mucho porque de ellos aprendí a salir adelante a pesar de los obstáculos que se presentan en la vida.
A G R A D E C I M I E N T O S
A mis asesores, Dr. Serna que me brindó todo su apoyo y disposición en todo momento e inculcarme el amor a la investigación, Dra. Janet que compartió sus conocimientos y experiencias durante el desarrollo de este estudio, Dra. Rocío por sus comentarios y recomendaciones que sirvieron para el mejoramiento de esta tesis.
Al Dr. José Luis Vázquez y a Santos por el apoyo brindado con el cuidado y en el sacrificio de los hamsters.
Al Dr. Fahey por tener fe en este proyecto y brindarme las facilidades para la obtención de los extractos y análisis requeridos.
Al ITESM y al CONACYT, que proporcionaron la ayuda necesaria para la realización de mis estudios de postgrado.
A M.C. José Rodríguez y al Q.C.B. Benito Martínez por su ayuda con el análisis en el GC/MS. A Lorena, Liz, Abraham, Fany y Raúl por el apoyo en la parte experimental de este proyecto.
RESUMEN
E l germinado de b r ó c o l i se ha estudiado in vitro y en modelos animales y se ha
demostrado que es u n potente inductor de las enzimas de fase I I y u n supresor de la carcinogénesis, sin embargo hay poca evidencia de su potencial en el tratamiento para la hipercolesterolemia. E l o b j e t i v o de este estudio fue investigar los efectos del germinado de b r ó c o l i y sus extractos (glucosinolatos y sulfurafanos) en el desarrollo de la hipercolesterolemia en u n m o d e l o animal.
U n total de 48 hamsters sirianos se d i v i d i e r o n en cuatro bloques de seis unidades experimentales cada uno. Fueron alimentados durante siete semanas con dietas que contenían 0 . 1 % de colesterol y 1 0 % de manteca animal lo cual incrementó 1.5 veces el n i v e l de colesterol en plasma y 4.5 veces el n i v e l de colesterol en hígado con respecto al n i v e l basal. Se d i v i d i e r o n en seis tratamientos, dieta c o n t r o l , dieta con u n fármaco h i p o l i p e m i a n t e , dieta c o n germinado de b r ó c o l i a dosis alta y baja, dieta co n extracto rico en glucosinolato y dieta c o n extracto rico en sulfurafano.
A l finalizar el estudio de 7 semanas, se analizaron muestras de plasma, hígado y heces. Se encontró que los niveles de triglicéridos en plasma fueron diferentes estadísticamente en el grupo c o n el tratamiento c o n extracto rico en sulfurafano comparado con el grupo que consumió la dieta c o n el fármaco. L o s niveles de colesterol total en paslma, H D L y L D L fueron similares entre los tratamientos. Sin embargo, los niveles de colesterol hepático fueron más bajos en los grupos que consumieron una dieta co n germinado en dosis alta y con extracto r i c o en sulfurafanos.
ABREVIACIONES
Abreviatura Significado
uL Microlitro
°C Grados centrígrados
min Minuto
d.i. Diámetro interior
mg Miligramo
g Gramo
UI Unidades internacionales
ND No detectable
Microgramos
E.U.A Estados Unidos de América
ppm Partes por millón
um Micrómetro
m Metro
mm Milímetros
umol Micromol
mL Mililitros
HPLC Cromatografía líquida de alta resolución EDTA Acido etilen diamino tetra acético rpm Revoluciones por minuto
hr Hora
ÍNDICE
Página
AGRADECIMIENTOS I
RESUMEN II ABREVIACIONES III
ÍNDICE IV ÍNDICE DE TABLAS VII
ÍNDICE DE FIGURAS VIII 1. INTRODUCCIÓN 1 2. REVISIÓN BIBLIOGRÁFICA 3
2.1 Colesterol y fracciones de lipoproteínas 3
2.1.1 Metabolismo del colesterol 4 2.1.1.1 Síntesis de colesterol 4 2.1.1.2 Absorción y transporte de colesterol 6
2.1.2 Enfermedades cardiovasculares 8 2.1.2.1 Ateroesclerosis y estrés oxidativo 9
2.2 Compuestos naturales con actividad hipocolesterolémica 11
2.3 Brócoli y Germinado de Brócoli 15 2.3.1 Composición química del brócoli y germinado de brócoli 15
2.3.2 Compuestos activos del germinado de brócoli: glucosinolatos y
sulfurafanos 16 2.3.3 Bioactividad de los sulfurafanos en la salud 19
2.3.3.1 Actividad anticancerígena y antioxidante 19
2.3.3.2 Actividad bactericida 20
3. MATERIALES Y MÉTODOS 21 3.1 Caracterización del germinado de brócoli y extractos 21
3.1.1 Composición química proximal del germinado de brócoli 21 3.1.2 Extractos del germinado de brócoli enriquecidos con glucosinolato y
sulfurafano 22
3.2.2 Animales experimentales 24 3.2.2.1 Estudio metabólico preliminar 24
3.2.2.2 Estudio metabólico in vivo de colesterol 25
3.2.3 Recolección de muestras al finalizar el estudio in vivo 26
3.3 Análisis de muestras 27 3.3.1 Determinación de colesterol por método enzimático 27
3.3.2 Determinación y cuantificación de colesterol por
cromatografía gaseosa acoplada a un detector de ionización de
flama 27 3.3.2.1 Colesterol total en plasma 30
3.3.2.2 Colesterol ligado a lipoproteínas de alta densidad
(C-HDL) 27 3.3.2.3 Colesterol total en hígado 28
3.3.2.4 Condiciones cromatográficas para el análisis de
colesterol en plasma e hígado 29
3.3.3 Triglicéridos en plasma 30 3.3.4 Fosfolípidos en hígado y bilis 31 3.3.5 Determinación y cuantificación de esteróles neutrales en
heces por cromatografía gaseosa acoplada a un detector de
ionización de flama 32 3.3.5.1 Condiciones cromatográficas para el análisis de
esteróles neutrales en heces 32
3.3 Análisis estadístico 33 4. RESULTADOS Y DISCUSIÓN 34
4.1 Estudio metabólico preliminar 34 4.2 Estudio metabólico in vivo de colesterol 35
4.3 Análisis bioquímicos en plasma e hígado 36 4.3.1 Colesterol total, % de HDL, LDL y triglicéridos en plasma 36
4.3.2 Colesterol total y fosfolípidos en hígado 39
4.3 Análisis de función discriminante de colesterol en plasma e hígado 43
5. CONCLUSIONES Y RECOMENDACIONES 46
REFERENCIAS BIBLIOGRÁFICAS 48
ÍNDICE DE TABLAS
Página
Tabla 1. Estudios relacionados en la investigación de la disminución de colesterol 13 Tabla 2. Comparación de la composición nutrimental del brócoli maduro y germinado... 16 Tabla 3. Composición química proximal del germinado de brócoli utilizado durante el
estudio in vivo 21
Tabla 4. Componentes de las dietas utilizadas en el estudio in vivo expresados en
porcentaje 23 Tabla 5. Programa de temperaturas utilizado para el análisis cromatográfico en plasma e
hígado 30 Tabla 6. Soluciones y cantidades utilizadas para la preparación del blanco y el estándar en
la determinación de fosfolípidos 31 Tabla 7. Programa de temperaturas utilizado para el análisis cromatográfico en heces 33
Tabla 8. Excreción urinaria de Ditiocarbamatos en hamsters sometidos a diferentes dosis de
extractos ricos en glucosinolatos y sulfurafanos 35 Tabla 9. Peso y excreción de heces y orina en hamsters sujetos a un estudio metabólico ..36
Tabla 10. Efecto de la suplementación de germinado de brócoli y extractos del mismo en la concentración de lípidos en plasma en hamsters después de 7 semanas de
estudio 38 Tabla 11. Efecto de la suplementación de germinado de brócoli y extractos del mismo en la
concentración de lípidos en hígado 40 Tabla 12. Efecto de la suplementación de germinado de brócoli y extractos del mismo en la
ÍNDICE DE FIGURAS
Página
Figura 1. Estructura del colesterol 3 Figura 2. Biosíntesis del colesterol 5 Figura 3. Estructura de una lipoproteína de baja densidad (LDL) y alta densidad
(HDL) 7 Figura 4. Proceso aterogénico 11
Figura 5. Estructura del glucosinolato 17 Figura 6. Metabolismo del sulfurafano 18 Figura 7. Esquema del metabolismo de la glucorafanina 18
Figura 8. Coeficiente de la correlación de Pearson en las variables de colesterol en plasma
analizadas por método enzimático y por cromatografía de gases 44 Figura 9. Biplot del comportamiento de las hembras ante los tratamientos estudiados en las
variables de colesterol plasmático y hepático 45 Figura 10. Biplot del comportamiento de los machos ante los tratamientos estudiados en las
1 .
INTRODUCCIÓN
En los últimos ańos, las enfermedades del corazón han mostrado un incremento constante,
llegando a ser la primera causa de muerte a nivel mundial así como también en México
(INEGI, 2006). La Organización Mundial de la Salud tiene registrado en el ańo 2005 un
total de 17.5 millones de muertes, lo cual representa el 30% de todas las defunciones
mundiales. Si no se toman las debidas acciones preventivas, se pronostica que para el ańo
2015 alrededor de 20 millones de personas morirían cada ańo a causa de enfermedades
cardiovasculares, principalmente por infartos y accidentes vasculares cerebrales (OMS,
2007)
La ateroesclerosis es la principal causa para la patogénesis de estas enfermedades y está
asociada con el colesterol y el metabolismo de lípidos. El proceso aterogénico inicia
cuando el contenido de colesterol de las lipoproteínas de baja densidad (LDL) se acumula
en la pared íntima produciendo dańo en las arterias (Maxfield y Tabas, 2005). La
modificación de las LDL es debida principalmente a la oxidación producida por el ataque
enzimático y no enzimático. Un ejemplo es la peroxidación lipídica producida por las
especies reactivas de oxígeno (ROS) (Hansson et al, 2006).
Por otra parte, las pautas para el tratamiento de la hipercolesterolemia incluyen el uso de
fármacos o el consumo de alimentos que ayuden a disminuir los niveles de lípidos en
sangre. Las estatinas son el fármaco de elección más utilizado en la actualidad, actúa
como inhibidor de la enzima HMGCoA reductasa, enzima clave para la biosíntesis de
colesterol (Glassberg y Arder, 2008). Sin embargo el uso prolongado de este fármaco
puede ocasionar dańo hepático o en el rińon (Bhardwaj y Chalasani, 2007; Jain et al.,
2007). Una de las ventajas que tiene el consumir alimentos para disminuir el colesterol en
sangre, es evitar los efectos secundarios que traen consigo el uso de fármacos.
Diversos alimentos o alguno de sus componentes han sido identificados con propiedades
2006), sorgo (Sorghum bicolor L. Moench) (Carr et al., 2005), zanahorias (Daucus carota) (Nicolle et al., 2004) alga espirulina (Spirulina platenses) (Riss et al., 2007), té
verde y negro (Vinson et al., 1998), fibra soluble (Leontowicz et al., 2001). A pesar la diversidad de éstos estudios, aún no está suficientemente claro si los efectos son debidos al compuesto en particular o al estar asociado a la matriz alimenticia.
El germinado de brócoli se ha estudiado in vitro y en modelos animales y se ha
demostrado que es un potente inductor de las enzimas de fase II y un supresor de la carcinogénesis (Fahey et al., 1997). Estas acciones son atribuidas al compuesto sulfurafano que por medio de la activación de la enzima glutatión genera los efectos antioxidantes (Wu y Juurlink, 2001). Por esta razón se seleccionó este vegetal para su estudio además de evaluar los efectos hipocolesterolémicos tanto de los extractos ricos en glucosinolatos y sulfurafanos, así como del germinado de brócoli.
2.
REVISIÓN BIBLIOGRÁFICA
2.1 C o l e s t e r o l y f r a c c i o n e s d e l i p o p r o t e í n a s
El colesterol es una molécula lipídica que juega un papel muy importante desde el punto de vista estructural y fisiológico, especialmente en la membrana plasmática, donde actúa de manera estructural y regulando los procesos metabólicos en el interior de la célula (Maxfield y Tabas, 2005). Además es precursor de las hormonas esteroideas, ácidos biliares y vitamina D (Chang et al., 2006; Mitchell et al., 1991).
Como se puede observar en la Figura 1, la estructura del colesterol consiste en cuatro anillos (A,B,C,D) condensados, unidos a dos grupos metilo localizados en el CÍO y C l 3 . Esta estructura es característica de los esteroides naturales, sin embargo el colesterol contiene un grupo 3|3-OH unido al anillo A, una doble ligadura entre el C5 y C6 y una cadena alifática ramificada en el C17.
El colesterol y el resto de los lípidos como los triglicéridos y los fosfolípidos circulan en la sangre unidos a proteínas específicas (apolipoproteínas) formando un complejo macromolecular denominado lipoproteínas. Estas se pueden clasificar en quilomicrones, lipoproteínas de muy baja densidad (VLDL), lipoproteínas de baja densidad (LDL) y lipoproteínas de alta densidad (HDL).
2.1.1 M e t a b o l i s m o D e l C o l e s t e r o l
2.1.1.1 SÍNTESIS DE COLESTEROL
La mayor parte del colesterol del organismo proviene de síntesis novo aportando
diariamente aproximadamente de 800mg a lg y sólo 0.3g proveniente de la dieta. Se encuentra en productos de origen animal, principalmente en la carne, hígado, cerebro y yema de huevo (Omoigui, 2007).
El colesterol es sintetizado por todos los tejidos, siendo el hígado el principal lugar de su biosíntesis (Dietschy et al., 1993). El retículo endoplasmático es el sitio de la síntesis de colesterol. Sin embargo, su concentración es baja (0.5-1%), pero su nivel incrementa a través del aparato de Golgi hasta llegar a la membrana plasmática donde su concentración es mayor (60-80%) (Maxfield y Wünstner, 2002).
El sistema de biosíntesis de colesterol tiene un mecanismo regulador dependiente, en parte, de la cantidad de colesterol absorbida en el intestino. Cuando el colesterol dietético es bajo, su síntesis en el organismo aumenta y lo opuesto sucede en el caso contrario. De esta manera, hay una tendencia a sostener el colesterol corporal a un nivel relativamente constante. (Grundy, 1983).
Mediante una serie de fosforilaciones seguidas de la descarboxilación del compuesto fosforilado intermediario se sintetiza la unidad isoprénica activa de pirofosfato de isopentilo. Esta molécula se isomeriza a pirofosfato de dimetil-alilo, el cual a su vez se condensa con pirofosfato isopentenilo. Posteriormente, mediante una nueva reacción de condensación, una segunda molécula de pirofosfato de geranilo se une para formar como producto el pirofosfato de farnesilo. La molécula de pirofosfato de farnesilo, al tener la capacidad de rotación libre, forma anillos básicos A y B del núcleo de los esteroides, de continuar con su proceso se formará un hidrocarburo de cadena larga conformado por dos moléculas de pirofosfato de farnesilo denominado escualeno. Mediante la acción de oxigenasas y la migración de grupos metilo, la estructura de escualeno, forma el primer compuesto esteroideo de esta vía conocido como lanosterol. La última etapa se inicia con la activación del escualeno con O2 y NADPH, para formar el epóxido del escualeno ciclizado o lanosterol, por medio de una ciclasa. En seguida, el lanosterol pierde tres grupos metilo, una de las dobles ligaduras es reducida con NAPDH y la otra doble ligadura emigra, para formar finalmente el colesterol (Laguna, 2002; Omoigui, 2007).
2.1.1.2 ABSORCIÓN Y TRANSPORTE DE COLESTEROL
El colesterol que se encuentra en el intestino proviene de dos fuentes, de la dieta (colesterol exógeno), el cual se encuentra en forma esterificada y el colesterol que proviene de la degradación de las sales biliares y se encuentra en forma libre (colesterol endógeno) (Grundy, 1983).
Antes de su absorción el colesterol tiene que ser emulsificado por las sales biliares que facilitan la hidrólisis de los esteres de colesterol por la enzima colesterol esterasa. Además de la emulsificación, las sales biliares tienen la propiedad de formar las llamadas micelas (Laguna, 2002). Las micelas transportan colesterol, ácidos grasos, monoglicéridos y lisolecitina desde el lumen del intestino delgado hasta las microvellosidades de las células epiteliales, donde se disocian de las micelas y se difunden a través de la membrana por difusión pasiva hasta el citoplasma celular. (Grundy 1983; Martini y Pallottini, 2007). Cabe mencionar que alrededor de un 90% de las sales biliares son reabsorbidas en el íleum y transportadas hasta el hígado y el resto son metabolizadas en el intestino y excretadas en las heces.
Figura 3. Estructura de una lipoproteína de baja densidad (LDL) y alta densidad (HDL) (Libby, 2002)
Como se mencionó anteriormente, los quilomicrones llegan a la circulación general a través del conducto torácico y están constituidos principalmente por triglicéridos (85-90%). Mientras circulan en el torrente sanguíneo, los triglicéridos se van hidrolizando por la acción de la lipasa lipoproteica (LPL) para proporcionar energía a los tejidos o en su caso, almacenarse como reserva en el tejido adiposo. El colesterol no esterificado, los fosfolípidos y una parte de los triglicéridos que permanecen en la molécula llegan al hígado como remanentes de quilomicrones (Grundy 1983; Martini y Pallottini, 2007).
los lípidos un 7 5 % de la lipoproteína. Las LDL se enlazan a los receptores para Apo B-100 y después de su internalización por endocitosis, la Apo B y los esteres de colesterol se hidrolizan por enzimas lisosomales.
Las lipoproteínas de alta densidad (HDL), son las lipoproteínas más pequeńas, están constituidas en cerca de la mitad de su peso por las apoproteínas A y C, contienen 25% de fosfolípidos, 16% de esteres de colesterol, 5% de colesterol y 4% de triglicéridos. Se forman en el hígado y en el intestino y su función principal es retirar el exceso de colesterol de los tejidos y devolverlo al hígado en donde el colesterol se incorpora para la síntesis de nuevas lipoproteínas o para ser segregado a la bilis para su excreción en heces. (Grundy 1983; Martini y Pallottini, 2007)
2.1.2 E n f e r m e d a d e s c a r d i o v a s c u l a r e s
Las enfermedades cardiovasculares (ECV) son aquellas en donde existe un dańo en el corazón o en vasos sanguíneos ocasionado principalmente por obstrucciones que impiden que la sangre fluya de manera natural. Entre ellas se encuentran las cardiopatías coronarias, reumáticas o congénitas, enfermedades cerebrovasculares, arteriorpatías periféricas y trombosis (OMS, 2007).
2.1.2.1 ATEROESCLEROSIS Y ESTRÉS OXIDATIVO
La ateroesclerosis es la principal causa para la patogénesis de las ECV y esta asociada con el colesterol y el metabolismo de lípidos. La ateroesclerosis se define como cambios degenerativos en donde existe una infiltración de depósitos de grasa en las paredes de las arterias (Jain et al., 2007).
El proceso aterogénico inicia cuando el contenido de colesterol de las lipoproteínas de baja densidad (LDL) se acumula en la pared íntima produciendo dańo en las arterias. (Maxfield y Tabas, 2005; Jain et al.,2007). Cuando los niveles de LDL aumentan en plasma, se infiltran en la capa íntima de la pared arterial de tal manera que excede la capacidad de eliminación y son retenidas en la matriz extracelular provocando una respuesta inflamatoria. La modificación de las LDL principalmente debida a la oxidación producida por el ataque enzimático y no enzimático, libera fosfolípidos oxidados que pueden activar las células endoteliales (Hansson et al., 2006). Los macrófagos derivados de los monocitos y linfocitos T ingieren las partículas de LDL oxidadas (LDL-ox). Si el colesterol que proviene de las partículas LDL no puede movilizarse hacia afuera de la célula se acumula como partículas citosólicas lo que le otorga a las células el aspecto espumoso característico de la aterosclerosis (Maxfield y Tabas, 2005). Como se observa en la Figura 4 la primera lesión en la ateroesclerosis son las llamadas estrías de grasa y no producen ninguna obstrucción o síntoma. Sin embargo a la estría grasa le sigue la lesión intermedia, conformada por capas de macrófagos, de células musculares lisas y matriz extracelular y al aumentar de diámetro disminuye el calibre de la arteria e interfiere con el flujo normal de sangre (Jain et al., 2007). Además, las placas ateromatosas pueden sufrir necrosis, calcificación, ulceración y fisuras, lo cual puede resultar en eventos trombóticos y la oclusión parcial o total del vaso sanguíneo (Lusis, 2000).
dańo orgánico conocido como estrés oxidativo. Las principales especies reactivas del oxígeno son: el radical superóxido (O2"'), el peróxido de hidrógeno (H2O2) y el radical hidroxilo (HO
-). Las ROS están relacionados con el proceso aterogénico al dańar la función vascular por diversos mecanismos. Primero, los radicales hidroxilo dańan directamente el núcleo y la membrana celular. Segundo, los ROS interactúan con los mediadores endógenos formados en las células endoteliales y tercero, provocan la peroxidación en cadena que altera la membrana de las células del endotelio vascular y oxida las lipoproteínas de baja densidad (LDL), uno de los mediadores clave en la aterosclerosis (Bonomini et al., 2008)
Para contrarrestar el dańo provocado por las ROS, nuestro organismo posee un sistema enzimático de detoxificación de ROS, como la superóxido dismutasa (SOD), catalasa (CAT), sistema glutatión (GSH) y sistema tioredoxin (Nedelijkovic et al., 2003). Estas enzimas actúan específicamente sobre determinadas especies reactivas. Así, la superóxido dismutasa transforma al 02"' a O2 y H2O2, la catalasa transforma al H2O2 en O2 y agua. El GSH interviene en la donación de electrón para eliminar los radicales peróxido incluyendo el peróxido de hidrógeno, esta reacción es catalizada por la GSH-Px generando glutatión oxidado (GSSG), el cual es reducido por la enzima GSH-Red usando NADPH como electrón donador (Wu y Juurlink, 2001; Fahey y Talalay, 1999). Además el glutatión es esencial para la regeneración del radical tocoferoxil a tocoferol, el cual forma parte del sistema de defensa de nuestro organismo. La tioredoxina reductasa participa en la restauración de los niveles de GSH reducido adquiriendo por ello propiedades antioxidantes, además diversos estudios han demostrado el papel cardioprotectivo de la familia tioredoxina (Das, 2004, Malik et al., 2006).
íntima Media
Figura 4. Proceso Aterogénico (Libby, 2002)
2.2 C o m p u e s t o s n a t u r a l e s con actividad hipocolesterolémica
Diversos estudios in vitro e in vivo han demostrado eficientemente el uso de compuestos naturales para la prevención o intervención en las enfermedades cardiovasculares, especialmente aquellas relacionadas con la hipercolesterolemia.
En un estudio in vitro realizado por Chang et al., (2001) mostró que algunos derivados de
Singh et al., (2004) realizaron un estudio in vitro con extractos de ajo (Allium sp) en
donde además de la inhibición de la HMG CoA reductasa, se encontró la inhibición de la enzima 4 a-metil oxidasa que cataliza las reacciones entre el paso de lanosterol a colesterol. Si bien se han probado compuestos fenólicos de té verde y negro, vino tinto y jugo de uva, extractos fenólicos de Fagopyrium esculentum Moench para reducir el
colesterol en plasma(Vinson et al., 1998, 2001; Lin et al., 2008), también se han estudiado el efecto de la fibra utilizando como mecanismo de acción, la disminución en la absorción de colesterol o interrumpiendo la circulación enterohepática de los ácidos biliares (Hsu et al., 2006; Alien et al., 2004; Nicolle et al., 2003, 2004 ). Los fitoesteroles son otros compuestos naturales con estructura similar al colesterol pero con una absorción intestinal menos eficiente. Al consumir en la dieta éstos compuestos ayudan a disminuir el colesterol plasmático y/o hepático, interviniendo en el desplazamiento del colesterol de las micelas por competición física, provocando una disminución en su absorción y un incremento en la excreción de colesterol (Yokohama 2004; Hayes, 2002, Hu et al., 2006).
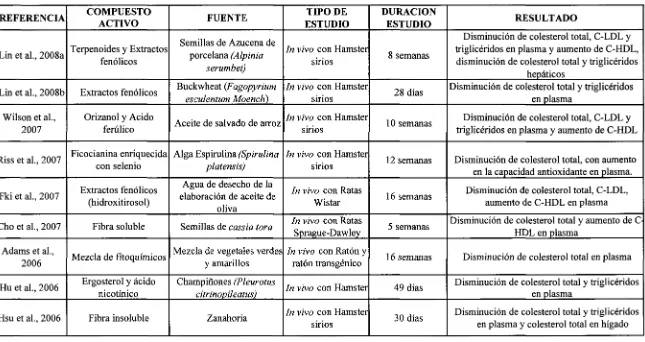
Tabla
1.
Estudios relacionados en la investigación de la disminución de colesterol.
REFERENCIA COMPUESTO A C T I V O FUENTE TIPO DE ESTUDIO
DURACIÓN
ESTUDIO RESULTADO
Lin et a l , 2008a Terpenoides y Extractos fenólicos
Semillas de Azucena de porcelana (Alpinia
serumbet)
In vivo con Hámster
sirios 8 semanas
Disminución de colesterol total, C-LDL y triglicéridos en plasma y aumento de C-HDL,
disminución de colesterol total y triglicéridos hepáticos
Lin et al., 2008b Extractos fenólicos Buckwheat (Fagopyrium
esculentum Moench)
In vivo con Hámster
sirios 28 días
Disminución de colesterol total y triglicéridos en plasma
Wilson et al., 2007
Orizanol y Acido
ferúlico Aceite de salvado de arroz
In vivo con Hámster
sirios 10 semanas
Disminución de colesterol total, C-LDL y triglicéridos en plasma y aumento de C-HDL
Riss et al., 2007 Ficocianina enriquecida con selenio
Alga Espirulina (Spirulina
platensis)
In vivo con Hámster
sirios 12 semanas Disminución de colesterol total, con aumento en la capacidad antioxidante en plasma.
Fki et al., 2007 Extractos fenólicos (hidroxitirosol)
Agua de desecho de la elaboración de aceite de
oliva
In vivo con Ratas
Wistar 16 semanas
Disminución de colesterol total, C-LDL, aumento de C-HDL en plasma
Cho et al., 2007 Fibra soluble Semillas de cassia tora In vivo con Ratas
Sprague-Dawley 5 semanas
Disminución de colesterol total y aumento de C HDL en plasma
Adams et al.,
2006 Mezcla de fitoquímicos
Mezcla de vegetales verdes y amarillos
In vivo con Ratón y
ratón transgénico 16 semanas Disminución de colesterol total en plasma
Hu et al., 2006 Ergosterol y ácido nicotínico
Champińones (Pleurotus
citrinopileatus) In vivo con Hámster 49 días
Disminución de colesterol total y triglicéridos en plasma
Hsu et a l , 2006 Fibra insoluble Zanahoria In vivo con Hámster
sirios 30 días
[image:28.792.78.723.58.400.2]Continuación Tabla
1.
Estudios relacionados en la investigación de la disminución de colesterol.
REFERENCIA COMPUESTO
A C T I V O FUENTE
TIPO DE ESTUDIO
DURACIÓN
ESTUDIO RESULTADO
Carr et al., 2005
Fitoesteroles y
Policosanoles Sorgo rojo
In vivo con Hámster
sirios 4 semanas
Disminución de C- LDL y aumento de C-HDL en plasma, así como disminución de coelsterol
total y triglicéridos hepáticos
Ausman et al, 2005.
gama orizanol, tocotrienoles, tocoferoles, fitoesteroles
Aceite de salvado de arroz In vivo con Hámster
sirios 6 semanas
Disminución de colesterol total y C-LDL en plasma
Nicolle et al., 2004
Carotenoides, Vitamina
E y Fibra Zanahoria liofílizada
In vivo con Ratones
C57BL/6J 4 semanas
Disminuyeron el colesterol total y triglicéridos en plasma e hígado
Chau et al.,
2004 Fibra insoluble
Piel de Naranja (Citrus
sinensis L. cv.)
In vivo con Hámster
sirios 30 días
Disminución de colesterol total y triglicéridos en plasma y coelsterol total en hígado
Suido et al.,
2002 Mezcla de fitoquímicos
Bebida a base de diversas frutas y verduras
In vivo con
Humanos 10 semanas
Disminución del colesterol total y del C-LDL plasmático.
Vinson et al.,
2001 Compuestos fenólicos
Vino Tinto, Vino tinto sin alcohol y jugo de uva
In vivo con Hámster
sirios 10 semanas
Disminución del colesterol total y del C-LDL plasmático.
Leontowicz
et al., 2001 Fibra soluble Betabel y manzana
In vivo con Ratas
Wistar 40 días
Disminución de colesterol total y C-LDL en plasma y colesterol total en hígado Vinson et al.,
1998 Flavonides y vitamina C
Naranjo amargo (Citrus aurantium)
In vivo con Hámster
sirios 4 semanas
Disminución de colesterol total y C-LDL en plasma e índice aterogénico Murashima
etal., 1994 Sulfurafano Germinado de brócoli
In vivo con
Humanos 7 días
En hombres se presentó una disminución de colesterol total y C-LDL en plasma.
Chang et al.,
2001 Taninos Hierbas chinas
In vitro con Células
Vero . . . .
Actividad inhibitoria de HMGCoA reductasa en los compuestos proantrocianidina y
2.3 Brócoli y Germinado de Brócoli
2.3.1 Composición química del brócoli y germinado de brócoli.
El brócoli (Brassica olerácea L. variedad Itálica) pertenece a la familia Cruciferae, es
originario del Mediterráneo, principalmente de Italia e introducida a Estados Unidos en 1925 por inmigrantes italianos.
El brócoli es uno de los vegetales más ricos en vitamina C (52.9mg/100g), p-caroteno (0.81mg/100g), luteína (0.68mg/100g) y a-tocoferol (0.47mg/100g) y contenido fenólico de (63.4mg/100g) (Singh et al., 2007) También contiene fitoesteroles como el p-sitoesterol, campesterol, estigmasterol, brasicasterol y avenasterol, en concentraciones de 285, 67, 8, 3 y 2 mg/ Kg peso fresco, respectivamente (Piironen et al., 2003). Además de otros minerales como el selenio, el cual se encuentra en mayor proporción en forma de selenio-metil-seleniocisteína (Lyi et al., 2005) y compuestos bioactivos como el sulfurafano.
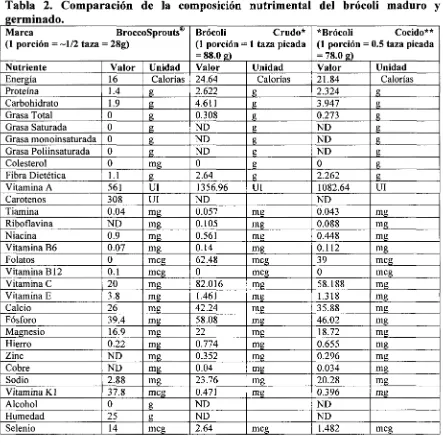
Tabla 2. Comparación de la composición nutrimental del brócoli maduro y germinado.
Marca BroccoSprouts®
(1 porción = -1/2 taza = 28g)
Brócoli Crudo* (1 porción = 1 taza picada
= 88.0g)
*Brócoli Cocido**
(1 porción = 0.5 taza picada = 78.0g)
Nutriente Valor Unidad Valor Unidad Valor Unidad
Energía 16 Calorías 24.64 Calorías 21.84 Calorías
Proteína 1.4 g 2.622 g 2.324 g
Carbohidrato 1.9 g 4.611 g 3.947 g
Grasa Total 0 g 0.308 g 0.273 g
Grasa Saturada 0 g ND g ND g
Grasa monoinsaturada 0 g ND g ND g
Grasa Poliinsaturada 0 g ND g ND g
Colesterol 0 mg 0 g 0 g
Fibra Dietética 1.1 g 2.64 g 2.262 g
Vitamina A 561 UI 1356.96 UI 1082.64 UI
Carotenos 308 UI ND ND
Tiamina 0.04 mg 0.057 mg 0.043 mg
Riboflavina ND mg 0.105 mg 0.088 mg
Niacina 0.9 mg 0.561 mg 0.448 mg
Vitamina B6 0.07 mg 0.14 mg 0.112 mg
Folatos 0 mcg 62.48 mcg 39 mcg
Vitamina B12 0.1 mcg 0 mcg 0 mcg
Vitamina C 20 mg 82.016 mg 58.188 mg
Vitamina E 3.8 mg 1.461 mg 1.318 mg
Calcio 26 mg 42.24 mg 35.88 mg
Fósforo 39.4 mg 58.08 mg 46.02 mg
Magnesio 16.9 mg 22 mg 18.72 mg
Hierro 0.22 mg 0.774 mg 0.655 mg
Zinc ND mg 0.352 mg 0.296 mg
Cobre ND mg 0.04 mg 0.034 mg
Sodio 2.88 mg 23.76 mg 20.28 mg
Vitamina Kl 37.8 mcg 0.471 mg 0.396 mg
Alcohol 0 g ND ND
Humedad 25 g ND ND
Selenio 14 mcg 2.64 mcg 1.482 mcg
* US Department of Agriculture, Agricultural Research Service. 2001. USDA Nutrient Datábase for Standard Reference, Reléase 14. Nutrient Data Laboratory Home Page, http://nal.usda.gov/fnic/foodcomp. ** Cocido, escurrido, sin sal.
2.3.2 Compuestos activos del germinado de brócoli: glucosinolatos y sulfurafanos.
Los glucosinolatos son conocidos sólo en pocas especies, se reportan casi exclusivamente en el orden de las Caparales que contienen 15 familias, incluyendo la Brassicaceae, Capparaceae y Caricaceae. Existen aproximadamente 120 glucosinolatos que comparten
[image:31.612.35.478.56.499.2]aminoácidos y un sulfuro unido a una molécula de P-D-glucopiranosa. (Halkier et al., 2006)
OH
o-OH
hP~Í^o
o
[image:32.612.117.373.111.221.2]R
Figura 5. Estructura del glucosinolato (Talalay y Fahey, 2001.)
Los glucosinolatos son solubles en agua, amónicos, no volátiles y estables al calor, se considera que los glucosinolatos per se no poseen una actividad biológica significativa
(Fahey y Talalay, 1999). Se mantienen químicamente estables hasta que hacen contacto con la enzima mirosinasa (tioglucosidasa glucohidrolasa EC 3:2:2:1) (Rask et a l , 2000). y los principales productos de la hidrólisis de los glucosinolatos son los isotiocianatos.
La glucorafanina (4-metilsulfinilbutil) es el principal glucosinolato presente en el germinado de brócoli (Fahey et al., 1997). Fue inicialmente aislado del rábano (Raphanus sativus) por Ivanovics y Horvath (1947). Posterior a esto, sólo se ha identificado en la
familia de las Cruciferas, principalmente en el género Brassica (brócoli, germinado de
brócoli, coles de Bruselas, coliflor, repollo, entre otros) (Mithen et al., 2000). La hidrólisis de éste glucosinolato es la aglicona sulfurafano. El sulfurafano es metabolizado en los mamíferos principalmente por la ruta del ácido mercaptúrico. En la Figura 6 se muestra como la mirosinasa cataliza la hidrólisis de glucorafanina a sulfurafano y éste es metabolizado por conjugación con la glutationa (catalizada por la glutationa S-transferasa), para remover los residuos glutamil y de glicina actúan las enzimas y-glutamil transferasa y cisteinilglicinasa respectivamente. Finalmente se produce una
H20 glucosa
MVROSIKASA ^..L^ Glucorafanina
. N=C = S
Sulfurafano
(Glutatión) Gli>-Cys-Gly
KH R— ^=C = K (Sulfurafano)
3lu-Cys-Gly Cyj-Gty Cys Cys-MAc í Acido Müfcapiurico) S S S H | CJ3SS8 H I _ NA: H I
R—N—C = S .-—N - - .' R— K— c. = &
y
[image:33.612.79.442.60.222.2]Ditiocarbamatos
Figura 6. Metabolismo del Sulfurafano (Adaptado de Kensler, 2005)
Bheemreddy y Jeffery (2007) purificaron glucorafanina de semillas de brócoli y se les proporcionó a ratas F344 en forma oral e intravenosa. Como se observa en la Figura 7 el resultado de esta investigación reveló que la glucorafanina se absorbe de manera intacta, pasa por la circulación enterohepática y se convierte en su forma reducida como glucoerucina en el cuerpo. La cantidad de productos urinarios fue mayor cuando la dosis se administró vía oral en comparación con la dosis vía intravenosa, esto sugiere que en ausencia de mirosinasa la glucorafanina puede ser hidrolizada por la microflora intestinal.
GP.ip HÍGADO
GP po NTESTINO
GP, GR, SF, ER, SF-NAC, ER-NAC
en orina
[image:33.612.167.348.445.632.2]2.3.3 Bioactividad de los sulfurafanos en la salud
2.3.3.1 Actividad anticancerígena y antioxidante
El sulfurafano es un potente inductor de las enzimas fase II (glutatión peroxidasa GSH-Px, glutatión S-transferasa GST, NAD(P):quinona reductasa y UDP glucoroniltransferasa) sin inducir a las enzimas de fase I (Fahey et al., 1997), activando los elementos de respuesta a antioxidante (ARE) a través de Keap 1 y Nrf2. El sulfurafano interactúa de manera directa con los grupos sulfidrilos de Keap 1, causando que se libere el Nrf2. Además activa la ruta de la proteína quinasa mitogen activada (MAPK), que ocasiona la fosforilación de Keapl y la liberación de Nrf2. Al liberar el Nrf2, entra al núcleo en donde induce la respuesta al gen ARE y por consiguiente la expresión de las enzimas de fase II. (Fahey y Kensler, 2007; Talalay y Fahey, 2001) Existen otros mecanismos por los cuales el sulfurafano es un agente quimioprotector, inhibe la polimerización de tubulina lo cual genera la interrupción del ciclo celular durante la mitosis, además mantiene el check point 2 quinasa e inhibe la actividad de la histona deacetilasa, que están correlacionadas con la inducción de apoptosis (Myzak y Daswood, 2006). Adicionalmente, el sulfurafano previene la tumorogénesis de cáncer de piel interviniendo en la etapa de promoción, debido a la inhibición de la enzima ornitina descarboxilasa (Gills et al., 2006).
Dinkova-Kostova et al., (2006) concluyeron que la aplicación tópica de sulfurafano (1 umol) contenido en extractos de germinado de brócoli, disminuye en un 50% la formación de tumores de piel en ratones.
Existe otro sistema endógeno antioxidante, la familia de las enzimas tioredoxinas. En un estudio reciente, Mukherjee et al., (2008), concluyeron que el consumo de brócoli mejoró la función ventricular, redujo la apoptosis de las células cardiacas y el tamańo del infarto en ratas que consumieron lml de extracto de brócoli durante 30 días, debido a que el sulfurafano induce una serie de seńales celulares de supervivencia y la inducción de genes y proteínas en la familia tioredoxinas, las cuales están involucradas en la protección cardiaca en nuestro organismo (Das, 2004).
Li et al., (2008) investigaron la sinergia entre los extractos de germinado de brócoli ricos en sulfurafanos y el selenio en células hepáticas inmortalizadas (HHL-5), concluyendo, que éstos compuestos por sí solos pueden regular la inducción y la actividad de la enzima tioredoxina reductasa solo 2 veces aproximadamente, sin embargo la sinergia de éstos dos compuestos pueden aumentar la inducción 3.7 veces y la actividad enzimática 5 veces más.
2.3.3.2 Actividad Bactericida
La infección por Helicobacter pylori es un problema de salud mundial, afecta alrededor
del 50% de la población humana. La gastritis, úlcera péptica y cáncer gástrico están asociados con la infección de ésta bacteria (Torres et al., 2005). El sulfurafano posee actividad bactericida contra H. pylori in vitro y bloquea la formación de tumores gástricos
3. MATERIALES Y MÉTODOS
3.1 Caracterización del germinado de brócoli y extractos.
3.1.1 Composición química proximal del germinado de brócoli
El germinado de brócoli utilizado para la presente investigación fue donado por Alimentos Lee® (Monterrey, N.L., México) y la semilla utilizada para la obtención del germinado fue proporcionada por la Marca Broceo Sprouts® (Baltimore, MD., E.U.A).
[image:36.612.80.517.505.605.2]Los componentes se determinaron en porcentaje base seca y base húmeda. La humedad y cenizas se determinaron utilizando los métodos analíticos No. 925.1 y 923.03, respectivamente (AOAC, 1990). El contenido de proteína se determinó mediante el procedimiento estándar de la AOAC No. 978.02, utilizando el valor de 6.25 como factor de conversión de nitrógeno a proteína (AOAC, 1990). El contenido de grasa total fue determinado mediante la extracción continua utilizando como solvente éter de petróleo por un período de 6 horas en un equipo de extracción Goldfisch Labconco® (AOAC, 1990). El contenido de fibra cruda se determinó de acuerdo al procedimiento establecido por la AOAC (1998) y el contenido de carbohidratos se determinó por método diferencial. En la Tabla 3 se puede observar los resultados de la composición química proximal, los cuales se utilizaron para ser considerados en la elaboración de las dietas experimentales.
Tabla 3. Composición química proximal del germinado de brócoli utilizado durante el estudio in vivo.
% Base Seca % Base Húmeda Método analítico
Humedad NA 91.85 JAOAC 925.10
Cenizas 26.91 2.67 JAOAC 923.03
Proteínas 15.14 1.13 JAOAC 978.02
Grasas 6.99 0.57 Goldfisch Labconco
Fibra Cruda 18.88 1.54 AOAC (1998)
3.1.2 Extractos del germinado de brócoli enriquecidos con glucosinolato y sulfurafano.
Los extractos enriquecidos con glucosinolato y con sulfurafano fueron donados por el Dr. Jed Fahey de la Escuela de Medicina de la Universidad Johns Hopkins (Baltimore, MD, E.U.A). La cantidad de glucosinolato y sulfurafano contenido en el extracto del germinado de brócoli, fue determinada por el Dr. Jed W. Fahey y los resultados fueron de 388 umol de glucosinolato por gramo de extracto y 70 umol de sulfurafano por gramo de extracto.
3.2 Estudio in vivo
3.2.1 Elaboración de dietas experimentales
Tabla 4. Componentes de las dietas utilizadas en el estudio in vivo, expresados en porcentaje.
INGREDIENTE NEGATIVO CONTROL CONTROL POSITIVO
DOSIS BAJA EN GERMINADO DOSIS ALTA EN GERMINADO EXTRACTO RICO EN GLUCOSINOLATO EXTRACTO RICO EN SULFURAFANO
CASEÍNA 1 20 20 20 19 20 20
METIONINA2 0.20 0.20 0.20 0.20 0.20 0.20
ACEITE DE MAÍZ 5 5 5 5 5 5
MANTECA
ANIMAL 10 10 10 10 10 10
COLESTEROL3 0.10 0.10 0.10 0.10 0.10 0.10
CELULOSA4 3.50 3.49 3.50 2.82 3.50 3.50
SACAROSA 10 10 10 9 10 10
ALMIDÓN5 46.55 46.55 46.19 45.59 46.04 43.69
VITAMINAS6 1 1 1 1 1 1
MINERALES7 3.50 3.50 3.50 3.50 3.50 3.50
PELETIZADOR 0.15 0.15 0.15 0.15 0.15 0.15
GERMINADO DE
BRÓCOLI 0 0 0.36 3.60 0 0
GLUCOSINOLATO 0 0 0 0 0.51 0
SULFURAFANO 0 0 0 0 0 2.86
SIMVAST ATINA 0 0.0064 0 0 0 0
AIN Caseína pura alta en nitrógeno. MP Biomedicals, Inc. (Ohio, E.U.A)
2
Metionina
3 Colesterol grado ultrapuro. Amresco® (Ohio, E.U.A)
4 AIN Alphacel Non-Nutritive Bulk. MP Biomedicals, Inc. (Ohio, E.U.A) 5 Fécula de Maíz. Marca MAIZENA®
6
AIN 76 Mezcla de vitaminas. MP Biomedicals, Inc. (Ohio, E.U.A)
7 AIN 76 Mezcla de minerales. MP Biomedicals, Inc. (Ohio, E.U.A)
[image:38.612.44.512.72.405.2]El pellet alimenticio se guardó en bolsas de polietileno con cierre hermético (Marca Ziploc®) y se mantuvo en congelación a -4°C. Antes de ser utilizadas se pasaron a un refrigerador ajustado a 4°C para ser proporcionadas a los hamsters.
3.2.2 Animales experimentales
Un total de 48 Hamsters adultos Sirios Dorados, 24 hembras y 24 machos de 16 semanas de edad con un peso aproximado de lOOg fueron adquiridos del bioterio de la Escuela de Medicina del Tecnológico de Monterrey. Los animales se bloquearon por sexo y peso inicial en orden ascendente y se diferenciaron con una muesca en la oreja y se asignaron al azar en cuatro bloques de 6 hamsters cada uno. Los protocolos de experimentación con animales de laboratorio se hicieron según las especificaciones de la Norma Oficial Mexicana NOM-062-ZOO-1999 para la producción, cuidado y uso de animales de laboratorio. Además se incluyeron 5 hamsters (3 hembras y 2 machos) que no recibieron una dieta hipercolesterolémica para ser considerados como controles básales.
Las condiciones ambientales dentro del bioterio fueron controladas, la temperatura a 20°C, la humedad relativa a 66% y se aplicaron ciclos de 12 horas luz/oscuridad. El agua y alimento se proporcionaron ad libitum durante 7 semanas.
Al término del Estudio in vivo, los hamsters fueron anestesiados con éter etílico
(Desarrollo de Especialidades Químicas, San Nicolás de los Garza, N.L., México) y sacrificados mediante punción intracardiaca.
3.2.2.1 Estudio metabólico prelimiar
Los tratamientos consistieron en administrar por vía oral una dieta control sin extractos, una dieta con extracto enriquecido en glucosinolato a dosis de 0.1% y 1.0% y una dieta con extracto enriquecido con sulfurafano a dosis de 0.1% y 1.0%. Durante la prueba se cuantificó el alimento y se recolectaron heces y orina. A la orina se le adicionó ácido bórico al 1.8% para su conservación, se guardó a -20°C en un congelador (Marca VWR®) para posteriormente enviarse a Baltimore, E.U.A para el análisis de los metabolitos de glucosinolatos y sulfurafanos.
3.2.2.2 Estudio metabólico " in vivo" de colesterol
Se realizó un estudio metabólico durante el estudio in vivo en donde los hamsters en
forma individual se mantuvieron durante 7 días en jaulas metabólicas (Marca Nal gene® Miami, Florida, E.U.A.). El peso de los hamsters se registró al iniciar y terminar del estudio metabólico.
% Digest. de la materia seca = gr alimento consumido - gr de heces xlOO
gr alimento consumido
% Absorción de colesterol = mg colesterol consumido - mg de colesterol en heces xlOO
mg colesterol consumido
3.2.3 Recolección de muestras al finalizar el estudio in vivo
Al final del estudio in vivo, los animales se mantuvieron en ayuno por 12 horas y se
anestesiaron con éter etílico. La sangre fue retirada mediante punción intracardiaca utilizando una jeringa de lOmL (Marca Terumo®). La sangre fue colectada en tubos de vidrio estériles (Marca Vacutainer®) utilizando K3 EDTA como anticoagulante, los tubos se invirtieron de 3 a 5 veces para asegurarse que la sangre entrará en contacto con el anticoagulante.
Para la separación de plasma, las muestras se centrifugaron por 7 minutos a 3500 rpm a 4°C (Centrífuga Eppendorf 5804C, Eppendorf, Hamburg, Alemania). Se extrajo el plasma con cuidado de no tocar la capa de fibrina ni de células restantes, se separaron alícuotas en tubos Eppendorf y se guardaron a -80°C en un ultracongelador (Marca Reveo®) para su posterior análisis.
La bilis de la vesícula biliar se recolectó utilizando una jeringa insulínica y se colocó en un tubos de microcentrífuga con solución salina al 0.9% (200 uL) (PiSA Laboratorios Monterrey, N.L. México) (Carr et al., 2005). La jeringa se lavó varias veces en la solución salina para la transferencia cuantitativa. Se guardaron a -80°C en un ultracongelador (Marca Reveo®) para su posterior análisis.
3.3 Análisis de muestras
3.3.1 Determinación de colesterol por método enzimático
Para la determinación de colesterol en plasma se utilizó un método enzimático. El fundamento de la técnica es la hidrólisis de los esteres de colesterol mediante la acción enzimática de la colesterol esterasa para formar colesterol y ácidos grasos libres, posteriormente el colesterol es oxidado por la colesterol oxidasa para producir colesten-3ona y peróxido de hidrógeno. El hidrógeno peróxido, fenol y la 4-aminoantipirina producen un indicador que es una quinonemina (cromóforo), bajo la acción catalítica de laperoxidasa (Allain et al, 1974; Roeschlau et al, 1974).
Se tomó 1 mi. del reactivo y se colocó en un tubo eppendorf de 1.5 m de capacidad y se agregó 10 ul de muestra, se incubó durante 10 minutos a 25°C. Posteriormente, se leyó la absorbancia antes de los 60 minutos en un espectrofotómetro (Beckman modelo DU650, Beckman Instruments, Fullerton, CA., EUA) ajustado a una longitud de onda de 546 nm. Los cálculos se determinaron de acuerdo a lo siguiente:
n . .r r Absorbancia muestra Loncentracion\mg I dl\ = * 200
Absorbancia estándar
3.3.2 Determinación y cuantificación de colesterol por cromatografía gaseosa acoplada a un detector de ionización de flama
Para la determinación y cuantificación de colesterol en plasma, hígado y del colesterol ligado a lipoproteínas por cromatografía gaseosa acoplada a un detector de ionización de flama se hicieron algunas modificaciones de los métodos reportados por Du y Ahn, (2002), Ahmida et al., (2002) y SGE Corporation.
3.3.2.1 Colesterol total en plasma
saponificación se realizó en bańo maría (Marca VWR Internacional West Chester, PA, EUA) durante 1 hora a 80°C. Se dejó enfriar el vial y posteriormente se le adicionó agua destilada (100 uL) seguido de hexano grado HPLC (400 uL). Se agitaron los contenidos en un vortex por 10 segundos y se esperó a que se formaran dos fases. Se retiró la fase superior y se colocó en un vial de vidrio, el extracto se evaporó hasta sequedad con flujo de nitrógeno.
Se agregó derivatizante BSTFA + TMCS (15 uL) N,0-bis trimetilsilil trifluoroacetamida + trimetilclorosilano obtenido en Sigma-Aldrich Co. (St. Louis MO, E.U.A.) y se aforó con hexano grado HPLC (100 uL) obtenido por EMD® Chemicals, para su análisis en el cromatógrafo de gases.
3.3.2.2 Colesterol ligado a lipoproteínas de alta densidad (C-HDL)
Para determinar y cuantificar el colesterol ligado a lipoproteínas de alta densidad (C-HDL) primeramente se necesitó precipitar las lipoproteínas de baja densidad (LDL), las de muy baja densidad (VLDL) y la fracción de quilomicrones utilizando una solución acuosa de fosfotungstato de sodio obtenido en Sigma-Aldrich Co. (40g/L) y de cloruro de magnesio obtenido de Desarrollo de Especialidades Químicas (2mol/L) en una relación 100:25 de acuerdo al procedimiento de Lopes-Virela et al., (1977), las soluciones se prepararon por separado y se mantuvieron en refrigeración a 4°C, cada que se realizó el análisis se preparó la relación 100:25.
3.3.2.3 Colesterol total en hígado
La extracción de lípidos en hígado se llevó a cabo según la técnica del Folch (1957) con algunas modificaciones. El hígado se homogenizó (200mg) en una mezcla de cloroformo/metanol 2:1 (lmL) utilizando un homogenizador (Tissue-Tearor®, BioSpec Products, Inc Bartsville, Okla., EUA.) a una velocidad de 20000 rpm. Posteriormente el extracto se vertió en un tubo de vidrio y se ańadió cloroformo/metanol (lmL), seguido de una solución de cloruro de potasio al 0.88% (400ul). La mezcla se agitó y se dejó reposar 5 minutos, dando como resultado un sistema bifásico, se desecha la fase superior y la fase inferior y se centrifugó por 10 min a 2400 rpm a 4°C. Después de la centrifugación, la fase inferior, la cual contiene los lípidos fue secada en un concentrador centrífugo con vacío Speed Vac® SC250EXP (Termo Electrón Corporation, Milford, MA., E.U.A) el cual se operó a una temperatura de 40°C por un tiempo de 1 hora 15 minutos. El extracto seco se redisolvió en cloroformo/metanol 2:1 (lmL) y se tomaron lOuL de muestra y se continuó de acuerdo al procedimiento de colesterol total en plasma.
3.3.2.4 Condiciones cromatográficas para el análisis de colesterol en plasma e hígado
Las muestras se analizaron utilizando un cromatógrafo de gases Hewlett-Packard 6890 equipado con un detector de ionización de flama que utiliza un software HP ChemStation 6890GC (Agilent Technologies Inc., CA, EUA). La separación cromatográfica fue desarrollada empleando una columna capilar BPX-5 (5% fenil / 95% metil-polisilfenileno) obtenida de SGE Inc. (Austin, Texas EUA.) de 30m x 0.25mm d.i. x 0.25um. El gas portador utilizado fue el helio aplicado a una presión de 20 psi. El volumen de inyección fue de 2uL de muestra con split 1:10. El tiempo total de la corrida fue de 9 minutos con 3 minutos para estabilizar la columna. El programa de temperaturas se detalla en la Tabla 5.
Tabla 5. Programa de temperaturas utilizado para el análisis cromatográfico en plasma e hígado.
Temperatura inicial: 280°C, 1 min.
Rampa: 7.5°C/min, 4 min.
Temperatura final: 310°C,4min.
Detector: 360°C
Inyector: 270°C
La curva de calibración se realizó por triplicado y se muestra en el Anexo A.l y A.2. Para la identificación del colesterol de las muestras analizadas, se realizó mediante la comparación de los tiempos de retención con los estándares comerciales. En el Anexo B.l se muestra un cromatograma del análisis de colesterol en plasma y en el Anexo B.2 se muestra un cromatograma del análisis de colesterol en hígado.
3.3.3 Triglicéridos en plasma
Para la determinación de triglicéridos en plasma se utilizó un método enzimático Marca Randox®, el fundamento de la técnica es la hidrólisis de los triglicéridos mediante la acción enzimática de la lipasa para formar glicerol y ácidos grasos, posteriormente entra en acción la glicerolkinasa para dar glicerol-3 fosfato + ADP, el cual es oxidado mediante la glicero-3-fosfato oxidasa para producir peróxido de hidrógeno. El hidrógeno peróxido, 4-aminofenazano y 4-clorofenol, producen un indicador que es una quinonemina (cromóforo), bajo la acción catalítica de la peroxidasa (Jacobs et al., 1960; Koditschek y Umbreit, 1969; Trinder, 1969).
Se tomó 1 mi. del reactivo y se colocó en un tubo eppendorf de 1.5 m de capacidad y se agregó 10 LII de muestra, se incubó durante 10 minutos a 25°C. Posteriormente, se leyó la absorbancia al cabo de los 60 minutos en un espectrofotómetro (Beckman modelo DU650, Beckman Instruments, Fullerton, CA., EUA) a una longitud de onda de 546nm. Los cálculos se determinaron de acuerdo a lo siguiente:
Concentración\mg /di] = Absorbancia muestra
[image:45.612.189.410.60.134.2]3.3.4 Fosfolípidos en hígado y bilis
[image:46.612.64.439.599.714.2]El ácido sulfúrico, ácido perclórico, glicerina, ácido tricloroacético, molibdato de amonio y el fosfato potásico monobásico utilizados en la preparaciones de las soluciones, fueron obtenidos de Desarrollo de Especialidades Químicas (San Nicolás de los Garza, N.L., México), el Fiske SubbaRow se obtuvo de Sigma-Aldrich Co. (St. Louis MO, E.U.A.) mientras que el pentóxido de vanadio fue obtenido de Fermont-Productos Químicos Monterrey (Monterrey, N.L., México). Para la determinación y cuantificación de fosfolípidos en hígado y bilis se hicieron unas modificaciones del método reportado por Nalto (1975). El extracto lipídico de hígado se redisolvió en cloroformo/metanol 2:1 (lmL). Se colocaron 50 uL de muestra (hígado o bilis) y se ańadió ácido tricloroacético lOOmg/L (1.5 mL) y se dejó reposar por 10 minutos. Posteriormente se centrifugó durante 15 minutos a 3000 rpm y 15°C utilizando una Centrífuga Eppendorf 5804R. Se descartó el sobrenadante y se ańadió agua destilada (2.5 mL) y se recentrifugó a 4000 rpm durante el mismo tiempo a la misma temperatura. Se descartó el sobrenadante y se ańadió la mezcla de digestión (250 uL), se calentó a bańo maría de glicerina durante 15 minutos a 200°C utilizando una plancha magnética con base caliente (Marca Cole-Parmer Instrument Co., EUA). Los tubos se dejaron enfriar a temperatura ambiente. Posteriormente a la muestra se le ańade agua destilada (2ml), molibdato de amonio (0.5ml) y solución Fiske-SubbaRow (0.5 mi). Para preparar el blanco y el estándar se agregaron las soluciones de la mezcla de digestión, agua destilada, molibdato de amonio, estándar fosfórico y la solución de Fiske-SubbaRow con las cantidades descritas en la Tabla 6. Posteriormente el blanco, el estándar y la muestra se calentaron en bańo María (Marca VWR® Internacional West Chester, PA, EUA) durante 10 minutos.
Tabla 6. Soluciones y cantidades utilizadas para la preparación del blanco y el estándar en la determinación de fosfolípidos.
Solución Blanco Estándar
Mezcla de digestión 250 uL 250 uL Agua destilada 2 mL 1.5 mL
Molibdato de
Para su análisis se utilizó un espectrofotómetro (Beckman modelo DU650, Beckman Instruments, Fullerton, CA., EUA) con una longitud de onda máxima de 660nm. Los cálculos se determinaron de acuerdo a lo siguiente:
^ ., r n T-, Absorbancia muestra . _
Concentracion[mmol/L] - * 2500
Absorbancia estándar
Para el resultado en hígado, la cantidad final se divide en 760, que es el peso molecular de la fosfatidilcolina, mayor fosfolípido presente en hígado.
3.3.5 Determinación y cuantificación de esteróles neutrales en heces por cromatografía gaseosa acoplada a un detector de ionización de flama
Para la extracción de esteróles neutrales en heces se hicieron algunas modificaciones de los métodos reportados por Carr et al., (2005), Folch et al., (1957) y Jones et al., (1998). Se tomaron lOOmg. de heces y se acidificaron con ácido clorhídrico 0.5 M (200 uL). Posteriormente se extrajeron los compuestos lipidíeos con cloroformo/metanol 2:1 (5mL), se centrífugo (Centrífuga Eppendorf 5804R) a 3000 rpm durante 5 minutos, se retiró el sobrenadante y se conservó en un tubo de vidrio. Se repite la extracción con cloroformo/metanol. Se le ańade al extracto una solución de cloruro de potasio al 0.88% (2ml), la mezcla se agitó y se dejó reposar 5 minutos, dando como resultado un sistema bifásico, se desecha la fase superior y la fase inferior se llevó a sequedad utilizando un concentrador centrífugo con vacío (Speed Vac® SC250EXP, Termo Savant, Holbrook, NY., EUA) durante 2 horas a 40°C.
El extracto seco se redisolvió en cloroformo/metanol 2:1 (lmL) y se tomaron lOuL de muestra y se continuó de acuerdo al procedimiento de colesterol total en plasma.
3.3.5.1 Condiciones cromatográficas para el análisis de esteróles neutrales en heces
BPX-5 de 30m x 0.25mm d.i. x 0.25um. El gas portador utilizado fue helio aplicado a un presión de 20 psi. El volumen de inyección fue de 2uL de muestra con split 1:10. Debido a que se detectaron áreas diferentes a lo reportado en la literatura, se analizó una muestra en un cromatógrafo de gases acoplado a un detector de masas para corroborar los compuestos de interés y se encontró un compuesto unido al colesterol por lo que se modificó el programa de temperaturas, el cual se detalla en la Tabla 7. El tiempo total de la corrida fue de 15 minutos con 3 minutos para estabilizar la columna.
Tabla 7. Programa de temperaturas utilizado para el análisis cromatográfico en heces.
Temperatura inicial: 240°C, 1 min. Rampa: 7.5°C/min, 4 min. Temperatura final: 300°C, 4 min. Detector: 360°C
Inyector: 270°C
Para la cuantificación de esteróles neutrales se realizaron curvas de calibración con una mezcla de estándares (5a-colestano, colesterol y coprostanol, obtenidos en Sigma-Aldrich Co.) a diferentes concentraciones. La curva de calibración se realizó por triplicado y se muestra en el Anexo A.l, A.3 y A.4. La identificación de esteróles neutrales en las muestras analizadas, se realizó mediante la comparación de los tiempos de retención con los estándares comerciales. En el Anexo B.3 se muestra un cromatograma del análisis de esteróles neutrales en heces.
3.4 Análisis Estadístico de los Datos
4. RESULTADOS Y DISCUSIÓN
4.1 Estudio metabólico preliminar
Los glucosinolatos (GS) per se no son bioactivos hasta que son hidrolizados
enzimáticamente por la mirosinasa. Esto ocurre mediante la liberación de la enzima presente en organelos mediante la ruptura celular debido a procesamiento o por masticación (Fahey y Talalay, 1999). En el estudio preliminar se utilizó extracto rico en glucosinolato, el cual no contuvo mirosinasa, por lo que la conversión a su forma aglicona (sulfurafano) dependió solamente de la capacidad de la microflora intestinal. Los sulfurafanos (SF) que son absorbidos son conjugados con glutatión, se metabolizan a ácidos mercaptúricos y posteriormente se excretan en orina como ditiocarbamatos (DTC) (Shapiro et al, 2006).
La presencia de ditiocarbamatos en la orina reflejan tres cosas: la absorción de sulfurafanos en el organismo, las conversiones metabólicas de la conjugación del sulfurafano con glutatión y la excreción de la dosis consumida.
Como se muestra en la Tabla 8, los hamsters que recibieron 1% de GS en su dieta presentaron menor excreción que los que consumieron 0.1% de GS, 3.8% y 8.6%, respectivamente. Los resultados de los hamsters que recibieron 1% de SF presentaron menor excreción de la dosis consumida (47.4%) que los hamsters que consumieron 0.1% de SF (83.3%). Estos resultados son consistentes a los obtenidos con la dieta de GS, es decir, a mayor dosis menor excreción de DTC y a menor dosis mayor excreción de DTC.
Beheemreddy y Jeffery (2007) administraron 150 umol de glucorafanina / Kg de peso en ratas F344 por vía oral e intraperitoneal (ip). Encontraron por primera vez la presencia de glucorafanina en orina en las ratas que consumieron GS por vía oral o ip, sin embargo fue mayor en la ratas con la dosis ip, lo que sugiere que una fracción de la glucorafanina administrada puede absorberse de manera intacta. Además, la glucorafanina puede regresar hacia el intestino por la circulación enterohepática donde es convertida a sulfurafano por la acción de la microflora intestinal. Otro hallazgo en la investigación de Beheemreddy y Jeffery (2007), fue la conversión de la glucorafanina en su análogo reducido glucoerucina y los productos urinarios encontrados en los tratamientos investigados fueron conjugados de sulfurafano, sulfurafano libre, sulfurafano nitrilo y erucina.
Tabla 8. Excreción urinaria de Ditiocarbamatos en hamsters sometidos a diferentes dosis de extractos ricos en glucosinolatos y sulfurafanos.
Consumo del compuesto
(umol) Excreción de DTC (umol) Dosis Excretada (%) Tipo de
extracto Hembra Macho Total Hembra Macho Total Hembra Macho Total
GS 1 % 124 140 264 2.7 2.3 5 2.2 1.6 3.8
GS 0.1% 6.4 11.2 17.6 0.4 0.3 0.7 5.6 3 8.6
SF 1 % 18.9 14.7 33.6 3.7 4.1 7.8 19.3 28.4 47.4
SF 0.1% 1.3 1.4 2.7 0.5 0.8 1.3 36 47.3 83.3
Abreviaciones: GS: glucosinolato, SF: sulfurafano, H: Hembra, M: Macho, DTC: Ditiocarbamatos
El extracto rico en sulfurafano mostró ser más biodisponible que el extracto rico en glucosinolato, posiblemente debido a la baja conversión vía mirosinasa del glucosinolato a sulfurafano.
4.2 Estudio metabólico " in vivo" de colesterol
Los resultados del estudio metabólico durante el estudio in vivo, se muestran en Tabla 9.