DETECCIÓN DE Batrachochytrium dentrobatidis POR MEDIO DE TÉCNICAS MOLECULARES Y MICROBIOLÓGICAS EN ENSAMBLAJES
DE ANFIBIOS EN LAS LOCALIDADES DE SANTA MARÍA (BOYACÁ), SAMANÁ (CALDAS) Y GUANENTÁ (BOYACÁ)
MARÍA ALEJANDRA RAMÍREZ CASTRO
TRABAJO DE GRADO
Presentado como requisito para optar el título de
Microbióloga Industrial
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
DETECCIÓN DE Batrachochytrium dentrobatidis POR MEDIO DE TÉCNICAS MOLECULARES Y MICROBIOLÓGICAS EN ENSAMBLAJES
DE ANFIBIOS EN LAS LOCALIDADES DE SANTA MARÍA (BOYACÁ), SAMANÁ (CALDAS) Y GUANENTÁ (BOYACÁ)
MARÍA ALEJANDRA RAMÍREZ CASTRO
APROBADO
____________________________ ___________________________ Luis Daniel Prada Salcedo Marcela Franco Correa Ph.D Director Coodirectora
_________________________ ________________________
DETECCIÓN DE Batrachochytrium dentrobatidis POR MEDIO DE TÉCNICAS MOLECULARES Y MICROBIOLÓGICAS EN ENSAMBLAJES
DE ANFIBIOS EN LOS MUNICIPIOS DE SANTA MARÍA (BOYACÁ), SAMANA (CAQUETÁ) Y GUANENTA (BOYACÁ)
MARÍA ALEJANDRA RAMÍREZ CASTRO
APROBADO
NOTA DE ADVERTENCIA
Artículo 23 de la resolución N° 13 de Julio de 1946
TABLA DE CONTENIDO
RESUMEN………...6
1. INTRODUCCIÓN………..7
2. PLANTEAMIENTO DEL PROBLEMA Y JUSTIFICACIÓN………9
3. MARCO TEÓRICO 3.1 Batrachochytrium dendrobatidis………11
3.2 Quitridiomicosis………12
3.3 Sitios de muestreos……….12
3.4 Batrachochytrium dendrobatidis in vitro……….13
3.5 PCR en tiempo real como una herramienta para la detección de Batrachochytrium dendrobatidis………..14
4. OBJETIVOS 4.1 Objetivo General………16
4.2 Objetivos Específicos………16
5. METODOLOGÍA 5.1 Recolección de las muestras y procesamiento microbiológico………..17
5.2 Extracción de ADN………18
5.3 PCR en tiempo real………...18
6. RESULTADOS 6.1 Aislamiento de Batrachochytrium dentrobatidis y descripción de flora acompañante……….19
6.2 PCR en tiempo real………...25
7. CONCLUSIONES Y RECOMENDACIONES………30
RESUMEN
La quitridiomicosis es una enfermedad que está afectando gran parte de las poblaciones de anfibios a nivel mundial, estos declives son atribuidos a Batrachochytrium dentrobatidis (Bd), hongo perteneciente al filum Chytridiomycota que es identificado como el agente causal de la muerte de anfibios. Para la detección de Batrachochytrium dentrobatidis se utilizó PCR en tiempo real, el cuál es considerado el método más específico y sensible, así como el menos invasivo para los anfibios, De un total de 48 muestras recolectadas de Santa María (Boyacá), Samaná (Caldas) y Guanenta (Boyacá-Santander) todas fueron analizadas por PCR en tiempo real y siembra en medio sintético.
Paralelamente se realizó la identificación de la población microbiológica acompañante que tiene la capacidad de desarrollarse bajo las mismas condiciones nutricionales que Bd, a partir de esta siembra se aisló a Pseudomonas aeruginosa, Enterobacter cloacae y Rhodotorula rubra como habitantes comunes relacionados con la muestra obtenida del anfibio.
1. INTRODUCCIÓN
Actualmente se han incrementado alarmas por el declive y extinción de ranas en diferentes partes del mundo. Los declives han sido atribuidos a Batrachochytrium dentrobatidis (Bd),hongo perteneciente al filum Chytridiomycota, identificado como el agente causal de la muerte de los anfibios.
El papel de los anfibios como especies bioindicadoras, les permite demostrar el estado de conservación del medio donde viven, en numerosos hábitats los anfibios son el principal motor en la transformación de energía y nutrientes acumulados en los insectos, la transferencia energética de los anfibios es altamente eficiente gracias a que necesitan de poca energía para vivir, son de sangre fría, por lo que el calor que usan para mantener sus procesos fisiológicos proviene de fuentes externas de energía, como el sol. Para vivir requieren de temperaturas más bajas que las especies de sangre caliente, y por lo mismo actúan como reservorio energético dentro de los ecosistemas (Suazo y Alvarado, 2006). Adicionalmente, los anfibios son fundamentales para los ecosistemas porque controlan plagas como insectos y se consideran fuente de alimento para animales en el agua y en el suelo. Son indicadores ambientales, debido a que su piel es sensible frente a contaminantes y lluvia ácida adicionalmente, se usa con frecuencia en agricultura y en investigación médica (Rice et al., 2009).
La quitridiomicosis es una enfermedad que se está extendiendo rápidamente por todo el planeta (Berger et al., 1998; Longore et al., 1999), siendo por primera vez reportada en U.S.A en los años 1960s, en Australia 1970s, en Centro América y Sur América 1980s y finalmente en Europa en el año 1990 (Drew et al., 2006), los hongos de esta familia se dispersan en el agua mediante zoosporas y logran alcanzar la epidermis queratinizada de anfibios y las partes bucales de larvas de anuros, donde se desarrollan generando los esporangios (Rodríguez, 2004).
2. JUSTIFICACIÓN Y PLANTEAMIENTO DEL PROBLEMA
Colombia es un país con diversidad de anfibios, alberga cerca del 10% de todas las especies de animales y vegetales terrestres del mundo. Este país se caracteriza por una gran variedad de hábitats como páramos, bosques, valles, selvas húmedas, desiertos entre otros clasificándola como uno de los países con mayor biodiversidad del planeta (Ruiz & Rueda-Almonacid, 2008).
3. MARCO TEÓRICO
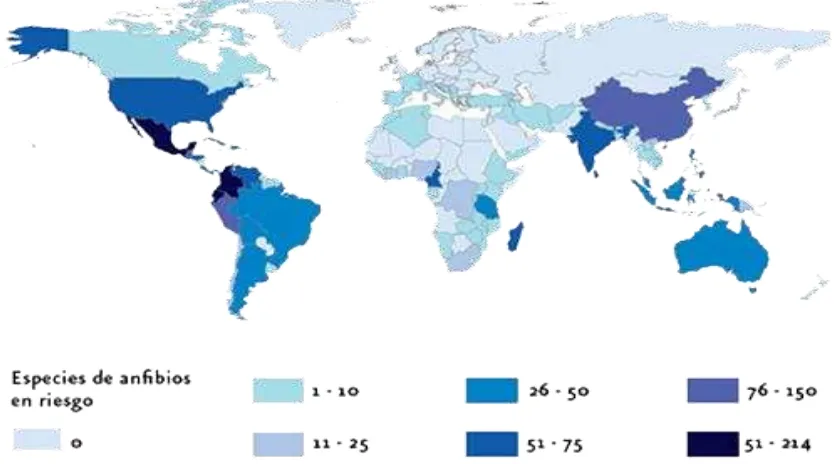
[image:10.612.100.517.404.636.2]En los últimos años, la pérdida de diversidad de anfibios es un patrón que se ha incrementando de forma generalizada (Velásquez et al., 2008), patógenos, incluyendo virus y hongos son los causantes del declive alrededor de mundo. Batrachochytrium dendrobatidis es el agente etiológico responsable de la muerte de poblaciones de anfibios. Los episodios de declives son causados por contaminación y destrucción del hábitat, y fue en la década de los 80´s cuando se constataron los primeros casos de declive en áreas bien conservadas como espacios protegidos. Los dos casos más conocidos a nivel mundial fueron sin duda el caso del sapo dorado de Costa Rica (Bufo periglenes), (Crump et al., 1992) y la rana incubadora gástrica australiana (Rheobatrachus silus) (Pounds et al., 1997). A partir de esos dos casos, la lista de poblaciones extinguidas en todo el mundo fue aumentando y se comenzaron a generar alertas, en las zonas tropicales de Centroamérica (Young et al., 2001) y Australia (Laurance et al., 1996), donde el ambiente templado es propicio para la diseminación de Batrachochytrium dendrobatidis (Tejedo, 2003) (Figura 1).
3.1 Batrachochytrium dendrobatidis
Batrachochytrium dendrobatidis es un hongo parásito de anfibios, que posee zoosporas esféricas, en algunas ocasiones se pueden encontrar de forma alargada, miden aproximadamente 3 – 5 µm de diámetro. Después del periodo de motilidad y dispersión la zoospora se enquista y el flagelo es reabsorbido, haciendo parte de la pared (estado enquistado) (Berger et al., 2005), los rizoides comienzan a crecer, convirtiéndose en zoosporangios jóvenes, cuando los talos crecen el citoplasma se vuelve multinucleado por divisiones mitóticas transformándose en un zoosporangio maduro. Esta estructura no descarga zoosporas si el ambiente está demasiado seco, si no cuando las condiciones de humedad sean altas e induzcan la descarga (Berger et al., 2005).
CLASIFICACIÓN TAXONÓMICA
REINO Fungi
DIVISIÓN Chytridiomycota
CLASE Chytridiomycetes
ORDEN Rhizophydiales
GÉNERO Batrachochytrium
ESPECIE Batrachochytrium dendrobatidis
Fuente: Alexopoulos, 1979
3.2 Quitridiomicosis
La piel de los anfibios es permeable al agua, presentando capilares tanto en la epidermis como en la dermis lo que le ha permitido especializarse como superficie respiratoria, osmoreguladora y en menor medida termorreguladora, haciéndola susceptible a la contaminación ambiental, exposición prolongada a la luz solar e infecciones cutáneas (Johnson y Speare, 2005).
La quitriomicosis es una enfermedad asociada al declive de anfibios, que interviene directamente sobre la piel. El hongo actúa sobre la epidermis, fijándose y creando zoosporangios inoperculados que producen nuevas zoosporas, sin embargo la infección no se produce por la liberación de zoosporas al medio, sino por la penetración del talo, causando la muerte por asfixia; además, el hongo libera sustancias tóxicas que son absorbidas a través de la piel y que afectan el intercambio gaseoso, provocando hiperplasia en los estados córneos y granulosos de la epidermis (Boyle et al., 2004).
Batrachochytrium dendrobatidis únicamente afecta zonas de la piel donde está presente la queratina, por lo que los renacuajos solamente son infectados en la zona bucal, el periodo de incubación de la enfermedad puede estar entre los 9 y 76 días, es posible observar oscurecimiento o aparición de manchas en la parte superior del cuerpo, color rojizo e inflamación en la zona ventral debajo de la región pélvica y en los dedos, y a su vez falta de movimiento de las patas traseras (Boyle et al., 2004).
3.3 Sitios de muestreos
Si bien, son aerobios obligados, algunas especies son anaerobios facultativos y pueden tolerar bajas concentraciones de oxígeno y niveles elevados de dióxido de carbono sin que estén en contacto con el agua (Hall, 1996).
Estudios posteriores han demostrado que Batrachochytrium dendrobatidis prevalece en los bosques mayoritariamente en zonas subtropicales, en hábitats como pastos, riachuelos o en bosques secundarios con una abundancia de especies de plantas exóticas, además de paisaje urbano (Burrowes et al., 2004) quebradas y en reservas naturales, a una temperatura aproximada de 20°C -25°C (Puschendorf et al., 2006).
3.4 Batrachochytrium dendrobatidis in vitro
Bajo condiciones de laboratorio, se utilizan medios líquidos o sólidos con bajo potencial osmótico aproximadamente a un pH neutro, en presencia de oxígeno y en cuarto de temperatura constante para su crecimiento (Gleason et al., 2007)
Batrachochytrium dendrobatidis produce proteasas extracelulares que degradan la caseína y la gelatina (Piotrowski et al., 2004), por lo tanto la triptona, gelatina hidrolizada, glucosa y lactosa son evaluados para el crecimiento del hongo, siendo componentes similares a la piel del anfibio, por lo tanto, TGhL (16 g triptona, 4 g gelatina hidrolizada, 2 g lactosa, 15 g agar en 1000ml de agua destilada) (Boyle et al 2004) fue seleccionado como un medio de cultivo óptimo para la conservación de especies de quitridios debido a que su composición reproduce las características nutricionales semejantes a las generadas por su hospedero natural (Berger et al., (b) 2005).
El pH y la cantidad de carbohidratos en las diferentes fuentes de nitrógeno pueden tener efecto en el crecimiento de Batrachochytrium dendrobatidis, la gelatina hidrolizada (pH 5.7) y el extracto de malta (pH 5.6), poseen un pH bajo para el crecimiento óptimo, el alto contenido de azúcar del extracto de malta comparado con la triptona, genera un crecimiento escaso. Batrachochytrium dentrobatidis no requiere de otros tipos de azúcares, sólo con el suministro de la triptona se revela un alto crecimiento (Piotrowski el al., 2004).
Sobre el medio de cultivo TGhL, Batrachochytrium dendrobatidis, presentan crecimiento granular, en racimos y con apariencia cremosa, las zoosporas presentan una película en la superficie alrededor de cada colonia en forma aislada, el talo crecen en agrupaciones, y los rizoides aparecen distribuidos en la superficie uniéndose con otros rizoides de esporangios. (Berger et al., (b)2005)
3.5 PCR en tiempo real como una herramienta para la detección de Batrachochytrium dendrobatidis
Desde el descubrimiento y la descripción de Batrachochytrium dendrobatidis como agente del declive de anfibios, la investigación se ha centrado en la incorporación de nuevas técnicas de diagnóstico para el diagnóstico de la enfermedad en anfibios (Berger et al., 2002, Annis et al., 2004, Olsen et al., 2004, Hyatt et al., 2007).
El uso de métodos histológicos, que en muchas ocasiones no son eficientes para detectar a Batrachochytrium dendrobatidis cuando la infección en la piel se encuentra en la fase de inicio, posee una baja sensibilidad para la detección del hongo (Boyle et al., 2004), produciendo falsos negativos en los resultados (Puschendorf et al., 2006)
aún, cuando en pruebas histológicas o el uso de PCR convencional se generen sólo resultados de ausencia o presencia.
La PCR permite detectar en tiempo real la amplificación de la región de interés, utilizando un par de oligonucleótidos llamados primers o cebadores, cada uno hibridiza en sentido 5´a 3´dependiendo de la hebra de la doble cadena de DNA. Cada uno de los primers hibridados es el punto de partida para la producción de cadenas de DNA complementaria a través de la secuencia de los deoxinucleótidos utilizando la DNA polimerasa. Para llevar a cabo esta detección existen varios métodos basados en la utilización de otro fragmento de ADN (sonda) complementario a una parte intermedia del ADN que se quiere amplificar. Esta sonda lleva adherida una molécula, de tal forma que sólo cuando la sonda se desplaza de su sitio por acción de la ADN polimerasa la molécula emite fluorescencia, la cuantificación de la fluorescencia emitida durante cada ciclo de la PCR será proporcional a la cantidad de ADN que se está amplificando (Mackay et al., 2007), este es el mecanismo de acción de la sonda Taqman implementada para este diagnóstico, siendo el mecanismo que proporcionará la fluorescencia.
4. OBJETIVOS
4.1 OBJETIVO GENERAL
Detección de Batrachochytrium dendrobatidis por medio de técnicas moleculares y microbiológicas en anfibios de tres localidades de Colombia.
4.2 OBJETIVOS ESPECIFICOS
Establecer la metodología de muestreo para la detección de B. dendrobatidis.
Aislar en medios sintéticos B. dendrobatidis e identificar la población microbiológica acompañante.
5. METODOLOGÍA
5.1 Recolección de las muestras y procesamiento microbiológico
Los municipios en los cuales se obtuvieron las muestras para realizar detección en PCR en tiempo real y el análisis microbiológico fueron: Santa María (Boyacá) con una temperatura promedio de 23°C, Samaná (Caldas) con temperatura promedio de 19 °C y Guanentá (Boyacá-Santander) es una reserva natural denominada “Santuario de Fauna y Flora Guanentá Alto Río Fonce” el cual abarca los municipios de Encino, Charalá y Gámbita con una temperatura promedio de 13°C.
La recolección de las muestras se realizó a anfibios previamente capturados, tomando frotis con hisopos de algodón al parche ventral y de la parte dorsal, pasándolos 20 a 30 veces. Los hisopos se introdujeron en tupos eppendorf que contenían 300 µl de etanol al 70% y tubos con medio TGhL líquido y sólido para el transporte de las muestras, a fin de realizar la detección molecular y siembra en medio de cultivo sintético.
Se realizaron siembras masivas en medio de cultivo TGhL sólido con adición de sulfato de estreptomicina y peniclina G a una concentración de 25 mg/ml llevándolo a una temperatura de incubación de 22°C, para la determinación de colonias sospechosas, se realizó una observación diaria, evaluando el crecimiento de Bd. Paralelamente se realizó la identificación de la población microbiológica acompañante en el punto de muestreo, que tiene la capacidad de desarrollarse bajo las mismas condiciones nutricionales que el hongo quitridio, y adicionalmente resistir los antibióticos que se le añaden al medio (Johnson et al., 2005).
5.2 Extracción de ADN
Para la extracción del ADN, se tomaron los tubos eppendorf de 1,5 mL que contenían hisopos estériles embebidos en etanol al 70%. Una vez tomadas las muestras y transportadas al laboratorio en frio (4°C), se procedió a evaporar el etanol a temperatura ambiente durante 30 a 48 horas, ubicando los eppendorf en cabina de extracción. Cuando el etanol se evaporó totalmente se adicionó 50 µL de solución PrepMan (Applied Biosystems®) directamente al hisopo, posteriormente se centrifugó a 13000 rpm durante 30 seg, inmediatamente se introdujeron los eppendorf en un baño termostatado a 100°C por 10 minutos y a continuación, se realizó un choque térmico a 4°C durante 2 minutos introduciendo los tubos en hielo, en seguida se centrifugó a 13000 rpm por 3 minutos. Finalmente los hisopos fueron separados del contenido líquido con pinzas estériles. Las muestras se almacenaron a -20°C (Boyle et al., 2004; Hyatt et al., 2007).
5.3 PCR en tiempo real
Se determina la presencia de Batrachochytrium dendrobatidis aplicando la técnica PCR en Tiempo Real, utilizando el equipo LightCycler 1.5 System Roche®. Se preparó un volumen final para cada reacción de 20µL, de los cuales 9 µL fueron de Agua para PCR, 2µL de solución previamente preparada de Primers (9µM) y Sonda (6µM), 4µL de solución Master Mix Roche® y 5µL de DNA. Luego de servidos los 20µL para cada capilar, éstos fueron sellados y mezclados homogéneamente. Los capilares fueron transferidos al Light Cycler Instrument, en el cual se especificaron las siguientes condiciones, un ciclo de preincubación a 95°C durante 10 min, cincuenta ciclos de: Denaturación 95°C durante 15 seg, Anillaje 60°C durante 1 min, extensión 72°C durante 2 seg y un último ciclo de enfriamiento a 4ºC durante 30 seg. La lectura se realizó en la fase de extensión a una longitud de onda de 530nm.
Se utilizó agua de PCR como control negativo y diferentes diluciones (10-1, 10-2y 10-3) de un standard de ADN de Batrachochytrium dendrobatidis como controles
6. RESULTADOS Y DISCUSIÓN
6.1 Aislamiento de Batrachochytrium dentrobatidis y descripción de flora acompañante
La metodología utilizada permitió realizar la captura de anfibios en su hábitat natural, a fin de efectuar los frotis y su posterior análisis de laboratorio. El mayor desafío a la hora de aislar y cultivar Batrachochytrium dentrobatidis es la contaminación de bacterias y hongos presentes a nivel medioambiental en el momento del muestreo. Es necesario el uso de guantes para evitar la contaminación cruzada entre especímenes y no descartar que los microorganismos presentes en el frotis no sólo estén asociados al anfibio sino al ambiente que los rodea. En estudios anteriores, la recolección de los frotis se realizaba por medio de cortes histológicos en dedos y en otras partes del cuerpo; Hyatt et al., (2007) describe y realiza una comparación entre el uso de hisopos y cortes histológicos y otras técnicas, llegando a la conclusión que los hisopos remueven residuos de piel que puede contener zoosporangios y zoosporas, por lo tanto resulta ser menos invasivo para el anfibio, en la fase de muestreo, se confirmó que este método resultó ser práctico y eficiente abarcando toda la superficie del anfibio.
Para evitar la contaminación presente en el lugar del análisis in vitro, se sugiere utilizar un ambiente estéril, idealmente en cámara de flujo laminar con materiales estériles, debido a que el periodo de crecimiento de Bd es prolongado es factible que, la contaminación impida el aislamiento del hongo.
Los anfibios viven expuestos a una serie de microorganismos y por las características de su piel son afectados por patógenos, Luke, (2006) reporta que las bacterias Gram negativas son más comunes que las bacterias Gram positivas. Con mucha frecuencia se han aislado Pseudomonas aeruginosa, Aeromonas hydrophilia, Providencia rettgeri, Morganella morganii, Salmonella arizonae y Klebsiella oxytoca, de reptiles cautivos sanos y enfermos; estas bacterias han llegado a ser invasoras cuando las condiciones alteran la resistencia de los huéspedes o favorecen el crecimiento de microorganismos patógenos.
estreptomicina, para el aislamiento del hongo. Una vez el medio fue incubado, se presentaron una gran cantidad de microorganismos (Bacterias y Levaduras), por lo tanto se realizó la descripción microscópica y macroscópica de estos microorganismos. De las 48 muestras predominaron dos (2) bacterias Gram negativas y una (1) levadura. Los microorganismos más comunes encontrados a partir de las muestras en anfibios fueron Pseudomonas aeruginosa, Enterobacter cloacae y Rhodotorula rubra, siendo estos microorganismos invasores cuando las condiciones del hábitat alteran la resistencia de los huéspedes y favorecen su crecimiento (Aguillón et al., 2007).
Basándose en la evaluación de la coloración de Gram y después de realizar la caracterización bioquímica con BBL CRYSTAL™, se obtuvo porcentajes de coincidencia del 99% y 97,57% para Pseudomonas aeruginosa y Enterobacter cloacae respectivamente en el total de las muestras analizadas, el resultado anterior demuestra una concordancia con Martínez et al., (2003) quienes identificaron bacterias Gram negativas de la familia Pseudomonaceae y Enterobacteriacea. A parte de las bacterias y levadura encontrada se estima que existe la presencia de otros microorganismos en las muestras, sin embargo la adición de antibióticos al medio limita el crecimiento de otros tipos de microorganismos entre ellos a los Gram positivos, grupo reportado por Culp et al., (2007).
Por medio de la metodología utilizada, no se puede asegurar que la descripción de la flora acompañante sea huésped exclusiva de los anfibios muestreados, debido a que los géneros hallados son residentes naturales de diversos ambientes, para obtener resultados más fiables, se recomiendan realizar una serie de prelavados con el fin de eliminar microorganismos que pertenezcan al ambiente y que no estén asociados con la epidermis del anfibio (Culp et al., 2007).
En cuanto a los dos géneros encontrados se tiene que Pseudomonas aeruginosa es un habitante normal en el agua, y pueden llegar a multiplicarse y colonizar el suelo. (DeLuca et al., 1998), por otra parte Enterobacter cloacae es una bacteria anaerobia facultativa que se encuentra presente en los mismos ambientes.
Figura 1. Microscopía de Pseudomonas aeruginosa
Figura.2 Identificación Bioquímica de Pseudomonas aeruginosa por medio de BBL CRYSTAL™. Lectura realiza a las 24 h.
[image:21.612.84.544.304.459.2]Figura. 3 Microscopía de Enterobacter cloacae
Figura.4 Identificación Bioquímica de Enterobacter cloacae por medio de
BBL CRYSTAL™. Lectura realiza a las 24 h
Rhodotorula rubra presenta colonias cremosas redondas rosadas con la presencia de pigmentos que le confieren el color, y microscópicamente se observan colonias ovoides (Figura 5).
[image:22.612.86.543.308.461.2]la radiación ultravioleta (Libkind, 2003), la síntesis de pigmentos absorbe la radiación ultravioleta, esta cualidad podrían representar una presión selectiva a favor del desarrollo de estrategias de fotoprotección, entre ellos la producción de pigmentos, este mecanismo usado por la levadura puede sugerir una forma de cooperación entre los dos organismos, debido a que los mismos pigmentos producidos por la levadura pueden llegar también a proteger al anfibio frente a la radiación ultravioleta.
Figura 5. Microscopía de Rhodotorula rubra
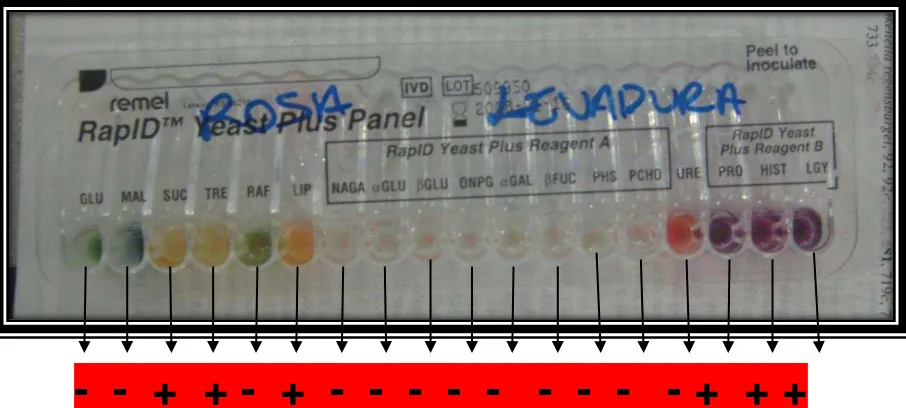
Adicionalmente se realizó la identificación con RapID para levaduras arrojando los siguientes resultados (figura 6).
- - + + - + - - - - - - - + + +
[image:23.612.88.541.450.654.2]Los anfibios viven expuestos a una serie de microorganismos y por las características de su piel resultan muy fácilmente afectados, por eso generan secreciones glandulares que actúan como barrera antimicrobiana. Se ha estudiado que las secreciones de los anfibios son capaces de inhibir el crecimiento de bacterias como Bacillus auerus, y Pseudomonas, además de la actividad antimicrobiana podrían tener actividad antiviral y antitumoral y (Navas, 2008), siendo una posible causa de no poder realizar el aislamiento de Batrachochytrium dendrobatidis en agar TGhL, además puede existir una diferencia en las condiciones entre la rana y el hongo, por ejemplo, los factores abióticos como la temperatura (Pounds et al., 2006; Kriger & Hero 2007a; Lips et al., 2006; Woodhams et al., 2007), la elevación (Brem y Lips, 2008), el medio ambiente, contaminantes (Parris & Baud 2004; Davidson et al., 2007, Rohr et al., 2008) e interacciones bióticas, tales como la competencia y la depredación (Parris & Baud, 2004) condiciones que pueden influir en la interacción anuro-hongo permitiendo o no el desarrollo de la enfermedad.
Batrachochytrium dendrobatidis puede ser inhibido por péptidos antimicrobianos presentes en algunas especies de anfibios y salamandras, por lo cual se puede pensar que los microorganismos acompañantes de la piel producen antimicrobianos motivo por el cual juegan un papel importante en la determinación de la susceptibilidad de los anfibios ante la quitridiomicosis (Rollins & Smith et al., 2002).
Un aspecto de la flora cutánea de anuros resistentes a la infección es que puede ser transmitida de un individuo a otro. Se puede inferir que in vitro o in vivo los anfibios transmiten la flora cutánea beneficiosa entre sí durante las actividades como el apareamiento, o al congregarse en terrarios. Una flora que inhibe a B. dendrobatidis puede ayudar a otras poblaciones de anfibios que a su vez son afectadas por distintos factores de estrés como presencia de pesticidas, condiciones secas y alta densidad poblacional, contribuyendo a disminuir los efectos letales de la quitridiomicosis. (Harris et al., 2006).
6.2 PCR en tiempo real
Según los resultados obtenidos de la PCR (tabla1) en tiempo real a partir de las muestras de Santa María se produjo un resultado positivo de las 26 muestras que se evaluaron. Para todas las corridas en PCR se utilizaron diferentes estándares, un estándar está definido como una unidad de patrón de concentración conocida en nuestro caso de ADN y un blanco (Agua de PCR) como referencia.
Área evaluada Muestras obtenidas Positivos para PCR
Santa María 26 1
Guanentá 14 0
Samaná 8 0
[image:25.612.83.541.228.330.2]Total muestras 48 1
Tabla 1.Total de áreas evaluadas y muestras obtenidas
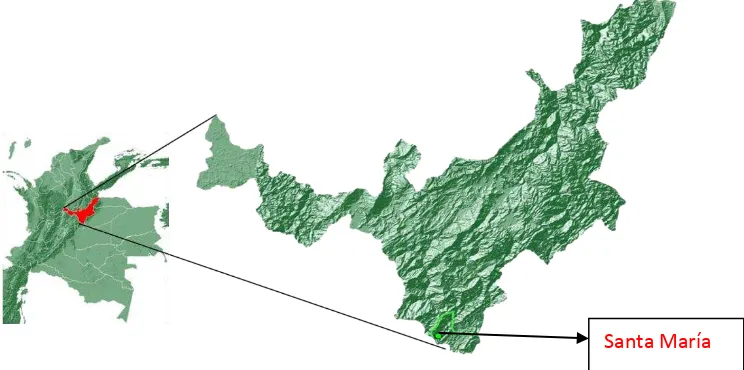
Santa María es un municipio situado en el sureste de la Provincia de Neira, en el Departamento de Boyacá, Colombia, tiene una temperatura de 24°C, latitud 4°51'N, longitud 73° 16'O y altitud de 850 m( figura 7), se ilustra la localización de Santa María, siendo el municipio con un resultado positivo para Batrachochytrium dentrobatidis.
Figura 7. Ubicación Geográfica de Santa María- Boyacá Mapas Andrés Acosta
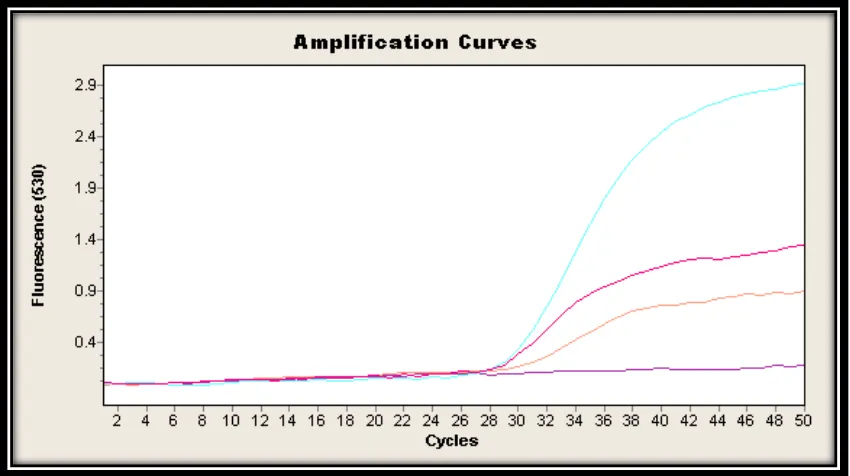
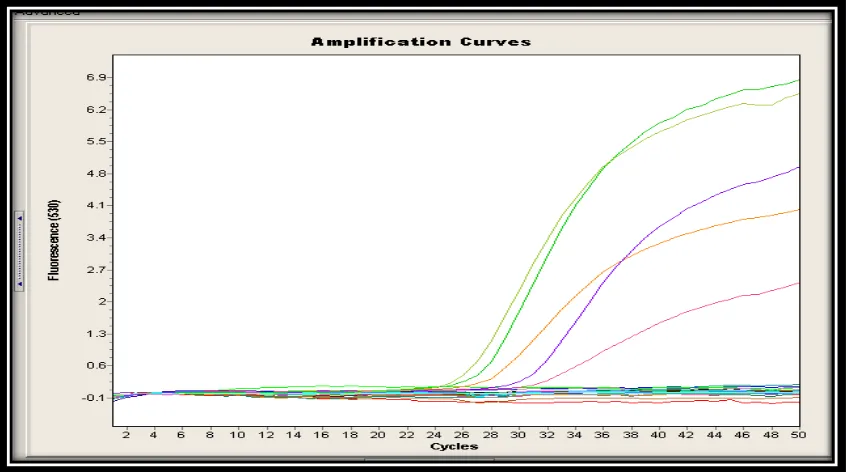
[image:25.612.134.506.454.639.2]Figura 8. Gráfico de amplificación (qPCR) realizados en Santa María. Las curvas exponenciales muestran resultados positivos, Muestra S17, Estándar 100 Estándar 10 Blanco. El resto de líneas indican que no hubo
amplificación, luego se consideran negativos.
De un total de 48 muestras a las cuales se les realizó PCR en tiempo real, tan sólo una reportó un resultado positivo (figura. 8), cuando se empleó esta misma muestra para realizar el aislamiento de Bd no se observó el crecimiento del hongo en medio líquido ni sólido, este resultado sugiere que el hongo no era viable, estaba muerto, inhibido por otros factores o no se generaron las condiciones nutricionales y medioambientales óptimas para su desarrollo.
Figura 9.Leptodactylus colombiensis S17= MUJ 7184, positiva para Batrachochytrium dendobatidis, Santa María (Boyacá)
[image:27.612.149.465.89.232.2]Además de las muestras anteriores, se evaluaron 22 muestras de las cuales 14 provienen de Guanenta y 8 de Samaná y como referencia se utilizaron: un estándar 10, dos estándar 100 dos estándar 1000 y dos blancos, la detección por medio de esta técnica arrojó resultados negativos (figura 10).
[image:27.612.95.519.387.623.2]La PCR en tiempo real, es una herramienta que ayuda a la detección de Batrachochytrium dentrobatidis, constituyéndose en un método menos invasivo y más sensible que la PCR convencional, debido a que los especímenes no son maltratados por la mutilación de alguno de los dedos de los pies y que solo identifica el ADN del microorganismo de interés en medio de la gran abundancia de organismos presentes en la muestra. En muchos casos, por ejemplo cuando un gran número de zoosporas son detectadas por qPCR, no logran ser detectadas por métodos microbiológicos por lo tanto permiten hablar en términos de cantidad de zoosporas de B. dendrobatidis detectadas, y no solo de presencia o ausencia del patógeno (Boyle et al., 2004)
Con respecto a las muestras que presentan resultados negativos (figura 10), se concluye que no existe evidencia de la presencia de Batrachochytrium dentrobatidis, sin embrago es posible que la técnica arroje resultados falsos negativos. Porque aún cuando es la técnica de referencia para el diagnóstico existen factores que la afectan. Según Boyle et al., (2004), el uso de los hisopos pueden generar una mayor contaminación que genera problemas en el ADN del hongo, dando lugar a falsos negativos. Para Ruiz y Rueda-Almonacid (2008) el tiempo y la temperatura de transporte de la muestra en muchas ocasiones puede no ser el adecuado influyendo en la no amplificación, lo que sugiere que la degradación del ADN puede tener lugar en el transporte de las muestras hasta el laboratorio. Finalmente en algunos casos las concentraciones de material genético serían muy bajas arrojando resultados negativos, por lo tanto no se descarta la presencia del hongo en su totalidad.
Beebee, (1995) demostró que el aumento de los brotes de la quitridiomicosis se debe al cambio de temperatura en el transcurso del año, evaluando la presencia de Batrachochytrium dentrobatidis en las poblaciones de anfibios, en diferentes estaciones. Para Blaustein y Dobson (2006), las temperaturas en muchas zonas montañosas de los trópicos americanos se están convirtiendo en el óptimo para el crecimiento Bd, motivo por el cual la geografía física Colombiana es adecuada para la diseminación del hongo, por consiguiente la época del año en la cual se realice el muestreo se verá relacionada con las concentraciones de material genético obtenidas a partir del anfibio.
virulencia, hechos que pueden estar asociados con el medio ambiente y los diferentes tipos de anfibios (Lips et al,. 2005). Existe la posibilidad de que haya hospederos diferente a los anfibios, como cangrejos, peces y aves, facilitando las investigaciones para determinar las formas en que la hongo persiste en las zonas donde los anfibios han desaparecido, y la manera en que puede ser transportado a otras poblaciones (Lips et al., 2005), los parámetros anteriormente mencionados pueden ser evaluados y cuantificados mediante la técnica de PCR en tiempo real, además del uso de metodologías convencionales como análisis microbiológicos y conocimientos de la biología de los anfibios.
7. CONCLUSIONES Y RECOMENDACIONES
La estrategia de utilizar PRC en tiempo real permitió detectar la presencia de B. dendrobatidis, teniendo en cuenta criterios como ser menos invasivo para los anfibios, más específico y sensible permitiendo el diagnóstico, sin embrago no se logró aislarlo por métodos microbiológicos en siembras en agar TGhL.
La población microbiológica acompañante se logró identificar con el uso de métodos rápidos y confiables, Pseudomonas aureginosa, Enterobacter cloacae y Rhodotorula rubra son poblaciones acompañantes, siendo huesped normales de la piel y del ambiente, además de ésto pueden llegar a interactuar de diversas formas con el anfibio.
8. BIBLIOGRAFIA
Acosta A, Rueda-Almonacid JV, Velásquez A, Sánchez S, Peña J (2006) Descubrimiento de una nueva especie de Atelopus (Bufonidae) para Colombia: ¿una luz de esperanza o el ocaso de los sapos arlequines? Revista de la academia Colombiana de Ciencias Exactas, Físicas Y Naturales 30: 279-190.
Alexopoulos (1979) Clasificación taxonómica de Batrachochytrium
dentrobatidis.
Annis SL, Dastoor FP, Ziel H, Daszak P, Longcore JE (2004) A DNA -based assay identifies Batrachochytrium dendrobatidis in amphibians. Journal of Wildlife Diseases, 40(3):420–428
Aguillón DR, Lazcano D, Ramírez R, Aguirre A, Zárate J, Won A (2007) Bacterias cloacales y evaluación física de la herpetofauna del Parque Ecológico Chipinque, Ciencia UANL. Universidad Autónoma de Nuevo León, México. Volúmen X año 002 168-174.
Barry T, Colleran G, Glennon M, Dunican LK, Gannon F (1991) The 16s/23s ribosomal spacer region as a target for DNA probes to identify eubacteria. PCR Methods Appl 1:51–56
Beebee, TJC. (1995). Amphibian Breeding and Climate. Nature 374:219-220.
Berger L, Speare R, Daszak P, Green DE, Cunningham AA, Goggin CL, Slocombe R, Ragan MA, Hyatt AD, McDonald K R, Hines HB, Lips K R, Marantelli G, Parkes, H (1998) Chytridiomycosis causes amphibian mortality associated with population declines in the rainforests of Australia and Central America. Proc Natl Acad Sci, 95: 9031-9036.
Berger L, Hyatt AD, Olsen V, Hengstberger SG, Boyle D, Marantelli G, Humphreys K, Longcore JE. (2002)Production of polyclonal antibodies to Batrachochytrium dendrobatidis and their use in an immunoperoxidase test for chytridiomycosis in amphibians. Dis Aquat Org 48(3):213-220.
Berger L, Hyatt, AD, Speare R, Longore JE (2005) (a) Life Cycle of the amphibian chytrid Batrachochytrium dendrobatidis Dis Aquat Org 68: 51-63. Berger L, Marantelli G, Skerratt LF, Speare R (2005)(b) Virulence of the amphibian chytrid fungus Batrachochytrium dendrobatidis varies with the strain. Dis Aquat Org 68: 47–50.
Blaustein AR, Dobson A. (2006) A message from the frogs. Nature 439:143-144.
Bosch, J (2008) Nuevas amenazas para los anfibios: enfermedades emergentes
Boyle DG, Boyle Db, Olsen V, Morgan JAT, Hyatt AD (2004) Rapid quantitative detection of chytridiomycosis (Batrachochytrium dendrobatidis)
in amphibian samples using real-time Taqman PCR assay. Dis Aquat Org 60: 141-148.
Brem FM, Lips KR (2008) Batrachochytrium dendrobatidis infection patterns among Panamanian amphibian species, habitats and elevations during epizootic and enzootic. Dis Aquat Org 81:189–202
Burrowes, PA, Joglar RL, Green DE (2004) Potential causes for amphibian declines in Puerto Rico. Herpetologica 60(2):141-154.
Burton TM, y Likens GE (1975) Salamander populations and biomass in the Hubbard Brook Experimental Forest, New Hampshire. Copeia 541-546. Cadavid JG, Román C, Gómez A (2005) Composición y estructura de
anfibios anuros en el transecto altitudinal de los Andes Centrales de Colombia. Revista del museo Argentino de Ciencias Naturales 7 (2) 103-108. Buenos Aires, Argentina.
Castro F, Vargas F (2008) Anfibios y Reptiles en el departamento del Valle del Cauca, Colombia. Biota Colombiana 9 (2): 251-277.
Culp CE, Falkinham III JO, Belden LS (2007) Identification of the Natural Bacteria Microflora on the Skin of Easter Newts, Bullfrog Tadpoles and Redback Salamander. Herpetologica 63 (1): 66-71
Crump ML, Hensley F y Clark K (1992) Apparent declines of the Golden toad: underground or extinct? Copeia, 1992: 413-420.
Parris MJ y Beaudoin JG (2004) Chytridiomycosis impacts predatorprey interactions in larval amphibian communities. Oecologia 140, 626–632. Cornelius TO, Parris MJ (2004) Fungal pathogen causes competitive and
developmental stress in larval amphibian communities. Ecology: Vol. 85, No. 12, pp. 3385-3395
Czeczuga B (2000) Zoosporic Fungi Growing on Freshwater Molluscs. Polish Journal of Envoromental Studies 9 Volumen 3: 151-156.
Davidson EW, Parris M, Collins JP, Longore JE, Pessier AP, Brunner J (2003) Pathogenicity and Transmission of Chytridiomycosis in Tiger Salamanders (Ambystoma tigrinum: Corpei 3: 601-607.
Davidson C, Benard MF, Shaffer HB, Parker JM, O’Leary C, Conlon JM, Rollins-Smith LA (2007) Effects of chytrid and carbaryl exposure on survival, growth and skin peptide defenses in foothill yellow-legged frogs. Environ Sci Technol 41:1771–1776
De Luca LC, Zamora AS, Folabella AM (1998) Bacterias indicadoras de riesgo sanitario aportadas por el riego frente a la supresividad edáfica.
Facultad de Ciencias Exactas y Naturales. UNMDP. Departamento de Biología. Laboratorio de Microbiología. Mar del Plata. Argentina
Drew A, Allen EJ, Allen LJS (2006) Analysis of climatic and geographic factors affecting the presence of chytridiomycosis in Australia. Dis Aquat Org 68: 245-250.
Gleason FH, Mozley-Standridge SE, Porter D, Boyle DG, Hyatt AD (2007) Preservation of Chytridiomycota in culture collections. Mycology Research; 111:129-136
.
Harris RN, Timothy Y, Lauer J, Mary Alice Simon MA, Patel A (2006) Amphibian Pathogen Batrachochytrium dendrobatidis Is Inhibited by the Cutaneous Bacteria of Amphibian Species. EcoHealth 3, 53–56.
Hall GS, (1996) Zoosporic Fungi. International Mycological Institute.
Harmsen D, Schwinn A, Brocker EB, Frosch M (1999) Molecular differentiation of dermatophyte fungi. Mycoses 42:67–70.
Hyatt AD, Boyle DG, Olsen V, Boyle DB, Berger L, Obendorf D, Dalton A, Kriger K, Hero M, Hines H, Phillott R, Campbell R, Marantelli G, Gleason F, Colling (2007) A. Diagnostic assays and sampling protocols for the detection of Batrachochytrium dendrobatidis. Dis Aquat Org 73:175-192.
Henry T, Iwen PC, Hinrichs SH (2000) Identification of Aspergillus species
using internal transcribed spacer regions 1 and 2. J Clin Microbiol 38:1510–
1515
Jensen MA, Webster JA, Straus N (1993) Rapid identification of bacteria on the basis of polymerase chain reactionamplified ribosomal DNA spacer polymorphisms. Appl Environ Microbiol 59:945–952
Johnson ML, Speare R (2005) Possible modes of dissemination of the amphibian chytrid Batrachochytrium dendrobatidis in the environment. Dis Aquat Org 65: 181-186.
Kriger KM, Hero JM (2007) The chytrid fungus Batrachochytrium
dendrobatidis is non-randomly distributed across amphibian breeding habitats, Biodiversity Research.
Kriger KM, Hines HB, Hyatt AD, Boyle DG, Hero JM (2006a) Techniques for detecting chytridiomycosis in wild frogs: comparing histology with real-time Taqman PCR. Dis Aquat Org 71: 141–148.
Kriger km, Hero JM, Ashton KJ (2006) Cost efficiency in the detection of chytridiomycosis using PCR assay. Dis Aquat Org 71: 149–154.
Laurance WF, McDonald KR, Speare R. 1996. Epidemic Disease and the Catastrophic Decline of Australian Rain Forest Frogs. Conservation Biology 10(2):406-413.
Lidkind D (2003) Levaduras pigmentadas de los agos y ríos de la Patagonia noroccidental. Universidad Nacional del Comahue, CRUB. Bariloche, Argentina.
Lips KR, Burrowes PA, Mendelson JR, Parra-Olea G. (2005) Amphibian population declines in Latin America: A synthesis. Biotropica 37(2):222-226. Longore JE, Pessier AP; Nichols DK (1999) Batrachochytrium dendrobatidis
gen. et sp. Nov., a chytrid pathogenic to amphibians. Mycologya, 91: 219-227.
Luke AF (2006) Fluctuating Gram Negativo Microflora in developing Anuras. Journal of Herpetology 40 (1): 131-135.
Martínez A, Silveria L, Mateo JA, Urioste J, Rodríguez MA, Pether J (2003) Microbiología cloacal en lagartos gigantes amenazados de las islas Caranias (Género Gallotia) en cautividad. Revista Española de Herpetología 17: 29-37.
Mackay I, Mackay JF, Nissen M, Sloots T (2007) Real time PCR: History and fluorogenic chemestries. Real time PCR in Microbiology from diagnosis to characterization. 1-39.
Navas ME (2008) Anfibios para antibióticos. BBC mundo. Revista electónica.http://news.bbc.co.uk/hi/spanish/science/newsid_7281000/72810 29.stm. Revisada el 28 de Junio de 2010.
Parris, MJ, Baud DR. (2004) Interactive effects of a heavy metal and chytridiomycosis on gray treefrog larvae (Hyla chrysoscelis). Copeia 2004, 344 350.
Piotrowski JF, Annis SL, Longore JE (2004) Physiology of Batrachochytrium dendrobatidis, a chytrid pathogen of amphibians, Mycologya, 96 (1) 9-15. Pounds AJ, Bustamante MR, Coloma LA, Consuegra JA, Fogden MPL,
Foster PN, la Marca E, Masters KL, Merino-Viteri A, Puschendorf R, Ron SR, Sanchez-Azofeifa GA, Still CJ, Young BE (2006) Widespread amphibian extinctions from epidemic disease driven by global warming. Nature 439:161-167.
Puschendorf R, Castañeda F, McCranie JR (2006) Chytridiomycosis in wild frogs from Pico Bonito National Park, Honduras. EcoHealth.
Rachowicz LJ, Vredenburg VT (2004) Transmission of Batrachochytrium dendrobatidis within and between amphibian life stages. Dis Aquat Org: 61: 75–83.
Rice KG, Mazzotti FJ, Waddle JH, Conill MD (2009) Uso de Anfibios como Indicadores del Éxito de la Restauración de Ecosistemas.University of Florida. USA
Rodríguez A (2004) Quitridiomicosis y cambios climáticos sobre algunas poblaciones de anfibios de los Andes Venezolanos. Tesis de grado.
Rohr JR, Schotthoefer AM, Raffel TR, Carrick HJ and others (2008) Agrochemicals increase trematode infections in a declining amphibian species. Nature 455:1235–1239
Rollins-Smith LA, Doersam JK, Longcore JE, Taylor SK, Shamblin JC, Carey C, Zasloff MA (2002) Antimicrobial peptide defenses against pathogens associated with global amphibian declines. Dev Comp Immunol 26:63–72
Rosenblum EB, Fisher MC, James TY, Stajich JE,. Longcore JE, Lydia R. Gentry LR, Thomas J. Poorten TJ (2009) A molecular perspecive: biology of the emerging pathogen Batrachochytrium dendrobatidis. Dis Aquat Org 60: 141-148.
Rowley JJ, Alford RA, Skerratt LF (2006) The Amphibian Chytrid Batrachochytrium dendrobatidis Occurs on Freshwater Shimp in Rian Forest Streams In Northern Qeensland, Australia. Ecohealth 3: 49-52.
Ruiz A, Rueda-Almonacid JV (2008) Batrachochytrium dendrobatidis an Chytridiomycosis in Anuran Amphibians of Colombia. Ecohealth 5, 27-33. Santos G (2004) Enfermedades infecciosas en poblaciones de anfibios.
Suazo I, Alvarado J (2006) Anfibios: centinelas de la biodiversidad. Revista Ciencia y Desarrollo 30: 178. México D.F.
Tejedo M (2003) El declive de los anfibios. Las dificultad de separar las variaciones naturales del cambio global. Munive 16: 20-43
Valasek M.A. & Repa,J.J. (2005). The power of real-time PCR. Advances in Physiology Education 29: 151-159.
Velásquez B, Castro F, Bolivar W, Herrera MI (2008). Infección por el hongo quitridio Batrachochytrium dendrobatidis en Anuros de la cordillera Occidental de Colombia. Herpetotropicos Vol 4(2):65-70.
Young, B. E., Lips, K. R., Reaser, J. K., Ibáñez, R., Salas, A. W., Cedeño, J. R., Coloma, L. A., Santiago, R., La Marca, E., Meyer, J. R., Muñoz, A., Bolaños F, Chaves G y Romo D (2001) Population declines and priorities for amphibian conservation in Latin America. Conservation Biology, 15:1213-1223.