EVALUACIÓN EN 3 MICROAMBIENTES DIFERENTES DE LA
TERMORRESISTENCIA DE UNA CEPA DE Salmonella spp AISLADA DE
COMPOST
GERMAN ANDRES BAUTISTA BALLEN
TRABAJO DE GRADO
Presentado como requisito parcial Para optar el título de
Microbiólogo Industrial
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRRERA DE MICROBIOLOGIA INDUSTRIAL BOGOTA D.C
Artículo 23 de la Resolución Nº 13 de Julio de 1946
“La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques
EVALUACIÓN EN 3 MICROAMBIENTES DIFERENTES DE LA
TERMORRESISTENCIA DE UNA CEPA DE Salmonella spp AISLADA DE
COMPOST
GERMÁN ANDRÉS BAUTISTA BALLEN
APROBADO
Dra. Ana Karina Carrascal M.Sc Dra. Maria Mercedes Martínez M.Sc
Director Asesor
EVALUACIÓN EN 3 MICROAMBIENTES DIFERENTES DE LA
TERMORRESISTENCIA DE UNA CEPA DE Salmonella spp AISLADA DE
COMPOST
GERMÁN ANDRÉS BAUTISTA BALLEN
APROBADO
! " " !
#
"
$ %
TABLA DE CONTENIDO
RESUMEN 10
INTRODUCCIÓN 11
1. MARCO TEÓRICO 13
1.1 ABONOS ORGÁNICOS 13
1.1.1 Compost 13
1.2 Microorganismos patógenos en los bioinsumos 15
1.3 Salmonella spp. 18
1.3.1 Características bioquímicas 19
1.3.2 Serotipificación 19
1.3.3 Efecto de la temperatura 20
1.4 Brotes de Salmonella spp. asociados al consumo de alimentos 21
2. JUSTIFICACION 24
3. OBJETIVOS 25
3.1 Objetivo general 25
3.2. Objetivos específicos 25
4. METODOLOGÍA 26
4.1 Microorganismos de estudio 26
4.1.1 Banco de cepas primario 26
4.1.2 Caracterización de la cepa 27
4.2 Curvas de crecimiento 27
4.3 Microcosmos 28
4.3.1 Preparación de los inóculos 28
4.3.2 Montaje del microcosmos 29
4.3.3 Análisis y seguimiento del microcosmos 29
4.4 Curvas de muerte térmica 30
4.4.1 Preparación del inóculo 30
4.4.2 Montaje curvas de muerte térmica 31
4.4.2.1 Curvas muerte térmica en caldo compost 32
4.4.3 Valor D 32
5. RESULTADOS 34
5.1.1 Aislamiento de la cepa 34
5.1.2 Caracterización de la cepa 34
5.2 Banco de cepas primario 36
5.3 Elaboración de curvas de crecimiento 36
5.4 Microcosmos 37
5.5 Curvas de muerte térmica 37
5.5.1 Valor D 42
6. DISCUSION DE RESULTADOS 44
6.1 Microorganismos de estudio 44
6.2 Elaboración de curvas de crecimiento 44
6.3 Microcosmos 45
6.4 Curvas de muerte térmica 47
6.4.1 Curva de muerte térmica en caldo BHI a pH 5.5 51
6.4.2 Curvas de muerte térmica en caldo compost 52
6.5 Valor D 53
7. CONCLUSIONES 55
8. RECOMENDACIONES 56
9. REFERENCIAS 57
10. ANEXOS 70
ANEXO 1. Preparación del caldo compost 70
ANEXO 2. Resultados Número Más Probable de Salmonella spp. 71 según el Método de la EPA Nº 1682/2006
ANEXO 3. Recuentos curvas de muerte térmica 75
ÍNDICE DE TABLAS
Tabla 1. Temperatura necesaria para la eliminación de algunos 17
patógenos en compost.
Tabla 2. Composición de los tratamientos para el microcosmos 29 Tabla 3. Resultados de la identificación bioquímica, serológica y 34
microscópica de la cepa aislada.
Tabla 4. Caracterización de la cepa mediante Kit de bioquímicas 35
Tabla 5. Caracterización serológica de la cepa 36
Tabla 6. Valor D para cada tratamiento con Salmonella spp. 43
Tabla 7. Valor D para S. enteritidis 43
ÍNDICE DE FIGURAS
Figura 1. Distribución estimada anual de los costos (dólares) 22
de Salmonelosis en EEUU.
Figura 2. Montaje del inóculo para curvas de crecimiento 28
Figura 3. Montaje final del microcosmos 30
Figura 4. 4a. Montaje curvas de muerte térmica 31
4b. Control de Tº mediante termocupla
Figura 5. Cepa aislada de Salmonella spp 35
Figura 6. Bioquímicas Salmonella spp 35
Figura 7. Curva de crecimiento por absorbancia Salmonella spp. 38
y S. enteritidis
Figura 8. Curva de crecimiento por recuento en placa de 39 Salmonella spp. y S. enteritidis
Figura 9. Comportamiento de Salmonella spp respecto al pH en 39
el microcosmos
Figura 10. Microcosmos control 40
RESUMEN
El uso de bioinsumos agrícolas en la última década ha generado brotes por el consumo de alimentos contaminados con patógenos, de ahí la importancia de evaluar la termorresistencia de patógenos. El objetivo de este trabajo fue determinar la temperatura óptima de muerte para una cepa de Salmonella sppaislada de pilas
de compost empleando microambientes diferentes a escala de laboratorio. Para ello se recreó un microambiente a base de compost inoculado artificialmente con 10 y 100 células/g de Salmonella spp previamente aislada de residuos domiciliarios y
llevado a incubación durante nueve semanas a 70ºC, semanalmente se evaluó el pH y la presencia de Salmonella spp mediante el método EPA 1682/2006, hasta la tercera semana se tuvo la presencia del patógeno, concordando con la disminución del pH. Por otro lado, se realizaron curvas de muerte térmica para éste microorganismo en diferentes medios: caldo BHI (pH 7.0) a temperatura de 50, 60, 70 y 80ºC; caldo BHI (pH 5.5) a 80ºC; caldo compost filtrado y sin filtrar a 80ºC. Igualmente se llevó a cabo un ensayo control en caldo BHI (pH 7.0) con S. enteritidis a 70ºC. En cada ensayo se halló el valor DL y DT (Lineal – Tails “colas”)
debido a la injuria bacteriana sufrida por la cepa, determinándose un valor DL de
40.2 min en caldo BHI a pH 7.0; de 17.7 min en caldo BHI a pH 5.5 y de 31.8 min en caldo compost filtrado, sugiriendo una posible sensibilidad de la cepa a los ácidos inorgánicos y la necesidad de sustratos de fácil degradación para recuperarse de la injuria bacteriana. Los datos obtenidos demuestran que es necesario llegar a temperaturas altas para garantizar la calidad del compost.
Palabras clave: compost, injuria bacteriana, Salmonella spp., termorresistencia, y
INTRODUCCION
El compostaje es uno de los procesos más utilizados hoy en día a nivel agroindustrial para el manejo de residuos sólidos. Sin embargo, son varias las materias biodegradables sometidas a este tratamiento y dependiendo de su procedencia, pueden determinar el tipo y la cantidad de microorganismos que se desarrollen durante el proceso.
Al emplear materias como estiércol de animales se está agregando una carga microbiana elevada de patógenos proveniente del tracto intestinal de estos, así mismo sucede al emplear lodos residuales y desechos domésticos. La gran mayoría de los microorganismos presentes en estas materias son catalogados como patógenos y muchos de ellos sobreviven al tratamiento térmico que se da durante el proceso de compostaje, encontrándose al final de este un elevado número de microorganismos viables de alto riesgo para la salud y causantes de brotes de difícil control.
El abono orgánico producto del compostaje es generalmente empleado en agricultura en el cultivo de hortalizas para consumo humano, significando un riesgo debido a la contaminación cruzada que se presenta del suelo a la planta y sobretodo en plantas que se desarrollan a nivel de suelo y que presentan pliegues en su estructura, generando así un medio que alberga gran cantidad de patógenos.
1. MARCO TEORICO
1.1 Abonos orgánicos
Un abono orgánico se define como un recurso o producto biológico, que al ser aplicado al suelo activa principalmente los procesos microbiales, fomentando simultáneamente su estructura, aireación y capacidad de retención de humedad y aportando pequeñas cantidades de nutrientes. Incluye subproductos animales, estiércoles, residuos vegetales y lombricompuestos (ICA, 1995).
Los procesos para la obtención de productos orgánicos se basan en la degradación de la materia orgánica, los cuales la transforman en una mezcla homogénea de gran valor agronómico. Su calidad depende de la estabilización de los residuos orgánicos utilizados para su elaboración, mediante procesos como el compostaje, la lombricultura o camas de secado (Zaleski et al., 2005).
1.1.1 Compost
Este proceso consiste en la descomposición de la materia orgánica en un ambiente controlado mediante la acción de microorganismos, los cuales sintetizan enzimas, vitaminas, hormonas, antibióticos y otros compuestos que repercuten favorablemente en el equilibrio biótico del suelo y en el desarrollo vegetal (Augusti, 1995).
El éxito que ha tenido el proceso de compostaje radica principalmente en combinar los conocimientos científicos con los tradicionales, donde la gran cantidad de materiales de desecho y residuos orgánicos que se producen en la naturaleza son aprovechados (Alfaro et al., 2001).
patógenos. Del mismo modo el tamaño de las partículas a compostar, el diseño de la pila y el tamaño de ésta afectan la velocidad de aireación, y la tendencia del compost a retener o desperdiciar el calor que es generado (Chen et al., 2000).
El compostaje hecho a partir de residuos animales y desechos orgánicos biodegradables puede ser usado, dependiendo de su grado de madurez y calidad, en procesos agrícolas como la horticultura o para la rehabilitación de minas y suelos. Dentro de las materias primas utilizadas para compostaje se encuentran residuos de jardinería, lodos industriales, desechos sólidos municipales y de ganadería entre otros (Déportes et al., 1995). El compost no es un producto
peligroso, sin embargo puede contener un número elevado de contaminantes que ponen en riesgo la salud pública y el medioambiente (Gong, 2007).
Al emplear desechos animales como el estiércol en pilas de compost, varias clases de bacterias patógenas como coliformes y Salmonella pueden existir y perdurar en
esta materia (Déportes et al., 1995). En estiércol de vaca, lodos residuales y
residuos de comida el número de coliformes presentes es de 105 -109 UFC/g (Pera
et al., 1991). Estos valores pueden ser críticos si se tiene en cuenta que los cultivos
orgánicos, en su mayoría hortalizas, son tratados con material de compost o abonos orgánicos a base de estiércol animal. Aunque se considera que la mayoría de microorganismos patógenos mueren por el calor generado durante la fermentación de la pila, muchos de ellos se han encontrado al final del proceso de compostaje. Esto se debe a que las temperaturas al interior y exterior de la pila de compost no son uniformes, siendo la temperatura externa más baja que la interna. Mientras que en el interior en fase termófila la temperatura oscila los 65-75 ºC en el exterior puede continuar en 30-40 ºC. De esta forma es posible que microorganismos patógenos logren sobrevivir durante el proceso del compostaje (Gong, 2007).
aumento de la temperatura hasta los 40ºC, lo que provoca que los microorganismos termófilos sean más competentes y se incremente la temperatura hasta los 70ºC (Pinto, 2001).
Las elevadas temperaturas alcanzadas en la fase termofílica del proceso de compostaje representan un factor fundamental a la hora de producir abonos orgánicos libres de patógenos, debido a que los microorganismos patógenos son eliminados cuando la pila de compost ha sido correctamente construida y se ha logrado llegar una temperatura por encima de los 60ºC (LeaMaster et al., 1998).
Por otra parte, aunque la mayoría de patógenos son destruidos rápidamente cuando la pila de compost alcanza una temperatura uniforme de 55ºC, unos pocos logran sobrevivir y se hace necesario lograr temperaturas superiores a los 67ºC para garantizar la ausencia de quistes de protozoos, huevos de helmintos, cepas de
Clostridium perfringens y C. botulinum (Jones & Martin, 2003). Además, se ha
reportado la capacidad de ciertas cepas de Salmonella spp. para crecer y
desarrollarse a temperaturas cercanas a los 68ºC (Droffner y Brinton, 1995).
1.2 Microorganismos patógenos en los bioinsumos
Los desperdicios animales en forma de estiércol son unos de los más aplicados en la agricultura debido a que es un método económico y ambientalmente sostenible para el tratamiento del suelo, ya que posee un valor benéfico como fertilizante fuente de nitrógeno, fosfato y potasio que puede ayudar a mantener la calidad del suelo. Sin embargo, el estiércol animal frecuentemente contiene microorganismos patógenos que ingresan en la cadena alimentaria. Por tal motivo, es indispensable controlar el nivel de patógenos con el fin de evitar la contaminación del suelo, aguas, cosechas, animales y el hombre (Islam et al., 2004).
Existe un gran número de bacterias capaces de desarrollarse en los materiales usados para el compostaje y más aún capaces de sobrevivir todo el proceso y hallarse al final de este. Bacterias como Salmonella, Campylobacter, Escherichia coli, Listeria, Pasteurella, Staphylococcus aureus, Leptospira, Serpulina hyodysenteriae, Mycobacterium bovis, Mycobacterium paratuberculosis, Clostridium prefringens, Clostridium tetani entre otros (Jones y Martin, 2003). La gran mayoría
de estos microorganismos no sobreviven el proceso de compostaje, sin embargo algunos como Listeria, Mycobacterium y los esporoformadores pueden ser más
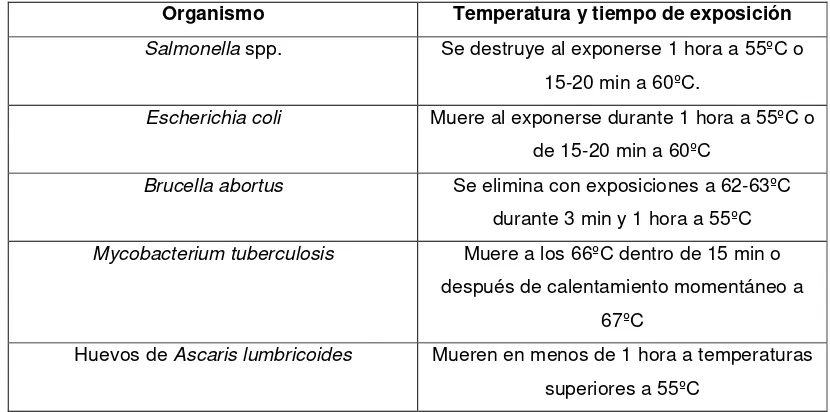
resistentes y encontrarse al final del proceso (tabla 1). No obstante, el número encontrado de estos microorganismos al final del compostaje no representa riesgo alguno (Jones, 1982; Pell, 1997; Jones y Martin, 2003). Según Jones y Martin (2003) la mayoría de patógenos son eficientemente removidos durante el proceso de compostaje siempre y cuando la temperatura alcance los 55 °C y se mantenga durante 3 días como mínimo.
Tabla 1. Temperatura necesaria para la eliminación de algunos patógenos en compost (Arnedo et al., 2002).
Organismo Temperatura y tiempo de exposición
Salmonella spp. Se destruye al exponerse 1 hora a 55ºC o
15-20 min a 60ºC.
Escherichia coli Muere al exponerse durante 1 hora a 55ºC o
de 15-20 min a 60ºC
Brucella abortus Se elimina con exposiciones a 62-63ºC
durante 3 min y 1 hora a 55ºC
Mycobacterium tuberculosis Muere a los 66ºC dentro de 15 min o
después de calentamiento momentáneo a 67ºC
Huevos de Ascaris lumbricoides Mueren en menos de 1 hora a temperaturas
superiores a 55ºC
Los desechos animales aplicados en los abonos orgánicos contribuyen con un aporte significativo de nutrientes esenciales como nitrógeno, fosfato y potasio, además de incluir microorganismos que ayudan a la estabilización y mantenimiento de los bioabonos. Si los bioabonos no son sometidos a procesos eficientes de compostaje, pueden llegar a convertirse en un vehículo transmisor de microorganismos patógenos que puede incurrir en brotes de carácter entérico (Chang & Fang,2007).
Acorde con Islam et al., (2004), la contaminación de hortalizas frescas con Escherichia coli O157H:7. y Salmonella spp. ocurre más fácilmente en granjas
donde se manejan aguas para riego y abonos contaminados. Además, microorganismos como Escherichia coli O157H:7, Salmonella typhimurium y L. monocytogenes, se pueden encontrar en una amplia variedad de carnes crudas, así
Ahora bien, los humanos pueden entrar en contacto con los patógenos presentes en los bioinsumos ya sea por contacto directo o indirecto con agua o comida previamente contaminada. El contacto directo se puede dar mediante manipulación del material orgánico, por caminar sobre el área donde se aplica, por manipular el suelo donde se aplica o por inhalación de los microorganismos presentes en el aire. El contacto indirecto se puede dar por el consumo de las cosechas contaminadas, por ingestión de agua contaminada, por contacto con el bioinsumo o con patógenos transportados por vectores como roedores, insectos e incluso mascotas (Gutiérrez & Martínez 1999).
1.3 Salmonella spp.
El género Salmonella pertenece a la familia Enterobacteriaceae. Estos
microorganismos se hallan distribuidos ampliamente en la naturaleza que abarcan un amplio rango de huéspedes que van desde animales (reptiles, aves, insectos) hasta humanos, y en los cuales produce un amplio espectro de enfermedades (Parra et al, 2002).
Se caracteriza por ser un bacilo Gram negativo, anaerobio facultativo, móvil no formador de esporas y con flagelo perítrico. Los desinfectantes comunes como clorados, iodados y fenoles son eficaces frente a Salmonella spp (Mejía, 2003). Al
ser un Gram negativo se caracteriza por tener la típica pared celular estratiforme rica en lípidos. La capa externa contiene lipopolisacárido (LPS) responsable de la mayoría de las propiedades tóxicas y biológicas de este microorganismos. Unido al lipopolisacárido se encuentran las complejas cadenas de oligosacáridos que determinan especificidad antigénica en las cepas. El peptidoglucano forma una capa definida en la pared celular entre el lipopolisacárido y la membrana citoplasmática.
Salmonella spp posee además un 10% de lipoproteínas encargadas de la
asociación LPS – peptidoglucano (Hirsh, 1999).
El rango de temperatura para el crecimiento de Salmonella esta entre 5.5 y 45 °C y
depende de la cepa de Salmonella presente y la fase de crecimiento en la que se
encuentre, la composición del medio y otros factores como los microorganismos presentes (Doyle y Mazzotta, 2000).
El género de Salmonella mas conocido y estudiado es sin duda alguna Salmonella typhi, causante de la fiebre tifoidea, pero en los últimos años han adquirido gran
notoriedad otros géneros como Salmonella dublin, Salmonella enteritidis y Salmonella spp por ser patógenos causantes de brotes y muertes en humanos (Pell,
1997).
1.3.1 Características bioquímicas
Las características bioquímicas más relevantes y claves en el proceso de identificación de Salmonella spp son: catalasa (positivo) y oxidasa (negativo), la
fermentación de la glucosa y otros carbohidratos, con la producción de gas, la producción de ácido sulfhídrico, la lisina-descarboxilasa, la capacidad de crecimiento en agar citrato de Simmons, la no producción de indol, la incapacidad de hidrólisis de la urea, la resistencia al verde malaquita, tetrationato, desoxicolato y selenito (ICMSF, 1996).
1.3.2 Serotipificación
La definición del serotipo se realiza mediante la descripción de sus antígenos de pared y flagelares. Esta se basa en la mezcla del organismo, que hace el papel de antígeno, con el suero inmune (anticuerpo). Si el suero posee aglutininas frente al antígeno, se presenta una aglutinación (Schneider, 2001).
1.3.3 Efectos de la temperatura
La resistencia térmica de Salmonella ha sido ampliamente estudiada sobre diversos
sustratos y ambientes, tanto a nivel ambiental como de alimentos, a fin de establecer la temperatura necesaria para la destrucción de éste patógeno. A nivel medioambiental se ha buscado mejorar la forma de erradicar éste microorganismo de los productos agrícolas debido al impacto que causa en los ya mencionados cultivos, aguas de riego y humanos.
El control de la temperatura durante los diversos procesos agrícolas, como la elaboración de bioabonos, ha resultado ser una metodología eficiente para el control de patógenos, sin embargo, se ha sugerido la combinación de diversos factores como el contenido de humedad, la concentración de amonio y la presencia de otros microorganismos, como complemento eficaz para el tratamiento térmico, así como lo describe Knoll (1961) en algunos experimentos, donde varias cepas de
Salmonella spp. fueron sometidas a diferentes temperaturas de compostaje,
encontrando que al exponer por 14 días a temperatura de 55 – 60ºC, el producto final era negativo para Salmonella spp.
Sin embargo, Droffner & Brinton (1995) reportaron la sobrevivencia de Salmonella
spp. y Escherichia coli en compost industrial durante 59 días a 60ºC, al igual que
Gibbs et al., (1998), quienes encontraron Salmonella spp. en muestras de compost
Por otra parte, Salmonella spp. no se caracteriza por ser una bacteria que presente
elevada termorresistencia en comparación con otras cepas como S. senftenberg o S. typhimurium (Doyle & Mazzotta, 2000). No obstante, estudios de resistencia
térmica bacteriana en alimentos y medios de cultivo han demostrado que
Salmonella spp. es capaz de generar factores de termorresistencia como proteínas
de membrana alternas que le confieren una mayor protección al calor (Humpheson
et al., 1998).
1.4 Brotes de Salmonella spp. asociados al consumo de alimentos
Las bacterias del género Salmonella continúan siendo un problema mayor en lo que
a salud pública respecta y al riesgo que representa en la industria alimentaria, debido a que son una de las bacterias más importantes que pueden provocar enfermedades en el hombre por ingestión de alimentos contaminados. Ha sido aislada de una amplia variedad de alimentos y de materias primas para la fabricación de estos. Varios procesos térmicos aplicados en la industria durante la fabricación de alimentos suelen ser efectivos para la destrucción de este microorganismo, sin embargo, el tratamiento con calor ha dejado de ser altamente efectivo y debe combinarse con otro factor como lo es la variación en los valores de pH (Leguérinel et al., 2007). Esta resistencia a los tratamientos térmicos resulta en
gran medida de cambios en la formulación o características del alimento en el que se encuentre y alteraciones en los sólidos totales, acidez y actividad del agua (aw)
(Doyle y Mazzotta, 2000).
Los casos de brotes por Salmonella en frutas y vegetales crudos, se deben
Los brotes producidos por Salmonella spp. anualmente reportan en países
[image:22.595.134.490.220.429.2]industrializados y en vías de desarrollo una gran cantidad de pérdidas no solo de vidas sino también a nivel monetario, sólo en EEUU y Canadá las pérdidas ascienden a $3.4 billones de dólares (Figura 1).
Figura 1. Distribución estimada anual de los costos (dólares) de Salmonelosis en EEUU. Fuente: USDA, 2007 <en línea>
Son varios los brotes de salmonelosis reportados en una amplia variedad de alimentos como tomates crudos (Hedberg et al., 1999; Klerks, 2007; Zhuang et al.,
1995), lechuga, melones, espinaca y varias clases de ensaladas preparadas con estos alimentos (Sivapalasingam et al., 2004), así como también en tejidos internos
de frutas como melón y sandía (Golden et al., 1993). Esto se debe principalmente a
que recientemente se ha incrementado la demanda de alimentos orgánicos así como de frutas y vegetales frescos, permitiendo la expansión de este mercado y la oferta de grandes cantidades de alimentos crudos (Francis et al., 1999;
Sivapalasingam et al., 2004; Thunber et al., 2002).
Según Pell (1997), Salmonella spp ha sido en un 45% el microorganismo
huevos, pescados, ensaladas y chocolates en donde el agente causante ha sido identificado. El costo a nivel económico de la salmonelosis ha sido estimado en un valor cercano al billón de dólares por año, debido al tratamiento de la sintomatología caracterizada por nausea, calambres, diarrea, y en cerca del 2% de los casos se presenta artritis (Pell, 1997).
Parra y colaboradores (2002) reportan que a nivel mundial Salmonella spp es un
2. JUSTIFICACIÓN
Las implicaciones a nivel de salud pública y medio ambiente que conlleva el entregar un bioinsumo contaminado con algún patógeno, en este caso el compost, para su uso en procesos agrícolas es enorme si se tiene en cuenta que se emplea para la fabricación de productos mínimamente procesados, cuya demanda se ha incrementado en la última década (Francis et al., 1999). Además, no solo los
cultivos se ven perjudicados por la presencia de algún patógeno contaminante, también las aguas de riego se ven afectados debido a que los microorganismos se movilizan a través de ésta hacia otros cultivos y abastecimientos de agua (potable o de riego) aledaños al cultivo.
De esta forma, la importancia de realizar un estudio acerca de la temperatura óptima para eliminar un patógeno como Salmonella spp, radica en que se podrán aplicar
estos avances en la mejora de los procesos de compostaje, hallando los valores térmicos necesarios para la destrucción de patógenos resistentes a las temperaturas máximas alcanzadas normalmente durante este proceso.
Al determinar la temperatura en la que se destruye la mayoría de la población bacteriana de las cepas de Salmonella spp presentes en el compost, se pueden
plantear nuevas metodologías tendientes a optimizar la temperatura alcanzada durante cada una de las fases del compostaje, especialmente la termófila, en donde la mayoría de patógenos suelen ser eliminados, permitiendo de esta manera la obtención de un compost limpio libre de contaminantes y apto para el uso en diferentes áreas sin representar ningún riesgo para la salud pública o el medio ambiente.
Asimismo, la identificación de una cepa de Salmonella sppresistente a un elevado y
3. OBJETIVOS
3.1 Objetivo general:
- Determinar la temperatura óptima de muerte para una cepa de Salmonella
spp aislada de pilas de compost empleando microambientes diferentes a escala de laboratorio.
3.2 Objetivos específicos:
- Realizar el aislamiento y caracterización de una cepa de Salmonella spp
proveniente de residuos orgánicos domiciliarios.
- Establecer el comportamiento de la cepa en un microcosmos creado a base de material de compostaje bajo condiciones de temperatura y pH controlados.
- Evaluar en 2 medios de cultivo a escala de laboratorio el efecto de diferentes temperaturas sobre la cepa y la influencia del medio en la transmisión de calor y la resistencia que este le confiera al microorganismo.
4. METODOLOGIA
Los ensayos llevados a cabo en este estudio se realizaron en los laboratorios de Microbiología de Alimentos y Microbiología Ambiental, Departamento de Microbiología, Facultad de Ciencias de la Pontificia Universidad Javeriana.
4.1 Microorganismos de estudio
Para el presente estudio se realizó el aislamiento de la cepa de Salmonella spp a
partir de muestras de compost, elaborado a partir de residuos domésticos, provenientes de una empresa ubicada en el Llano.
Para el aislamiento se empleó la Técnica de Número Mas Probable (NMP) para
Salmonella spp en Bioinsumos y Abonos Orgánicos, según el método de la EPA Nº
1682 (2006).
La cepa empleada como control en las curvas de crecimiento y de muerte térmica fue S. enteritidis (CMDM PUJ 247) suministrada por el cepario de la Pontificia
Universidad Javeriana.
4.1.1 Banco de cepas primario
Para la conservación de las cepas se siguió la metodología descrita por Poutou et al., (1994), usando inóculos en caldo BHI con glicerol al 30% p/v y almacenados
a -70ºC.
Las pruebas de viabilidad se realizaron semanalmente, llevando el vial a evaluar en diluciones seriadas (base 10) desde 10-1 hasta 10-9. Las diluciones 10-6 y 10-7 se
sembraron en profundidad (1 ml) empleando agar BHI y se llevaron a incubación por 24h a 37ºC, para así realizar conteo de las unidades formadoras de colonia (Meza
et al., 2002). La pureza se confirmó con aislamientos de las colonias en agar XLD y
4.1.2 Caracterización de la cepa
Para la caracterización de la cepa se realizaron las pruebas bioquímicas API 20E y BBL Crystal E/NF. La metodología llevada a cabo fue la descrita en el inserto de cada Kit bioquímico.
Igualmente la cepa fue llevada al Laboratorio de Microbiología de la Facultad de Veterinaria de la Universidad Nacional de Colombia para un análisis mediante antisueros específicos para el microorganismo.
4.2 Curvas de crecimiento
Para la realización de las curvas de crecimiento se tuvo en cuenta la metodología empleada por Díaz-Borrego et al., (2005) con algunas modificaciones en base a la
metodología propuesta por Pedroza et al., (2007) para las curvas de crecimiento
bacteriano.
El preinoculo consistió en un erlenmeyer de 50 ml con 27 ml de caldo BHI adicionada con una suspensión del microorganismo igual al patrón 0.5 de McFarland. Previamente se preparó mediante la emulsión de una colonia de
Salmonella spp crecida en agar XLD (24h – 37ºC) en un tubo Khan con 3 ml de
caldo BHI estéril. El preinoculo se llevó a incubación durante 12h a 37ºC bajo agitación continua (130 rpm).
Figura 2. Montaje del inóculo para curvas de crecimiento
El recuento en placa se realizó cada dos horas, haciendo diluciones seriadas (base 10) del inóculo en agua peptonada 0.1% p/v estéril y sembrando en profundidad (1ml) en agar BHI para ser llevadas a incubar a 37ºC durante 18h.
4.3 Microcosmos
El montaje del microcosmos se basó en la metodología llevada a cabo por Natvig et al., (2002); y por Lemunier et al., (2005), con algunas modificaciones en cuanto a la
preparación y distribución de los inóculos y en la temperatura de incubación del microambiente, debido al objetivo de la investigación.
4.3.1 Preparación de los inóculos
Un tubo Khan con 2.5 ml de caldo BHI estéril se ajustó al tubo 0.5 de McFarland a partir de la emulsión de una colonia de Salmonella spp crecida en agar XLD (24h –
A partir del inóculo se realizaron diluciones sucesivas en frascos Schott de 500 ml con 225 ml de agua peptonada 0.1% p/v estéril hasta obtener concentraciones de 100 y 10 células/ml. Cada dilución fue agregada a una muestra de compost y homogenizada manualmente. A la muestra de compost control se le adicionó agua peptonada 0.1% p/v estéril para mantener las condiciones de humedad similares.
4.3.2 Montaje del microcosmos
Se emplearon envases de vidrio de 750 cm3 y cada uno fue adicionado con 150 g de
la muestra de compost (tabla 2). Este compost tenía la misma procedencia del cual se aisló la cepa inicialmente, y se encontraba en fase mesofílica (1 semana). Cada envase se selló con un tapón de caucho, se rotuló adecuadamente y se llevo a incubar a 70ºC (figura 3). Previamente se tomaron muestras de cada tratamiento correspondientes al tiempo cero (inicio del estudio) para el análisis de pH y
[image:29.595.108.518.449.518.2]Salmonella spp.
Tabla 2. Composición de los tratamientos para el microcosmos
Tratamiento Muestra de compost (g) Inóculo
1 150 100 células/g
2 150 10 células/g
Control 150 Agua peptonada estéril 0.1%
4.3.3 Análisis y seguimiento del microcosmos
Se retiraron semanalmente 3 envases de cada tratamiento para realizar el seguimiento al comportamiento de Salmonella spp y niveles de pH en cada
microambiente.
Para el seguimiento del microorganismo se empleó la Técnica de Número Mas Probable (NMP) para Salmonella spp en Bioinsumos y Abonos Orgánicos, según el
El pH del compost fue medido semanalmente a los envases retirados para el análisis de Salmonella spp. Éste se midió diluyendo una muestra de compost en
[image:30.595.250.387.203.388.2]agua destilada relación 1:5 (Lemunier et al., 2005).
Figura 3. Montaje final del microcosmos
4.4 Curvas de muerte térmica
4.4.1 Preparación del inóculo
El preinoculo se preparó adicionando un tubo Khan con 2 ml de caldo BHI, ajustado al patrón 0.5 de McFarland mediante la emulsión de una colonia de Salmonella spp,
en un erlenmeyer de 50 ml con 18 ml de caldo BHI estéril y llevado a incubar por 12h a 37ºC bajo agitación (130 rpm).
Para preparar el inóculo, un erlenmeyer de 500 ml con 180 ml de caldo BHI estéril fue adicionado con el cultivo de 12h y llevado a incubación durante 10h a 37ºC y 130 rpm, tiempo durante el cual la cepa ha alcanzado ya la fase estacionaria y por ende mayor termorresistencia (Pagan et al., 1997; Fang et al., 1996; Foster &
fue de 12 horas, tiempo necesario para que la cepa de S. enteritidis alcanzara la
fase estacionaria.
4.4.2 Montaje curvas de muerte térmica
A partir del inóculo se tomaron 0.5 ml y se realizaron diluciones seriadas (base 10) en agua peptonada 0.1% p/v estéril hasta 10-8, sembrando por triplicado en
profundidad las ultimas tres diluciones (10-6, 10-7, 10-8) en agar BHI a fin de conocer
la concentración inicial en UFC/ml antes de iniciar el tratamiento térmico (Meza et al., 2002). Así mismo, se realizó coloración de Gram para asegurar la pureza del
inóculo.
Se tomaron 10 ml del cultivo y se adicionaron a un tubo de ensayo tapa rosca de vidrio (16 x 150 mm) estéril. Este se llevó a un baño serológico ajustado previamente a la temperatura establecida para cada ensayo (50, 60, 70 y 80ºC) (Taylor-Robinson et al., 2003).
[image:31.595.138.501.506.631.2]La temperatura al interior del inóculo se mantuvo monitoreada mediante la ubicación de una termocupla dentro del tubo de ensayo control (10 ml de caldo BHI estéril) (figura 4).
Figura 4. 4a. Montaje curvas de muerte térmica 4b. Control de Tº mediante termocupla
Las curvas a temperatura de 50, 60 y 70ºC se llevaron a cabo durante 120 minutos, mientras la curva a 80ºC se realizó durante 240 minutos.
En intervalos de tiempo de 15 minutos cronometrados, se retiró el tubo de ensayo y se realizaron diluciones seriadas (base 10) en agua peptonada 0.1% p/v estéril. La cantidad de diluciones se manejo acorde con la temperatura y el tiempo de exposición al calor del inóculo, siendo menor el número de diluciones a medida que transcurría el tratamiento térmico. Las últimas tres diluciones de cada muestreo se sembraron por triplicado en profundidad empleando agar BHI, y posteriormente incubadas a 37ºC durante 24h para determinar el número de sobrevivientes o células viables (Henry et al., 1969).
Para la curva de muerte térmica en caldo BHI a pH 5.5 se empleo ácido clorhídrico 0.5 M adicionado al inóculo antes de ser transferido al tubo de ensayo. El ajuste se realizó con papel indicador de pH (Blackburn et al., 1997).
4.4.2.1 Curva muerte térmica en caldo compost
La curva de muerte térmica fue llevada a cabo en caldo compost (Galindo & Londoño, 2005), suplementado con peptona de caseína al 2.5% (p/v), pH 7.0 (Anexo 1).
Se preparó una variación del caldo compost no filtrado, a fin de evaluar la incidencia de los sólidos en la termorresistencia del microorganismo. De tal forma que se realizaron dos curvas de muerte térmica a 80ºC x 120 minutos, una en caldo compost filtrado y otra en caldo sin filtrar. Tanto el preinoculo como el inóculo se desarrollaron en este medio. La metodología para el tratamiento térmico y la recuperación de células viables fue la misma que se empleó para el caldo BHI.
4.4.3 Valor D
Donde:
Dt es el valor D para determinada temperatura t X es el tiempo del tratamiento térmico en minutos
No es el número de células al inicio del tratamiento
Nf es el número de células supervivientes después del tratamiento
Se halló un valor D lineal y un valor D Tail (con colas) para las gráficas que no
presentaron comportamiento lineal. Este valor se calculó teniendo en cuenta los
shoulders (hombros), mientras que en el valor D lineal solo se tuvieron en cuenta los
datos que presentaron comportamiento lineal decreciente (Humpheson et al., 1998).
ln
X
Dt
No
Nf
=
5. RESULTADOS
5.1 Microorganismos de estudio
5.1.1 Aislamiento de la cepa
[image:34.595.105.521.431.607.2]Para el aislamiento y purificación de la cepa se empleó la metodología descrita en el Método EPA Nº 1682 / 2006 a partir de una muestra de compost tomada al finalizar el proceso proveniente de una empresa procesadora de residuos domésticos ubicada en el Llano. Los resultados obtenidos durante el desarrollo del método resultan ser los esperados para un microorganismo del género Salmonella (tabla 3).
Tabla 3. Resultados de la identificación bioquímica, serológica y microscópica de la cepa aislada.
Medio Resultado
MSRV Colonia blanquecina con halo grande de movilidad XLD Colonias transparentes con centros negros. Fig 5a. HECKTOEN Colonias verde-azules con centro negro. Fig. 5b. SULFITO BISMUTO Colonias de color verde metálico con centro negro y
halo de precipitación. Fig. 5c.
TSI Reacción ALK/AC con producción de H2S. Fig 6c
LIA Reacción ALK/ALK con producción de H2S. Fig 6b
UREA Negativo, sin cambio de color del medio. Fig. 6a
COLORACIÓN DE GRAM Bacilos Gram negativos
5.1.2 Caracterización de la cepa
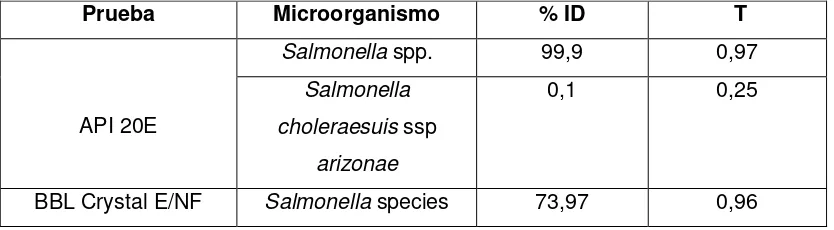
Los resultados de las pruebas bioquímicas API 20E y BBL Crystal E/NF se muestran en la tabla 4. En ambos casos el microorganismo fue identificado como Salmonella
Figura 5. Cepa aislada de Salmonella spp: a. XLD b. Hecktoen c. Sulfito Bismuto
Figura 6. Bioquímicas Salmonella spp. a. Urea b. LIA c. TSI
Tabla 4. Caracterización de la cepa mediante Kit de bioquímicas
Prueba Microorganismo % ID T
Salmonella spp. 99,9 0,97
API 20E
Salmonella choleraesuis ssp
arizonae
0,1 0,25
BBL Crystal E/NF Salmonella species 73,97 0,96
5a 5b 5c
[image:35.595.105.522.580.695.2]Los resultados del análisis mediante antisueros realizado en la Facultad de Veterinaria de la Universidad Nacional de Colombia se muestran en la Tabla 5.
Tabla 5. Caracterización serológica de la cepa
Análisis Resultado
ANTISUERO POLIVALENTE “O” Positivo, aglutinación
ANTISUERO GRUPO “B” Negativo, no aglutinó
ANTISUERO GRUPO “D” Negativo, no aglutinó
5.2 Banco de cepas primario
El banco para el microorganismo de estudio se realizó con una concentración de 33 x 108 UFC/ml en caldo BHI con glicerol al 30%. La estabilidad de la cepa se evaluó
en tres ocasiones en las cuales se confirmó la pureza y la estabilidad de la cepa. Además en los recuentos realizados durante los 6 meses del estudio la población se mantuvo constante en 108 UFC/ml, encontrándose al final una concentración de 2 x
108 UFC/ml.
A partir de este banco se realizaron los aislamientos necesarios para el montaje de cada curva de muerte térmica.
5.3 Elaboración de curvas de crecimiento
En la figura 7 se muestran los resultados de la curva de crecimiento por absorbancia, donde se pueden observar las diferentes etapas de crecimiento de los microorganismos, evidenciándose que entre la hora 8 y 10 se logra tener la fase estacionaria para la cepa en estudio y la cepa control respectivamente.
5.4 Microcosmos
En la figura 9 se presentan los resultados de los recuentos en NMP/4g de
Salmonella spp. y el comportamiento del pH en el microcosmos durante las nueve
semanas de estudio. Igualmente en la figura 10 se muestra el control del microcosmos con sus valores de NMP/4g y pH.
En la primera semana de estudio se presenta un descenso del 88.1% y 94.1% de la población inicial en los tratamientos de 10 y 100 células/g respectivamente. Esta disminución se presenta simultáneamente con una ligera caída de 0.2 en el nivel de pH.
Si se observa detalladamente en la segunda semana la población de ambos tratamientos se incrementa al igual que el valor de pH. Ambos tratamientos alcanzan poblaciones similares entre 6.5 y 6.7 NMP/4g, mientras el nivel de pH aumenta de 6.4 a 6.7.
A partir de la tercera semana tanto la población de ambos tratamientos como el nivel de pH descienden, siendo el recuento de Salmonella spp NMP/4g <0.006473
mientras el pH alcanza paulatinamente un mínimo de 4.5, presentándose una correlación entre la caída del pH y la disminución de la población inicial del microorganismo.
5.5 Curvas de Muerte térmica
En la figura 11 se muestran las curvas de muerte térmica realizadas a Salmonella
spp a temperatura de 50, 60 y 70ºC en caldo BHI a pH de 7.0.
Por otra parte, a temperatura de 60ºC la población inicial se vio disminuida en un 53.2% y a 70ºC en un 62%. No obstante gráficamente las curvas a 60 y 70ºC no presentan una conducta linear decreciente, por el contrario exhiben un comportamiento irregular conocido como shoulders (hombros) (Asselt & Zwietering,
[image:38.595.157.462.240.478.2]2006).
Figura 7. Curva de crecimiento por absorbancia Salmonella spp. y S. enteritidis
De igual forma sucede con las curvas de muerte térmica realizadas a temperatura de 80ºC (figura 12), en donde no se presenta una tendencia lineal decreciente en la inactivación de la cepa, pero con la variante que el tiempo de exposición al calor se duplicó (240 minutos) para lograr la inactivación total de la cepa, siendo esta a los 180 minutos de tratamiento a pH 7.0 y de 105 minutos a pH 5.5.
En la figura 14 se muestra la curva de muerte térmica de referencia (S. enteritidis),
en donde la cepa se mantuvo constante durante 90 min en una concentración de 104 UFC/ml, para luego de 135 min de tratamiento alcanzar la muerte de todas las
células.
Tiem po (m in)
0 100 200 300 400 500 600 700 800 900 1000
A
bs
or
ba
nc
ia
5
40
n
m
0,0 0,5 1,0 1,5 2,0 2,5
Salm onella spp.
Figura 8. Curva de crecimiento por recuento en placa de Salmonella spp. y S. enteritidis
Figura 9. Comportamiento de Salmonella spp respecto al pH en el microcosmos
Tiem po (m in)
0 200 400 600 800 1000
Lo g 10 U F C /m l 6,5 7,0 7,5 8,0 8,5 9,0 9,5
S alm onella spp.
S . e nte ritidis
0 10 20 30 40 50 60 70 80 90
0 1 2 3 4 5 6 7 8 9
[image:39.595.155.477.416.678.2]Figura 10. Microcosmos control
[image:40.595.146.455.433.687.2]
Figura 11. Curvas muerte térmica a 50, 60 y 70ºC en caldo BHI a pH 7,0 Tiempo (min)
0 20 40 60 80 100 120 140
Lo g10 U F C /m l 2 3 4 5 6 7 8 9 10 50ºC 60ºC 70ºC 0 2 4 6 8 10 12 14
0 1 2 3 4 5 6 7 8 9
Figura 12. Curva muerte térmica a 80ºC en caldo BHI a diferente pH
Figura 13. Curva de muerte térmica a 80ºC en caldo compost Tiempo (min)
0 20 40 60 80 100 120 140 160 180 200
Lo
g10
U
F
C
/m
l
0 2 4 6 8 10
pH 5,5 pH 7,0
Tiempo (min)
0 20 40 60 80 100 120 140
Lo
g10
U
F
C
/m
l
0 2 4 6 8 10
[image:41.595.157.427.454.683.2]Figura 14. Curva muerte térmica S. enteritidis a 70ºC en caldo BHI (pH 7.0)
En caldo compost la destrucción de la totalidad de los microorganismos requirió de una menor cantidad de tiempo a temperatura de 80ºC respecto al caldo BHI (pH 7.0 y 5.5), siendo esta de tan solo 75 minutos en caldo compost sin filtrar y de 120 minutos en caldo filtrado (figura 13).
5.5.1 Valor D
En la tabla 6 se presenta el valor D para cada una de las temperaturas y cada uno de los medios empleados, con un valor D lineal y un valor D Tail (con colas) en
donde se tienen en cuenta los valores que no presentaron tendencia lineal decreciente. En el caso de la curva de muerte térmica en caldo BHI a 50ºC no aplica un valor D Tail debido a que el comportamiento de la gráfica fue lineal decreciente
durante todo el tratamiento.
Tiempo (min)
0 20 40 60 80 100 120 140 160
Lo
g10
U
F
C
/m
l
En la tabla 7 se presenta el valor D correspondiente a la cepa de S. enteritidis con la
[image:43.595.103.520.229.387.2]cual se comparó la cepa de estudio, y como era de esperarse los valores son inferiores indicando una menor termorresistencia de la cepa.
Tabla 6. Valor D para cada tratamiento con Salmonella spp.
Medio de cultivo Temperatura (ºC) Valor D lineal (min) Valor D Tail (min)
50 35.7 NA*
60 80.7 24.6
70 73.6 20.9
Caldo BHI pH 7,0
80 40.2 20.2
Caldo BHI pH 5,5 80 17.7 13.1
Caldo compost sin filtrar
24.5 8.1
Caldo compost filtrado
80
31.8 14.52
* No Aplica
Tabla 7. Valor D para S. enteritidis
Medio de cultivo Temperatura (ºC) Valor D lineal (min) Valor D Tail (min)
6. DISCUSION DE RESULTADOS
6.1 Microorganismos de estudio
El banco para el microorganismo de estudio (Salmonella spp.) se realizó con una
concentración inicial de 33 x 108 UFC/ml, manteniéndose constante durante todo el
estudio ya que hasta el sexto mes no se disminuyó la unidad logarítmica, manteniéndose en 108. Para esta clase de microorganismos, se reporta un elevado
porcentaje de supervivencia en distintos medios de conservación, debido a la presencia de factores de virulencia que le permiten soportar temperaturas bajas y ambientes adversos (Meza et al., 2002). Además durante el estudio la cepa no
presentó modificaciones a nivel metabólico y tampoco se registró contaminación de otros microorganismos.
6.2 Elaboración de curvas de crecimiento
La cepa control (S. enteritidis) presentó valores de absorbancia y recuento en placa
(figura 7 y 8) mucho mayores comparados con la cepa de estudio (Salmonella spp).
Esto puede adjudicarse posiblemente al origen “salvaje” de la cepa en estudio ya que en este tipo de microorganismos, adaptados a los ambientes adversos, el metabolismo es más rápido logrando degradar sustratos en un menor tiempo y culminando su ciclo de vida en un período de tiempo mas corto, y ello se evidencia al iniciar la fase estacionaria 2 horas antes que la cepa control, fase en la cual los microorganismos son más resistentes al estrés en comparación con la fase de logarítmica (Taylor-Robinson et al., 2003; O’Bryan et al., 2006). Este factor es
importante ya que en el medio ambiente estos microorganismos son competidores eficientes frente a hongos y actinos que están presentes en el suelo, lo que le permite aumentar la población y de esta manera poder diseminarse dentro del suelo.
(caldo BHI sin suplementos), un período de tiempo de 18 horas para iniciar la fase estacionaria, comparadas con las 8 horas requeridas en este estudio. Esto se debe posiblemente a la elaboración del inóculo previo a la curva de crecimiento, ya que mediante esta metodología se logra un proceso previo de adaptación por parte de la cepa, propiciando de esta forma curvas de crecimiento en menor tiempo (Walker et al., 1990; Gay et al., 1996).
6.3 Microcosmos
La resistencia de Salmonella spp a diferentes tratamientos térmicos ha sido
evaluada principalmente en alimentos como huevos (Garibaldi et al., 1969), leche
líquida (Dega et al., 1972), leche en polvo (Read et al., 1968) carne de pollo
(O´Bryan et al., 2006) y harina de maíz (VanCauwenberge et al., 1981). Sin
embargo son pocos los estudios que reportan la termorresistencia de Salmonella
spp en microambientes a base de compost y en caldo compost, a pesar de ser éste un insumo agrícola que en los últimos años ha adquirido una elevada importancia en los procesos agroindustriales (Tchobanoglous, 1994). Es posible que la falta de datos referenciados esté relacionado con el hecho de que sólo en años recientes se han presentado brotes de Salmonella asociado al consumo de vegetales donde las
fuentes de contaminación han sido el agua y los abonos (Solomon et al., 2002;
Natvig et al., 2002; Warriner et al., 2003).
Al someter las muestras de compost a temperatura de 70ºC durante 9 semanas continuas, se impide el desarrollo normal de éste y por ende el comportamiento no será el típico esperado. Las 3 fases que dividen el proceso, mesófila, termófila y de maduración (Sansford & MacLeod, 1998), no se llevaron a cabo debido al ambiente extremo al cual fueron sometidas, razón por la cual variables dependientes como el pH se vieron afectadas, presentando también un comportamiento anormal durante el estudio.
orgánicos por parte de los microorganismos fermentadores facultativos (Droffner & Brinton, 1995). Durante la primer semana de estudio, el microcosmos exhibió el mismo comportamiento descrito anteriormente presentando una leve disminución en el pH acompañado de la reducción en la población de Salmonella spp (figura 9).
Ésta disminución en el crecimiento puede deberse a que el pH óptimo para
Salmonella spp oscila entre 5.5 y 7.4, siendo los valores más cercanos al neutro los
más favorables para su desarrollo (Weissinger et al., 2000), resultando un pH de 6.0
a temperatura de 70ºC sumamente hostil para su supervivencia ya que se dificulta la síntesis de enzimas extracelulares encargadas de degradar el material orgánico obstaculizándose de esta forma la toma de nutrientes por parte del microorganismo (Tiquia et al., 1998).
Por otro lado, en la primera semana de tratamiento disminuyó la población inicial del tratamiento 1 hasta 5 NMP/4g; y el tratamiento 2 hasta 2.13 NMP/4g, pero en la segunda semana el incremento del pH estuvo acompañado de un alza poblacional que alcanzó los mismos valores en ambos tratamientos, 6.7 y 6.58 NMP/4g, sugiriendo que en ambos tratamientos, independientemente de la concentración inicial de Salmonella spp, el medio posiblemente le proporciona al microorganismo
las condiciones necesarias para recuperarse de la injuria sufrida a causa de la temperatura a la que fue sometida. Estas condiciones hacen referencia al sustrato disponible y a la protección al calor suministrada por las partículas de gran tamaño presentes en el compost (Galindo & Londoño, 2005), ya que como se demostró en estudios llevados a cabo por Natvig et al., (2002) y Franz et al., (2005) un tamaño de
partícula mediano en suelos favorece la retención de agua y disminuye la tensión de oxígeno, incrementando las posibilidades de colonización de los microorganismos, garantizando la sobrevivencia de éstos en el suelo.
A partir de la tercera semana la concentración de Salmonella spp en ambos
tratamientos fué <0.006473 NMP /4g, lo cual sugiere que la cepa al ser sometida a
es inevitable e irreparable (Doyle & Mazzotta, 2000), es allí donde se llega a la destrucción total del microorganismo.
Teniendo en cuenta lo anterior, si bien después de la segunda semana no se encontró crecimiento de Salmonella spp en el microcosmos, es posible que en
compost con poblaciones mayores de éste microorganismo, el tiempo de supervivencia pueda ser mayor, además es importante señalar que a temperatura de 70ºC durante 9 semanas seguidas se puede ver inhibido el crecimiento de actinomycetes, hongos y bacterias esporoformadoras, quienes son los microorganismos encargados de descomponer proteínas, degradar ácidos orgánicos y transformar el nitrógeno en amoníaco, para de esta forma alcalinizar el pH del compost (Sundberg et al., 2004). Esto podría ser la causa del pH ácido del
medio durante todo el tratamiento y uno de los principales factores que limitó el desarrollo de Salmonella spp.
6.4 Curvas de muerte térmica
Las curvas de muerte térmica realizadas tanto en caldo BHI (pH 5.5 y 7.0) como en caldo compost, no muestran una tendencia linear decreciente, por el contrario exhiben un comportamiento particular conocido como shoulders (hombros) o
comportamiento bifásico, el cual puede deberse a varias razones como la heterogeneidad dentro de la población o la adaptación al calor durante el tratamiento térmico (Stringer et al., 2000).
Teniendo en cuenta los controles llevados a cabo en el desarrollo del estudio, la adaptación al calor de la cepa de Salmonella spp durante la elaboración de las
curvas es probablemente la causa por la cual no se presenta un comportamiento linear decreciente. La adaptación al calor por parte de la cepa en estudio puede relacionarse con la síntesis de proteínas de choque térmico y/o el desarrollo de injuria bacteriana (Asselt & Zwietering, 2006).
la población inicial de Salmonella spp. durante los primeros 15 a 30 minutos de
tratamiento, tiempo después del cual se presenta un leve incremento en la población microbiana que se mantiene estable durante cerca de 30 minutos antes de presentar una disminución linear en la población (figura 11 y 12).
Éste fenómeno se atribuye principalmente a la injuria bacteriana, consistente en daños subletales a nivel de rRNA que cambia la fisiología de la célula bacteriana causando pérdida de la integridad de la membrana celular y por consiguiente el desperdicio de una gran variedad de constituyentes intracelulares. Este daño puede ser causado por radiaciones, deshidratación, congelación o temperaturas cercanas al punto de ebullición (Ray, 1993).
A nivel molecular la injuria bacteriana consiste en fenómenos a nivel intracelular: la inducción de la síntesis de proteínas de choque térmico y la degradación de material ribosomal. La inducción de la síntesis de las proteínas de choque térmico (HSP) puede presentarse antes o durante la aplicación de calor y conlleva a un incremento significativo en la resistencia a la temperatura y a otros factores adversos (Lindquist & Craig, 1988).
Adicionalmente, se sugiere que los sobrevivientes iniciales durante un tratamiento térmico pueden con el tiempo ganar protección adicional a partir del material celular proveniente de la muerte de otras células al comienzo de este tratamiento (Humpheson et al., 1998), siendo éste uno de los posibles factores de la
termorresistencia de la cepa si se tiene en cuenta que las curvas de muerte térmica se iniciaron con recuentos de 108 UFC/ml y 10 ml de suspensión inicial, una
cantidad elevada comparada con estudios recientes en donde se emplean cantidades de 0.1 a 1 ml (Brackett et al., 2001; Bacon et al., 2003; Leguérinel et al.,
2007).
aplicación de un tratamiento térmico, la expresión de 7 proteínas con pesos moleculares de 14, 16, 21, 23, 60, 75 y 89 KDa, relacionando su producción con el incremento de la resistencia al calor por parte de estos microorganismos (Xavier & Ingham, 1997). Si bien no se ha comprobado que se trata de proteínas que confieran única y exclusivamente termorresistencia, si se ha reportado su papel en la modificación de la pared celular a nivel de conformación para disminuir la permeabilidad y por ende limitar la pérdida de material intracelular (Xavier & Ingham, 1997; Humpheson et al., 1998). Por consiguiente, es posible que durante el
tratamiento térmico ocurra la producción de proteínas de choque térmico (HSP) en una pequeña cantidad de células y conlleve a la aparición de colas (tails) en las
curvas de microorganismos recuperados.
De igual forma, se ha encontrado que S. typhimurium requiere de la síntesis de
proteínas durante la recuperación después de un tratamiento térmico para sintetizar la subunidad de RNA 17S y proteínas alternas como lo son las de choque térmico (HSP), las cuales le permiten resistir durante mas tiempo el calor y recuperarse en mayor cantidad en un medio de cultivo luego de sufrir injuria (Witter, 1981).
La injuria bacteriana también viene acompañada de la degradación completa de la partícula ribosomal 30S y una ligera alteración de la partícula 50S. Estas dos partículas conforman el ribosoma el cual es responsable de la síntesis de proteínas en la célula. Durante un procedimiento de choque térmico a microorganismos como
Staphylococcus aureus y Salmonella typhimurium se encontró que el RNA 23S,
asociado con la partícula ribosomal 50S, permanecía intacto mientras el 16S, asociado con la partícula ribosomal 30S, era degradado por completo (Witter, 1981).
La concentración inicial de microorganismos con la cual se realizaron las curvas de muerte térmica puede ser fundamental en el comportamiento exhibido por la cepa, debido a que un elevado número de células/ml facilita la interacción célula-célula en el cultivo y la formación de conglomerados que resisten mejor las condiciones térmicas extremas (Taylor-Robinson et al., 2003). De igual forma, una elevada
resultado de una rápida disminución en el oxígeno disuelto (causado por la respiración de las células) que reduce el daño oxidativo al microorganismo (Doyle & Mazzotta, 2000).
Otro factor importante a tener en cuenta es el medio en el cual se lleva a cabo el ensayo. Si se observan detenidamente los resultados se notará la elevada termorresistencia que presenta Salmonella spp en caldo BHI a pH 7,0 en
comparación con el caldo compost (figura 9). Esto puede deberse a que los medios con algún tipo de azúcar (el caldo BHI contiene D (+) glucosa 2g/l) como sacarosa, fructosa o glucosa (Goepfert et al., 1970), tienden a disminuir el aW y deshidratar
parcialmente las células, incrementando de esta forma su resistencia al calor (Corry, 1974; Baird-Parker et al., 1970). En igual sentido, se ha reportado que el calor
favorece la interacción de componentes de bajo peso molecular y cationes divalentes presentes en el medio de calentamiento, con componentes de la superficie celular, resultando en la estabilización de la membrana externa y el subsiguiente incremento en la tolerancia al calor por parte de las células (Sergelidis & Abrahim, 2009).
De la misma forma, sustancias como la trimetilglicina (betaína) y la carnitina (4-trimetilamino-3-hidroxibutirato) presentes en el caldo BHI, han sido reportadas como sustancias termoprotectoras debido a que estabilizan la membrana celular luego de un proceso térmico, e incluso por estimular la síntesis de proteínas de choque térmico (HSP) (Ryser & Marth, 1999; Schultzen et al., 2007). La base molecular de
Igualmente, el medio de recuperación juega un papel fundamental ya que las células injuriadas pueden repararse y crecer en un medio nutritivo pero son incapaces de desarrollarse en un medio selectivo debido al incremento en la sensibilidad hacia ciertos reactivos químicos empleados para aumentar la selectividad en los medios de cultivo (Ray, 1993). Boziaris et al., (1998) reportan que las células de Salmonella
spp y S. typhimurium injuriadas mediante calor se tornan sensibles al desoxicolato,
agente selectivo empleado en el medio xilosa - lisina - desoxicolato (XLD). Las células injuriadas pierden su resistencia normal y se vuelven sensibles a muchos agentes químicos, además de perder compuestos celulares de bajo peso molecular hacia el medio. De esta forma se sugiere que la mayoría de estudios deben emplear medios nutritivos sin agentes selectivos para la recuperación de células injuriadas por tratamientos térmicos (Stephens et al., 1997; Boziaris et al., 1998).
6.4.1 Curva de muerte térmica en caldo BHI a pH 5.5
Por otra parte, el pH juega un papel fundamental como complemento para el calor en el desarrollo de las curvas de muerte térmica, viéndose disminuido drásticamente el tiempo requerido para la inactivación de Salmonella spp a temperatura de 80ºC
en caldo BHI ajustado a pH de 5.5 (figura 12), siendo en este estudio reducido a la mitad comparado con el caldo BHI a pH de 7.0.
Couvert et al., (1999) sugieren que una disminución en el pH del medio de
calentamiento y/o del medio de cultivo para la recuperación reduce la resistencia bacteriana al calor. Igualmente Leguérinel et al., (2007) han demostrado que un
tratamiento térmico para S. typhimurium a pH de 5 reduce el tiempo de
calentamiento en una proporción de 3.5 veces, o con el mismo tiempo de calentamiento, puede reducir la temperatura en 2.25ºC con la misma eficiencia letal. Esto se debe a que el pH ácido del medio altera el orden de los componentes de la membrana celular haciéndola más permeable y por ende más sensible a factores externos (Leguérinel et al., 2007). Del mismo modo, las alteraciones
suministrado al microorganismo afecta de manera más directa el material intracelular denaturando e impidiendo la síntesis de nuevas proteínas.
Sin embargo, Doyle y Mazzotta (2000) reportan un incremento en la termorresistencia de S. enteritidis al disminuir el pH del medio con ácido láctico y
ácido cítrico, pero no al emplear ácido clorhídrico o acético pues se reduce el tiempo de exposición al calor necesario para la destrucción de la cepa, lo que demuestra que en este tipo de ensayos la termorresistencia esta asociada al tipo de ácido utilizado. De este modo, los ácidos inorgánicos al parecer disminuyen la termorresistencia de los microorganismos ya que penetran con mayor facilidad la pared celular alterando su conformación (Humphrey et al., 1995; Kinner & Moats,
1981).
6.4.2 Curvas de muerte térmica en caldo compost
Para esta parte se trabajó con caldo compost filtrado y sin filtrar a temperatura de 80ºC debido a que previamente se había logrado la inactivación total de la cepa a esta temperatura en caldo BHI.
Contrario a los esperado, el caldo compost filtrado presentó mejores condiciones para la supervivencia de Salmonella spp puesto que se logró recuperar la cepa
hasta los 105 minutos de tratamiento, en contraste con los 60 minutos obtenidos en el caldo sin filtrar (figura 13). Al no filtrar el caldo compost se pueden hallar partículas suspendidas de gran tamaño las cuales se esperaría le brindaran protección a la cepa durante el tratamiento térmico, pero contrario a esto, resulto ser un medio que no favorece el desarrollo de la termorresistencia de la cepa, posiblemente por la dificultad de la cepa para degradar las partículas de gran tamaño en busca de nutrientes, debido a que este microorganismo no presenta una maquinaria enzimática capaz de degradar sustratos complejos (Bertoldi et al., 2000).