1
EVALUACIÓN DE RESPUESTAS SISTÉMICAS INDUCIDAS EN PLANTAS DE
FRIJOL Phaseolus vulgaris POR LA INTERACCIÓN CON ACTINOMICETOS
NATIVOS COLOMBIANOS.
JUANITA CAROLINA FERRONI CALDERÓN
TRABAJO DE GRADO Presentado como requisito parcial
Para optar el titulo de
MICROBIOLOGO INDUSTRIAL;
DIRECTORA: MARCELA FRANCO CORREA Ph.D
CO-DIRECTORA: MARIA XIMENA RODRÍGUEZ BOCANEGRA Ph.D
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL BOGOTA
2 NOTA DE ADVERTENCIA
Artículo 23 de la Resolución Nº 13 de Julio de 1946
“La Universidad no se hace responsable por los conceptos emitidos por sus
alumnos en sus trabajos de tesis. Solo velará porque no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el
3
EVALUACIÓN DE RESPUESTAS SISTÉMICAS INDUCIDAS EN PLANTAS DE
FRIJOL Phaseolus vulgaris POR LA INTERACCIÓN CON ACTINOMICETOS
NATIVOS COLOMBIANOS.
JUANITA CAROLINA FERRONI CALDERÓN
APROBADO
____________________________ _____________________________
Marcela Franco Correa Ph.D María Ximena Rodríguez Bocanegra Ph.D Directora Co-Directora
_____________________________
Claudia Ramírez Sandoval M.sc Profesor Asociado
4
EVALUACIÓN DE RESPUESTAS SISTÉMICAS INDUCIDAS EN PLANTAS DE
FRIJOL Phaseolus vulgaris POR LA INTERACCIÓN CON ACTINOMICETOS
NATIVOS COLOMBIANOS.
JUANITA CAROLINA FERRONI CALDERÓN
APROBADO
_____________________________ _____________________________
5
Tabla de contenido
1. INTRODUCCIÓN ... 8
2. OBJETIVOS ... 10
2.1. Objetivo general ... 10
2.2. Objetivos específicos ... 10
3. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN DE LA INVESTIGACIÓN ... 11
4. MARCO TEÓRICO ... 13
4.1. Rizosfera ... 13
4.2. Microorganismos rizosféricos ... 13
4.2.1. Rizobacterias promotoras de crecimiento vegetal (PGPR) ... 13
4.3. Resistencia sistémica inducida (RSI) ... 14
4.3.1. Incremento en la resistencia celular y fortalecimiento de barreras físicas ... 15
4.3.2. Estrés oxidativo ... 16
4.3.3. Peroxidasas ... 16
4.4. El frijol ... 17
5. METODOLOGÍA ... 18
5.1. Preparación del material biológico ... 18
5.2. Determinación de la actividad guayacol peroxidasa ... 20
5.3. Determinación de calosa y suberina por microscopía de fluorescencia ... 21
5.4. Análisis estadístico. ... 22
5.5. Diseño experimental ... 22
6. RESULTADOS Y DISCUSION ... 23
6.1. Actividad guayacol peroxidasa GPX y guayacol peroxidasa GPX específica a nivel de tratamientos ... 23
6.2. Actividad guayacol peroxidasa GPX y guayacol peroxidasa GPX específica a nivel de estados de desarrollo ... 26
6.3. Actividad guayacol peroxidasa GPX y guayacol peroxidasa GPX específica a nivel foliar y radical ... 30
6.4. Presencia de calosa a nivel de los estados de desarrollo ... 33
6.5. Presencia de suberina a nivel de los estados de desarrollo ... 38
7. CONCLUSIONES ... 44
8. RECOMENDACIONES ... 45
9. BIBLIOGRAFIA ... 46
10. ANEXOS ... 53
6
Indice de figuras
Figura 1. Actividades GPX y GPX específica en plantas testigo con agua. ... 23
Figura 2. Actividades GPX y GPX específica en plantas control con fertilizante químico (NPK). ... 24
Figura 3. Actividades GPX y GPX específica en plantas inoculadas con la cepa MCR9... 25
Figura 4. Actividades GPX y GPX específica en plantas inoculadas con la cepa MCR24.………..25
Figura 5. Actividad GPX y GPX específica a nivel de primer estadío muestreado.. ... 27
Figura 6. Actividad GPX y GPX específica a nivel de segundo estadío muestreado.. ... 28
Figura 7. Actividad GPX y GPX específica a nivel de tercer estadío muestreado... 29
Figura 8. Actividad GPX y GPX específica a nivel de cuarto estadío muestreado……….……….29
Figura 9. Actividad GPX y GPX específica a nivel radical. ………..………31
Figura 10. Actividad GPX y GPX específica a nivel foliar…..………..32
Figura 11. Presencia de calosa en el segundo estadío muestreado (Anexos 10.1). ... 33
Figura 12. Deposición inducida de calosa en tejido foliar durante el segundo estadío muestreado, por la cepa MCR9. ... 34
Figura 13. Presencia de calosa en el tercer estadío muestreado (Anexos 10.2). ... 34
Figura 14. Deposición inducida de calosa en tallo durante el tercer estadío muestreado, por la cepa MCR24. ... 35
Figura 15. Presencia de calosa en el cuarto estadío muestreado (Anexos 10.3). ... 36
Figura 16. Deposición inducida de calosa en hoja (izquierda) y tallo (derecha) durante el cuarto estadío muestreado, por la cepa MCR24………...36
Figura 17. Presencia de suberina en el segundo estadío muestreado (Anexos 10.1). ... 38
Figura 18. Deposición inducida de suberina en tejido foliar durante el segundo estadío muestreado, por la cepa MCR9. ... 39
7 Figura 20. Deposición inducida de suberina en tallo durante el tercer estadío muestreado, por la cepa MCR24. ... 40
Figura 21. Presencia de suberina en cuarto estadío muestreado (Anexos10.3). ... 41
Figura 22. Deposición inducida de suberina en hoja (izquierda) y raíz (derecha) durante el cuarto
estadío muestreado, por la cepa
8
1. INTRODUCCIÓN
Las plantas desarrollan resistencia frente a las enfermedades e infecciones causadas por cepas patógenas, provocando un rápido colapso de sus células lesionadas, lo cual se denomina respuesta hipersensible (HR); además de desarrollar múltiples defensas inducidas como la síntesis de fitoalexinas, compuestos oxidantes, fortalecimiento de las paredes celulares, producción de enzimas líticas y proteínas antimicrobianas en las células lesionadas y en aquellas que las rodean (Tenhaken et al., 1995). La respuesta hipersensible puede ser evitada por rizobacterias
promotoras de crecimiento vegetal (PGPR: acrónimo del inglés Plant Growth Promoting
Rhizobacteria) (Jetiyanon et al., 2002), las cuales facilitan la obtención de nutrientes solubles del
suelo; de esta forma promueven el crecimiento de las plantas mediante la fijación de nitrógeno y solubilización de nutrientes como el fósforo, la producción de reguladores de crecimiento vegetal, el incremento de otros microorganismos benéficos nativos del suelo, lo que puede desarrollar en la planta un control de enfermedades microbianas limitando el posible establecimiento de un patógeno, especialmente a nivel radical (Jetiyanon et al., 2002; Mcmillan,
2007; Franco-Correa, 2008).
Las PGPR inducen resistencia sistémica (RSI), la producción de enzimas líticas de pared celular
de algunos microorganismos, como las quitinasas y β-1,3-glucanasas, la síntesis de fitoalexinas, el fortalecimiento de las paredes celulares con la deposición de lignina y calosa y la regulación del estrés oxidativo (Xue et al., 1998). Estudios anteriores han demostrado la capacidad de las
PGPR de inducir resistencia, no solo en raíces sino también en hojas y tallos, sin producir daño a las plantas (Raupach et al., 1996).
El grupo de las PGPR se encuentra conformado por varios géneros y especies; Pseudomonas sp.
y Bacillus sp. son los géneros más reportados. Sin embargo, dentro de las bacterias filamentosas,
Streptomyces sp. es descrito como PGPR debido, entre otros, a la síntesis de compuestos
quelantes de hierro como sideróforos, fijación de nitrógeno, solubilización de fósforo y otras actividades implicadas en la promoción del crecimiento vegetal (Duque y Quintana, 2008; Franco-Correa, 2008). Algunos estudios realizados in vitro con el objetivo de seleccionar
9 sistema radical, producir sideróforos, enzimas líticas y sustancias que regulan el crecimiento vegetal (Sousa et al., 2008).
Por otra parte, la literatura demuestra que los actinomicetos son cuantitativa y cualitativamente importantes en la rizosfera y que pueden influir en el crecimiento de las plantas y proteger sus raíces contra la invasión de hongos patógenos (Crawford, 1993; El-Tarabily, 2006).
Por lo tanto, mediante el estudio de dos cepas de actinomicetos pertenecientes al laboratorio UNIDIA, previamente evaluadas in vitro y caracterizadas como PGPR (Duque y Quintana, 2008;
Franco- Correa, 2008), se espera encontrar en plantas de frijol (Phaseolus vulgaris) un
incremento en la formación de polímeros protectores contra patógenos (calosa y suberina) y en la actividad enzimática peroxidasa, cuya función es prevenir el estrés oxidativo que se produce ante el ataque de un fitopatógeno, además de oxidar compuestos fenólicos a quinonas y peróxido de hidrógeno, los cuales son tóxicos para múltiples microorganismos (Agrios, 2005).
10
2. OBJETIVOS
2.1. Objetivo general
Evaluar la actividad peroxidasa y el fortalecimiento de barreras físicas como un mecanismo de inducción de defensa en plantas de frijol (Phaseolus vulgaris) al interactuar con actinomicetos a
nivel rizosférico.
2.2. Objetivos específicos
Determinar la actividad peroxidasa en Phaseolus vulgaris en respuesta a la interacción rizosférica
con actinomicetos, como mecanismo de defensa inducida.
Detectar el fortalecimiento de las barreras físicas de defensa (suberina y calosa) inducidas en
11
3. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN DE LA INVESTIGACIÓN
Las alternativas biológicas que pueden favorecer el sostenimiento y a la fertilidad del suelo han sido poco estudiadas, por lo tanto es preciso investigar sobre posibles alternativas que potencialicen el uso del suelo y su actividad biológica. Alguna de las posibles alternativas biológicas es el empleo de microorganismos nativos, que induzcan el mejoramiento de estructuras, enraizamiento e incremento en la disponibilidad de nutrientes necesarios para el desarrollo vegetal (Schaudner et al 1992).
La evaluación de respuestas de defensa inducida, reflejada en el fortalecimiento de las barreras físicas de defensa y en el incremento de la actividad peroxidasa, representa un aporte importante para el estudio de esta actividad fisiológica vegetal generada por la interacción con PGPR al mejorar la absorción de nutrientes y agua, generando una mejor competencia frente a la penetración de algún fitopatógeno (Billing, 1987). Asimismo, el incremento de la actividad peroxidasa evita posiblemente un estrés oxidativo e incrementa la catálisis de compuestos fenólicos oxidantes, los cuales contribuyen a la formación de barreras de defensa para el fortalecimiento de la estructura celular (Xue et al., 1998; Chen et al., 2000).
Este proyecto se centra en el estudio de la interacción de cepas de actinomicetos colombianos con plantas de frijol (Phaseolus vulgaris), en el cual se evaluaron algunas respuestas de defensa
sistémica inducida. Esta investigación buscó ajustar metodologías adecuadas para determinar la actividad enzimática peroxidasa y evaluar el fortalecimiento de las barreras físicas de defensa mediante el aumento en la deposición de calosa y suberina. Este ajuste se realizó ante la falta de estudios relacionados con la respuesta producida en la planta frente a la interacción con actinomicetos.
El frijol Phaseolus vulgaris fue escogido como planta modelo para este estudio debido a su
12 Debido a reportes anteriores (Duque y Quintana, 2008; Frnaco-Correa, 2008) que afirman la capacidad de las cepas MCR9 y MCR24 de promover el crecimiento vegetal in vitro (Duque y
Quintana, 2008; Franco-Correa, 2008), se espera en este estudio demostrar que estas cepas son capaces igualmente de promoverlo in vivo, mediante el incremento de la actividad peroxidasa y
13
4. MARCO TEÓRICO
4.1. Rizosfera
El suelo es el producto meteorizado obtenido gracias a la acción de los organismos vivos y el clima. Las interacciones entre los microorganismos del suelo y las plantas se manifiestan de modo especial en la zona que está en contacto con las raíces, llamada rizosfera (Carrillo, 2003).
El término rizosfera hace referencia a la parte del suelo que se encuentra influenciada por las raíces de las plantas y se caracteriza por una alta biomasa y actividad microbiana (Anderson y
Coats, 1994). El “efecto rizosférico” es causado por el incremento de compuestos orgánicos e
inorgánicos provenientes de las raíces de las plantas, entre los cuales se encuentran exudados, secreciones, mucílagos plantulares y lisados (Maier et al., 2009). La característica más
importante de la rizosfera es estimular la actividad bacteriana (Fitter & Hay, 2002).
4.2. Microorganismos rizosféricos
En la rizosfera se encuentran microorganismos saprófitos y simbiontes, los cuales pueden ser patógenos y/o mutualistas. Los microorganismos perjudiciales incluyen los principales patógenos de plantas y la minoría de bacterias, hongos parásitos y no parásitos pertenecientes a la rizosfera. Algunos microorganismos saprófitos benéficos, pertenecientes a diferentes grupos microbianos, son capaces de promover crecimiento en las plantas. Entre estos microorganismos se encuentran los descomponedores de detritos orgánicos, las PGPR y los hongos y bacterias antagonistas de patógenos radiculares (Barea et al., 2004).
4.2.1. Rizobacterias promotoras de crecimiento vegetal (PGPR)
Las PGPR (acrónimo del inglés Plant Growth Promoting Rhizobacteria) (Jetiyanon et al., 2002),
promueven el crecimiento de la planta al cambiar la composición de la microflora presente en la rizosfera produciendo sustancias promotoras de crecimiento que inciden en las plantas (Kloepper
14 características: no invadir internamente los tejidos en plantas, tener una elevada densidad poblacional en la rizosfera después de su inoculación y deben presentar capacidad de colonización en la superficie de la raíz, y como consecuencia, que influyan positivamente en el crecimiento de la planta (Jiménez-Delgadillo et al., 2001; Kloepper, 2004; Franco-Correa, 2008).
Estas bacterias actúan como agentes inductores de resistencia sistémica inducida debido a la capacidad de liderar la protección sistémica vegetal contra fitopatógenos (Wei et al.,1996 ;
Bonaterra et al., 2003; Ji et al., 2006).
Los mecanismos mediante los cuales las PGPR pueden ejercer un efecto positivo sobre el crecimiento de las plantas pueden ser de dos tipos: directos e indirectos. La promoción indirecta del crecimiento consiste en la disminución o la prevención del efecto nocivo causado por microorganismos patógenos, como consecuencia de la síntesis de antibióticos o sideróforos bacterianos, acción de enzimas líticas e inducción de mecanismos de resistencia. La promoción directa del crecimiento ocurre mediante la producción de metabolitos que son utilizados como reguladores de crecimiento, fijación biológica de nitrógeno, síntesis de enzimas reguladoras de fitohormonas y solubilización de fósforo orgánico e inorgánico (Rodríguez et al., 1999; Lucas et
al., 2004; Duque y Quintana, 2008, Bello y Gómez, 2009).
Por lo tanto, su uso como biofertilizantes o agentes inductores de resistencia para el mejoramiento de la agricultura, ha sido de gran interés para numerosos investigadores desde hace varios años (Reynders & Vlassak, 1982; Rodríguez et al., 1999; Vessey, 2003; Malboobi et al.,
2009).
4.3. Resistencia sistémica inducida (RSI)
15 La RSI causada por microorganismos rizosféricos brinda, por definición, protección sistémica a la planta tras la inducción de un elicitor en cada parte de la misma, mientras que otros mecanismos de control biológico no son por lo general sistémicos (Wei et al., 1996). El sistema
de defensa incluye barreras físicas y químicas preformadas, así como defensas inducidas, como el fortalecimiento de las paredes celulares y la síntesis de compuestos antimicrobianos y proteínas (Stacey & Keen, 1996).
4.3.1.Incremento en la resistencia celular y fortalecimiento de barreras físicas
El fortalecimiento de las barreras físicas de defensa incluye la deposición de calosa y suberina. El engrosamiento secundario reduce el posible crecimiento bacteriano en la superficie vegetal y la interacción planta-patógeno (Billing, 1987).
La síntesis y degradación de calosa son administradas por un sistema de enzimas, y sus lugares de actividades están determinadas por los patrones de crecimiento de la planta, el desarrollo de esta y de la respuesta de defensa a los diversos agentes de estrés y patógenos (Voigt et al., 2006). La
calosa es un glucano que presenta enlaces β-(1,3), el cual es importante para la defensa vegetal, pues en tejidos dañados puede rápidamente encerrar células dañadas y cerrar las conexiones que unen los protoplastos a las células adyacentes (Billing, 1987).
Entre los estímulos conocidos para inducir la deposición de calosa se encuentran perturbaciónes mecánicas, estrés ambiental, infección por microorganismos patógenos, entre otros (Radford et
al. 1998). La deposición de calosa ha sido observada en el lugar donde ocurre la penetración por
parte de algún patógeno y ocurre cuando la planta activa sus primeros mecanismos de defensa (Flors et al., 2005; Khöle et al., 1985).
16 Las células suberizadas se encuentran principalmente en el sistema radical de la planta y en términos de función, la suberina contribuye tanto a la fuerza y a la resistencia de la pared celular por la pérdida de agua durante el crecimiento de las plantas y su desarrollo. La suberina se considera un componente importante en heridas inducidas por patógenos como respuesta de defensa en muchas variedades de plantas (Bernards, 2002; Gandini et al., 2006; Franke et al.,
2007).
4.3.2. Estrés oxidativo
El estrés oxidativo es inducido en células vegetales por diversos factores, incluyendo la presencia de metales pesados, contaminantes y heridas, además de la interacción con patógenos o con sus productos. Este tipo de estrés implica la generación de especies activas o reactivas de oxígeno (AOS, ROS). La generación de especias reactivas de oxígeno, provee protección a las plantas ante posibles daños, al participar en procesos de oxido-reducción. Entre las ROS se encuentra el peróxido de hidrógeno, superóxido, radicales hidroxilo, entre otros. Las ROS median la resistencia que pueda adquirir la planta mediante varios mecanismos (Billing, 1987; Rodríguez et
al., 2002).
La liberación de peróxido de hidrógeno y oxígeno libre induce la expresión de genes que retardan directamente el ingreso del patógeno o protegen a la planta de sus propias sustancias microbicidas (Stacey & Keen, 1996).
La generación de superóxido y peróxido de hidrógeno se encuentra directamente relacionada con la interacción con microorganismos patógenos y con la generación de una respuesta hipersensible (HR) (Tenhaken et al., 1995).
4.3.3. Peroxidasas
17 interacciones planta-patógeno se encuentra asociada con una incorporación progresiva de compuestos fenólicos dentro la pared celular; por lo tanto, la actividad peroxidasa debe reducir el nivel de especies reactivas de oxígeno (ROS) mediante el metabolismo del peróxido de hidrógeno (Lagrimini et al., 1987).
4.4. El frijol
El frijol común (Phaseolus vulgaris), al ser una leguminosa, fue escogido para este estudio como
planta modelo debido a su rápido crecimiento.
Esta planta se caracteriza por un sistema radical, originado a partir de la radícula del embrión, que se convierte en raíz primaria y raíces secundarias. El tallo está formado por una sucesión de nudos y entrenudos, tiene una fuerte dominancia apical y su proceso de desarrollo genera nudos, en donde las hojas se insertan en el tallo. Las hojas del frijol pueden ser de dos tipos: simples y compuestas. Las hojas simples pueden ser primarias, que aparecen en el segundo nudo del tallo, son opuestas y unifoliadas, y las hojas compuestas son trifoliadas.
18
5. METODOLOGÍA
5.1. Preparación del material biológico
Se estableció un banco primario de trabajo a partir de los aislamientos de las cepas de actinomicetos pertenecientes al Laboratorio UNIDIA (Unidad de Investigaciones Agropecuarias) de la Pontificia Universidad Javeriana. Estas cepas fueron escogidas por estudios previos realizados in vitro, los cuales demostraron que estas cepas tienen capacidad promotora de
crecimiento vegetal (Duque y Quintana, 2008; Franco-Correa, 2008; Bello y Gómez, 2009). Las cepas seleccionadas para este estudio fueron MCR9 y MCR24, por evaluaciones de promoción de crecimiento previas a este trabajo (Franco-Correa, 2008; Bello y Gómez, 2009). Las cepas se reconstituyeron en cajas de petri con Agar Avena mediante siembra masiva y se incubaron por un período de 7 a 10 días a 22°C (Franco-Correa, 1999). A partir de esta siembra se montaron crioviales con glicerol al 12% y se mantuvieron a una temperatura de –20°C (Bayona, 2003).
En cuanto al manejo de las semillas de frijol (Phaseolus vulgaris), se lavaron con abundante agua
corriente, a continuación se desinfectaron con etanol al 80 % durante 30 s, y se colocaron en hipoclorito de sodio al 5% por 6 min y por último se realizaron 9 lavados con agua destilada estéril. A continuación se preparó el inóculo y se realizó la homogenización del suelo (negro, sin abono y estéril) para el montaje de las semillas en materos.
Posteriormente, se realizó el montaje de los cuatro tratamientos. Se tomó 1 Kg de suelo por cada matero y se sembraron 2 semillas de frijol, este procedimiento se realizó para la cepa MCR9, MCR24 (aislamientos descritos por Franco-Correa, 2008), fertilizante (control) y agua (testigo). La semilla que germinó primero fue la única seleccionada y se dejó en el matero, la otra fue descartada. Para los tratamientos, se tomaron 14 materos por réplica.
A partir de la suspensión de propágulos, se inoculó el suelo previamente esterilizado a una concentración de 1x106 células∙g suelo-1 para los tratamientos con la cepa MCR9 y MCR24.
19 agua y 2.88 g de fertilizante) a cada matero. El fertilizante se adicionó en tres momentos del desarrollo de la planta, al momento de la siembra, en una fase vegetativa (aparición del primer par de hojas verdaderas) y en una fase reproductiva (formación del fruto). Para el tratamiento testigo con agua, el suelo fue humedecido a capacidad de campo.
[image:19.612.78.553.299.726.2]Se realizaron muestreos en cuatro estados de desarrollo de la planta de frijol; en dos estados de desarrollo pertenecientes a la fase vegetativa (despliegue total de hojas primarias y despliegue total de la tercera hoja trifoliada) y en dos estados de desarrollo de la fase reproductiva (aparición del órgano floral y formación del fruto) (ver tabla 1).
Tabla 1. Fenología de la planta de fríjol de acuerdo con la escala BBCH.
Codificación de los estadíos fenológicos del desarrollo del fríjol (Phaseolus vulgaris L.), definidos para este
estudio
Codificación BBCH de los estadíos fenológicos del desarrollo del frijol (Phaseolus vulgaris L.),
correspondientes a los estados de desarrollo definidos para este estudio.
Estado de desarrollo N°1: Despliegue total de las hojas primarias.
Estadio principal 1: Desarrollo de las hojas Código: 10. Descripción: Cotiledones, desplegados
completamente.
Código: 12. Descripción: Dos hojas enteras (1er. par de hojas), desplegadas.
Estado de desarrollo N°2: Despliegue total de la tercera hoja trifoliada.
Estadio principal 1: Desarrollo de las hojas Código: 13. Descripción: Tercera hoja verdadera (1a
hoja trifoliada), desplegada.
Código: 14-18. Descripción: Los estadios continúan hasta ...
Código: 19. Descripción: Nueve o más hojas (2 hojas enteras y 7 o más hojas trifoliadas), desplegadas.
Estado de desarrollo N°3: Aparición del órgano floral.
Estadio principal 5: Aparición del órgano floral Código: 51. Descripción: Primeros botones florales,
visibles fuera de las hojas.
Código: 55. Descripción: Primeros botones florales individuales, visibles fuera de las hojas, pero cerrados
todavía.
Código: 59. Descripción: Primeros pétalos, visibles; muchos botones florales individuales, cerrados todavía.
Estado de desarrollo N°4: Formación del fruto.
Estadio principal 7: Formación del fruto Código: 71. Descripción: El 10 % de las vainas alcanza
la longitud típica 1). Las vainas comienzan a crecer 2).
Código: 72. Descripción: El 20 % de las vainas alcanza la longitud típica 1).
20
la longitud típica 1).
Código: 74. Descripción: El 40 % de las vainas alcanza la longitud típica 1).
Código: 75. Descripción: El 50 % de las vainas alcanza la longitud típica, las judías empiezan a rellenarse 1).
Período principal de crecimiento de las vainas 2). Código: 76. Descripción: El 60 % de las vainas alcanza
la longitud típica 1).
Código: 77. Descripción: El 70 % de las vainas alcanza la longitud típica; las vainas aún se rompen limpiamente
1.
Código: 78. Descripción: El 80 % de las vainas alcanza la longitud típica 1).
Código: 79. Descripción: Vainas: las judías son fácilmente visibles individualmente 1).
5.2. Determinación de la actividad guayacol peroxidasa
A partir de las muestras vegetales tomadas se prepararon los extractos mediante la maceración con nitrógeno líquido partiendo de 2 g de material vegetal (hojas y raíz) (Fernández, 2003). Se homogenizaron con tampón fosfato de potasio (0,1 M y pH 6.0) en proporción 2:1 (mL de buffer: g de tejido) (Schopfer et al., 2001) con 5% (p/p) de PVPP (Rodríguez, 2001) y los
homogenizados se agitaron durante 1 hora en baño de hielo. Posteriormente se centrifugaron a 3500 x g durante 15 min a 4°C y se filtraron a través de 4 capas de gasa; se centrifugaron a 15000
x g a 4°C por 20 min y posteriormente a 13000 x g a 4°C por 15 min (Lagrimini et al., 1987). Los
extractos enzimáticos obtenidos se almacenaron a -20°C hasta su análisis (Fernández, 2003). Posteriormente se determinó la concentración de proteínas totales en cada extracto vegetal mediante el método de Bradford (595 nm) (Bradford, 1976; Rodríguez, 2001), además de determinar la velocidad de reacción de la oxidación del guayacol por la enzima en presencia de peróxido de hidrógeno.
Posteriormente, se registraron los valores de absorbancia en el espectrofotómetro a temperatura ambiente a 470 nm durante 2 min, a intervalos de 0,1 s (Schopfer et al., 2001). Se utilizó como
volumen final de reacción 1 mL y para la medición de la actividad, se empleó la siguiente mezcla en el correspondiente orden: 750 L de tampón fosfato de potasio 0.1 M pH 6.0, 100 L de
21 guayacol 2.8%, 50 L de extracto enzimático y 100 L de peróxido de hidrógeno 3% (Haskins, 1955).
La unidad peroxidasa fue definida como Abs/min y la unidad peroxidasa específica fue definida
como Abs/min/ g de proteína cuantificada mediante el método de Bradford (595 nm) (Rodríguez, 2001).
5.3. Determinación de calosa y suberina por microscopía de fluorescencia
Se removieron segmentos de material vegetal (raíz, tallo y hojas) y se sumergieron en una solución fijadora de formaldehído: ácido acético glacial: etanol al 70%, en una proporción de 10:5:90 (v/v/v) por 24 horas (Sass, 1961; Hao et al., 2008). A continuación se deshidrataron en
siete series progresivas de etanol (70%-100%) por 24 horas cada una, se realizó un proceso de aclarado en xilol por 24 horas durante 2 días, un proceso de imbibición en parafina durante 24 horas y una inclusión en parafina (confección del bloque de parafina) (Sass, 1961). Posteriormente, se realizaron cortes de 7-10 m con un micrótomo rotatorio y se removió el exceso de parafina mediante un baño en xilol, etanol al 95% y agua corriente (Hao et al. 2008).
Consecutivamente, se realizó una tinción con azul de anilina al 0.1 % (p/v) en buffer fosfato de potasio (0,1 M y pH 7.0) y se observó en microscopio de fluorescencia con el set de filtros Leitz
A (UV-365nm) y I 2/3 (azul-495nm) para la determinación cuantitativa de calosa (Schraudner et
al., 1992; Radford et al., 1998).
Para la determinación cuantitativa de células suberizadas se llevó a cabo la misma metodología, sin embargo la fijación del material vegetal se realizó con glutaraldehído al 2.5% durante 7 días y se cortaron secciones de 7–10 m que fueron teñidas con azul de toluidina al 0,1 % (p/v) y se observaron en microscopio de fluorescencia con luz UV (Lux, 2005).
22
5.4. Análisis estadístico.
La información obtenida se analizó en el programa estadístico SPSS Statistics mediante un análisis de varianza para diferencias de medias (ANOVA) de un factor, donde se observó la existencia de diferencias estadísticamente significativas. A continuación se realizó un análisis Post Hoc (Duncan) (α=0,05).
5.5. Diseño experimental
El diseño experimental de este estudio fue de tipo aplicado, porque se realizó con el fin de encontrar una aplicación benéfica a una determinada comunidad (plantas de frijol). La finalidad de este estudio fue analítica, porque mediante muestreos se logró obtener resultados considerados como estimadores de los valores estadísticos, correspondientes a las características de la población. Además de esto, fue aleatorio experimental controlado, porque el investigador intervino directamente la población, en la cual se evaluará un control. Por otra parte, de acuerdo a la medición de variables fue de secuencia temporal longitudinal, porque el monitoreo de la población será a través del tiempo y la direccionalidad fue prospectiva porque la exposición del tratamiento se dio antes de comenzar el estudio.
Población:
Los asilamientos de las cepas de actinomicetos, MCR9 y MCR24, los cuales fueron escogidos por medio de estudios previos realizados in vitro, los cuales demostraron que estas cepas tienen
capacidad de promoción de crecimiento vegetal.
Muestra:
Tejidos de las plantas de frijol inoculadas y no inoculadas.
Variables de respuesta analizadas:
Unidades enzimáticas, para actividad peroxidasa y peroxidasa específica, definidas como Abs/min y Abs/min/ g.
23
Unidad de muestreo:
Hojas, tallos y raíces de plantas inoculadas y no inoculadas.
6. RESULTADOS Y DISCUSION
6.1. Actividad guayacol peroxidasa (GPX) y guayacol peroxidasa (GPX) específica a nivel de tratamientos
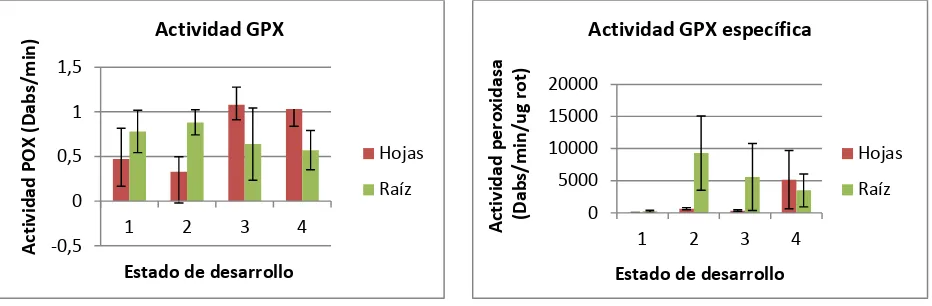
El análisis de varianza (ANOVA) y la prueba Post-Hoc (Duncan) demostraron que para las plantas sometidas al tratamiento testigo con agua, la actividad GPX fue mayor en el tejido radical al momento en que se desplegaron totalmente las hojas primarias (estado de desarrollo N°1) (Sig.0, 000; F. 5,181; α= 0,05). La actividad GPX específica fue también mayor en el tejido radical en las plantas que se encontraban en la etapa de formación del fruto (estado de desarrollo N°4) (Sig. 0,000; F. 8,850; α= 0,05) (Figura 1).
El incremento en la actividad GPX se debe posiblemente a la susceptibilidad que presenta la plántula a diferentes tipos de estrés abióticos. Paralelamente y, debido a un crecimiento rápido de las raíces, se infiere el incremento de sustancias de origen proteico necesarias para iniciar la fase reproductiva (Lambers et al., 1998). Por otro lado, el incremento en la actividad GPX específica,
se explica posiblemente gracias a Schumann y D’Arcy (2006) quienes evidencian, que a medida que el desarrollo de la planta va progresando, la concentración de proteínas y nutrientes presentes en ella, será mayor.
0 0,5 1 1,5
1 2 3 4
A ctiv id ad PO X (Dabs/ m in )
Estado de desarrollo ActividadGPX Hojas Raíz 0 5000 10000 15000 20000 25000
1 2 3 4
A ctiv id ad p e ro xi d asa (Dabs/ m in /u g p ro t)
Estado de desarrollo Actividad GPX específica
Hojas
24 Figura 1. Actividades GPX y GPX específica en plantas testigo con agua. Los estados de desarrollo N° 1 y 2 corresponden a las dos etapas evaluadas pertenecientes a la fase vegetativa (despliegue total de las hojas primarias y despliegue total de la tercera hoja trifoliada) y los estados de desarrollo N° 3 y 4 a las dos etapas de la fase reproductiva evaluadas (aparición del órgano floral y formación del fruto).
Para las plantas sometidas al tratamiento control con fertilizante químico NPK, la actividad GPX fue mayor en el tejido radical al momento de la formación del fruto (estado de desarrollo N°4) (Sig. 0,000; F. 9,458; α= 0,05). La actividad GPX específica fue también mayor en el tejido radical al momento de la aparición del órgano floral (estado de desarrollo N°3) (Sig. 0,000; F.
6,309; α= 0,05) (Figura 2). Los resultados obtenidos se deben posiblemente a que el fertilizante
químico influye de manera significativa en fomentar la secreción de diversas enzimas vegetales, debido al aporte de nutrientes esenciales para el crecimiento y desarrollo de la planta (Fageria et
al.,2002, Schumann y D’Arcy, 2006).
Figura 2. Actividades GPX y GPX específica en plantas control con fertilizante químico (NPK). Los estados de desarrollo N° 1 y 2 corresponden a las dos etapas evaluadas pertenecientes a la fase vegetativa (despliegue total de las hojas primarias y despliegue total de la tercera hoja trifoliada) y los estados de desarrollo N° 3 y 4 a las dos etapas de la fase reproductiva evaluadas (aparición del órgano floral y formación del fruto).
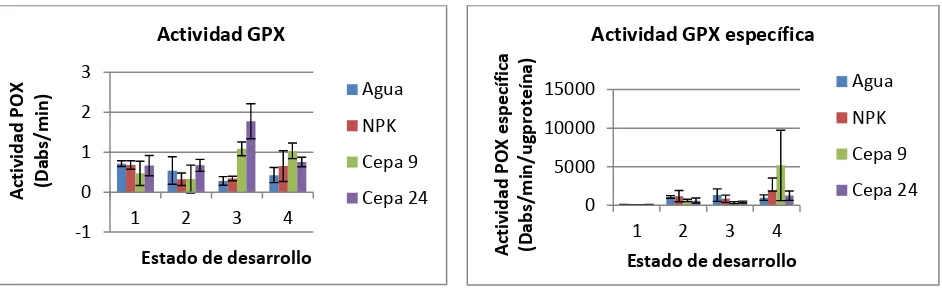
Para las plantas sometidas al tratamiento biológico con la cepa MCR9, la actividad GPX fue mayor en hojas al momento de la floración (Sig. 0,000; F. 8,102; α= 0,05). La actividad GPX
específica fue mayor en raíces de las plantas que se encontraban finalizando el desarrollo de la
tercera hoja trifoliada (Sig. 0,000; F. 8,320; α= 0,05) (Figura 3).
Igualmente, para las plantas sometidas al tratamiento biológico con la cepa MCR24, la actividad GPX fue mayor en tejido foliar al momento de la floración (Sig. 0,000; F. 36, 281; α= 0,05). La
0 0,5 1 1,5
1 2 3 4
A ct iv id ad P OX(D abs/m in )
Estado de desarrollo Actividad GPX
Hojas
Raíz 0
5000 10000
1 2 3 4
A ctiv id ad p e ro xi d asa (Dabs/ m in /u g p ro t)
Estado de desarrollo Actividad GPX específica
Hojas
[image:24.612.87.558.307.451.2]25 actividad GPX específica fue mayor en el tejido radical de las plantas que estaban terminando de desarrollar la tercer hoja trifoliada (Sig. 0,000; F. 13,509; α= 0,05) (Figura 4).
Figura 3. Actividades GPX y GPX específica en plantas inoculadas con la cepa MCR9. Los estados de desarrollo N° 1 y 2 corresponden a las dos etapas evaluadas pertenecientes a la fase vegetativa (despliegue total de las hojas primarias y despliegue total de la tercera hoja trifoliada) y los estados de desarrollo 3 y 4 a las dos etapas de la fase reproductiva evaluadas (aparición del órgano floral y formación del fruto).
Figura 4. Actividades GPX y GPX específica en plantas inoculadas con la cepa MCR24. Los estados de desarrollo N° 1 y 2 corresponden a las dos etapas evaluadas pertenecientes a la fase vegetativa (despliegue total de las hojas primarias y despliegue total de la tercera hoja trifoliada) y los estados de desarrollo N° 3 y 4 a las dos etapas de la fase reproductiva evaluadas (aparición del órgano floral y formación del fruto).
Estos comportamientos se deben posiblemente a la respuesta que la planta genera ante la interacción con un microorganismo rizosférico, en este caso con las cepas de actinomicetos MCR9 y MCR24; la cual genera una respuesta local inmediata en raíces y hojas debido a la capacidad de estas cepas para inducir resistencia sistémica. Esto quiere decir que la resistencia es
-0,5 0 0,5 1 1,5
1 2 3 4
A ct iv id ad P OX (D abs/m in )
Estado de desarrollo Actividad GPX Hojas Raíz 0 5000 10000 15000 20000
1 2 3 4
A ct iv id ad p er oxi d as a (Dabs/ m in /u g r o t)
Estado de desarrollo Actividad GPX específica
Hojas Raíz 0 1 2 3
1 2 3 4
A ctiv id ad PO X Dab s/m in )
Estado de desarrollo Actividad GPX Hojas Raíz 0 2000 4000 6000 8000 10000
1 2 3 4
A ctiv id ad p e ro xi d asa (Dabs/ m in /u g p ro t)
Estado de desarrollo Actividad GPX específica
Hojas
[image:25.612.84.556.373.518.2]26 inducida en tejidos lejanos con respecto al punto de inoculación con los actinomicetos, como en las hojas.
El incremento de esta actividad produce posiblemente la peroxidación de compuestos fenólicos que pueden ser de carácter tóxico para algunos microorganismos y ocurre junto con la síntesis de otros compuestos fenólicos que ayudan a la producción de la lignina. Igualmente, el incremento en la actividad peroxidasa se encuentra asociado con la síntesis de proteínas relacionadas con
patogénesis (Agrios, 2005; Schumann y D’Arcy, 2006).
El incremento inducido en la actividad peroxidasa por la interacción con PGPR, ha sido ampliamente documentado en otros estudios; Chen et al. (2000) reportan la inducción de las
actividades peroxidasa (PO) y polifenol oxidasa (PPO) en plantas de pepino y tabaco inoculadas con Pseudomonas syringae en tejido foliar a los 3 días siguientes a la inoculación. Nandakumar
et al. (2001) evidencian el efecto inhibitorio de Pseudomonas fluorescens ante el crecimiento
micelial de Rhizoctonia solani aumentando in vitro el vigor de las plántulas de arroz, induciendo
así resistencia sistémica (ISR), mediante el incremento de la actividad peroxidasa y quitinasa. Sivakumar y Sharma (2003) refieren un incremento mayor de las actividades peroxidasa (PO), polifenol oxidasa (PPO) y fenilalanina liasa (PAL) en tejido foliar de plantas de maíz inoculadas con Pseudomonas fluorescens, en comparación con aquellas inoculadas con Rhizoctonia solani.
Con actinomicetos no se encuentran estudios relacionados, por lo tanto estos resultados son pioneros en la respuesta de inducción al estudiar la interacción planta-actinomiceto.
6.2. Actividad GPX y GPX específica a nivel de estados de desarrollo
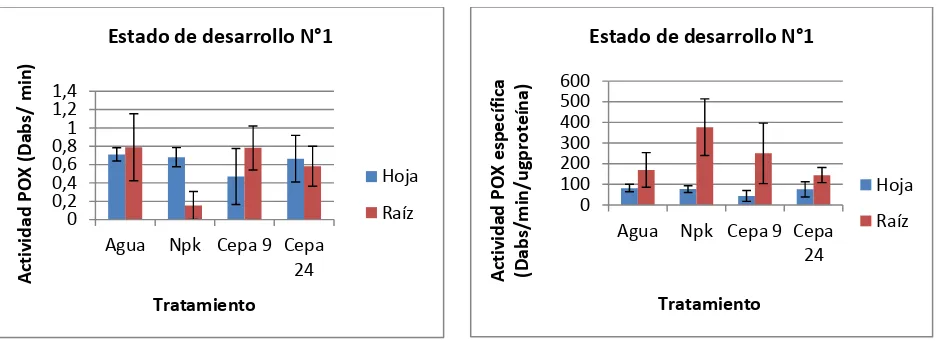
Para las plantas que se encontraban en el estado de desarrollo N° 1 definido anteriormente (ver tabla 1.), la actividad GPX fue mayor en raíces de las plantas sometidas al tratamiento con agua
(Sig. 0,000; F. 6,476; α= 0,05), mientras que la mayor actividad GPX específica se presentó en raíces para plantas fertilizadas con NKP (Sig. 0,000; F. 15,784; α= 0,05) (Figura 5).
Estos resultados se deben probablemente a la susceptibilidad que presenta la plántula en estados tempranos de desarrollo (Lambers et al., 1998), además de la influencia ejercida por el
27 producción agrícola (Zou et al., 1992). Adicionalmente, cada planta necesita cantidades
diferentes de microelementos como algunos iones metálicos, puesto que la mayoría de las enzimas requieren de un ión específico para su funcionamiento (Lambers et al., 1998).
[image:27.612.88.558.156.328.2]
Figura 5. Actividad GPX y GPX específica en plantas que se encuentran en el estado de desarrollo N°1. El estado de desarrollo N° 1 corresponde al despliegue total de las hojas primarias.
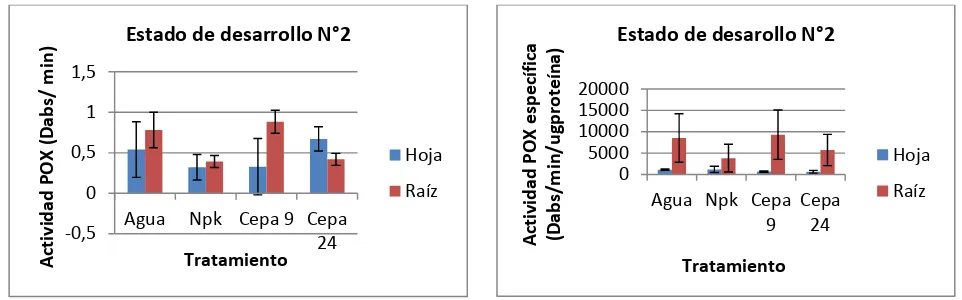
Para las plantas que se encontraban en el estado de desarrollo N° 2 anteriormente definido (ver tabla 1.), la actividad GPX fue mayor en tejido foliar para las plantas sometidas al tratamiento biológico con la cepa MCR9. En cuanto a la actividad GPX específica, fue mayor en tejido radical para las plantas sometidas al tratamiento biológico con la cepa MCR9 (Sig. 0,000; F.
8,081 y 9,160 respectivamente; α= 0,05) (Figura 6).
Los resultados obtenidos se deben probablemente a la respuesta que genera la planta ante la interacción con un microorganismo rizosférico o con PGPR, el cual genera un aumento en las actividades enzimáticas mediante la activación de defensas inducidas (Nandakumar et al., 2001).
El incremento de la actividad peroxidasa se encuentra asociado con una incorporación progresiva de compuestos fenólicos dentro la pared celular (Lagrimini et al., 1987). Adicionalmente, formas
reducidas de NAD y NADP en presencia de enzimas peroxidasas y oxígeno, generan grandes cantidades de peróxido de hidrógeno con capacidad antimicrobiana (Peng y Kuc, 1992).
0 0,2 0,4 0,6 0,8 1 1,2 1,4
Agua Npk Cepa 9 Cepa
24 A ct iv id ad P OX (D abs/ m in ) Tratamiento
Estado de desarrollo N°1
Hoja Raíz 0 100 200 300 400 500 600
Agua Npk Cepa 9 Cepa
24 A ctiv id ad PO X e sp e cí fi ca (Dabs/ m in /u g p ro te ín a) Tratamiento Estado de desarrollo N°1
Hoja
28 Figura 6. Actividad GPX y GPX específica en plantas que se encuentran en estado de desarrollo N°2. El estado de desarrollo N° 2 corresponde al despliegue total de la tercera hoja trifoliada.
La figura 7 muestra que la actividad GPX fue mejor con la inoculación de la cepa MCR24 en hojas al momento de la aparición del órgano floral (estado de desarrollo N°3) (Sig. 0,000; F.
34,338; α= 0,05), mientras que la mejor actividad GPX específica se presentó con la inoculación
de la cepa MCR9 en raíces al momento de la aparición del órgano floral (estado de desarrollo N°3) (Sig. 0,000; F. 6,133; α= 0,05). Estos resultados obtenidos concuerdan con lo reportado por Dutta et al. (2008) quienes observaron un aumento en las enzimas relacionadas con defensa como
POX, PAL y PPO en plántulas de gandul inoculadas con Bacillus cereus, Pseudomonas
aeruginosa (PGPR) y Rhizobium en comparación con las plantas no inoculadas (control).
Análogamente, otros estudios han demostrado que las peroxidasas se incrementan en respuesta a la interacción con un patógeno y que desarrollan un papel importante en la defensa de varias plantas cucurbitáceas (Chen et al., 2000). El patógeno Colletotrichum lagenarium induce
resistencia sistémica en cucurbitáceas y esta respuesta se asocia con un aumento sistémico de las enzimas peroxidasas extracelulares. De igual forma, se ha evidenciado también que las plantas de melón con mayor actividad peroxidasa son más resistentes a Sphaerotheca fuliginea respecto a
aquellas con menor actividad (Reuveni et al., 1992; Xue et al., 1998).
-0,5 0 0,5 1 1,5
Agua Npk Cepa 9 Cepa
24 Ac tiv id ad POX ( Dab s/ m in ) Tratamiento Estado de desarrollo N°2
Hoja Raíz 0 5000 10000 15000 20000
Agua Npk Cepa 9 Cepa 24 A ctiv id ad PO X e sp e cí fi ca (Dabs/ m in /u g p ro te ín a) Tratamiento Estado de desarollo N°2
Hoja
29 Figura 7. Actividad GPX y GPX específica en plantas que se encuentran en estado de desarrollo N°3. El estado de desarrollo N° 3 corresponde a la aparición del órgano floral.
La actividad GPX en la formación del fruto fue mayor en las raíces de las plantas inoculadas con
la cepa MCR24 (Sig. 0,000; F. 9,342; α= 0,05), mientras que la actividad GPX específica fue mayor en las raíces de las plantas testigo con agua (Sig. 0,000; F. 7,105; α= 0,05) (Figura 8). El
incremento de la actividad GPX se debe a la interacción de las plantas con la cepa MCR24 (PGPR), al estar en contacto directo con las raíces de las plantas de frijol. El incremento de esta actividad generado por estés biótico, por contacto directo con el microorganismo es comparable con el aumento de la misma actividad cuando las plantas son sometidas a un estrés abiótico como la presencia de metales, como cobre (Cu) y zinc (Zn) (Cuypers et al., 2002). Con lo anterior se
puede inferir que los actinomicetos, sin ser patógenos, inducen la síntesis de peroxidasas en las plantas de frijol de forma sistémica, por lo cual pueden ser considerados agentes elicitores.
0 0,5 1 1,5 2 2,5
Agua Npk Cepa 9 Cepa
24 A ct iv id ad P OX (D abs/m in ) Tratamiento
Estado de desarrollo N°3
Hoja Raíz 0 2000 4000 6000 8000 10000 12000
Agua Npk Cepa 9 Cepa 24 A ctiv id ad PO X e sp e cí fi ca (D abs/m in /u g p rot eí n a) Tratamiento
Estado de desarrollo N° 3
Hoja Raíz 0 0,5 1 1,5
Agua Npk Cepa 9 Cepa
24 A ctiv id ad PO X ( D ab s/m in ) Tratamiento Estado de desarrollo N° 4
Hoja Raíz 0 5000 10000 15000 20000 25000
Agua Npk Cepa 9 Cepa 24 A cti v id ad PO X e spec íf ic a (D ab s/mi n /u g p ro te in a ) Tratamiento Estado de desarrollo N°4
Hoja
30 Figura 8. Actividad GPX y GPX específica en plantas que se encuentran en el estado de desarrollo N°4. El estado de desarrollo N° 4 corresponde a la formación del fruto.
En general, la presencia de actividades GPX específicas relacionadas con los diferentes estados de desarrollo de la planta evaluados, se debe posiblemente a lo reportado por Azcón-Bieto y Talón (2008), en donde las células vegetales estimulan la producción de ROS al reconocer la presencia de agentes patógenos y está mediada por enzimas peroxidasas de pared celular durante todo el desarrollo de la planta.
6.3. Actividad GPX y GPX específica a nivel foliar y radical
En plantas sometidas al tratamiento biológico con la cepa MCR24, se presentó mayor actividad GPX en tejido radical al momento de la formación del fruto (estado de desarrollo N°4) (Sig.
0,000; F. 10,680; α= 0,05). La actividad GPX específica fue también mayor en raíces al momento de la formación del fruto (estado de desarrollo N°4), para las plantas sometidas al tratamiento testigo con agua (Sig. 0,000; F. 6,980; α= 0,05). Sin embargo, para esta última actividad, la
desviación estándar supera el promedio de los datos obtenidos, debido a la mayor manipulación experimental de las muestras. Por consiguiente, la mayor actividad GPX específica se presentó en raíces de plantas sometidas al tratamiento biológico con la cepa MCR9 al finalizar el desarrollo de la tercera hoja trifoliada (estado de desarrollo N°2) (Figura 9).
Por lo tanto, teniendo en cuenta que el incremento de la actividad enzimática se debe a los tratamientos biológicos, los resultados obtenidos se pueden atribuir a una respuesta local inmediata en estados tempranos de desarrollo (Agrios, 2005). Esta tendencia concuerda con lo reportado por Ramammorthy et al. (2001); en donde se evidencia el incremento de la actividad
GPX en raíces de plántulas de frijol en etapas tempranas de desarrollo, debido a la interacción con Pseudomonas sp., microorganismo clasificado como PGPR (Ramammorthy et al., 2001,
Zahir et al., 2004). Sin embargo, el incremento de la actividad GPX específica puede deberse a lo
reportado por Randhir et al. (2004), donde dicha actividad se encuentra relacionada con la
31 Figura 9. Actividad GPX y GPX específica a nivel radical. Los estados de desarrollo N° 1 y 2 corresponden a las dos etapas evaluadas pertenecientes a la fase vegetativa (despliegue total de las hojas primarias y despliegue total de la tercera hoja trifoliada) y los estados de desarrollo N° 3 y 4 a las dos etapas de la fase reproductiva evaluadas (aparición del órgano floral y formación del fruto).
En las plantas sometidas al tratamiento biológico con la cepa MCR24, la actividad GPX fue mayor en hojas al momento de la aparición del órgano floral (estado de desarrollo N°3). La actividad GPX específica fue mayor en hojas en plantas sometidas al tratamiento biológico con la cepa MCR9, que se encontraban en el momento de la formación del fruto (estado de desarrollo N°4) (Sig. 0,000; F. 19,657 y 7,623 respectivamente; α= 0,05) (Figura 10).
Esto demuestra que ambas cepas (MCR24 y MCR9) inducen resistencia sistémica, dato no reportado antes para estos microorganismos. Esto quiere decir que la síntesis de compuestos fenólicos para la formación de barreras estructurales y el incremento de la actividad peroxidasa, necesaria para reducir ROS generadas en las interacciones incompatibles planta-patógeno, no solo ocurre a nivel de raíz, en donde hubo una menor actividad, además de ser el lugar donde generalmente se presenta; también se presentó en tejidos lejanos al sitio de inoculación, como las hojas (Lagrimini et al., 1987; Burns y Dick, 2002).
0 0,5 1 1,5
1 2 3 4
A ctiv id ad PO X (Dabs/ m in )
Estado de desarrollo Actividad GPX Agua NPK Cepa 9 Cepa 24 0 5000 10000 15000 20000 25000
1 2 3 4
A ctiv id ad PO X e sp e cí fi ca (Dabs/ m in /u g p ro te ín a)
Estado de desarrollo Actividad GPX específica
Agua
NPK
Cepa 9
32 Figura 10. Actividad GPX y GPX específica a nivel foliar. Los estados de desarrollo N° 1 y 2 corresponden a las dos etapas evaluadas pertenecientes a la fase vegetativa (despliegue total de las hojas primarias y despliegue total de la tercera hoja trifoliada) y los estados de desarrollo N° 3 y 4 a las dos etapas de la fase reproductiva evaluadas (aparición del órgano floral y formación del fruto).
Los análisis de varianza (ANOVA) para las actividades GPX en diferentes estados de desarrollo y tejidos, demostraron que el mejor tratamiento es la cepa MCR24 para tejido foliar al momento de la aparición del órgano floral (Sig. 0,000; F. 15,043; α= 0,05). Sin embargo, el ANOVA para
la actividad GPX específica demostró que la mayor actividad se presentó en raíces de plantas sometidas al tratamiento testigo con agua, al momento de la formación del fruto (Sig. 0,000; F. 8,789; α= 0,05). Este comportamiento se debe posiblemente a la ausencia de una inducción previa; por lo tanto se puede inferir que la misma planta activa algunos mecanismos enzimáticos que le permiten proteger el desarrollo de la semilla que se está formando dentro del fruto. Se sabe que el ácido abscísico es un regulador implicado en procesos de crecimiento y desarrollo de las semillas y hay reportes que demuestran que promueve la acumulación de proteínas necesarias para los procesos de embriogénesis (Taiz y Zeiger, 2002).
Con base en estos estudios y reportes nombrados anteriormente (Lagrimini et al., 1987;
Ramammorthy et al., 2001; Burns y Dick, 2002; Randhir et al., 2004; Zahir et al., 2004) se
infiere que el comportamiento de la cepa MCR24 se debe posiblemente a la capacidad inductora de activar mecanismos de defensa en plantas, como el incremento de la actividad GPX en tejidos lejanos a la inoculación, como las hojas; por lo tanto se puede inferir que esta cepa puede ser contemplada como PGPR, no solo a nivel de estudios in vitro, como había sido reportado
anteriormente, también in vivo.
-1 0 1 2 3
1 2 3 4
A ct iv id ad P OX (Dabs/ m in )
Estado de desarrollo Actividad GPX
Agua
NPK
Cepa 9
Cepa 24 0
5000 10000 15000
1 2 3 4
A ctiv id ad PO X e sp e cí fi ca (D abs/m in /u g p rot eí n a)
Estado de desarrollo Actividad GPX específica
Agua
NPK
Cepa 9
33
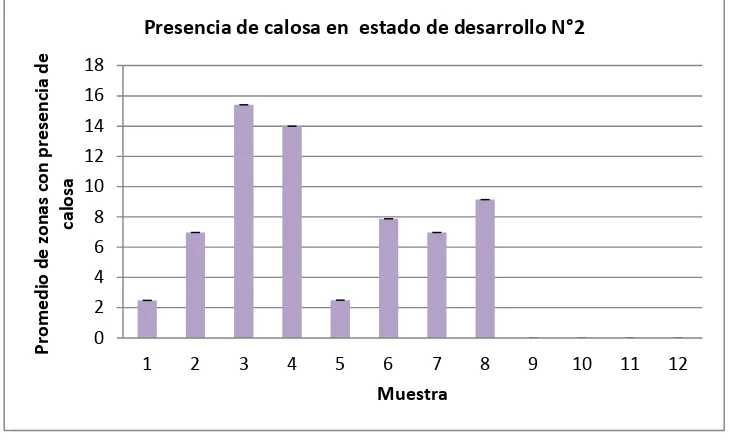
6.4. Presencia de calosa a nivel de los estados de desarrollo
El análisis de varianza (ANOVA) demostró que el tratamiento que indujo mayor deposición de calosa en plantas durante el estado de desarrollo N°2, (ver tabla 1.) fue la cepa MCR9 en hojas
[image:33.612.119.484.181.402.2](Sig. 0,000; F. 120,698; α= 0,05) (Figura 11).
Figura 11. Muestra 1: Tratamiento testigo con agua, hojas. Muestra 2: Tratamiento control NPK, hojas. Muestra 3: Tratamiento biológico con cepa MCR9, hojas. Muestra 4: Tratamiento biológico con cepa MCR24, hojas.
Muestra 5: Tratamiento testigo con agua, tallos. Muestra 6: Tratamiento control NPK, tallos. Muestra 7:
Tratamiento biológico con cepa MCR9, tallos. Muestra 8: Tratamiento biológico con cepa MCR24, tallos. Muestra 9: Tratamiento testigo con agua, raíces. Muestra 10: Tratamiento control NPK, raíces. Muestra 11: Tratamiento biológico con cepa MCR9, raíces. Muestra 12: Tratamiento biológico con la cepa MCR24, raíces.
0 2 4 6 8 10 12 14 16 18
1 2 3 4 5 6 7 8 9 10 11 12
Pr
o
m
e
d
io
d
e
z
o
n
as c
o
n
p
re
sen
ci
a
d
e
cal
o
sa
Muestra
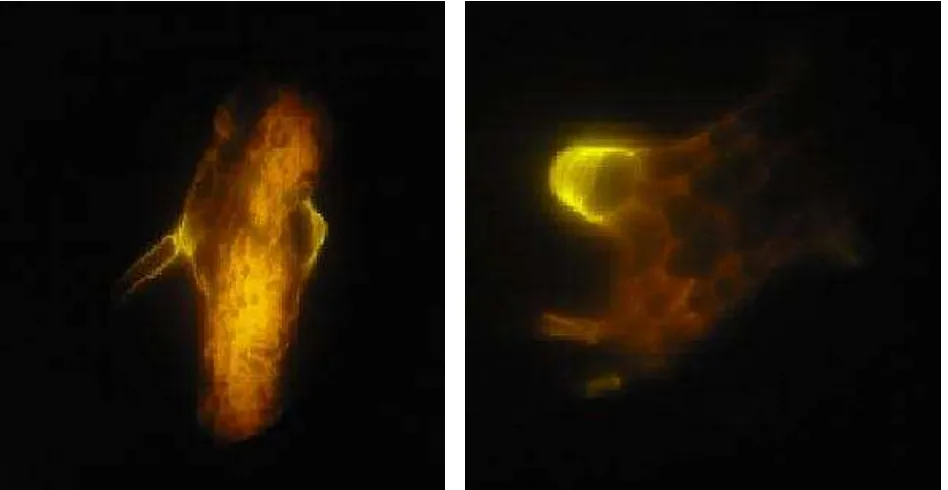
34 Figura 12. Deposición inducida de calosa en tejido foliar durante el estado de desarrollo N°2, por la cepa MCR9.
La cepa MCR24 demostró ser el tratamiento que indujo mayor deposición de calosa en plantas que se encontraban en el estado de desarrollo N°3 (ver tabla 1.), en tallos (Sig. 0,000; F.212, 502;
α= 0,05 (Figura 12).
0 5 10 15 20 25
1 2 3 4 5 6 7 8 9 10 11 12
Pr
o
m
e
d
io
d
e
z
o
n
as c
o
n
p
re
sen
ci
a
d
e
cal
o
sa
Muestra
35 Figura 13.Muestra 1: Tratamiento testigo con agua, hojas. Muestra 2: Tratamiento control NPK, hojas. Muestra 3: Tratamiento biológico con cepa MCR9, hojas. Muestra 4: Tratamiento biológico con cepa MCR24, hojas.
Muestra 5: Tratamiento testigo con agua, tallos. Muestra 6: Tratamiento control NPK, tallos. Muestra 7:
Tratamiento biológico con cepa MCR9, tallos. Muestra 8: Tratamiento biológico con cepa MCR24, tallos. Muestra 9: Tratamiento testigo con agua, raíces. Muestra 10: Tratamiento control NPK, raíces. Muestra 11: Tratamiento biológico con cepa MCR9, raíces. Muestra 12: Tratamiento biológico con la cepa MCR24, raíces.
Figura 14. Deposición inducida de calosa en tallo durante el estado de desarrollo N°3, por la cepa MCR24.
Las plantas inoculadas con la cepa MCR24, en el cuarto estado de desarrollo (ver numeral 5.1.),
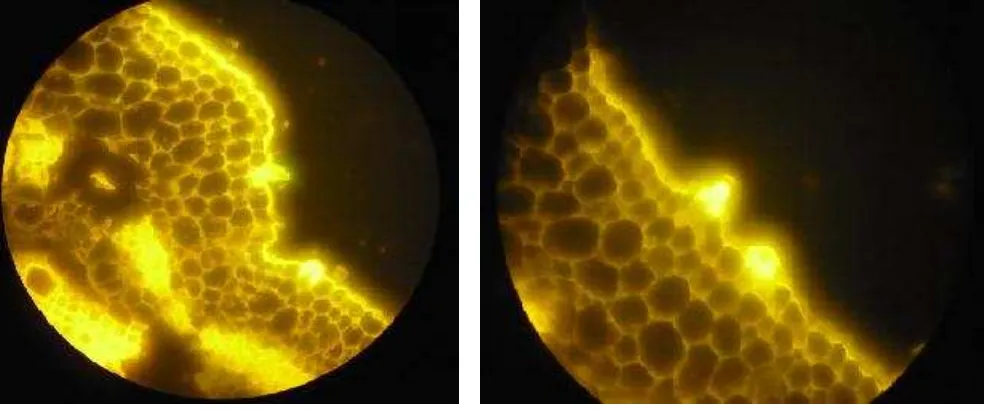
demostraron mayores zonas con presencia de calosa en tallos y hojas (Sig. 0,000; F.152, 704; α=
36 Figura 15.Muestra 1: Tratamiento testigo con agua, hojas. Muestra 2: Tratamiento control NPK, hojas. Muestra 3: Tratamiento biológico con cepa MCR9, hojas. Muestra 4: Tratamiento biológico con cepa MCR24, hojas.
Muestra 5: Tratamiento testigo con agua, tallos. Muestra 6: Tratamiento control NPK, tallos. Muestra 7:
Tratamiento biológico con cepa MCR9, tallos. Muestra 8: Tratamiento biológico con cepa MCR24, tallos. Muestra 9: Tratamiento testigo con agua, raíces. Muestra 10: Tratamiento control NPK, raíces. Muestra 11: Tratamiento biológico con cepa MCR9, raíces. Muestra 12: Tratamiento biológico con la cepa MCR24, raíces.
Figura 16. Deposición inducida de calosa en hoja (izquierda) y tallo (derecha) durante el estado de desarrollo N°4, por la cepa MCR24.
0 5 10 15 20 25
1 2 3 4 5 6 7 8 9 10 11 12
Pr
o
m
e
d
io
d
e
z
o
n
as c
o
n
p
re
sen
ci
a
d
e
cal
o
sa
Muestra
[image:36.612.85.542.441.625.2]37 Los resultados obtenidos con respecto a la deposición de calosa para el estado de desarrollo N°2 (ver tabla 1.) y para el estado de desarrollo N°4 (ver tabla 1.) con los tratamientos evaluados, concuerdan con los reportados por Gregory et al. (2002), en donde se determinó presencia de
calosa en hojas y tallos jóvenes a nivel de pared celular, evidenciando un engrosamiento secundario de los tejidos, en plántulas de frijol (Phaseolus vulgaris) y calabacín (Cucurbita
pepo), bajo condiciones normales de crecimiento.
La tendencia de los resultados obtenidos en el estado de desarrollo N°3 (ver tabla 1.), no concuerda con la reportada por Voigt et al. (2006), en donde se evidenció la presencia de calosa
en haces vasculares en plantas de trigo, principalmente en células adyacentes al raquis y la raquilla. Igualmente, Pérez de Luque et al. (2006) reportan presencia de calosa únicamente en
células del xilema en plántulas de veza (Vicia sativa) ante la interacción con un parásito
(Orobanche sp.).
Los resultados obtenidos determinan que el mejor tratamiento para la inducción de deposición de calosa a nivel sistémico, especialmente en tallos y hojas, es la cepa MCR24; este tratamiento biológico actuaría entonces como una sustancia elicitora de resistencia sistémica inducida (RSI), siendo el primer reporte de inducción de este mecanismo estudiado para estos microorganismos, y sin ocasionar ningún daño a la planta. La deposición de calosa en la pared celular ha sido anteriormente reportada como una defensa inducida que se presenta como respuesta rápida ante el ataque por microorganismos patógenos (Hunt et al., 1997; Radford et al., 1998) o de algún
tratamiento con sustancias elicitoras (Schaudner et al., 1992). Este tipo de respuesta da lugar a la
formación de las barreras estructurales, tales como el engrosamiento de la pared celular, debido a la deposición de calosa (Compant et al., 2005). Por otra parte, la deposición de este polímero ha
sido observada en el sitio donde ocurre la penetración por parte de un agente patógeno (Flors et
al., 2005; Khöle et al., 1985) y, generalmente, la deposición de calosa se presenta como una
solución a largo plazo para daños estructurales en los tubos cribosos del floema, causados por estrés biótico y abiótico, o en la preparación de eventos normales de desarrollo, como es la dormancia (Taiz y Zeiger, 2002).
38 deposiciones de calosa (Voigt et al., 2006). La fluorescencia emitida por los tejidos visualizados
se debe a la utilización del colorante azul de anilina, el cual produce fluorescencia verde-amarilla
brillante en presencia β-1,3 glucanos. La intensidad de fluorescencia emitida depende de la cantidad de calosa que se haya depositado (Bonhoff et al., 1987).
6.5. Presencia de suberina a nivel de los estados de desarrollo
[image:38.612.120.483.282.504.2]La cepa MCR9 indujo mayor deposición de suberina en hojas, en plantas que se encontraban en el estado de desarrollo N°2 (ver numeral 5.1.) (Figura 14).
Figura 17.Muestra 1: Tratamiento testigo con agua, hojas. Muestra 2: Tratamiento control NPK, hojas. Muestra 3: Tratamiento biológico con cepa MCR9, hojas. Muestra 4: Tratamiento biológico con cepa MCR24, hojas.
Muestra 5: Tratamiento testigo con agua, tallos. Muestra 6: Tratamiento control NPK, tallos. Muestra 7:
Tratamiento biológico con cepa MCR9, tallos. Muestra 8: Tratamiento biológico con cepa MCR24, tallos. Muestra 9: Tratamiento testigo con agua, raíces. Muestra 10: Tratamiento control NPK, raíces. Muestra 11: Tratamiento biológico con cepa MCR9, raíces. Muestra 12: Tratamiento biológico con la cepa MCR24, raíces.
0 5 10 15 20 25
1 2 3 4 5 6 7 8 9 10 11 12
p
ro
m
e
d
io
d
e
zo
n
as c
o
n
p
re
sen
ci
a d
e
su
b
e
ri
n
a
Muestra
39 Figura 18. Deposición inducida de suberina en tejido foliar durante el estado de desarrollo N°2, por la cepa MCR9.
La cepa MCR24 indujo mayor número de zonas suberizadas en paredes celulares de tallos en plantas que se encontraban en el estado de desarrollo N°3 (ver numeral 5.1.) (Figura 15).
0 2 4 6 8 10 12 14
1 2 3 4 5 6 7 8 9 10 11 12
p
ro
m
e
d
io
d
e
zo
n
as c
o
n
p
re
sen
ci
a d
e
su
b
e
ri
n
a
Muestra
40 Figura 19. Muestra 1: Tratamiento testigo con agua, hojas. Muestra 2: Tratamiento control NPK, hojas. Muestra 3: Tratamiento biológico con cepa MCR9, hojas. Muestra 4: Tratamiento biológico con cepa MCR24, hojas.
Muestra 5: Tratamiento testigo con agua, tallos. Muestra 6: Tratamiento control NPK, tallos. Muestra 7:
[image:40.612.209.435.173.366.2]Tratamiento biológico con cepa MCR9, tallos. Muestra 8: Tratamiento biológico con cepa MCR24, tallos. Muestra 9: Tratamiento testigo con agua, raíces. Muestra 10: Tratamiento control NPK, raíces. Muestra 11: Tratamiento biológico con cepa MCR9, raíces. Muestra 12: Tratamiento biológico con la cepa MCR24, raíces.
41 La cepa MCR24 indujo mayor deposición de suberina en hojas y raíces en el estado de
[image:41.612.85.528.116.372.2]desarrollo N°4 (ver numeral 5.1.) (Figura 16).
Figura 21. Muestra 1: Tratamiento testigo con agua, hojas. Muestra 2: Tratamiento control NPK, hojas. Muestra 3: Tratamiento biológico con cepa MCR9, hojas. Muestra 4: Tratamiento biológico con cepa MCR24, hojas.
Muestra 5: Tratamiento testigo con agua, tallos. Muestra 6: Tratamiento control NPK, tallos. Muestra 7:
Tratamiento biológico con cepa MCR9, tallos. Muestra 8: Tratamiento biológico con cepa MCR24, tallos. Muestra 9: Tratamiento testigo con agua, raíces. Muestra 10: Tratamiento control NPK, raíces. Muestra 11: Tratamiento biológico con cepa MCR9, raíces. Muestra 12: Tratamiento biológico con la cepa MCR24, raíces.
0,000 2,000 4,000 6,000 8,000 10,000 12,000 14,000
1 2 3 4 5 6 7 8 9 10 11 12
Pr
o
m
e
d
io
d
e
z
o
n
as c
o
n
p
re
sen
ci
a
d
e
su
b
e
ri
n
a
Muestra
42 Figura 22. Deposición inducida de suberina en hoja (izquierda) y raíz (derecha) en el estado de desarrollo N°4, por
la cepa MCR24.
La tendencia de los resultados obtenidos concuerdan con aquellas publicadas por Rammamorthy
et al. (2001), quienes determinaron barreras estructurales inducidas por la presencia de Pseudomonas fluorescens, microorganismo clasificado como PGPR, en células epidérmicas de
semillas de arveja (Pisum sativum); en plántulas de tomate (Solanum lycopersicum), se determinó
un fortalecimiento de las paredes celulares en raíces por deposición de compuestos fenólicos y formación de papilas (acumulación de calosa), los cuales restringen el crecimiento de patógenos como Fusarium oxysporum. Analogamente, Thomas et al. (2007) reportan deposiciones de
suberina y ceras en la pared celular de la epidermis de las raíces de plantas de soya (Glycine max
L.) ante la interacción con Phytophthora sojae, produciendo un engrosamiento secundario de la
corteza.
La resistencia sistémica inducida ejercida por PGPR, incrementa la rigidez de la pared celular y altera las respuestas fisiológicas y metabólicas, produciendo una mayor síntesis de sustancias químicas de defensa ante la interacción con patógenos y /o factores de estrés abiótico. Compant
et al. (2005) reportan un engrosamiento de la epidermis en plantas de tomate, después de la
inoculación de tomate con P. fluorescens. El fortalecimiento de la pared celular ocurre debido a