PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
MICROBIOLOGÍA INDUSTRIAL
AISLAMIENTO DE BACTERIAS LIPOLÍTICAS Y DETERMINACIÓN DE PATÓGENOS HUMANO Escherichia coli y Salmonella sp. A PARTIR DE RESIDUOS ORGÁNICOS
DOMICILIARIOS EN COMPOSTAJE
LEIDY ANDREA CEPEDA PATIÑO SANDRA PATRICIA VALENCIA CÁRDENAS
Directora:
ADRIANA MATIZ VILLAMIL BACTERIOLOGA M. Sc.
Codirectora:
MARÍA MERCEDES MARTÍNEZ MICROBIÓLOGA M. Sc.
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA MICROBIOLOGÍA INDUSTRIAL BOGOTÁ D.C.
NOTA DE ADVERTENCIA
Artículo 23 de la resolución No. 13 de julio de 1946
“La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará porque no se publique nada contrario al dogma y la moral católica y porque la tesis no contenga ataques personales contra persona alguna,
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
MICROBIOLOGÍA INDUSTRIAL
AISLAMIENTO DE BACTERIAS LIPOLÍTICAS Y DETERMINACIÓN DE PATÓGENOS HUMANOS Escherichia coli y Salmonella sp. A PARTIR DE RESIDUOS ORGÁNICOS
DOMICILIARIOS EN COMPOSTAJE
LEIDY ANDREA CEPEDA PATIÑO SANDRA PATRICIA VALENCIA CÁRDENAS
Aprobado:
___________________________ _______________________
Dra. Adriana Matiz Villamil Dra. María Mercedes Martínez Directora Coodirectora
__________________________ _______________________
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
MICROBIOLOGÍA INDUSTRIAL
AISLAMIENTO DE BACTERIAS LIPOLÍTICAS Y DETERMINACIÓN DE PATÓGENOS HUMANOS Escherichia coli y Salmonella sp. A PARTIR DE RESIDUOS ORGÁNICOS
DOMICILIARIOS EN COMPOSTAJE
LEIDY ANDREA CEPEDA PATIÑO SANDRA PATRICIA VALENCIA CÁRDENAS
Aprobado:
_________________________________ ____________________________
Dra. ANGELA UMAÑA MUÑOZ.,M.Phil Dra. Janeth Arias
A Dios por brindarme apoyo para alcanzar todas mis metas…. A mi mama por ser compañera y amiga por su apoyo y compañía durante
la elaboración de este trabajo de grado A mi papa por ser la inspiración de todo lo que hago A mis tios por la confianza y apoyo constante a pesar de la distancia A mis amigas por su amistad y por compartir conmigo esta gran
experiencia
Leidy Andrea Cepeda Patiño
A Dios por haberme acompañado en el transcurso de mi carrera. A mi mami por darme apoyo en los momentos mas difíciles y por infundirme paciencia cuando creí que esto no sería posible. A mi papi por darme ejemplo de no desfallecer y luchar por lo que se quiere. A mis amigos que me brindaron una sonrisa y sus palabras en el momento justo. Por último a mis compañeros de laboratorio por su ayuda incondicional en los
momentos de desesperación.
AGRADECIMIENTOS
A Bioagrícola del Llano S.A. E.S.P., empresa de aseo de Villavicencio por la colaboración prestada durante el desarrollo de este proyecto.
A la Dra. Adriana Matiz directora del presente proyecto, por su dedicación e infinita paciencia, aportando sus conocimientos para el desarrollo de este trabajo.
A la Dra. Maria Mercedes Martínez codirectora del presente proyecto, por el aporte de sus conocimientos y su paciencia para concluir con éxito este trabajo.
A todos aquellos que de una u otra forma colaboraron con nuestro trabajo e hicieron posible que este se llevara a cabo.
TABLA DE CONTENIDO
Pág.
1.-INTRODUCCIÓN 1
2.- MARCO TEÓRICO 2
COMPOSTAJE 2
2.1.1 Beneficios del Uso del Compost 2
2.1.2 Factores de Importancia 3
• Equilibrio carbono/nitrógeno 3
• Temperatura 4
• Humedad 5
• pH 6
• Aireación 6
• Tamaño de partícula 7
• Ambiente 7
• Porcentaje de líquido efectivo (% LE) 7
2.2 PROPIEDADES FÍSICO QUÍMICAS DE LOS RESIDUOS COMPOSTABLES 8
2.2.1 Propiedades Físicas. 8
2.2.2 Propiedades Químicas. 8
2.3 ESTRUCTURA DE LÍPIDOS Y GENERALIDADES DE LAS LIPASAS 8
• Lípidos simples 9
• Lípidos complejos 9
2.4 LIPASAS 10
2.4.1 Métodos de Determinación de Lipasas 12
2.4.2 Enzimas Termoestables 12
2.4.3 Enzimas en el Tratamiento de Residuos 14
2.4.4 Importancia Industrial de las Enzimas Lipolíticas 14
2.4.5 Microorganismos reconocidos Biotecnológicamente como Productores de
Lipasas 16
2.5 IMPORTANCIA DE LOS INOCULANTES BIOLÓGICOS. 17
2.6 MICROORGANISMOS PATÓGENOS
3.- JUSTIFICACIÓN 21
4.- OBJETIVOS 23
4.1 Objetivo General. 23
4.2 Objetivos Específicos. 23
5.- METODOLOGÍA 24
5.1 REACTIVACIÓN DE CEPAS 24
5.2 FASE DE LABORATORIO 24
5.2.1 MUESTREO 24
5.2.2 PROCESAMIENTO DE LAS MUESTRAS 25
5.2.2.1 Aislamiento de bacterias con actividad lipolítica 25 5.2.2.2 Identificación microscópica y macroscópica de las colonias 26
5.3 BANCO DE CÉLULAS PRIMARIO (Conservación de Cepas) 26
5.4 PRUEBAS DE ANTAGONISMO 26
5.5 CURVAS DE CRECIMIENTO 28
5.5.1 Producción del inóculo 28
5.5.2 Fermentación Discontinua 28
5.6 TÉCNICA COLORIMÉTRICA P-NITROFENIL PALMITATO PARA ACTIVIDAD
LIPOLÍTICA 28
5.6.1 Curva Patrón de p-nitrofenol 28
5.6.1.1 Evaluación y estandarización cuantitativa de actividad lipolítica 29
5.6.1.2 Prueba preliminar de actividad enzimática 29
5.7 DETERMINACIÓN DE MICROORGANISMOS PATÓGENOS Escherichia coli y
Salmonella sp 31
5.7.1 Determinación de microorganismos patógenos Salmonella sp 32
5.7.2 Determinación de Escherichia coli 33
5.8 FASE DE CAMPO
34
5.8.1 Determinación de pH y Temperatura 34 5.8.2 Análisis Físico Químico de las muestras 34
6. RESULTADOS Y DISCUSIÓN 36
6.1. Procesamiento de las muestras 36
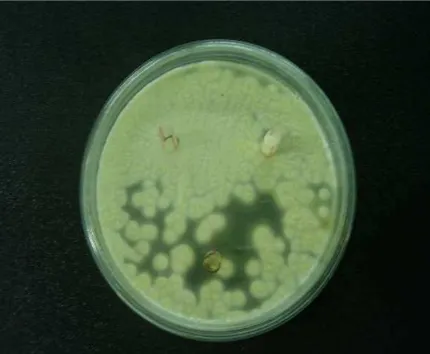
6.1.1 Aislamiento de bacterias con actividad lipolítica 36
6.1.3 Criopreservación de cepas 40
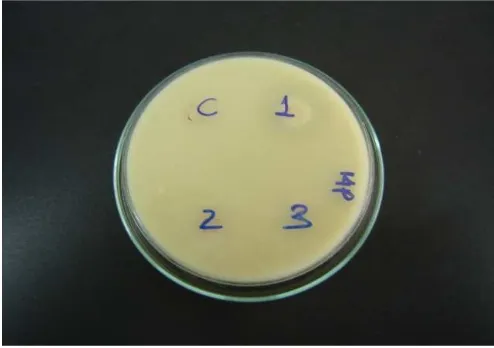
6.1.4 PRUEBAS DE ANTAGONISMO 40
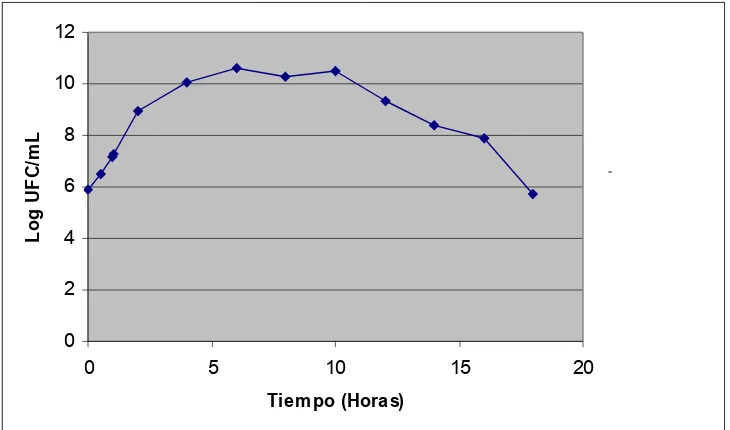
6.2 CURVAS DE CRECIMIENTO 42
6.3 CURVA DE CALIBRACIÓN 45
6.3.1 Actividad Lipolítica 45
6.3.1.1 Estandarización del tiempo de contacto entre sustrato y extracto crudo 45 6.3.1.2 Estandarización de diferentes concentraciones de sustrato 46 6.3.1.3 Estandarización con diferentes volúmenes de extracto crudo 20 ul, 500 ul y 700 ul 49
6.4 Toma de muestras 51
6.4.1 Determinación de pH y temperatura 52
6.5 ANÁLISIS DE MICROORGANISMOS PATÓGENOS Escherichia coli y Salmonella sp 55 6.5.1 NMP de Salmonella sp con medio Rappaport Vassiliadis semisólido modificado 56
6.5.2 NMP Escherichia coli 59
6.6 ANÁLISIS FÍSICO QUÍMICOS 61
7.- CONCLUSIONES 64
8.- RECOMENDACIONES 65
9.- REFERENCIAS 66
LISTA DE TABLAS
Pág.
Tabla 1. Tiempo y temperatura de eliminación de patógenos comunes en
materiales orgánicos. 5
Tabla 2. Microorganismos productores de lipasas 17
Tabla 3.Tabla guía para la lectura indicadores de Presencia de Salmonella sp 32
Tabla 4 Cepas presuntivas lipolíticas 37
Tabla 5. Identificación macroscópica y microscópica de las colonias 39 Tabla 6. Promedio de resultados de las pruebas antagónicas 41 Tabla 7 a,b,c Promedio de No de colonias características en medio XLT4 y BS 57
LISTA DE FIGURAS
Pág.
Figura 1. Mecanismos de acción de las lipasas (Arpigny y Jaeger, 2000). 11
Figura 2 a. Cepa aislada L1 38
Figura 2 b. Cepa aislada L2 38 Figura 2 c. Cepa aislada L3 38
Figura 3 a. Cepa L1 Bacilos Gram negativos 39
Figura 3 b. Cepa L2 Bacilos Gram negativos filamentosos 39
Figura 3 c. Cepa L3 Bacilos Gram negativos 40 Figura 4. Enfrentamiento de cepas lipolíticas sin halo de inhibición 41 Figura 5. Enfrentamiento de cepas lipolíticas con las cepas del inóculo 42 Figura 6. Curva de producción de biomasa en función del tiempo Cepa L3 43
Figura 7. Curva de crecimiento Cepa L2 44
Figura 8. Tiempo de Contacto 46
Figura 9. Evaluación de las diferentes concentraciones de sustrato 47 Figura 10. Curva de UL al 1 ٪ y producción de biomasa en función del tiempo 47 Figura 11. Segunda evaluación de diferentes concentraciones de sustrato 48 Figura 12 Curva UL al 1.5 ٪ y producción de biomasa en función del tiempo 48
Figura 13. Estandarización de los diferentes volumenes de extracto crudo 50 Figura 14. Estandarización de los diferentes volumenes de extracto crudo 50
Figura 15. Conformación de las pilas 52
Figura 16. Medición de temperatura 52
Figura 17. Resultados de pH y temperatura vs tiempo durante el proceso de compostaje
de residuos orgánicos 53
Figura 18. Medio semisólido Rappaport V con halo de aclaramiento 56
Figura 19. Medio XLT4 con colonias presuntivas. 57
Figura 20. Medio BS con colonias presuntivas 57
Figura 21. Resultados de bioquímicas para identificación de Salmonella sp 58 Figura 22. Turbidez e indol positivo 59
LISTA DE ANEXOS
Pág.
Anexo 1. Medio Leche- Almidón al 1% 77
Medio Líquido TSB 77
Medio Rappaport Vassiliadis Modificado 77
Medio Lecitina 78
Anexo 2. Promedios de Temperatura y pH de las 3 réplicas 79
Anexo 3. Preparación de Buffer Fosfato Concentración 1 M 83
Anexo 4. Curva Patrón p-nitrofenol 84
Anexo 5. Promedio de absorbancias de actividad enzimática 85
Anexo 6. Recuentos de las cepas aisladas 89
Anexo 7. Resultados pruebas de antagonismo 90
Anexo 8. Pruebas Bioquímicas de las Colonias Positivas para Salmonellla sp 91 Anexo 9. Requisitos específicos de fertilizantes o abonos orgánicos minerales
Y enmiendas orgánicas según NTC 5167 (Icontec 2004) 92
RESUMEN
La Empresa “Bioagrícola del Llano S.A E.S.P” ubicada en Villavicencio (Meta) ha venido desarrollando desde el 2003 un plan integral en cuanto a la disposición de residuos sólidos urbanos (RSU) generados en esta región, como residuos de plaza, industria pecuaria, cocinas, entre otros. Es por esto que, actualmente se llevan a cabo procesos de transformación de estos residuos mediante el compostaje aeróbico, produciendo un bioabono rico en nutrientes y de buenas condiciones según la norma NTC 5167. Esta empresa ha venido desarrollando un importante proyecto de aprovechamiento y transformación de residuos urbanos sólidos mediante el proceso de compostaje enriquecido con inoculantes microbianos termófilos, compuestos por 14 cepas amilolíticas y proteolíticas.
Este proyecto de investigación se fundamenta en el aislamiento de microorganismos lipolíticos, a partir de 3 replicas de pilas de compostaje de residuos orgánicos (plaza 55%, poda, contenido ruminal y cascarilla de arroz). Igualmente se estandarizó la técnica que permitió la evaluación y determinación de la actividad lipolítica generada por la cepa 3, mediante el manejo de diferentes tiempos de contacto entre la enzima producida y el sustrato (p-nitrofenil), como fueron 30 minutos y 60 minutos, así como también fueron utilizados diferentes concentraciones de sustrato 0.08% (p/v), 0.5% (p/v), 1% (p/v), 1.5% (p/v) y 2%(p/v).
Los resultados determinaron como tiempo óptimo de contacto 30 minutos pero en las diferentes concentraciones de sustrato y volumen demuestra, no se presentaron diferencias significativas. De la misma manera, la cepa 3 obtuvo UL del orden de 30.73UL corroborando una actividad muy baja relacionada con su biomasa que fue de 30*109
UFC/ml. Así mismo se llevó a cabo un análisis de microorganismos patógenos humanos Escherichia coli y Salmonella sp al inicio y al final del proceso arrojando resultados positivos al inicio y al final y un NMP de Salmonella sp < a 0.006473 NMP/4g.
ABSTRACT
"Bioagrícola del Llano SA ESP" located in Villavicencio (Meta) has been developing since 2003 a comprehensive plan regarding the provision of municipal solid waste (MSW) generated in this region, such as waste plaza, livestock industry, kitchens , among others. That is why, now being carried out processing of this waste through aerobic composting, producing a bioabono rich in nutrients and good conditions under the rule NTC 5176. The company has been carrying out a major project for the use and conversion of municipal solid waste through composting process enriched inoculators microbial thermophilic, composed of 14 strains amilolityc and proteolityc.
This research project is based on the isolation of microorganisms lipollitycs, from the assembly of 3 replicas of bacteria composting of organic waste (plaza 55%, pruning, rumen contents and cascarilla). They also standardized technique that permitted the evaluation and determination of the activity lipolityc generated by the strain 3, through handling different times of contact between the enzyme and substrate produced (p-nitrofenil), as were 30 minutes and 60 minutes, they were used as well as different concentrations of substrate 0.08% (w / v), 0.5% (w / v), 1% (w / v), 1.5% (w / v) and 2% (w / v).
The results identified as optimum time to contact 30 minutes but in different concentrations of substrate and volume shows there was no significant difference. In the same way, the strain 3 obtained UL order 30.73 UL corroborating a very low related to biomass that was 30 * 109 CFU / ml. It also took out an analysis of human pathogens Escherichia coli and Salmonella sp at the beginning and end of the process yielding positive results at the beginning and end and an MPN Salmonella sp <a 0.006473 NMP/4g.
1.-INTRODUCCIÓN
La generación de residuos sólidos municipales, varía en función de diferentes factores asociados a los niveles de ingreso, hábitos de consumo, desarrollo tecnológico y calidad de vida de determinada población, es por esto, que en la actualidad se busca una eliminación segura de dichos residuos para evitar problemas de salud pública y ambiental.
La Empresa “Bioagrícola del Llano S.A E.S.P.” ubicada en Villavicencio (Meta) ha venido desarrollando desde el 2003 un plan integral en cuanto a la disposición de residuos sólidos urbanos (RSU) generados en esta región, como residuos de plaza, industria pecuaria, cocinas, entre otros. Es por esto que, actualmente se llevan a cabo procesos de transformación de estos residuos mediante el compostaje aeróbico, produciendo un bioabono rico en nutrientes y de buenas condiciones según la norma NTC 5176 (Anexo 10). Este sistema ha sido optimizado, mediante el uso de un inoculante biológico acelerante, compuesto por 14 cepas nativas termofílicas con actividad proteolítica y amilolítica (Galindo et al., 2005). Este inoculante ha sido evaluado con diferentes porcentajes de materias primas utilizadas, en la búsqueda de la optimización del proceso y por ende, en la calidad del producto obtenido (bioabono), gracias a la actividad enzimática proteolítica y amilolítica de los microorganismos del inoculante.
2.- MARCO TEÓRICO
2.1 COMPOSTAJE
El compostaje es la descomposición biológica y la estabilización de sustratos orgánicos, bajo condiciones controladas que desarrollan temperaturas termófilas como un resultado del calor producido biológicamente, y genera un producto final que es estable, libre de patógenos y semillas de plantas y puede ser aplicado benéficamente al suelo (Stefan et al., 2006). En el compostaje la fase sólida del material orgánico sirve de soporte físico, matriz de intercambio de gases, fuente de nutrientes orgánicos e inorgánicos, vertederos para los productos residuales metabólicos y aislamiento térmico (Sylvia et al., 1998).
Los principales objetivos del proceso son estabilizar materia orgánica putrescible, conservar la mayor cantidad de nutrientes y materia orgánica como sea posible, y generar un producto uniforme y relativamente seco conveniente para usar como acondicionador de suelo y suplemento para jardines o para disponer en tierra.
2.1.1 Beneficios del Uso del Compost
El compost se obtiene industrialmente por la transformación biológica de la materia orgánica. De esta transformación resulta un bioabono o acondicionador de suelos, apto según las características fisicoquímicas y microbiológicas, para la fertilización, tanto por la mejora del suelo como soporte fisicoquímico, como en relación con la capacidad de retención de agua, y presencia de agregados y microorganismos (MacGregor et al., 2001).
Los ácidos resultantes de los procesos de degradación de la materia orgánica disuelven parte de los productos minerales del suelo y los hacen aprovechables para la nutrición de las plantas. Los organismos actúan como promotores de crecimiento, controladores biológicos y remediadores de suelo.
arrastrado por las aguas de lluvia o de riego a capas más profundas fuera del alcance del sistema radicular (Macgregor et al., 2001).
Igualmente, la modificación de las características físico - químicas del terreno hace que se incremente el grado de disponibilidad del fósforo y potasio para la planta.
El compost incorpora al terreno micro y oligo elementos (cobre, magnesio, zinc, manganeso, hierro, boro, etc.) que son muy necesarios para la actividad y desarrollo vegetativo de las plantas. Otra característica importante es que reduce la necesidad de pesticidas químicos al producir plantas saludables que son menos atacables por plagas de insectos, enfermedades y heladas (Trautmann yOlynciw, 1999).
Físicamente, la aplicación de compost reduce la erosión y mejora la estructura del suelo, la retención de agua y el drenaje (Vásquez, 2003).
2.1.2 Factores de Importancia
Hay varias condiciones críticas para la elaboración óptima de compost. Debe haber una humedad adecuada (50-60% de contenido de agua), evitando el exceso (70% o superior), puesto que interfiere con la aireación y reduce el autocalentamiento. La relación carbono-nitrógeno no debería ser mayor de 40:1(Atlas y Bartha, 2001).
• Equilibrio carbono/nitrógeno
En la composición elemental del sustrato, se encuentra la cantidad relativa de carbono, nitrógeno, fósforo, azufre y otros nutrientes. Además de la composición, es necesario conocer la calidad de los sustratos para determinar el rango de descomposición (Silvya, et al 1998).
hortalizas y orujos de frutas). El nitrógeno será aportado por el estiércol, el purín, las leguminosas verdes y los restos de animales de mataderos. Todo se debe mezclar de manera tan homogénea como sea posible materiales pobres y ricos en nitrógeno, y materiales secos y húmedos (Vásquez, 2003).
Un contenido menor de nitrógeno no permite la formación de biomasa microbiana suficiente. Una proporción excesiva de nitrógeno (C:N= 25:1 o menos) causa la volatilización del amonio, produce malos olores, y baja el valor fertilizante del compost resultante (Atlas y Bartha, 2001).
• Temperatura
Al inicio del proceso de desprende gran cantidad de calor, etapa termófila, la temperatura en el material a compostar puede subir hasta los 60 ó 70ºC, la actividad bacteriana aumenta rápidamente. Debido al aumento de temperaturas, una gran cantidad de agua del material se evapora. El oxígeno tiene que llegar a todo el material, por lo que el material requiere de una buena ventilación. En esta etapa los microorganismos atacan la materia más fácilmente biodegradable (Roder, 1998).
La actividad metabólica de los microorganismos, al actuar sobre los sustratos orgánicos, libera energía. Parte de la energía generada al interior de la pila de compostaje es utilizada por los microorganismos, y otra parte es liberada al ambiente en forma de calor, es por esto que el incremento de la temperatura es reflejo de la actividad microbiana sobre la materia orgánica. Uno de los efectos de la temperatura sobre la pila de compostaje es la eliminación de microorganismos patógenos (Fundases, 2006).
Es importante tener en cuenta que para determinado grupo de microorganismos existen rangos de temperatura y tiempos de exposición (tabla 1).
Tabla 1. Tiempo y temperatura de eliminación de patógenos comunes en materiales orgánicos.
Microorganismo Tiempo Temperatura
Salmonella sp. 1 hora 55ºC
Escherichia coli 1 hora 55ºC
Brucela Abortus 1 hora 55ºC
Fuente: EPA, 1992
El diseño de un proceso de compostaje debe tener en cuenta la destrucción de patógenos, ya que la presencia de ellos afecta los cambios normales de temperatura.
Estos organismos prefieren temperaturas por debajo de los 42ºC, ya que normalmente viven a la temperatura corporal del hombre y animales, o a la temperatura ambiental de las plantas. En la fase termofílica del compostaje se busca eliminar patógenos con el fin de minimizar focos de contaminación y establecer un bioabono óptimo para ser aplicado a cultivos de consumo directo.
Las técnicas para la preparación de compost se les señalan como muy efectivas para el control de microorganismos patógenos y la tasa de mortalidad de estos microorganismos esta en función del tiempo y de la temperatura. Cuando el proceso de compostaje funciona correctamente se pone de manifiesto que la mayoría de los organismos patógenos mueren cuando se exponen todas las partes de la pila a temperaturas de 55 ºC (Luque, 1997).
• Humedad
El agua es requerida por los microorganismos para desarrollar sus funciones metabólicas, además, es utilizada como vehículo de trasporte de nutrientes y productos de desecho.
En la pila de compostaje, el balance de la humedad es importante, ya que bajos valores afectan el metabolismo microbiano, mientras que altos valores de humedad, conllevan a la acumulación de agua en las cavidades intersticiales, dificultando la difusión de O2 y
favoreciendo las condiciones de anaerobiosis.
Así pues, la humedad de la pila de compostaje debe oscilar entre el 60 al 70% (Fundases, 2006).
• pH
Un pH entre 5.5 y 8.5 es óptimo a los microorganismos del compost. En las fases tempranas del proceso los ácidos orgánicos excretados por los hongos y bacterias aumentan, hay un crecimiento fúngico y se empieza la degradación de lignina y celulosa. Si el sistema se vuelve anaeróbico la acumulación ácida puede bajar el pH hasta 4.5 y limitar la actividad microbiana; en estos casos la aireación es importante para volver el pH hasta sus rangos óptimos (Trautmann y Olynciw, 1999).
Así mismo es importante resaltar como se menciona en estudios recientes que la actividad enzimática lipolítica se ve afectada por factores como el pH, la temperatura, la composición del medio y la aireación, mostrando mayor afinidad por pHs alcalinos debido a que se presenta una mejor solubilización de los productos de hidrólisis formados (Chahinian et al., 2005).
• Aireación
Se trata de un proceso aerobio (requiere oxígeno) por lo que es importante mantener una aireación adecuada. Para ello, se han de mezclar materiales pastosos (lodos de depuradora, estiércol) con otros que aumenten la porosidad (paja, virutas, etc). Los materiales de excesivo tamaño (restos de poda), es conveniente triturarlos previamente para que descompongan más fácilmente. Una forma de mantener una adecuada aireación durante el compostaje es mediante volteos periódicos o con aireación forzada. El material de los materiales a compostar debe variar entre los 35 y los 75 mm (Trautmann y Olynciw, 1999).
Otra forma de oxigenar las pilas de compost son los métodos de aireación directa, ya sea por succión o por presión (Roder, 1998).
• Tamaño de partícula
cuando la partícula es demasiado pequeña se unen inhibiendo la circulación de aire en el compost, y por ende el oxígeno disponible para los microorganismos, minimizando su actividad (Trautmann y Olynciw, 1999).
Es importante tener en cuenta el tamaño de las partículas, todos los tipos de residuos verdes con excepción del pasto deben ser triturados para optimizar el proceso de degradación ya que ésta otorga propiedades como agrandar la superficie para que el microorganismo pueda actuar, reduciendo el material original a un volumen del 30 % (Stock, 2002).
• Ambiente
En climas fríos y húmedos conviene situarlo al sol y al abrigo del viento, protegiéndolo de la lluvia con una lámina de plástico o similar que permita la oxigenación. En zonas más calurosas es mejor situarlo en un lugar sombreado para evitar la desecación (Vásquez, 2003).
• Porcentaje de líquido efectivo (% LE)
Este parámetro se utiliza cuando hay presencia de lípidos (grasas y aceites) en los materiales a compostar debido a que ellos son líquidos a las temperaturas de tratamiento y causan interferencia en la medición de humedad. Se ha encontrado que el porcentaje LE debe estar entre el 68% y el 70 % de acuerdo con diversos estudios (Pérez, 1999).
2.2 PROPIEDADES FÍSICO QUÍMICAS DE LOS RESIDUOS COMPOSTABLES
2.2.1 Propiedades Físicas.
estructura y estabilidad del suelo, la textura y su permeabilidad ya que regula el balance hídrico del suelo y reduce el riesgo de erosión porque los suelos compactos se sueltan y los arenosos se compactan por la acción de la materia orgánica (Vásquez, 2003).
2.2.2 Propiedades Químicas.
La aplicación de residuos orgánicos y desechos de una amplia variedad de actividades humanas a suelos arables ha recibido atención alrededor del mundo por una potencial mejora en la fertilidad del suelo e incremento en el contenido de materia orgánica. Los residuos orgánicos son raramente aplicados al suelo en estado fresco o crudo. Generalmente, ellos son procesados para obtener materia orgánica estabilizada, madura, con producción de sustancias húmicas (Gigliotti et al., 2002).
En la materia orgánica procesada, una parte de las sustancias orgánicas es soluble en agua, por esta razón, un impacto inmediato de la aplicación de materiales orgánicos sobre los suelos agrícolas es la liberación de materia orgánica dentro de la solución del suelo (Gigliotti et al., 2002).
2.3 ESTRUCTURA DE LÍPIDOS Y GENERALIDADES DE LAS LIPASAS
Los lípidos (del griego, lipos, grasa) se encuentran en todos los organismos vivos y desempeñan un papel indispensable en el mantenimiento de la vida. Sin embargo a diferencia de las proteínas y los carbohidratos, los lípidos son en extremo polimórficos y difíciles de definir estructuralmente (Horton, 2003).
Aunque las estructuras de los lípidos son con frecuencia complejas, comparten en su estructura partes similares. Los lípidos más sencillos son los ácidos grasos, ácidos monocarboxílicos de la fórmula general R-COOH, en donde R representa una cola de hidrocarburo.
Los lípidos se pueden clasificar de diferentes maneras, aunque en general se dividen en:
eicosanoides, los polihidroxialcanoatos, las cutinas, las suberinas, los cianolípidos, los acilgliceroles (o acilglicéridos), las ceras, las ceramidas, los lipoaminoácidos y lipopéptidos, los lípidos fenólicos, los terpenos, los alcaloides isoprenicos, las quinonas lipidicas y los esteroides (Rivera y García, 2007).
● Lípidos complejos: son aquellos que contienen glúcidos en su estructura, y los que están formados por tres o más tipos de moléculas diferentes. Incluyen a los gliceroglicolípidos, los glicerofosfolípidos, las esfingomielinas, los gangliósidos, los cerebrósidos, los lipoaminoácidos glicosídicos, los acilglicósidos, los lipopolisacáridos y los proteolípidos, entre otros (Rivera y García, 2007).
De los lípidos mencionados, los ácidos grasos y los acilglicéridos son de especial interés. Los ácidos grasos están formados por cadenas hidrocarbonadas saturadas o insaturadas que contienen al menos un grupo carboxílico en uno de sus extremos. Estas moléculas intervienen en múltiples funciones biológicas, y están en la base de la biosíntesis del resto de lípidos (Rivera y García, 2007). Una variedad de lípidos anfipáticos, que incluyen los glicerofosfolípidos y los esfingolípidos, son componentes de importantes de todas las membranas biológicas (Horton, 2003).
Los acilglicéridos están formados por uno, dos o tres ácidos grasos esterificados a una molécula de glicerol (mono, di y triacilglicéridos, respectivamente), y están, implicados en varias funciones biológicas: reserva energética, aislamiento, señalización intra e intercelular, etc. Estos compuestos pueden ser hidrolizados mediante soluciones alcalinas (saponificación), o mediante la actividad de unas enzimas llamadas lipasas que liberan un ácido graso (Cheetham, 2005).
Por otra parte, los lípidos están envueltos en diferentes procesos biológicos. La estructura de la membrana celular depende de la combinación de ciertas proteínas y lípidos específicos.
organismo a otro (Beisson et al., 2000). Los microorganismos han sido la principal fuente de extracción de diversas enzimas.
Las lipasas son parte de la familia de las hidrolasas, catalizan la hidrólisis de triacilglicéridos en la interfase lípido-agua. Además de su rol fisiológico en la hidrólisis de grasas neutras, las lipasas catalizan la hidrólisis o síntesis enantio- y regio-selectiva de una amplia variedad de sustratos naturales tales como soya, aceite de pescado, ricino y frutas cítricas (Björkling et al., 1991), así mismo pueden llevar a cabo la esterificación, interesterificación y transesterificación en medios no acuosos (Houde et al., 2004).
Estas enzimas presentan su pH óptimo entre 8 y 9, también se han reportado lipasas con pH óptimo ácido. En cuanto a la temperatura, la mayoría trabaja apropiadamente en el rango de 30-40ºC, algunas son activas a temperaturas bajas como 29ºC. El calcio parece estimular la actividad de la mayoría de las lipasas, mientras que los agentes quelantes y los iones de metales pesados las inhibe (López, 1999).
2.4 LIPASAS
Son usadas para hidrolizar lípidos produciendo ácidos grasos y glicerol, las reacciones más importantes en las cuales las lipasas están implicadas son reacciones quirales debido a la posibilidad de resolver mezclas racémicas (Sánchez, 1999).
En algunos organismos, las grasas y los aceites (triacilgliceroles) funcionan como depósitos de reserva de energía metabólica. En algunos casos, los lípidos llevan a cabo funciones biológicas como moléculas individuales; en otros interactúan con otras biomoléculas para realizar una función como parte de un complejo o a un agregado. Los complejos lipídicos comprenden las lipoproteínas (partículas compuestas de lípidos y proteína), y los agregados lipídicos incluyen las membranas biológicas (capas delgadas compuestos de lípidos, proteínas y algunas veces carbohidratos) (Horton, 2003).
Las lipasas son una clase de enzimas de rápida producción, poseen actualmente nuevas aplicaciones en la industria de hidrocarburos en síntesis orgánica y han expandido su penetración en la producción farmacéutica. El primer objetivo son las lipasas bacterianas y fúngicas porque éstas son más fáciles de producir, modificar por tecnología de DNA recombinante (Snellman y Cowell, 2004).
Ambientalmente las lipasas son utilizadas en inoculantes como depurador de tratamientos cloacales y como tratamiento para hidrolizar grasa en residuos sólidos y líquidos como una alternativa de sustitución de productos de origen químico (Sánchez, 1999).
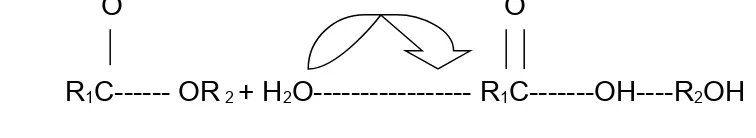
O O
[image:26.612.111.489.432.501.2]R
1C--- OR
2+ H
2O--- R
1C---OH----R
2OH
Figura 1. Mecanismos de acción de las lipasas (Arpigny y Jaeger, 2000). 2.4.1 Métodos de determinación de lipasas
hidrolizar los acilglicéridos o sus correspondientes análogos, métodos, basados en la neutralización de la acidez generada por los ácidos grasos libres, métodos tensiométricos que miden cambios en la tensión superficial de las monocapas lipídicas, métodos radiométricos que utilizan sustratos marcados radiactivamente, y otros métodos para la detección de la actividad lipolítica o de las propiedades fisicoquímicas de estas enzimas tales como ensayos conductimétricos, turbidimétricos, resonancia magnética nuclear, microscopia de fuerzas atómicas, cristalografía, etc. (Beisson et al., 2000).
Por otro lado, estas enzimas son caracterizadas por tener una amplia actividad ya que catalizan un gran rango de reacciones, usando así para ser evaluadas la técnica de p -nitrofenil laurato (sustrato), la cual en estudios recientes ha demostrado que dichas enzimas lipolíticas tienen en su mayoría un alto contenido de ácidos hidrofóbicos (60.2%) (Neerupmaa y Jagdeep, 2006).
Así mismo, la mayoría de las enzimas lipolíticas han sido estudiadas según sus propiedades químicas. Entre estas se encuentran la dependencia a la actividad de los iones Ca2+, pH y temperatura (Arpigny y Jaeger, 2000).
2.4.2 Enzimas Termoestables
Las enzimas son los catalizadores de las reacciones de los sistemas biológicos cuyas dos principales características son la extrema especificidad y la óptima velocidad de reacción. La estructura de la membrana celular depende de la combinación de ciertas proteínas y lípidos específicos (Rivera y García, 2007).
Las enzimas estables se encuentran generalmente en organismos adaptados a vivir en condiciones hostiles. Actualmente, hay un gran interés en las enzimas de organismos ya que se han realizado gran cantidad de estudios sobre la relación estructura-estabilidad de las enzimas provenientes de dichos microorganismos (Hubble, 1990).
gran proporción de lípidos saturados en las membranas, lo cual impide la fusión a esas temperaturas (Atlas y Bartha, 2001). Muchos microorganismos termófilos producen enzimas que no se desnaturalizan a altas temperaturas. A veces, las proteínas de los termófilos presentan secuencias de aminoácidos poco frecuentes que estabilizan dichas proteínas a temperaturas elevadas. Cuando se sobrepasa el máximo de temperatura de crecimiento, los ribosomas se funden y cesa la síntesis de proteínas. Muchos termófilos tienen proporciones muy altas de guanina y citosina en su ADN, que eleva el punto de fusión y añade estabilidad a la molécula de ácido nucléico del organismo (Atlas y Bartha, 2001).
Las termoenzimas son aquellas que se producen a temperaturas aproximadas de 60ºC y 80ºC (hipertermófilos). Son resistentes a la denaturación irreversible y óptimamente activas a altas temperaturas (60-120ºC), por lo cual son usadas en muchos procesos industriales (Zeikus et al., 1998).
Estas formas termófilas de vida son de interés, no solo desde el punto de vista biológico sino porque poseen ventajas industriales y biotecnológicas. Las enzimas de termófilos son capaces de catalizar reacciones bioquímicas a altas temperaturas y son generalmente más estables; esto se debe a la presencia de los puentes de hidrógeno, interacciones hidrofóbicas, intercambio iónico, unión a metales y puentes disulfuro; lo que prolonga la vida útil de las enzimas (Páez et al., 2000).
2.4.3
Enzimas en el tratamiento de residuosLa aplicabilidad de grupos enzimáticos depende de la capacidad de hidrolizar polímeros complejos para incrementar su posterior degradación microbiana. Dentro de éstas se incluyen empleo de lipasas asociados a cultivos bacterianos para eliminar depósitos de grasa procedentes de diversas industrias, como embutidos o láctea, entre otras. Así mismo en estudios recientes se ha demostrado que combinando microorganismos aislados del agua residual de una industria de alimentos con microorganismos lipolíticos termófilos se acelera el proceso de compostaje al ser utilizados éstos, mezclados en un inoculante (Tsai et al., 2006).
Otras enzimas degradadoras de polímeros utilizadas en forma similar son las celulasas, amilasas y proteasas. Además de esta hidrólisis de materiales poliméricos existen también aplicaciones de enzimas capaces de degradar compuestos tóxicos que podrían ocasionar la inhibición de procesos fundamentados en el desempeño microbiológico.
2.4.4 Importancia industrial de las enzimas lipolíticas
Pocas enzimas lipolíticas son las que han sido aisladas en forma pura y cristalizada, y poco se conoce acerca de su estructura y función. Las enzimas lipolíticas han cobrado gran atención por su potencial aplicación en biotecnología (Benjamín y Pandey,1998). Muchas son las aplicaciones que se han encontrado para las lipasas, en la industria del aceite, la producción de farmacéuticos, agroquímicos y componentes aromáticos (Jaeger, 1999).
Las lipasas son usadas en dos distintos ámbitos. Ellas son usadas en la catálisis para la manufactura de otros productos (como ingredientes alimentarios) y por sus aplicaciones (producción de químicos). Todas ellas presentan una gran eficiencia cuando son empleadas en la industria (Cheetham, 2005).
manufactura alimentaria y, las lipasas, se usan actualmente en la producción de una variedad de productos como quesos y alimentos preparados (Ashok et al., 1999)
En la mayor parte de los casos la producción de enzimas debe ser inducida por la adición de aceites y grasas. Aunque se reconocen casos en que las grasas no tienen efecto sobre la producción de estas. Las lipasas están generalmente unidas a las células por tanto inhiben la superproducción pero mediante la adición de un catión como magnesio; las lipasas se liberan y esto conduce a un título mayor de enzimas en el proceso de producción (Sánchez, 1999).
Entre otras aplicaciones, estas enzimas se utilizan en la industria alimentaria (producción de aromas, emulgentes, etc.), en química orgánica (síntesis de antibióticos, pesticidas, producción de compuestos enantiopuros, etc.), en detergencia (aditivos en detergentes, producción de surfactantes para jabones y productos de limpieza, etc.), en la industria papelera (eliminación del “pitch”, de tintas, etc.), así como en el tratamiento de productos residuales o tóxicos, en biosensores, en la producción de biodiesel, etc (Bornscheuer, 2002).
La importancia de estas aplicaciones ha llevado a la optimización de las reacciones catalizadas por las lipasas, a mejoras en la producción y purificación de estas enzimas, así como a la obtención de lipasas con nuevas propiedades catalíticas o una mayor estabilidad, lo que se ha conseguido mediante la modificación de enzimas ya existentes, o mediante el aislamiento de nuevas lipasas (Wiseman, 1995).
2.4.5 Microorganismos reconocidos biotecnológicamente como productores de lipasas
Las lipasas han sido aisladas de una gran variedad de microorganismos pero una de las primeras fuentes ha sido la especie Bacillus, la cual además de la producción de lipasas, produce otras enzimas de interés industrial como son las celulasas, amilasas, elastasas, etc.
de una gran variedad de esteres carboxílicos y liberan ácidos orgánicos y glicerol. Todas ellas muestran una alta especificidad sobre los sustratos (Rivera y García, 2007).
En años recientes, más de 30 lipasas fueron asiladas de cepas de Rhizopus y muchas de ellas han sido caracterizadas (Rivera y García, 2007). Las lipasas de Rhizopus están relacionadas con las lipasas de Rhizomucor miehei (existe una homología >55%), éstas tienen una alta especificidad en la posición 1,3 de triglicéridos, las cuales las hacen muy versátiles en la modificación de lípidos.
En estudios recientes en la ciudad de Suiza se determinó en la fase termofílica del compost el gen Thermus perteneciente a Bacillus stearothermophillus, aislado de un proceso de compostaje con residuos de cocina y de poda. Este compost alcanzó una temperatura máxima reportada de 80°C la cual es óptima para el crecimiento de este microorganismo(Beffa et al., 2006).
[image:31.612.86.515.499.556.2]Las enzimas termoestables pueden ser obtenidas de organismo mesofílicos y termofílicos; se han obtenido algunas enzimas termofílicas a partir de organismos psicrófilos (Imamura y Kitaura, 2000). Los principales organismos de los cuales se han extraído enzimas de interés industrial son hipertermófilos Pyrococcus furiosus y Thermotoga sp (Adams et al., 1995). Otros organismos como hongos son productores de lipasas termoestables (Tabla 2).
Tabla 2. Microorganismos productores de lipasas
Organismo Temperatura óptima ºC pH Óptimo
Candida Antarctica 70 6.5
Candida curvata 50-60 6.5
Mucor miehei 40 7.0
Fuente: (Rivera y García, 2007).
Entre los microorganismos reportados como mayores productores de enzimas lipasas termofílicas se encuentra el género de Bacillus sp, siendo la especie mas destacada B. thermocatenolatus, éstos producen dos lipasas extracelulares termoestables las cuales dependen de la edad del cultivo (Nerupmaa y Jagdeep, 2006).
Se han encontrado estudios recientes de levaduras productoras de lipasas como: Candida rugosa la cual produce lipasa extracelularmente y es ampliamente utilizada para propósitos industriales. Una preparación comercial de lipasa de esta levadura puede separase en varias izoenzimas, con varios mecanismos como: diferente contenido de carbohidratos, punto isoeléctrico, substrato específico y secuencia primaria (Neerupma, 2006).
2.5 IMPORTANCIA DE LOS INOCULANTES BIOLÓGICOS.
Los inoculantes biológicos están clasificados como: biofertilizantes, biocontroladores y acelerantes.
Los biofertilizantes o abonos biológicos tienen como principio activo microorganismos vivos (bacterias y hongos) que promueven y benefician la nutrición y el crecimiento de las plantas. Desde el punto de vista de una agricultura sostenible, el uso de biofertilizantes representa una importante alternativa para limitar el uso de abonos químicos, reduciendo su negativo impacto ambiental y económico, y mejorando la productividad de los cultivos enfocado al óptimo crecimiento vegetal permitiendo así un mejor aprovechamiento de los recursos naturales del suelo, por estas razones la producción de bio-insumos agrícolas ha cobrado importancia (Cuevas et al., 2000).
Es evidente que un desarrollo exitoso de esta tecnología debe ir ligado a la generación de conocimiento básico que conduzca a una mayor comprensión de los fenómenos asociados al proceso de nutrición vegetal promovidos por los inoculantes (Lozano, 2005).
utilización de inoculantes biológicos a partir de microorganismos mesófilo - termófilos ha traído grandes beneficios en compostación de residuos domésticos, industriales y hospitalarios.
En estudios recientes en una industria láctea, se realizó una prueba de compostaje de campo, comparando un inoculante comercial con un inoculante que tenía cepas nativas, observando al final del proceso, la eficiencia de las bacterias nativas y la óptima utilización de estas en la degradación de diversos desechos producidos por la industria en estudio (Moreno et al.,2001).
De la misma forma, otro proyecto de investigación fue el realizado en la ciudad de Sogamoso (Boyacá), donde se evaluó la acción de un inóculo termofílico con actividad enzimática proteolítica, amilolítica, lipolítica y celulolítica, acelerador del proceso de compostaje en residuos sólidos municipales. En la prueba de campo se verificó la eficiencia del inoculante aplicado sobre la pila experimental, se evidenció la reducción del tiempo de degradación a ocho semanas, ya que el tiempo del proceso de compostaje era de 16 semanas. Por otra parte, este proceso garantizó el mejoramiento de las características fisicoquímicas y la eliminación de patógenos en el producto final (Palomino et al., 2002).
En diversos proyectos se ha obtenido un rendimiento óptimo a partir de inoculantes correspondiente a la tasa de degradación de cada tipo de residuo a tratar, sin alterar de modo alguno la calidad del producto final; por el contrario se ha logrado la producción de un compost con alto contenido de elementos como nitrógeno, fósforo y potasio, que ayudan a aumentar la viabilidad de los suelos (Moreno et al., 2001).
El control sanitario del compost es de vital importancia, éste debe ser tratado de manera adecuada debido a que será utilizado como biofertilizante o nutriente del suelo, ya sea en agricultura orgánica o inorgánica, dando lugar a la contaminación de los productos y/o de las fuentes de aguas, por lo que su aplicación descontrolada constituye un peligro para la salud pública y una amenaza para el medio ambiente por la exposición a microorganismos patógenos que esto representa (Fundases, 2006).
Los patógenos son causantes de enfermedades y pueden pertenecer a cualquiera de las clases de microorganismos, bacterias, hongos, virus, ricketsias y protozoos. El diseño de un proceso de compostaje debe tener en cuenta la destrucción de patógenos, ya que la presencia de ellos afecta los cambios normales de temperatura (Islam et al., 2004).
A lo largo del proceso de compostaje, se espera una reducción total de los agentes patógenos por acción de diferentes condiciones como pH, temperatura, humedad, sustancias antibióticas, entre otros.
Salmonella sp. es una bacteria Gram negativa, predominantemente móvil, anaerobia facultativa, que al ser un microorganismo patogénico de tipo entérico causa salmonellosis en animales y humanos (EPA Método 1682, 2006). De igual manera Salmonella sp. puede causar una deshidratación crónica y muerte en los niños mientras que en el ganado puede causar abortos. Una vez la vaca es infectada con Salmonella su erradicación es difícil ya que hay cepas resistentes a antibióticos. Además, puede transmitirse por contacto directo de animales (Islam et al., 2004) Así mismo, Salmonella sp, es uno de los patógenos entéricos más estudiados encontrados en el compost. Es conocido que la temperatura de 55°C por 15 días es letal para los miembros de este grupo (EPA, 1682).
3.- JUSTIFICACIÓN.
constituida el 17 de agosto de 1995, a fin de atender a la necesidad surgida de la Ley 142 de 1994, que aplica a aquellas entidades que realizan actividades prestadoras de servicios públicos domiciliarios, alcantarillado, aseo, entre otros.
De ésta manera la empresa se ha orientado en una gestión que promueve el mejoramiento continuo de los procesos y la satisfacción de los usuarios. Por esta razón, se han obtenido reconocimientos por los avances efectuados en materia de disposición final y compensación ambiental efectuada en el relleno sanitario “Don Juanito”, el cual en la actualidad es el Parque Ecológico Reciclante en esta ciudad.
Así mismo, esta empresa es la encargada de realizar la recolección y transporte de residuos sólidos domiciliarios y comerciales. En la actualidad se reciben 308 toneladas/día de residuos de la cuales aproximadamente 285 toneladas corresponden a la disposición de Villavicencio y 23 toneladas corresponden a la disposición de otros municipios. En cuanto a los residuos orgánicos generados se utilizarán como recurso para eliminar focos de contaminación y optimizar la higiene pública.
Actualmente, se ha venido desarrollando un inoculante biológico acelerante compuesto por 14 cepas nativas termofílicas con actividad proteolítica y amilolítica (Galindo et al., 2005) el cual ha contribuido a la reducción del tiempo de producción y a la obtención de un compost de buena calidad.
Por lo anterior, se buscará potencializar la eficiencia del inóculo ya existente compuesto por cepas termofílicas amilolíticas y proteolíticas, aislando microorganismos nativos con actividad lipolítica que serán adicionados al inoculante microbiano termofílico con el fin de optimizar su acción en el proceso de degradación de residuos orgánicos. Así mismo, debido a la importancia que ha alcanzado este compost producido (bioabono) se plantea el análisis de patógenos humanos E.coli y Salmonella sp. al inicio y al final del proceso para garantizar su calidad.
4.- OBJETIVOS
Aislar bacterias lipolíticas y determinar patógenos humanos Escherichia coli y Salmonella sp. a partir de residuos orgánicos domiciliarios en compostaje.
4.2 Objetivos Específicos.
•
Aislar bacterias con actividad lipolítica a partir de los residuos orgánicos a compostar.• Evaluar la capacidad antagónica de las cepas en estudio.
• Evaluar cualitativamente y cuantitativamente actividad enzimática lipolítica de las cepas seleccionadas.
•
Estandarizar la técnica de p-nitrofenol para la evaluación cuantitativa de las cepas.•
Determinar patógenos humanos Escherichia coli y Salmonella sp. en compost, alinicio y final del proceso de compostaje.
5.- METODOLOGÍA
a cabo el montaje de tres replicas de compostaje, utilizando 55% de residuos de plaza, contenido ruminal, poda y cascarilla de arroz, para el aislamiento de bacterias lipolíticas y para llevar a cabo la determinación de patógenos humanos Escherichia coli y Salmonella sp. Las muestras fueron procesadas y analizadas en los laboratorios de Microbiología Ambiental y Biotecnología Aplicada de la Pontificia Universidad Javeriana. La determinación de los parámetros fisicoquímicos del producto inicial y final se realizó en AGRILAB, laboratorio certificado por el ICA (Anexo 12).
5.1 REACTIVACIÓN DE CEPAS
Se llevó a cabo la reactivación de 14 cepas nativas termofilicas, con actividad proteolítica y amilolítica provenientes de residuos orgánicos domiciliarios del relleno sanitario “Don Juanito” de la ciudad de Villavicencio, las cuales fueron conservadas en glicerol al 25%(v/v), en el banco de células del laboratorio de Biotecnología Aplicada de la Pontificia Universidad Javeriana (Galindo et al; 2005).
El proceso de reactivación de las 14 cepas se llevó a cabo en medio líquido leche-almidón al 1%(p/v) (Anexo1) hasta obtener una concentración de 1020 UFC/mL a una temperatura
de 55°C. A partir de estas, se produjo la cantidad de inoculante necesaria para aplicar a las pilas de compostaje. Para comprobar la producción de biomasa de las cepas reactivadas se determinó mediante técnicas cualitativas (formación de halos de hidrólisis) en agares específicos (leche-almidón al 1%), se realizaron recuentos en placa para determinar biomasa, fueron incubadas a 55°C por 24 horas. La cantidad de inoculante a preparar se calculó de acuerdo a los metros cúbicos de residuos orgánicos que se compostaron y a la concentración final deseada de 1020 UFC/mL, siendo 2.5 litros por
metro cúbico la cantidad destinada para cada tonelada (Galindo et al., 2005).
5.2 FASE DE LABORATORIO
A partir de las 3 réplicas de compostaje, se tomaron de las materias primas y del compost final 5 muestras de 100 g cada una para completar 500 g, utilizando un tubo de PVC de 70 cm de largo por 3 de diámetro, para esto se retiró el material de tal forma que la materia quedó al descubierto, de dicha pared se tomaron las 5 muestras de diferentes alturas y distancias (Universidad de los Andes, 2003).
Posteriormente, se trasladaron en bolsas plásticas de cierre hermético dentro de una nevera plástica al laboratorio de Biotecnología Aplicada de la Pontificia Universidad Javeriana. El análisis realizado a estas muestras primero fueron análisis físico químico y segundo “screening” de bacterias lipolíticas y patógenos.
5.2.2 PROCESAMIENTO DE LAS MUESTRAS
5.2.2.1 Aislamiento de bacterias con actividad lipolítica
A partir de 500g de muestra homogenizada se tomaron 10 gramos y se realizaron diluciones seriadas en agua peptonada al 1% (p/v) de 10-1 a 10-8. Luego se sembró en
superficie y por duplicado 0.1 mL de las diluciones, en medio lecitina (Ramírez et al., 2004) (Anexo 1) se utilizó como control medio de cultivo tributirina.
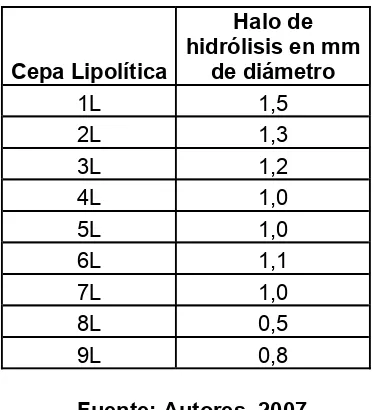
Algunos de los microorganismos aislados hidrolizaron el ácido graso presente en el medio, generando una zona de hidrólisis o aclaramiento alrededor de las colonias que se evidenció después del tiempo de incubación a 55°C por 24 horas. Se tuvo como parámetro de selección, las cepas con halos ≥ 1mm de diámetro (Jaeger et al., 1999, citado por Moreno et al., 2001)
Las siembras realizadas fueron sucesivas, mediante la técnica de parcheo para purificar cada colonia, en donde se observó la actividad enzimática, la cual se determinó de forma cualitativa en mm de diámetro con la siguiente ecuación (1):
C = A – B (ecuación 1) En donde:
C: Diámetro del halo de hidrólisis (Rodríguez et al., 2002)
5.2.2.2 Identificación microscópica y macroscópica de las colonias
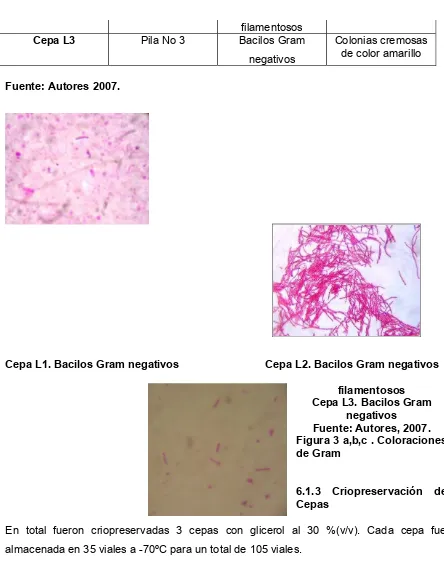
Para llevar a cabo la identificación microscópica se realizaron montajes en láminas de cada una de las colonias seleccionadas y se realizaron tinciones de Gram para evidenciar morfología celular (Madigan, 1997).
En la identificación macroscópica se tuvieron en cuenta características de las colonias como halos de hidrólisis, color, textura, tamaño y elevación de las colonias bacterianas.
5.3 BANCO DE CÉLULAS PRIMARIO (Conservación De Cepas).
La conservación de las cepas seleccionadas se realizó mediante la técnica de criopreservación con glicerol al 30% (v/v).
Para alcanzar la concentración óptima de 108 UFC/mL del banco fue necesario realizar
recuentos en placa en medio lecitina para confirmar la concentración inicial. Cada cepa fue cultivada en 25 mL de caldo lecitina por 12 horas a 55ºC. Posteriormente se añadieron 25 mL de caldo lecitina más glicerol al 60% (v/v).
Finalmente se tomó 1 mL de dicha suspensión y se almacenó en tubos eppendorf a -70°C (Poutou et al., 1994). Este procedimiento se llevó a cabo con cada una de las cepas aisladas.
5.4 PRUEBAS DE ANTAGONISMO
Las 14 cepas existentes correspondientes al inóculo utilizado en La Empresa “Bioagrícola del Llano S.A E.S.P.” se llevaron a cultivar de 48 horas a 55°C en el medio correspondiente a cada cepa, para determinar el tiempo óptimo de crecimiento del microorganismo. (Galindo et al., 2005).
Se realizó un inóculo con una concentración de 108UFC/mL en un erlenmeyer relación 1/5
horas, después de este tiempo se realizaron las pruebas de antagonismo para cada una de las cepas.
Para la prueba se sembraron masivamente cada uno de los microorganismos en medio almidón-leche al 1%(p/v) y lecitina. A partir de la suspensión anterior se tomaron 20µl y se dispusieron en pozos, como control se tomó el microorganismo que se sembró masivamente, esta técnica se realizó por triplicado enfrentando las 14 cepas existentes con las cepas lipolíticas aisladas. Este antagonismo se evaluó con el fin de evidenciar si las cepas lipolíticas pueden ser adicionadas al inóculo ya existente .Las 14 cepas ya existentes no presentan antagonismo entre ellas comprobado en estudios anteriores. (Galindo et al.,2005)
El efecto antagónico se evaluó midiendo el diámetro de los halos de inhibición, tomando como antagonismo positivo a las cepas que enfrentándose entre sí, inhibieron el crecimiento de las otras en ≥ 5mm de diámetro (Gauze, 1967).
Adicionalmente, se realizaron pruebas antagónicas de las cepas lipolíticas enfrentadas entre si obtenidas del screening, sembrando masivamente cada cepa lipolitica. De igual manera al iniciar las pruebas fue necesario que los microorganismos alcanzaran la misma concentración (108UFC/mL) para evitar falsos positivos. Para esto se llevaron a cabo
nuevamente recuentos en placa en medio lecitina, lo cual permitió determinar la concentración inicial de cada microorganismo, posteriormente se realizó la metodología anteriormente mencionada.
5.5 CURVAS DE CRECIMIENTO
Esta prueba se realizó con el fin de determinar el tiempo de la fase de crecimiento de cada una de las cepas aisladas y de esta manera saber, el tiempo óptimo para la producción del inóculo nativo termofílico, en el cual se genera mayor actividad enzimática.
Se preparó un inóculo de 100mL de caldo lecitina, inoculando un vial obtenido del banco primario de cada una de las cepas en un erlenmeyer de 500 mL (1/5), el cual duró en incubación un tiempo aproximado de 24 horas. Transcurrido este tiempo para la fermentación se transfirió a un erlenmeyer de 1000mL con 500 mL de medio lecitina, relación (1/2) adicionalmente se realizó coloración de Gram para corroborar pureza (Moreno et al., 2001).
5.5.2 Fermentación Discontinua
Se tomó del inóculo preparado en el numeral anterior la cantidad correspondiente a 0.5 mL para realizar diluciones de 10-1 a 10-10 para luego determinar biomasa mediante la
técnica de recuento en placa (UFC/mL) por triplicado, por un periodo de incubación de 18 horas a 55ºC. Para la determinación de biomasa de los diferentes tiempos de muestreo se leyó absorbancia utilizando la técnica de lavado con buffer Fosfato 1 M a pH 7 (K 2HPO 4
+ KH2 PO4) y adición de Triton X-100 al 1%, debido a la turbidez del medio. Esta técnica
se leyó a 540 nm (Otálora et al., 2003) la metodología anterior se uso para bacterias, para actinomycetes utilizó únicamente la técnica de recuento en placa.
5.6 TÉCNICA COLORIMÉTRICA P-NITROFENIL PALMITATO PARA ACTIVIDAD LIPOLÍTICA
5.6.1 Curva patrón de p-nitrofenol
La curva de p-nitrofenol se realizó en tubos 13 x 100mm, utilizando una solución buffer fosfato 1M (Anexo 3), el cual fue utilizado como blanco y como solución buffer del p -nitrofenil (Otálora et al., 2003).
Las concentraciones de p-nitrofenol que arrojaron valores de absorbancias entre 0.1 y 0.9 fueron escogidos para realizar el trabajo de acuerdo con la Ley de Beer-Bouguer-Lambert (Otálora et al., 2003).
5.6.1.1 Evaluación y estandarización cuantitativa de actividad lipolítica
Para determinar la actividad lipolítica se preparó una solución buffer fosfato 1M a pH 7 + o – 2 (Na2HPO4 + NaH2PO4) con diferentes concentraciones de p-nitrofenil palmitato
(0,08%(p/v), 0,5%(p/v), 1%(p/v), 1,5%(p/v) y 2%(p/v)) + 1% de TRITON X-100 (Shuen et al., 1996). A partir de esta solución se tomó 900µl en tubos 16*150 y se le adicionó diferentes volúmenes de extracto crudo (20µl, 500µl y 700µl). La solución se incubó por 30 y 60 minutos a 55 °C. Transcurrido este tiempo se frenó la reacción con NaOH.
Posteriormente cada una de las mezclas fue llevada a centrifugación a 10000 rpm por 10 minutos, a partir del sobrenadante se tomó 1mL y fue depositado en las celdas de cuarzo, para luego realizar la lectura usando como blanco la solución buffer sin extracto crudo de la enzima en espectrofotómetro Spectronic 21D Milton Roy a 450nm (Beltrán et al., 2006). Las unidades lipolíticas fueron determinadas a través de la curva patrón de calibración donde una unidad de p-nitrofenol liberada corresponde a una unidad lipolítica por minuto (UL). (Kampen, 1999).
5.6.1.2 Prueba preliminar de actividad enzimática
Se realizaron pruebas preliminares de actividad enzimática de las cepas escogidas, llevando a cabo una fermentación discontinua, para lo cual se llevó a cabo la producción de un inóculo en 100mL de caldo lecitina, inoculando un vial de cada cepa obtenido del banco primario en un erlemmeyer de 500mL para alcanzar una relación (1/5) con un pH inicial 7.5 y un tiempo de incubación de 24h a 55°C.
hora y media, a partir de aquí se realizaron muestreos cada 2 horas de fermentación hasta la hora 18, para corroborar pureza del cultivo se realizaron coloraciones de Gram en cada hora de muestreo (Otálora et al.,2003).
En cada muestreo se tomaron del erlenmeyer 5mL de muestra, esta se centrifugó a 150 rpm durante 15 minutos para obtener el sobrenadante, es decir, el extracto crudo que contiene la enzima lipolítica como se mencionó el numeral anterior.
Por otro lado, se preparó una solución de Buffer Fosfato 1 M a pH 7 (K 2HPO 4 + KH2 PO4),
el cual fue mezclado con el p-nitrofenil palmitato mas Triton X – 100 a una concentración del 1% (Beltrán et al.,2006). A partir de esta solución se tomaron las cantidades especificadas anteriormente de p-nitrofenil palmitato y extracto crudo en tubos 13*100.
La solución se incubó por 30 y 60 minutos a 55ºC transcurrido este tiempo se frenó la reacción con 1575 ul de NaOH (Otálora et al., 2003).
Luego se realizó la lectura usando como blanco la solución de Buffer sin el extracto crudo de la enzima (Beltrán et al., 2006). Para realizar la técnica de cuantificación de la actividad enzimática, se formula que una unidad lipolítica se define como la cantidad de enzima capaz de liberar una micromol de p- nitrofenol por minuto por litro (Moreno et al., 2001).
5.7 DETERMINACIÓN DE MICROORGANISMOS PATÓGENOS. Escherichia.coli y Salmonella sp.
5.7.1 Determinación de microorganismos patógenos. Salmonella sp.
Las muestras iniciales fueron tomadas de la primera y última semana de residuos del proceso de compostaje, éstas fueron recolectadas en bolsas plásticas de cierre hermético y llevadas a refrigeración a 4°C hasta el momento de su análisis.
Para la presencia de Salmonella sp se usó el método de NMP (número más probable).
realizaron tres diluciones: el primer juego se realizó con frascos de vidrio, con 10mL de medio líquido TSB (Anexo 1) mas 20mL de muestra homogenizada, el segundo juego se realizó en tubos tapa rosca (16x150mm) con 5mL de medio líquido TSB más 5mL de muestra homogenizada y finalmente el tercer juego con tubos tapa rosca (16x150mm) con 10mL de medio liquido TSB mas 1mL de muestra homogenizada. Cada juego correspondió a las diluciones 10-1, 10-2 y 10-3 respectivamente. Se incubó 24h a 36°C (EPA,
1682-2006), para cada una de las diluciones (10-1, 10-2 y 10-3) se preparó el medio
Rappaport Vassiliadis (semisólido) (Anexo 1). Sobre cada caja se distribuyeron cinco puntos equidistantes y se depositaron 30µl de cada juego de diluciones. Esto se llevó a incubar a 42°C por 24h. De cada una de las gotas depositadas (5) en el medio semisólido Rappaport Vassiliadis correspondiente a cada dilución, se repicaron a medios selectivos XLD y Sulfito Bismuto (EPA, 1682-2006).
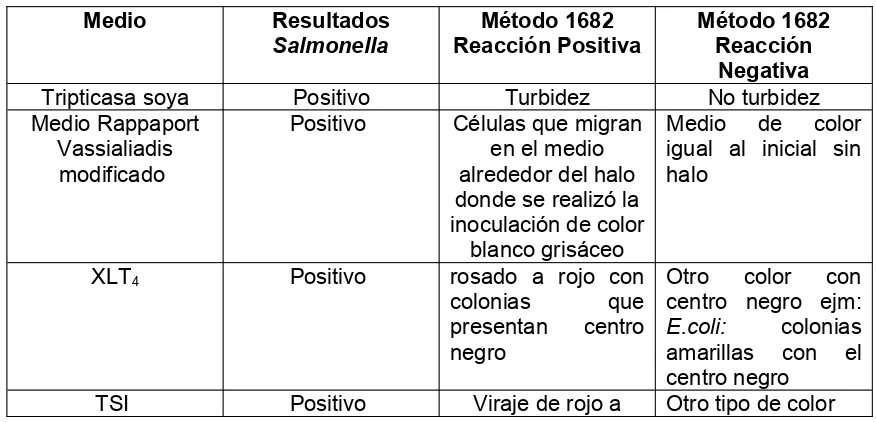
[image:46.612.76.514.503.714.2]De los aislamientos se escogieron colonias características de Salmonella sp y de estas se hicieron pases a: TSI, LIA y UREA (Tabla 3), seguido de esto se escogieron las colonias que presentaron reacción metabólica positiva, y se realizó la prueba serológica con solución salina y antisuero polivalente ´´o``, esta prueba consiste en obtener una muestra de la superficie inclinada del tubo de cada una de las bioquímicas, emulsionando sobre una lámina con suero fisiológico estéril, evidenciando aglutinación en caso de un resultado positivo (EPA, 1682-2006).
Tabla 3.Tabla guía para la lectura indicadores de Presencia de Salmonella sp
Medio Resultados Salmonella Método 1682 Reacción Positiva Método 1682 Reacción Negativa
Tripticasa soya Positivo Turbidez No turbidez
Medio Rappaport Vassialiadis modificado
Positivo Células que migran en el medio alrededor del halo donde se realizó la inoculación de color
blanco grisáceo
Medio de color igual al inicial sin halo
XLT4 Positivo rosado a rojo con
colonias que
presentan centro negro
Otro color con centro negro ejm: E.coli: colonias amarillas con el centro negro
amarillo con o sin producción de H2S
LIA Positivo Columna vertical y
superficie inclinada color violeta, formación de H2S
Otra combinación de colores ejm: E.coli presenta
color rojo o variación entre rojo
y morado sin producción de H2S
ÚREA Negativo Color Rosado No hay cambio de
color ( Salmonella es ureasa negativo)
Polivalente “O” Positivo Aglutinación No Aglutinación
Fuente: EPA 2006 United States Enviromental Protection Agency Method 1682: Salmonella in Sewage Sludge (Biosolids) by Modified Semisolid Rappaport-Vassiliadis (MSRV) Medium
La determinación de NMP se realizó a partir de los tubos originales de TSB con resultados positivos para Salmonella sp en MSRV, XLD, Hecktoen, Sulfito Bismuto, TSI, LIA, urea negativo y antisuero polivalente positivo, se leyeron en la tabla de NMP.
Para la determinación de sólidos totales se tomaron 15g de la muestra a 100°C por 24 horas. El porcentaje de peso seco se calculó utilizando la siguiente ecuación (1)
g de la muestra seca
(1) % peso seco = * 100% g de la muestra
Para la determinación de Salmonella sp como NMP/15g peso seco se utilizó la siguiente ecuación (2):
NMP/ ml (peso húmedo) * 15 (2) NMP/15g (peso seco) = Porcentaje de sólidos totales
Las muestras para el análisis fueron tomadas de la primera y última semana de la mezcla del compost, éstas fueron recolectadas en bolsas plásticas de cierre hermético y llevadas a refrigeración a 4°C hasta el momento de su análisis.
Para la presencia de Escherichia coli se usó el método de NMP (número más probable).
A partir de 500g de muestra se tomaron 10g para diluirlo en 90ml de agua peptonada al 0.1%(p/v), enseguida se homogenizó por inmersión (EPA, 1680, 2006). Seguido a esto se realizan tres diluciones 10-1, 10-2 y 10-3. Alternamente se preparan 9 tubos, cada uno con
9ml de caldo LMX ,los cuales cada serie de tres serán inoculados con 1ml de las diluciones ya preparadas, que corresponderán la primera serie de tres a la dilución 10-1, la
segunda serie de tres ala dilución 10-2, y la ultima serie de tres a la dilución 10-3.
Se tomó como resultados positivos para Escherichia coli aquellos tubos que presentaran tres reacciones positivas como lo son: Indol positivo, fluorescencia y presencia de glucoronidasa (EPA, 1680, 2006).
Para la determinación de NMP/4g se revisó en la tabla establecida por la EPA, 1680, 2006.
5.8 FASE DE CAMPO
5.8.1 Determinación de pH y Temperatura
La temperatura fue analizada mediante un termómetro de punzón de 70 cm de largo con receptor digital, las mediciones se realizaron diariamente. Estas temperaturas se registraron de las 3 replicas de compostaje para luego ser promediadas y encontrar el valor medio. Este procedimiento se realizó diariamente los resultados fueron registrados para su posterior análisis.