PONTIFICIA UNIVERISAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA MICROBIOLOGÍA INDUSTRIAL
EVALUACIÓN DE LA ACTIVIDAD ANTIMICROBIANA DE LOS METABOLITOS SECUNDARIOS OBTENIDOS POR FERMENTACIÓN EN MEDIO SÓLIDO DE Penicillium roseopurpureum NATIVO DEL PÁRAMO DE GUASCA, CUNDINAMARCA
LINA MARÍA SEGURA CELY
TRABAJO DE GRADO
Presentado como requisito parcial para optar al título de
MICROBIÓLOGO INDUSTRIAL
Director
JORGE ROBLES CAMARGO PhD.
Codirectora
ANDREA GARCÍA CAYCEDO
EVALUACIÓN DE LA ACTIVIDAD ANTIMICROBIANA DE LOS METABOLITOS SECUNDARIOS OBTENIDOS POR FERMENTACIÓN EN MEDIO SÓLIDO DE Penicillium roseopurpureum NATIVO DEL PÁRAMO DE GUASCA, CUNDINAMARCA
LINA MARÍA SEGURA CELY
APROBADO
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL BOGOTÁ, D.C.
2010 Dra. INGRIDSCHULER GARCÍA PhD
Decana académica
EVALUACIÓN DE LA ACTIVIDAD ANTIMICROBIANA DE LOS METABOLITOS SECUNDARIOS OBTENIDOS POR FERMENTACIÓN EN MEDIO SÓLIDO DE Penicillium roseopurpureum NATIVO DEL PÁRAMO DE GUASCA, CUNDINAMARCA
LINA MARÍA SEGURA CELY
JORGE ROBLES CAMARGO PhD Director
ANDREA GARCÍA CAYCEDO Codirectora
LUIS DAVID GÓMEZ M.Sc Jurado
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL BOGOTÁ, D.C.
“La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus
trabajos de tesis. Sólo velará por que no se publique nada contrario al dogma y a la moral
católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien
se vea en ellas el anhelo de buscar la verdad y la justicia”.
TABLA DE CONTENIDO
1. RESUMEN ... 1
2. INTRODUCCIÓN ... 2
3. PLANTEAMIENTO DEL PROBLEMA ... 3
4. MARCO TEÓRICO ... 4
5. OBJETIVOS ... 6
5.1. Objetivo General ... 6
5.2. Objetivos Específicos ... 6
6. METODOLOGÍA ... 6
6.1.Reactivación de la cepa SPG 91 ... 6
6.2. Elaboración del banco de trabajo ... 7
6.3. Pruebas preliminares ... 7
6.4. Cinética de crecimiento ... 8
6.5. Obtención de metabolitos ... 8
7. RESULTADOS Y DISCUSIÓN ... 9
8. CONCLUSIONES Y RECOMENDACIONES ...17
9. REFERENCIAS ...18
LISTA DE ANEXOS
10.1. METABOLITOS DEL GÉNERO Penicillium sp. ………..…………22
10.2. MEDIOS DE CULTIVO PARA LA FERMENTACIÓN SÓLIDA………23
10.3. PRUEBAS DE IDENTIFICACIÓN MACROSCÓPICA……….………24
10.4. SUSTRATOS EMPLEADOS EN FERMENTACIÓN SÓLIDA……….……25
10.5. MONTAJES DE FERMENTACIÓN……….…26
10. 6. RENDIMIENTO DE LAS FERMENTACIONES………27
10. 7. PRUEBAS DE ACTIVIDAD ANTIMICROBIANA………28
10. 8. CROMATOGRAFÍAS EN CAPA FINA ………31
EVALUACIÓN DE LA ACTIVIDAD ANTIMICROBIANA DE LOS METABOLITOS SECUNDARIOS OBTENIDOS POR FERMENTACIÓN EN MEDIO SÓLIDO DE Penicillium roseopurpureum NATIVO DEL PÁRAMO DE GUASCA, CUNDINAMARCA
Grupo de investigación en Fitoquímica Universidad Javeriana (GIFUJ)- COLCIENCIAS
Metabolitos de cepas nativas colombianas de hongos filamentosos y evaluación de su actividad biológica III
1. RESUMEN
Los metabolitos secundarios, o compuestos naturales son sustancias que han reportado gran cantidad de utilidades por su actividad biológica; debido a la amplia biodiversidad colombiana, existe gran interés en la investigación de sustancias activas de origen natural. Las cepas nativas de Penicillium roseopurpureum aisladas del suelos paramunos en Guasca, (Cundinamarca) han sido objeto de estudios en los que se ha demostrado la producción de sustancias con actividad antimicrobiana por fermentación líquida en batch; numerosos estudios demuestran que para la producción de metabolitos bioactivos, el rendimiento de las fermentaciones, la actividad biológica y la estabilidad de compuestos como antibióticos y alcaloides ha incrementado cuando se emplea fermentación sólida. Debido a esto, en el presente trabajo se propone detectar si los metabolitos de Penicillium roseopurpureum nativo del páramo de Guasca (Cundinamarca) obtenidos por fermentación en medio sólido tienen actividad antimicrobiana.
Para esto, se realizó la selección de tres sustratos reportados en la bibliografía (arroz, avena y cebada), suplementados con solución de microelementos y se desarrolló un trabajo pre-experimental montando fermentaciones de 100g durante 13 días; se realizó la extracción de los metabolitos mediante el lavado de biomasa con Tween 80 al 0,1% (v/v) en agua destilada y posterior extracción líquido- liquido en embudo de decantación de la solución de lavado obtenida, la biomasa seca fue extraída mediante soxleth con acetato de etilo y éter de petróleo como solventes; el sustrato avena fue descartado con base en cantidad de pruebas antimicrobianas positivas y la cantidad de extracto obtenido frente a los demás sustratos.
dimetilsulfóxido (DMSO), y actividad antifúngica mediante difusión en placa de agar suplementando cada medio con 50mg de extracto en 7mL de agar PDA (7,1mg/mL).
Las fracciones con marcada actividad antimicrobiana (mayor cantidad de microorganismos inhibidos), fueron corridas en cromatografía de gases y comparadas con base de datos, donde se encontraron tres sustancias comunes en los extractos: Tetrametilpirazina, Pyrrolo [1,2-α]pirazina-1,4-diona, y 1,3-butanodiol. Es posible que las pirazinas sean las moléculas responsables de la actividad antimicrobiana, debido a que ya existen reportes al respecto. Las cromatografías en capa fina de la curva de crecimiento permitieron detectar la producción de sustancias en el transcurso de la fermentación, de acuerdo a los valores de factor de retención (Rf) de las sustancias comunes en los extractos que reportaron actividad, se evaluaron las bandas obtenidas en las fracciones de la curva; las bandas con los valores de Rf comunes y comportamiento similar frente a la luz ultravioleta, visible y al revelador ácido sulfúrico-vainillina, comenzaron aparecer entre los días 9 y 15, lo que indica la producción de sustancias propias del metabolismo secundario. No se detectó el compuesto metil-(2-oxo-3,4-dihidro-2H-chromen-6-il)-acetato, al cual se le atribuye la actividad antimicrobiana en medio líquido.
2. INTRODUCCIÓN
Los metabolitos secundarios de origen fúngico, han sido objeto de estudio desde 1942 cuando se industrializó la producción de penicilina, antibiótico obtenido a partir del hongo Penicillium nonatum, desde entonces, se han desarrollado una enorme cantidad de estudios que buscan aislar cepas productores de toda clase de metabolitos que puedan ser empleados a nivel industrial como enzimas, antibióticos, sustancias con actividad farmacológica, biocontroladores y pigmentos, entre otros (1).
Como consecuencia del clima frio propio de los páramos, los microorganismos nativos de estas zonas se encuentran adaptados a las bajas temperaturas y a las condiciones agrestes que con ella vienen, entre los mecanismos de adaptación que se conocen se encuentran: función de enzimas, función de transporte de nutrientes y función de la membrana celular; según Arias y Piñeros, 2008 (2), estos organismos especialmente adaptados producen sustancias metabólicas que pueden llegar a tener interés industrial.
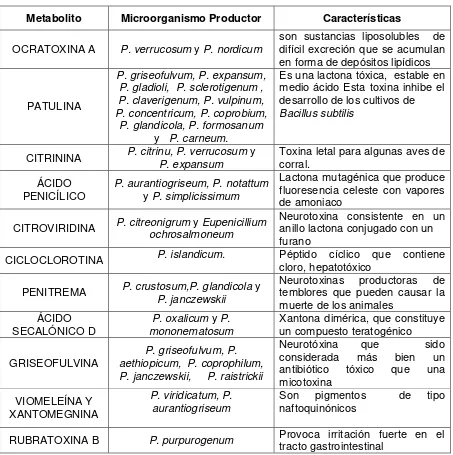
griseofulvina, ocratoxina A, patulina, y penitrem A (3). Los metabolitos secundarios tienen diversa estructura química, su peso molecular es relativamente bajo, se producen en medianas y bajas concentraciones y se difunden en el medio. (4,5). El género Penicillium se destaca como productor de una gran cantidad de metabolitos secundarios de importancia industrial, la tabla 1 describe algunas sustancias de importancia biológica aisladas a partir de este género (Anexo1).
Durante la biosíntesis de metabolitos secundarios, la cantidad y el tipo de sustancias producidas depende tanto de condiciones nutricionales y ambientales, como de de la historia previa del desarrollo del hongo; la formación de metabolitos refleja que el hongo ha alcanzado cierto grado de diferenciación bioquímica, fisiológica y a veces morfológica; es así como, cuanto más compleja es la ruta biosintética de estos metabolitos secundarios más restringido es el número de especies de hongos productores de estas sustancias (4). La producción de sustancias a partir de biomasa fúngica se ha desarrollado habitualmente mediante procesos de fermentación en medio líquido en batch; sin embargo, la fermentación en medios sólidos se presenta como una alternativa viable para la producción de metabolitos secundarios con actividad biológica (6).
3. PLANTEAMIENTO DEL PROBLEMA
Los metabolitos secundarios son utilizados como agentes antibacterianos, antifúngicos, antitumorales, antioxidantes, citotóxicos, antiparasitarios y antivirales; estos compuestos, se aplican principalmente en farmacología clínica para la terapia humana, pero también son utilizados en la terapia animal y en la agricultura como plaguicidas (7). Debido a la amplia biodiversidad colombiana, la investigación que apunta hacia la separación de nuevas moléculas activas, o a las nuevas aplicaciones de sustancias ya reportadas, es de gran importancia e interés (8).
a la producción de este tipo de compuestos (10); las condiciones de humedad, aireación y soporte que proporciona la fermentación en medio sólido han sido vistas como ventajosas en la obtención de metabolitos secundarios a partir de hongos filamentosos (9). Numerosos estudios demuestran que para la producción de enzimas, antibióticos, alcaloides, aceites esenciales y pigmentos entre otros, el rendimiento de las fermentaciones ha aumentado cuando esta se realiza en medio sólido; así mismo, la actividad biológica y la estabilidad de compuestos como antibióticos y alcaloides a incrementado también con este tipo de fermentación (11)
Como consecuencia de todo lo anteriormente señalado, el presente trabajo pretende detectar si los metabolitos de Penicillium roseopurpureum nativo del páramo de Guasca (Cundinamarca) obtenidos por fermentación en medio sólido tienen actividad antimicrobiana como la obtenida por fermentación líquida en trabajos anteriores.
4. MARCO TEÓRICO
Colombia posee el 60% de los páramos del mundo, esta es una ventaja no solamente hidrológica dado que en los páramos se da el nacimiento de las fuentes de agua, sino también biológica debido a que son una importante reserva de biodiversidad, en el que se alojan numerosas especies de plantas, animales y microorganismos nativos (12,13). El paramo de Guasca se ubica en el municipio de Guasca, departamento de Cundinamarca a 53 Km de Bogotá, posee una altura de 3000-3250m, y una temperatura de 10°C a 13°C. El clima del páramo se caracteriza por el frió- húmedo dónde la cantidad de lluvia alcanza 3000mm anuales. El suelo posee textura tipo franco-arenoso orgánico, de estructura granular fina, consistencia en húmedo friable; permeabilidad rápida, reacción de ácida a muy ácida, que se compone principalmente por: arena 63% limo 18% arcilla 19%, posee porcentajes de humedad de 19,36%, y pH de hasta 4,7; el porcentaje de carbono orgánico y de nitrógeno total es de 1,73 y 10,8 respectivamente (13).
Debido a la amplia diversidad biológica de los páramos Colombianos, se han desarrollado varias investigaciones con el fin de aislar hongos filamentosos de los suelos paramunos, Romero, Et al. 2004 reporta haber aislado 12 cepas de los géneros Absidia sp., Alternaria sp.,
Las especies del género Penicillium están ampliamente distribuidas en la naturaleza formando parte de los microorganismos del suelo y del aire (14). Dado que la clasificación taxonómica de los microorganismos pertenecientes a esta especie se encuentra establecida principalmente con base en su morfología, cabe resaltar que microscópicamente las especies de este género poseen micelio hialino que produce conidióforos largos, erectos y simples, los cuales se ramifican en dos o tres veces en los extremos; poseen además una célula conidiogénica en forma de botella, denominada fiálide que produce conidios ovalados, generalmente hialinos de arreglo basipétalo u acropétalo; la fiálide se encuentra sostenida sobre un conidióforo denominado penicilio (14).
Penicillium roseopurpureum es un hongo filamentoso con una temperatura óptima de crecimiento de 25°C, y como característica distintiva no presenta crecimiento a 37°C. Microscópicamente posee conidióforos usualmente con pared lisa en hifas hialinas, mono verticilado, estipos no ramificados de pared lisa que terminan en un verticilio de 3-5 fiálides. Las fiálides con forma de botella de 5,6-7,8 x 1.5-1-8 µm, conidios producidos en columnas, esferoidales, globosas y ornamentadas con diámetros menores de 3 micras (9).
Los metabolitos secundarios de P. roseopurpureum obtenidos por fermentación en medio líquido han demostrado interesantes actividades antimicrobianas; García (2009) reporta la presencia de metil-(2-oxo-3,4-dihidro-2H-chromen-6-il)-acetato aislado del micelio del hongo como sustancia activa contra E. coli y especialmente contra S. aureus con concentraciones mínimas inhibitorias de 125-250µg/mL. Adicionalmente, sustancias aisladas del extracto crudo demostraron tener actividad anti fúngica contra Fusarium oxysporum, con un porcentaje de inhibición del 73% (9).
solución de sales y una suspensión de esporas de hongos como inoculante (15). Para medir el crecimiento de los microorganismos en (FMS), se puede recurrir a la respirometría, análisis de la biomasa con diferentes métodos directos como el recuento de conidios o esporas al microscopio y a métodos indirectos como la cuantificación de proteínas, quitina, y ácidos nucléicos o por la producción de diferentes metabolitos (15). Algunas ventajas que presenta la fermentación en medio sólido con respecto a otros métodos es que los medios de cultivo que se emplean son simples, al final del proceso el producto de interés se concentra, lo que facilita su purificación; El bajo contenido de humedad de los sustratos y del medio en general reducen la posibilidad de contaminación y se presenta una menor cantidad de residuos metabólicos lo que disminuye la represión por catabolito que se pueda generar (1).
5. OBJETIVOS
5.1. Objetivo General
Determinar la actividad antimicrobiana de metabolitos secundarios obtenidos por fermentación en medio sólido de Penicillium roseopurpureum.
5.2. Objetivos Específicos
Determinar la cepa SPG91 conservada en el cepario del laboratorio de química microbiológica de la Pontificia Universidad Javeriana.
Elaborar un banco de trabajo a partir de un cultivo monospórico de la cepa SPG91 Realizar una evaluación preliminar de la actividad antimicrobiana de los metabolitos
obtenidos por fermentación en medio sólido en tres sustratos diferentes.
Realizar curva de crecimiento del microorganismo en el/ los sustratos seleccionados Realizar pruebas de actividad antimicrobiana.
6. METODOLOGÍA
6.1.Reactivación de la cepa SPG 91
gránulos de suelo, por lo que fue reactivada mediante repique en agar PDA e incubación a 25°C durante 7 días (16). Una vez obtenido el microorganismo axénico y viable, se realizó la determinación a partir de repiques realizados en los medios Czapeck, saboureaud, extracto de malta, extracto de levadura, y PDA, empleando las claves taxonómicas de Pitt (1990), y Samson (2000) (16,2).
6.2. Elaboración del banco de trabajo
Se realizó un cultivo monospórico mediante la técnica descrita por García (2010) a partir del cual se elaboró un banco de primario conservando el microorganismo en discos de agar con aceite mineral, gránulos de suelo, discos de papel, agua destilada y tubo inclinado, se elaboró además, un banco de trabajo mediante discos de agar en aceite mineral conservado-20°C empleando la metodología utilizada por Alarcón, A., Irney, D. en 2006 (9).
6.3. Pruebas preliminares
Para la selección del sustrato se realizaron nueve fermentaciones de 100g durante 13 días a 25°C en bandejas de aluminio 15cm x 10cm x 4cm correspondientes a los triplicados de las pruebas para los sustratos arroz, avena y cebada (90g) suplementados (anexo 2). Para lo cual, se elaboró un inoculo correspondiente a 90mL de una suspensión de conidios de concentración 107 Células/mL , a partir del cual se transfirieron 10mL a cada bandeja de fermentación que posteriormente se llevaron a incubación bajo las ya mencionadas condiciones (9,17). Finalizado el tiempo de fermentación, se realizó el recuento de conidios y la extracción de metabolitos.
actividad antimicrobiana mediante la técnica de pozos a concentraciones de 10mg/50µL en dimetilsulfóxido (DMSO) contra Bacillus subtilis ATCC 6633, Pseudomonas aeureginosa ATCC 9027, Escherichia coli ATCC 8739 y Staphylococcus aureus ATCC 6535 obteniéndose así un total de 16 ensayos por sustrato. Se emplearon como controles DMSO puro, y gentamicina solución 10mg/mL. La selección de los sustratos para el estudio se decidió de acuerdo al número de ensayos positivos y el peso de los extractos obtenidos.
6.4. Cinética de crecimiento
La curva de crecimiento se realizó en los sustratos arroz y cebada suplementados de la misma forma que en las pruebas preliminares, se emplearon bandejas de aluminio rectangulares de 9cm x 7cm x 3cm, y bandejas cilíndricas de 11,5cm de diámetro y 3 cm de altura, con 30g de medio como lo muestra la figura 1 (anexo 4); la preparación de inoculo se realizó teniendo en cuenta los mismos criterios establecidos en el numeral anterior. Los muestreos se realizaron cada 24 horas durante quince días, la cuantificación de biomasa se llevó a cabo mediante recuento en cámara; adicionalmente se realizó extracción de los metabolitos y cromatografía en capa fina por la metodología ya mencionada, para los días 0, 3, 6, 9, 12 y 15, todo el procedimiento se realizó por triplicado para cada sustrato (15,17).
6.5. Obtención de metabolitos
con 50mg de extracto (7.1mg/mL) de acuerdo a Steven y Rusell (2007) (18), el porcentaje de inhibición se calculó de acuerdo a la fórmula:
A las fracciones activas se les realizó cromatografía de gases con detector de masas para realizar la comparación de las sustancias con las de la base de datos del equipo (9,13).
7. RESULTADOS Y DISCUSIÓN
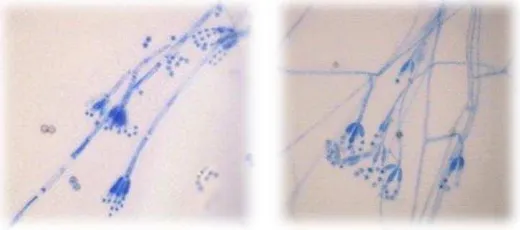
[image:15.612.174.434.544.659.2]Se realizó la recuperación del microorganismo SPG91 del cepario del laboratorio de química microbiológica de la Pontificia Universidad javeriana, a partir del cual se realizaron repiques para las pruebas de identificación macroscópicas y microscópicas en los medios de cultivo saboureaud, extracto de malta, extracto de levadura, Czapeck y PDA obteniendo colonias características macroscópicas descritas en la tabla 4 (anexo3); la microscopía se determinó empleando el sistema Motic images plus®, donde se evidenciaron conidióforos de pared lisa, hialinos monoverticilados, estipos no ramificados de pared lisa terminados en un verticilio de 3-5 fiálides con forma de botella de 3-5,6-7,8 x 1.3-5-1-8 µm, conidios producidas en columnas, esferoidales, ornamentados con un diámetro de 2.0 – 2.5 µm (figura 2); Con esta información y mediante el uso de claves taxonómicas de Pitt (1990) y Samson (2000), se confirmó la identificación del microorganismo como Penicillium roseopurpureum (16,2).
Figura 2. Identificación microscópica de P. roseopurpureum.
Una vez identificado el microorganismo, se elaboró un cultivo monospórico a partir del cual, se realizó el banco celular; el cultivo monospórico, consiste en la obtención de biomasa fúngica a partir de un único propágulo, en este caso conidio, lo que garantiza que toda la biomasa del estudio sea genotípicamente homogénea (16).
Se realizó un banco primario mediante conservación en discos de agar, papel de filtro, gránulos de suelo y tubo inclinado; adicionalmente, se desarrolló un banco de trabajo donde se eligió como método de conservación la técnica de discos de agar en aceite mineral a -20°C, lo cual garantiza la estabilidad de la cepa de estudio durante el desarrollo de la investigación (mediano plazo), debido a que el aceite mineral disminuye la transferencia de oxígeno y la temperatura detiene el metabolismo fúngico (9). Una de las principales ventajas de la fermentación en medio sólido, es el uso de sustratos complejos de origen agrícola, la literatura reporta diversos sustratos empleados para la producción de metabolitos mediante fermentación sólida (tabla 4, anexo 3). Para la selección de los sustratos en el presente estudio, se seleccionaron los de mayor reporte en la literatura para el género Penicillium sp. y de mayor accesibilidad: Arroz, avena y cebada; igualmente la revisión bibliográfica permitió establecer los suplementos y definir la composición de los medios de cultivo (Anexo 2).
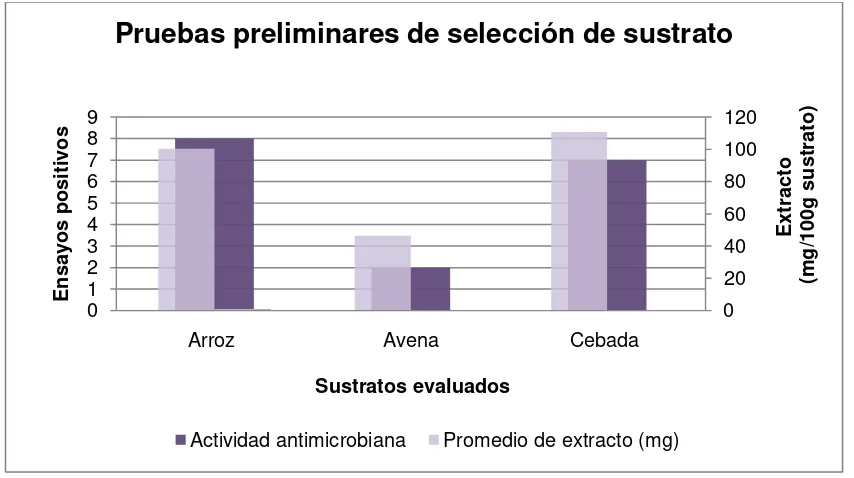
Se desarrolló una investigación de tipo pre-experimental para determinar el sustrato a emplear; las fermentaciones tuvieron una duración de 13 días debido a que este fue el tiempo reportado por García, en 2010, en el que se completa la cinética de crecimiento para P. roseopurpureum (9); se obtuvo un rendimiento promedio de 1,04mg extracto/g arroz, 0,4mg extracto/g avena y 1,1mg extracto/g cebada (anexo 5, tabla 6).
Figura 3. Pruebas preliminares de selección de sustrato. Fuente: Elaboración propia
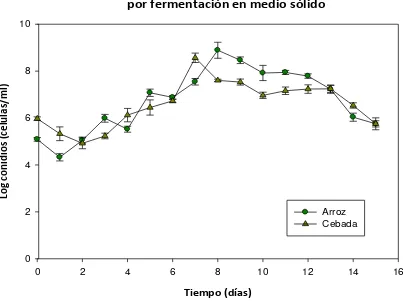
Las cinéticas de crecimiento obtenidas (figura 4), poseen el comportamiento típico de una curva de crecimiento de hongo filamentoso, que en cuanto a la producción de biomasa es similar a la de una bacteria, es decir posee cuatro fases: fase de adaptación, fase de crecimiento exponencial, fase estacionaria y fase de muerte, aunque los hongos filamentosos poseen duración de fase estacionaria mucho más corta (19). sin embargo, la producción de metabolitos se caracteriza en una curva con dos fases: tropofase donde ocurre la mayor producción de biomasa y las sustancias producidas se encuentran asociadas al crecimiento e ideofase donde se generan una serie de compuestos secundarios que no son esenciales para la célula pero, están asociadas a la supervivencia del microorganismo (20,21).
En la primera fase ocurre la germinación de propágulos, por lo que se observa una disminución de la concentración de conidios inoculada hacia el día uno, y un crecimiento lento hasta el día 3, a continuación ocurre un rápido desarrollo del micelio en los extremos periféricos de este, aquí, el micelio más senecente no crece, sino que se encarga de obtener los nutrientes que requiere el micelio nuevo para desarrollarse, por lo que ocurre la utilización de la mayor cantidad de los nutrientes (carbohidratos, nitrógeno, y fosforo entre otros).
En este punto de máximo crecimiento, metabólicamente hablando ocurriría el inicio de la ideofase (21); para los sustratos evaluados este punto se alcanzó entre los días 7 y 8 para cebada y arroz respectivamente, resultados que coherentes con lo reportado por García en
0 20 40 60 80 100 120 0 1 2 3 4 5 6 7 8 9
Arroz Avena Cebada
E xtrac to (mg /10 0g sust rato ) E nsa yos po sitiv os Sustratos evaluados
Pruebas preliminares de selección de sustrato
2010, donde la ideofase se alcanza más rápidamente (día 6) (9), debido a la dificultad en el transporte de nutrientes propia de la fermentación sólida, lo que ocasiona una tasa de crecimiento menor (22).
Finalmente ocurre la pérdida de peso por autolisis del micelio ocasionada por el rompimiento de la quitina, polisacáridos y proteínas, esta lisis genera amoniaco, aminoácidos y compuestos de fósforo orgánico y moléculas azufradas. La disminución del crecimiento se debe principalmente a la acumulación de metabolitos tóxicos (ácidos orgánicos y amoniaco), y el agotamiento de los nutrientes (19,21).
Ci ética de creci ie to de
Penicillium roseopurpureum
por fer e tació e edio sólido
Tie po días
0 2 4 6 8 10 12 14 16
Lo
g c
o
idios
c
élulas/
l
0 2 4 6 8 10
[image:18.612.93.496.277.578.2]Arroz Cebada
Figura 4. Cinética de crecimiento de Penicillium roseopurpureum por fermentación en medio sólido. Fuente: elaboración propia
gaseosos (23). Aunque una humedad elevada en el sustrato causa un aumento de la tasa del crecimiento de la producción de biomasa y de la biosíntesis de enzimas, también puede generar una disminución de la porosidad del sustrato, una baja difusión de oxígeno y aumenta la probabilidad de contaminación, si la cantidad del agua se vuelve insuficiente y no permite una buena difusión de solutos y el gas, el metabolismo celular se desacelera o se detiene, debido a la falta de sustratos o por la concentración demasiado alta de metabolitos inhibitorios, así mismo, si la cantidad intracelular o extracelular de agua no permite el mantenimiento de las propiedades funcionales de algunas enzimas, su inactividad crea un desequilibrio en la cadena metabólica de las células. De la misma manera, si la transferencia de agua inducida por el estrés hídrico conduce a una desnaturalización de la estructura mecánica de la membrana plasmática, todas las propiedades de permeabilidad y transporte a través de la membrana se ven afectados y la célula es entonces perturbado, adicionalmente, el exceso de humedad puede inducir el desarrollo de vías metabólicas anaerobias (24); Por otro lado, una baja humedad conduce a un crecimiento limitado y disminuye la disponibilidad del sustrato (15, 23). En general, los procesos de fermentación en medio sólido con hongos filamentosos se desarrolla con humedades entre el 20 y el 60%, por lo que el valor empleado para el estudio, se considera apropiado (25).
De la misma manera, La aireación de los medios de cultivo es de gran interés para el desarrollo de fermentaciones con microorganismos, aerobios ya que permite realizar diferentes funciones: abastecimiento en oxígeno para los cultivos, regulación de la humedad, regulación de la temperatura eliminación de metabolitos volátiles (CO2, alcoholes), en procesos tecnificados la aireación se controla inyectando aire estéril a concentraciones adecuadas a los biorreactores (25), en el desarrollo de este trabajo se desarrollaron condiciones aerobio mediante el llenado con el sustrato del 50% del volumen las bandejas de fermentación, con una profundidad aproximada de 2cm.
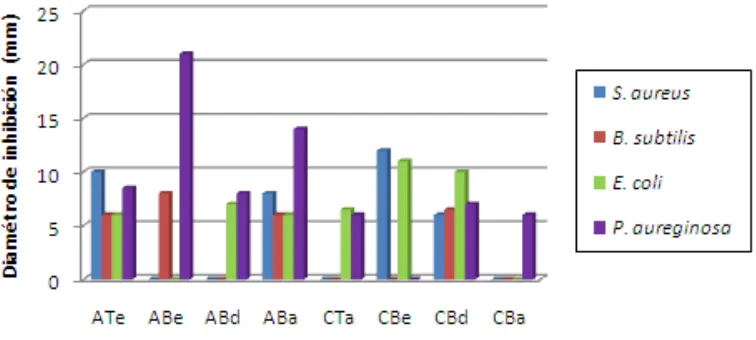
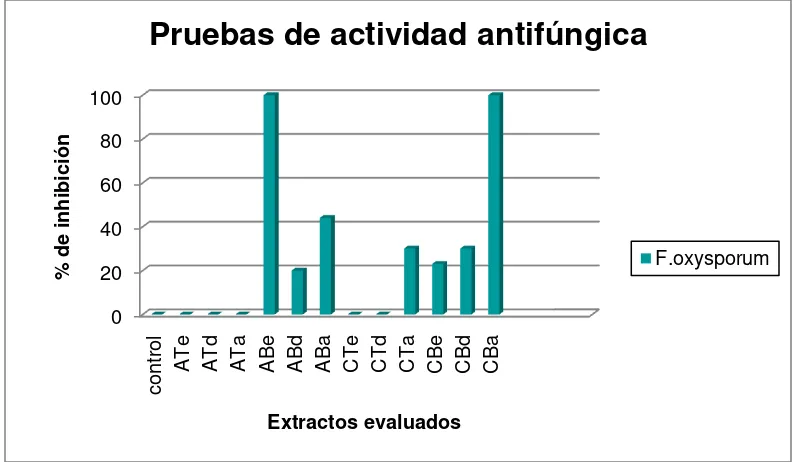
La actividad antibacteriana fue evaluada mediante la técnica de pozos a una concentración de 20mg/50µL en DMSO y la actividad antifúngica mediante difusión en placa de agar suplementando los medios con 50mg de cada extracto, los resultados obtenidos se representan en las figuras 5 y 6.
Figura 5. Resultado de pruebas de actividad antibacteriana de las fracciones obtenidas: ATe: arroz, tween, éter; ABe: Arroz, biomasa, éter; ABd: arroz, biomasa, diclorometano; ABa: Arroz,
biomasa, acetato; CTa: cebada, tween, acetato; CBe: cebada, biomasa, éter; CBd: cebada, biomasa, diclorometano, CBa: cebada, biomasa, acetato.
Fuente: Elaboración propia
Figura 6. Resultado de pruebas de actividad antifúngica de las fracciones obtenidas: ATe: arroz, tween, éter; ATd: arroz, Tween, diclorometano; ATa: arroz, tween, acetato; ABe: Arroz,
biomasa, éter; ABd: arroz, biomasa, diclorometano; ABa: arroz, biomasa, acetato; CTe: cebada, tween, éter; CTd: cebada, Tween, diclorometano; CTa: cebada, tween, acetato; CBe: cebada, biomasa, éter; CBd: cebada, biomasa, diclorometano, CBa: cebada, biomasa, acetato.
Fuente: Elaboración propia.
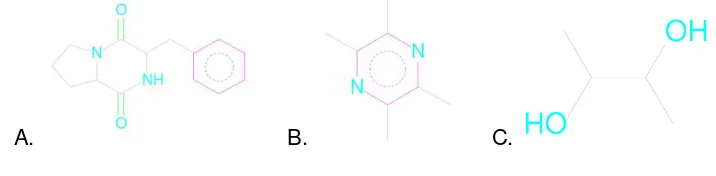
La actividad antifúngica obtenida es mayor a la reportada por García para el mismo microorganismo por fermentación en medio líquido quien reporta una inhibición del 73% a concentración de 2mg/mL de extracto obtenido a partir de 20L de fermentación, frente a una inhibición del 100% a una concentración de 7,1mg/mL de extracto obtenido a partir de 3 kg de medio (9). Adicionalmente, se le realizó cromatografía de gases a los extractos que mostraron actividad antimicrobiana, mediante el software del equipo, los cromatogramas obtenidos fueron comparados con una base de datos en la que se obtuvieron los compuestos descritos en la tabla 5 (anexo 6); los compuestos comunes para las fracciones con actividad fueron Tetrametilpirazina, Pyrrolo [1,2-α]pirazina-1,4-diona, y 1,3-butanodiol (figura 8). El compuesto al que se le atribuye la actividad antimicrobiana obtenido en medio líquido no se reportó en las fracciones del medio sólido, esto puede ser resultado de que el cambio de sustrato inhiba la síntesis de ciertos compuestos, o que la molécula de interés no se encuentre en la base de datos del cromatografo.
0 20 40 60 80 100 con tr ol A T e A T d A T a
ABe ABd ABa CT
e CT d CT a CB e CB d CB a % de inh ibición Extractos evaluados
Pruebas de actividad antifúngica
A. B. C.
Figura 8. Compuestos comunes en las fracciones activas.
A. Pyrrolo [1,2-α]pirazina-1,4-diona, B. Tetrametilpirazina, C. y 1,3-butanodiol. Fuente: elaboración propia
La actividad antimicrobiana obtenida, podría ser atribuida a la presencia de pirazinas, ya que las alquilpirazinas y pirrolpirazinas son derivados del pirazol, con actividad biológica demostrada (26), estas sustancias son precursores y forman parte del sitio activo de antibióticos del tipo quinolonas, que actúan sobre las bacterias bloqueando la enzima ADN girasa, inhibiendo la replicación (26). FoKs, Et al (2005), reportan actividad de 1H-pyrazolo[3,4-b]pyrazine contra las bacterias Staphylococcus aureus, Corynbacterium spp. , Klebsiella pneumoniae, Acinetobacter baumanii, Escherichia coli, Pseudomonas aeruginosa ,y Pseudomonas stutzeri, algunas especies de micobacterias y de hongos filamentosos, para los cuales las pirrol pirazinas poseen mayor efecto inhibitorio como 7-(1,2,3,4-tetrahydropyrrolo[1,2-a]- pyrazin-7-yl) quinolones (27). Las pirazinas pueden ser producidas por microorganismos mediante fermentación sólida, como B. subtilis y Aspergillus oryzae, las pirazinas de B. subtilis deben ser modíficadas por síntesis química para alcanzar efecto antibacterial, mientras que las de A. oryzae son por sí mismas, fuertes antimicrobianos, por ejemplo, el flavocol (28,29). Sin embargo, la actividad antimicrobiana no se podría atribuír a una única sustancia, es posible que la mezcla de dos o más sustancias en una fracción posean un efecto sinérgico sobre la inhibición de los microorganismos. El butoanodiol en sus isómeros 1,3 y 2, 3 es un comprobado agente antimicrobiano, aunque con reducido efecto empleado como excipiente en algunas preparaciones cosméticas, junto con sustancias de mayor actividad (19); Este diol, hace parte del metabolismo primario derivando de la condensación de dos moléculas de piruvaro provenientes del ciclo de los ácidos tricarboxílicos en una molécula de acetoína que es reducida a butanodiol (5).
bandas con los valores de Rf comunes y comportamiento similar frente a la luz ultravioleta, visible y al revelador ácido sulfúrico-vainillina, comenzaron aparecer entre los días 9 y 15, lo que indica la producción de sustancias propias del metabolismo secundario, sin embargo, para algunas fracciones de diclorometano y éter, las bandas comunes aparecieron desde el día 6, característica de metabolitos parcialmente asociados al crecimiento, estos datos concuerdan con lo reportado por FoKs, Et al (2005) y Yoshihito, S. Et al (2008). Los resultados obtenidos, corresponden a datos cualitativos que pueden dar una idea del comportamiento del metabolismo del microorganismo durante la fermentación, sin embargo, para detectar con seguridad la producción de pirazinas, sería necesario realizar pruebas cromatográficas como la de gases ya empleada a cada una de las fracciones de la cinética.
8. CONCLUSIONES Y RECOMENDACIONES
Se obtuvo actividad antibaceriana contra Bacillus subtilis, Pseudomonas areuginosa, Escherichia coli y Sthaphylococcus aureus en las fracciones de de tween-éter, arroz-biomasa-acetato, y cebada-biomasa-diclorometano, y actividad antifúngica frente a F. oxysporum, las fracciones Arroz-biomasa-éter y cebada-biomasa-acetato presentaron inhibición del 100% frente a F. oxysporum valor mayor que el alcanzado por los metabolitos obtenidos mediante fermentación liquida. No se detectó el compuesto metil-(2-oxo-3,4-dihidro-2H-chromen-6-il)-acetato, al cual se le atribuye la actividad antimicrobiana en medio líquido, sin embargo se detectó la presencia de pirazinas en las fracciones de mayor actividad antimicrobiana, compuestos con actividad antimicrobiana reportada, que son precursores y forman parte del sitio activo de las quinolonas.
9. REFERENCIAS
1. Hyuk Yu, J., Keller, N. Regulation of secondary Metabolism in Filamentous Fungi. Annual Review of Phytopathology. 2005 (42):437-458.
2. Arias, L., Piñeros, P. Aislamiento e Identificación de hongos filamentosos de muestras de suelo de los Paramos de Guasca y Cruz Verde. Tesis de Pregrado. Microbiología Industrial. Faculta de Ciencias. Pontificia Universidad Javeriana.2008. Bogotá.
3. Pitt JI, Hocking AD. Fungi and Food Spoilage. 2º edition . Blackie Academic & Professional. 1997. London, 259p.
4. Krska R . Mycotoxin Research. 2003. 13(1): 11-16.
5. Carrillo, L. Hongos de los Alimentos y los Forrajes. Primera edición. Editorial Salta, 2003. México, 165p.
6. T. Robinson, T., Singh, D., Nigam, P.,Solid-state fermentation: a promising microbial technology for secondary metabolite production. Apply Microbiology Biotechnology (2001) 55:284–289
7. Donadio, S., Monciardini, P., Alduina, R., Mazza, P., Chiocchini, C., Cavaletti, L., Sosio, M. Bioactive Microbial Metabolites. The Journal of Antibiotics (2005) 58, 1–26; doi:10.1038/ja.2005.1
8. Isaza, J. Agro, Farmacia y metabolitos secundarios: algo en común. En: Memorias del seminario internacional –ACCEFYN. Tendencias y futuro en investigación en parasitología y en productos naturales. Corredor, C. Guhl, F. Duque, C. (2009). Editorial Guadalupe S. A.
10. Aguilar, N., Gutiérrez, G. Prado, N. Rodríguez, R. Martínez, J. Contreras, J. Food Research Department, School of Chemistry. Universidad Autónoma de Coahuila, Saltillo, 25280, Coahuila, México. American Journal of Biochemistry and Biotechnology 4. (2008) 4: 354-366. ISSN 1553-3468
11. Hôlker, U., Hôfer, M., Lenz, J. Biotechnological advantages of laboratory-scale solide-state fermentation with fungi. Apply Microbiology Biotechnology (2004) 64:175-186.
12. Chitiva, A., Torrenegra, R. Cabrera, C. Díaz, N. Pineda, V. Contribución al estudio de microhongos filamentosos en los Ecosistemas páramo de guasca y el tablazo. Estudio preliminar de mohos de páramos colombianos. Tesis de maestría. (2009) Grupo de Investigación en Fitoquímica y Biotransformación, Departamento de Química, Pontificia Universidad Javeriana.
13. Rangel-Ch., J. O. Consideraciones sobre la diversidad y la vegetación de alta montaña en Colombia. En: J.A. Lozano & D. Pabón. (eds). Memorias del I seminario taller sobre alta montaña colombiana. Acad. Colombia Ciencia. Colección de Memorias, (2001) N° 3:33-60.
14. Olarte, P. Determinación de ácidos grasos como criterio quimiotaxonómico en cepas de Penicilliun sp. Y su correlación con las claves taxonómicas. Tesis de Pregrado (2003). Microbiología Industrial. Faculta de Ciencias. Pontificia Universidad Javeriana. Bogotá.
15. S. Roussos y I. Perraud-Gaime. Fisiologia y Bioquimica de Microorganismos Utilizados en Procesos de Fermentación en Medio Sólido. Laboratorie de Biotechnologie PMC, Centre ORSTOM,(1995) BP 5045,34034 Montpellier cedex
17. Chávez, M., Montaña, J. Martínez, M., Mercado, M., Rodríguez, M., Quevedo, B. Efecto del sustrato y la exposición a la luz en la producción de una cepa de Trichoderma sp. Universitas Scientiarum (2008) 13 (3): 245-251
18. Colegate, S., Molyneux, R. Bioactive natural products: detection, isolatin, and structural determination. Taylor and Francys group. Second edition. Boca ratón, (2007). 603 p
19. Puglia, M. Microbial Technologies forthe Discovery of Novel Bioactive Metabolites. Journal Biotechnology,(2002) 99: 187-198.
20. Kavanagh, K. Fungi: Biology and Applications. Wiley-Blackwell, United States (2005), 280 pp
21. Popoff, F., Wright, J. Hongos y Líquenes" en "Flora del Iberá", Cap. (2005) 7:381-415. M.M. Arbo & S.G. Tressens (Eds.), EUDENE. Buenos Aires.
22. Frisvad,C., Larsen, T,. Meijer, M., Houbraken, J., Cabañes, F. Secondary metabolite profiling, growth profiles and other tools for species recognition and important Aspergillus mycotoxins. Studies in Mycology (2007) 59: 31–37.
23. Krishna, C. 2005. Solid-State Fermentation Systems—An Overview. Critical Reviews in Biotechnology, 25:1–30, 2005. Copyright _c Taylor & Francis Inc. ISSN: 0738-8551 print / 1549-7801
24. Gervais, P., Molin, P. The role of water in solid-state fermentation. Biochemical Engineering Journal (2003)13: 85–101
25. Chandrakant G., Naresh J. Synthesis and preliminary evaluation of some pyrazine containing thiazolines and thiazolidinones as antimicrobial agents. Bioorganic & Medicinal Chemistry (2004) 12: 2151–2161
27. Bin Zhu, Brett A. Marinelli, Raul Goldschmidt, Barbara D. Foleno, Jamese J. Hilliard, Karen Bush, Mark J. Macielag. Synthesis and antibacterial activity of 7-(1,2,3,4-tetrahydropyrrolo[1,2-a]-pyrazin-7-yl) quinolones. Bioorganic & Medicinal Chemistry Letters 19 (2009) :4
28. Larroche, C., Besson, I., Gros, J., High pyrazine production by Bacillus subtilis in solid substrate fermentation on ground soybeans Process Biochemistry 34 (1999) 667–674
10. ANEXOS
[image:28.612.81.534.202.657.2]10. 1 Metabolitos del género Penicillium sp.
Tabla 1. Metabolitos secundarios del género Penicillium sp. de importancia biológica
Fuente: Carrillo, 2003
Metabolito Microorganismo Productor Características
OCRATOXINA A P. verrucosum y P. nordicum son sustancias liposolubles de difícil excreción que se acumulan en forma de depósitos lipídicos
PATULINA
P. griseofulvum, P. expansum, P. gladioli, P. sclerotigenum , P. claverigenum, P. vulpinum, P. concentricum, P. coprobium, P. glandicola, P. formosanum
y P. carneum.
Es una lactona tóxica, estable en medio ácido Esta toxina inhibe el desarrollo de los cultivos de Bacillus subtilis
CITRININA P. citrinu, P. verrucosum y P. expansum
Toxina letal para algunas aves de corral.
ÁCIDO
PENICÍLICO P. aurantiogriseum, P. notattum y P. simplicissimum
Lactona mutagénica que produce fluoresencia celeste con vapores de amoniaco
CITROVIRIDINA P. citreonigrum y Eupenicillium ochrosalmoneum
Neurotoxina consistente en un anillo lactona conjugado con un furano
CICLOCLOROTINA P. islandicum. Péptido cíclico que contiene cloro, hepatotóxico
PENITREMA P. crustosum,P. glandicola y P. janczewskii
Neurotoxinas productoras de temblores que pueden causar la muerte de los animales
ÁCIDO
SECALÓNICO D mononematosum P. oxalicum y P.
Xantona dimérica, que constituye un compuesto teratogénico
GRISEOFULVINA aethiopicum, P. coprophilum, P. griseofulvum, P. P. janczewskii, P. raistrickii
Neurotóxina que sido
considerada más bien un antibiótico tóxico que una micotoxina
VIOMELEÍNA Y XANTOMEGNINA
P. viridicatum, P.
aurantiogriseum Son naftoquinónicos pigmentos de tipo
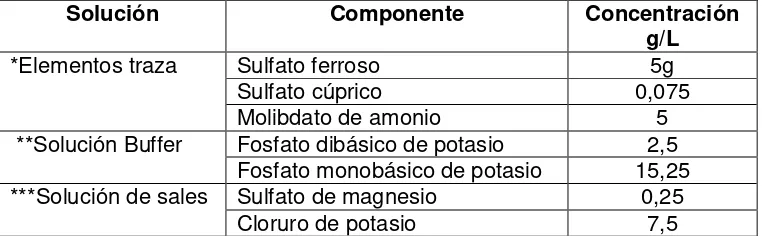
10.2 Medios de cultivo para la fermentación sólida
Tabla 2. Composición de los medios de cultivo para la fermentación en medio sólido.
Fuente: Elaboración propia
Composición de los medios de cultivo (para 300g)
sustrato 100g
Agua destilada 180ml
Solución de extracto de levadura (6% (p/v)) 10ml
Solución de elementos traza (*) 2ml
Solución buffer (**) 4ml
Solución de sales (***) 4ml
Tabla 3.Suplementos de los medios de cultivo para la fermentación en medio sólido.
Fuente: Elaboración propia
Solución Componente Concentración
g/L
*Elementos traza Sulfato ferroso 5g
Sulfato cúprico 0,075
Molibdato de amonio 5
**Solución Buffer Fosfato dibásico de potasio 2,5 Fosfato monobásico de potasio 15,25 ***Solución de sales Sulfato de magnesio 0,25
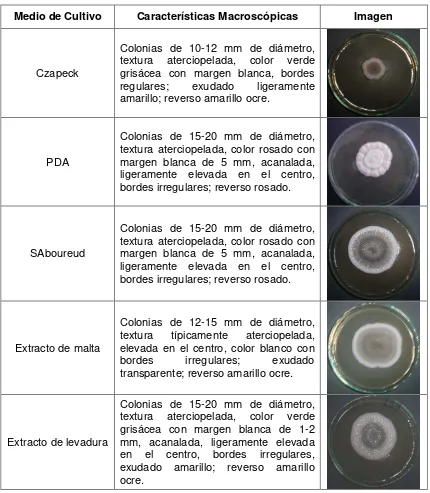
[image:29.612.117.498.405.523.2]10. 3. Pruebas de identificación macroscópica
Tabla 4. Identificación macroscópica de la cepa SPG91. Fuente: Elaboración propia
Medio de Cultivo Características Macroscópicas Imagen
Czapeck
Colonias de 10-12 mm de diámetro, textura aterciopelada, color verde grisácea con margen blanca, bordes regulares; exudado ligeramente amarillo; reverso amarillo ocre.
PDA
Colonias de 15-20 mm de diámetro, textura aterciopelada, color rosado con margen blanca de 5 mm, acanalada, ligeramente elevada en el centro, bordes irregulares; reverso rosado.
SAboureud
Colonias de 15-20 mm de diámetro, textura aterciopelada, color rosado con margen blanca de 5 mm, acanalada, ligeramente elevada en el centro, bordes irregulares; reverso rosado.
Extracto de malta
Colonias de 12-15 mm de diámetro, textura típicamente aterciopelada, elevada en el centro, color blanco con bordes irregulares; exudado transparente; reverso amarillo ocre.
Extracto de levadura
10.4. Sustratos empleados en fermentación sólida
Tabla 5. Producción de compuestos bioactivos mediante fermentación en medio sólido.
10.5. Montajes de fermentación
[image:32.612.106.501.110.647.2]
Figura 1. Montajes de fermentación en medio sólido: A. Cinética de crecimiento en arroz (30g), B.
cinética de crecimiento en cebada (30g), C. Fermentación de 300g en arroz, D. Fermentación de 300g en cebada.
Fuente: elaboración propia.
A B
C
10.6. Rendimiento de las fermentaciones
Tabla 6.Rendimiento de las fermentaciones de las pruebas preliminares. 100g de fermentación
Fracción obtenido (g) Extracto Rendimiento (mg/g)
Arroz
biomasa éter de petróleo 113.20 1.13
acetato de etilo 105.10 1.05
lavado tween éter de petróleo 87.70 0.88
acetato de etilo 95.50 0.96
Rendimiento promedio mg/g 1.00
Avena
biomasa éter de petróleo 49.20 0.49
acetato de etilo 56.10 0.56
lavado tween éter de petróleo 38.10 0.38
acetato de etilo 39.60 0.40
Rendimiento promedio mg/g 0.46
Cebada
biomasa éter de petróleo 119.90 1.20
acetato de etilo 123.80 1.24
lavado tween éter de petróleo 102.90 1.03
acetato de etilo 96.18 0.96
[image:33.612.112.505.445.705.2]Rendimiento promedio mg/g 1.11
Tabla 7.Rendimiento de las fermentaciones 3000g de fermentación
Fracción obtenido (g) Extracto Rendimiento (mg/g)
A
rr
o
z
biomasaEter de petróleo 5.29 1.762
Diclorometano 3.22 1.072
acetato de etilo 5.32 1.774
lavado de tween
Eter de petróleo 2.86 0.952
Diclorometano 0.43 0.144
acetato de etilo 1.00 0.334
Rendimiento promedio mg extracto/g arroz 1.006
C
eb
ad
a
biomasaEter de petróleo 5.33 1.776
Diclorometano 3.83 1.275
acetato de etilo 5.67 1.891
Lavado de tween
Eter de petróleo 2.54 0.848
Diclorometano 0.32 0.108
acetato de etilo 1.73 0.576
10.7. Pruebas de actividad antimicrobiana
1ª
1B
1C
1D
1E
1F
2ª
2B
2C
[image:34.612.104.521.121.566.2]2D
2E
2F
Figura 7. Pruebas de actividad antimicrobiana. 1. Contra P. aureginosa, 2. Comtra E. coli.
Fracciones probadas de izquierda a derecha: A. Arroz, biomasa, acetato –Arroz, biomasa, éter. B. Arroz, biomsa, diclorometano- Arroz, Tween, éter. C Cebada, Tween, acetato- Cebada, biomoasa, éter D.
1ª
1B
1C
1D
1E
1F
2ª
2B
2C
[image:35.612.101.523.71.550.2]2D
2E
2F
Figura 8. Pruebas de actividad antimicrobiana. 1. Contra S. aureus, 2. Contra B. subtilis.
Fracciones probadas de izquierda a derecha: A. Arroz, biomasa, acetato –Arroz, biomasa, éter. B. Arroz, biomsa, diclorometano- Arroz, Tween, éter. C Cebada, Tween, acetato- Cebada, biomoasa, éter D.
1 2 3
4 5 6
7 8 9
[image:36.612.85.543.71.568.2]10 11 12
Figura 9 Pruebas de actividad antimicrobiana contra F. oxysporum .Difusión en placa de agar (7mg/ml)
A. Arroz, biomasa, acetato – 1. Arroz biomasa éter. 2 cebada biomasa acetato, 3. Cebada Tween acetato, 4. Arroz biomasa acetato, 5. Arroz biomasa diclorometano, 6. Cebada biomasa diclorometano,
10.8. Cromatografías en capa fina
1A 1B 1C
2A 2B 2C
[image:37.612.103.478.120.651.2]
3A 3B 3C
Figura 10.Cromatografía en capa fina de los extractos obtenidos de la fermentación en medio sólido.
Carril 1: arroz-tween; Carril 2. Arroz-biomasa; Carril 3: Cebada-tween; Carril 4:Cebada biomasa. 1. Fracción de éter de petróleo; 2. Fracción de diclorometano; 3. Fracción de acetato de etilo;
1A 1B
2A 2B
[image:38.612.95.522.102.619.2]3A 3B
Figura 11.Cromatografía en capa fina de las curvas de crecimiento.
Imágenes: de izquierda a derecha: curva en arroz, curva en cebada. Carriles: de izquierda a derechas:
1
2
[image:39.612.176.434.77.626.2]3
Figura 12.Cromatografía en capa fina de las curvas de crecimiento reveladas con vainillina.
Imágenes: de izquierda a derecha: curva en arroz, curva en cebada. Carriles: de izquierda a derechas:
10.9. Cromatografía de gases
Tabla 9.Relación de los compuestos encontrados por cromatografía de gases. Fuente: Elaboración
propia
Fracción
Compuestos encontrados %
coincidenci a
Abundancia en la fracción
(%) Tiempo de
retención
(min) Compuesto
Arroz biomasa
acetato
5,919 tetramethyl pyrazine 94 11,5
2,442 2,3-Butanediol 91 2,5
2,331 n-Butyl acetate 86 9,65
2,439 1,3-Butanediol 91 2,5
Arroz biomasa éter
5,915 tetramethyl pyrazine 94 5,318
15,525 Ethyl palmitate 99 2,152
15,710 Hexadecanoic acid 99 15,342
17,580 Ethyl linoleate 93 3.008
17,918 9, 12-Octadecadienoic acid 99 41,709
Arroz tween éter
12,649 5-hydroxy-2-
(hydroxymethyl)- 4H-Pyran-4-one
90 2,045
17,591 Ácido oléico 99 2,70
Arroz biomasa Diclorometano
15,623 n-Hexadecanoic acid 98 3,43
17,780 9,17-Octadecadienal 90 2,4
20,996 9,12-Octadecadienoic acid 99 5,012
Cebada
tween Acetato 15,353 17,648 Hexadecanoic acid 9-Octadecenoic acid 99 99 11,953 11,38 Cebada
Biomasa éter
20,996 9,12-Octadecadienoic acid 95 23,097
22,437 Testosterone 95 6,969
Cebada biomasa diclorometano
2,543 2,3-Butanediol 91 7,361
5,922 Tetramethylpyrazin 94 2,83
15,653 Hexadecanoic acid 99 10,388
17,840 9,12-Octadecadienoic acid 99 31,66
23,403 Pyrrolo[1,2-a]pyrazine -1,4-
dione 97 1,853
Cebada biomasa
acetato
2,459 2,3-Butanediol 91 1,233
5.992 Tetramethylpyrazin 92 2,817
15,649 Hexadecanoic acid 99 1,320
17,573 9,12-Octadecadienoic acid 98 1,002
23,399 Pyrrolo[1,2-a]pyrazine -
Figura 13.Cromatograma general fracción arroz, biomasa, acetato
Figura 15.Cromatograma general fracción arroz, tween, éter