INSTITUTO POLITÉCNICO NACIONAL
ESCUELA SUPERIOR DE INGENIERÍA MECÁNICA Y ELECTRICA
UNIDAD PROFE“IONAL ADOLFO LÓPEZ MATEO“
PROTECCIÓN CATÓDICA CON ÁNODO“ DE “ACRIFICIO
TIPO BRAZALETE PARA TUBERÍAS SUBMARINAS
EN LA “ONDA DE CAMPECHE
MEMORIA DE EXPERIENCIA PROFESIONAL
QUEPARA OBTENER EL TITULO DE:
INGENIERO ELECTRICISTA
PRESENTA:
SERGIO RAÚL ARTEAGA AQUINO
ASESORES:
ING. RUBEN DE JESÚS NAVARRO BUSTOS
ING. JORGE RAMÍREZ GONZÁLEZ
INSTITUTO
POLITECNJC:O
NACIONi\L
EScUEtA SUPERIOR DE INGENIERíA M ECÁNICA y ÉLECTRICA
UNIDAD
pヲセofesional@
セGaooャfo@
tÓPEZ
mateosセG@
REPORTE TÉCNIC()
INGENIERO ELECTRICISTA MEMORIA DE EXPERIENCIA PROFESIONAL SERGIO RAÚL ARTEAGA AQUINO
"PROTECCIÓN CATÓDICA CON ÁNODOS DE SACRIFICIO TIPO BRAZALETE PARA
TUBERÍAS SUBMARINAS EN LA SONDA DE CAMPECHE"
ESTABLECER LOS REQUISITOS TÉCNICOS, CRITERIOS, METODOLOGÍAS, ESPECIFICACIÓN DE MATERIALES E INSTALACIÓN DE LOS SISTEMAS DE PROTECCIÓN CATÓDICA EN ESTRUCTURAS ENTERRADAS O SUMERGIDAS, UTILIZADAS PARA LA EXPLOTACIÓN, TRANSPORTE Y ALMACENAMIENTO DE HIDROCARBUROSPOR LA IMPORTANCIA DE ESTO, DEMANDA LA APLICACIÓN DE UNA PROTECCIÓN CATÓDICA PARA GARANTIZAR UNA VIDA DE USO ÚTIL AMPLIA, APLICANDO LOS MÁS
ESTRICTOS NIVELES DE SEGURIDAD, EFICIENCIA, CONFIABILIDAD y RÉNT ABILIDAD,
PARA LA VIGILANCIA CONTINUA, LA INTEGRIDAD INTERNA Y EXTERNA DE LOS DUCTOS.
>
INTRODUCCIÓN>
FUNDAMENTOS BÁSICOS SOBRE CORROSIÓN.>
FUNDAMENTOS BÁSICOS DE PROTECCIÓN CATÓDICA.>
INSTALACIÓN y MANTENIMIENTO DE LA P OTECCIÓN CATÓDICA. >-SÚS NAV ARRO BUSTOSMEXICO D.F., A 20 DE ENERO DEL 2014
ASESOR
NイッZ[MeMrセirrコ@ GONZÁLEZ セ@r-,.,.,
r-;,''...
セ@ ''1v:¡
セセ@Señor DIOS gracias por permitirme ver el amanecer un día más para concluir mis estudios profesionales, que sea tu luz la que ilumine y guie mis pasos cada día de mi vida.
A mis padres, de quienes recibí su tiempo, dedicación y esfuerzo. Y en memoria de mi padre que lo recuerdo siempre por su gran corazón, tenacidad, honradez y fortaleza por la vida. A ti mamá que siempre nos apoyaste a mis hermanos y a mí en todo momento, para que continuáramos con nuestros estudios y preparación, estaré siempre muy agradecido.
A mi alma gemela, mi esposa Laura, que siempre y en todo momento e recibido su gran apoyo, amor y cariño, a Tere a quien agradezco sus buenos consejos de madre, al amigo Miguel gracias por su compañía. A todos los amo.
A mis hermanos, con quienes comparto momentos y vivencias muy especiales de nuestras vidas, y aunque todos tenemos ocupaciones y algunos de nosotros nos encontramos a distancia, los recuerdo con cariño y también agradezco su compañía y apoyo, por siempre, gracias.
A todos aquellos Maestros, Doctores y personal docente de esta Gran Institución por sus sabias experiencias vertidas en los salones de clases y ejemplo a seguir, y muy en especial al Ing. Rubén Navarro Bustos y Ing. Jorge Ramírez Gonzalez. Muchas gracias.
A la Empresa PROTEXA. S.A de C.V; gracias por la confianza y el apoyo recibido durante este tiempo, así como al Ing. Sergio Uribe Leal y al Ing. Alfredo Arroyo Meléndez, de quienes he tenido la oportunidad de aprender y adquirir conocimiento. Muchas gracias.
Y para todos aquellos grandes amigos que me dieron su apoyo con explicaciones consejos información desarrollo y sobre todo su tiempo el cual no podré pagar pero si dejar constancia de su apoyo; en este trabajo.
Página 3 LINEAS MARINAS
INDICE
OBJETIVO --- 7
JUSTIFICACION --- 9
INTRODUCCION. --- 13
CAPITULOI. --- 19
I.1.FUNDAMENTOSBASICOSSOBRECORROSIÓN. --- 19
I.2.-FORMASDELACORROSIÓN. --- 20
I.3.CORROSIÓNGALVANICAYUNIFORME. --- 20
I.4.CORROSIÓNPOREROSIÓN --- 21
I.5.CORROSIÓNPORAGRIETAMIENTO --- 22
I.6.CORROSIÓNPORPICADURA. --- 23
I.7.CORROSIÓNPOREXFOLIACIÓNYDISOLUCIONSELECTIVA. --- 23
I.8.CORROSIÓNINTERGRANULAROINTERCRISTALINA. --- 24
I.9.CORROSIÓNDEFRACTURAPORTENSIÓN. --- 24
CAPITULOII. --- 29
II.FUNDAMENTOSBÁSICOSDEPROTECCIÓNCATODICA. --- 29
II.1.DEFINICIÓNDEPROTECCIÓNCATÓDICA. --- 29
II.2.MEDIDADEPOTENCIALES. --- 29
II.3.CRITERIOSDEPROTECCIÓN. --- 30
II.4.PRODUCTOSDELACORROSIÓN. --- 31
II.5.REACCIONESANODICAS. --- 31
II.6.REACCIONESCATÓDICAS. --- 31
II.7.FENÓMENOSDEPOLARIZACIÓN. --- 32
II.8.POTENCIALDECORROSIÓN. --- 33
II.9.POTENCIALESDEOXIDOREDUCCIÓN. --- 33
II.10.CRITERIOPARACORROSIÓN. --- 33
II.11.DIAGRAMASDEPOTENCIALIONPH. --- 34
II.12.CORROSIÓNGALVÁNICA. --- 35
II.13.RECONOCIMIENTODELACORROSIÓNGALVÁNICA. --- 35
II.14.PREVENCIÓNDELACORROSIÓNGALVÁNICA. --- 35
II.15.FORMASDEPREVENCIÓNDELACORROSIÓN. --- 36
II.16.MEDIASCELDASDEREFERENCIA. --- 37
II.17.ELECTRODOSDEREFERENCIA. --- 37
II.18.DIFERENTESZONASDECORROSIÓNENUNAPLATAFORMAMARINA. --- 41
CAPITULOIII. --- 45
III.FUNDAMENTOSBASICOSSOBREPROTECCIÓNCATODICA. --- 45
III.1.PARÁMETROSDEDISEÑODEPROTECCIÓNCATÓDICAPARADUCTOSMARINOS. --- 45
III.2CRITERIOSDEPROTECCIÓNCATÓDICA. --- 45
III.3.REQUERIMIENTOSDECORRIENTEPARADUCTOSMARINOS. --- 46
III.4.FACTORESDEDAÑOPARARECUBRIMIENTOSDELDUCTOMARINO(ƑC). --- 47
III.5.FUNCIONALIDADDEÁNODOSGALVÁNICOSPARADUCTOSMARINOS. --- 48
III.6.SELECCIÓNDELMATERIALDELÁNODO. --- 48
III.7.PROPIEDADESELECTROQUÍMICAS. --- 49
III.8.FORMAYFACTORDEUTILIZACIÓNDELÁNODO. --- 49
III.9.CONSIDERACIONESMECÁNICASYELÉCTRICASESPECIALES. --- 49
III.10.INSPECCIÓNDELOSANODOSENELPATIOANTESDESERINSTALADOS. --- 50
III.11.MUESTREO. --- 51
III.12. IDENTIFICACIÓNDELLOTEDEÁNODOS. --- 51
III.13.DENTIFICACIÓNFÍSICAPORLOTEYPORCOLADA: --- 52
III.14.IDENTIFICACIÓNFÍSICAPORÁNODO: --- 52
III.15.INFORMACIÓNCONTENIDAENELCERTIFICADODECALIDAD: --- 52
III.16.INSPECCIÓNYPRUEBAS. --- 53
III.17.DIMENSIONESYPESO. --- 53
III.18.CRITERIODEACEPTACIÓN. --- 54
III.19.MANEJOYTRANSPORTE. --- 54
III.20.ALMACENAMIENTO. --- 55
LINEAS MARINAS Página 4
III.22.SOLDADURADEÁNODOS. --- 56
III.23.INSPECCIÓNALSISTEMADEPROTECCIÓNCATÓDICA. --- 58
III.24.DUCTOSMARINOS. --- 58
III.25.MÉTODOPARADETERMINACIÓNDEPOTENCIALESELÉCTRICOSENDUCTOSASCENDENTES. --- 58
III.26.DISEÑODELOSÁNODOSDESACRIFICIO. --- 60
III.27.DENSIDADDECORRIENTENECESARIA. --- 61
III.28.TIEMPODEPROTECCIÓN. --- 61
III.29.PARÁMETROSDEDISEÑOENLAPROTECCIÓNCATÓDICA. --- 61
III.30.PERFILDETEMPERATURA. --- 61
III.31.CRITERIOSPARAELSISTEMADEPROTECCIÓNCATÓDICA. --- 61
III.32.REQUERIMIENTOSDECORRIENTEYFACTORESDEFALLADELRECUBRIMIENTO. --- 61
III.34.RESISTIVIDADDELAMBIENTE. --- 62
III.35.CALCULODELARESISTENCIADELÁNODO. --- 62
III.36.PARÁMETROSDEDISEÑOENLOSÁNODOSDESACRIFICIO.(MATERIALDELÁNODO). --- 63
III.37.CAPACIDADELECTROQUÍMICA. --- 63
III.38.POTENCIALDELÁNODOPARACIRCUITOCERRADO. --- 63
III.39.FACTORDEUTILIZACIÓNDELÁNODO. --- 63
III.40.INSTALACIÓNDEÁNODOS. --- 63
III.41.CONSIDERACIONESENLAFABRICACIÓNDEÁNODOS. --- 64
III.42.EJEMPLOPARAELDISEÑODEANODOSDEALUMINIO. --- 64
III.43.INSTALACIÓNYMANTENIMIENTODELOSÁNODOSDESACRIFICIO. --- 67
III.44.MANTENIMIENTOPREVENTIVO. --- 68
III.45.VENTAJASDELMANTENIMIENTOPREVENTIVO. --- 68
III.46.FASESDELMANTENIMIENTOPREVENTIVO: --- 68
III.47.ELMANTENIMIENTOCORRECTIVO. --- 68
III.48.INSPECCIÓNDELOSÁNODOSDESACRIFICIO. --- 69
III.49.LIMITACIONESDELEQUIPOUTILIZADO. --- 70
CAPITULOIV. --- 73
IV.FASESDETENDIDODELINEASSUBMARINAS. --- 73
IV.1.GENERALIDADES. --- 73
IV.2INGENIERÍA.--- 74
IV.3.PROGRAMADECONSTRUCCIÓN. --- 77
IV.4.FABRICACIONDEMATERIALES. --- 79
IV.5.RECEPCIÓNDEMATERIALES. --- 79
IV.6.CERTIFICACIONDEMATERIALES. --- 79
IV.7.PROTECCIONANTICORROSIVAYLASTRADODETUBERÍA.--- 79
IV.8.PROTECCIÓNANTICORROSIVA.--- 80
IV.9.RECUBRIMIENTOCONCINTATERMOCONTRACTIL. --- 80
IV.10.RECUBRIMIENTOEPOXICO. --- 80
IV.11.RECUBRIMIENTOCONESMALTE. --- 81
IV.12.PROTECCIÓNCATÓDICA. --- 81
IV.13.LASTRADODETUBERÍA --- 82
IV.14.FABRICACIONDEELEMENTOS. --- 82
IV.15.CALIFICACIÓNDEPROCEDIMIENTODESOLDADURA. --- 83
IV.16.CALIFICACIÓNDESOLDADORES. --- 84
IV.17.ARMADOYSOLDADURADEELEMENTOS. --- 84
IV.18.TENDIDODETUBERIA. --- 84
IV.19.PREPARATIVOSPARACONSTRUCCIÓNDELÍNEA. --- 85
IV.20.TRANSPORTEYRECEPCIÓNDETUBERÍA. --- 85
IV.21.LIMPIEZADETUBERÍA. --- 85
IV.22.ALINEAMIENTODETUBERÍA. --- 85
IV.23.PRODUCCIÓNDESOLDADURAS. --- 86
IV.24.DETECTORDEPANDEO. --- 86
IV.25.EMBARCACIONES. --- 86
IV.26.PROCEDIMIENTODEINSTALACIÓN. --- 87
IV.27.INSTALACIÓNDEELEMENTOS. --- 89
IV.28.INSTALACIONDECURVADEEXPANSION. --- 90
Página 5 LINEAS MARINAS
IV.30.INSTALACIÓNDELCUELLODEGANSO. --- 91
IV.31. INSTALACIÓNDELATRAMPADEDIABLOS. --- 91
IV.32.INSPECCIÓNFINAL. --- 92
IV.33.INSPECCIÓNDELDUCTOASCENDENTE. --- 92
IV.34.INSPECCIÓNDELACURVADEEXPANSIÓN. --- 92
IV.35.DRAGADOENTERRADOYACOLCHONAMIENTODELALÍNEAREGULAR. --- 92
IV.36.EQUIPODEDRAGADO. --- 93
IV.37.ACOLCHONAMIENTODECRUCESDELÍNEASYDISPAROSSUBMARINOS. --- 93
IV.38. SECUENCIAPARAACOLCHONAMIENTOS. --- 94
IV.39.PRUEBAHIDROSTÁTICAYLIMPIEZADEDUCTOSSUBMARINOSEINTERCONEXIONES. --- 94
IV.40.EQUIPOPARALLENADO. --- 95
IV.41.PRESIÓNDEPRUEBA. --- 95
IV.42.EQUIPOPARALAPRUEBADEPRESIÓN. --- 95
VI.43. REGISTRODELAPRUEBA. --- 97
IV.44.LIMPIEZAINTERIORDEDUCTOSSUBMARINOS. --- 98
IV.45.INSPECCIÓNDELDUCTO. --- 98
IV.46.ENTREGADELDUCTOALARAMAOPERATIVA. --- 99
ANEXOS --- 101
ANEXO1. --- 103
ANEXO2. --- 109
ANEXO3. --- 117
ANEXO4. --- 141
ANEXO5. --- 145
ANEXO6. --- 149
ANEXO7. --- 175
ANEXO8. --- 183
ANEXO9. --- 207
ANEXO10. --- 211
ANEXO11 --- 217
ANEXO12. --- 223
ANEXO13. --- 229
CAPITULO V. --- 235
V.1. ANALISISECONOMICODELASLINEASSUBMARINAS. --- 235
CONCLUSIONES --- 239
GLOSARIODETERMINOS --- 243
Página 7 LINEAS MARINAS
OBJETIVO
Página 9 LINEAS MARINAS
JUSTIFICACION
Página 11 LINEAS MARINAS
Página 13 LINEAS MARINAS
INTRODUCCION.
En PEMEX Exploración y Producción (PEP), al igual que en la mayoría de las industrias petroleras, uno de los retos que enfrentan en la actualidad dentro del ámbito es la construcción de Ductos Marinos dentro de la Sonda de Campeche en el Golfo de Mexico, para la explotación de hidrocarburos de ese sitio, cuyos ductos están construidos principalmente de partes metálicas.
Estas están construidas principalmente de acero al carbón para resistir la fuerte erosiona de los ambientes marinos, aproximadamente la protección catódica presenta sus primeros avances, en el año 1824, en que Sir. Humphrey Davy, recomienda la protección del cobre de las embarcaciones uniéndolo con hierro o zinc; habiéndose obtenido una apreciable reducción del ataque al cobre, a pesar de que se presentó el problema de ensuciamiento por proliferación de organismos marinos, habiéndose rechazado el sistema por problemas de navegación.
En 1850 y después de un largo periodo de estancamiento la marina canadiense mediante un empleo adecuado de pintura con antiorganismos y anticorrosivos demostró que era factible la protección catódica de embarcaciones con mucha economía en los costos y en el mantenimiento.
Para tener una pequeña idea de lo que esto puede suponer, entiéndase que aproximadamente un 30% de la producción anual de acero es destruido por la corrosión.
Las medidas preventivas tomadas para controlar la corrosión consisten fundamentalmente en : sistemas basados en protección catódica, son sin duda el método mas eficaz para controlar la corrosión en instalaciones enterradas e inmersas en agua de mar, estos sistemas, de acuerdo a su forma de operar, se clasifican como de corriente impresa y por ánodos de sacrificio, de los cuales los segundos se utilizan en las líneas y plataformas de la sonda de Campeche del Golfo de Mexico.
Por lo consiguiente a las líneas submarinas se le instalaran Ánodos de Sacrificio de Aluminio (aleación Al-In-Zn) tipo brazalete segmentado o molde cilíndrico, para protección catódica de tubería submarina, con composición química de acuerdo a la norma de referencia NRF-126-PEMEX-2011, considerando una vida útil de 20 años. Para que con ello se logren mantener en óptimas condiciones de operación, a los ánodos instalados comúnmente reciben el nombre de sistema de protección catódica con lo cual se evita que las líneas se deterioren por la corrosión agresiva existente costa fuera.
Para una mejor explicación la protección catódica se define como “El método de reducir o eliminar la
corrosión de un metal, haciendo que, la superficie de este, funcione completamente como cátodo cuando se encuentra sumergido o enterrado en un electrolito”.
Esto se logra haciendo que el potencial eléctrico del metal a proteger se vuelva más electronegativo mediante la aplicación de una corriente directa a la unión de un material de sacrificio (comúnmente magnesio, aluminio o zinc).
Normalmente, el método es aplicable a estructuras de fierro y acero pero, también, se usa en grado limitado en plomo, aluminio y otros metales.
Las líneas por encontrarse dentro del agua de mar, están continuamente sufriendo el deterioro y el ingeniero se enfrenta siempre al problema de corrosión mencionado, pero para que se tomen las decisiones más acertadas, se deben de inspeccionar las líneas construidas, es aquí donde se deberá efectuar el monitoreo de la protección catódica con la más alta tecnología y con el mejor personal ampliamente capacitado.
El presente trabajo tiene el objetivo de “Dar a conocer el funcionamiento correcto de la protección catódica
así como su diseño”, para comprender este tema se consideraran conceptos principales, los cuales muestran los fundamentos básicos de corrosión, protección catódica, proceso de instalación de ánodos en la tubería, diseño de protección catódica, monitoreo e inspección de la protección catódica, finalmente definiremos los resultados, las conclusiones y las recomendaciones.
LINEAS MARINAS Página 14
México inicio la explotación de yacimientos de hidrocarburos en el mar frente a las costas de Tampico, Tamps, y Poza Rica, Ver., en el año de 1965, así, el 05 de Julio de ese año se descubre el campo "Tiburón" y el 16 de Septiembre del mismo el campo "Atún", el resultado de estas exploraciones fue altamente satisfactorio e influyó para que se decidiera a continuar la exploración con plataformas fijas.
En el año de 1975 se reinició la exploración de yacimientos en el mar, esta vez frente a las costas de Carnpeche, en un área de 700 Km² aproximadamente, que se localiza en un área de 80 Kms. al Noreste de Cd. del Carmen Camp.; en 1977 se revela que los descubrimientos realizados en la sonda de Campeche no constituyen una extensión del área de Reforma, si no que forma parte de un yacimiento gigantesco paralelo al anterior, y se autorizan de inmediato los trabajos previos para establecer la infraestructura necesaria para la explotación de esos recursos naturales, presentados en seis campos productores iniciales y uno actual.
1.- CANTARELL.
2.- ABKATUN.
3.- KU-MALOOB-ZAAP.
4.- POOL.
5.- CHUC.
6.- IXTOC.
7.- LITORAL TABASCO (TSIMIN-XUX).
Para llevar a cabo esta importante tarea se reunieron todas las áreas y especialidades de PEMEX, los trabajos de construcción e instalación en esta Zona Marina se iniciaron oficialmente el 20 de Octubre de 1978 con el tendido del oleoducto de 36"Ø por 161 Km. de longitud de "Akal-C" hacia dos Bocas, Tab., y unos días después, el 24 de mismo mes y año, con el lanzamiento al mar de la subestructura de la plataforma de perforación "Akal-C".
Al mismo tiempo se realizaron más perforaciones, exploraciones y estudios acerca de la rentabilidad de los equipos, siendo el resultado óptimo, por lo que se llevó a cabo la construcción de más plataformas para cubrir diferentes objetivos, siendo entre otros, los de: Perforación, Producción, Enlace, Habitación, Compresión, Rebombeo, Apoyo, telecomunicaciones, Etc., y como consecuencia. La construcción de los sistemas de ductos necesarios para la recolección, distribución y transporte de los productos de la perforación o de la separación.
Actualmente la Subdirección de Servicios a Proyectos (SSAP)/ Gerencia de Servicios a Proyectos Regiones Marinas (GSPPM), tiene a su cargo la responsabilidad de la instalación de las diversas líneas de conducción, que varían de 06"Ø (152.4 mm.) a 48"Ø (1219.2 mm.).
Los trabajos de instalación de plataformas en la Sonda de Campeche iniciaron oficialmente el 24 de Octubre de 1978 con el lanzamiento al mar de la subestructura de la plataforma de perforación de Akal-C. En la actualidad el campo Cantarell es sin duda el más importante de México, su producción en diciembre de 1985, fue de 975 MBI/Dia, que represento el 35% de la producción total del país en esa época. La productividad de los pozos es relativamente alta, pues actualmente la sonda de Campeche sola produce más de 2'000.000 de BI/DIA. Siendo la explotación de crudo un aspecto importante para nuestro país.
Las tuberías de diferentes diámetros y espesores que han sido instaladas en el Golfo de México (Sonda de Campeche) para transporte de hidrocarburos a los centros de exportación y procesamiento obliga a los ingenieros mexicanos a desarrollar criterios que faciliten el diseño y construcción de ductos, con el fin de tener que recurrir lo menos posible a tecnología extranjera.
Página 15 LINEAS MARINAS Sonda de Campeche (zona de las líneas submarinas).
LINEAS MARINAS Página 16
Página 17 LINEAS MARINAS
Página 19 LINEAS MARINAS
CAPITULO I.
I.1. FUNDAMENTOS BASICOS SOBRE CORROSIÓN.
La vida útil del equipo de la industria petrolera se acorta a menudo como un resultado de la corrosión y en los últimos 10 años se ha tenido grandes adelantos en su detección y remedios aplicados para controlar, en la producción del petróleo.
En términos técnicos simplificados, la corrosión ha sido definida como la destrucción de un metal por reacción química o electroquímica por el medio ambiente y representa la diferencia entre una operación libre de problemas con gastos de operación muy elevados. Para efectos prácticos, es casi imposible eliminar la corrosión y el secreto efectivo de la ingeniería en este campo radica más en su control, que en su eliminación siendo necesario tomar en cuenta el fenómeno corrosivo desde el diseño de las instalaciones y no después de ponerlas en operación.
El ingeniero que trabaja en problemas de corrosión necesita saber dónde empezar y tener un conocimiento básico para reconocer la corrosión, cómo se produce, cómo impedir su severidad, qué herramientas son necesarias, técnicas de inspección, variables de diseño que afectan a la corrosión, selección de materiales y la forma de interpretar y aplicar la información del problema corrosivo, así como saber dónde obtener ayuda.
Todos los metales y aleaciones son susceptibles de sufrir el fenómeno de corrosión, no habiendo material útil para todas las aplicaciones. Por ejemplo el oro, conocido por su excelente resistencia a la atmósfera, se corroe si se pone en contacto con mercurio a temperatura ambiente. Por otra parte el acero no se corroe en contacto con el mercurio, pero rápidamente se oxida expuesto a la atmósfera. Afortunadamente se tienen bastantes metales que pueden comportarse satisfactoriamente en medios específicos y también se tienen métodos de control de la corrosión que reducen el problema. Los paros de las plantas pueden ocurrir y ocurren como un resultado de la corrosión, provocando gastos directos e indirectos de aspecto económico y humano.
Dentro de los aspectos económicos tenemos:
a).- Reposición del equipo corroído.
b).- Coeficiente de seguridad y sobre diseño para soportar la corrosión. c).- Mantenimiento preventivo como la aplicación de recubrimientos. d).- Paros de producción debidos a fallas por corrosión.
e).- Contaminación de productos.
f).- Pérdida de eficiencia ya que los coeficientes de seguridad, sobre diseño de equipo y productos de corrosión por ejemplo, decrece la velocidad de transmisión de calor en cambiadores de calor.
g).- Daño de equipo adyacente a aquel en el cual se tuvo la falla de corrosión.
Dentro de los aspectos humanos y sociales tenemos:
a).- La seguridad, ya que fallas violentas pueden producir incendios, explosiones y liberación de productos tóxicos.
b).- Condiciones insalubres por ejemplo, contaminaciones debido a productos del equipo corroído o bien un producto de la corrosión misma.
c).- Agotamiento de los recursos naturales, tanto en metales como en combustibles usados para su manufacturera.
d).- Apariencia, ya que los materiales corroídos generalmente son desagradables a la vista.
LINEAS MARINAS Página 20
I.2.- FORMAS DE LA CORROSIÓN.
La corrosión ocurre en muchas y muy variadas formas, pero su clasificación generalmente se basa en uno de los tres siguientes factores:
1.- Naturaleza de la substancia corrosiva. La corrosión puede ser clasificada como húmeda o seca, para la primera se requiere un líquido o humedad mientras que para la segunda, las reacciones se desarrollan con gases a alta temperatura.
2.- Mecanismo de corrosión. Este comprende las reacciones electroquímicas o bien, las reacciones químicas. 3.- Apariencia del metal corroído. La corrosión puede ser uniforme y entonces el metal se corroe a la misma velocidad en toda su superficie, o bien, puede ser localizada, en cuyo caso solamente resultan afectadas áreas pequeñas.
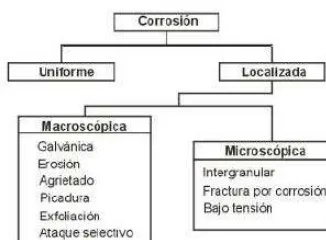
La clasificación por apariencia, uniforme o localizada, es muy útil para una discusión preliminar que en caso de requerirse en forma más completa, necesita del establecimiento de las diferencias entre la corrosión localizada de tipo macroscópico y el ataque microscópico local.
[image:21.612.236.399.294.414.2]En el ataque microscópico, la cantidad de metal disuelto es mínimo y puede conducir a daños muy considerables antes de que el problema sea visible. Los diferentes tipos de corrosión se presentan en la tabla No. 1 y se esquematizan en la figura No. 1, a continuación se enuncia cada una de estas formas.
Figura Nº 1 Tipos de corrosión
I.3. CORROSIÓN GALVANICA Y UNIFORME.
El ataque uniforme sobre grandes áreas de una superficie metálica (Figura N° 2) es la forma más común de la corrosión y puede ser húmeda o seca, electroquímica o química, siendo necesario seleccionar los materiales de construcción y los métodos de protección como pintura, para controlarla. Por otra parte, la corrosión uniforme es la forma más fácil de medir, por lo que las fallas inesperadas pueden ser evitadas simplemente por inspección regular.
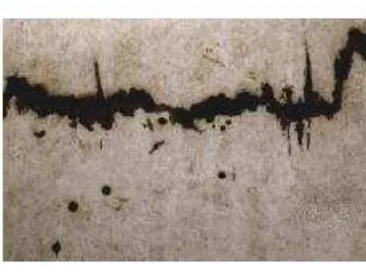
La corrosión galvánica se presenta, cuando dos metales diferentes en contacto o conectados por medio de un conductor eléctrico, son expuestos a una solución conductora. En este caso, existe una diferencia en potencial eléctrico entre los metales diferentes y sirve como fuerza directriz para el paso de la corriente eléctrica a través del agente corrosivo, de tal forma que el flujo de corriente corroe uno de los metales del par formado.
Mientras más grande es la diferencia de potencial entre los metales, mayor es la probabilidad de que se presente la corrosión galvánica debiéndose notar que este tipo de corrosión sólo causa deterioro en uno de los metales, mientras que el otro metal del par casi no sufre daño.
Página 21 LINEAS MARINAS
La relación de áreas entre los dos metales es muy importante, ya que un área muy grande de metal noble comparada con el metal activo, acelerará la corrosión, y por el contrario, una mayor área del metal activo comparada con el metal noble disminuye el ataque del primero.
La corrosión galvánica a menudo puede ser reconocida por el incremento del ataque junto a la unión de los metales, como se indica en la (Figura N° 2) y este tipo puede ser controlado por el uso de aislamientos o restringiendo el uso de uniones de metales cuando ellos forman diferencias de potencial muy grande en el medio ambiente en el que se encuentran. La diferencia de potencial puede ser medida, utilizando como referencia la serie galvánica de los metales y aleaciones que se presentan más adelante, en la serie de los potenciales tipo (standard) de óxido de reducción.
[image:22.612.213.387.194.320.2]Otro método para reducir la corrosión galvánica, es evitar la presencia de grandes áreas de metal noble con respecto a las de metal activo.
Figura Nº 2 Corrosión Uniforme.
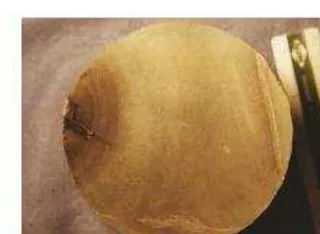
I.4. CORROSIÓN POR EROSIÓN
Cuando el movimiento del medio corrosivo sobre la superficie metálica incrementa la velocidad de ataque debido a desgaste mecánico, este recibe el nombre de corrosión por erosión. La importancia relativa del desgaste mecánico y la corrosión, es a menudo difícil de establecer y varia grandemente de una situación a otra, y el mecanismo de la erosión generalmente se atribuye a la remoción de películas superficiales protectoras, como por ejemplo, películas de óxido formadas por el aire, o bien, productos adherentes de la corrosión.
La corrosión por erosión, generalmente tiene la apariencia de picaduras poco profundas de fondo terso, como se ve en la Figura Nº.3, y el ataque puede presentar también una distribución direccional debido al camino seguido por el agente agresivo cuando se mueve sobre la superficie del metal, tal y como se muestra en la Figura N° 3. La corrosión por erosión prospera en condiciones de alta velocidad, turbulencia, choque, etc., y frecuentemente se observa en impulsores de bombas, agitadores y en codos y cambios de dirección de tuberías. Los líquidos con suspensión conteniendo partículas sólidas duras pueden igualmente causar este tipo de problema. La corrosión por erosión puede ser evitada por cambios de diseño o por selección de materiales más resistentes.
[image:22.612.219.379.574.691.2]LINEAS MARINAS Página 22
La corrosión por cavitación y desgaste (fretting) son formas especiales de la corrosión por erosión. La primera es causada por la formación y colapso de burbujas de vapor en la superficie del metal. Las altas presiones producidas por este colapso pueden disolver el metal, remover las partículas protectoras, etc.
La corrosión por desgaste (fretting) ocurre cuando las piezas de metal se deslizan una sobre la otra, causando daño mecánico a una o ambas piezas (Figura N° 3) y el deslizamiento es generalmente un resultado de la vibración.
La corrosión se cree que juega uno de los siguientes papeles: el calor de la fricción oxida el metal y a continuación el óxido se desgasta, o bien, la remoción mecánica de las partículas protectoras de óxido, o los productos de la corrosión resultantes, dan como resultado la exposición de superficies limpias del metal al medio agresivo, en tal forma que el fenómeno corrosivo se acelera.
La corrosión por deslizamiento se atenúa utilizando materiales de construcción más duros, empleando lubricación o bien incrementando la fricción hasta un punto tal en que el deslizamiento es imposible.
I.5. CORROSIÓN POR AGRIETAMIENTO
Las condiciones ambientales en una grieta, pueden con el tiempo volverse muy diferentes de las existentes en una superficie limpia y abierta, por lo que un medio ambiente muy agresivo puede desarrollar y causar corrosión en las grietas (Figura N° 4), Las grietas o hendeduras generalmente se encuentran en los empaques, traslapes, tornillos, remaches, etc., y también pueden formarse por depósitos de suciedad, productos de la corrosión y raspaduras en las películas de recubrimiento. La corrosión por agrietamiento, generalmente se atribuye a los siguientes factores:
a).- Cambios de acidez en la grieta o hendidura. b).- Escasez de oxígeno en la grieta.
c).- Desarrollo de iones diferentes en la hendidura. d).- Agotamiento de Inhibidor en la grieta.
[image:23.612.172.415.490.663.2]Al igual que todas las formas de corrosión localizada, la corrosión por agrietamiento no ocurre en todas las combinaciones metal-agente corrosivo, y algunos materiales son más susceptibles para producirla que otros, como por ejemplo aquellos que dependen de las películas protectoras de óxido formadas por el aire para adquirir su resistencia a la corrosión, tal y como sucede con el acero inoxidable y el titanio. Estos materiales pueden ser aleados para mejorar su resistencia y el diseño deberá hacerse de tal manera, que se reduzcan las hendiduras, tratando de mantener las superficies limpias para combatir este tipo de corrosión.
Página 23 LINEAS MARINAS
I.6. CORROSIÓN POR PICADURA.
La corrosión por picadura se presenta por la formación de orificios en una superficie relativamente in atacada y las picaduras pueden tener varias formas (Figura N° 5). La forma de una picadura es a menudo responsable de su propio avance, por las mismas razones mencionadas en la corrosión por agrietamiento, es decir, una picadura puede ser considerada como una grieta o hendidura formada por si misma. Para reducir la corrosión por picadura se necesita una superficie limpia y homogénea, por ejemplo, un metal homogéneo y puro con una superficie muy pulida deberá ser generalmente, mucho más resistente que una superficie que tenga incrustaciones, defectos o rugosidad.
[image:24.612.213.389.218.337.2]La corrosión por picadura es un proceso lento que puede llevarse meses y años antes de ser visible, pero que naturalmente, causará fallas inesperadas. El pequeño tamaño de la picadura y las minúsculas cantidades de metal que se disuelven al formarla, hacen que la detección de ésta sea muy difícil en las etapas iniciales.
Figura Nº 5 Corrosión por Picadura.
I.7. CORROSIÓN POR EXFOLIACIÓN Y DISOLUCION SELECTIVA.
La corrosión por exfoliación es una corrosión subsuperficial que comienza sobre una superficie limpia, pero se esparce debajo de ella y difiere de la corrosión por picadura en que el ataque tiene una apariencia laminar.
Capas completas de material son corroídas (Figura N° 6) y el ataque es generalmente reconocido por el aspecto escamoso y en ocasiones ampollado de la superficie.
Al final del ataque, una muestra tiene la apariencia de un mazo de barajas en el cual algunas de las cartas han sido extraídas. Este mecanismo es bien conocido en las aleaciones de aluminio y se combate utilizando aleaciones y tratamientos térmicos.
La corrosión por disolución selectiva se produce al efectuarse la remoción de uno de los elementos de una aleación siendo el ejemplo más común la eliminación del zinc en aleaciones de cobre-zinc, conocido con el nombre de dezincificación. Este fenómeno corrosivo produce un metal poroso (Figura N° 6) que tiene propiedades mecánicas muy pobres y obviamente el remedio a este caso es el empleo de aleaciones que no sean susceptibles a este proceso.
[image:24.612.213.389.590.702.2]LINEAS MARINAS Página 24
I.8. CORROSIÓN INTERGRANULAR O INTERCRISTALINA.
Para entender este tipo de ataque es necesario considerar que cuando un metal fundido se cuela en un molde, su solidificación comenzó con la formación de núcleos al azar, cada uno de los cuales crece en un arreglo atómico regular para formar lo que se conoce con el nombre de granos o cristales.
El arreglo atómico y los espaciamientos entre las capas de los granos, son los mismos en todos los cristales de un metal dado; sin embargo, debido a la nucleación al azar, los planos de los átomos en las cercanías de los granos no encajan perfectamente bien y el espacio entre ellos recibe el nombre de límite de grano. Si se dibuja una línea de 2.5 cm de longitud sobre la superficie de una aleación, esta deberá cruzar aproximadamente 100 límites de grano, los límites de grano son a veces atacados preferencialmente por un agente corrosivo y el ataque se relaciona con la segregación de elementos específicos o por la formación de un compuesto en el límite.
La corrosión generalmente ocurre, porque el agente corrosivo ataca preferencialmente el límite de grano o una zona adyacente a él, que ha perdido un elemento necesario para tener una resistencia a la corrosión adecuada.
En un caso severo de corrosión ínter cristalina, granos enteros se desprenden debido a la deterioración completa de sus límites (Figura N° 7), en cuyo caso, la superficie aparecerá rugosa al ojo desnudo y se sentirá rasposa debido a la pérdida de los granos.
El fenómeno de límite de grano que causa la corrosión Inter cristalina, es sensible al calor por lo que la corrosión de este tipo, es un subproducto de un tratamiento térmico como la soldadura o el relevado de esfuerzos y puede ser corregido por otro tipo de tratamiento térmico o por el uso de una aleación modificada.
Figura Nº 7 Corrosión Intergranular o Intercristalina.
I.9. CORROSIÓN DE FRACTURA POR TENSIÓN.
La acción conjunta de un esfuerzo de tensión y un medio ambiente corrosivo, dará como resultado en algunos casos, la fractura de una aleación metálica. La mayoría de las aleaciones son susceptibles a este ataque, pero afortunadamente el número de combinaciones aleación – corrosivo que causan este problema, son relativamente pocas.
Sin embargo, hasta la fecha, este es uno de los problemas metalúrgicos más serios. Los esfuerzos que causan las fracturas provienen de trabajos en frío, soldadura, tratamiento térmicos, o bien, pueden ser aplicados en forma externa durante la operación del equipo.
Las fracturas pueden seguir caminos Ínter cristalinos o transcristalinos (Figura N° 8) que a menudo presentan una tendencia a la ramificación. Algunas de las características de la corrosión de fractura por tensión, son las siguientes:
a) Para que esta corrosión exista, se requiere un esfuerzo de tensión.
b) Las fracturas se presentan quebradizas en forma macroscópica, mientras que las fallas mecánicas de la misma aleación, en ausencia de un agente corrosivo especifico, generalmente presentan ductibilidad.
Página 25 LINEAS MARINAS
d) Algunos medios ambientes específicos, generalmente causan fractura en una aleación dada. El mismo medio ambiente no causa fracturas en otras aleaciones.
e) La corrosión por esfuerzo puede ocurrir en medios ambientes considerados no
f) agresivos para una aleación dada, por ejemplo la velocidad de corrosión uniforme es baja hasta que se presenta una fractura.
g) Largos periodos de tiempo, a menudo años, pueden pasar antes de que las fracturas sean visibles, pero entonces al presentarse, se propagan rápidamente con el resultado de una falla inesperada.
h) La corrosión por esfuerzo, no está completamente entendida en la mayoría de los casos; sin embargo, en la actualidad se dispone de muchos datos para ayudar al ingeniero a evitar este problema. Para combatir la corrosión de fracturas por tensión, es necesario realizar el relevado de esfuerzo o seleccionar un material más resistente.
El término de fragilización por hidrógeno se confunde frecuentemente con la corrosión de fractura por tensión, debido a que el hidrógeno desempeña una función en algunos casos de ésta y para distinguir la fragilización por hidrógeno de la corrosión de fractura por tensión, es conveniente juzgar los siguientes conceptos:
a) La fractura debido al hidrógeno introducido en el metal sin corrosión de éste, por ejemplo, en la protección catódica, no es definitivamente corrosión de fractura por tensión.
b) La fractura debido al hidrógeno producido por una alta velocidad de corrosión
c) uniforme como en el decapado, tampoco es corrosión de fractura por tensión porque no se necesita tener un esfuerzo mientras el hidrógeno se produce y la fractura se presenta posteriormente cuando la tensión es aplicada después de la reacción corrosiva con liberación de hidrógeno.
d) Cuando el hidrógeno se produce por corrosión local en una fractura o picadura sobre un metal sometido a esfuerzo de tensión y resulta una propagación en la fractura, entonces sí se considera que la corrosión pertenece al tipo de corrosión de fractura por tensión.
La corrosión por fatiga, es una forma especial del tipo de corrosión de fractura por tensión y se presenta en ausencia de medios corrosivos, debido a esfuerzos cíclicos repetidos.
[image:26.612.210.393.498.634.2]Estas fallas son muy comunes en estructuras sometidas a vibración continua. La corrosión por fatiga, se incrementa naturalmente con la presencia de un medio agresivo, de tal forma que el esfuerzo necesario para producir la corrosión por fatiga, se reduce en algunas ocasiones hasta la mitad del necesario, para producir la falla en aire seco (Figura N° 8).
Figura Nº 8 Corrosión por Tensión.
Los métodos para evitar la corrosión por fatiga, necesitan prevenir la fractura producida por ésta desde el principio, ya que es muy difícil detener la propagación de las fracturas, una vez que se inician.
Página 27 LINEAS MARINAS
Página 29 LINEAS MARINAS
CAPITULO II.
II. FUNDAMENTOS BÁSICOS DE PROTECCIÓN CATODICA.
II.1. DEFINICIÓN DE PROTECCIÓN CATÓDICA.
La protección catódica se define como “el método de reducir o eliminar la corrosión de un metal, haciendo que, la superficie de este, funcione completamente como cátodo cuando se encuentra sumergido o enterrado en un electrólito”. Esto se logra haciendo que el potencial eléctrico del metal a proteger se vuelva más electronegativo mediante la aplicación de una corriente directa o la unión de un material de sacrificio (comúnmente magnesio, aluminio o zinc). Normalmente, el método es aplicable a estructuras de fierro y acero pero, también, se usa en grado limitado en plomo, aluminio y otros metales. Se debe recordar que el cátodo es aquel electrodo donde se desarrolla la reacción de reducción y prácticamente no ocurre corrosión alguna. Antes de aplicar la protección catódica, las estructuras corroíbles presentan áreas catódicas y anódicas (estas son aquellas donde la estructura se corroe). Por lo tanto, si todas las áreas anódicas se pudieran convertir en catódicas, la estructura completa funcionaría como un cátodo y la corrosión sería eliminada.
II.2. MEDIDA DE POTENCIALES.
La determinación para saber si una estructura se encuentra adecuadamente protegida, generalmente se basa en una medida de la FEM (voltaje) entre la estructura y un electrodo de referencia. Para la realización de ésta, se deben hacer conexiones tanto a la estructura como al electrólito, la conexión a la estructura por proteger se puede hacer mediante una barra de acero la cual se pone en contacto con aquella, mientras que la conexión al electrólito se puede hacer con una variedad de medios, pero como el potencial se desarrollará en este punto y formará parte del valor final, se deberá hacer con bastante exactitud y facilidad de reproducción, las lecturas de la medida del potencial estructura / electrólito siempre especificarán el tipo de electrodo de referencia usado. La conexión al electrólito se puede hacer simplemente sumergiendo un pedazo de metal dentro de aquél, este método es algunas veces aceptable, por ejemplo; (a) pequeños bloques de zinc puro se pueden emplear en ciertos sistemas de agua de mar donde la exactitud es de menor importancia, (b) un simple electrodo metálico que contacte al terreno puede ser satisfactorio cuando las medidas de potencial se hacen a intervalos relativamente cortos entre las condiciones “encendido y apagado” de la fuente de corriente.
LINEAS MARINAS Página 30
Este gradiente de potencial estará en función tanto de la resistividad del electrólito como de la corriente, así en los muelles sumergidos en agua salada (con una resistividad de 20 a 40 ohm-cm), la localización de la media celda se puede hacer a un pie o más de retirado pero en los condensadores que manejan agua aereada de alta resistividad y donde se necesitan grandes cantidades de corriente, el electrodo se debe localizar a una fracción de una pulgada de la superficie protegida.
En la medida del potencial, existen numerosos factores como la difusión del potencial, la variación de éste debido a la temperatura y la concentración del líquido que pueden ser causa de error, además existen errores inherentes en el aspecto eléctrico de la medida, es probable que en trabajos de campo se obtenga una exactitud no mayor de ±20 milivolts.
II.3. CRITERIOS DE PROTECCIÓN.
Cuando se aplica protección catódica a una estructura, es extremadamente importante saber si esta se encontrará realmente protegida contra la corrosión en toda su plenitud así que para la verificación existen diferentes criterios. Existen varios criterios para comprobar que la estructura en mención está exenta de riesgo de corrosión, basados en unos casos en función de la densidad de corriente de protección aplicada y otros en función de los potenciales de protección obtenidos. No obstante, el criterio más apto y universalmente aceptado es el de potencial mínimo que debe existir entre la estructura y el agua de mar, generalmente se basa en una medida de la Fuerza Electromotriz (FEM), medición que se realiza con un electrodo de referencia. El criterio de potencial mínimo se basa en los estudios realizados por el Profesor Michael Pourbaix, en 1939, quién estableció a través de un diagrama de potencial de electrodo Vs-pH del medio, un potencial mínimo equivalente a –0.85 volts con relación al electrodo de referencia cobre-sulfato de cobre, (Cu-SO4Cu) observando una zona definida por la inmunidad del acero.
[image:31.612.104.500.383.678.2]Los criterios de potencial mínimo de protección que se utilizará es de –0.85 volts respecto al Cu-SO4Cu como mínimo, ya que si se alcanzan valores en oscilan entre los –0.500 a – 0.600 volts el acero empezara a corroerse
Página 31 LINEAS MARINAS
II.4. PRODUCTOS DE LA CORROSIÓN.
El término productos de la corrosión se refiere a las substancias obtenidas durante las reacciones de corrosión y estas pueden ser solubles como en el caso del cloruro de zinc y del sulfato de zinc o insolubles como en el caso del óxido de fierro e hidróxido de fierro.
La presencia de los productos de la corrosión es una de las formas por las cuales se detecta ésta, por ejemplo el óxido. Sin embargo, es conveniente notar que los productos insolubles de la corrosión no siempre son visibles, por ejemplo al exponer una pieza de aluminio al aire, se forma una película de óxido casi invisible que protege al metal de un ataque posterior y la película es casi invisible porque es extraordinariamente delgada, siendo esta la razón del uso extensivo del aluminio en la construcción de ventanas, canceles y molduras automotrices.
II.5. REACCIONES ANODICAS.
Durante el ataque corrosivo la reacción anódica siempre es la oxidación de un metal a un estado superior de valencia, por ejemplo las reacciones 1, 2 y 3.
Zn + 2HCl = ZnCl2 + H2 ( 1 )
Fe + 2HCI = FeCI2 + H2 ( 2 )
2Al + 6HCI = 2AlCI3 + 3H2 ( 3 )
Todas ellas, representan la reducción de los iones hidrógeno a gas hidrógeno y la única diferencia entre ellas, es la naturaleza de sus procesos anódicos de oxidación dentro de esto podemos observar que la reacción catódica es simplemente el desprendimiento de gas hidrógeno.
Este desprendimiento de hidrógeno ocurre con una gran variedad de metales y de ácidos, tales como el clorhídrico, sulfúrico, fluorhídrico, acético, fórmico y otros ácidos orgánicos solubles en agua.
Separando las reacciones 1, 2 y 3 en reacciones anódicas y catódicas, vemos que la ecuación 1 representa la oxidación del zinc a sus iones, tal como se indica en las siguientes reacciones anódicas:
Zn = Zn+2 + 2e (4)
Fe = Fe+2 + 2e (5)
Al = Al+3 + 3e (6)
De acuerdo con estas reacciones, la reacción anódica se puede representar en forma general como sigue:
M = M+ n + ne (7)
Es decir, la corrosión del metal M da por resultado su oxidación para formar iones con valencia +n y la liberación de n electrones.
El valor de n depende de la naturaleza del metal, así por ejemplo, la plata es monovalente mientras que otros metales como el fierro, titanio y uranio son polivalentes y algunos pueden tener cargas positivas tan elevadas como 8.
La ecuación 7 es entonces general y se aplica a todas las reacciones de corrosión.
II.6. REACCIONES CATÓDICAS.
Hay varias reacciones catódicas que se encuentran durante la corrosión de los metales, tales como las que se enlistan a continuación: Desprendimiento de hidrógeno
2H++2e = H2 (8)
LINEAS MARINAS Página 32
O2 + 4H++ 4e = 2H2 O (9)
Reducción de oxígeno (en soluciones neutras o alcalinas)
O2 + 2H2 O + 4e = 4OH- (10)
Reducción de iones metálicos
Fe+3 + 1e = Fe+2 (11)
Depósito de metal
Cu+2 + 2e = Cu (12)
La reducción del oxígeno, ecuaciones 9 y 10, es una reacción catódica muy común ya que el oxígeno está presente en la atmósfera y las soluciones están expuestas a la misma. La reducción de iones metálicos y el depósito de metales aunque es menos frecuente, causan problemas de corrosión muy severos. Todas estas reacciones tienen en común que consumen electrones y todas las reacciones de corrosión son simplemente combinaciones de una o más de las reacciones catódicas indicadas, unidas con una reacción anódica similar a la ecuación 7.
Durante la corrosión puede ocurrir más de una reacción de oxidación y de reducción, así por ejemplo, durante el ataque de una aleación, los átomos de los componentes metálicos pasan a la solución en forma de iones, como sucede con la aleación de cromo fierro en donde tanto el cromo como el fierro son oxidados a iones.
II.7. FENÓMENOS DE POLARIZACIÓN.
Es de interés primordial del ingeniero de corrosión, el conocer la velocidad a la cual se desarrollan las reacciones catódicas y anódicas que pueden ser determinada por varios métodos físicos y químicos.
Cuando una reacción electroquímica se retarda, se dice que esta polarizada y hay dos tipos diferentes de polarización que son:
a) Polarización de activación. b) Polarización por concentración.
La polarización por activación: Se refiere a aquellos factores retardadores de la reacción que son inherentes a la reacción misma como por ejemplo, la velocidad a la cual los iones hidrógeno se reducen a gas hidrógeno, otro factor determinante de esto que incluyen la velocidad de transporte del electrón al Ion hidrógeno en la superficie metálica, que naturalmente es inherente de un metal en especial y depende de la concentración de iones hidrógeno y de la temperatura del sistema, por lo que la velocidad de desprendimiento del hidrógeno es muy diferente para cada metal.
Por otra parte, la polarización por concentración: Se refiere al retardo de la reacción electroquímica como un resultado de los cambios de concentración en la solución adyacente a la superficie metálica.
Si la reacción procede a muy alta velocidad y la concentración de iones hidrógeno de la solución es baja, se puede ver que la región cercana a la superficie metálica se agota en sus iones hidrógeno puesto que son consumidos en la reacción química. Bajo estas condiciones, la reacción es controlada por la velocidad de difusión de los iones hidrógeno a la superficie metálica.
La polarización por activación es generalmente el factor que controla la corrosión en ácidos fuertes, mientras que la polarización por concentración predomina cuando la concentración de las especies activas es baja, por ejemplo, en ácidos diluidos o en soluciones salinas y agua con oxígeno, ya que la solubilidad del oxígeno es muy baja en soluciones acuosas y en agua.
Página 33 LINEAS MARINAS
Por otra parte, si la reacción catódica se controla por polarización por activación, entonces la agitación no tendrá ningún efecto en la velocidad de corrosión, lo cual confirma que el conocimiento del tipo de polarización presente permite hacer predicciones muy útiles concernientes a efecto relativo que sobre la velocidad de corrosión puede ser producida por el aumento de velocidad de flujo de un líquido en una tubería.
II.8. POTENCIAL DE CORROSIÓN.
El potencial de un metal que se corroe es muy útil en los estudios de corrosión y se puede obtener fácilmente en el laboratorio y en condiciones de campo y se determina midiendo la diferencia de potencial existente entre el metal sumergido en un medio corrosivo y un electrodo de referencia apropiado.
Los electrodos de referencia más utilizados son el electrodo saturado de calomel, el electrodo de cobre – sulfato de cobre, plata-cloruro de plata y el de zinc puro.
La medición de la diferencia de potencial entre el metal que se corroe y el electrodo de referencia se lleva a cabo con la ayuda de un potenciómetro.
Al medir y reportar los potenciales de corrosión es necesario indicar la magnitud y el signo de voltaje obtenido.
II.9. POTENCIALES DE OXIDO REDUCCIÓN.
El potencial de óxido reducción se refiere al potencial relativo de una reacción electroquímica en condiciones de equilibrio por lo que las reacciones deben proceder a la misma velocidad en ambas direcciones. Estos potenciales también son conocidos con el nombre de potenciales Redox, potencial de media celda y serie de fuerzas electromotrices.
II.10. CRITERIO PARA CORROSIÓN.
Los potenciales de óxido reducción son muy útiles ya que pueden ser utilizados para predecir si un metal es o no corroído en un medio ambiente dado. Esto se puede establecer por medio de la siguiente regla generalizada:
“En cualquier reacción electroquímica la media celda más negativa tiende a oxidarse, mientras que la media celda más positiva tiende a reducirse”.
Se puede ver que todos los metales que tienen potenciales Redox más negativos que la media celda iones hidrógeno – gas hidrógeno, serán corroídos por soluciones ácidas lo cual incluye a metales como el plomo, estaño, níquel, fierro y aluminio junto con los metales con potenciales negativos.
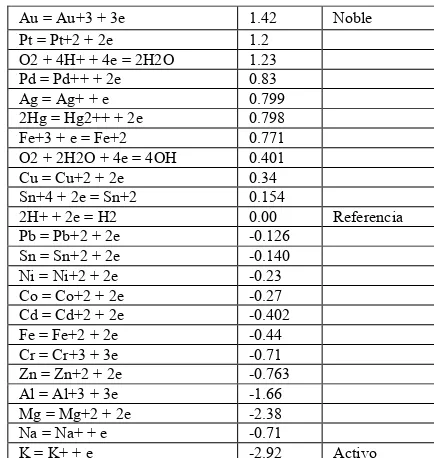
Por otra parte, el cobre, mercurio, plata, paladio y los otros metales con potenciales más positivos que la media celda iones hidrógeno – gas hidrógeno, no serán corroídos por soluciones ácidas, es decir, el cobre por ejemplo, podría ser un buen material para guardar ácidos, sin embargo el cobre se corroe si el ácido contiene oxígeno ya que el potencial Redox del cobre es menos positivo que el potencial de las dos medias pilas de oxígeno, tal y como se muestra en la tabla
LINEAS MARINAS Página 34
Tabla N° 1 Potenciales Standard de Óxido - reducci ón (Redox) a 25 ° C
II.11. DIAGRAMAS DE POTENCIAL ION PH.
El uso de los potenciales Redox puede ser extendido, graficando los potenciales Redox como función del pH de la solución. Estos diagramas se conocen como diagramas de Pourbaix y se elaboran utilizando cálculos electroquímicos, datos de solubilidad y constantes de equilibrio.
Es necesario recordar que el pH es simplemente el logaritmo negativo de la concentración de iones hidrógeno de tal manera que un pH de 7 indica que se tiene 10-7 iones gramo de hidrógeno por litro de solución y corresponde a una solución neutra, mientras que un pH =0 representa una solución muy ácida y un pH = 14, es una solución muy alcalina.
Diagrama de Pourbaix para el sistema Fe – H2O
El diagrama de Pourbaix para el sistema Fe – H2O permite ver que a potenciales más positivos que –0.6 volts y pH menor que nueve, los iones ferrosos son la substancia estable por lo que el fierro deberá corroerse en estas condiciones suministrando iones Fe+2 En otras regiones del diagrama se puede ver que la corrosión del fierro produce iones férricos, hidróxido ferroso y en condiciones muy alcalinas iones complejos de fierro.
Au = Au+3 + 3e 1.42 Noble
Pt = Pt+2 + 2e 1.2
O2 + 4H+ + 4e = 2H2O 1.23
Pd = Pd++ + 2e 0.83
Ag = Ag+ + e 0.799
2Hg = Hg2++ + 2e 0.798
Fe+3 + e = Fe+2 0.771
O2 + 2H2O + 4e = 4OH 0.401
Cu = Cu+2 + 2e 0.34
Sn+4 + 2e = Sn+2 0.154
2H+ + 2e = H2 0.00 Referencia
Pb = Pb+2 + 2e -0.126
Sn = Sn+2 + 2e -0.140
Ni = Ni+2 + 2e -0.23
Co = Co+2 + 2e -0.27
Cd = Cd+2 + 2e -0.402
Fe = Fe+2 + 2e -0.44
Cr = Cr+3 + 3e -0.71
Zn = Zn+2 + 2e -0.763
Al = Al+3 + 3e -1.66
Mg = Mg+2 + 2e -2.38
Na = Na+ + e -0.71
Página 35 LINEAS MARINAS
El principal uso de los diagramas de Pourbaix, que pueden ser constituidos para todos los metales son: 1.- Predecir si hay o no corrosión.
2.- Estimar la composición de los productos de la corrosión.
3.- Predecir cambios del medio ambiente que ayuden a prevenir o reducir el ataque corrosivo.
En el diagrama de Pourbaix en el sistema fierro agua, la región oscura indica que el fierro no se corroe bajo estas condiciones de potencial y pH, es decir si el potencial de corrosión del fierro se hace suficientemente negativo, por ejemplo –1.2 volts, el fierro no se corroerá en ningún sistema que varié desde pH muy ácido hasta pH muy básico. Esta observación es el fundamento de la protección catódica del fierro.
II.12. CORROSIÓN GALVÁNICA.
En las instalaciones de planta, se emplean una gran variedad de metales y aleaciones diferentes, que a menudo están en contacto físico y eléctrico. Este contacto o acoplamiento de metales diferentes algunas veces causa velocidad de corrosión elevada, que recibe el nombre de corrosión galvánica. La corrosión galvánica se presenta cuando se tienen las siguientes condiciones:
Cuando se conectan metales diferentes, el más activo o metal anódico se corroe más rápidamente que el metal
más noble o metal catódico tiende a protegerse.
A medida que la diferencia de potencial entre los dos metales se incrementa, la corrosión galvánica también
aumenta. Un ejemplo de la corrosión galvánica se presenta al conectar tuberías de aluminio y de fierro que dan como resultado una mayor velocidad de corrosión en la tubería de aluminio.
La corrosión galvánica se presenta también con mucha frecuencia en cambiadores de calor donde los tubos
generalmente son de cobre, mientras que el resto del cambiador de calor es de acero. En estas condiciones, la parte de acero funciona anódicamente disolviéndose mientras que los tubos de cobre funcionan catódicamente protegiéndose.
En el problema planteado del cambiador de calor se puede ver el efecto que las áreas de los diferentes metales
tienen en el fenómeno corrosivo y puede establecerse que a medida que la reacción del área catódica a área anódica se aumenta, la velocidad de corrosión se acelera.
II.13. RECONOCIMIENTO DE LA CORROSIÓN GALVÁNICA.
Antes de discutir la forma de prevenir la corrosión galvánica, es necesario asegurarse de que este tipo de corrosión está ocurriendo para lo cual es necesario que coincidan tres condiciones:
Presencia de dos metales electroquímicamente diferentes.
Contacto eléctrico entre los dos metales diferentes.
Los metales deberán estar expuestos a un electrolito.
II.14. PREVENCIÓN DE LA CORROSIÓN GALVÁNICA.
LINEAS MARINAS Página 36
Evitando el uso de metales diferentes siempre que esto sea posible. Si esto no es práctico, tratar de usar metales
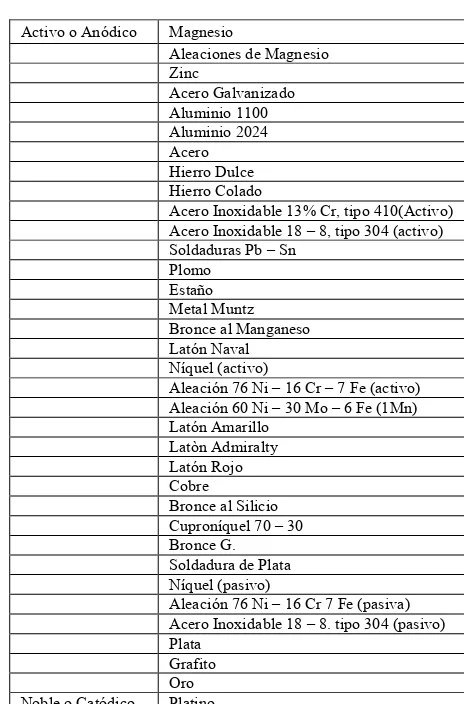
que estén lo más cercano posible entre sí en la serie galvánica. (Tabla Nº 2)
Es necesario evitar una relación de áreas desfavorables, es decir, bajo ninguna circunstancia conectar una
pequeña área anódica a una gran área catódica.
Si se utilizan metales diferentes, aislar eléctricamente uno del otro, instalando juntas de aislamiento.
Si se necesita utilizar metales diferentes, y no pueden ser aislados, las partes anódicas deberán ser diseñadas de
manera de poderlas reemplazar fácilmente o construirlas de materiales más gruesos para alargar la vida del equipo bajo los efectos de la corrosión.
Tabla N° 2 (Serie galvánica en agua de mar, de algunos materiales metálicos comerciales.
II.15. FORMAS DE PREVENCIÓN DE LA CORROSIÓN.
1. Para prevenir la corrosión es importante la homogeneidad del material existen cuatro métodos para
evitar la oxidación del hierro.
2. Mediante aleaciones del hierro que lo convierten en químicamente resistente a la corrosión, es el más
satisfactorio pero también el más caro. Un buen ejemplo de ello es el acero inoxidable, una aleación de hierro con cromo o con níquel y cromo. Esta aleación está totalmente a prueba de oxidación e incluso resiste la acción de productos químicos corrosivos como el ácido nítrico concentrado y caliente.
3. Amalgamándolo con materiales que reaccionen a las sustancias corrosivas más fácilmente que el hierro,
quedando éste protegido al consumirse aquéllas. Es igualmente satisfactorio pero también costoso. El ejemplo más frecuente es el hierro galvanizado que consiste en hierro cubierto con zinc. En presencia
Activo o Anódico Magnesio
Aleaciones de Magnesio Zinc Acero Galvanizado Aluminio 1100 Aluminio 2024 Acero Hierro Dulce Hierro Colado
Acero Inoxidable 13% Cr, tipo 410(Activo) Acero Inoxidable 18 – 8, tipo 304 (activo) Soldaduras Pb – Sn
Plomo Estaño Metal Muntz Bronce al Manganeso Latón Naval Níquel (activo)
Aleación 76 Ni – 16 Cr – 7 Fe (activo) Aleación 60 Ni – 30 Mo – 6 Fe (1Mn) Latón Amarillo
Latòn Admiralty Latón Rojo Cobre
Bronce al Silicio Cuproníquel 70 – 30 Bronce G. Soldadura de Plata Níquel (pasivo)
Aleación 76 Ni – 16 Cr 7 Fe (pasiva) Acero Inoxidable 18 – 8. tipo 304 (pasivo) Plata
Grafito Oro
[image:37.612.185.417.192.544.2]Página 37 LINEAS MARINAS
de soluciones corrosivas se establece un potencial eléctrico entre el hierro y el zinc, que disuelve éste y protege al hierro mientras dure el zinc.
4. Recubriéndolo electrolíticamente con una capa impermeable que impida el contacto con el aire y el
agua, es el más barato y por ello el más común. Este método es válido mientras no aparezcan grietas en la capa exterior, en cuyo caso la oxidación se produce como si no existiera dicha capa.
5. Pinturas, los recubrimientos más apreciados son los esmaltes horneados, y los menos costosos son las
pinturas de minio de plomo.
Algunos metales como el aluminio, aunque son muy activos químicamente, no suelen sufrir corrosión en condiciones atmosféricas normales. Generalmente el aluminio se corroe con facilidad, formando en la superficie del metal una fina capa continua y transparente que lo protege de una corrosión acelerada. El plomo y el zinc, aunque son menos activos que el aluminio, están protegidos por una película semejante de óxido. El cobre, comparativamente inactivo, se corroe lentamente con el agua y el aire en presencia de ácidos débiles como la disolución de dióxido de carbono en agua (que posee propiedades ácidas), produciendo carbonato de cobre básico, verde y poroso. Los productos de corrosión verdes, conocidos como cardenillo o pátina, aparecen en aleaciones de cobre como el bronce y el latón, o en el cobre puro, y se aprecian con frecuencia en estatuas y techos ornamentales. Algunos trabajos experimentales han demostrado que en el caso del acero sumergido en soluciones que contengan bacterias sulfato-reductoras, el potencial de protección mínimo será de –0.97 volts en lugar de –0.85 volts.
II.16. MEDIAS CELDAS DE REFERENCIA.
La fuerza electromotriz (FEM) posible medirla mediante la utilización de una media celda de referencia en contacto con un electrolito. Las medias celdas más conocidas en el campo de la protección catódica son:
HIDROGENO O CALOMELO (H+/H2)
ZINC PURO (Zn/Zn++)
PLATA-CLORURO DE PLATA (Ag/AgCl)
COBRE-SULFATO DE COBRE (Cu/SO4Cu)
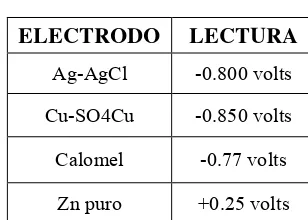
Estas medias celdas de referencia se utilizan en diferentes tipos de mediciones ya sea por su importancia o por el tipo de medio en que se desea medir, por ejemplo:
ELECTRODO LECTURA
Ag-AgCl -0.800 volts
Cu-SO4Cu -0.850 volts
Calomel -0.77 volts
[image:38.612.212.366.485.595.2]Zn puro +0.25 volts
Tabla N° 3
II.17. ELECTRODOS DE REFERENCIA.
LINEAS MARINAS Página 38
En las condiciones mencionadas, el potencial de este electrodo es únicamente función del pH, según la siguiente expresión: E = 0.059 pH
Tomando como referencia el electrodo de hidrógeno, el potencial de un metal cualquiera sumergido en una solución de sus iones de actividad igual a la unidad, corresponde a la fuerza electromotriz (FEM) de una pila, en la cual el semielemento metal / solución de sus iones actúa como polo positivo, o sea de cátodo, y el electrodo de H2 como polo negativo, o ánodo, según la convención propuesta por la Unión Internacional de Química Pura y Aplicada (IUPAC), universalmente aceptada. Lo anterior lo podemos representar de una manera esquemática como: -Pt, H2 (1 atm)/H+(aH+ = 1)// Me n+/Me +, donde una barra indica la presencia de una interface y la doble barra significa la presencia de una unión electrolítica o puente salino entre ambos semielementos de la pila. En la convención propuesta, el polo negativo o ánodo se coloca en el lado izquierdo de la pila, en la forma en que tiene lugar la reacción de oxidación: H2 2H++e-
Hay que resaltar que en la bibliografía norteamericana, es común que se trabaje con potenciales de oxidación, por lo que serán los mismos en valor absoluto, pero con el signo cambiado. Por ejemplo, el oro (Au) tiene un potencial de reducción alto y positivo porque es fuerte su tendencia a aparecer en su estado reducido; consecuentemente, su tendencia a la oxidación es pequeña y su potencial de oxidación es alto en valores absolutos, pero negativo.
Las dificultades operativas que se presentan en el manejo de un electrodo de hidrógeno, demasiado frágil para la mayoría de las aplicaciones prácticas, han dado lugar a la utilización de otros electrodos de referencia que lógicamente deben de reunir determinadas condiciones. Aparte de ser manejables y de construcción sencilla, la condición fundamental es que el potencial de equilibrio de la reacción de óxido-reducción (redox) que tenga lugar en ellos, permanezca constante respecto al electrodo de hidrógeno. En estas condiciones, en cualquier momento se podría referir un potencial al del electrodo de hidrógeno o viceversa. Como electrodos de referencia se utilizan los siguientes:
1) Electrodo de calomelanos. Este electrodo está formado por mercurio cubierto por una capa de cloruro insoluble (calomelanos), Hg2Cl2 en equilibrio con una disolución de cloruro potásico, KCl, que puede ser 0.1 N, 1 N o saturada. El contacto eléctrico con el mercurio se realiza por medio de un hilo de platino. Un esquema de este electrodo se presenta en la figura N° 1.
Figura Nº 1 Electrodos de referencia: a) Calomelanos saturado, EC S
La reacción del electrodo de calomelanos es: Hg2Cl2 + 2e- 2 Hg +2 Cl-.
Página 39 LINEAS MARINAS
2) Electrodo de plata/cloruro de plata (Ag/AgCl). Está formado por un hilo de Ag sobre el cual se deposita AgCl, generalmente por vía electroquímica, en una solución de NaCl o KCl, en la cual el hilo de Ag actúa como ánodo, como se muestra en la figura N° 2.
Figura Nº 2 Plata /cloruro de plata, Ag/AgCl
La reacción electrónica es la siguiente:
AgCl + e- Ag + Cl-, y su potencial de equilibrio a 25°C es: E = 0.2224 - 0.059 log [Cl-].
En agua de mar, el valor del potencial es aproximadamente de + 0.25 V respecto al electrodo normal de hidrógeno (ENH) a 25°C. El potencial del electrodo depende muy especialmente de la salinidad de la solución en la cual el electrodo está sumergido.
3) Electrodo de zinc (Zn). Está constituido por un bloque de Zn de alta pureza; generalmente se utiliza una aleación de Zn como la empleada para los ánodos galvánicos de Zn de composición.
Cuadro N°4 Electrodos de referencia.
La reacción electrolítica es la siguiente: Zn Zn2+ + 2e-, y su potencial de equilibrio a 25°C es: E = -0.763 + 0.0295 log [Zn2+] V vs. ENH
El potencial en agua de mar es de cerca de -0.80 V vs. ENH.
LINEAS MARINAS Página 40
Figura Nº 3 Zinc, Zn.
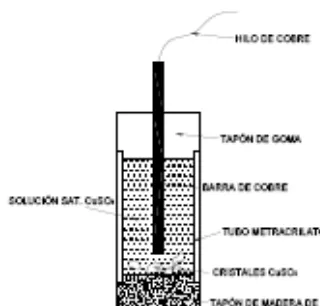
4) Electrodo de cobre/sulfato de cobre (Cu/CuSO4). Está formado por una barra cilíndrica de Cu sumergida en una solución de CuSO4 saturada. El contacto electrolítico con la solución o suelo se realiza mediante un puente salino constituido (formado) por un tapón de madera de balsa. En la figura N° 4 se ilustra este tipo de electrodo.
Figura Nº 4 Cobre/ sulfato de cobre, Cu/CuSO4.
La reacción de electrodo es la siguiente:
Cu Cu2+ + 2e-; su potencial de equilibrio a 25°C viene dado por: E = 0.340 + 0.0295 log [Cu2+] V vs. ENH.
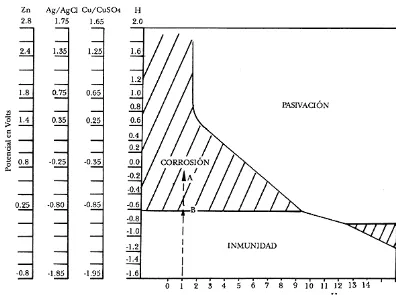
[image:41.612.219.379.285.438.2]Página 41 LINEAS MARINAS Figura Nº 5 Equivalencia entre escalas de potencial.
Equivalencia aproximada entre las escalas de potencial relativas a los electrodos de referencia utilizados en protección catódica, con indicación de los intervalos de corrosión, protección y sobreprotección para acero al carbono (figura 5).
II.18. DIFERENTES ZONAS DE CORROSIÓN EN UNA PLATAFORMA MARINA.
Zona atmosférica: Esta parte de la estructura donde se encuentra continuamente sobre el nivel del mar. Los problemas de corrosión se resuelven con el uso de recubrimientos anticorrosivos.
Zona de marea y oleaje: Es la parte de la estructura expuesta intermitentemente a la acción de las olas y mareas. En el Golfo de México es aproximadamente igual a dos metros.
Zona sumergida: Es la parte de la estructura que se encuentra sumergida continuamente, La protección catódica se utiliza para la protección de esta zona.
Zona por debajo del fondo del mar: Se debe considerar que cierta cantidad de corriente de protección catódica es captada por esta zona.
LINEAS MARINAS Página 42
Figura Nº 16 Diferentes Zonas de Corrosión.
ZONA ADMOSFERICA
ZONA DE MAREAS
ZONA SUMERGIDA
Página 43 LINEAS MARINAS