Facultad de Ciencias Agropecuarias Programa de Doctorado en Ciencias Agrarias
Los abajo firmantes, convocados por el Programa de Doctorado en Ciencias Agrarias de la Universidad de Caldas, hemos revisado el informe final de la tesis doctoral:
DESINFECCIÓN DE PEZONES, AMAMANTAMIENTO E INFECCIÓN INTRAMAMARIA
Presentada por: PAULO CÉSAR DUQUE MADRID
Como requisito parcial para obtener el título de Doctor en Ciencias Agrarias y certificamos su aprobación
____________________________________ ALEJANDRO CEBALLOS MÁRQUEZ Nombre completo 1er miembro
_____________________________________ MARIO LOPEZ BENAVIDEZ
Nombre completo 2do miembro
______________________________________ MARCOS MUÑOZ DOMON
Facultad de Ciencias Agropecuarias Programa de Doctorado en Ciencias Agrarias
DESINFECCIÓN DE PEZONES, AMAMANTAMIENTO E INFECCIÓN INTRAMAMARIA
Tesis Presentada a:
Programa de Doctorado en Ciencias Agrarias Facultad de Ciencias Agropecuarias
Universidad de Caldas
Como requisito parcial para obtener el título de Doctor en Ciencias Agrarias
Por
PAULO CÉSAR DUQUE MADRID
ALEJANDRO CEBALLOS MÁRQUEZ, PhD. Director de Tesis
AGRADECIMIENTOS
Quiero expresar mis agradeciemientos al Dr. Alejandro Ceballos por su ejemplo, guía y
apoyo contante en mi crecimiento profesional.
A los Drs. Marcos muñoz y Mario Lopez, por haberme abierto puertas hacia el
conocimiento e incluso hasta las puertas de sus hogares.
Al Dr. Nestor Alonso Villa y Sebastian Sanchez Arias que como amigos y con su apoyo
constate y dedicación ayudaron para que esta etapa de mi vida llegara buen termino.
A todos los integrantes del grupo de calidad de leche y epidemiologia veterinaria – CLEV
sin quienes nada de esto hubiese sido posible.
A todos los profesionales, propietarios y trabajadores que hicieron parte de los proyectos de
investigación y que de una y otra forma pusieron su grano de arena en este doctorado.
DEDICATORIA
Quiero dedicar estos años de trabajo a mi familia, especialmente a mi madre Luz Adriana y
mi hermana Nathalia que simpre con su tenacidad y buen ejemplo han sido el faro de luz
TABLA DE CONTENIDOS
Agradecimientos ii
Dedicatoria iii
Tabla de contenidos iv
Lista de figuras v
Lista de tablas vi
Lista de anexos vii
Resumen ix
Capítulo I
1. Introducción 1
1.2. Justificación 3
1.3. Planteamiento del problema 4
1.4. Hipotesis 5
1.5. Objetivo general 6
1.5.1. Objetivos específicos 6
Capítulo II
2. Revisión de literatura. 8
2.1. Infecciones intramamarias y recuento de células somáticas 8
2.2. Utilidad diagnostica del RCS 12
2.3. Ensayos clínicos para evaluar desinfectantes para pezones 15
2.4. Amamantamiento posordeño y RCS 18
Capítulo III. Primer artículo
3. Sensitivity and specificity of somatic cell count in quarter milk samples to decide the culture of milk samples
24
Capítulo IV. Segundo artículo
4. Evaluación de la clorhexidina como desinfectante para pezones bajo condiciones de pastoreo y desafío natural
50
Capítulo V. Tercer artículo
5. Efecto del amamantamiento con ternero sobre el recuento celular somático en hatos lecheros
76
Capítulo VI
6. Discusión general 102
6.1. Conclusiones generales
LISTA DE FIGURAS
Figura Título Página
1 ROC curve of LnSCC as a predictor of milk samples to be cultured for major pathogens in primiparous (a) and multiparous (b) cows.
46
2 ROC curve of SCC as a predictor of milk samples to be cultured for minor pathogens in primiparous (a) and multiparous (b) cows.
47
3 Sensitivity-Specificity plot of LnSCC as a predictor of milk samples to be cultured for major pathogens in primiparous (a) and
multiparous (b) cows (with 95% confidence interval).
48
4 Sensitivity-Specificity plot of LnSCC as a predictor of milk samples to be cultured for minor pathogens in primiparous (a) and multiparous (b) cows (with 95% confidence interval).
49
5 Modelo de células somáticas en logaritmo natural por semana de estudio del grupo control (☐) y experimental ().
73
6 Modelo de la tasa de Incidencia de infección intramamaria de todos los cuartos a riesgo por semana de estudio en el grupo control (☐) y experimental ().
74
7 Diferencia en la tasa incidencia de IMI en cuartos semana a riesgo con un intervalo de confianza del 95% [-0,019 (-0,062; 0,024)] entre el grupo experimental (0,034) y el grupo control (0,053) en el ensayo de no inferioridad. El Δ es el punto preestablecido para declarar la no inferioridad.
75
8 Promedio de LnRCS para cada mes de muestreo en los hatos con amamantamiento del ternero al final del ordeño y sin amamantamiento al final del ordeño.
100
9 Promedio de LnRCS según cada categoría de permanencia de los teneros con las madres después del ordeño.
LISTA DE TABLAS
Tabla Título Página
1 Year, cow and number of quarters enrolled in each study. 41
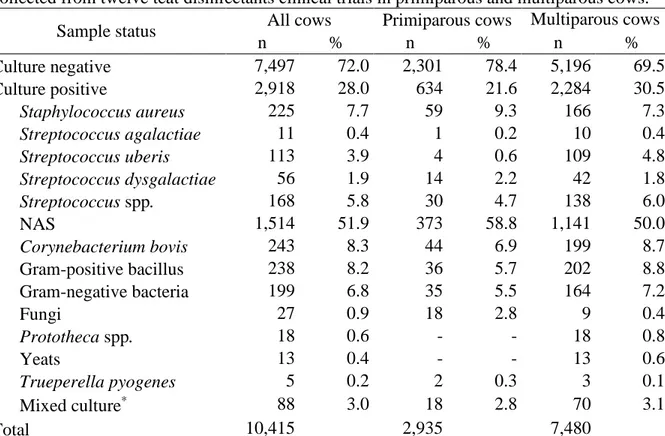
2 Frequency of isolation of mastitis pathogens in 10,415 quarter milk samples collected from twelve teat disinfectants clinical trials in primiparous and multiparous cows.
42
3 Mean and standard deviation (SD) of the LnSCC according to mastitis pathogens in primiparous and multiparous cows.
43
4 Sensitivity (%) and specificity (%) of SCC at different thresholds values (x103 cells/mL) to get the isolation for major pathogens from a quarter milk sample in primiparous and multiparous cows.
44
5 Sensitivity (%) and specificity (%) of SCC at different thresholds values (x103 cells/mL) to get the isolation for minor pathogens from a quarter milk sample in primiparous and multiparous cows.
45
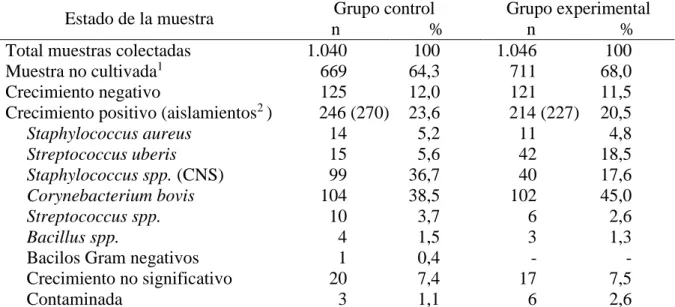
6 Frecuencia de aislamiento de patógenos mamarios provenientes de 2086 muestras tomadas de 91 vacas en los grupos control y experimental.
70
7 Número de nuevas infecciones intramamarias y cuartos- semana a riesgo de una infección cada dos semanas en el grupo control y experimental.
71
8 Número de nuevas IMI agrupadas según el patógeno causante en el grupo control y experimental.
72
9 Estructura de los datos de 2.905 mediciones de RCS en hatos del departamento de Caldas, Colombia.
96
10 Características productivas de los hatos con y sin amamantamiento al final del ordeño.
97
11 Distribución de hatos según el número de horas reportadas de permanencia del ternero con la madre después del ordeño.
98
12 Cantidad de muestras colectadas según el número de medicines realizadas por hato para el estudio 1 y el estudio 2.
LISTA DE ANEXOS
Anexo
1 Presentación oral Pruebas de desafío para selladores de pezones en sistemas pastoriles en Latinoamérica. Segundo congreso Red Latinoamericana de Investigacion en mastitis - RELIM 2014. Costa Rica.
112
2 Poster Sample size calculation for non-inferiority teat dip trials conducted in pasture based systems. National Mastitis Council Regional Meeting 2014, Ghent, Belgium.
118
2 Poster Sensitivity and specificity of SCC in quarter milk samples to diagnose intramammary infections in pasture-based systems. 54º reunion anual, National Mastitis Council 2015. Memphis, Tennessee.
Resumen
La mastitis, definida como la inflamación de la glándula mamaria generalmente causada
por una infección bacteriana es la mas común y costosa de las enfermedades en el ganado
lechero a nivel mundial. En su forma subclínica se caracteriza principalmente por una
elevación del recuento de células somáticas (RCS) el cual es usado como un biomarcador
útil para diagnosticar la enfermedad. Un primer capitulo de esta investigación tuvo por
objetivo evaluar el uso del RCS como criterio para decidir el análisis microbiológico de
muestras de leche. Se analizaron 10.415 muestras de cuartos provenientes de doce estudios
que comprendían resultado de cultivo microbiológico y RCS. Los cuartos libres de IMI
tuvieron un LnRCS de 3,08 ± 1,4 (miles/mL) para las vacas de primer parto y de 3,48 ± 1,6
(miles/mL) para las vacas multíparas. Los cuartos infectados tuvieron un promedio de 4,51
± 1,8 y 4,5 ± 2,0 (miles/mL) en vacas primíparas y multíparas, respectivamente. La sensibilidad (Se) y especificad (Sp) del RCS fueron variables según el tipo de patógeno que
causaba la IMI y el punto de corte usado. En general la Se fue más baja cuando la IMI fue
causada por un patógeno menor en comparación con uno mayor. Cuando se uso un punto
de corte de 100 x 103 células/mL para infecciones por patógenos mayores la Se fue de 81.7
y 86.2% para vacas primíparas y multíparas, respectivamente. Cuando la infección fue
causada por un patógeno menor a este mismo punto de corte la Se fue de 48.2% para vacas
primíparas y de 40.4% para multíparas. Con un punto de corte de 200 x 103 en vacas
multíparas la Se fue de 80.4% la Sp de 83.2% para IMI causadas por patógenos mayores.
Este estudio calculo un punto de corte donde se alcanza la mayor Se y Sp para infecciones
por patógenos mayores de 114 x 103 células/mL en vacas primíparas y de 184 x 103
muestras de leche que deben ser cultivas es eficaz para determinar las verdaderas IMI
causadas por un patógeno mayor pero la relevancia de la identificación de patógenos
menores por esta metodóloga requiere una mayor discusión.
Un segundo ensayo bajo condiciones de pastoreo y desafío natural fue realizado con 91
vacas durante diez semanas con el objetivo de demostrar la no inferioridad de un producto
desinfectante de pezones experimental de clorhexidina comparado con un control positivo a
base de yodo. Para establecer las nuevas IMI se uso una metodología que incluía el cultivo
de las muestras que sobrepasaban un umbral de RCS. La tasa de incidencia promedio fue
de 0,053 (IC 95%: 0,035 – 0,080) y 0,034 (IC 95%: 0,012 – 0,089) cuartos-semana a riesgo
en el grupo control y experimental, respectivamente. La razón de la tasa de incidencia fue
0,65 (P = 0,17) y la diferencia entre las dos tasas de -0,019 (IC 95%: -0,062 – 0,024)
ubicándose por debajo del margen de no inferioridad establecido (0,05). No se encontraron
diferencias en el RCS y la salud de la piel y punta del pezón. Concluyendo que el producto
desinfectante a base de clorhexidina demostró ser no inferior al producto control.
Por último con el fin de establecer el efecto del amamantamiento con el ternero al finalizar
el ordeño sobre RCS al nivel del hato fue colectada información de 384 predios a los cuales
se les realizo seguimiento de su RCS de manera mensual hasta por un año. De cada hato se
colecto información sobre sus características productivas a través de una visita. Los hatos
que tenían el sistema de amamantamiento con ternero tuvieron un RCS mas bajo en
comparación con los otros hatos (5,32 ± 1,0 vs 5,76 ± 0,9 LnRCS miles/mL) (P = 0,001), pero este efecto mostro una interacción con el mes de toma de la muestra. El tiempo de
permanencia promedio de los terneros con sus madres fue de 5,0 ± 2,0 horas sin que se
cuales se da el amamantamiento del ternero después del ordeño presentan un RCS mas bajo
independientemente de las horas de permanencia con la madre.
Palabras claves: Amamantamiento, desinfección, infección intramaria, pezones, recuento de
CAPITULO I
1. Introducción
La mastitis, definida como la inflamación de la glándula mamaria, continúa siendo la
principal enfermedad en producción lechera bovina mundial. Esta enfermedad es casi
siempre de origen infeccioso caracterizándose por daños en el epitelio glandular y pudiendo
cursar de forma clínica o subclínica. La forma clínica se presenta con alteraciones físicas y
químicas en la leche, inflamación de la ubre o incluso con el comprometimiento sistémico
de vaca, mientras en la forma subclínica solo se dará una elevación del recuento de células
somáticas (RCS)(Sharif and Muhammad, 2009; Blowey and Edmondson, 2010).
La elevación del RCS es un indicador de la sanidad mamaria y un factor de preocupación
para la industria lechera por diversas razones como la exigencia internacional para la
comercialización de leche (Directriz 92/46 de la Unión Europea) y la relación que se da
entre presencia de mastitis y residuos de antibiótico pues se ha comprobado un mayor
riesgo de presencia de antibióticos en los hatos cuando se tienen en RCS más alto en el
tanque de leche (Ruegg and Tabone, 2000; Schukken et al., 2003). Además de lo anterior,
el uso del RCS como una herramienta que permite detectar las infecciones subclínicas
desde hace más de tres décadas, se ha convertido en un biomarcador útil para diagnosticar
la enfermedad (Dohoo et al., 1981; Leslie et al., 1983; Schukken et al., 2003; Sharma et al.,
2011).
Para separar los cuartos infectados de los que no presentan infección, mediante el uso del
diferentes puntos de corte que varían entre 100 x 103 y 500 x 103 células/mL con lo que
también varían la sensibilidad (Se) y la especificidad (Sp) según el punto seleccionado
(Dohoo and Leslie, 1991; Sargeant et al., 2001; Djabri et al., 2002).
Esta herramienta diagnóstica es también útil para establecer qué muestras tendrían una
mayor probabilidad de ser positivas al cultivo microbiológico y de esta forma ha sido
propuesta como una variante metodológica en los ensayos clínicos para desinfectantes de
pezones, ya que en los ensayos tradicionales se incurre en un alto costos al cultivar todos
los cuartos de vacas que participan en el estudio.
Tradicionalmente las investigaciones y desafíos de campo realizados por las empresas
productoras de desinfectantes para pezones en el mundo, se dan bajo ambientes de
estabulación y en sistemas con condiciones de manejo que difieren de las observadas en
Colombia. Unido a esto, en nuestro país no existe una legislación que exija pruebas de
campo para el registro de los productos, lo que facilita la comercialización de
desinfectantes para pezones sin que se conozca su verdadera eficacia para la prevención de
nuevas infecciones intramamarias (IMI) bajo las condiciones de producción en Colombia.
Una de estas condiciones de manejo diferente se da en los sistemas de producción bovina
de doble propósito, que en nuestro país como en otros de Latinoamérica generan gran parte
de la producción láctea y se caracterizan porque además de haber un beneficio por la
producción de leche hay también un interés productivo en la obtención de carne. En este
tipo de sistemas el ordeño de las vacas es apoyado por el ternero y como parte de su rutina
finalizado el ordeño las vacas lactantes son dejadas libremente con sus crías para
alimentarlas con la leche residual, lo que podría estar relacionado con un menor riesgo de
infección intramamaria. Si bien algunos estudios reportan efectos sobre la vaca y el
comportamiento del ternero con este amamantamiento posordeño (Krohn, 2001; Fröberg et
al., 2008), los efectos sobre la producción de leche y sobre la sanidad mamaria han sido
poco estudiados y se encuentra divergencia en los estudios realizados.
1.2. Justificación
Tradicionalmente los ensayos clínicos para la evaluación de desinfectantes para pezones así
como otros productos usados en la producción de leche se han realizado evaluando el RCS
y realizando cultivo bacteriológico a todas las mueras de leche de las vacas involucradas,
esto hace que se incrementen los costos de los ensayos clínicos lo que sugiere la búsqueda
de alternativas con el objeto de hacer estos ensayos a un menor costo.
Si el RCS es utilizado como un indicador de IMI sería posible entonces la selección de las
muestras de leche a cultivar mediante el RCS realizado previamente. Aunque se han
reportado algunos ensayos que indican la Se y Sp del RCS, es necesario evaluar cuales
serían estas estimadas al utilizar el RCS como un criterio de selección de las muestras para
cultivo en ensayos clínicos para evaluar desinfectantes para pezones.
Es demás necesario, garantizar que los productos desinfectantes presentes en el mercado
Colombiano y que se usan bajo condiciones de pastoreo, cumplen con unos requisitos
De otra parte, en Colombia un porcentaje de la producción lechera se da en los sistemas de
doble propósito en los cuales la aplicación posordeño de desinfectantes de pezones no se
lleva a cabo pues las vacas amamantan los terneros una vez terminado el ordeño, sin que
haya un criterio establecido sobre el real efecto de este amamantamiento con ternero sobre
el RCS, haciendo entonces necesaria su evaluación al nivel del hato.
1.3. Planteamiento del problema
La mastitis bovina continúa siendo la más costosa y desafiante de las enfermedades en
producción lechera a pesar de los esfuerzos y los recursos que se han destinado al control y
prevención de la misma en los últimos años. La aplicación de estrategias de control ha
tenido éxito en la lucha contra los patógenos causantes de esta enfermedad y ha llevado a
una drástica reducción en su incidencia y en el RCS en leche (Bradley, 2002). Siendo la
aplicación de desinfectantes de pezones una práctica fundamental en dicho control pues
reducen el riesgo de nuevas IMI en el hato (Dodd and Jackson, 1971).
Estos desinfectantes para pezones deben tener un eficacia comprobada, pero los ensayos de
campo que se llevan acabo para tal fin generalmente resultan en un alto costo debido a que
el establecimiento de la IMI se da como resultado del cultivo bacteriológico de todas las
muestras tomadas durante el estudio. Así, nuevos protocolos basados en el cultivo de las
muestras según el RCS, permitirían llevar a cabo ensayos de menor costo
En nuestras condiciones de pastoreo las prevalencias de los patógenos que se presentan son
diferentes a lo que actualmente sucede en otras latitudes, pues se tiene una alta prevalencia
de patógenos contagiosos, mientras que la presencia de infecciones por Gram negativos son
bajas (Ramírez et al., 2001; Calderón et al., 2011) haciendo necesario probar los productos
desinfectantes para pezones producidos y comercializados en nuestro país en dichas
condiciones y bajo desafío natural.
De otra parte, algunos de los sistemas de producción bovinos tradicionales en países de
Latinoamérica y en Colombia involucran una práctica que en algunos casos suprime la
desinfección de pezones después del ordeño, dado que una vez éste ha finalizado las vacas
son dejadas libremente con sus crías para alimentarlas con la leche residual durante un
periodo de tiempo. Tradicionalmente se han atribuido efectos de esta práctica de
amamantamiento sobre el RCS sin que se haya establecido una real diferencia entre estos
sistemas y los que no usan los teneros después de finalizado el ordeño de las vacas.
1.4. Hipótesis
Para el desarrollo de este estudio se propone la evaluación de las siguiente hipótesis:
Las muestras de leche provenientes de cuartos con un RCS por encima de un punto
de corte establecido, permitirá aislar con mayor probabilidad patógenos causantes
de mastitis.
Bajo las condiciones de producción de leche en Colombia un producto desinfectante
para pezones a base de clorhexidina no presentan diferencias en cuanto al número
Las lecherías donde se realiza un amamantamiento de los terneros por sus madres
después de terminado el ordeño, tienen un RCS en el tanque o cantinas de leche
diferente a aquellas lecherías donde no se realiza esta práctica.
1.5. Objetivo General
Validar el uso del RCS como criterio de sección de muestras para cultivo, así como la
efectividad de un producto de clorhexidina para la desinfección de pezones y el efecto del
amamantamiento con el ternero al finalizar el ordeño sobre el RCS del hato.
1.5.1. Objetivos Específicos
• Validar la Se y Sp del RCS del cuarto, como criterio de selección de las muestras de
leche para ser cultivadas.
• Evaluar la eficacia de la desinfección de pezones con un producto a base de
clorhexidina sobre las nuevas infecciones intramamarias, en vacas bajo condiciones de
pastoreo y desafío natural.
• Establecer el efecto del amamantamiento con el ternero al finalizar el ordeño sobre el
Referencias
Blowey, R. W., and P. W. Edmondson. 2010. Mastitis control in dairy herds. Cab International, Winslow, UK.
Bradley, A. J. 2002. Bovine mastitis: an evolving disease. Vet. J. 164: 116-128.
Calderón, A., V. Rodríguez, G. Arrieta, and S. Máttar. 2011. Prevalencia de mastitis bovina en sistemas doble propósito en Montería (Colombia): Etiología y susceptibilidad antibacteriana. Rev. Colomb. Cienc. Pecu. 24: 19-28.
Ceballos-Marquez, A., T. Hemling, B. J. Rauch, M. Lopez-Benavides, and Y. H. Schukken. 2013. Noninferiority trial on the efficacy of premilking teat disinfectant against naturally occurring new intramammary infections using a novel 2-step diagnostic process. J. Dairy Sci. 96: 8081-8092.
Djabri, B., N. Bareille, F. Beaudeau, and H. Seegers. 2002. Quarter milk somatic cell count in infected dairy cows: a meta-analysis. Vet. Res. 33: 335-357.
Dodd, F. H., and E. R. Jackson. 1971. Control of bovine mastitis. 1st ed. British Cattle Veterinary Association, UK.
Dohoo, I. R., and K. E. Leslie. 1991. Evaluation of changes in somatic cell counts as indicators of new intramammary infections. Prev. Vet. Med. 10: 225-237.
Dohoo, I. R., A. H. Meek, S. W. Martin, and D. A. Barnum. 1981. Use of total and differential somatic cell counts from composite milk samples to detect mastitis in individual cows. Can. J. Comp. Med. 45: 8-14.
Fröberg, S., E. Gratte, K. Svennersten-Sjaunja, I. Olsson, C. Berg, A. Orihuela, C. S. Galina, B. García, and L. Lidfors. 2008. Effect of suckling (‘restricted suckling’) on dairy cows’ udder health and milk let-down and their calves’ weight gain, feed intake and behaviour. Appl. Anim. Behav. Sci. 113: 1-14.
Krohn, C. C. 2001. Effects of different suckling systems on milk production, udder health, reproduction, calf growth and some behavioural aspects in high producing dairy cows — a review. Appl. Anim. Behav. Sci. 72: 271-280.
Leslie, K. E., I. R. Dohoo, and A. H. Meek. 1983. Somatic cell counts in bovine milk. Comp. Cont. Educ. Pract. 5: S601–S607.
Ramírez, N., G. Gaviria, O. Arroyave, B. Sierra, and J. Benjumea. 2001. Prevalencia de mastitis en vacas lecheras lactantes en el municipio de San Pedro de los Milagros, Antioquia. Rev. Colomb. Cienc. Pecu. 14: 76-87.
Ruegg, P. L., and T. J. Tabone. 2000. The Relationship Between Antibiotic Residue Violations and Somatic Cell Counts in Wisconsin Dairy Herds. J. Dairy Sci. 83: 2805-2809.
Sargeant, J. M., K. E. Leslie, J. E. Shirley, B. J. Pulkrabek, and G. H. Lim. 2001. Sensitivity and specificity of somatic cell count and California Mastitis Test for identifying intramammary infection in early lactation. J. Dairy Sci. 84: 2018-2024. Schukken, Y. H., D. J. Wilson, F. Welcome, L. Garrison-Tikofsky, and R. N. Gonzalez.
2003. Monitoring udder health and milk quality using somatic cell counts. Vet. Res. 34: 579-596.
Sharif, A., and G. Muhammad. 2009. Mastitis control in dairy animals. Pak. Vet. J. 29: 145-148.
CAPITULO II
2. Revisión de Literatura
2.1. Infecciones intramamarias y recuento de células somáticas
La protección de la glándula mamaria está dada por una variedad de mecanismos de
defensa que pueden ser clasificados como inmunidad innata e inmunidad específica. En el
caso de las respuestas innatas o inespecíficas estas son mediadas en primera instancia por la
barrera física del extremo del pezón que actúa como una primera línea de defensa contra la
mastitis y que también impone la presencia de sustancias antimicrobianas como ácidos
grasos no esterificados y proteínas en la capa de queratina (Paulrud, 2005).
En segunda medida, esta respuesta innata esta dada por la presencia de células como
neutrófilos, macrófagos, células asesinas naturales y por ciertos factores solubles como
lactoferrina, complemento, lizosimas y lactoperoxidasa, que se encargan de hacer la
defensa de la glándula mamaria cuando la primera línea ha sido superada por algún agente
patógeno (Riollet et al., 2000; Sordillo, 2005; Rainard and Riollet, 2006).
Durante el proceso de producción de leche la ubre es irrigada con grandes cantidades de
sangre llegando alcanzar hasta los 450 litros por kg de leche producida (Hibbitt et al.,
2004). Esta sangre además de transmitir los elementos básicos para la galactogénesis en el
parénquima glandular, también suministra las células de defensa antes mencionadas que en
una ubre sana serán en su mayoría macrófagos (66-88%) seguidos por linfocitos (10-27%),
neutrófilos (0-11%) y células epiteliales (0-7%) (Sordillo et al., 1997; Riollet et al., 2000;
la glándula mamaria y alcanza el canal del pezón o la cisterna, se desencadenan una serie
de sucesos inmunológicos a partir de los cuales son liberados los factores de defensa
celulares y como consecuencia se da una elevación en el recuento de células somáticas
(RCS) en la leche (Sordillo et al., 1997; Sordillo and Streicher, 2002).
La gravedad y duración de la mastitis estarán relacionadas con la rápida respuesta de
migración leucocitaria y su actividad bactericida en el sitio de la infección. Los neutrófilos
son el principal tipo celular (50-95%) que es reclutado activamente hacia la infección y se
encuentran en los tejidos mamarios y secreciones durante la etapa temprana del proceso
inflamatorio asociado con la infección bacteriana (Sordillo et al., 1997; Riollet et al., 2000;
Paape et al., 2003). Los demás tipos celulares como macrófagos, linfocitos y células
epiteliales serán encontrados en una menor proporción durante el proceso inflamatorio.
Diferentes mediadores químicos (citocinas) desencadenan esas reacciones inflamatorias
como consecuencia de la acción de las bacterias (Sordillo et al., 1997; Gruet et al., 2001).
Estas citocinas reconocen y responden a diferentes patógenos a través de las estructuras de
su pared celular y los receptores de membrana. Estas estructuras son lipopolisacaridos,
peptidoglicanos y acido lipotéicoico que forman el patrón molecular asociado a patógenos
(PAMP) que es reconocido por los receptores tipo peaje (TLR) localizados en las
membranas de las células del sistema inmune y cuya interacción es la que induce la
formación de citocinas y otros mediadores (Oviedo-Boyso et al., 2007).
RCS elevado durante la lactancia (Harmon, 1994). Este proceso crónico causa un daño en
el parénquima del tejido mamario por la diapédesis constante de leucocitos trayendo como
consecuencia una disminución en la producción de leche de la vaca (Harmon and Heald,
1982; Sordillo et al., 1997).
Algunos factores como el número de partos han demostrado afectar el RCS normal de las
vacas sin infección intramamaria (IMI), siendo más bajo en las vacas de primer parto
comparado con vacas multíparas (Sheldrake et al., 1983; Schepers et al., 1997). Se ha
reportado que las vacas de primer parto tienen una curva de RCS mas baja y plana a lo
largo de esa primera lactancia que las vacas de más partos (Schepers et al., 1997). De igual
forma, el efecto del parto sobre las células somáticas será mas notorio al comparar animales
de primer parto con vacas multíparas que se encuentren con IMI (Harmon, 1994; Laevens
et al., 1997; Sabuncu et al., 2013). Esto se relacionaría no solo con la infección en sí
misma, sino también con el hecho de que las vacas de mayor edad han tenido una mayor
oportunidad de exposición a patógenos de mastitis lo que resultarían en un aumento gradual
del número de cuartos que se han podido ver afectados generando un mayor daño tisular a
lo largo de su vida y por ende una mayor respuesta celular comparado con los animales que
no han sufrido infección (Reneau, 1986).
Otro factor que puede influenciar el RCS es la etapa de lactancia en la cual se encuentra la
vaca, pues es sabido que a lo largo esta se generan cambios que la afectan. Al momento del
parto la concentración del RCS será alta e incluso por encima de un millón de células por
mL (Jensen and Eberhart, 1981), condición que es aceptada normalmente y que ira bajando
vacas no infectadas (Dohoo, 1993). Barkema et al. (1999) trabajando con vacas de primera
y mas lactancias sin infección encontró un reducción del RCS desde las 593 x 103
células/mL en promedio al momento del parto hasta 126 x 103 células/mL hacia el tercer
día posparto.
Después de la primera semana posparto y durante la lactancia media las células se
mantendrán bajas (Sheldrake et al., 1983; Reneau, 1986), pero se notará un ligero aumento
de estas hacia el final de la misma tanto en vacas de primer parto como en vacas multíparas
(Dohoo and Meek, 1982; Sheldrake et al., 1983; Schepers et al., 1997). Esta forma de la
curva en el RCS durante la lactancia sería explicado por un posible efecto de dilución del
RCS en la leche, es decir que en las vacas sin infección el RCS a lo largo de la lactancia
estaría afectado por la cantidad de leche producida (Schepers et al., 1997).
El estado de infección es el principal factor que explica la variación en el RCS durante la
lactancia (Dohoo et al., 1981; Dohoo and Meek, 1982; Reneau, 1986). La respuesta del
sistema inmune y la producción de células somáticas dependerá del agente patógeno que se
encuentre causando la infección. En el caso de cuartos infectados por patógenos mayores
como Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis, Escherichia coli y Klebsiella spp. se espera un RCS promedio superior a las 350 x 103 células/mL. (Djabri et al., 2002). Para el caso de infecciones
causadas por patógenos menores como staphylococcus no aureus (NAS) y
2.2. Utilidad diagnostica del RCS
Las células somáticas son un indicador de la resistencia y la susceptibilidad de la vaca a la
IMI y un parámetro que se usa a menudo para distinguir los cuartos infectados de los sanos
por el aumento que se da como consecuencia de la respuesta inflamatoria. El uso de esta
herramienta que permite detectar y monitorear la presencia de IMI en las vacas lecheras se
ha dado desde hace más de 30 años y sus beneficios han sido ampliamente reportados
(Dohoo et al., 1981; Leslie et al., 1983; Schukken et al., 2003; Sharma et al., 2011).
Varias investigaciones (Dohoo and Leslie, 1991; Schepers et al., 1997; Djabri et al., 2002)
han demostrado que los cuartos que no presentan IMI tienen un RCS medio aproximado de
70 x 103 células/mL, y para poder detectar los cuartos infectados de los que no presentan
IMI se debe establecer un punto de corte a partir del cual será considerada dicha infección.
El tener un punto de corte permite tomar decisiones prácticas como seleccionar vacas para
cultivo microbiológico, realizar segregación de animales en el ordeño, escoger vacas para
descarte y poder decidir el uso de productos antibióticos para secado (Dohoo, 2001).
Además, posibilita el establecimiento de datos epidemiológicos como prevalencia,
incidencia, curación y duración de las infecciones dentro del hato.
El rango de RCS observado entre lo que podemos considerar como infectado y lo no
infectado se sobrepone uno con otro. Por consiguiente, podemos tener cuartos infectados
por debajo de un punto de corte dado (falsos negativos) y cuartos sanos por encima del
punto de corte (falsos positivos) (Dohoo, 2001). Por lo anterior, un punto de corte no es una
infección, sino que es un punto establecido buscando tener la menor probabilidad de error
diagnostico al usar el RCS como herramienta para el establecimiento de la IMI (Schukken
et al., 2003)
El punto de corte se debe establecer después de calcular los parámetros de sensibilidad (Se
y especificidad (Sp). La Se es entendida como la probabilidad de tener un RCS mayor a un
punto de corte establecido cuando el cuarto esta realmente infectado por un patógeno y la
Sp como la probabilidad de que el RCS se encuentre por debajo del punto de corte
establecido cuando un cuarto sea identificado como sano en el diagnostico por cultivo
microbiológico (Dohoo et al., 2009).
Es así como algunos investigadores han propuesto un punto de corte sobre 200 x 103
células/mL como un valor práctico que permite diferenciar los cuartos sanos de los
infectados (Dohoo and Leslie, 1991; Laevens et al., 1997; Schepers et al., 1997). Sobre este
valor de corte como determinador de la infección para todos los patógenos (mayores y
menores) se han reportado valores de Se entre 73 y 75% con una Sp entre 86% y 90%
(Dohoo and Leslie, 1991; Schepers et al., 1997).
Un punto de corte sobre las 225 x 103 o 250 x 103 células/mL incrementará la Sp de la
prueba a 93% y 96% respectivamente, aumentando la probabilidad de clasificar
correctamente los individuos sanos, pero se perderá la capacidad de detectar los
verdaderamente enfermos al tener valores de Se de 54 y 63%, para los mismos puntos de
De la misma forma, cuando el punto de corte se ha fijado en 400 x 103 células/mL, se ha
reportado una Sp del 95%, pero con una Se del 62% (Schepers et al., 1997) y valores de
37% y 89% en Se y Sp respectivamente, se han encontrado a un punto de corte de 500 x
103 células/mL en muestras de vacas con tres días posparto (Sargeant et al., 2001). Lo
anterior indicaría que los puntos de corte superiores a las 200 x 103 células/mL tiene una
mayor capacidad para identificar los animales sanos correctamente, pero esto iría en
detrimento de la Se perdiendo la capacidad de detectar los verdaderamente enfermos.
Al situar el punto de corte para todos los patógenos sobre las 100 x 103 células/mL se
incrementará la Se diagnóstica del RCS a un 83% (Schepers et al., 1997) mejorando la
capacidad de la prueba de detectar los individuos realmente infectados frente al umbral de
200 x 103 células/mL, pero contrario a lo que sucede con puntos de corte superiores la Sp
de la prueba será mas baja (80%) (Schepers et al., 1997).
Estos valores de Se y Sp también pueden tener una variación según el agente causal de la
enfermedad. Así, para infecciones con patógenos mayores y un punto de corte de 200.000
células/mL se ha reportado una sensibilidad del 84% que es mayor a la esperada si se tienen
en cuenta todos los patógenos, mientras la Sp para este caso sería del 85% siendo menor
que la reportada al tener en cuenta todos los patógenos (Dohoo and Leslie, 1991).
Esta habilidad del RCS de predecir realmente cuando existen una IMI ha hecho que en los
estudios en los cuales se da la necesidad de establecer dichas infecciones se haya propuesto
el uso de esta herramienta diagnostica para establecer las muestras que tienen una mayor
investigación beneficiado con este nuevo enfoque son los estudios de eficacia para la
desinfección de pezones (Ceballos-Marquez et al., 2013).
En la práctica diferentes puntos de corte sobre 100 x 103 células /mL (Schwarz et al., 2010;
Pilla et al., 2012), 200 x 103 células /mL (Breen et al., 2009; Dufour and Dohoo, 2012), 250
x 103 células /mL (Berry and Meaney, 2006; Windig et al., 2010), 300 x 103 células /mL
(Deluyker et al., 2005) y 400 x 103 células /mL (Polat et al., 2010) se han usado por
diversos investigadores para establecer la IMI.
2.3. Ensayos clínicos para evaluar desinfectantes para pezones
El concepto de desinfección de los pezones después del ordeño se remonta a 1916 cuando
el aceite de pino diluido fue usado en un esfuerzo por reducir la propagación del Strep. agalactiae (Moak, 1916). Sin embargo, este tipo de práctica no fue usada ampliamente sino hasta décadas más tarde cuando los investigadores de la Universidad de Ontario en
Canadá demostraron que la inmersión de los pezones en un desinfectante después del
ordeño llevó a la reducción de la mastitis que causaban las poblaciones de bacterias en
pezoneras. Estas observaciones fueron confirmadas más adelante en los ensayos de campo
realizados en el Instituto Nacional para la Investigación en Lechería de Inglaterra, dando
lugar posteriormente a extensas investigaciones en la Universidad de Cornell en New York,
donde la desinfección de los pezones se incluyó como un componente de los programas
integrales para el control de mastitis (Nickerson, 2001).
herramienta en la prevención de nuevas infecciones intramamarias en vacas lecheras (Dodd
et al., 1969; Farnsworth et al., 1980; Pankey et al., 1984; Fang and Pyörälä, 1995). Como
consecuencia, esto se ha traducido en la aparición de numerosos productos germicidas
comercializados como desinfectantes de pezones y ha suscitado que se tengan que realizar
diferentes tipos de ensayos para poder establecer la real eficacia de estos productos en
campo.
Tradicionalmente el Consejo Nacional de Mastitis (NMC) recomienda cuatro protocolos
para evaluar la efectividad de esos productos fuera del laboratorio: 1) Determinar la
eficacia de un desinfectante de pezones posordeño con exposición experimental de pezones
a patógenos de mastitis; 2) Determinar la eficacia de un desinfectante de pezones
posordeño en prevenir las nuevas IMI ocurridas de forma natural; 3) Comparar un
desinfectante de pezones posordeño experimental con uno de eficacia conocida en la
reducción de nuevas IMI ocurridas de forma natural; 4) Determinar eficacia de un
desinfectante de pezones posordeño de barrera en prevenir nuevas IMI ocurridas de forma
natural (Nickerson et al., 2004). En todos estos protocolos el establecimiento del estado de
IMI inicial y de las nuevas IMI ocurridas durante el tiempo de estudio se da como resultado
de realizar análisis microbiológicos a todas las muestras de leche colectadas durante el
tiempo de estudio.
Estos estudios tradicionales generan un alto costo que se deriva del hecho de llevar a cabo
cultivos microbiológicos en cuartos de vacas que tiene la probabilidad de estar sin IMI
debido a su bajo RCS al momento de colectar la muestra. Como consecuencia, estos
desinfectantes para probar sus nuevas formulaciones (Ceballos-Marquez et al., 2013).
Los ensayos de no inferioridad en los que se enfrenta un producto de reconocida eficacia
frente a uno experimental, son muy útiles cuando se pretende diseñar estudios en los cuales
no es práctica o éticamente posible hacer un ensayo controlado con placebo o control
negativo. Además de lo anterior, en los casos en los que el tratamiento experimental no
tiene que ser necesariamente mayor en su eficacia primaria, pero puede ser mejor en efectos
secundarios como seguridad de aplicación, costos, producción o administración (Lesaffre,
2008). El anterior sería el caso de los ensayos diseñados para probar la eficacia de los
desinfectantes de pezones.
En los últimos años se ha propuesto una variante a la metodología usada tradicionalmente
en la cual se combina el uso de los ensayos clínicos de no inferioridad con un modelo de
dos pasos para determinar las existencia de una nueva IMI utilizando para ello el RCS
como determinador del cultivo microbiológico de la muestra (Ceballos-Marquez et al.,
2013). Así, solo serán cultivadas las muestras provenientes de cuartos con un valor de RCS
mayor a 100 x 103 y 200 x 103 células/mL para vacas de primer parto y multíparas,
respectivamente (Schepers et al., 1997). Se busca con este umbral cultivar solo las muestras
que tendrán una mayor probabilidad de ser positivas a la IMI. Lo anterior, resulta atractivo
pues permite ahorrar en los costos que se dan como consecuencia de realizar una mayor
cantidad de cultivos microbiológicos y se hacen mas asequibles para los fabricantes al
2.4. Amamantamiento posordeño y RCS
Tradicionalmente en los países en desarrollo los sistemas de producción bovina han estado
enfocados la producción en doble propósito (Holmann and Lascano, 1998). Entendiendo
este último como el sistema que produce tanto leche como carne para la venta, donde un
porcentaje de las vacas del hato se ordeñan parcialmente y la leche remanente la consumen
las crías directamente de la ubre al final del ordeño suprimiendo la desinfección de pezones
posordeño. Estos sistemas con amamantamiento al final del ordeño han mostrado algunos
efectos sobre la vaca y el comportamiento del ternero (Krohn, 2001; Fröberg et al., 2008).
Entre estos efectos se ha mencionado un impacto sobre la producción de leche de las vacas
con amamantamiento del ternero al final del ordeño, pues cuando este consume la leche
residual se da un vaciamiento mayor en la ubre y esto estaría relacionado con una mayor
producción (Sandoval-Castro et al., 2000). Lo anterior, se daría como consecuencia de
remover el efecto físico de mayor presión dentro de los alveolos y la gandula mamaria que
se da por la acumulación de la leche y quien es el que provoca una compresión de la célula
secretora reduciendo el metabolismo celular y la síntesis de los componentes de la leche
(Assan, 2015).
Además de los efectos descritos sobre la producción, algunos autores han relatado efectos
del sistema de amamantamiento con ternero sobre la sanidad mamaria de las vacas. En un
estudio realizado con vacas de la raza Lucerna se reporta un promedio menor de RCS en las
vacas que eran sometidas al amamantamiento con ternero posordeño (85 x 103 células/mL)
frente a las vacas que no eran sometidas a este amamantamiento (106 x 103 células/mL)
diferencias significativas en la reducción del RCS de las vacas ordeñadas una vez al día y
que amamantaban sus terneros frente las que no lo hacían.
En otro estudio realizado en vacas Holstein que eran sometidas al amamantamiento con
ternero dos veces al día por espacio de media hora se reporta un tendencia a tener puntajes
mas bajos en la prueba de California Mastitis Test (CMT) frente a vacas que no recibían
este tratamiento. Si bien es de resaltar que en este estudio las vacas recibían desinfección de
pezones después del tratamiento con el ternero (Fröberg et al., 2008).
De manera contraria Fulkerson et al. (1974) y Thomas et al. (1981) no reportan un efecto en
la incidencia de mastitis en las vacas sometidas al amamantamiento con ternero posordeño
frente a las vacas ordeñadas solamente con máquina. Además, estudios realizados en Brasil
bajo este sistema de amamantamiento posordeño (Malek dos Reis et al., 2011) relatan
Referencias
Assan, N. 2015. Influence of suckling and/or milking method on yield and milk composition in dairy animals. Sci. J. Zool. 4: 1-7.
Barkema, H. W., H. A. Deluyker, Y. H. Schukken, and T. J. G. M. Lam. 1999. Quarter-milk somatic cell count at calving and at the first six Quarter-milkings after calving. Prev. Vet. Med. 38: 1-9.
Berry, D. P., and W. J. Meaney. 2006. Interdependence and distribution of subclinical mastitis and intramammary infection among udder quarters in dairy cattle. Prev. Vet. Med. 75: 81-91.
Boden, R. F., and J. D. Leaver. 1994. A dual purpose cattle system combination milk and beef production. Anim. Prod. 58: 463-464.
Breen, J. E., A. J. Bradley, and M. J. Green. 2009. Quarter and cow risk factors associated with a somatic cell count greater than 199,000 cells per milliliter in United Kingdom dairy cows. J. Dairy Sci. 92: 3106-3115.
Ceballos-Marquez, A., T. Hemling, B. J. Rauch, M. Lopez-Benavides, and Y. H. Schukken. 2013. Noninferiority trial on the efficacy of premilking teat disinfectant against naturally occurring new intramammary infections using a novel 2-step diagnostic process. J. Dairy Sci. 96: 8081-8092.
Deluyker, H. A., S. N. Van Oye, and J. F. Boucher. 2005. Factors affecting cure and somatic cell count after pirlimycin treatment of subclinical mastitis in lactating cows. J. Dairy Sci. 88: 604-614.
Djabri, B., N. Bareille, F. Beaudeau, and H. Seegers. 2002. Quarter milk somatic cell count in infected dairy cows: a meta-analysis. Vet. Res. 33: 335-357.
Dodd, F. H., D. R. Westgarth, F. K. Neave, and R. G. Kingwill. 1969. Mastitis: The strategy of control. J. Dairy Sci. 52: 689 - 695.
Dohoo, I. R. 1993. An evaluation of the validity of individual cow somatic cell counts from cows in early lactation. Prev. Vet. Med. 16: 103-110.
Dohoo, I. R. 2001. Setting SCC cutpoinnts for cow and herd interpretation. In: Natl. Mastitis Counc. 40th Annu. Mtg., Reno, NV. p. 10-18.
Dohoo, I. R., and K. E. Leslie. 1991. Evaluation of changes in somatic cell counts as indicators of new intramammary infections. Prev. Vet. Med. 10: 225-237.
Dohoo, I. R., S. W. Martin, and H. Stryhn. 2009. Veterinary Epidemiologic Research. 3rd ed. AVC Incorporated, Charlottetown, Canada.
Dohoo, I. R., and A. H. Meek. 1982. Somatic cell counts in bovine milk. Can. Vet. J. 23: 119-125.
Dohoo, I. R., A. H. Meek, S. W. Martin, and D. A. Barnum. 1981. Use of total and differential somatic cell counts from composite milk samples to detect mastitis in individual cows. Can. J. Comp. Med. 45: 8-14.
Dufour, S., and I. R. Dohoo. 2012. Monitoring herd incidence of intramammary infection in lactating cows using repeated longitudinal somatic cell count measurements. J. Dairy Sci. 96: 1568-1580.
Farnsworth, R. J., L. Wyman, and R. Hawkinson. 1980. Use of a teat sealer for prevention of intramammary infections in lactating cows. J. Am. Vet. Med. Assoc. 177: 441-444.
Fröberg, S., E. Gratte, K. Svennersten-Sjaunja, I. Olsson, C. Berg, A. Orihuela, C. S. Galina, B. García, and L. Lidfors. 2008. Effect of suckling (‘restricted suckling’) on dairy cows’ udder health and milk let-down and their calves’ weight gain, feed intake and behaviour. Appl. Anim. Behav. Sci. 113: 1-14.
Fulkerson, W. J., R. D. Hooley, and J. K. Findlay. 1974. Improvement in milk production of first calf heifers by multiple suckling. Aust. J. Agric. Res. 29: 351-357.
Gruet, P., P. Maincent, X. Berthelot, and V. Kaltsatos. 2001. Bovine mastitis and intramammary drug delivery: review and perspectives. Adv. Drug. Deliver. Rev. 50: 245-259.
Harmon, R. J. 1994. Physiology of mastitis and factors affecting somatic cell counts. J. Dairy Sci. 77: 2103-2112.
Harmon, R. J., and C. W. Heald. 1982. Migration of polymorphonuclear leukocytes into the bovine mammary gland during experimentally induced Staphylococcus aureus mastitis. Am. J. Vet. Res. 43: 992-998.
Hibbitt, K. G., N. Craven, and E. H. Batten. 2004. Anatomy, physiology and immunology of the udder. In: A. H. Andrews, R. W. Blowey, H. Boyd and R. G. Eddy (eds.) Bovine Medicine Diseases and Husbandry of Cattle, Blackwell, Oxford.
Holmann, F., and C. Lascano. 1998. Una nueva estrategia para mejorar los sistemas de producción de doble proposito en los tropicos: el consorcio Tropileche. In: Primer Congreso Internacional de Ganadería de Doble Propósito, Maracaibo, Venezuela. p. 1-33.
Jensen, D. L., and R. J. Eberhart. 1981. Total and differential cell counts in secretions of the nonlactating bovine mammary gland. Am. J. Vet. Res. 42: 743-747.
Krohn, C. C. 2001. Effects of different suckling systems on milk production, udder health, reproduction, calf growth and some behavioural aspects in high producing dairy cows — a review. Appl. Anim. Behav. Sci. 72: 271-280.
Laevens, H., H. Deluyker, Y. H. Schukken, L. De Meulemeester, R. Vandermeersch, E. De Muêlenaere, and A. De Kruif. 1997. Influence of parity and stage of lactation on the somatic cell count in bacteriologically negative dairy cows. J. Dairy Sci. 80: 3219-3226.
Lesaffre, E. 2008. Superiority, equivalence, and non-inferiority trials. Bull. NYU Hosp. Jt. Dis. 66: 150-154.
Leslie, K. E., I. R. Dohoo, and A. H. Meek. 1983. Somatic cell counts in bovine milk. Comp. Cont. Educ. Pract. 5: S601–S607.
Malek dos Reis, C. B., J. R. Barreiro, J. F. G. Moreno, M. A. F. Porcionato, and M. V. Santos. 2011. Evaluation of somatic cell count thresholds to detect subclinical mastitis in Gyr cows. J. Dairy Sci. 94: 4406-4412.
Margerison, J. K., T. R. Preston, and C. J. Phillips. 2002. Restricted suckling of tropical dairy cows by their own calf or other cows' calves. J. Anim. Sci. 80: 1663-1670. Moak, H. 1916. Control and eradication of infectious mastitis in dairy herds. Cornell Vet.:
6-36.
Nickerson, S. C., A. Saxon, L. K. Fox, T. Hemling, J. S. Hogan, J. Morelli, S. P. Oliver, W. E. Owens, M. Pawlak, and L. Petersson. 2004. Recommended protocols for evaluating efficay of postmilking teat germicides. In: Natl. Mastitis Counc. 43rd Annu. Mtg., Charlotte, NC. p. 379-399.
Oviedo-Boyso, J., J. J. Valdez-Alarcón, M. Cajero-Juárez, A. Ochoa-Zarzosa, J. E. López-Meza, A. Bravo-Patiño, and V. M. Baizabal-Aguirre. 2007. Innate immune response of bovine mammary gland to pathogenic bacteria responsible for mastitis. J. Infection 54: 399-409.
Paape, M. J., D. D. Bannerman, X. Zhao, and J. W. Lee. 2003. The bovine neutrophil: Structure and function in blood and milk. Vet. Res. 34: 597-627.
Pankey, J. W., R. J. Eberhart, A. L. Cuming, R. D. Daggett, R. J. Farnsworth, and C. K. McDuff. 1984. Uptake on postmilking teat antisepsis. J. Dairy Sci. 67: 1336-1353. Paulrud, C. O. 2005. Basic concepts of the bovine teat canal. Vet. Res. Communns. 29:
215-245.
Pilla, R., D. Schwarz, S. Konig, and R. Piccinini. 2012. Microscopic differential cell counting to identify inflammatory reactions in dairy cow quarter milk samples. J. Dairy Sci. 95: 4410-4420.
Polat, B., A. Colak, M. Cengiz, L. E. Yanmaz, H. Oral, A. Bastan, S. Kaya, and A. Hayirli. 2010. Sensitivity and specificity of infrared thermography in detection of subclinical mastitis in dairy cows. J. Dairy Sci. 93: 3525-3532.
Rainard, P., and C. Riollet. 2006. Innate immunity of the bovine mammary gland. Vet. Res. 37: 369-400.
Reneau, J. K. 1986. Effective use of dairy herd improvement somatic cell counts in mastitis control. J. Dairy Sci. 69: 1708-1720.
Riollet, C., P. Rainard, and B. Poutrel. 2000. Cells and cytokines in inflammatory secretions of bovine mammary gland. Adv. Exp. Med. Biol. 480: 247-258.
Sabuncu, A., S. O. Enginler, and E. Dumen. 2013. The effect of parity, age and season on somatic cell count of dairy cows with subclinical mastitis. J. Anim. Vet. Adv. 12: 472-477.
Sandoval-Castro, C. A., S. Anderson, and J. D. Leaver. 2000. Production responses of tropical crossbred cattle to supplementary feeding and to different milking and restricted suckling regimes. Livest. Prod. Sci. 66: 13-23.
Sargeant, J. M., K. E. Leslie, J. E. Shirley, B. J. Pulkrabek, and G. H. Lim. 2001. Sensitivity and specificity of somatic cell count and California Mastitis Test for identifying intramammary infection in early lactation. J. Dairy Sci. 84: 2018-2024. Schepers, A. J., T. J. G. M. Lam, Y. H. Schukken, J. B. M. Wilmink, and W. J. A.
Hanekamp. 1997. Estimation of variance components for somatic cell counts to determine thresholds for uninfected quarters. J. Dairy Sci. 80: 1833-1840.
Schukken, Y. H., D. J. Wilson, F. Welcome, L. Garrison-Tikofsky, and R. N. Gonzalez. 2003. Monitoring udder health and milk quality using somatic cell counts. Vet. Res. 34: 579-596.
Schwarz, D., U. S. Diesterbeck, K. Failing, S. König, K. Brügemann, M. Zschöck, W. Wolter, and C. P. Czerny. 2010. Somatic cell counts and bacteriological status in quarter foremilk samples of cows in Hesse, Germany - A longitudinal study. J. Dairy Sci. 93: 5716-5728.
Sheldrake, R. F., R. J. T. Hoare, and G. D. McGregor. 1983. Lactation stage, parity, and infection affecting somatic cells, electrical conductivity, and serum albumin in milk. J. Dairy Sci. 66: 542-547.
Sordillo, L. M. 2005. Factors affecting mammary gland immunity and mastitis susceptibility. Livest. Prod. Sci. 98: 89-99.
Sordillo, L. M., K. Shafer-Weaver, and D. De Rosa. 1997. Immunobiology of the mammary gland. J. Dairy Sci. 80: 1851-1865.
Sordillo, L. M., and K. L. Streicher. 2002. Mammary gland immunity and mastitis susceptibility. J. Mammary Gland Biol. Neoplasia 7: 135-146.
Thomas, G., S. Spiker, and F. Mickan. 1981. Influence of suckling by Friesian cows on milk production and anoestrus. Aust. J. Exp. Agr. 21: 5-11.
CAPITULO III
RUNNING HEAD: Somatic cell count as a potential qualifier for milk samples to be
cultured
Sensitivity and specificity of somatic cell count in quarter milk samples to decide the
culture of milk samples
P. C. Duque-Madrid*, M. Lopez-Benavides†, M. A. Munoz‡, J. Velasco-Bolaños*, A.
Ceballos-Marquez*
*Universidad de Caldas, Manizales, Colombia. †DeLaval, Kansas City, MO, USA.
‡
Universidad de Concepción, Chillan, Chile
Corresponding author:
P. C. Duque-Madrid; email: paulo.duque@ucaldas.edu.co
ABSTRACT
The aim of this study was to evaluate the somatic cell count (SCC) as a predictor for
milk samples that should be microbiologically analyzed. A total of 10,415 quarter milk
samples gathered from 12 different studies and which included microbiological culture
results and SCC. The uninfected quarters had a LnSCC of 3.08 ± 1.4 (thousands/mL) in
first lactation cows and 3.48 ± 1.6 (thousands/mL) for multiparous cows. By the other hand,
infected quarters had an average of 4.51 ± 1.8 y 4.5 ± 2.0 (thousands/mL) in primiparous
and multiparous cows, respectively. The main pathogens isolated were Staphylococcus no
aureus (NAS), Corynebacterium bovis, Staphylococcus aureus and Streptococcus uberis. The sensibility (Se) and specificity (Sp) of SCC were evaluated obtaining variable results
according to the pathogen that caused the IMI and the selected cutoff point used in the
estimation. In general, the Se was lower when the IMI was caused by a minor pathogen in
comparison whit a major. When a cut-off point of 100 x 103 cells/mL was used with major
pathogens the Se was 81.7 and 86.2% for primiparous and multiparous cows, respectively.
When the infection was caused by a minor pathogen and the same cut-off point was used
the Se was 48.2% for primiparous and 40.4% for multiparous cows. With a threshold set at
200 x 103 cells/mL in multiparous cows the Se was 80.4% and Sp 83.2% for IMI caused by
major pathogens. This study calculated a cut-off point of 114 and 184 x 103 cells/mL where
the highest Se and Sp for infections due to major pathogens in primiparous and multiparous
cows, respectively, was reached. In conclusion, the use of SCC as a predictor for quarter
milk samples to be cultured is effective to determine true IMI caused by major pathogens,
INTRODUCTION
Mastitis is defined as a mammary gland inflammation generally caused by bacterial
infection and is the most common disease in lactating cows. Mastitis causes great economic
loss to the dairy industry due to high discarded milk, decreased milk yield, extra labor,
early culling of cows, and treatments (Halasa et al., 2007).
An inflammation of the mammary gland may result in clinical mastitis with several
degrees of visible signs of the disease or subclinical mastitis. Although infection may
occur, visible changes of the udder or milk are not always present (Blowey and
Edmondson, 2010). Subclinical infections are usually associated with high somatic cell
counts (SCC) (Lam et al., 2013). Somatic cells are part of the natural defense mechanism,
including lymphocytes, macrophages, polymorphonuclear cells, and epithelial cells (Pillai
et al., 2001). The SCC represents the inflammatory status of the mammary gland, and is the
most frequently used indicator of subclinical mastitis in dairy cattle (Dohoo and Meek,
1982; Schukken et al., 2003; Sharma et al., 2011). The most important cause of increased
SCC is a bacterial infection of the mammary gland (Sharma et al., 2011). Besides, the
magnitude of the increase in SCC varies according to the bacteria involved in the
intramammary infection (IMI) (Harmon, 1994; Bradley and Green, 2005).
The SCC can be used for a several purposes, some of which require setting
thresholds (Dohoo, 2001). One of these purposes involves the possible use of SCC as a
potential qualifier for milk samples to be cultured. This application can be useful in clinical
trials in which bacteriological culture of milk samples is considered the standard method to
diagnose IMI.
An example of the trials that involve bacteriological culture for IMI diagnostics are
postmilking teat dip involving natural or experimental exposure to mastitis pathogens
(Nickerson et al., 2004). In those protocols, the establishment of initial infection status is
performed as result of duplicate quarter milk samples, a third sample is obtained when
results of the first two samples differ. Besides, all milk samples should be examined
microbiologically during the trial. Thus, the extensive culture-based diagnostics would lead
to expensive trials. As a consequence, these standardized protocols are currently not
routinely performed by manufacturers of teat disinfectants (Ceballos-Marquez et al., 2013).
As a result, there is a constant need to improve these methods accuracy, cost, or
convenience.
In recent years, several trials were carried out to evaluate the efficacy of teat
disinfectants following a two-step diagnostic process for identifying new IMI. Under this approach, a SCC threshold is established to make a decision on whether the milk sample should be cultured or not. Considering that SCC testing is less expensive than bacteriological culture. In addition, the SCC above a given threshold increases the
likelihood of identifying mastitis-causing pathogens (Ceballos-Marquez et al., 2013). The
threshold for culturing method was based on previous information about distinguishing
infected from uninfected quarters, which reports a sensitivity (Se) and specificity (Sp) of
74.5 and 89.6%, respectively (Schepers et al., 1997). Thus, if one quarter met an SCC value
>100 x 103 cells/mL for primiparous cows, and >200 x 103 cells/mL for multiparous cows,
this quarter should be considered for bacteriological culture (Ceballos-Marquez et al.,
2013).
On the other hand, other researchers have used thresholds at 100 x 103 cells/mL for
respectively. Conversely, other author have used higher thresholds such as 250 (Berry and
Meaney, 2006; Windig et al., 2010), 300 (Deluyker et al., 2005) and 400 x 103 cells/mL
(Polat et al., 2010) to consider healthy and infected quarters.
Unfortunately, there is no a ‘perfect’ cut-off point. The range of SCC observed in
cows with IMI and those without IMI overlap, making it difficult to select a single
threshold that clearly differentiates infected from uninfected quarters. Regardless of what
threshold is chosen there will be some uninfected quarters with the SCC above the
threshold (false positive results) and some infected quarters with SCC below the threshold
(false negative results) (Dohoo, 2001). Thus, the choice of a cut-off point will depend on
the goal of study. For example, if the cut-off point increases, the Sp will increase (the false
positives will decrease) and Sp will decrease (more false negatives). Lowering the cut-off
point has the opposite effect. Therefore, the correct cut-off point will be the compromise
between Se and Sp (Dohoo et al., 2009). The aim of this study was to evaluate the use of
SCC as an indicator of milk samples to be analyzed by bacteriological cultures.
MATERIALS AND METHODS
Data
The data used in these analyses were derived from twelve teat dip clinical trials
carried out in the United Estates of America, Canada and Colombia between 2009 and
2014. Each database was obtained directly from researches that carried out the studies and
were initially introduced in an Excel spreadsheet (Microsoft Corp., Redmond, WA), for
data cleaning and coding. Subsequently all data were transferred to Stata Ver. 14.2
All studies were conducted in commercial dairies with Holstein cows. All herds
used milking machines, and cows were milked twice a day. All cows were considered
clinically normal (no abnormal milk) at initial of each trial. In all studies the cows were in
good health at the time of recruitment, based on a visual inspection, and had not been
treated with antibiotics or anti-inflammatory products in the 30 d prior to recruitment.
The final database was built out using the first milk sample of each trial, this
because those include the SCC and the microbiological culture results at the same time.
Also including the study identification, country, system (housed or granzing), cow id,
quarter and lactation number. Information of 11,626 quarter-milk samples was collected
from 2,923 primiparous and multiparous lactating cows.
Milk samples
At the beginning of each the trial, duplicate quarter foremilk samples were collected
from all quarters of all lactating cows. First sample was taken in a sterile vial and used for
aerobic culture following standard protocols established by the NMC (NMC, 1999).
Briefly, approximately 0.01 mL of milk was streaked on trypticase soy agar containing 5%
sheep blood and 0.1% esculin, and agar plates were incubated aerobically at 37°C and
visually inspected at 24 h and 48 h for bacterial growth. Morphology, hemolytic patterns on
blood agar and Gram staining were used for initial identification. The catalase test was used
to differentiate staphylococci from streptococci. Coagulase test was performed on catalase
positive cocci to confirm Staphylococcus aureus. Gram positive and catalase negative cocci were differentiated by their reaction to the hydrolysis of esculin under ultraviolet light.
and culture in enterococcosel agar were used for the identification Streptococcus uberis. Corynebacteriumbovis was identified by their morphology and Gram stain. Gram negative bacteria were identified by their morphology and growth in MacConkey agar. Biochemical
tests, such as citrate, indole, motility and oxidase, were used to differentiate Gram negative
bacteria. Those cultures that presented more than two bacterial species were considered
contaminated and not informative of intramammary infection.
A second sample was collected using a vial containing bronopol as milk
preservative and SCC was analyzed using automated cell counting equipment
(Fossomatic®, Foss, Hillerød, Denmark; Somacount 500®, Bentley Instruments Inc.,
Chaska, MN). All quarters were eligible for inclusion in the analysis except those that had
no culture or SCC results.
Reference test and thresholds
The result of the bacteriological culture was the reference test and the criteria for
defining the IMI. Each quarter classified as truly infected when a mastitis pathogen was
isolated, a truly negative quarter means that mastitis pathogen was not isolated. An IMI was
defined if one or more colonies of mastitis pathogens were isolated from a 0.01 mL milk
sample, except for non-aureus staphylococci (NAS). For NAS, two or more colonies
isolated from a 0.01 mL milk sample were needed to establish presence of an IMI. Thus,
quarter was coded = 0, if culture was negative, and coded =1, if culture was positive with
one or two pathogens.
Several cut-offs for SCC were evaluated as a criterion to decide the bacteriological
analysis of milk samples. The threshold values were 50, 100 and 150 x 103 cells/mL for
1997; Jashari et al., 2016). The estimates were made for each pathogen grouped as major
(Staph. aureus, Strep. agalactiae, Strep. uberis and Strep. dysgalactiae) and minor (NAS, and C.bovis).
Statistical analysis
To validate the use of SCC test to decide a bacteriological analysis of milk samples,
Se, Sp, positive predictive value (PPV) and negative predictive value (NPV) were
calculated for the given cut-offs (Dohoo et al., 2009). Sensitivity was calculated as the
proportion of infected quarters (culture positive for an IMI) that had SCC values above the
selected threshold (test positive) and Sp was calculated as the proportion of non-infected
quarters (culture negative for an IMI) that had SCC values below the selected threshold
(test negative). Finally, PPV was calculated as the proportion of SCC values above the
selected threshold that had infected quarters and NPV was calculated as the proportion of
SCC values below the selected threshold that had uninfected quarters, that is:
Se = [p (T+| D+)] [1]
Sp = [p (T-| D-)] [2]
PPV = [p (D+| T+)] [3]
NPV = [p (D-| T-)] [4]
Where, T+ represents the quarters that had SCC values above the selected threshold,
T- represents the quarters that had SCC values below the selected threshold, D+ is infected