Efecto de las células stem mesenquimales sobre la proliferación, inmunofenotipo y clonogenicidad de las células stem hematopoyéticas
Presentado como requisito parcial para otorgar el titulo de Bacteriólogo a: José Alejandro Aristizábal Castellanos.
Carrera Bacteriología. Facultada de Ciencias. Pontificia Universidad Javeriana.
Efecto de las células stem mesenquimales sobre la proliferación, inmunofenotipo y clonogenicidad de las células stem hematopoyéticas
Presentado como requisito parcial para otorgar el titulo de Bacteriólogo a: José Alejandro Aristizábal Castellanos.
__________________ Decana Académica Dr. Ingrid Schuler. Ph,D.
___________________________ Director(a) Programa Académico Dr. Luz Amparo Maldonado. M.Sc.
Carrera Bacteriología. Facultada de Ciencias. Pontificia Universidad Javeriana.
Efecto de las células stem mesenquimales sobre la proliferación, inmunofenotipo y clonogenicidad de las células stem hematopoyéticas
Presentado como requisito parcial para otorgar el titulo de Bacteriólogo por: José Alejandro Aristizábal Castellanos.
_________________________ Director(a)
Dra. Viviana Rodríguez. M.Sc.cPh,D
________________________ Coordinadora de la Asignatura.
Dra. Luisa Gutiérrez. Bact
________________________ Evaluador
Dr. Ismael Samudio.Ph,D
Carrera Bacteriología. Facultada de Ciencias. Pontificia Universidad Javeriana.
AGRADECIMIENTOS
!
"
#
$
%
&
'
&
!
!
(
)
*
+
,
-'
!
+
(#
.
*
+
,
-(
#
%
/' & !
0
Nota de Advertencia
"La Universidad no se hace responsable por los conceptos emitidos por los alumnos en sus tesis de grado. Sólo velará porque no se publique nada contrario al dogma y a la moral católica, y por que las tesis no contengan ataques o polémicas puramente personales, antes bien, se vea en ellas el anhelo de buscar la verdad y la justicia".
ABREVIATURAS
CD: Cluster de Diferenciación.
CFSE: Carboxiflueresceina Diacetato Succinil Ester. CS: Célula Stem.
SCF: Stem Cell Factor.
CSH: Células Stem Hematopoyéticas. CSM: Células Stem Mesenquimales. HIV: Virus de inmunodeficiencia Humana IMDM: Iscove´s Modified Dulbecco Medium IMF: Intensidad Media de Fluorescencia. ISCT: International Society Cellular Therapy. MO: Medula Ósea.
RPMI: Roswell Park Memorial Institute SFB: Suero Fetal Bovino.
TPO: Trombopoyetina.
UFB-E Unidad formadora de brotes eritroides. UFC-E: Unidades formadoras de colonias eritroides. UFC-G: Unidades formadoras de colonias granulocíticas
UFC-GEMM: Unidades formadoras de colonias granulocíticas, eritrocítica, megacariocítica, monocíticas.
1. RESUMEN
El trasplante de células stem hematopoyéticas(CSH) a partir de sangre de cordón umbilical (SCU) se ha convertido en la alternativa de tratamiento para distinto tipos de patologías en la actualidad. Pero el mayor obstáculo consiste en el número de células requeridas para garantizar la supervivencia del receptor. La universidad de Minnesota sugiere dosis precisas de 1,5X10 7 /Kg de células mononucleares totales (CMN) (Ballen k, et al.2001).Por tal razón la optimización de procesos de expansión in vitro de CSH que mantengan su número sin perder la capacidad de autorenovación se convirtió en el motivo principal a evaluar
Se evaluó, con el sistema de co-cultivo, el efecto de las células stem mesenquimales (CSM) provenientes de MO los cambios sobre las CSH de SCU en la expresión de inmunofenotipo, proliferación y clonogenicidad en medios semi-solido. Estas células fueron puestas en distintas condiciones teniendo en cuenta la influencia del contacto celular directo, contacto celular más factores solubles y el semicontacto celular para algunos ensayos.
Inicialmente se estableció una optimización en la obtención, cultivo, expansión y mantenimiento de CSM provenientes de donantes voluntarios que fueron sometidos a intervenciones quirúrgicas de cadera. Se realizaron también aislamientos, purificación y cultivo celular de CSH a partir de SCU de trabajo de parto o cesáreas para luego ser puestas en un sistema de co-cultivo celular con CSM.
Se observaron cambios en los eventos proliferativos a los 3 y 7 días de las CSH que fueron puestas en la condición “A” (Hematopoyéticas , Mesenquimales y factores ) y “C” (Hematopoyéticas y factores), a diferencia de los cultivos en la condición “B” (Hematopoyéticas y Mesenquimales) que presentaron menos eventos proliferativos al evaluarse por CFSE.
La expresión del Inmunofenotipo de las CSH presentó variaciones en CD33,CD38(p=0,003 y p=0,0271, respectivamente) a los 3 días pero no diferencias significativas a los 7 días(p=0,4648 y 0,0625, respectivamente). El antígeno CD34 no presenta variaciones ni a los 3 y 7 días (0,1353; p=0,0625). Otros antígenos como HLA-DR presentaron una expresión constante de antígenos en el tiempo, mientras que CD117 guardó diferencias estadísticamente significativas a los 7 días (p=0,0083).
2. INTRODUCCION
Tras el creciente diagnostico en los últimos años de diversas enfermedades hematoncológicas, errores innatos del metabolismo, neoplasias y enfermedades degenerativas en la población infantil y adulta. La ciencia ha buscado el mejor método para combatir este tipo de enfermedades que hoy en día son consideradas de alto costo y una problemática de salud pública. Existen evidencias sobre la eficiencia de la terapia celular (Scadden D, et al.2008)basado en el uso de células stem mesenquimales y células stem hematopoyéticas con capacidad regenerativa que podría contribuir a aumentar la expectativa de vida de estos pacientes. Debido a que aun no es completamente claro este mecanismo, surge la necesidad de entender el papel que cumplen estas células en su nicho medular, llamado así por Schofield en 1976(Schofield R.1978).
Indicios muestran que las células estromales o CSM regulan la supervivencia, autorenovación, proliferación, migración y diferenciación de las CSH a través de varios mecanismos como la interacción célula-célula, producción de factores de crecimiento y moléculas de matriz extracelular,(Dazzi F,et al 2006) llevando a plantear un modelo in vitro que se aproxime al comportamiento celular in vivo. Por tal motivo el establecimiento de un sistema de co-cultivo celular entre las CSM y las CSH fue el seleccionado en este estudio permitiendo evaluar variables como la proliferación celular, usando la técnica de CFSE, cambios en el inmunofenotipo por expresión de cluster de diferenciación(CD) y formación de distintos linajes celulares en medios semisólidos.
3. JUSTIFICACION.
Estudios previos sobre el nicho medular y su papel en el mantenimiento y diferenciación de las células stem Hematopoyéticas (CSH),llevan a la conclusión que este microambiente juega un papel crucial en la regulación, autorenovación, proliferación, diferenciación, apoptosis y migración de las CSH (Mark J.Kiel, et al.2008) y en la terapia celular basada en trasplante autólogos (Devine S, et al .2001) y alogénico (Koc O, et al.2000). Datos siguieren que una relación directa de las célula stem mesenquimal y las células stem hematopoyética puede aumentar la adhesión de trasplantes de progenitores hematopoyéticas (Anklesaria P, et al.1987).
La principal ventaja de la obtención de las células stem(CS) a partir de sangre de cordón umbilical se atribuye a que estas células tienen alta tolerancia inmunológica y una gran capacidad de proliferación in
vitro. De tal forma, los estudios basados en un eficiente expansión ex vivo de CSH fundamentados
Con base en los criterios planteados se estableció un sistema de co- cultivo que permitió evaluar dos de los componentes principales del nicho medular como: células stem mesenquimales y las células
stem hematopoyéticas teniendo en cuenta las interrelaciones en cultivo que pueden mediar efectos directos sobre la proliferación, cambios en el inmunofenotipo y la capacidad de generar diferentes linajes celulares in vitro.
4. MARCO TEORICO
El concepto de nicho de CSH fue propuesto primeramente por Schofield en 1978 donde describe fisiológicamente el sitio de residencia de la CS (Schofield R. 1978).El nicho de la CS es un sitio especifico en el tejido adulto donde la CS puede autorenovarse y producir gran numero de progenie celular. Estructuralmente el nicho está formado por células y un conjunto de factores solubles que proveen un microambiente para el mantenimiento de las CS y de todas las células adyacentes (Li L, et al.2002). Una importante función del nicho medular es mantener la proliferación de células stem y así permitir la conservación de éstas a nivel medular. Uno de los mecanismos que permite este balance es el control de asimetría vs simetría. La división asimétrica significa que la CS se divide en dos células hijas y una de ellas mantiene el nicho como CS indiferenciada y la otra permite que el nicho produzca un gran número de progenies. La división simétrica hace referencia a que la CS se divida en dos células hijas idénticas y ambas mantienen el nicho como a las células madre (Watt FM, et al.2000) .
4.1Nicho medular
Se denomina nicho medular al entorno en el cual se encuentra la CSH, la CSM, los constituyentes del microambiente medular, el conjunto de proteínas solubles y factores de adhesión de la medula ósea (MO) necesarios para llevarse a cabo la hematopoyesis. El nicho está conformado por: Nicho óseo, revestido con osteoblastos los cuales se en encuentran en la superficie del endostio; el nicho estromal el cual contiene células reticulares, fibroblastos , adipocitos, células endoteliales y macrófagos; y el nicho adiposo los cuales ocupan el espacio no hematopoyético a lo largo del hueso, conocido también como medula ósea amarilla(Dazzi F, e t al.2006).
El nicho óseo con un constituyente principal, el osteoblasto, desempeña un papel crucial en la hematopoyesis basado en la autorenovación de CSH sin inducir diferenciación .Se ha observado que la regulación en el numero de CSH se relación con el aumento o disminución de osteoblastos a nivel medular y su ubicación adjunta al osteoblasto en el endostio(Kopp H, et al.2005). Muchos autores
proliferación de la CSH dentro del nicho hematopoyético es regulada por contacto celular, factores solubles (Eglits M, et al.1997; Camargo F, et al.2003) y la regulación positiva de autorenovación de la CSH es el resultado de la interacción de ésta con componentes celulares del nicho hematopoyético incluyendo el Notch y Wnt/beta caderina (Reya T, et al.2003).
4.2Célula stem mesenquimal
La célula CSM fue identificada por Friedenstein en 1961 sobre las bases de adherencia al plástico y su crecimiento in vitro (Friedenstein AJ 1961).Las CSM ha logrado ser aislada de diferentes tejidos como MO, musculo, sinovia, dermis, tejido adiposo sangre de cordón y Wharton´s jelly (Pittenger M, et al .1999; Wang H, et al.2004). Su habilidad de autorenovación y diferenciación en tejidos de origen mesodérmico(osteocitos, adipocitos, condrocitos) son los motivos principales para su aislamiento y crecimiento in vitro. Así pues su capacidad multipotencial de las CSM, su papel en el soporte de la hematopoyesis y su actividad inmunoreguladora hace de las CSM sea de interés para la exploración terapéutica (Vincent K, et al.2006).
Se ha estimado que las CSM representan el 0,001-0.0001% de células nucleadas en medula ósea adulta. Los CSM pueden tener características adherentes , formar colonias similares a fibroblastos cuando crecen en suero fetal bovino y pueden ampliarse en presencia de varios factores de crecimiento (Kuznestsov S, et al.1997).Estudios detallados han mostrado que in vitro el crecimiento de CSM, así como también otros progenitores celulares , tiene tres fases con un lapso de retraso (3-4 días )seguido por una expansión rápida y una subsecuente fase estacionaria (Brider SP, et al.2001).Se ha propuesto que la regulación de las diferentes fases podría deberse bajo expresión de ciclos de genes como Dick-kop-1 (Dkk-1) y Wnt5a. Dkk-1 es altamente sobre regulado durante el periodo logarítmico y reducido en la etapa de retraso por inhibición de la expresión de Wnt5a. Por el contrario Wnt5 llega a ser sobre regulada en cultivos estacionarios (Krampera M et al. 2005).
La sociedad internacional de terapia celular (ISCT) expresa a la comunidad científica la adopción de protocolos para la identificación de células mesenquimales. Por ello propuso tres criterios : las CSM deben ser células plasmáticas adherentes cuando se mantienen en cultivo; deben ser positivas para antígenos como CD105, CD73 y CD90, adicionalmente estas células deben carecer de antígenos como CD45 , CD34 y marcadores para monocitos , macrófagos y células B; tercero, las células deben ser diferenciadas a osteoblastos, adipocitos y condrioblastos bajo condiciones in
vitro (Dominici M, et al 2006)
4.3Células stem Hematopoyéticas
Los orígenes de CSH en el ser humano dan inicio en La aorta-gonadal-mesonefros una región durante el desarrollo temprano embrionario (Muller A, et al.1994).Tiempo más tarde estas células se desarrollan en el hígado fetal, donde se diferencian y proliferan a linajes mieloides y linfoides. Subsecuentemente en el séptimo mes de gestación , las CSH dejan el hígado y empiezan a repoblar la medula ósea , dando inicio a la constitución del microambiente medular (Alp C.2008). Las células stem poseen la facultad de abandonar en intervalos el nicho medular para salir a circulación.
Ensayos basados en la inducción de proliferación de células CD34 se observa que la combinación de factores de crecimiento como FLT3-ligando,trombopoyetina y stem cell factor generan un aumento en el numero de progenitores hematopoyéticos que incluye monocitos, granulocitos, megacariocitos y células dendríticas(Salmon P, et al. 2000).
Las MSC residen en la medula ósea adulto y es capaz de generar adipocitos, osteocitos, condrocitos, miocitos y células estromales que soportan la hematopoyesis. El sistema de co-cultivo permite explorar la influencia de las células mesenquimales sobre la biología de las CSH (Koh SH, et al 2005).
5. OBJETIVOS GENERAL
Evaluar el efecto de las células stem mesenquimales (CSM) sobre la proliferación, inmunofenotipo y clonogenicidad las células stem hematopoyéticas (CSH) en un sistema de co-cultivo.
6. OBJETIVOS ESPECIFICOS
1. Aislar CSM a partir de medula ósea (MO) de donantes voluntarios, sin enfermedad hematopoyética asociada, sometidos a remplazo protésico total o parcial de cadera.
2. Caracterizar por inmunofenotipo de CSM obtenidas a partir de MO.
3. Aislar CSH (células CD34) a partir de sangre de cordón umbilical.
4. Establecer un sistema de co-cultivo entre las CSM y CSH.
5. Determinar la proliferación e inmunofenotipo antes y después de co-cultivo con MSC de CSH (células CD34+) aisladas de sangre de cordón umbilical.
7. METODOLOGIA
7.1 Aislamiento y cultivo de CSM de MO
Las CSM fueron aisladas a partir de MO de pacientes intervenidos por el departamento de Ortopedia del Hospital Universitarios sometidos a remplazos protésicos parcial o total de cadera teniendo en cuenta como criterio de exclusión enfermedad hematopoyética asociada, tratados con terapia biológica inmunomodulora y no aceptación de consentimiento informado de donación voluntaria (Anexo 1). La recolección se realizó en tubos falcon de 50 ml con EDTA 0.25 %.Luego de la obtención de las muestra, estas fueron procesadas en esterilidad mediante maceración física y filtrado en una gasa estéril para luego realizar una separación por gradientes de densidad en una solución de Ficoll Hypaque que nos permite la obtención de una capa de células mononucleares (CMN). Finalizado este proceso se realiza recuento y viabilidad con Azul tripan 5% de CMN y se lleva a cultivo en Medio Dubelcco Modificado de Isco (IMDM) suplementado con suero fetal bovino al 10% y un coctel de Streptomicina 100 ug/ml, penicilina 100 U/ml y Anfotericina B 2 ug/ml por 72 h a 37®C en 5 % de CO2. Después de 72 h se hizo retiro de no adherentes y se realizó pase celular cuando las células alcanzaban un 90 % de confluencia. Con base en lo postulado por la Sociedad internacional de terapia Celular (ISCT) se cumple los criterios de adhesión al plástico y caracterización por inmunofenotipo de antígenos:
7.2 Aislamiento y cultivo de CSH de SCU.
Las CSH fueron aisladas a partir de SCU a partir de mujeres en trabajo de parto o cesárea, intervenidas por el departamento de Ginecología y obstetricia del Hospital Universitario San Ignacio, bajo previa firma del consentimiento informado(Anexo 2) y criterio de exclusión para madres con VDRL reactivo ; seropositivas para el virus de inmunodeficiencia humana (VIH) y malformaciones congénitas del feto. Las muestras son recogidas en tubos con heparina y luego procesadas bajo esterilidad. Se aislaron por gradientes de densidad en solución Ficoll Hypaque para la extracción de CMN. Se realizó recuento y
ANTICUERPO FLUOROCROMO
CD105 FITC
CD73 PE
CD90 PE
CD44 FITC
CD13 APC
HLA-I FITC
HLA-DR PE
CD34 APC
viabilidad con azul tripan al 5% y se cultivaron en medio Roswell Park Memorial Institute (RPMI) suplementado con suero fetal bovino al 10% y un coctel de antibióticos de Streptomicina 100 ug/ml, penicilina 100 U/ml y Anfotericina B 2 ug/ml por 24 h a 37ºC en 5 % de CO2.Cumplidas las 24 horas se realiza separación por selección positiva inmunomagnética con el uso de anticuerpos anti CD34 Sistema (Miltenyi Microbead Kit). La determinación de porcentaje de pureza osciló entre el 62 y el 98 % , su medición se realizó por citometría de flujo en FACS Calibur y con el software Cell Quest Pro, el anticuerpo usado fue CD34 APC Miltenyi.
7.3Establecimiento de Sistema de Co-cultivo para CSM Y CSH.
Para establecer el sistema de co-cultivo se utilizaron CSM entre el 2 y 5 pase, se sembradas en placas de 24 hasta obtener una confluencia del 80 % y posteriormente las CSH aisladas de SCU fueron sembradas a tres distintas condiciones : Hematopoyéticas y Mesenquimales(HM); Hematopoyéticas y factores (Flt3 50 mg/ml, TPO(Trombopoyetina) 50 ng/ml, SCF(stem cell factor) 50 ng/ml) (HF) y Hematopoyéticas, Mesenquimales y Factores ( Flt3 50 mg/ml, TPO 50 ng/ml, SCF 50 ng/ml)(HMF), por duplicado. El sistema de co-cultivo se llevó a cabo en medio RPMI 37ºC con 5% CO2.
7.4Ensayos de Proliferación.
Para observar la capacidad proliferativa de las CSH en co-cultivos con CSM, fueron marcadas previamente las CSH con 5 uM de Carboxiflueresceina Diacetato Succinil Ester (CFSE) durante 10 minutos a 20ºC,3 minutos 37ºC y 5 minutos a 4ºC,posterirormente se neutralizó el CFSE con medio RPMI, para luego llevarse al sistema de co-cultivo por 3 y 7 días a 37ºC en 5% de CO2.Para establecer la proliferación del día cero, se uso la técnica de deprivación de suero, con lectura a las 72h . Luego de del tiempo de incubación las CSH fueron retiradas de cada pozo por pipeteo repetitivo y llevadas hacer analizadas, para evaluar la disminución de la media de fluorescencia por citometría de flujo en FACS Aria II. Los datos fueron adquiridos y analizados por medio del software Diva y PentaGate.
7.5Determinación de Cambio de inmunofenotipo.
Los ensayos de diferenciación son evaluados mediante el co-cultivo de CSH Y CSM durante 3 y 7 días a 37ºC en 5% de CO2. Luego del tiempo de incubación las CSH son retiradas de cada pozo por pipeteo repetitivo y llevadas hacer analizadas para expresión de marcadores fenotípicos: CD33;CD34 ;CD38; CD117 y HLA-DR por citometría de flujo en FACS Aria- II y analizados por medio del software Diva y PentaGate. Las características de los anticuerpos empleados son:
Antígeno Clon fluorocromo Referencia
CD 33 4D3 PE-Cy5.5 MHCD3318
CD34 8G12 APC 340441
CD38 HB7 PE-Cy7 335790
CD117 104D2 PE 340529
7.6Ensayos de Clonogenicidad
Para los ensayos de clonogenicidad se evaluó un sistema basal, células CSH sin co-cultivo, un sistema de co-cultivo de HM;HMF; HF a 3 días respectivamente de incubación a 37ºC en 5% CO2 , HM en una membrana transwell con un diámetro de poro de 5 um a 3 días de incubación 37®C en 5% CO2, co-cultivo de HM;HMF;HF en medio IMDM a partir de sobrenadantes de CSM congelados a -20®c por 3 días y sobrenadantes frescos de CSM y llevadas las células a 3 días de incubación 37ºC en 5% CO2. Luego del tiempo de incubación los cultivos de HMF Y HM se les realizó una separación por selección positiva inmunomagnética con el uso de anticuerpos anti CD105 (Sistema Miltenyi MSC Biotec) para evitar que hubiese contenido de CSM en los cultivos. Se tomaron 3.3x10 2 de CSH de cada condición y se reconstituyen en metil celulosa (Miltenyi Biotec) para luego ser sembrados en cajas de 35 mm conteniendo 1 ml de medio de metil celulosa semisólido con SCF 50 ng/ml, GM-CSF 20 ng/ml ,IL-3 20 ng/ml, IL-6 20 ng/ml, G-CSF 20 ng/ml y EPO 3 U/ml e incubadas por 15 días a 37º C en 5% de CO2. Como criterio de lectura de las unidades formadora de colonias, se basó en que 1 colonia = > 50 células con diámetro >0,5 mm.El recuento comprendió la identificación de Unidades formadoras de colonias granulomonocíticas (UFC-GM),unidades formadoras de colonias granulocíticas(UFC-G),unidades formadoras de colonias monocíticas(UFC-M),unidades formadoras de colonias eritroides(UFC-E),unidades formadoras de colonias granulocíticas, megacariocítica, eritrocítica, monocíticas(UFC-GEMM),unidad formadora de brotes eritroides (UFB-E) por microscopia invertida con objetivo 20x, y para corroborar que cada colonias perteneciera al linaje establecido a se les realizo un cytoespín y se tiñeron con la coloración de Wright.
7.7Metodo Estadístico
8. RESULTADOS
8.1Aislar CSM a partir de medula ósea (MO) de donantes voluntarios.
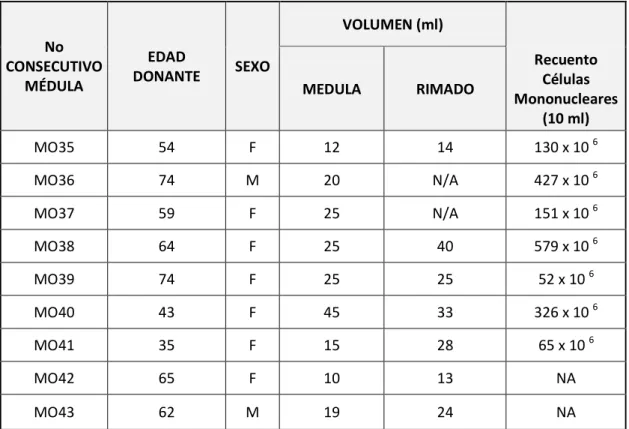
Las CSM fueron obtenidas de MO y rimados acetabulares de intervenciones quirúrgicas de cadera. Las muestras recolectadas fueron procesadas en el laboratorio de hematología de la Facultad de Ciencias. Las características de las muestras obtenidas de médula ósea de presentan en la tabla 1.
Tabla 1. Muestras Recolectadas de Médula Ósea Edad promedio de 59 años, volumen rimado medio de 24,83ml y volumen medular medio 21.78 ml.
NA: No aplica
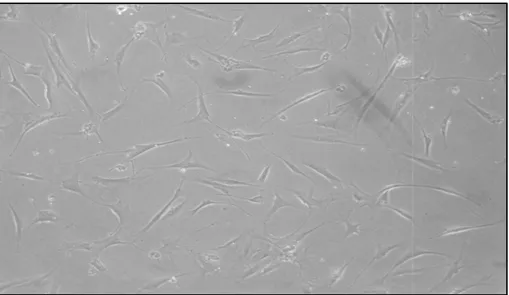
Para cumplir con los criterios sugeridos por ISCT se evaluaron las características de adhesión, morfología e inmunofenotipo. En la figura 1 se observan células fibroblastoide-adherentes que coinciden con la morfología característica de CSM (Figura 1). El inmunofenotipo demostró la expresión de los antígenos CD105, CD73, CD90, CD44, CD13, HLA-I, HLA-DR en ausencia de los antígenos hematopoyéticos CD34 y CD45 (Figura 2). Se observó una diferencia estadísticamente significativa (Test Willcoxon. p=0.006) entre la intensidad media de fluorescencia (IMF) del antígeno CD45 y los antígenos mesenquimales (Figura 3)
No CONSECUTIVO
MÉDULA
EDAD
DONANTE SEXO
VOLUMEN (ml)
MEDULA RIMADO
Recuento Células Mononucleares
(10 ml)
MO35 54 F 12 14 130 x 10 6
MO36 74 M 20 N/A 427 x 10 6
MO37 59 F 25 N/A 151 x 10 6
MO38 64 F 25 40 579 x 10 6
MO39 74 F 25 25 52 x 10 6
MO40 43 F 45 33 326 x 10 6
MO41 35 F 15 28 65 x 10 6
MO42 65 F 10 13 NA
Figura 1. Mo
Figura 2. Inmunofenotipo CSM Software CellQuest-Pro). Lin CD44positivo, CD13positivo, C isotipo para PE, PECy5, APC y F
Morfología fibroblastoide de CSM. Objetivo 10x (prim
CSM – tercer pase de cultivo. Análisis del inmu Linea roja: CD34negativo, CD45negativo, CD7 , CD90positivo, HLA-Ipositivo y HLA-DRvarible. y FITC .
(primer pase).
Figura 3.
Intensidad Media de Fluorescencia para antígenos CSM. Se presenta las medianas de IMF para los antígenos evaluados por citometría de flujo (p=0.006)
8.2Aislamiento de CD34 a partir de SCU
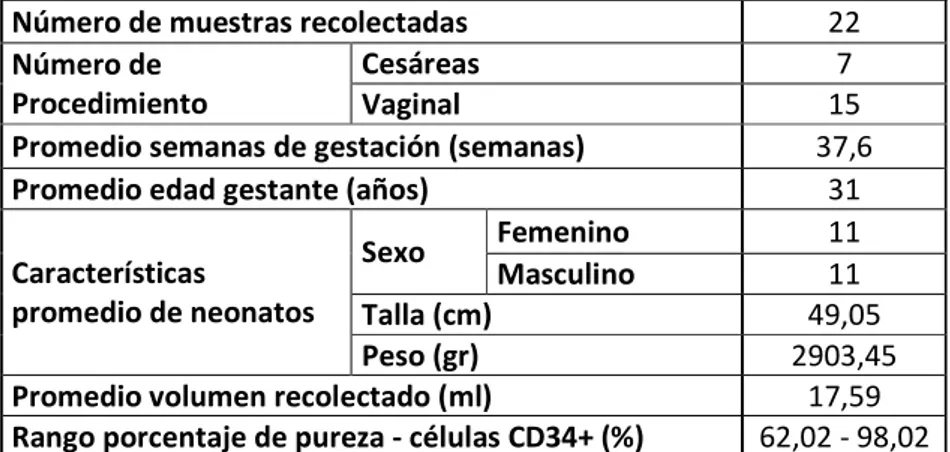
Las células CD34+ aisladas de SCU fueron obtenidas a partir de muestras recolectadas con las características que se presentan en la tabla 2. En la figura 4 se presenta un ejemplo del porcentaje de pureza de células CD34+ determinado mediante citometría de flujo después de la separación inmunomagnética.
Tabla 2. Muestras Recolectadas de SCU.
Número de muestras recolectadas 22
Número de Procedimiento
Cesáreas 7
Vaginal 15
Promedio semanas de gestación (semanas) 37,6
Promedio edad gestante (años) 31
Características
promedio de neonatos
Sexo Femenino 11
Masculino 11
Talla (cm) 49,05
Peso (gr) 2903,45
Promedio volumen recolectado (ml) 17,59
Figura 4. Porcentaje de pureza el antígeno CD34, detectad
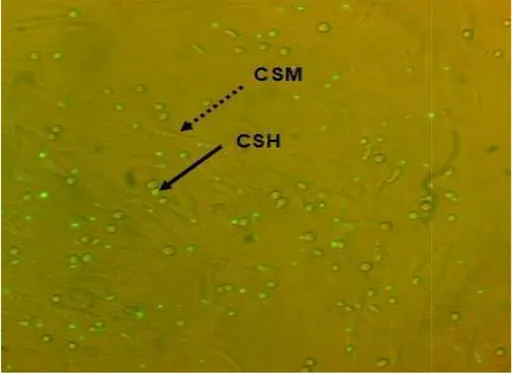
8.3 Establecimiento del sistem En la figura 5 se presenta el sis la tinción verde sobre las CSM.
Figura 5. Co-cultivo CSM y CSH observa la tinción fluorescen microscopio invertido de fluore
reza células CD34+. Se presenta una grafica tipo dot
tado con el uso de un anticuerpo monoclonal acopla (análisis software PentaGate).
stema de co-cultivo CSM y CSH
l sistema de co-cultivo establecido. Las CSH marcada SM.
CSH. Las CSH fueron sembradas (5x104/ml) sobre l scente de las células hematopoyéticas marcadas luorescencia (10x).
dot plot de fluorescencia para
oplado al fluorocromo APC
cadas con CFSE sobresalen por
8.4Efecto de las CSM sobre la proliferación de CSH aisladas de SCU
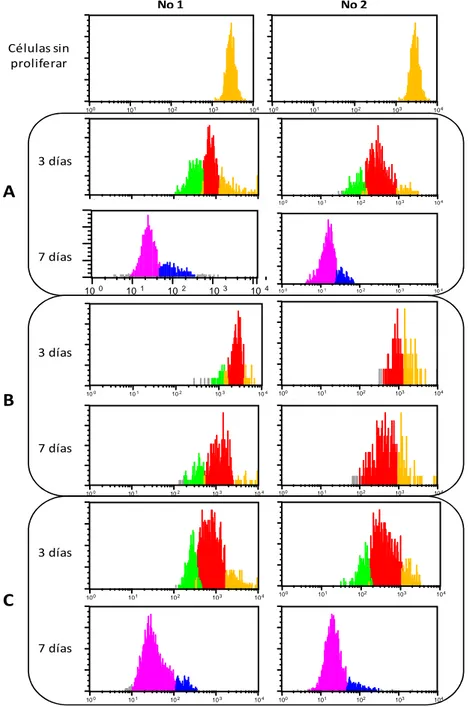
Después de 3 días y 7 días de co-cultivo, se observó una disminución en la intensidad de fluorescencia (IF) de CFSE en la población de CSH en co-cultivo en la condición “A” (HSC+MSC+Factores) y “C” (HSC+Factores), mientras que en la condición “B” (HSC+MSC) no se observó una disminución de la IF después de 3 y 7 días de cultivo. Los histogramas se presentan en la figura 6.Las figuras A y C muestran 5 eventos proliferativos entre los 3 y 7 días de cultivo.
No 1 No 2
100 101 102 103 104
100 101 102 103 104
100 101 102 103 104
CFSE FITC-A ->
100 101 102 103 104
100 101 102 103 104
CFSE FITC-A ->
100 101 102 103 104
FITC-A ->
100 101 102 103 104
100 101 102 103 104
100 101 102 103 104
CFSE FITC-A ->
100 101 102 103 104
100 101 102 103 104 100 101 102 103 104
CFSE FITC-A ->
100 101 102 103 104
3 días
100 101 102 103 104
7 días 3 días 7 días 3 días 7 días
A
B
C
Células sin proliferar8.5Evaluación del inmunofenotipo de HSC después del co-cultivo con CSM
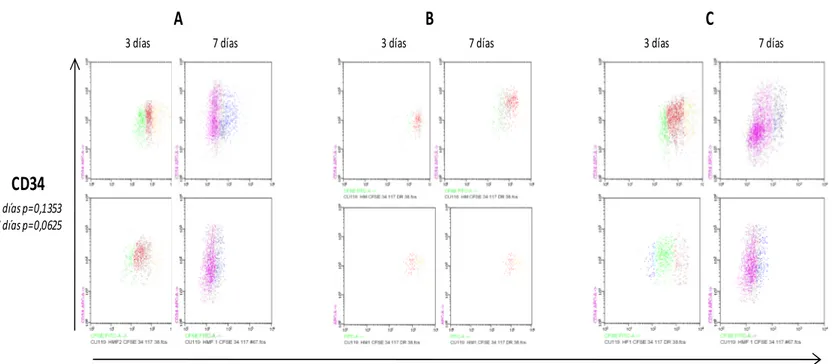
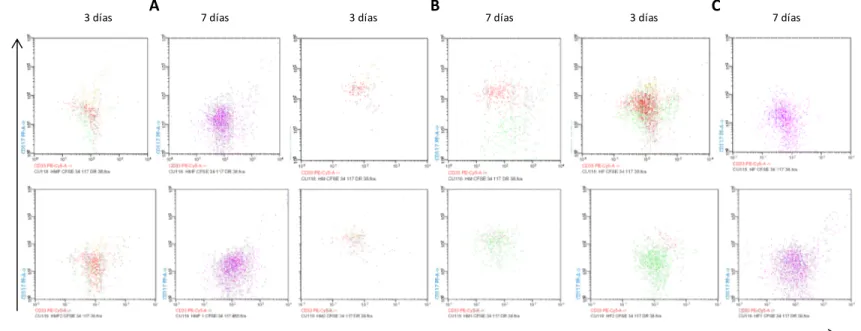
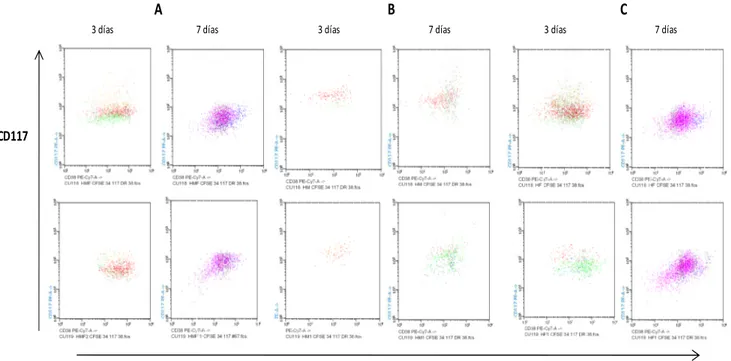
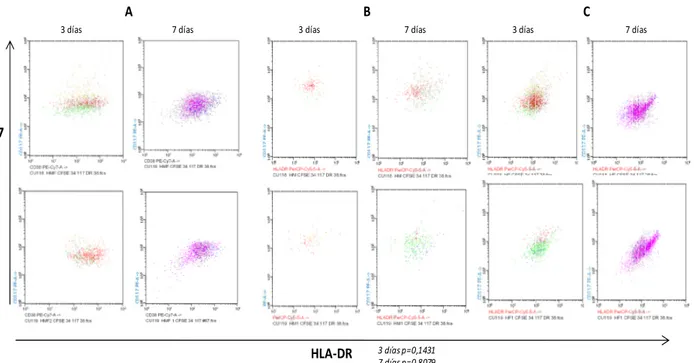
Para el análisis de la expresión de los antígenos analizados mediante citometría de flujo, se aplicó la prueba de Shapiro-Wilk para probar la normalidad de los datos de intensidad media de fluorescencia (IMF). Según esta prueba el antígeno CD34 presenta una distribución paramétrica (p>0.05) en las condiciones “B” (p=0,2530) y “C” (p= 0,3172) pero una distribución no paramétrica en la condición “A” (p=0,0001). Debido a ésta distribución y al número de datos analizados se decidió utilizar la prueba de Kruskal-Wallis para datos no paramétricos, para comparar IMF de los antígenos entre las condiciones experimentales A, B y C. Después de 3 y 7 días de co-cultivo, no se observan diferencias estadísticamente significativas en la IMF del antígeno CD34 entre las condiciones experimentales A, B y C (p=0.1353, p=0,0625) (Figura 7), sin embargo; después de 7 días de co-cultivo se observó una diferencia significativa en el IMF para CD117 entre las condiciones experimentales (p=0,0083) (Figura 8). No se observaron diferencias significativas, después de 7 días de co-cultivo, en el IMF para los antígenos CD33 (p=0,4648) (Figura 8), CD38 (p=0,0625) (Figura 9) y HLA-DR (p=0,8079) (Figura 10).
8.6Ensayos de clonogenicidad
Con la finalidad de relacionar las colonias obtenidas con la morfología celular correspondiente, se aisló cada una de las colonias clasificadas y se realizó una preparación a partir de cythospin (ver materiales y métodos). En la figura 11 se presenta el registro fotográfico de cada una de las colonias obtenidas y su correspondiente morfología por tinción con colorante de Wright. Las UFC-GEMM muestras células con citoplasma basófilo y nucléolos; UFB-E y UFC-E muestran células compatibles con morfología eritroide de linaje temprano y las tinciones para UFC-G; UFC-M y UFC-GM muestran neutrófilos y monocitos en estadios temprano.
CFSE
CD34
A
B
C
3 días 7 días 3 días 7 días 3 días 7 días
3 días p=0,1353 7 días p=0,0625
CD117
CD33
3 días 7 días
3 días 7 días 3 días 7 díasA
3 días p=0,1303 7 días p=0,0083
3 días p=0,0038 7 días p=0,4648
B C
CD38
3 días 7 días 3 días 7 días
3 días 7 días
A B C
CD117
3 días p=0,0271 7 días p=0,0625
B
A C
HLA-DR CD117
3 días 7 días 3 días 7 días 3 días 7 días
3 días p=0,1431 7 días p=0,8079
Figura 11. Registro fotográfic el medio
ráfico unidades formadoras de colonias. Se observa -UFC y las preparaciones con tinción de Wright obj
Figura 12. Ensayo de clonogen
Al observar que en los ensa recuentos de UFC-GEMM se suspensión con sobrenadante con el fin de evaluar el efec evidenciaron que la capacidad no es evidente para UFC-G formación no es estadística GM(p=0577).
Para evaluar si hay un efect sembradas estableciendo un contacto directo entre las diferencias estadísticamente (p=0,241) y UFC-GM ( p=0,006 celular( Figura 14).
genicidad después de 3 días de co-cultivo
ensayos de co-cultivo habían diferencias estadística se realizaron ensayos de cultivo por 3 días a pa antes frescos y congelados provenientes de CSM(v efecto de factores solubles y la termolabilidad de
idad de formar colonias a partir de cultivos con so GEMM,UFB-E,UFC-E( figura 13) y que a pesar ticamente significativa con respecto a la form
fecto de contacto que genere la formación de co un co-cultivo de semicontacto por medio de un las CSM y las CSH por 3 días. La lectura de
te significativas en los recuentos de colonias UF 0067), para las condiciones mediadas por contact
ticamente significativa en los a partir de CSH aisladas y en
M(ver materiales y métodos) de ellos. Los experimentos on sobrenadantes congelados sar de formar UFC-GM esta ormación de colonias
UGC-e colonias, las células fuUGC-eron una membrana transwell y
Figura 13: Recuento de UFC a partir de sobrenadantes frescos y congelados de CSM.
Figura 14.Condicion de evaluación de semicontacto y contacto para la formación de unidades de colonias. 0 5 10 15 20 25 30 35 40 45 50 55 60
UFC-GEMM UFB-E UFC-E UFC-GM
U FC / 1 ,1 X 1 0 3cé lu la s C D 34 +
Ensayo de clonogenicidad (Sobrenadantes MSC)
Congelados Frescos p=0,0577 0 5 10 15 20 25 30 35 40
UFC-GEMM UFB-E UFC-E UFC-GM
U FC / 1 ,1 X 1 0 3cé lu la s C D 3 4+
Ensayo de clonogenicidad (Semi-contacto)
SOLAS (3 días de cultivo) CONTACTO DIRECTO TRANSWELL 5um
9. DISCUSIÓN
La principal herramienta de este estudio fue evaluar el efecto que tienen las CSM extraidas de MO humana en la proliferacion, diferenciacion y clonogenicidad en células CD34 + extraidas de SCU en un sistema de co-cultivo. Existen evidencias de una mayor eficacia de cultivos de CSH dependientes de CSM para su expansion por medio de factores solubles y de contacto célula (Alakel N et al. 2009;
Yue Z, et al. 2006). Debido al papel que cumple las CSM en la generación de tejido conectivo y su función en la medula ósea (Muraglia A . et al, 2000), éstas células han sido motivo de estudio por
proveer un amplio número de señales que favorecen la expansión in vitro de CSH y compatibilidad inmunológica en trasplantes (McNiece I. et al 2004). Por ello es de suma importancia comprender los mecanismos que controlan la autorenovación, diferenciación y la habilidad de expansión de las CSH para optimizar su aplicación clínica.
Los resultados obtenidos en la proliferación de CSH en las condiciones HMF y HF evidenciaron picos de fluorescencia CFSE de uno a cinco ciclos de división que pueden atribuirse al uso de citoquinas como FLT3, TPO y SCF. Estudios previos ya habían demostrado el efecto positivo, en la proliferación de CD34+, de citoquinas (TPO,FLT3.IL-3, IL-6 y SCF) en cultivos in vitro y afirman que
éstas proteínas son de gran ayuda en la obtención de un elevado número de células stem ex vivo y así poder garantizar el éxito de un trasplante celular (Hyeok K,et al 2005).Debido a que la condición HM
presento tan solo tres ciclo de proliferación a los 3 y 7 días seria de gran uso seguir estudiando el mantenimiento de la capacidad de autorenovación mantenida en estas condición.
Desafortunadamente la expansión in vitro de HSC no ha sido solucionada con el uso de factores solubles debido a que la proliferación se acompaña de diferenciación (Sorrentino BP ,et al 2004). En nuestros ensayos donde se evaluaron cambios en la expresión del inmunofenotipo en las condiciones HMF, HM y HF, la diferencia más importante fue obtenida en la expresión de CD117 en la condición HM a los 7 días (p=0.0083), según lo analizado a partir de las IMF obtenidas por citometría de flujo; mientras que no se observaron variaciones fenotípicas significativas en la expresión de HLDA-DR(p=0,807),CD34(0,0625), CD33(p= 0,4648) y CD38(0,0625). Se ha planteado la solución para mantener la expresión primitiva de marcadores fenotípicos por medio del uso de la actividad epigenética de aza-D y TSA ,dando solución al problema de expansión con diferenciación (Hyeok K,et al 2005).
a la clonogenicidad celular, pero en menor proporción . Los ensayos realizados en cultivos 3D(citoquinas, células y matriz extracelular)han mostrado una alta capacidad clonogénica de UFC-GEMM debido a que las CSM secretan mas matriz extracelular en esta condición(Yue Z, et al 2005).
Este estudio demostró que los co-cultivos (HM, HMF y HF) presentan diferencias en la inducción de la proliferación, cambios de marcadores fenotípicos y en la capacidad clonogénica de las CSH, permitiendo concluir que para la obtención de un buen numero de HSC in vitro en necesario garantizar la proliferación y el mantenimiento de la pluripotencia de las células CD34+ provenientes de SCU.
10. CONCLUSIONES
• La obtención de CSM fue posible a partir de MO cumpliendo los criterios de adherencia al plástico , morfología fibroblastoide y expresión de marcadores de inmunofenotipo, según lo definido por la ISCT.
• Fue posible la obtención de células CSH a partir de SCU con porcentajes de pureza para CD34+ entre el 62 y el 98 %.
• El establecimiento de un sistema de co-cultivo fue realizado con éxito a partir de mesenquimales sembradas a un confluencias del 80 % y células CD34+a una densidad celular de 5.X104 mantenidas durante 3 y 7 días.
• Se observó un efecto positivo en la proliferación de CSH al adicionar citoquinas como SCF,FLT3 y TPO en las condiciones en las que CSH estaban con y sin CSM.
• No se observaron diferencias estadísticamente significativas en la expresión de marcadores como CD34; CD33; CD38 y HLA-DR a los 7 días de cultivo en las condiciones HMF, HM y HF. la expresión de CD117 a los 7 días mostraron diferencias estadísticamente significativas en las 3 condiciones evaluadas. La grafica de dot plot y la IMF muestra que la condición HM es el co-cultivo que marca la diferencia en la expresión del fenotipo CD117.
• Los ensayos de clonogenicidad mostraron que la condición HM presentaban mayor capacidad generar UFC-GEMM (primitivas) a diferencia de las condiciones HF y HMF.
• Al evaluar si los sobrenadantes de las CSM y la termolabilidad de éstos influía sobre la formación de colonias en las CSH . Se logró observar que en los cultivos de sobrenadantes congelados solo hay formación de UFC-GM, a diferencias de los cultivos a partir de sobrenadantes frescos, los cuales presentaron formación de UFC GM,E,GEMM y UFB-E. • Los ensayos de clonogenicidad que evaluaban la capacidad de formación de UFC a partir
11. BIBLIOGRAFIA
1. A Muraglia, R Cancedda and R Quarto. Clonal mesenchymal progenitors from human bone marrow differentiate in vitro according to a hierarchical model. Journal of Cell Science 2000; 113:1161-66.
2. Alakel N, Jing D, Muller K et al. Direct contact with mesenchymal stromal cells affects
3. Alp C. Haematopoietic stem cells niche: interrelations between structure and fuction. Transfus Apher Sci..2008; 38:261-268.
4. Anklesaria P, Kase k,Glowachi J, Holland C, Sakakenny M, Wright J,FitzGerald, Lee C. Engraftment of a clonal bone marrow stromal cell line in vivo stimulates hematopoietic recovery from total body irradiation. Proc, Natl. Acad. Sci USA 1987;84:7681-87.
5. Ballen K, Broxmeyer H, McCullought P, et al.Current status of cord blood banking transplantation in the United States and Europe. Biology of Blood and Marrow Transplantatation 2001;7:635-645.
6. Berenson RJ, Andrews RG, Bensinger WI, Kalamasz D, Knitter G, Buckner CD, et al. Antigen CD34+ marrow cells engraft lethally irradiated baboons. J Clin Invest 1988;81:951–5.
7. Brider SP, Jaiswal N , Haynesworth SE. Growth Kinetics, self –renewal, and the osteogenic potential of purified human mesenchymal stem cells during extensive subcultivation and following cryopreservation. J Cell Biochem 1997;64 :278-94.
8. Camargo FD, Green R,Capetanaki Y, Jackson KA , Goodell Ma.Single hematopoietic stem cell generate skeletal muscle through myeloid intermediates. Nat Med 2003; 9:1520-27.
9. Dazzi F, Ramasamy R, Glennie S, Jones S,Roberts I.the role of mesenchymal stem cell in Haemopoiesis. Blood reviews 2006; 20:161-71.
10. Devine S, Bartholome A, Mahamud N, Nelson , Patil S , Hardary W, Sturgeon C, Hewett T, Chung T,Stock W, et al.Mesenchymal stem cells are capable of homing to the bone marrow of non-human primates following sysytemic infusion. Exp Hematol 2001; 2:129- 244.
11. Dominic M, Le Blanc K, Mueller I, Slaper-Cortenbach L,Marini FC, Krause DS, Deans RJ, Keating A, Prockop DJ y Horwitz EM. Minimal criteria for defining multipotente mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy.2006;4: 315 – 17.
12. Eglits MA, Mezey E .Hematopoietic cells differentiate into microglia and macroglia in the brains of the adult mice.Proc Nat Acad Sci USA 1997; 94: 4080-5.
13. Friedenstein AJ. Ontogenetic activity of transplanted transitional epithelium. Acta Anat 1961; 45:31–59.
14. George Q . Daley and David T. Scadden. Prospects for Stem Cell-Based Therapy. Cell 2008;132: 544-47.
15. Hyeok K, Soo Ch , Sil P , Jin K ,Seop A, Young Sh, Co-culture of human CD34+ cells with mesenchymal stem cells increases the survival of CD34+ cells against the 5-aza-deoxycytidine- or trichostatin A-induced cell death. Biochem Biophys Res Commun. 2005; 329 :1039-45
advanced breast cáncer patients receiving high- dose chemoterapy. J Clinic Oncol 2000;1: 307-316.
17. Koh SH, Choi HS, Park ES, Kang HJ, Ahn HS, Shin HY. Co-culture of human CD34+ cells with mesenchymal stem cells increases the survival of CD34+ cells against the 5-aza-deoxycytidine- or trichostatin A-induced cell death. Biochem Biophys Res Commun. 2005;329(3):1039-45.
18. Kopp, H.G.,Avecilla, .ST., Y Rafii, s.The bone marrow vascular niche: home if HSC differentiation y mobilizacion.Physiology 2005; 20:349-56.
19. Krampera M, Pasini A, Rigo A,et al.HB-EGF/HER-1 signaling in bone marrow mesenchymal stem cell :inducing cell expansion and preventing reversibly multi-lineage differentiation. Blood 2005;106:59-66.
20. Kuznestsov SA, Friedenstein AJ, Robery Pg 1997; Gronthos S, Simmons PJ . Factors reuquiered for bone marrow stromal fibroblast colony formation in vitro . Br J haematol 1995; 97:561-70. 21. Li L y Xie , T. Stem cell niche: structure and fuction. Annu, Rev. Cell Dev. Biol. 2005; 21: 605-31. 22. LI N,Feugier P,Seurrurrier B,Latger Cl,Lesesve J, Stoltz y Eljaafari. Human mesenchymal stem cells
improve ex vivo expansión of adult human CD34 peripheral blood progenitor cells and decrease their allostimulatory capacity 2007;35:507-515.
23. Mark J. Kiel & Sean J. Morrison. Uncertainty in the niches that maintain haematopoietic stem cells. Nature Reviews Immunology 2008;8: 290-301.
24. McNiece I,. Shpall J. ex vivo expansion of cord blood .Cytotherapy 2005;7: 243-50
25. migratory behavior and gene expression profile of CD133+ hematopoietic stem cells during ex vivo expansion. Exp.Hematol. 2009;37:504-513.
26. Muller A, Medvinsky A.Strouboulis J.Grosveld F, Dzierzak E.Development of hematopoietic stem cell activity in the mouse embryo. Inmunity 1994;1:291-301.
27. Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R,Mosca JD, et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999;284:143–7.
28. Reya T, Duncan AW, Ailles L, Domen J, Scherer DC, Willert K, Hintz L, Nusse R, Weissman IL. A role for Wnt signalling in self-renewal of haematopoietic stem cells. Nature. 2003;423:409-14. 29. Salmon P, Kindler V, Ducrey O, Chapuis B, Zubler RH, Trono D. High-level transgene expression in
human haematopoietic progenitors and differentiated blood lineages after transduction with improved lentiviral vectors. Blood 2000;96:3392–8.
30. Schofield, R. The relationship between the spleen colony- forming cell and the hematopoietic stem cells. Blood cells 1978; 4: 7-25.
31. Sorrentino BP. Clinical strategies for expansion of haematopoietic stem cells. Nat.Rev.Immunol. 2004;4:878-888
32. Till JE, McCulloch CE. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiat Res 1961;14:213–22.
34. Wang HS, Hung SC, Peng ST, Huang CC, Wei HM, Guo YJ, et al.Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord. Stem Cells 2004;22:1337-7.
35. Watt, F,M and Hogan B.L. Out of Eden : stem cells and their niches . Science 2000; 287:1427-30.