CARACTERIZACIÓN DE LOS LINFOCITOS T CD4 ESPECÍFICOS
DE ROTAVIRUS
MIGUEL HERNANDO PARRA AVILA
TESIS
Presentada como requisito parcial para optar al título de
Doctor en Ciencias Biológicas.
Directores
Juana Ángel Manuel Antonio Franco
Pontificia Universidad Javeriana Facultad de Ciencias
Programa de doctorado en Ciencias Biológicas Bogotá, D.C.
NOTA DE ADEVERTENCIA
3
CARACTERIZACIÓN DE LOS LINFOCITOS T CD4 ESPECÍFICOS
DE ROTAVIRUS
MIGUEL HERNANDO PARRA AVILA
APROBADO
___________________________ _____________________________
Juana Ángel, MD. PhD Manuel Antonio Franco, MD. PhD
Directora Director
___________________________ _____________________________
Fernando Esquivel G, Biol. PhD Beatriz Parra Patiño, Bact, PhD
Jurado Jurado
___________________________ _____________________________
Nelly Stella Roa, Odont. PhD Jairo Antonio Rodríguez, MD, PhD
Jurado Jurado
_____________________________ Paula Andrea Velilla H. Bact. PhD
CARACTERIZACIÓN DE LOS LINFOCITOS T CD4 ESPECÍFICOS
DE ROTAVIRUS
MIGUEL HERNANDO PARRA AVILA
___________________________ _____________________________
Concepción Puerta B. Bact. PhD Manuel Antonio Franco, MD. PhD
Decana Académica Director de Posgrados
5
TABLA DE CONTENIDO
INTRODUCCIÓN ... 10
MARCO TEÓRICO ... 16
Rotavirus ... 16
Estructura del virus ... 16
Clasificación de los rotavirus ... 17
Replicación de los rotavirus ... 18
Epidemiología de la infección por rotavirus ... 21
Las vacunas contra rotavirus ... 22
Poblaciones de los linfocitos T ... 25
Tejido linfoide asociado al tracto gastrointestinal (GALT, por sus siglas en inglés) ... 26
El tráfico de las células T hacia el intestino ... 27
Respuesta inmune al rotavirus ... 30
Inmunidad Innata contra la infección por rotavirus ... 35
Métodos para estudiar linfocitos T ... 37
Los tetrámeros ... 37
Los tetrámeros de clase II. ... 38
Uso de tetrámeros de clase II en la identificación de células T específicas de antígeno en enfermedades infecciosas ... 39
OBJETIVOS ... 40
Objetivo general ... 40
Objetivos específicos ... 40
Artículos ... 41
Artículo número 1 ... 41
Introducción ... 41
Materiales y Métodos ... 41
Resultados ... 42
Conclusiones ... 43
Limitaciones ... 43
Texto del artículo 1 ... 44
Figuras y tablas adicionales del artículo 1 ... 58
Ensayos no incluidos en el artículo número 1 ... 62
Coloración para identificar los perfiles de regulación en CMSP ... 62
Estimulación y fenotipificación de las células CD4 extraídas de muestras de intestino humano ... 69
Artículo número 2 ... 78
Introducción ... 78
Materiales y Métodos ... 79
Resultados ... 79
Conclusiones ... 79
Limitaciones ... 80
Figura adicional del artículo 2 ... 133
Discusión General ... 134
Perspectivas ... 145
7
RESUMEN
En la infección por rotavirus los linfocitos T CD4 son importantes porque estimulan a los LB a que produzcan anticuerpos IgA protectores. El objetivo principal del estudio fue caracterizar los linfocitos T CD4 humanos específicos de rotavirus. Por métodos bioinformáticos se seleccionaron 39 péptidos de rotavirus predichos de ser presentados por moléculas DRB1*0101. Se evaluó la producción de citocinas de células mononucleares de sangre periférica (CMSP) de adultos sanos genotipificados para el HLA estimuladas con los péptidos organizados en grupos. Se realizó la deconvolución de los grupos positivos para identificar los péptidos individuales. Los péptidos seleccionados fueron acoplados con moléculas solubles de HLA DRB1*0101 para formar tetrámeros. CMSP de adultos y niños DR1 fueron teñidas con los tetrámeros, y anticuerpos contra marcadores de migración y diferenciación. Además, se aislaron CMSP, y células mononucleares de intestino humano de adultos para evaluar la producción de citocinas por los linfocitos T, generar líneas de linfocitos T y teñir con los tetrámeros a los linfocitos T. Tres de los péptidos identificados por bioinformática fueron reconocidos por los linfocitos T de adultos en contexto de moléculas DRB1*0101. Dichos péptidos hacen parte de tres proteínas del virus, dos estructurales y una no estructural. Las líneas de linfocitos T generadas a partir de estos voluntarios mostraron ser específicas al re-estimularlas con los péptidos específicos. Se observó que en CMSP de adultos sanos y niños vacunados, las células específicas de rotavirus están enriquecidas en células de memoria y que éstas expresan marcadores de migración intestinal. Al comparar la producción de citocinas de CMSP estimuladas con rotavirus, tétanos o virus de la influenza se observó que la respuesta de las células T CD4 contra
rotavirus está enriquecida en células productoras de sólo IFN-γ, mientras que las
ABSTRACT
In rotavirus infection, T CD4 lymphocytes are important because they stimulate B-lymphocytes to produce protective IgA antibodies. The principal aim of this work was to characterize human rotavirus specific T CD4 cells. Using bioinformatics, 39 rotavirus peptides predicted to be restricted by HLA DRB1*0101 were selected. Cytokine production by PBMC obtained from healthy adults, previously HLA genotyped, were evaluated after stimulation with pools of peptides. To identify individual rotavirus specific peptides, pools were deconvoluted. Selected peptides were assembled with soluble HLA DRB1*0101 molecules to form tetramers. PBMC obtained from DR1 healthy adults and children were stained with tetramers, and antibodies against migration and differentiation markers. Moreover, PBMC and human intestinal mononuclear cells from adults were isolated to evaluate cytokine production by T cells, produce T cell lines and stain the T cells with the tetramers. Three of the peptides identified by bioinformatics, were recognized by CD4 T cells in the context of DRB1*0101. The peptides are derived from two structural and one non-structural rotavirus proteins. Cell lines generated after stimulation with these peptides specifically responded after re-stimulation with the specific peptides. Results also showed that rotavirus specific T cells were enriched in antigen-experienced cells that expressed intestinal migration markers. Comparison of cytokine production by rotavirus specific T cells with those specific for influenza and tetanus toxoid showed that rotavirus specific T cells are enriched in cells producing only IFN-γ, whereas tetanus toxoid and influenza specific cells are enriched in multifunctional cells.
9
LISTA DE ABREVIATURAS
ARN. Ácido ribonucleico.
VLPs. Partículas virales vacías.
DNA. Ácido desoxiribonucleico.
LT. Linfocitos T.
CMSP. Células mononucleares de sangre periférica. GALT. Tejido linfoide asociado al tracto gastrointestinal.
CMV. Citomegalovirus.
ICS. Tinción intracelular de citocinas. TCM. Células T de memoria central. TEM. Células T de memoria efectora.
TTE. Células T de memoria efectora terminal. DLPs. Partículas virales de doble capa.
TLPs. Partículas virales de triple capa.
HA. Hemaglutinina.
RER. Retículo endoplasmático rugoso. VIH. Virus de inmunodeficiencia humana. TRM. Células T residentes en los tejidos.
PP. Placas de Peyer.
ILF. Folículo linfoide aislado. NLM. Nódulo linfático mesentérico.
CD. Células dendríticas.
TREG. Células T reguladoras.
VEA. Vénulas endoteliales altas.
MHC. Complejo mayor de histocompatibilidad.
TCR. Receptor de las células T.
Dpi. Días post-infección.
EBV. Virus Epstein Barr.
ISGs. Genes estimulados por interferón. PCR. Reacción en cadena de la polimerasa. TRF. Receptor de transferrina.
CMIH. Células mononucleares intestinales humanas.
GE. Gastroenteritis.
VHC. Virus de hepatitis C.
SEB. Enterotoxina estafilococcica B.
DTT. Ditiotreitol.
HBSS. Solución salina balaceada de Hanks
INTRODUCCIÓN
Rotavirus es un virus perteneciente a la familia Reoviridae, cuyo genoma está constituido por 11 segmentos de ARN de doble cadena que sintetizan 12 proteínas, de las cuales 6 son proteínas estructurales y 6 no estructurales 1. Antes de la introducción de las vacunas en el 2008, la diarrea causada por rotavirus era la principal causa de hospitalizaciones en el mundo en niños menores de 5 años 2, 3. Además, de acuerdo con un estudio retrospectivo en el que se evaluaron 72 publicaciones realizadas en diferentes países, se determinó que la infección por este virus está asociada con una alta mortalidad en niños menores de 5 años; se estimó entonces que la infección por rotavirus cobraba la vida de cerca de 527.000 (475.000-580.000) niños anualmente, esto se traduce en aproximadamente 1.440 muertes por rotavirus diariamente 2, 3. Un estudio más reciente mostró que para el año 2008 la mortalidad mundial se estimó en 453.000 muertes mundialmente (95% IC 420.000-494.000) en niños menores de 5 años, datos que corresponden con el 37% de las muertes debidas a diarrea y 5% de las muertes totales en niños menores de 5 años 4. Antes de la inclusión de las vacunas, en Colombia se estimó que el número de visitas a urgencias y muertes relacionadas con infecciones por rotavirus en niños menores de 2 años era de 105.378 y 470, respectivamente 5. La infección por rotavirus se encuentra distribuida en todo el mundo y los datos recolectados indican que las tasas de infección son similares en los países desarrollados y en vías de desarrollo. Sin embargo, la mortalidad es diferente; India concentra la mayor cantidad de muertes relacionadas con la infección por rotavirus con cerca de un 25% de todos los casos a nivel mundial; seis países (China, Nigeria, Pakistán, Congo, Etiopia e India) suman más del 50% de los casos fatales a nivel mundial 2. El desarrollo de vacunas contra este patógeno es una necesidad teniendo en cuenta los datos epidemiológicos.
En 1998 la FDA aprobó para su uso la vacuna Rotashield®, un año después la vacunación fue suspendida debido a un elevado número de casos de invaginación intestinal relacionados con el uso de la vacuna 6. Actualmente hay dos vacunas en el mercado que tiene la aprobación de Organización Mundial de la Salud (OMS) 7: Rotarix®® (GlaxoSmithKline Biologicals) y RotaTeq® (Merk and Co. Inc.). Sin embargo, los estudios post-licencia de las dos vacunas, que se han realizado en diferentes países, han mostrado que en países con bajos niveles socioeconómicos (África Subsahariana y Asia) las dos vacunas son menos eficaces 8, 9, en comparación con los informes obtenidos de la vacunación realizada en países europeos o latinoamericanos 2.
11
contra rotavirus puede deberse a que: la infección en países de África Subsahariana y Asia ocurre durante todo el año y no es estacional como sucede en países desarrollados; a una alta dosis de infección e incluso a una coinfección con varias cepas virales; la circulación de cepas poco comunes que escapan a la protección ofrecida por las vacunas; además, la flora intestinal y la presencia de parásitos intestinales en los niños vacunados pueden también ejercer un papel negativo en la efectividad de la vacuna 10. Debido a estos factores y al alto costo de las vacunas para los países con menores ingresos per cápita, se ha hecho necesario el desarrollo de nuevas vacunas contra rotavirus 11, 12 o implementar otro tipo de estrategias, como el uso de virus inactivados, partículas virales vacías (VLPs), vacunas de DNA o subunidades de VP6, las cuales se encuentran actualmente en estudios en animales 10.
Sin embargo, el uso de estrategias diferentes a las vacunas vivas-orales o el mejoramiento de las vacunas actuales implica tener un amplio conocimiento de la patogénesis y la respuesta inmunológica frente al virus.
Los rotavirus se replican preferencialmente en las células absortivas del intestino delgado, por lo que la inmunidad mucosa local es esencial en el desarrollo de la inmunidad contra el rotavirus 10. Sin embargo, este virus induce una respuesta inmune intestinal y sistémica, esta última relacionada con la antigenemia que ha sido detectada en infecciones agudas de animales y niños 13, 14. Tanto en humanos como animales se ha observado que la IgA intestinal específica de rotavirus es esencial en la respuesta inmune contra rotavirus 15. La IgA es importante para al aclaramiento viral y la protección contra la infección por rotavirus 15. Actualmente, la medición de IgA sérica específica de rotavirus poco después de una infección natural o de la vacunación es el mejor correlato de protección contra la gastroenteritis por rotavirus en humanos 16.
Con el desarrollo del presente trabajo buscamos aportar al conocimiento de la respuesta de las células T específicas de rotavirus desde varios aspectos:
1. Identificación de nuevos epítopes de células T CD4 humanas de rotavirus. Los primeros epítopes restringidos a clase I derivados de la proteína VP7 de rotavirus se identificaron en un modelo de ratón infectado con la cepa bovina RF 21. A partir de ese punto, el número de epítopes derivados de las proteínas VP7 y VP6 de clase I y II murinos se ha incrementado 22-24, incluyendo epítopes derivados de la proteínas NSP1 25 y epítopes de la proteína VP6 restringidos a clase II en modelos de monos Rhesus 26. En humanos se han identificado muy pocos péptidos específicos de rotavirus, además, los descritos en la literatura están ligados a la presentación por moléculas de clase I y son derivados de las proteínas VP6 y VP7 del virus 27, 28. Para el desarrollo de este trabajo se eligieron las secuencias de aminoácidos de las proteínas de una cepa de rotavirus humano y se identificaron los posibles péptidos presentados por las moléculas de clase II DR β1:0101, usando una combinación de dos algoritmos bioinformáticos, P9 y SYFPHEITI. Los péptidos reconocidos por el algoritmo se organizaron en grupos de 5 péptidos cada grupo y se evaluó la producción de IL-2 e IFN-γ en CMSP derivadas de adultos sanos. Finalmente, se realizó la deconvolución de los grupos con resultados positivos para identificar los péptidos individuales específicos de rotavirus que eran reconocidos por las células T CD4 de los voluntarios.
2. Usando marcación con tetrámeros de clase II caracterizamos las células T CD4 circulantes específicas de rotavirus, determinando sus perfiles de diferenciación y de migración. El uso de los tetrámeros de clase II ha surgido como una importante herramienta para evaluar la especificidad y determinar el fenotipo de las células CD4 en las respuesta inmune de diferentes enfermedades y en los estudios post-vacunación 29, 30. El uso de las marcaciones con los tetrámeros solubles de clase II se ha transformado en una tecnología robusta usada en numerosos contextos clínicos 30. Determinar los perfiles de migración y diferenciación de las células individuales específicas de rotavirus nos ayuda a entender en qué lugar anatómico se estimularon inicialmente las células de memoria y a determinar la funcionalidad de las mismas. Esto debido a que las células T son funcionalmente heterogéneas y median su actividad a través de diferentes mecanismos. Para identificar mejor las células con perfiles de migración intestinal es necesario combinar la expresión de la integrina α4β7 y del receptor CCR9, que permite diferenciar si las células migran hacia colon o intestino delgado ya que el receptor CCR9 que es un marcador de migración de intestino delgado exclusivamente, mientras que α4β7 es de intestino delgado y colon.
13
hacia la piel o la mucosa gastrointestinal 31, 32. Estos receptores son impuestos por las células dendríticas durante el desarrollo de las células T y promueven el tráfico de estas células hacia los tejidos donde se expresan sus ligandos 33. Las células dendríticas ligadas al GALT metabolizan la vitamina A transformándola en ácido retinóico, que induce a las células T vírgenes a expresar los marcadores α4β7 y CCR9, marcadores que predisponen a las células recientemente activadas a migrar desde el torrente sanguíneo hacia el tejido del tracto gastrointestinal 34. El ligando natural de la moléculas α4β7 es la adresina MadCAM-1 35, que se encuentra expresada en las células endoteliales de la lámina propia a lo largo de todo el recorrido del intestino, mientras que el ligando natural de CCR9 es la molécula CCL25 que solamente se encuentra expresada en las vénulas del intestino delgado 36; por lo tanto, una células que expresa ambos marcadores está condicionada a migrar desde el torrente sanguíneo al intestino delgado.
El rotavirus tiene como sitio de replicación principal a los enterocitos maduros del intestino delgado, sin embargo, se ha observado en animales y en niños una diseminación sistémica 13, 14, 37, consecuentemente, se generan células T específicas de rotavirus en los dos compartimientos (el intestinal y el sistémico). La evaluación de poblaciones de células T CD4 circulantes específicas de rotavirus han mostrado que éstas expresan preferencialmente el marcador de migración intestinal α4β7 38, 39. No obstante, la metodología usada en estos trabajos implicaba la separación de todas las células α4β7, para posteriormente evaluar únicamente la proliferación frente al antígeno de rotavirus. Esta metodología no permitía la evaluación de los estadios de diferenciación de las células circulantes y además, tampoco se podía saber si las células específicas de rotavirus migraban hacia el intestino delgado y/o el colon, porque no se incluyó la determinación del receptor CCR9.
La característica fundamental para evaluar la respuesta de las células T es la magnitud, entendida como la frecuencia de las células específicas contra un patógeno o la medición de una función efectora, como la producción de IFN-γ; mientras que la calidad de la respuesta representa mejor las características de una células T eficiente: habilidades para proliferar, inducir la proliferación de otras células, organizar la respuesta inmune y llevar a cabo funciones efectoras a través de mecanismos citolíticos o la secreción de citocinas 42.
La respuesta de las células T contra rotavirus ha sido caracterizada mediante la técnica de linfoproliferación 43-46; los resultados han mostrado que la mayoría de los adultos sanos y niños en la etapa convaleciente tienen células específicas de rotavirus que proliferan en respuesta al antígeno. Por medio de las técnicas de ELISPOT y la tinción intracelular de citocinas (ICS) se ha observado que en los adultos sanos la mayoría de las células T tanto CD4 y como CD8 producen únicamente IFN-γ, mientras que las células doble positivas (IFN-γ/IL-2) o las que producen solamente IL-2 se observan en muy bajos porcentajes 38, 40, 41, 47. Pese a esto, las frecuencias detectadas son comparables con las células específicas de los virus de mucosas respiratorias 40
. Las características de estas células sugieren entonces que las células T específicas de rotavirus son probablemente células de memoria terminales, incapaces de generar una respuesta inmune eficiente. La respuesta de células T en niños con infección natural por rotavirus ha mostrado que la frecuencia de células CD4 que secretan IFN-γ es más baja que en los adultos, mientras que la respuesta de citocinas en niños sanos no ha sido estudiada 38, 40, 41, 47.
15
MARCO TEÓRICO
Rotavirus
Estructura del virus
Los rotavirus son virus no envueltos que pertenecen a la familia Reoviridae, se caracterizan porque la partícula viral infecciosa tiene morfología icosaédrica, semejante a una rueda, al observarla por microscopía electrónica, de la cual se deriva su nombre. Está compuesto por tres capas proteicas concéntricas que rodean un genoma conformado por 11 segmentos de ácido ribonucleico (ARN) de doble cadena 1, 49 (figura 1). Cada uno de los segmentos de ARN codifica para una proteína, excepto el segmento 11 que codifica para 2 proteínas (NSP5 y NSP6, en algunas cepas virales) 1. De las 12 proteínas del virus, 6 corresponden a proteínas estructurales y 6 a proteínas no estructurales 1.
Figura 1. Estructura del virión de rotavirus. El virión de rotavirus se
[image:16.612.202.471.371.625.2]17
El virión infectivo tiene cerca de 100 nm de diámetro, la capa más interna está conformada por 120 copias de la proteína VP2, que se encuentra asociada con VP1 (ARN polimerasa dependiente de ARN) y VP3 (Guaniltransferasa y metilasa) protegiendo el genoma del virus e implicadas en la replicación del virus. La capa intermedia rodea el core del virus y está compuesta por 260 trímeros de VP6 organizados en pentámeros y hexámeros. VP6 es la proteína estructural más abundante del virus y conforma las partículas de doble capa (DLPs), que no son infecciosas pero si son replicativamente activas 50. Finalmente, la capa externa está compuesta por los 260 trímeros de la glicoproteína de unión a calcio VP7 y por 60 espículas triméricas de la proteína sensible a proteasas VP4 49; la combinación de las tres capas forma las estructuras infecciosas de tres capas denominadas TLPs 51
. Por último, la morfología del virus tiene 132 canales que se agrupan en 3 tipos, dependiendo de la posición que ocupan dentro de la arquitectura del virus, que juegan un papel muy importante en la entrada del virus y la liberación de los ARN mensajeros recién formados 51, 52.
Clasificación de los rotavirus
Las cepas de rotavirus poseen una alta diversidad genética y antigénica y son clasificadas en tres diferentes especificidades, grupo, subgrupo y serotipo 19. Los grupos de rotavirus se identifican basados en la antigenicidad de la proteína estructural más abundante, VP6. Actualmente son reconocidos 7 grupos designados con las letras A hasta G; los rotavirus del grupo A, B y C son la causa más común de infección en los seres humanos y animales, mientras que los grupos D a G sólo han sido identificados en huéspedes animales 53. El grupo A es el grupo más común encontrado en las infecciones en humanos, los cuales se subdividen en tres diferentes genogrupos, basados en características comunes que comparten con tres cepas prototipo humanas Wa, DS-1 y AU-1. Los epítopes de reacción cruzada presentes en la proteína VP6 confieren la clasificación de subgrupo y se organizan en los subgrupos I, II, I/II y no I/no II. Los rotavirus humanos G2 y G8 pertenecen al subgrupo I, mientras que la mayoría de los G1, G3, G4 y G9 humanos pertenecen al subgrupo II, sin embargo, esta clasificación ha caído en desuso 53, 54.
G1, G2, G3, G4 y G9 y están relacionados con cerca del 90% de las infecciones en humanos, mientras que el serotipo P1 representa alrededor del 91% de las cepas circulantes humanas 10, 19.
Pero no solo la clasificación actual de los rotavirus se centra en reacciones serológicas, también se han descrito genotipos basados en la secuencia de los segmentos del genoma del virus. Los serotipos G y su correspondiente genotipo son generalmente equivalentes, mientras que existen al menos 35 genotipos P que no son siempre equivalentes con los serotipos P; para hacer la clasificación completa se deben reportar los dos, por lo tanto, los genotipos se designan entre corchetes; por ejemplo, la cepa Wa se identifica como P1A[8]G1 53. A pesar de esto, la diversidad de las cepas humanas es limitada: cerca del 90% de los aislamientos humanos realizados antes de la introducción de las vacunas corresponden a los tipos G1, G2, G3, G4 y G9 que se combinan preferencialmente con los tipos P1A[8] (G1, G3, G4, G9) o con P1B[4] (G2) 10. En conclusión, el grupo de trabajo de la clasificación de rotavirus recomienda la siguiente nomenclatura: primero, el serotipo/genotipo G, “X” si es desconocido, seguido del serotipo P, y finalmente el genotipo P enmarcado en corchetes 54. Las asociaciones más comunes en humanos son G1P1A[8], G2P1B[4], G3P1A[8], G4P1A[8] y G9P1A[8] 10, 19
.
Replicación de los rotavirus
Los rotavirus tienen un tropismo natural por los enterocitos maduros localizados en las extremos de la vellosidades intestinales, lo que sugiere que este tipo de células son las que poseen los receptores específicos del virus. Sin embargo, con el descubrimiento de que el virus se puede diseminar extraintestinalmente, se sospecha que el rango de células huésped es mucho más amplio del que se consideraba inicialmente 53(Figura 2).
19
α4β1 57. Los pasos de reconocimiento inicial ocurren dentro de microdominios de las membranas enriquecidos en colesterol y esfingolípidos llamados raft lipídicos. La penetración del virus es un proceso complejo que aún no se ha entendido completamente, puede ser mediado por la penetración directa de membrana o por endocitosis, además está constituido por varios pasos que envuelven una serie de cambios a nivel de las proteínas de la cápside. Los resultados muestran que las bajas concentraciones de Ca++ en los endosomas son los principales responsables del desnudamiento del virus, que ocurre por desacoplamiento de las proteínas de la capa externa, permitiendo que las partículas virales de doble capa (DLPs) entren al citoplasma. Para que la capa externa se desacople más rápidamente, los viriones debe haber sido activados con tripsina, que fracciona la proteína VP4 en dos, generando las proteínas VP5 y VP8; los estudios han mostrado que los virus no activados con tripsina tardan entre 30-50 minutos para penetrar la células, mientras que los virus activados lo hacen en tan solo 4-5 minutos.
El proceso de transcripción es mediado por una ARN polimerasa dependiente de ARN que hace parte de un complejo de transcripción formado por las proteínas VP1 y VP3 localizado al interior de la capa de VP2, por lo tanto, el proceso de transcripción ocurre dentro de las DLPs intactas estructuralmente. Los nuevos ARNs transcritos salen de las DLPs a través de los canales de tipo I formados en la estructura de la capa de VP2. Las proteínas virales son traducidas por la maquinaria celular a partir de los mARN liberados desde las DLPs, esos mARNs tienen estructuras cap pero no son poliadenilados.
21 Epidemiología de la infección por rotavirus
Antes de la introducción de las vacunas contra rotavirus a nivel mundial, los informes mostraban que la diarrea causada por rotavirus era la principal causa de hospitalizaciones en el mundo en niños menores de 5 años 2, 3. Se determinó entonces que la infección por este virus estaba asociada con una alta mortalidad en niños menores de 5 años, además, se estimó que la infección por rotavirus cobraba la vida de cerca de 527.000 (475.000-580.000) niños anualmente, esto se traducía en aproximadamente 1.440 muertes por rotavirus diariamente 2, 3. La infección por rotavirus se encuentra distribuida en todo el mundo y los datos recolectados indican que las tasas de infección son similares en los países desarrollados y en vías de desarrollo, sin embargo, la mortalidad es diferente. India concentra la mayor cantidad de muertes relacionadas con la infección por rotavirus con cerca de un 25% de todos los casos a nivel mundial; seis países (China, Nigeria, Pakistán, Congo, Etiopia e India) suman más del 50% de los casos fatales a nivel mundial 2. En los Estados Unidos, norovirus ha superado a rotavirus como la mayor causa de gastroenteritis luego de la implementación de los programas de vacunación 58. Sin embargo, rotavirus sigue siendo el agente etiológico más importante de la gastroenteritis severa en países en vías de desarrollo que no tienen implementado el programa de vacunación contra rotavirus 59. En Colombia, aproximadamente 1.300 niños menores de un año mueren anualmente debido a gastroenteritis agudas, representando el 10% de las muertes totales en este grupo de edad 5. En Colombia un estudio de 2004 mostró que en las ciudades de Bogotá, Barranquilla y Cali las infecciones por rotavirus causaban el 50% de las diarreas y que eran el motivo de 16 hospitalizaciones por cada 1.000 niños y de 1 muerte por cada 2.000 niños. Los genotipos asociados con las infecciones fueron G3P8 (32,7%), G2P4 (21,1%), G1P8 (19,1%) y mixtos (8,5%) 60. En Bogotá, los genotipos más frecuentemente encontrados fueron G1P8 (36,9%), G3P8 (29,2%) y G2P4 (16,9%) 60
. Recientemente, se estimó que sin vacunación el número anual de visitas médicas y muertes relacionadas con la infección por rotavirus en niños colombianos menores de 2 años fue de 105.378 y 470 (IC 95% 295-560), respectivamente 5.
La transmisión del virus depende de la zona geográfica en consideración. En zonas tropicales hay un patrón de infección constante, sin embargo, se ven ligeros aumentos de casos en los meses más fríos. En zonas con estaciones las tasas de infección son más altas en el otoño y el invierno; en Estados unidos la dinámica espaciotemporal del la infección por rotavirus se inicia en el sureste al final del otoño y termina en el noreste tres meses después, es de anotar que la implementación de la vacunación ha cambiado estos patrones impactando la dinámica de las epidemias de rotavirus 61, 62.
localización. De acuerdo con los estudios, las cepas más frecuentes a nivel mundial son G1P1A[8], G2P1B[4], G3P1A[8], G4P1A[8] y G9P1A[8], que representan más del 90% de los aislamientos 63. En algunas regiones geográficas de India, Brasil y África las cepas G9P[6], G5 y G8, respectivamente, son más prevalentes que en otras regiones del mundo 64. En África existe una gran variabilidad de cepas circulantes con combinaciones poco comunes de genes G y P, se sospecha que algunas cepas son de origen zoonótico 65.
La transmisión del rotavirus ocurre principalmente por la vía oro-fecal o por el tracto respiratorio, por contacto persona a persona o la manipulación de objetos o superficies contaminadas. En las heces de los pacientes infectados se excreta el virus infecciosos en altas concentraciones incluso dos días antes del inicio de la diarrea y hasta 10 días después del inicio de la misma. El inoculo para producir una infección en un huésped homologo es muy bajo de 10 o menos partículas virales. A pesar de que la infección sucede en otros animales, es muy baja la probabilidad de una transmisión animal-humano, debido a la restricción de especie, por lo tanto los animales no son considerados reservorios de las cepas de rotavirus humanas 50.
Las vacunas contra rotavirus
En 1998 la FDA aprobó para su uso en Estados Unidos la vacuna Rotashield®, en octubre de ese mismo año se inició la aplicación de esta vacuna con algunas advertencias relacionadas con el desarrollo de invaginación intestinal 6. Un año después del inicio del programa, la vacunación fue suspendida debido a un elevado número de casos de invaginación intestinal relacionados con el uso del biológico 6. El retiro de Rotashield® del mercado condujo a la industria farmacéutica a trabajar en el desarrollo de nuevas vacunas más seguras contra rotavirus 10.
Después de la experiencia de Rotashield®, en el año 2006 se dio inicio a una nueva etapa de las vacunas contra rotavirus con la aprobación de la vacuna Rotarix® (GlaxoSmithKline®) (Figura 3) inicialmente en México, seguida por su introducción en otros países latinoamericanos y europeos 10. Dos años después fue introducida en el mercado la vacuna RotaTeq® (Merck) 10, 66(Figura 3). Rotarix® es una vacuna monovalente obtenida a partir de la atenuación por pases consecutivos de la cepa humana 89-12 67, mientras que RotaTeq® es una vacuna pentavalente construida teniendo como base la cepa bovina WC3 combinada con genes que codifican para las proteínas VP4 y VP7 humanas 68, 69. Las dos vacunas contra rotavirus demostraron ser seguras y ofrecer una muy buena protección contra los casos de enfermedad severa en países europeos y latinoamericanos (85%-98%), donde se realizaron los estudios piloto 67, 70.
23
con alto y mediano nivel socioeconómico de América, Europa y Australia 66. Sin embargo, el uso de vacunas orales como las vacunas contra polio, cólera y fiebre tifoidea en países con bajo nivel socioeconómico no han mostrado resultados comparables a los observados en países con alto y mediano nivel socioeconómico, por eso la OMS recomendó que fueran llevados a cabo estudios en países con bajo nivel socioeconómico para poder hacer la recomendación de uso universal de estas vacunas 66. Los resultados de los estudios realizados en países con un nivel económico mediano, como Brasil y México, mostraron impactos destacables al usar las vacunas. En México, los índices de mortalidad por diarreas severas han disminuido en un 39% 71, 72, mientras que en Brasil los reportes señalan una disminución de 22% y 28% 73. En países con bajo nivel económico los reportes son menos alentadores, para Rotarix® los estudios realizados en Suráfrica y Malawi mostraron eficacia de 76% y 49%, respectivamente 74. En el caso de RotaTeq® estudios realizados en 5 países de África y Asia mostraron en promedio una eficacia de 64%75, 76. A pesar de esto, se determinó que hubo un beneficio importante porque se protegieron las vidas de los niños, por lo tanto la OMS recomendó la inmunización de los niños de forma universal 66. Para 2008, una serie de estudios llevados a cabo por hospitales a nivel individual alrededor de los Estados Unidos documentaron una marcada disminución de los casos de diarrea, hospitalizaciones y visitas a las salas de urgencia ocasionadas por la infección por rotavirus en niños menores de 2 y 3 años en la temporada de rotavirus 66, 77, 78. Incluso, reportes más recientes hablan de una disminución de los casos de rotavirus tan dramática que norovirus se proyecta como la causa más común de gastroenteritis viral aguda en niños norteamericanos menores de 5 años 58, 79. Aún más, los programas de vacunación sugirieron que la vacunación estaba fomentando un efecto rebaño que también estaba protegiendo a los niños no vacunados y a los adultos 66, 80
Figura 3. Esquema de las cepas componentes de las vacunas Rotarix® y
RotaTeq®. Rotarix es una vacuna monovalente derivada de una cepa humana
[image:23.612.108.552.499.635.2]Enfermedad causada por los rotavirus
La infección por rotavirus se adquiere por contacto persona a persona por transmisión oro-fecal. Luego que el virus es ingerido las partículas virales infecciosas se dirigen hacia el intestino delgado donde infecta los enterocitos maduros. Posteriormente, las nuevas partículas virales se dirigen hacia regiones más lejanas del intestino o terminan siendo excretadas en las heces 81. Durante la infección se ha estimado que los niños excretan entre 1010 y 1011 partículas virales. Las infecciones por rotavirus en los niños tienen manifestaciones clínicas claramente definidas: la mayoría de los casos de primoinfección se presentan entre las edades de 6 meses a 24 meses y los síntomas son fiebre y vómito durante 2 a 3 días, seguidos de diarrea sin sangre pero abundante y profusa, lo que conduce a los pacientes a sufrir deshidratación grave con riesgo de muerte en muchos de los casos 81. Las manifestaciones clínicas de las reinfecciones suelen ser menos graves en estos pacientes. A diferencia de lo que sucede en niños, los adultos presentan síntomas más difíciles de identificar, por lo que es muy difícil establecer un patrón de síntomas tras la infección por el virus, pero suelen presentar diarrea, vómito, dolor de cabeza y cólicos 81.
La deshidratación severa y la alteración de los niveles de electrolitos son las consecuencias más serias que ocurren durante la infección por rotavirus y los infantes son los que las sufren de forma más frecuente 82. Estas manifestaciones clínicas son responsables de la mayoría de los casos mortales especialmente en condiciones donde el acceso al tratamiento médico es deficiente.
Los hallazgos histopatológicos relacionados con la infección por rotavirus están restringidos al intestino delgado y se caracterizan por acortamiento y atrofia de las vellosidades, aumento de la profundidad de las criptas, aplastamiento de las células epiteliales e incremento del número de células inflamatorias en la lámina propia 82.
25 Poblaciones de los linfocitos T
Las células T ejercen su papel en la respuesta inmune a través de varios mecanismos, de hecho, actualmente se estima que el desarrollo de vacunas eficaces contra patógenos como la malaria o el VIH requieren de la generación de una respuesta T potente y durable, por lo tanto, una evaluación adecuada de la complejidad de la respuesta de las células T es necesaria 42. La adquisición de la experiencia antigénica por parte de las células T está marcada por la generación y la persistencia de las células T, que ofrecen protección contra los patógenos de por vida 83.
Las células T de memoria se pueden distinguir de forma clásica por medio de la expresión de la isoforma CD45RO y la pérdida de la expresión de la isoforma CD45RA 84, 85. Pero, la definición de las diferentes poblaciones de células T requiere de la determinación de otros marcadores celulares, como la quimiocina CCR7. Mediante la determinación de ambos marcadores se logró establecer que las células vírgenes expresan el CCR7, mostrando su predilección por los órganos linfoides, mientras que las células de memoria pueden ser divididas en dos diferentes poblaciones: CD45RA-CCR7+ que corresponden a las células T de memoria central (TCM) con capacidad de migrar hacia los tejidos linfoides, y las CD45RA-CCR7- que son células de memoria efectora (TEM) que pueden migrar hacia múltiples tejidos 48, 86. La expresión de otros marcadores superficiales como CD95 (FAS) y CD122 (IL-2Rβ), recientemente descritos en el contexto de células T vírgenes, determina la presencia de otra población de células de memoria llamadas células T de memoria “Stem” (TSCM). Tanto en humanos 87 como en ratones 88, este tipo de células tiene una alta capacidad de proliferación, son multipotenciales y se autorenuevan, incluso pueden diferenciarse en otras poblaciones como TCM y TEM 87
.
Tejido linfoide asociado al tracto gastrointestinal (GALT, por sus siglas en inglés)
El sistema inmune intestinal se puede dividir en dos importantes compartimientos: el inductivo y el efector. El compartimiento inductivo incluye todos los tejidos del GALT, en los que encontramos placas de Peyer (PP), los folículos linfoides aislados (ILF) y los nódulos linfoides mesentéricos (NLM), en contraste, los compartimientos efectores están formados por la lámina propia y el epitelio intestinal, que se caracterizan por contener altas cantidades de células T activadas y células plasmáticas secretoras de anticuerpos 95, 96.
El tracto gastrointestinal es la mayor puerta de entrada de numerosos patógenos, a pesar de estar protegido por barreras físicas y biológicas 97. Las barreras físicas están formadas principalmente por células epiteliales unidas de forma muy firme por proteínas de unión, las microvellosidades y una capa densa de mucina 97. Adicionalmente, los péptidos antimicrobianos como las defensinas también hacen parte de este sistema de barreras encargadas de evitar la entrada de patógenos al organismo 98. También, el tracto gastrointestinal incluye diferentes tipos de células del sistema inmune, como linfocitos, macrófagos y células dendríticas (CD) que se organizan en estructuras definidas en los tejidos, donde se destacan las PP y los ILF, o que se encuentran dispersas dentro del epitelio y la lámina propia 97.
Las PP son los tejidos linfoides asociados al sistema inmune gastrointestinal mejor organizados del tracto gastrointestinal. En los humanos hay cientos localizados en el recorrido del intestino delgado, mientras que en el ratón solamente hay entre 8 y 10 de ellos 99. La organización de las PP es muy similar a la de otros órganos linfoides secundarios, pero, hay características que los distinguen; por ejemplo, no tienen linfáticos aferentes, por lo que las PP están cubiertas por una región epitelial denominada epitelio asociado al folículo, que contiene un grupo de células especializadas llamadas células M, encargadas de transferir antígenos desde el lumen intestinal hacia las PP 100. La región subepitelial es rica en CD, que se encargan de tomar los antígenos transferidos por las células M, para procesarlos y presentarlos a las células T y B localizadas en las mucosas 101. Pero estas CD no sólo están encargadas de presentación de antígenos, ellas expresan la enzima retinaldehído deshidrogenasa, encargada de convertir la vitamina A en ácido retinóico 102, 103. El ácido retinóico induce la expresión de los marcadores α4β7 y CCR9 en las células T y B activadas, promoviendo el retorno de ellas a la lámina propia del intestino delgado 102, 103.
27
productoras de IL-10 y FoxP3+ 97. Los ILF están formados por un folículo único que está compuesto de forma predominante por células B y algunas CD recubiertas por un domo rico en células M 104, pero no contienen células T, indicando que los ILF son sitios de producción de IgA T independiente 105.
Existe un número considerable de literatura que evidencia que las PP y los ILF son críticos para el reconocimiento inmune de antígenos derivados de bacterias y virus 96, hecho que refleja la actividad de las células M que transportan activamente material desde el lumen de hacia los compartimientos del GALT, especialmente hacia PP y los ILF 100. De otro lado, se considera que el NLM es el compartimiento crucial en la inducción de la tolerancia oral 96, 106. Las CD locales y migratorias CD103+ son muy importantes en la generación de un ambiente tolerogénico en el NLM. Estas células procesan los antígenos en el lumen del intestino y posteriormente los presentan en el NLM, específicamente, no tienen la capacidad de llegar hasta el torrente sanguíneo ni de migrar hacia otros órganos linfoides 101. Estas CD CD103+ de las lámina propia y de los NLM tiene la capacidad de inducir la expresión de marcadores de migración intestinal CCR9 y α4β7 en las células T 107 y, además, también son fuertes inductoras de la expresión de la moléculas FoxP3 en los T reguladores (Tregs) 108. Estas dos actividades están ligadas a la capacidad de las CD103+ de producir ácido retinóico a partir de la degradación de la vitamina A, la sola presencia de éste induce la expresión de los marcadores de migración intestinal 102, y simultáneamente actúa como cofactor en la conversión de células T vírgenes en Tregs, junto con el TGF-β 109. Las características especiales de estas CD103+ intestinales no son compartidas por las CD103+ de otros tejidos y parecen ser condicionadas directamente por el ambiente intestinal 110.
El tráfico de las células T hacia el intestino
las PP hacia los NLM, de esta forma los antígenos tomados en el epitelio intestinal son transportados hacia el NLM, donde ocurre la tolerización 115. De otro lado, las PP son claves en la respuesta inmune, translocando los antígenos bacterianos y alimentarios desde el lumen intestinal hacia la lámina propia, pero, no es claro su papel en el desarrollo de la tolerancia oral, aunque si juegan un papel importante en la translocación y la respuesta contra los agentes patógenos que aprovechan las fisiología de las PP para invadir el organismo gracias a sus factores de virulencia 116. Cuando la relación entre la microbiota y la respuesta inmune se afecta o en presencia de agentes patógenos se ocasiona un desequilibrio que conduce al desarrollo de una respuesta inmune que causa una enfermedad.
Las moléculas de adhesión, en combinación con compuestos quimioatrayentes de leucocitos, dirigen el tráfico de las células del sistema inmune y regulan las interacciones entre las células durante los procesos de inflamación e inmunidad. Combinaciones específicas de receptores dirigen los linfocitos a sitios anatómicos particulares como la piel, el intestino delgado, nódulos linfáticos periféricos, los tejidos linfoides asociados al tracto respiratorio e intestinal, incluidas las PP 31, 33. Los estudios han mostrado que la inducción de las características de migración hacia el intestino delgado de los linfocitos está regulada por la presencia de ácido retinoico que es procesado y presentado a partir de la vitamina A por las CD intestinales. La presencia de este compuesto induce en las células T la expresión de los receptores intestinales α4β7 y CCR9, mientras suprime la expresión de ligandos asociados con la migración hacia la piel, como el CLA en humanos 102. Para organizar una respuesta inmune protectora contra los patógenos intestinales, los linfocitos T vírgenes intravasculares deben llegar a los órganos linfoides del intestino que son las PP, ILF y los NLM. Las células T vírgenes que llegan a estos sitios de inducción son activadas y posteriormente abandonan los tejidos linfoides a través de los vasos linfáticos eferentes, entran a la circulación sistémica y retornan nuevamente al tejido intestinal donde ayudan a eliminar los patógenos 117.
Las CD encargadas de presentar los antígenos a las células T vírgenes migran desde la lámina propia y las PP hacia los NLM, lo que sugiere que estos nódulos son el principal sitio de activación de las células T vírgenes 118, 119.
El tráfico de las células T hacia el tejido intestinal es un proceso complejo dividido en tres pasos principales de adhesión y señalización; el primero es el reconocimiento de los receptores en las células endoteliales, seguido por el “arrastre” de las células en la superficie del endotelio y finalmente la adhesión firme de los linfocitos al endotelio 117.
29
especializadas 120, 121. Las VEA asociadas con las PP expresan MAdCAM-1, mientras que las asociadas con los NLM expresan MAdCAM-1 y PNAd 117, 120. Los linfocitos vírgenes expresan L-Selectina (CD62L) a través de las cual reconocen los marcadores MAdCAM-1 y PNAd presentes en las vénulas y son retenidos para posteriormente iniciar el proceso de “arrastre”. Las interacciones entre MAdCAM-1/CD62L y PNAd/CD62L son las más eficientes para reclutar células T vírgenes a los NLM, no obstante, las interacciones entre las moléculas MAdCAM-1/α4β7 son también importantes, especialmente en el reclutamientos de los linfocitos T en las PP 117, 120. Luego de este primer reconocimiento se presenta la interacción entre el CCR7 de las células T vírgenes con los receptores CCL21 y/o CCL19 presentes en las membranas de las células especializadas de las VEA. Finalmente, estas interacciones activan a LFA-1 y a α4β7 en las células vírgenes, permitiendo la adhesión de éstas a las moléculas ICAM-1 y MAdCAM-1, respectivamente. Estas interacciones promueven la adhesión firme de las células vírgenes al endotelio y posteriormente éstas migran hacia el interior de las PP y los NLM 117, 120.
En presencia de agentes patógenos las células T vírgenes localizadas en los NLM y las PP entran en contacto con las CD activadas que les presentan los antígenos en el contexto de las MHC II. Aquellas células que reconozcan el antígeno inician el proceso de activación que lleva a las células a proliferar, perder la expresión de CD62L e incrementar la expresión de las moléculas específicas de tráfico intestinal, α4β7 y CCR9, además, también incrementan la expresión de LFA-1, α4β1 y CD44 117, 120
.
Posterior al proceso de activación las células T vuelven al torrente sanguíneo abandonando los NLM y las PP por las vénulas eferentes. Las células activadas tiene un patrón de migración diferente al de las células vírgenes, este se caracteriza por la interacción entre α4β7/MAdCAM-1 y CCR9/CCL25. Adicionalmente, las interacciones entre PSGL-1, LFA-1, α4β1 y CD44 con los receptores localizados en las VEA: P/E-selectina, ICAM-1 e ICAM-2, VCAM-1 e hialuronato, respectivamente, también son importantes 117, 120.
IL-18 y TNF-α junto con reactivos de oxígeno y metabolitos del nitrógeno 117. Las interacciones que se establecen durante este proceso terminan con la producción de mediadores de inflamación que reclutan y activan un mayor número de poblaciones de linfocitos en el tejido intestinal, induciendo inflamación.
Respuesta inmune al rotavirus
La respuesta inmune en los modelos animales
Los estudios realizados en modelos animales han sido muy útiles para mejorar el entendimiento acerca de la inmunidad frente a las infecciones por rotavirus 10. Los hallazgos en el modelo murino han mostrado que los anticuerpos secretores de tipo IgA son esenciales en la protección contra las reinfecciones, además, que las células T CD4 juegan un papel muy importante en la producción de cerca del 90% este tipo de inmunoglobulinas, pero aparentemente no tienen un efecto antiviral directo, mientras que las células TCR γ/δ no tienen ninguna influencia en la protección contra la infección de rotavirus 18. De otro lado, los linfocitos T CD8 de los ratones tienen un rol importante en la eliminación del virus a través de un efecto antiviral directo y son importantes en la inmunidad contra las reinfecciones virales; aunque, al parecer, el principal mecanismo antiviral protector está dado por los anticuerpos específicos contra rotavirus 18, 122, 123.
31
después de la infección y que luego caen muy rápidamente, que la respuesta frente a VP6 es predominantemente intestinal, mientras que para VP7 es más sistémica y finalmente que los animales lactantes y los adultos reconocen epítopes similares 22. Los estudios acerca de la producción de citocinas realizados en ratones han mostrado que existen diferencias en los perfiles de producción de citocinas cuando se comparan ratones adultos con ratones lactantes. En los ratones lactantes posterior a un reto con rotavirus homólogos y heterólogos mostró un perfil mixto entre Th1-Th2 129, mientras que los ratones adultos infectados con cepas homólogas y heterólogas presentan un perfil de secreción de citocinas Th1 130. Un estudio donde se evalúa la respuesta de las células T obtenidas de ratones lactantes de las cepa C57BL/6 de 5 días de nacidos mostró que la respuesta a la infección por un virus homologo (EC) en bazo, NLM, e hígado es similar a la observada en ratones adultos, sin embargo, la cinética y la calidad de la respuesta es significativamente menor en los ratones lactantes que en los adultos 22. En otro estudio, donde se compara la respuesta de las células T entre ratones adultos y lactantes, buscaba evaluar la respuesta a un rotavirus homólogo (EDIM), luego de una vacunación con una dosis de intranasal de una E. coli transgénica que expresaba la proteína VP6 de rotavirus, los resultados mostraron que los animales lactantes no estaban protegidos después de 10 días post-infección (dpi) y no tenían células CD4 ni CD8. Sin embargo, a los 28 y 42 dpi estos animales se encontraban protegidos y se detectaron células T de memoria específicas de rotavirus, pero no se desarrollaron anticuerpos. Por el contrario, los animales adultos tratados de igual forma estaban completamente protegidos 10 dpi y se observaron niveles de anticuerpos IgG y células T de memoria 131.
IgA a nivel intestinal y protección contra la infección 135. Usando cerdos gnotobióticos infectados con una cepa humana virulenta o vacunados con una cepa atenuada o partículas virales vacías (VLPs), se logró determinar que la protección contra el reto viral esta correlacionada con la presencia de células T intestinales productoras de IFN-γ 136. El modelo porcino también ha sido usado para evaluar preparaciones candidatas a vacunas, recientemente, un estudio mostró que luego de la administración de tres dosis de la vacuna derivada de la atenuación de una cepa humana CDC-9, solubilizada en fosfato de aluminio, indujo títulos de anticuerpos IgG, actividad neutralizante en suero y protección contra la excreción del virus frente al reto con una cepa virulenta Wa 137.
A diferencia de los resultados obtenidos en el modelo de ratón con las células T γ/δ, en el modelo de cerdos gnotobióticos, se ha observado que los linfocitos T CD2+CD8- y CD2-CD8- γ/δ en intestino tienen una función pro-inflamatoria ya sea produciendo IFN-γ o induciendo a las células CD4 α/β a proliferar y producir IFN-γ, mientras que los linfocitos T CD2+CD8+ γ/δ tienen una función reguladora mediante la translocación de FoxP3la, producción de IL-10 y TGF-β directamente o estimulando a las CD4 α/β a que los produzcan 138.
En modelos de primates no humanos, se han identificado dos péptidos derivados de una cepa humana de rotavirus. Los péptidos corresponden a los fragmentos de la proteína VP6 (301-315) asociado con la producción de IFN-γ, y un péptido de mayor tamaño VP6 (293-327) que está relacionado con la producción de TNF-α 26.
La respuesta de células T específicas de rotavirus en humanos
33
CD3+CD4+CD8-, presumiblemente células T ayudadoras 44. Posteriormente, se evaluó la respuesta de células T en niños y en adultos de forma simultánea 43, los resultados de esos estudios mostraron que la mayoría de los adultos sanos y los niños convalecientes de una infección por rotavirus presentan células T específicas del virus circulantes, que proliferan cuando se realizan ensayos in vitro. Además, se observó que las células de los niños menores de 2 años mostraban respuesta de proliferación para al menos una de tres de las cepas analizadas en el estudio, y que el número de serotipos reconocidos aumentaba con el incremento de la edad 43
. Un año después, el mismo grupo, usando una cohorte de 8 niños menores de 2 años infectados por rotavirus, a los que les evalúo la respuesta humoral y celular en el momento de la infección, 2-5 semanas y 3-5 meses después, mostró, por primera vez, que la respuesta de células T CD4 frente a los estímulos de las cepas de rotavirus humana w179 (P1G1) y HCR3a (P no humano, G3) aumentaba luego de la primoinfección 140. Otro grupo observó respuesta de proliferación al estímulo con la proteína recombinante NSP4 en 4 de 10 adultos sanos 141. Evaluando la respuesta proliferativa de las células de niños sin gastroenteritis entre 3 y 7 años frente al rotavirus, se observó que esta respuesta es transitoria y solamente estaba presente en el 35% de la población estudiada 45, 46. Adicionalmente, cuando se estimularon células de sangre periférica de estos individuos con rotavirus se detectaron aumentos en el ARNm para IFN-γ e IL-10 y TGF-β 46. Los resultados de estos estudios son compatibles con los que se hicieron con sueros de niños infectados de manera aguda en los que se observó un incremento en suero de IFN-γ, IL-10 e IL-6 142.
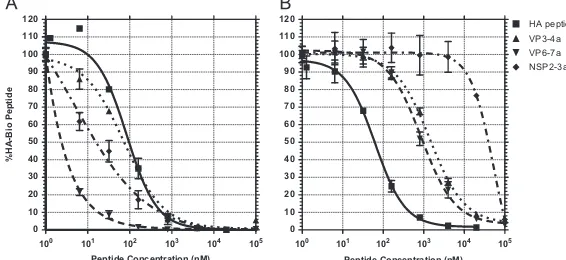
Los hallazgos de laboratorio han mostrado que la frecuencia de células T circulantes específicas de rotavirus en adultos son similares a las virus de mucosas respiratorias 40. Las células TCD8+ y TCD4+ específicas de rotavirus de adultos sanos producen IFN-γ pero no producen IL-13 41, IL-4 38, IL-2, IL-6 o IL-10 47. Mayores porcentajes de células T secretando IFN-γ fueron detectados en adultos sintomáticos infectados por rotavirus, pero las frecuencias son bajas en comparación con el porcentaje de células observadas en infecciones por CMV o EBV. Las frecuencias de células secretoras de IFN-γ, IL-13, IL-4, IL-2, IL-10 o IL17 en niños sintomáticos infectados por rotavirus son comparativamente muy bajas o indetectables (por debajo del límite de detección del ensayo) 38, 40, 41. Otros estudios basados en el uso de la técnica de ELISPOT con células de adultos sanos demostraron que cerca del 90% de los individuos presentaban una respuesta de memoria a los antígenos de rotavirus, además, que era posible predecir la respuesta frente a VP6 143, resultados que sugieren que VP6 puede ser un blanco importante en la respuesta contra rotavirus en humanos.
comparación con las CMSP de adultos sanos no depletadas de CD25 40. El mismo efecto se observó cuando las CMSP de los adultos sanos fueron tratadas con el inhibidor natural de TGF-β, la molécula LAP, o con el inhibidor de la vía de señalización del TGF-β, la molécula ALK5, sugiriendo que la actividad reguladora puede estar mediada por el TGF-β40.
Hasta el momento se han identificado pocos epítopes reconocidos por LT humanos específicos de RV. En el 2006 se describió un péptido de Clase I derivado de la proteína VP6, ligado a la presentación por moléculas HLA-A*0201 28 mientras que para el 2009, usando inmunogenética reversa, se describió otro epítope citotóxico de VP7 restringido a las moléculas de clase I HLA-A2.1 27. En algunos casos los epítopes de rotavirus se han asociado con el desarrollo de diabetes tipo 1 144, 145. Recientemente se ha mostrado que algunos péptidos derivados de la proteína VP7 de rotavirus en pacientes con HLA-DR4 muestran una similitud con los péptidos propios IA2 y GAD65, específicos de los islotes de células β en el páncreas, además se observó que líneas derivadas de estos péptidos de rotavirus proliferan en presencia de los péptidos propios en el contexto de las moléculas HLA-DR4 144. Últimamente, usando una metodología combinada entre la marcación con tetrámeros y citometría de masas, se identificaron seis epítopes de rotavirus restringidos a las moléculas de clase I HLA A 0201 en sangre de individuos sanos 146
. Aún más allá, los autores observaron que las células específicas de los péptidos derivados de la proteína VP3 de rotavirus expresaban marcadores de células en estadios de diferenciación mayores en comparación con las células específicas derivadas de los epítopes de otras proteínas, además se observó una disminución de la expresión del marcador de migración intestinal β7, mientras que las células de los demás epítopes expresan mayoritariamente marcadores intestinales 146. En modelo de ratón se ha identificado un péptido de clase II derivado de la proteína VP6 24, mientras que en monos Rhesus también ha sido identificado un péptido de células T CD4 derivado de la misma proteína 26.
35
Los estudios que han evaluado la respuesta proliferativa de las células T CD4 específicas de rotavirus 39 y de las que secretan IFN-γ 38 han mostrado que dichas células expresan en su mayoría el marcador de migración intestinal α4β7, soportando la hipótesis de que fueron estimuladas en el intestino 38. Para el caso de las células T CD8 específicas de rotavirus se ha observado que la transferencia de células efectoras α4β7+ generadas en ratones infectados a ratones Rag-2 (deficientes de células T y B) infectados con rotavirus de forma crónica, mostraron ser altamente eficientes en la eliminación de la infección del virus 149.
En conclusión, la respuesta en sangre de LT específicos de rotavirus comparte muchas de las características descritas para estas células en ratones. Son células que se encuentran en bajas frecuencias pero que proliferan cuando se estimulan con el antígenos de rotavirus. En adultos las múltiples exposiciones al virus ayudan a fortalecer la respuesta contra el virus y el patrón de secreción de citocinas es de tipo TH1, mientras que en niños es difícil de establecer 40, 41; además, la mayoría de las células presentan un perfil de migración intestinal representado por la expresión de α4β7 38, 39, 149.
Inmunidad Innata contra la infección por rotavirus
Los resultados de diferentes investigaciones muestran que la respuesta inmune innata es muy importante como la primera línea de defensa limitando la replicación y la enfermedad en las infecciones por rotavirus 16, 150-153. En otros modelos virales la respuesta inmune innata juega un papel clave en la intensidad y la duración de la respuesta inmune adaptativa 154, 155. Por estas razones es crucial evaluar el papel de la respuesta inmune innata en la infección por rotavirus para poder entender la patogénesis y cómo se desarrolla una respuesta inmune efectiva 156.
La inducción de IFN-I e IFN-III sucede cuando componentes virales son reconocidos por las células infectadas, en una gran mayoría de los casos el componente viral reconocido de forma habitual es el ácido nucleico que incluye ARN en diferentes formas 157. Dependiendo del origen, localización celular y las modificaciones químicas, el ARN viral puede ser detectado por varias proteínas que incluyen RIG-I, MDA-5 y las moléculas TLR3, TLR7 y TLR8. El reconocimiento de los ligandos a través de estás proteínas estimula la activación de intermediarios que finalmente terminan con la expresión de las moléculas de IFN-I e IFN-III. RIG-I y MDA-5 estimulan la producción de IFN a través de la señalización de las proteínas mitocondriales MAVS e IPS-1 que llevan a la activación de IRF3/7, mientras que TLR3 lo hace por medio de TRIF y TLR7 y 8 estimulando a MyD88 que terminan por activar las proteínas de señalización IRF 157.
epiteliales es una actividad complementaria de las actividades de RIG-I y MDA-5 en los modelos de infección por rotavirus 150, 158, 159. En modelos de ratones adultos deficientes de proteínas mitocondriales MAVS se ha observado que la replicación de cepas heterólogas RRV y SA11 (rotavirus de simios) es significativamente mayor si se compara con la replicación en animales normales 150. Por otro lado, la llave TLR3-TRIF no parece tener ningún efecto en la inducción de IFN-β, debido a que ratones deficientes de TLR3 no mostraron ninguna diferencia en la excreción del virus en heces comparándolos con ratones normales infectados con la cepa SA11, ni tampoco se observó una disminución de los niveles de ARNm del IFN-β en los animales deficientes de TLR3 150. Sin embargo, un estudio reciente mostró que la inducción de IFN-β por la actividad de TLR3-TRIF se presentaba en ratones adultos pero no en infantes durante la infección por la cepa homóloga EDIM, consistente con el aumento de TLR3 y la edad de los animales 152. Hasta el momento no se conoce por qué se observan diferencias en estos dos trabajos, sin embargo, se sospecha que puede ser debida al potencial de replicación de las cepas usadas, EDIM es una cepa homóloga con alta capacidad de replicación en los ratones, mientras que RRV y SA11 son cepas heterólogas con una menor capacidad de replicación en el modelo 156.
Rotavirus ha desarrollado una estrategia para limitar la expresión de IFN-I en las células infectadas a través de la proteína NSP1, que tiene la habilidad de unirse a IRF3, IRF5 e IRF7 y mediar su degradación por el proteasoma 160, 161. La habilidad de la proteína NSP1 de rotavirus de disminuir la expresión de IFN-I parece estar muy bien conservada entre las diferentes cepas de rotavirus, a pesar de las variantes de las moléculas de IRFs 162. La inhibición está relacionada con la cepa viral y el tipo de célula; por ejemplo, algunos rotavirus animales degradan IRF3, IRF5 e IRF7, mientras que las cepas humanas degradan de forma predominante IRF5 e IRF7, lo que podría estar relacionado con una menor eficiencia en la inhibición de la respuesta de IFN 162. Sin embargo, la inhibición de la producción de IFN no es suficiente para que evada la respuesta inmune innata; por ejemplo, la infección de la línea HT-29 con RRV, un virus que reconoce de forma eficiente IRF3 e IRF7, induce niveles sustanciales de IFN-I 163. Como otros virus, rotavirus es capaz de reducir el efecto de IFN inhibiendo la señalización del mismo IFN 164, este fenómeno ocurre por mecanismos desconocidos que evitan la acumulación nuclear de STAT1 y STAT2 165, y puede estar potenciando la inhibición de IFN en diferentes niveles.
37
Los primeros estudios que evaluaban la producción de citocinas luego de la infección por rotavirus usaron modelos con células epiteliales teniendo en cuenta que esta es la célula blanco primaria de la infección por rotavirus. En líneas HT-29, se observó una producción elevada de IL-8 167, que es un potente quimioatrayente de neutrófilos y aunque en modelos de cabras y pájaros se observó infiltrado de neutrófilos en el intestino, aún no es claro el papel que desempeñan estas células en la infección por rotavirus 156. A diferencia de los hallazgos en células HT-29, los estudios realizados con células Caco-2 no mostraron niveles incrementados de IL-8 durante la infección por rotavirus 168, 169.
La expresión de muchas de las citocinas es dependiente de la activación del factor transcripcional NF-κB luego de que la células detecta la presencia del virus. Además de IL-8, otras citocinas han sido detectadas en líneas de células epiteliales y en intestinos de ratón luego de la infección por rotavirus, algunas de ellas son RANTES, GM-CSF, GRO-α, MIP-1β, e IP-10 168, 170, Sin embargo, a pesar de que muchas de estas citocinas son importantes en la atracción de otras células del sistema inmune su importancia individual en las infecciones por rotavirus aún está por establecerse 171. Debido a que NF-κB es importante para en la inducción de las citocinas, los virus han desarrollado estrategias para contrarrestar la actividad de esta molécula 164. En el caso de rotavirus se ha observado que algunas cepas inhiben la activación de NF-κB a través de NSP-1 inhibiendo la degradación de IκB, la molécula represora del NF-κB 172. Por ejemplo, la cepa humana Wa y la cepa bovina RRV (ésta a multiplicidades de infección altas) son eficientes en evitar la translocación de NF-κB 173, sin embargo, no se ha definido el mecanismo exacto por el cual estas cepas ejercen esta actividad antiviral, pero se sospecha que es dependiente de NSP1.
Métodos para estudiar linfocitos T
Los tetrámeros
La marcación de las células T antígeno específicas con multímeros de moléculas de MHC ha sido una de las herramientas más importantes para monitorear la respuesta inmune de las células T 29, 30. El concepto de usar ligando solubles para detectar receptores celulares es un protocolo muy útil para entender la función y la especificidad de una célula, sin embargo, solamente en los últimos 15 años este concepto ha sido aplicado en el análisis de las células T a través del uso de complejos MHC-péptido que se unen de manera específica a los TCR de las células T 30.



![Figura 3. Esquema de las cepas componentes de las vacunas Rotarix® y RotaTeq®. Rotarix es una vacuna monovalente derivada de una cepa humana P1A[8]G1 atenuada, mientras que RotaTeq es una vacuna pentavalente formada por 5 cepas bovinas (WC3) recombinada](https://thumb-us.123doks.com/thumbv2/123dok_es/4084300.23507/23.612.108.552.499.635/componentes-rotarix-rotateq-rotarix-monovalente-atenuada-pentavalente-recombinada.webp)