UNIVERSIDAD ' AUTONOMA METROPOLITANA. Unidad Iztapalapa.
NOMBRE:
MATRICULA: 89242197
LDO NADO RODRIGUEZ MA. ANGELIC A.
/LICENCIATURA EN BIOLOGÍA EXPERIMENTAL
UNIDAD
Y
DIVISIÓN:J División de Ciencias Biológicas y de la Salud.
REPORTE
RE
PROYECTO TERMINALPROYECTO:
<*DETERMINACIóN DE LA EXPRESIÓN DE LA ENZIMA a-2,3 Stasa INTRAHIPOFISIARIA DURANTE EL CICLO ESTRAL DE LA
RATA POR HIBRIDACIÓN iu Siru "
LUGAR DE REALEACION DEL PROYEnO:
Laboratorio de Endocrinología Molecular (S-338), Area Reproducción Animal Asistida, DEPARTAMENTO DE BIOLOGIA DE LA REPRODUCCIÓN. UAh4
ETAPALAPA en colaboración con el INSTITUTO NACIONAL DE LA NUTRICION, Salvador Zubirán.
PROYECTO AL QUE PERTENECE:
"REGULACION DE LA EXPRESION DEL GENE DE LA ALFA 2.3-SIALILTRANSFERASA ( u 2.3-STasa) Y SU RELACION CON LA HETEROGENEIDAD POR CARGA DE LA
HORMONA ESTIMULANTE DEL FOLICULO (FSH) EN LA RATA HEMBRA."
ASESOR
M.C.PABL0 G. DAMIAN MATZUMURA PROFESOR TiTULAR "B".
mpoCOMPLETO. ~~ ~~~~
BIOLOGIA DE LA REPRODUCCION.
DIVISION C.B.S. U.A.M. IZTAPALAPA.
, . ._. P ~. r- c c c_ ..,.” c L.. c
._.
DETERMINACIÓN DE LA EXPRESIÓN DE LA ENZIMA
a-2,3 Stasa INTRAHIPOFISIARIA DURANTE EL CICLO
ESTRAL DE LA RATA
POR
HIBRIDACIÓN inSiru
.
ANTECEDENTES
El lóbulo anterior de la hipófisis de los mamíferos secreta ocho hormonas principales, la hormona adrenocorticotrópica (ACTH
o corticotropina), la hormona del crecimiento (GH, somatotropina o
STH), la prolactina (PRL, hormona lactógena, mamotropina, hormona luteotrópica, LTH o luteotropina), la hormona estimulante de los melanocitos gamma (yMSH), la R-lipotropina (B-LPH), la hormona estimulante de la tiroides (TSH o tirotropina), la hormona luteinizante (LH, luteotropina u hormona estimulante de células intersticiales, ICSH) y la hormona estimulante de los folículos (FSH, folículo-estimulante o folitropina). Las cinco primeras son proteínas simples, mientras que las tres Últimas, junto con las gonadotropinas coriónicas humana y equina (hCG y eCG, esta última también llamada gonadotropina sérica de yegua preñada o PMSG) placentarias, son parte de una familia de glicoproteínas heterodiméricas, formadas por subunidades unidas entre sí de manera no covalente denominadas alfa (a) y beta (R); las subunidades alfa de las glicohormonas diméricas son idénticas entre sí, mientras que las subunidades beta son especie-específicas y a cada hormona le confieren la actividad biológica característica de cada una de ellas.
(6, 23, 25).
Las gonadotropinas adenohipofisiarias FSH y LH son las principales responsables de la regulación de la gametogénesis, del desarrollo y maduración de los folículos ováricos, la esteroidogénesis ovárica y el control del ciclo estral (roedores) y menstrual (humanos); así como del proceso espermatogénico y de la actividad
-.
.."
.-
I
c
. _ I
.._,
es el resultado de controles por retroalimentacion tanto positivas (estimulatoria) como negativas (inhibitoria) debido a diferentes factores, entre los que se pueden mencionar los esteroides sexuales (estrógenos, progestágenos y andrógenos), la hormona liberadora de las gonadotropinas (GnRH) y, particularmente sobre la FSH, péptidos gonadales (inhibinas, activinas y folistatina), que actúan directamente sobre los gonadotropos adenohipofisiarios, lugar donde estas gonodotropinas son sintetizadas y almacenadas en gránulos secretores (3, 20,).
La FSH, al igual que la LH y otras glicoproteínas,
experimenta un proceso de maduración inmediatamente después de
su traducción mediante la adición de oligosacáridos en su paso por el retículo endoplasmático (RE), y finalmente cuando llega al Aparato de Golgi (AG) se completa la maduración mediante la adición y remoción de carbohidratos necesarios para ser clasificada, etiquetada y enviada a sus destinos finales (28). Una de las últimas y más importantes modificaciones post-traduccionales que se lleva a cabo sobre la FSH es la que realiza la enzima a2,3-sialiltransferasa (a2,3-STasa) del AG en el gonadotropo, que adiciona resíduos de ácido siálico a los oligosacáridos terminales (Galactosa) de esta hormona peptídica; estas modificaciones en el contenido de ácido siálico a la molécula de FSH le confiriere variaciones en su
estructura molecular y, por consecuencia la creación de múltiples isoformas de la misma, con propiedades fisiológicas características para cada subpoblación de isoformas tales como vida media plasmática, capacidad de unión al receptor, actividad biológica
in
vitro
ein vivo,
además de que se piensa que estas modificaciones se encuentran reguladas hormonalmente (19).En nuestro laboratorio se han estudiado los factores endócrinos que influyen en la aparación de las diferentes isohormonas de la FSH intrahipofisiaria y sérica, y su correlación
proyecto está dirigido’a medir la expresión del RNAm de la enzima a2,3-STasa intrahipofisiaria de la rata en condiciones fisiológicas (durante el ciclo estral) con la finalidad de esablecer los mecanismos moleculares que controlan en ultima instancia la actividad de la FSH en los procesos de ovulación.
INTRODUCC
IÓNEstructura y función de
FSH.
La FSH es una glicoproteína heterodimérica de peso molecular aproximado de 30,000 daltones, la cual es sintetizada y secretada por la adenohipófisis (20). Las subunidades monoméricas interaccionan por uniones no covalentes que estabilizan la estructura terciaria de la molécula; cada subunidad contiene dos cadenas de oligosacáridos del tipo “complejo”, unidas covalentemente al grupo amino de las cadenas laterales de las asparaginas. La subunidad
a
de la FSH está constituida por 92-96 aminoácidos (dependiendo de la especie) y presentan dos sitios de N-glicosilación en los residuos de asparagina 52 ó 56 y 78 u 83 (Asn-56 y Asn-831, en la subunidad BFSH existen2 sitios más de glicosilación en Asn 6 , 7 Ó 13 y Asn 23, 24 ó 30, y
está formada por 11 1-1 12 aminoácidos. Los oligosacáridos de la FSH humana y de roedores terminan con el azúcar denominado ácido siálico, pero las FSH ovina y bovina tienen terminaciones mixtas de ácido siálico y sulfatos (15).
Múltiples formas de la FSH han sido encontradas tanto en la adenohipófisis como en la circulación, siendo atribuida esta microheterogeneidad principalmente a las variaciones en el grado de sialización (1 8).
Glicosilación.
-1 .. J
Y,
! L 1
(oligosacáridos N-ligados) a diferencia de otros oligosacáridos que, con mucho menor frecuencia, se unen a los grupos hidroxíio (-OH) de la cadena lateral de los resíduos de serina (Ser), treonina (Thr) o
hidroxilisina (OH-Lys), denominados oligosacándos O-ligados. Esta glicosilación inicial la realiza la enzima glicosiltransferasa en el
RE
yes selectiva solo para la secuencia:
H2N-Asn-[X]-(Ser/Thr)-COOH,
donde
X
es cualquier aminoácido excepto prolina, lo que le confiereuna alta especificidad a este proceso (1, 19).
Esta transferencia se lleva a cabo en el lado expuesto hacia el lúmen de la membrana del RE y se ha observado que el oligosacárido es fabricado en su totalidad antes de ser transferido al residuo de Asn
"blanco" de la proteína, todo esto en un solo paso enzimático, tan pronto como el resíduo de Asn emerge a la luz del RE. El oligosacárido debe de estar presente en el lúmen del RE en forma "activada", esto es, unido a la molécula donadora, el lípido dolicol, via un enlace de alta energía, un puente de pirofosfato. El
oligosacárido es construido monosacárido tras monosacárido sobre esta molécula lipídica unida a la membrana, por lo que es anclado fuertemente a la superficie luminal del RE donde se lleva a cabo la glicosilación. Posteriormente se continúa el procesamiento de la glicoproteína con la remoción y adición de azúcares específicos en el AG (1, 13).
La presencia de diferentes estructuras y en cantidades variables de los residuos terminales de carbohidratos en las gonadotropinas les confiere características aún más especiales, ya que una misma glicohormona puede presentar diversas formas moleculares (microheterogeneidad) que le confieren características bioquímicas y fisiológicas únicas para cada isoforma, incluyendo la vida media metabólica, la capacidad de unión a sus respectivos receptores y la actividad biológica in vitro e in vivo (13).
La
FSH
en particular presenta oligosacaridos con terminación(oligosacáridos N-ligados) a diferencia de otros oligosacáridos que, con mucho menor frecuencia, se unen a los grupos hidroxílo
(-OH)
de la cadena lateral de los resíduos de serina (Ser), treonina (Thr) o
hidroxilisina (OH-Lys), denominados oligosacáridos O-ligados. Esta glicosilación inicial la realiza la enzima glicosiltransferasa en el RE y
es selectiva solo para la secuencia:
H2N-Asn-[X]-(Ser/Thr)-COOH,
donde X es cualquier aminoácido excepto prolina, lo que le confiere una alta especificidad a este proceso (1, 19).
Esta transferencia se lleva a cabo en el lado expuesto hacia el lúmen de la membrana del RE y se ha observado que el oligosacárido es fabricado en su totalidad antes de ser transferido al residuo de Asn "blanco" de la proteína, todo esto en un solo paso enzimático, tan pronto como el resíduo de Asn emerge a la luz del RE. El oligosacárido debe de estar presente en el lúmen del R E en forma "activada", esto es, unido a la molécula donadora, el lípido dolicol, via un enlace de alta energía, un puente de pirofosfato. El
oligosacárido es construido monosacárido tras monosacárido sobre esta molécula lipídica unida a la membrana, por lo que es anclado fuertemente a la superficie luminal del RE donde se lleva a cabo la glicosilación. Posteriormente se continúa el procesamiento de la glicoproteína con la remoción y adición de azúcares específicos en el AG (I, 13).
La presencia de diferentes estructuras y en cantidades variables de los residuos terminales de carbohidratos en las gonadotropinas les confiere características aún más especiales, ya que una misma glicohormona puede presentar diversas formas moleculares (microheterogeneidad) que le confieren características bioquímicas y fisiológicas Únicas para cada isoforma, incluyendo la vida media metabólica, la capacidad de unión a sus respectivos receptores y la actividad biológica in vitro e in vivo (1 3).
Sialización.
La familia del ácido siálico está compuesta de aproximadamente doce monosacáridos, siendo el ácido N-acetil neuramhico (ácido siálico: Neu 5 Ac, NANA Ó Sia) el miembro más
común de esta familia, y probablemente sirva como precursor biosintético de otros miembros de la misma familia. Debido a su carga negativa, los ácidos siálicos también pueden inhibir interacciones célula-célula, servir como ligandos para el reconocimiento celular, ser parte del ligando de inmunoglobulinas, ayudar en la adhesión de leucocitos a céluIas epiteliales mediadas por selectinas y en la depuración de asialo glicoproteínas de la circulación, entre otras funciones (13).
La importancia biológica de la sialización ha sido estudiada en diferentes hormonas, y se ha demostrado que la hLH, la hCG y la hFSH unen a sus respectivos receptores, pero su bioactividad varía según el grado de sialización que presenten (19). Se ha descrito la secuencia de los oligosacáridos N-ligados de FSH y de LH de bovino, ovino, rata y humano, siendo para estas especies una relación aproximada de diez veces mayor cantidad de oligosacáridos sulfatados en la LH que en la FSH, y en esta última existen exclusivamente las estructuras siaiizadas (2).
En general, se ha observado que la sialización es una modificación postraduccional de muchas glicoproteínas, incluyendo a hormonas como la FSH, para regular procesos tan diversos como la endocitosis mediada por un receptor, la adhesión celular, el reconocimiento viral de la célula huesped y como señal hormonal de transducción
(4).
P
c
L
e-.
.__
c
.-,
P'
.
.~...
n
r.
especificidad en el reconocimiento de la secuencia del oligosacárido aceptor y el enlace anomérico formado entre el ácido siálico y el azúcar al cual es adherido (14). En el caso de la
FSH,
se piensa que lasialización la realiza específicamente la Gal
B1,3(4)
GlcNAc a2,3-sialiltransferasa (2,3 STasa) debido al tipo de unión que presentan los
residuos de ácido siálico terminales con las galactosas de sus
oligosacáridos (2).
Sialiltransferasas.
Las sialiltransferasas son una familia de 12 a 15 enzimas altamente específicas relacionadas entre sí por su función común de transferir ácido siálico a las posiciones terminales de los oligosacáridos de las glicoproteínas y los glicolípidos (7, 12).
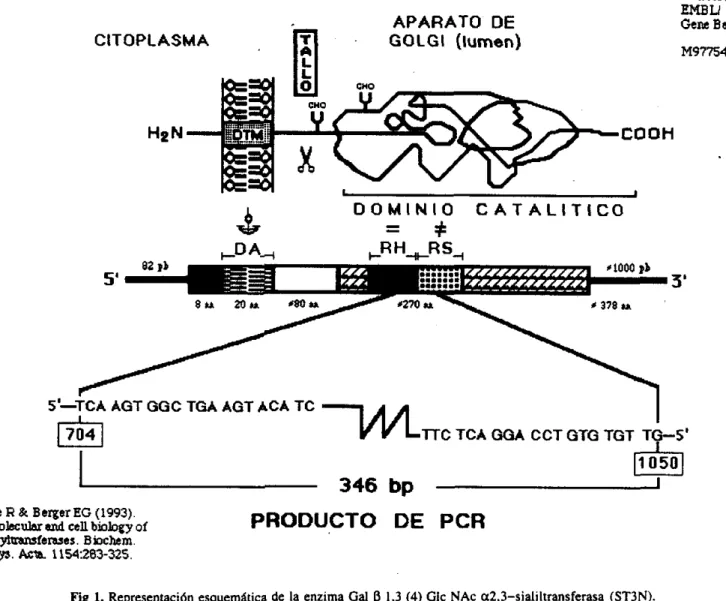
Recientemente se ha definido la topología de membrana de algunas sialiltransferasas, observándose que consisten de: una región
corta del extremo amino terminal hacia el citoplasma (dominio citoplasmático), una región "tallo" sensible a proteólisis y un dominio catalítico que se proyecta hacia el lumen del AG. Se han
identificado además secuencias homólogas de aminoácidos en la región catalítica de diferentes sialiltransferasas, con grados variables de similitud, por lo que se ha identificado esta región como la región específica de sialización (sialil motif) y se ha utilizado predominantemente en el análisis del funcionamiento y caracterización de otras sialiltransferasas (Fig. 1).
Hasta 1987, solamente se tenía información sobre la GalB1,4GlcNAc
o:
2,6-sialiltransferasa (ST6N) (21), la cual se aisló yGal
p
1,3(4)
GlcNAc
ar2,3-'SiaIiItransferasa
x Accem
EMBU
M97754
APARATO DE Gene Bank
CITOPLASMA GOLGI (lumen)
D O M I N I O C A T A L I T I C O
= #
3'
5'-TCA AGT GGC TGA AGT ACA TC
1704/
I n / L l T C TCA GGA CCT GTG TGT TE-5'&
1
346 bp IKieene R & BergerEG (1993).
'Rr mobcubr end ceii biobgy of
gScoiyimrafemer. Biochem BiaphY. AI& 11W283-325.
PRODUCTO DE PCR
Fig 1. Representación esquemática de la enzima Gal p 1.3 (4) Glc NAc a2,3-sialiltransferasa (ST3N).
En el panel superior se encuentra el modelo del dominio estructural y su probable topología con respecto a l a membrana del Aparato de Golgi (AG). donde DTM. dominio transmenbranal; Y. posibles sitios de N-glicosilación; CHO. corbohidratos. Una pequena porción de 8 aminoácidos del amino terminal se encuentra en la porción citoplásmatica. mientras que el resto de la molécula (-370 aa) encara hacia e l lumen del AG. La porción del DTM sirve como anclaje; la región del tallo une al DTM con e l
dominio catalítico.
En el panel de enmedio se encuentra una representación de l a ST3N con base en e l modelo propuesto (no dibujado a escala), de las regiones que representan los dominios correspondienter: de izquierda a derecha, =amino terminal (citoplásmatico). O=DA. dominio de anclaje (transmenbranal). S=tallo. y e l resto corresponde al dominio catalítico que representa los sitios de alta homología (0
HD;=) que une a CMP-ácido siálico y es común para todas las sialiltransferas. y e l sitio de alta
especificidad (0 DS; t) que reconoce el resíduo Gal pl,3 (6 p1,4) GlcNAc y genera un enlace a2.3 entre el ácido siálico y l a galactosa terminal.
En e l panel inferior se encuentran las secuencias de los dos oligonucleótidos (superior e
En 1992 se logró clonar y expresar el cDNA de una segunda sialiltransferasa, la GalBl,3GalNAc a2,3-~ialiltransferasa (ST30). Esta enzima es responsable de la síntesis de la secuencia: SA a2,3 GalBl,3GalNAc- encontrada en oligosacáridos O-ligados y también
como secuencia terminal de ciertos ganglósidos. Se observó que esta enzima presenta dos formas, una de 47-49 KDa y otra de 45 KDa
(7). En ambas enzimas encontradas en el hígado de la rata se observa una región de homología de 45 aminoácidos con 65% de identidad.
Posteriormente, en ese mismo año se aisló el cDNA de otra sialiltransferasa, la GalB1,3(4) GlcNAc a2,34aliltransferasa en hígado de rata (ST3N) (22) y en placenta humana (ST3N, HP-1)
(10). encontrándose un 91% de homología de nucleótidos y un 97% de aminoácidos entre ambas especies; sin embargo se reportó que esta misma enzima de placenta humana ST3N, HP- 1 prefiere cadenas aceptoras Gal B1,4 GalNAc (Tipo 2), mientras que la ST3N de hígado de rata tiene mayor afinidad por cadenas aceptoras GalB1,3GlcNAc (Tipo 1) (21) y otro tipo para cadenas aceptoras GalB1,3GalNAc (Tipo 3) (1 l).Esta enzima forma las secuencias SA a2,3 GalB1,3GlcNAc y SA a2,3GalBlPGlcNAc encontradas en los complejos terminales de las cadenas de oligosacáridos N-ligados.
A finales de 1992 se detectó en hígado y placenta humanas,
actividad de la CMP-NeuAc: Gal8 1,4 GlcNAc-R a 2 , 3 - sialiltransferasa (2,3-STasa) y de la Gal I3 1.4 GlcNAc-R a 2 , 6 -
sialiltransferasa (2,6-STasa), donde se apreció como actividad predominante en el hígado la de la 2,3-STasa, mientras que en la placenta la mayor actividad la presentó la 2,6-STasa (14).
....
r,.
solamente se expresa en el cerebro y ai momento de su nacimiento,
desconociéndose el motivo de esta actividad exclusiva (26). El análisis de otros tejidos en desarrollo, como la retina de rata han revelado cambios en la distribución del mRNA de la 2,6-STasa durante el proceso de desarrollo postnatal de este tejido (27).
Kitagawa y Paulson clonaron el cDNA de una siaiiltransferasa diferente, la Gall3 1,3(4)GlcNAc a2,3-sialiltransferasa humana a partir de tejido placentario, comparando con el cDNA de la 2,3- STasa previamente reportada por ellos mismos (12,22). El análisis por Northern blot reveló que el gene se expresa en niveles bajos en la placenta humana, pero mantiene una expresión abundante en el músculo esquelético y otros tejidos fetales humanos. También reportaron un nuevo gene (STZ) que codifica para la sialiltransferasa que identifica las secuencias GalB1,3GalNAc y GalB1,4GalNAc, pero no la secuencia Gall31,3GlcNAc aislado a partir de tejido placentano humano (1 1).
En 1993 se pudieron asociar los efectos de la sialización en la actividad hormonal de la TSH, y además la regulación que ejerce esta hormona sobre el mRNA de la 2,6-STasa (8, 9). Además se analizó la regulación de la expresión de la 2,3-STasa asociada con el desarrollo de los timocitos, encontrándose variaciones notables durante la maduración del tejido y entre las regiones medular y cortical (8).
Ciclo Ovárico de la rata
En el presente trabajo se estudia la expresión del RNAm de a2,3-STasa a l o largo del ciclo estral de la rata, por l o que se
requiere conocer su fisiología reproductiva.
c ..
...
r..
._
c- il_ c.-
n. F.-..
c L , "1 L.Jestá caracterizado por una fase lútea corta. La ovulación ocurre cada
4
o 5 días y se ha dividido en4
etapas principales:1)
Proestro, período en el cual el animal inicia la entrada al celo o "calor", dura de12
a14
horas, y se caracteriza por una predominancia de células epiteliales nucleadas en el frotis vaginal. 2)Estro
(del latín oistros,deseo vehemente) período en el que la hembra es receptiva sexualmente a la cópula con el macho y además si ésta sucede se puede llevar a cabo la concepción, dura de
25
a27
horas y predominan las células epiteliales escamosas cornificadas, de forma irregular, núcleo no visible y con citoplasma granular. 3) Metaestro (o Diestro1),
etapa posterior al estro si no ocurre la fecundación, en el que la hembra entra en un corto período de recuperación (6 a 8 horas) con cambios en el tracto reproductivo y caracterizada por la infiltración de leucocitos.4)
DiestrQ (o Biestro 2), etapa en la cual el tracto reproductivo se prepara nuevamente para recibir el óvulo fertilizado en el siguiente ciclo, dura de 55 a57
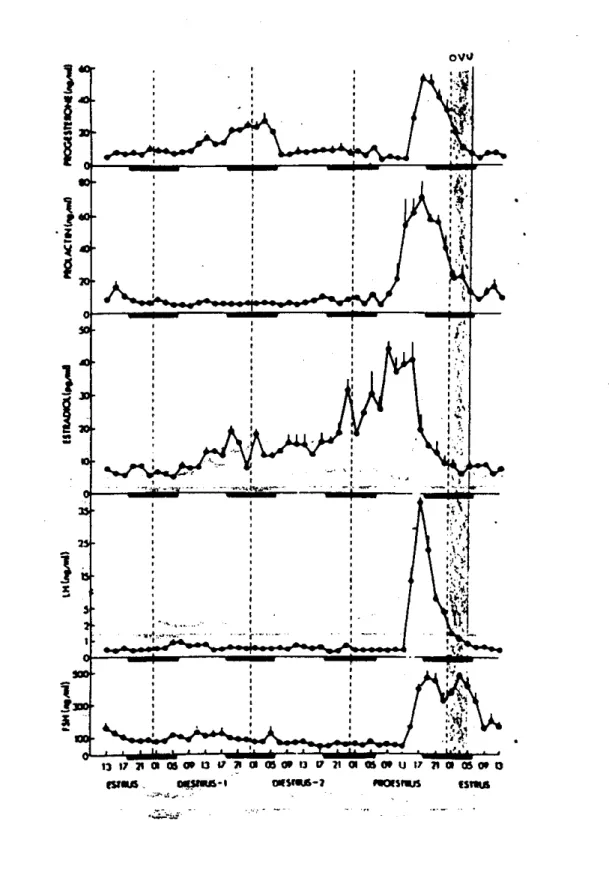
horas, predominan los leucocitos (que tienden a desaparecer hacia el final de esta etapa) y aparecen células epiteliales nucleadas que se hacen más numerosas conforme se aproxima nuevamente la etapa del proestro (5).Los niveles hormonales en la rata hembra se esquematizan en la figura 2 a lo largo del ciclo estral.
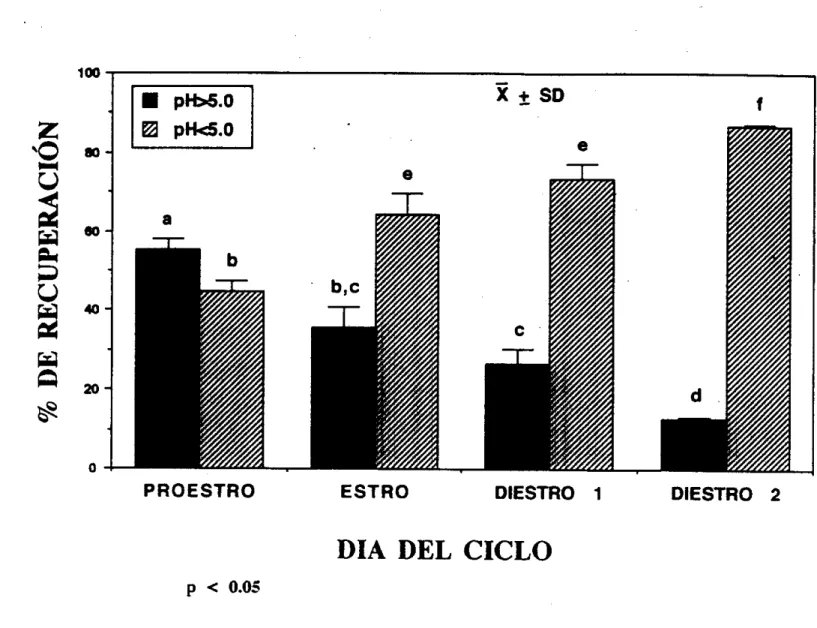
La proporción relativa de isoformas moleculares de la FSH con punto isoélectrico (PI) más ácido (pH<5) se incrementa en el Diestro
2,
mientras que las isoformas con PI menos ácidas (pH>5) aumentan en la etapa del proestro, donde es necesario un estímulo más potente (isoformas menos ácidas) pero de corta duración para evitar la poliovulación (Fig. 3).'1
m -
d o -
40-
7.0-
0 -
1 I
a
-
x
f SDe e
T
PROESTRO ESTRO DIESTRO 1 DIESTRO 2
DIA
DEL
CICLO
p 0.05
Fig. 3 La figura muestra como se encuentran distribuidas las isoformas moleculares de la hormona
folículo estimulante (FSH) con respecto a su punto isoeléctrico (pl). observandose una significante
diferencia a través del ciclo estral de la rata. En rectangulos obscuros se muestran las isoformas menos
ácidas. mientras que en los rectángulos a rayas se muestran las isoformas más ácidas. (Adaptado de Ulloa-
OBJETIVOS
Obietivo General.
Cuantificar la expresión de mRNA que codifica para la enzima a2,3-~ialiltransferasa en hipófisis de ratas en diferentes días del ciclo estral por medio de la técnica de hibridación in situ.
Obietivos específicos.
1. Estandarización de la técnica de hibridación in situ en cortes
histologicos de hipófisis de ratas.
a) Optimizar el espesor de los cortes histologicos de la hipófisis de rata para obtener mejores resultados.
b) Identificar el mejor fijador para mantener en buenas condiciones al téjido.
c) Establecer los tiempos requeridos en el tratamiento de pre- hibridación para obtener un Óptimo marcaje.
d) Determinar el agente desproteinizante más apropiado que será utilizado, así como los tiempos de digestión y la concentración a la que será usado dicho agente.
2. Observar los cambios de la sintesís de del mRNA que codifica para la enzima a2,3-sialiltransferasa en hipófisis de ratas hembra en diferentes fases del ciclo estral.
,
P
‘iOh‘ E
iOhD i 10, 14, 18 y 22h
D2
iOh.
.
1L
P
L
. . I
..,.
r, ..
METODOLOGIA
I. Modelos animales.
a) Se utilizaron ratas hembra maduras ciclantes (de aproximadamente 60 días de edad) de la cepa Wistar, del bioterio del Instituto Nacional de la Nutrición, Salvador Zubirán, mantenidas bajo condiciones de luz contraladas (luz de 05:OO a 19:OO hrs) y alimentadas ad libitum con agua y comida para ratas de laboratorio
(Purina Lab Chow, Purina, México) hasta el momento de su estudio. b) Se realizaron frotis vaginales diarios entre las 09:OO y las
1O:OO h para determinar la fase del ciclo estral en que se
encuentraban cada una de ellas. Solamente se utilizaron los animales que presentaron 4 ciclos consecutivos de 4 días cada uno con el fin de asegurar su ciclicidad.
c) Se sacrificaron en grupos de 3-5 animales en los diferentes estadíos del ciclo estral (proestro, estro, metaestro y diestro) por decapitación cervical, se obtuvieron las hipófisis, se lavaron con solución salina isotónica y se congelaron inmediatamente en nitrógeno líquido cubiertas con papel aluminio.
d) Cada hipófisis se corto con microtomo () refrigerado en
secciones de 4 pm de espesor, descartando las primeras y las últimas secciones. Las secciones obtenidas de cada hipófisis se tomaron en portaobjetos nuevos y tratados con anti-RNasas, de las cuales la mitad de las muestras fueron empleadas para Hibdridación in
situ
(HIS) yel resto para Inmunohistoquímica (IHQ). Los cortes fueron seriados y se distribuyeron de manera alternada para ambas técnicas, se fijaron en una solución etanol/ácido acetic0 (95% / 5%) para las
secciones destinadas a la técnica de
HIS
y en paraformaldehido enPBS 0.1M con pH 7.4/H*O-DEPC al
4%
para las destinadas a IHQ.(FSH), es decir los gonadotropos. y correlacionarlo con la síntesis de la enzima que sializa a la FSH, es decir la a 2.3-sialiltransferasa (2.3STasa)l.
e) Para la técnica de HIS, se empleo el ácido desoxirribonucleico complementario (cDNA) al ácido ribonucleico mensajero (RNAm) que codifica para la enzima a 2,3-
sialiltransferasa de rata marcado con biotina. Esta sonda de cDNA fue previamente sintetizada por RT-PCR de acuerdo a la secuencia descrita en la literatura (Wen et al 1992).
f) La técnica de IHQ se realizó empleando un antisuero
policlonal dirigido hacia la subunidad
B
de la FSH de rata elaboradoen cobayo para inmunohistoquímica (NIDDK) a una concentración
1:100, y se empleo un segundo anticuerpo anti-cobayo elaborado en
conejo y marcado con peroxidasa para ser revelado con
diaminobenzidina (DAB).
11. INMUNOHISTOQUIMICA PARA O-FSH DE RATA EN
HIPOFISIS.
1) Se desparafino por calentamiento en horno a 50-6OOC por 10-15 min .
2) Se lavo en xilol (2 veces), xilolletanol, y etanol absoluto por 1 min c/u.
3) Se elimino la peroxidasa endógena lavando en una solución de: 80 ml etanol absoluto
+
7 ml H 2 0 2+
13 ml dH2O por 30 a 60minutos
4)
Se lavo en etanol96OC por 3 minutos y después a chorro deagua de la llave.
5)
Se lavo con BFS [PBS 0.05M, pH7.4+
ovoalbúmina 3%] por 10min.
6) Se diluyo el ler. antisuero (anti4 FSH) con BSF a 1:20, 1 5 0 y
4 láminas por dilución incluyendo el control negativo (sin anticuerpo).
7) Se adiciono 100 pl Anti-BFSH por portaobjetos (3-5 cortes c/u). 8) Se incubo 1-18 horas en la cámara húmeda a 370C->TA.
9) Para quitar el ler. antisuero se lavo con BSF por 1 minuto (3
veces).
10) Se seco con gasa y se adicionaron 100 pl del 2do. anticuerpo 150
por portaobjetos [anticobayo inducido en conejo 1:2, 26 jul 891.
11) Se incubo 30 minutos en la cámara húmeda a TA.
12) Para quitar el 2do. anticuerpo se lava con BSF por 1 minuto (3
veces).
13) Se seco con gasa y se adiciono 100 p1 del 3er. anticuerpo [anticonejo inducido en cabra
+
peroxidasa 1:500] por portaobjetos.14) Se incubo 30 minutos en cámara húmeda a TA.
15) Se quito el 3er. anticuerpo y se lavo con BSF por 1 minuto (3
veces).
16) Se preparo cromógeno (Diaminobenzidina [DAB]): 1 mg DAB
+
1 ml PBS+
40 pl HzOz (30%).17) Se seco con gasa y se agregoaron 200 p1 de DAB por lámina y se
incubaron por 10 min en cámara húmeda. 18) Se lavo con agua destilada 2 veces.
19) Se tiñeron los núcleos con hematoxilina (20 sec)
+
Carbonato de litio (15-60 sec) hasta que cambie de morado a azul.20) Se deshidrataron con etanol 96OC, etanol absoluto y xilol por 3
min c/u.
21) Se seco con gasa y se agrego una gota de bálsamo de Canadá y
poner el cubreobjetos.
111.' H I B R I D A C I O N
in situ.a). Tratamiento de portaobjetos. Este tratamiento es requerido para que halla una mayor retención de las células del téjido sobre el portaobjetos por lo que es necesaria la utilización de un agente apropiado par el incremento de la adhesión celular.
1. Lavar el portaobjetos en agua jabonosa.
2. Enjuagar el portaobjetos en agua con DEPC(colocar1os en un recipiente de plástico con agitación) por espacio de 10 mins.
3. Colocar los en rejillas y ponerlos en homo a 200oC por una hora.
4. En una canastilla agregar y-Methacriloxi propil trimetoxilane sigma M-C5H 2% acetona (estéril) y colocar los portaobjetos dejandolos por espacio de 2hrs.
5. Sacar y escurrir
6. Meter cuando el homo se encuentre muy caliente y sacar de inmediato.
7. Guardar en cajas originales. a temperatura ambiente (pueden permanecer por mucho tiempo almacenados en un lugar libre de
b). Corte de tejidos. Los cortes se hacieron en microtomo refrigerado (-3OoC), con el fin de, por un lado conservar el tejido y por otro inhibir RNAasas, los cortes se hicieron con un diámetro de 4 p m y se colocarón en los portaobjetos previamente tratados (sialnizados).
c) Fijación. La fijación es con el fin de preservar la morfología celular y el nivel de señales de hibridación; en éste caso
se
usa un agente precipiante (etanol / ácido acético).1. Fijar el tejido con 95% de etanol / 5% ácido acético por 30 min. 2. Lavar con PBWGlicina (2mg/ml.) por 3 min., para detener la hidrólisi s.
3. Acetilación en anhidrido acético al 0.25% en trietanol amina
(pH=8.0) al 0.1M por 10 min. a temperatura ambiente.
4. Lavar con PBS por '3 min.
5. Post- fijación con etanol por 5min. a temperatura ambiente.
d). Pre- hibridación. Se hace con el fin de incrementar la eficiencia de la hibridación y para disminuir las uniones no específicas.
La pre-hibridación se realiza con 2x SSC por 30 min. a temperatura ambiente.
e). Hibridación. La hibridación se hace bajo condiciones óptimas para la sonda y para el téjido.
1. Desnaturalizar la sonda (ácido desoxirribonucleico complementario [cDNA] al ácido ribonucleic0 mensajero [RNAm] que codifica para la enzima a 2,34aliltransferasa de rata, la sonda de cDNA fué previamente sintetizada) por 30 min a 8OoC.
2. Agregar 10/20ml e incubar toda la noche a 42oC en cámara húmeda.
f) Lavados. Los lavados son con el fin de eliminar la sonda que
se unierá inespecifícamente.Para lo que es necesario Hacer los siguientes lavados:
1 . 4 ~ SSC a 56oC por 30 min. 2 . 2 ~ SSC a 56oC por 30 min. 3. lx SSC a 56oC por 30 min.
4. 0 . 5 ~ SSC a temperatura ambiente por 30 min.
g) Revelado.
1. Bloquear BSA 3% por 5 min. a 37oC en cámara húmeda.
2. La detección colonmétnca se hace de la siguiente manera: Avidina - AP 1:200 en BSA al 1% en TSBrij pH 7.5 por 30
min. a 37OC.
Lavar por 6 ocaciones con TSBrij con pH 7.5 por lmin. a 37oC. Lavar por 6 ocaciones con TSBrij con pH 9.5 por lmin. a 37oC. 3. Revelar con reactivo Mc Gaden por 30min. a 37oC.
r.'
i...
,."
5. Contrastar con Nuclear Fast Red (NFR) por 2 min. a
temperatura ambiente.
6. Lavar con agua destilada.
7. Deshidratar a través de alcoholes crecientesfiilol. a) alcohol 960 por 2 min.
b)alcohol absoluto por 2 min. c)xilol por 2 min.
8. Montar con resina.
NOTA: El RNA se verá de color azul y el fondo rosa.
RESULTADOS Y CONCLUSIONES.
En la gráfica
4
se observan los patrones de distribución por carga de las isoformas de FSH intrahipofisiaria. Las hipófisis fueron obtenidas a las 1O:OO h de cada uno de los4
días del ciclo estral y se separaron las isoformas en función a sus puntos isoélectricos (PI) por la técnica de cromatoenfoque. Se observa una prevalencia de isoformas más ácidas (pHc5.0) en Estro, Diestro1 y Diestro 2, mientras que en Proestro se observa un incremento en las formas menos ácidas (pH>5.0).Estas observaciones coinciden con un incremento en la concentración relativa del RNAm que codifica para la a2,3-STasa intrahipofisiaria (enzima que adiciona ácido siálico a la FSH, y por tanto la acidifica) en los días del Diestro 1 y Diestro 2, medida por hibridaciones en NorthernBlots.(Fig. 5).
Con el fin de determinar la ubicación de los gonadotropos en la hipófisis anterior se realizó la técnica de inmunohistoquimica, observándose los núcleos celulares teñidos en azul (Fig. 6 y 7), mientras que la inmunolocalización especifica de PFSH se observa en color marrón con una ubicación citoplasmática en las regiones del R E y AG. La fig. 6A es el control negativo sin anti-PFSH,
mientras que 6B y la fig. 7A y 7B son controles positivos de
A
>>>
B
>>>
D
>,>
O 20 4 0 60 10 100 120
a
.I
6
PH
I
4
3
n
PH
NÚMERO DE FRACCIÓN
P-io
E-10
D1-10
Di-14
Di-18
Di-22
D2-10
DENSIDAD OPTICA RELATIVA
(STvs Cyc)
o - N u i s u o i Y o
N
N
u n
X
I1
w
I+
.
..
*-
I
w.
.-.
P '
..
C'
.-
e.
I_
r-
L.
c
, .,.
..,
Estos resultados se correlacionaron con la expresión del RNAm-STasa en los gonadotropos, utilizando la técnica de hibridación
in
situ
para cuantificar su expresión. Resultados preliminares demuestran que existe una correlación entre los Northern Blots y la hibridaciónin situ,
sin embargo el escaso número de experimento realizados hasta el momento nos impide dar una conclusión estadísticamente significativa.A pesar de que el significado biológico de la heterogeneidad de la FSH aún no es muy claro, los estudios realizados hasta la fecha indican que la hipófisis tiene la capacidad de regular tanto la cantidad como la calidad de la hormona, (es decir, su actividad biológica y su vida media) que es sintetizada y liberada por los gonadotropos adenohipofisiarios. Este mecanismo está regulado a su vez por factores endócrinos del medio circundante, principalmente por estrógenos ováricos y por el péptido hipotalámico GnRH.
Todo indica que existe un control muy fino de los niveles hormonales en la hipófisis ya que esta libera varias isoformas de FSH altamente potentes pero con una vida media muy corta simultáneamente con isoformas de vida media larga y con poca actividad biológica.
Nosotros postulamos que este control se realiza a través de modificaciones en el grado de glicosilación de la FSH, principalmente en la catidad de ácido siálico que es incorporado a la hormona por la enzima a2,3-STasa; por otro lado esta enzima es regulada hormonalmente, siendo los estrógenos los principales candidatos a regular negativamente la expresión de la enzima.
c .
BIBLIOGRAFIA.
1) Alberts B, Bray D, Lewis J, Raff M, Roberts K and Watson JD. (1983) Molecular B iologv of the Cell. Garland Publishing, Inc. New York, USA.
2) Baenzinger JU & Green ED. (1988). Pituitary glycoprotein hormone oligosaccharides: structure, synthesis and function of the asparagine-linked oligosaccharides on lutropin, follitropin and thyrotropin. Biochim. Biophvs. Acta. 947:287-306.
3) Dah1 K D. and Hsueh AJW. (1988). Mechanism of action of FSH in the ovary. In Hormones and their actions. (Cooke B A and H J van der Molen, Eds.). Elsevier Science Publishers. Chapter 9, Parte 11, 181-192.
4) Fayos BE & Bartles JR. (1994). Regulation of hepatocytic glycoprotein sialylation and sialyltransferases by peroxisome proliferators. J. Biol. Chem. 269(3): 2151-7.
5) Freeman ME. (1994). The neuroendocrine control of the ovarian cycle of the rat. In: The Phvsiolom o f Reproduction., Second Edition. (Knobil E & Neil JD, Eds.) Raven Press, Ltd, New York. Vol. 2, Chapter 46, 613-58.
6) Ganong WF. (1988). Fisiología médica, l l a Ed. Editorial El Manual Moderno, SA, México.
7) Gillespie W, Kelm S and Paulson JC. (1992). Cloning and expression of the Gal B 1,3 GalNAc c1 2,3-Sialyltransferase. J. Biol.
8) Helton TE & Magner JA. (1994a). Sialyltransferase messenger ribonucleic acid increases in thyrotrophs of hypothyroid mice: An
in
Situ
Hybridization study. Endocrinoloyy. 134:2347-2353.9) Helton TE & Magner JA. (1994b). B-l,4-galactosyltransferase
and a-mannosidase I1 messenger ribonucleic acid levels increase with different kinetics in thyrotrophs of hypothyroid mice. Endocrinoloev. 135: 1980-1985.
10) Kitagawa H & Paulson JC. (1993). Cloning and expression of
11) Kitagawa H & Paulson JC. (1994a). Cloning of a novel a 2,3-
Sialyltransferase that sialylates glycoprotein and glycolipid carbohydrate groups. J. Biol
.
Chew. 269(2): 1394-1401.12) Kitagawa HE,Paulson J C. (1996). Genomic organization and chromosomal mapping of the
Gal~l,3GalNAc/Gal~l,4GlcNAc
a2,3-Sialyltransferase. J. Biol. Chem. 271(2)93 1-938.
13) Kornfeld R & Komfeld S. (1985). Assembly of asparagine-
linked oligosaccharides. Annu. Rev. Biochem. 54:63 1-64.
14) Nemansky M, Schiporst WECM, Koeleman CAM and Van den Eijnden DH. (1992). Human liver and human placenta both contains CMP-NeuAc: Gal
B
1,4GlcNAc-R N - a 2,3- as well as a 2,6-sialyltransferase activity. FEBS 3 12( 1):3 1-6.
15) Rathman P & Saxena BB. (1984) Structure-Function
relationships of gonadotropins. In: Hormone Receutors in Growth and Reproduction. (Saxena B B et al eds.) Raven Press, New York,
16) Ulloa-Aguirre A.& Chappel SC (1982). Multiple species of follicle-stimulating hormone exist within the anterior pituitary gland of male golden hamsters. J. Endocrino1 95:257-266.
17) Ulloa-Aguirre A, Espinoza R, Damián-Matsumura P, Larrea F, Morales L, Flores A and Domínguez R (1988a). Studies on the microheterogeneity of anterior pituitary follicle-stimulating hormone in the female rat. Isoelecric focusing pattern throughout the estrous cycle. Biol. Reprod. 38: 70-78.
18) Ulloa- Aguirre A, Damián-Matsumura P, Cravioto A, and Espinoza R. (1992).Microheterogeity of gonadotrophins.In: Reproduction.growth and development.(Negro-Vilar A and Pérez-
Palacios G. Eds.) Serono Symposia Publications from Raven Press, New York USA.
20) Ulloa-Aguirre A. (199 1). Aspectos bioquímico-funcionales de la hormona estimulante del folículo. En: .TrjDicos selectos de biología de la reproducción. (Dominguez casála
R.
Ed.) Editado por la UNAM. Cápitulo IV, 85-97.21) Weinstein
J,
Lee EU, McEntee K, Lai P-H and Paulson JC. (1987). Primary structure of B Galactosidea
2 , 6-
Sialy1transferase.Conversion of membrane-bound enzyme to soluble forms by cleavage of the "2-terminal signal anchor Biol. Chem. 262(26): 17735-43.22) Wen DX, Livington BD, Medzihradszky KF, Kelm S, Burlingame AL and Paulson JC. (1992). Primary structure of Gal
B 1,3(4) GalNAc a2,3-Sialyltransferase determined by mass spectrometry sequence analysis and molecular cloning. J. Biol.
23) Wilson JD & Foster DW (1985). Williams' Texbook of Endocrinology. 7th. Ed. Saunders, Philadelphia, USA.
24) Yen SSC. and Jaffe RB (Editors): Reproductive Endocrinology, 2nd. Ed. Saunders, Philadelphia, USA. (1986).
25) Fawcett DW, Bloom MD (1992).Hipófisis. En: Tratado de Histologia. 1 la. edición. Interamericana Mc Graw-Hill. Cápitulo
26) Livingston BD and Paulson JC. (1993). Polymerase chain reaction cloning of a developmentally regulated member of the sialyltransferase gene family. J. Biol. Chem. 268( 16): 11504-7. 27) Developmental change of distribution of
p
Galoctosidea
2,6- Sialyltransferase mRNA in rat retina. Exp. Eve Res. 56:89-93. 28) Pierce JG and Parsons TF. (1981). Glycoprotein hormones: Structure and fuction. Annu. Rev. Biochem. 50:465-95.29) Ulloa-Aguirre A, Damián-Matsumura P, Espinoza R, Domínguez R, Morales L and Flores A. (1990). Effects of neonatal androgenization on the chromafocusing patter of anterior pituitary FSH in the female rat. J. Endocrinol. 126:323-332.
m.
267(29): 2101 1-19.I.
-
..
DamiBn-MatsumM1 095559f
ENDO '98 Submission Program
1998 Abstract Form
Coatid bdividuil: Alñrdo A Ulla-AgUirm. Dspt. Rspmduarvc ' Biobgy.Ia~t&~b
Nacional de la NueiciQ SZ. Ves00 & QuiFoei No. 15, Cd. Tklp.n, Mexico D.F. 14000
MQgco. phonc: (525)573-1160Pa~: (525) 655-9859-
auU-.rmin.mnaeyt.mx