DINÁMICA ESPACIO TEMPORAL EN LA ESTRUCTURA DE LA COMUNIDAD Y DE LA POBLACIÓN MÓVIL Y SÉSIL DEL LITORAL ROCOSO,
SAN ANDRES (COVE).
LIZBETH PAOLA LÓPEZ RAMÍREZ
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
DINÁMICA ESPACIO TEMPORAL EN LA ESTRUCTURA DE LA COMUNIDAD Y DE LA POBLACIÓN MÓVIL Y SÉSIL DEL LITORAL ROCOSO,
SAN ANDRES (COVE).
LIZBETH PAOLA LÓPEZ RAMÍREZ
TRABAJO DE GRADO Presentado como requisito parcial
Para optar al título de
BIÓLOGA
Luis Alberto Acosta, PhD DIRECTOR
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
NOTA DE ADVERTENCIA
Artículo 23 de la Resolución Nº 13 de Julio de 1946
DINÁMICA ESPACIO TEMPORAL EN LA ESTRUCTURA DE LA COMUNIDAD Y DE LA POBLACIÓN MÓVIL Y SÉSIL DEL LITORAL ROCOSO,
SAN ANDRES (COVE).
LIZBETH PAOLA LÓPEZ RAMÍREZ
APROBADO
________________________ ________________________ Luis Alberto Acosta Moreno, Biólogo Fabio Gómez Delgado, Biólogo Director Jurado
________________________ Saúl Prada Pedreros, Biólogo
DINÁMICA ESPACIO TEMPORAL EN LA ESTRUCTURA DE LA COMUNIDAD Y DE LA POBLACIÓN MÓVIL Y SÉSIL DEL LITORAL ROCOSO,
SAN ANDRES (COVE).
LIZBETH PAOLA LÓPEZ RAMÍREZ
APROBADO
DINÁMICA ESPACIO TEMPORAL EN LA ESTRUCTURA DE LA COMUNIDAD
Y DE LA POBLACIÓN MÓVIL Y SÉSIL DEL LITORAL ROCOSO,
SAN ANDRES (COVE).
Lizbeth Paola López – Ramírez1
1 Unidad de Ecología y Sistemática, Departamento de Biología, Pontificia Universidad Javeriana. E-mail: lisloz@gmail.com
RESUMEN
Comprender los cambios en la estructura de la comunidad en el ecosistema Litoral Rocoso en espacio y tiempo resultan ser complejos, debido a que los factores identificados en definir la estructura de la comunidad, difieren entre organismos móviles y sésiles según la escala analizada. El objetivo del presente trabajo fue determinar y comparar cual comunidad y/o población entre organismos móviles y sésiles cambia en espacio y/o tiempo en el litoral rocoso San Andrés (Cove). Para ello tres transectos fueron monitoreados, dos hacía la parte interna o zona protegida de la bahía de Cove y un tercero en la parte expuesta al oleaje. En el análisis estadístico se compararon diferencias en la estructura de la comunidad y población móvil y sésil a nivel espacial: (1) a escala vertical (entre zonas) y (2) a escala horizontal (entre localidades distanciadas entre sí, a unos metros) y a nivel temporal entre años (2004, 2005 y 2006).
especies Echininus nodulosus, Tectarius muricatus y Echinometra lucunter variaron a nivel espacial entre zonas y localidades (a excepción de Tectarius muricatus entre localidades) y a nivel temporal. En conclusión, organismos móviles en comparación a sésiles presentaron variación tanto a nivel espacial (particularmente entre localidades) como temporal y poblaciones resultaron ser más sensibles que las comunidades a los factores que actuaron en espacio y tiempo, en el área de estudio (oleaje, contaminación y huracán).
PALABRAS CLAVES: Dinámica, Echininus nodulosus, Tectarius muricatus, Echinometra lucunter, Algas.
SPATIAL- TEMPORAL DYNAMIC OF MOBILE AND SESSIL COMMUNITY STRUCTURE
AND POBLATION ON ROCKY SHORE,
SAN ANDRÉS (COVE).
ABSTRACT
points random/quadrant) in quadrants of 0.2 x 0.2 m; to estimate the density of the mobile community was took the number of individuals covered in the entire area of the quadrant. The structure of the community and the sessile population (algae) varied significantly among zones. The population density of species, Echininus nodulosus, Tectarius muricatus and Echinometra
lucunter varied at level space between zones and locations (except for Tectarius muricatus between locations) and temporal level. In conclusion in mobile than sessile organisms showed spatial (particularly between locations) and temporal variation and poblations were more sensitive than communities to variables that acted in space and time in the study area (pollution, storm and wave).
WORDS CLAVES: Dynamic, Echininus nodulosus, Tectarius muricatus, Echinometra lucunter, Algaes.
INTRODUCCIÓN
La estructura de la comunidad intermareal ha sido extensamente estudiada por ser uno de los ecosistemas de fácil acceso a experimentos ecológicos, ser sitio de albergue y crianza de muchos organismos, fuente de sustento para el hombre e indicador de disturbios naturales y antrópicos (INVEMAR, 2005).
La variación en la estructura de la comunidad y de la población del litoral rocoso a nivel
espacial y temporal; ha sido reportada debido a distintos factores, difiriendo estos entre sí, de
acuerdo al tipo de organismo sésil o móvil o especie analizada según la escala espacial o
temporal analizada; es así cómo resulta de gran importancia el estudio de la estructura de la
comunidad no sólo comprendiendo las distintas escalas a nivel espacial (vertical y horizontal)
A nivel vertical, en organismos móviles, la heterogeneidad del sustrato y la acción del oleaje, han sido identificados, como los principales factores determinantes en la distribución vertical de los organismos. El tipo de sustrato “grietas” resulta favorecer la presencia y mayor densidad de gasterópodos hacía zonas altas del gradiente vertical (zona supralitoral) en litorales de Panamá y del Mar Mediterráneo (Garrity, 1984; Benedetti-Cecchi et al., 1999) y la acción del oleaje, favorable en la presencia de Echinometra lucunter en el límite superior de la zona infralitoral en litorales del África (Lawson, 1956). A diferencia de los factores identificados en móviles en el gradiente vertical en organismos sésiles, algunos factores responsables de la distribución vertical de las especies resultan ser:
1) los niveles de marea (Spring lower waters LWS, en localidades poco expuestas al oleaje); limitando la distribución de algas marinas típicas de la zona infralitoral (Lithothamnia,
Laurencia, Sargassum y Dictyopteris) hacía zonas más altas del litoral en las costas del África (Lawson, 1956);
2) el ángulo de la superficie rocosa en la distribución de especies de algas Ulva,
Chaetomorpha, Chthamalus y Lithothamnium, en litorales de África (Lawson, 1956);
3) el estrés físico limitante en la distribución de algas hacía zonas más altas en el litoral (Conell, 1972; Norton, 1985; Buschmann, 1990) y 4) el efecto del pastoreo por parte de lapas en el porcentaje de cobertura de algas (Benedetti-Cecchi,2000).
Sin embargo estos estudios comprenden el análisis de la variación vertical de organismos móviles y sésiles en su mayoría en litorales del subtrópico, siendo estos de tipo descriptivos y son pocas las investigaciones desarrollados en el trópico (Tabla 1).
Istrian (Kelaher et al., 2004). En organismos sésiles, el pastoreo en el porcentaje de cobertura de algas erectas (algas filamentosas y foliosas) en litorales semi-expuestos al oleaje en Hong-Kong (Kelaher y Williams, 1998); la disponibilidad de reclutas en la variación del porcentaje de cobertura de algas en Hong-Kong (Benedetti-Cecchi y Cinelli, 1993); el tipo de sustrato rugoso, favorable en el asentamiento y reclutamiento de propágulos de algas en el golfo Trieste al norte del mar Adriático (Rindi y Batelli, 2005) y en litorales expuestos al oleaje con una inclinación moderada del sustrato, favorable en la distribución de la especie Fucus virsoides y de la estructura asociada al ensamblaje algal en la costa Istrian al norte del mar Adriático (Munda, 1972). No obstante, en su mayoría estas investigaciones al igual que los estudios identificados en el gradiente vertical, son desarrolladas en ecosistemas del subtrópico.
El efecto de la contaminación por la descarga de aguas residuales, resulta ser otro de los factores determinantes en la variación espacial de los organismos en el ecosistema litoral rocoso; sin embargo, la mayoría de estudios han abarcado sólo la población sésil, evidenciando el reemplazo de algas cafés por algas verdes-azul (Littler y Murray, 1975); mejillones por algas (López-Gappa et al., 1990) y algas perennes por algas verdes efímeras (Worm et al., 1999; Bonsdorff et al., 1997; Díaz y Rosenberg, 1995). El efecto de la contaminación por la descarga de aguas residuales en espacio y tiempo en la población móvil en litorales rocosos no ha sido estudiada, reportándose algunas investigaciones sobre la población de moluscos en arrecifes rocosos submareales poco profundos en Italia (Terlizzi et al., 2005).
sobre los factores que influyen en la variación de los organismos a nivel temporal, resulta ser no representativa.
Respuestas ante los factores que actúan en espacio y tiempo no sólo han sido identificadas a nivel poblacional sino también a nivel de comunidad (Davidson et al., 2004 y Coates 1998); evidenciando de esta manera, la importancia del análisis del efecto de los factores tanto a nivel poblacional como a nivel de comunidad.
La variación en la comunidad sésil y móvil a nivel espacio-vertical, ha sido registrada
principalmente al gradiente de inmersión en litorales de Irlanda (Davidson et al., 2004); siendo
la tendencia en la densidad total de móviles y sésiles a aumentar acorde al incremento del gradiente de inmersión. No obstante, la comunidad intermareal a nivel vertical en su mayoría ha sido comprendida en términos de composición y pocos son los estudios que analizan la tendencia del patrón de acuerdo a las variables de densidad y nulos en el porcentaje de cobertura total de la comunidad sésil en el gradiente vertical, algunos investigadores proponen la existencia de una zonación global en la distribución vertical de los organismos (Stephenson y Stephenson, 1949; Lawson, 1956).
El efecto de la descarga de aguas residuales en el sistema a nivel espacial entre localidades, resulta ser analizada principalmente en términos de diversidad, registrando menor diversidad en áreas contaminadas en la comunidad intermareal dominada por el Bivalvo
Brachidontes rodriguezi en litorales de Argentina (Lopez-Gappa et al., 1990 y 1993); el análisis del efecto de las aguas residuales en términos del porcentaje de cobertura total de la comunidad sésil es evidenciado en hábitats de fondos blandos (Roberts et al., 1998; Terlizzi et
al., 2002) y en organismos móviles sólo a nivel poblacional (Terlizzi et al., 2005). Efecto de la contaminación sobre el porcentaje de cobertura total de la comunidad sésil y en la densidad total de la comunidad móvil en litorales rocosos no son reportados.
Estudios en Colombia, sobre la dinámica de la comunidad en el ecosistema litoral rocoso resultan ser pocos (Tabla 2). Información existente a nivel espacial, comprende la zonación de especies en el gradiente vertical en la región de Santa Marta (Brattstöm, 1980) y algunos otros, la distribución geográfica y estado actual a nivel poblacional del ofiuro Ophiotrix synoecina, el erizo de mar Echinometra lucunter y el molusco Citarum pica a lo largo del Caribe Colombiano (Monroy, 2003; Osorno y Díaz, 2006); a nivel temporal, se reporta la variación estacional de la comunidad sésil (Nuñez et al., 2003) y cambios a nivel espacial y temporal sólo es registrado en organismos sésiles (algas), en términos de abundancia y biomasa en litorales de Santa Marta (García y Díaz, 2006); estudios comprendiendo las variables de densidad y cobertura de la comunidad móvil y sésil en espacio y tiempo no son reportados.
En el presente estudio se estableció como objetivo cuantificar y comparar la densidad y cobertura total a nivel espacial y temporal de la comunidad y de la población móvil y sésil en el sistema litoral rocoso, San Andrés (Cove); con el fin de responder a la pregunta ¿Qué tipo de organismo, móvil o sésil, responde o presenta cambios significativos en las variables estudiadas en la escala espacial y temporal?
Para Colombia y en particular para la Isla de San Andrés este es el primer estudio en determinar y comparar la dinámica en espacio y tiempo de la comunidad móvil y sésil en un sistema de Litoral Rocoso.
METODOLOGÍA
Organismos
Las zonas del Litoral fueron determinadas de acuerdo al tipo de especies/taxa presentes en el sitio de muestreo (determinado por parte del observador en muestreos previos) siguiendo el patrón de zonación de organismos a nivel mundial (Lawson, 1957; Stepheson y Stepheson, 1972). Especie móvil fue definida como “cualquier animal epibéntico que regularmente se desplaza a través de bentos con la habilidad de moverse fuera del área del cuadrante” y especies sésiles fueron definidas como aquellas especies sedentarias o fijas al sustrato. Comunidad, fue definida como todas las especies o taxas pertenecientes a un mismo tipo de organismo (sésil o móvil) y población, fue definida como todos los individuos pertenecientes a una misma especie o especies de un mismo taxa que ocuparon un área y tiempo determinado (Davidson et al., 2004).
Sitio de estudio
temperatura anual promedio de 24.7 ºC; precipitaciones anuales en total de 1900 mm distribuidas entre las estaciones de época seca (febrero a abril) con promedios mensuales inferiores a 50 mm y en épocas de lluvia (junio a Diciembre) con precipitaciones promedio mensuales mayores a 150 mm (SIGAM-CORALINA, 2004). La corriente superficial del Caribe entra al archipiélago de San Andrés por el oriente a velocidades entre 0.5 y 1 m/s (Díaz et al., 1996).
El tipo de sustrato del litoral rocoso resulta ser de origen bioclástico, estructuras coralinas que emergieron del pleistoceno por la dinámica de transgresiones superpuestas de piedra caliza coralina. De acuerdo a la forma en que estas rocas erosionaron, la acción del viento, oleaje, precipitación y biota, el sustrato tipo piedra caliza se encuentra caracterizado por grietas (Geister, 1972; INVERMAR, 2000).
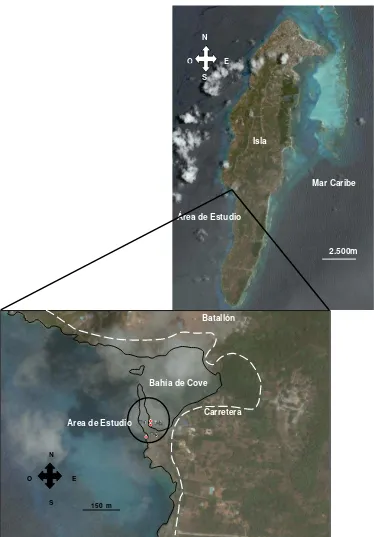
El muestreo se llevó a cabo en la Bahía de Cove (N 12º 31' 40.3'' W 81º 43' 58.3'') al sur-oeste de la Isla de San Andrés (Figura 1), los días 1 al 3 de septiembre del 2004 y 2006 y del 25 al 27 de octubre del 2005. Eventos como la contaminación por aguas residuales (Palmer, 2007), el paso del huracán Beta en octubre del 2005 (Rodríguez et al., 2008) y la apertura de dos corredores biológicos entre el lapso del 2004 y 2005, por acción del oleaje entre la zona protegida y expuesta; fueron algunos de los eventos que ocurrieron en el área de estudio durante el tiempo de monitoreo.
del litoral, baja rugosidad y presencia representativa de riqueza, densidad y cobertura de organismos móviles y sésiles en el área del litoral a monitorear (Figura 1).
A lo largo de cada transecto y mediante la técnica de puntos al azar en cuadrantes (0.2 m x 0.2 m) fue contabilizado el porcentaje de cobertura total de la comunidad sésil. Los cuadrantes consistieron en una grilla subdividida en cuadrículas con 81 puntos interseptos posibles, de los cuales se seleccionaron 50 puntos mediante una tabla de números aleatorios. Esos mismos puntos se usaron en el monitoreo permanente para la cuantificación de especies sésiles (Figuras 2 a, b y c). Dentro de cada cuadrante, el porcentaje de cobertura total de sésiles fue determinado por el conteo de puntos interseptos ocupados por cada especie y/o taxa en cada cuadrante. Para la cuantificación de la densidad de organismos móviles, se tuvo en cuenta la abundancia de cada especie ocupada en el área del cuadrante (0.04 m2). Los
muestreos se llevaron a cabo entre las ocho de la mañana y doce de la tarde para evitar posibles variaciones entre muestreos.
El desplazamiento de los cuadrantes se realizó a lo largo del transecto teniendo en cuenta el derecho del cuadrante (marcado como arriba en unos de los lados del cuadrante), dos puntillas de acero fueron colocadas en el límite superior de la zona supralitoral y dos en el límite inferior de la zona infralitoral teniendo en cuenta el ancho del cuadrante (0.02 m), ello como referencia para monitoreos posteriores del punto de inicio y punto final de la cuantificación de cuadrantes en cada transecto (Figura 2 d).
siguiente manera: ((No. de Individuos*100)/(50*No. de cuadrantes)). La densidad promedio de la comunidad móvil se calculó según el número total de individuos de cada especie por m2 sobre
el área en total monitoreada por año (1.84 m2), localidad (protegida 2.52 m2; expuesta 3 m2) y
zonas (supralitoral 2.2 m2, mesolitoral 1.4 m2 e infralitoral 1.9 m2); calculando la densidad
promedio de cada especie móvil así: ((No. de individuos * m2) / (0.04 m2 *No. de cuadrantes).
El porcentaje de cambio a nivel temporal para cada variable se expresó como = [(Valor de la variable en el ultimo año de monitoreo - Valor de la variable en el primer año de monitoreo / Valor de la variable en el primer año en que se llevó a cabo el monitoreo)*100].
El análisis de la variación espacial y temporal de la población sésil y móvil, se realizó teniendo en cuenta las especies o clases dominantes dentro de cada tipo de organismo; el criterio de clasificación de especies dominantes para organismos sésiles fueron aquellas que presentaron un porcentaje de cobertura mayor a 60% en cinco o más de cinco cuadrantes y para móviles, una densidad total igual o mayor a 150 individuos en dos o más cuadrantes. La frecuencia de aparición de las especies o grupos a cada zona se clasificaron como; exclusivas a una zona, a dos zonas o a tres zonas.
Análisis estadístico
El análisis de varianza de una vía Kruskal-Wallis, fue implementado para corroborar las hipótesis posibles del patrón de variación espacial y temporal de los organismos sésiles y móviles en el presente estudio, las hipótesis planteadas fueron: H0: No existen diferencias
significativas en la densidad y porcentaje de cobertura de móviles y sésiles entre zonas (independiente de localidad y tiempo); H1: No existen diferencias significativas en la densidad y
cobertura de móviles y sésiles entre localidades (independiente de zona y tiempo); H2: No
prueba paramétrica como son: la homogeneidad de varianza (Test de Levene´s; p<0,05) y normalidad de los datos (p<0,05; Shapiro-Wilk), pese a ver sido transformados los datos con log (x+0.5).
RESULTADOS
Un total de 14 taxa (especies y otros taxa) de la comunidad móvil y 10 taxa de la comunidad sésil fueron registradas en el área de estudio; de ellos 17 fueron identificados al nivel de especie (Phylum Cnidaria, Mollusca y Echinodermata); 6 a nivel de clase (Chlorophyceae, Cyanophyceae, Phaeophyceae, Rodophyceae, Crustácea y peces) y 1 a nivel de Phyllum (Porifera). Dentro del grupo de organismos móviles el Phylum Mollusca fue el grupo taxonómico más representativo, entre ellas las especies Tectarius muricatus y Echininus
nodulosus; mientras que las algas fueron el grupo dominante en la comunidad sésil.
Organismos móviles
Sólo diferencias significativas a nivel poblacional en la densidad promedio de organismos móviles (comprendiendo las especies dominantes) en espacio y tiempo fueron detectadas (Tablas 4 a y b).
Echinometralucunter y Echininus nodulosus registraron variación a nivel espacial, entre zonas (Kruskal-Wallis test; H=10.01, df=2, p=0.006; H=6.43, df=2, p=0.04, respectivamente); entre localidades (H=7.32, df=1, p=0.0006; H=5.25, df=1, p=0.021, respectivamente); como a nivel temporal (H=8.2, df=2, p=0.016; H=13.29, df=2, p=0.001, respectivamente). Tectarius
muricatus varió a nivel espacial solo entre zonas (H=24.66, df=2, p=0.001) y a nivel temporal (H=14.01, df=2, p=0.009).
supralitoral, Tectarius muricatus (densidad promedio de 37.5 ind/m2), Echininus nodulosus (37.5 ind/m2),
Littorina zigzag (7.9 ind/m2) y Littorina interrupta (0.5 ind/m2); zona mesolitoral, Eucidaris tribuloides e Eucidaris viridus (cada una 0.6 ind/m2) y zona infralitoral Echinometra lucunter (15.0 ind/m2), Diadema antillarum (6.1 ind/m2) y peces (2.8 ind/m2). A dos zonas (zona supralitoral y zona mesolitoral), Nerita tesselatta (zona supralitoral 0.5 ind/m2 y zona mesolitoral 1.3 ind/m2) y
Chiton marmoratus (zona supralitoral 0.5 ind/m2 y zona mesolitoral 9.6 ind/m2) y a las zonas mesolitoral e infralitoral, Cittarium pica (zona mesolitoral 1.3 ind/m2 y zona infralitoral 0.6 ind/m2) y especies al phylum Crustácea (zona mesolitoral 3.2 ind/m2 y zona infralitoral 1.7
ind/m2).
A nivel espacial, entre localidades, la densidad promedio de la comunidad móvil fue mayor en localidad protegida (51.2 ind/m2) frente a la localidad expuesta (44.7 ind/m2) aunque
diferencias significativas no se detectaron (H=0.008, df=1, p=0.926). Individuos comunes a ambas localidades fueron especies pertenecientes al grupo de litorinas, Tectarius muricatus,
Echininus nodulosus y Littorina zigzag (Tabla 6).
Tectarius muricatus (12.3 ind/m2) junto a Echininus nodulosus (23.8 ind/m2), registraron altas densidades en la localidad protegida y las especies Echininus nodulosus (16.7 ind/m2 y
Echinometra lucunter (9.0 ind/ m2) en la localidad expuesta.
La tendencia a escala temporal en la densidad total de la comunidad móvil fue a aumentar (Tabla 7), indicando un porcentaje de cambio positivo (+). A nivel poblacional en organismos móviles se observó variación en la densidad de Tectarius muricatus entre años disminuyendo hacia el 2005 y sin registro alguno para el último año de muestreo (2006), año en el cual se reportó Echininus nodulosus. El porcentaje de cambio de Echininus nodulosus y de
Organismos sésiles
Diferencias significativas se registraron en el porcentaje de cobertura promedio de la comunidad sésil (H = 8.655, df = 2, p = 0.014) y a nivel poblacional comprendiendo los grupos taxonómicos más representativos (Phaeophyceae; H = 8.909, df = 2, p = 0.011, Rodophyceae; H = 8.046, df = 2, p=0.017 y Clorophyceae; H =7.962, df = 2, p=0.018) entre zonas, a nivel de localidad y tiempo no se detectaron diferencias significativas en la comunidad o población sésil (Tabla 4).
La tendencia del porcentaje de cobertura de la comunidad sésil en el gradiente vertical fue a disminuir desde la zona infralitoral hacia la zona supralitoral (Tabla 5). Especies del Phylum Cnidaria fueron comúnmente registradas a la zona infralitoral, siendo exclusivas de la zona, Siderea radians, Siderea siderea, Millepora squarrosa y Agaricia agaricetes; a dos zonas (mesolitoral e infralitoral) algas pertenecientes a las clases Phaeophyceae y Rodophyceae y esponjas y comunes a las tres zonas las algas Clorophyceae y Cyanophyceae.
La distribución en el gradiente vertical de los organismos estuvo dominada en la zona Infralitoral por las clases de algas Phaeophyceae (22.1 %) y en la zona mesolitoral por algas pertenecientes a las clases Clorophyceae (12.6 %) y Phaeophyceae (12.5 %; Tabla 5).
Aunque no se detectaron diferencias significativas entre localidades, mayor porcentaje de cobertura promedio se observó en la localidad protegida (44.1 %) frente a la localidad expuesta (25.1 %); siendo dominantes en la localidad protegida, las algas pertenecientes a las clases Phaeophyceae (18.2 %) y Clorophyceae (15.6 %) y exclusiva a la zona Cyanophyceaes (Tabla 6) y en la localidad expuesta mayor porcentaje de cobertura de algas Rodophyceae (11.2 %).
DISCUSIÓN
Los organismos móviles en comparación a organismos sésiles, presentaron respuesta ante los factores estructurales en espacio y tiempo en el presente estudio; sólo a escala vertical, se registraron diferencias en ambos tipos de organismos. Son varios los factores a nivel espacial y temporal que se discutirán a continuación como factibles agentes determinantes de la densidad y la cobertura poblacional de las especies y/o taxa dominantes analizadas.
A nivel vertical, el gradiente de inmersión, es catalogado como uno de los principales factores determinantes en la distribución de especies móviles y sésiles; siendo más limitante en la distribución de sésiles que móviles (Davidson et al., 2004). De acuerdo a la zonación observada, este factor posiblemente determinó la distribución de organismos móviles y sésiles, arrojando diferencias significativas entre zonas en cuanto se refiere a la densidad poblacional de Echinometra lucunter, Echininus nodulosus y Tectarius muricatus y al porcentaje de cobertura de las algas pertenecientes a las clases Phaeophyceae, Rodophyceae y Clorophyceae.
En cada una de las tres zonas se reportaron especies comunes según la condición de emersión. Hacía la zona supralitoral, al igual que en litorales de Santa Marta y Cartagena (Brattström, 1980; Nuñez et al., 1999), se evidenciaron especies adaptadas a la emersión continua, todas ellas pertenecientes al grupo de litorinas (Tectarius muricatus, Echininus
nodulosus y Littorina spp), corroborando una vez más, las especies Tectarius muricatus y Echininus nodulosus como especies indicadoras del límite superior de la zona supralitoral (Brattström, 1980).
Laurencia y Gelidium (Nuñez et al., 1999). Para el área de estudio fueron comunes a esta zona, las algas pertenecientes a las clases Clorophyceae, Phaophyceae y Rodophyceae y al tipo de organismos móviles, erizos de mar del género Eucidaris (Emson et al., 2002).
Hacía la zona infralitoral, principalmente especies adaptadas a condiciones de inmersión continua (algas), pertenecientes al género Galaxaura (Nuñez et al., 1999), Sargassum y
Dictyopteris (Lawson, 1956) y grupos taxonómicos como corales, erizos y esponjas (Brattström, 1980) han sido registrados. La especie Echinometra lucunter y grupos de algas y corales fueron exclusivas a esta zona, corroborando lo encontrado por Lawson (1956), en litorales del este de India; la especie Echinometra lucunter como indicadora del límite superior de la zona infralitoral en zonas expuestas al oleaje.
Diferencias significativas en el porcentaje de cobertura de algas pertenecientes a las clases Phaeophyceae, Rodophyceae y Clorophyceae, entre zonas, pudo ser debido igualmente al sistema de pastoreo. Algunos estudios han evidenciado el límite de distribución de algas (principalmente foliosas) por arriba de su distribución normal en el gradiente vertical, en zonas del mesolitoral; debido al efecto del pastoreo por parte de littorinas y erizos de mar, en litorales de Australia (Underwood, 1980). Para el presente estudio, la variación espacial de algas entre zonas posiblemente fue debido al efecto del pastoreo y gradiente de inmersión.
A nivel espacial, entre localidades, se registraron diferencias significativas en la densidad de las especies móviles Echininus nodulosus y Echinometra lucunter. De acuerdo al criterio de selección en que fueron escogidas las localidades a monitorear (una localidad expuesta al oleaje y la otra protegida al oleaje) y de acuerdo a las condiciones físicas del área, evidenciando en la localidad protegida contaminación por descarga de aguas residuales, se sugirieron los factores acción del oleaje y contaminación, como los factibles agentes estructurantes en la variación espacial de la densidad poblacional móvil entre localidades.
Archipiélago de San Andrés, Providencia y Santa Catalina, de 1997), para 1999 se reportó el cierre de la cañería proveniente del campamento de Infantería de Marina ubicado al noreste del área de estudio (INVEMAR, 2003) y datos cuantitativos para la Bahía de Cove, han registrado altos índices de Coliformes totales (9000 NPM/100 mL) por encima de la norma Colombiana permitida (Tabla 3), constatando de esta manera la contaminación por aguas residuales en el área de estudio.
Echeverri y Reyes (1998), justificó cambios en la densidad poblacional del erizo de mar
Echinometra lucunter entre localidades, a causa de la acción del oleaje, favoreciendo este factor el incremento de la densidad de la especie debido a la mayor disponibilidad de recurso alimenticio, en comparación a localidades protegidas. El éxito de estas especies en zonas expuestas al oleaje, radica en el sistema de anclaje y la habilidad de usar pequeños huecos en la pared del litoral como refugios contra el arrastre de olas (Schoppe, 1996). En litorales del Atlántico y Pacífico; Schoppe (1996), evidenció en zonas fuertemente expuestas, densidades poblacionales de Echinometra lucunter por arriba de 90 individuos por metro cuadrado y típica a localidades expuestas al oleaje (Lawson, 1956; Brattström, 1980; Schoppe, 1996). Para el área de Cove, Echinometra lucunter fue exclusiva a la localidad expuesta y junto a Echininus
nodulosus, registraron las más altas densidades promedio en la localidad expuesta (respectivamente: 9.0 ind/m2; 16.7 ind/m2), siendo por ende la acción del oleaje determinante en
la variación espacial de estas especies. No obstante, diferencias en la densidad de estas especies, entre localidades, pudo haber sido igualmente debida a la descarga de aguas residuales.
sedimentación debido a la cantidad de sólidos suspendidos en la columna de agua ocasionando incremento de la turbidez e interactuando con los procesos de sedimentación, lo cual proporciona cambios en la heterogeneidad de la comunidad algal, alterando de esta manera la complejidad del hábitat de organismos móviles (Schreider et al., 2003).
Al contrario de organismos móviles, el efecto de aguas residuales sobre la población sésil resulta ser claramente reportado en litorales rocosos; registrando el reemplazo de algas cafés por cianobacterias y especies omnívoras (Littler y Murria, 1975); la disminución de algas perennes (Fucus vesiculosus) y su reemplazo por algas verdes efímeras (Worm et al., 1999; Bonsdorff et al., 1997; Diaz y Rosenberg, 1995) y el dominio en áreas contaminadas por algas verdes y cianobacterias (López-Gappa et al., 1990; Fairweather, 1990). De acuerdo a los anteriores registros y a observaciones personales del área de estudio, evidenciando mayor sedimentación, menor visibilidad y el reporte de cianobacterias en la localidad protegida frente a la localidad expuesta por el efecto de la contaminación por aguas residuales, para el presente estudio se esperaba encontrar diferencias significativas en las clases dominantes de algas entre localidades, pero esto no fue registrado. Sin embargo, notoriamente la localidad protegida (contaminada) fue dominada por algas, reportando altos porcentajes de cobertura de las algas Clorophyceaes (15.6 %) y Phaeophyceaes (18.2 %); probablemente diferencias significativas entre localidades en el porcentaje de cobertura de algas no fueron detectadas debido al esfuerzo de muestreo o bajo nivel de impacto del agente tensor.
A nivel temporal, se registraron diferencias en la densidad de Echinometra lucunter,
palmata y en praderas de pastos marinos, el desprendimiento de algas y vástago de Thalassia testudinum y Syringodium filiforme (Rodríguez-Ramírez et al., 2008); sin embargo, su efecto sobre el sistema de litoral rocoso no fue analizado.
Emson et al. (2002), debido al paso del huracán Erin (30 de junio de 1995) cerca de la Isla de Lee Stocking (Bahamas), evidenció variación en la densidad poblacional de Tectarius
muricatus a nivel temporal, reportando la disminución en la abundancia promedio de Tectarius muricatus de 20 m2 a 2.8 m2, un día después del paso del huracán Erin, registrando la disminución cerca del 89 % en la abundancia de individuos a 0.64 m del nivel de la marea baja (LWM) y el 45 % de la abundancia individuos a 1.05 m del nivel de la marea baja (LWM).
Para el área de Cove horas antes del paso del huracán Beta, fueron tomados los datos, evidenciando de esta manera para el 2005, disminución en la densidad poblacional de Tectarius
muricatus, Echinometra lucunter y Chiton marmoratus. Probablemente variación en la densidad poblacional móvil a nivel temporal fue debida al paso del huracán, presentando variación ante el factor organismos móviles y no sésiles, por su condición de movilidad y habilidad de percibir cambios en el medio, desplazándose los organismos móviles hacía refugios más seguros en el litoral (Emson et al., 2002).
La variación de la población móvil a nivel temporal, también pudo ser atribuida al efecto de la descarga de aguas residuales; sin embargo, no se hizo un seguimiento del grado de contaminación en el área de estudio. Schoppe (1993) y Monroy (2003), registraron respectivamente una densidad poblacional promedio de Echinometra lucunter de 52 ind/m2 y 41 ind/m2, en Punta Betín (Santa Marta), disminuyendo la densidad de esta especie más del 20 %
muestreo para el área de Cove, se llevó a cabo siempre durante la estación húmeda. De esta manera se sugiere, variación en la densidad poblacional de Echinometra lucunter a nivel temporal, por al efecto de aguas residuales o al paso del huracán Beta.
Cómo se observa, no es posible definir la principal causa de variación de la población móvil a nivel espacial y temporal debido a que no se cuantificaron datos físico-químicos de las variables independientes, se recomienda tomar datos físico-químicos del área de estudio; para definir de esta manera el factor determinante o la interacción de estos factores (antagónica u aditiva) sobre la población móvil.
A nivel de comunidad, variación espacial (zonas y localidad) en organismos móviles y sésiles han sido evidenciadas, sin embargo, en el presente estudio, las poblaciones resultaron ser más sensibles que las comunidades a las variables que potencialmente actuaron en espacio y tiempo (oleaje, contaminación y huracán).
Aunque diferencias significativas entre zonas en la densidad de la comunidad móvil no se detectaron, la tendencia fue a aumentar en el área de estudio desde la zona Infralitoral hacía la zona supralitoral, contrario a lo evidenciado en litorales de Irlanda por Davidson et al. (2004), probablemente debido al tipo de sustrato. El tipo de sustrato “grietas”, ha sido reportado como el tipo de hábitat más favorable en la presencia de especies de litorinas, lapas y neritas en partes altas del litoral (Benedetti-Cecchi et al., 1999). Para la bahía de Cove, este tipo de sustrato fue característico del área; mientras “grava”, fue el tipo de sustrato monitoreado en el área de estudio investigada por Davidson et al. (2004), proporcionando de esta manera el tipo de sustrato “grava” refugios no adecuados a las especies en las partes altas del litoral (Zona supralitoral y zona mesolitoral), dónde el estrés físico es extremo y por ende el registro de mayor densidad promedio de móviles y sésiles hacía zonas bajas del litoral (Zona mesolitoral e infralitoral) en litorales de Irlanda.
1999). La tendencia del porcentaje de cobertura de organismos sésiles a incrementar desde la zona supralitoral a la zona infralitoral, en el área de Cove, podría ser explicada por el aporte de materia orgánica. Debido a sedimentos y materia orgánica e inorgánica, Núñez et al.(1999), en litorales de Cartagena, registró más del 60 % de la superficie del litoral rocoso en la zona infralitoral cubierto o dominado por algas y en menor porcentaje esponjas 32 % y corales 5 %. Para el área de Cove la zona infralitoral fue dominada igualmente por algas 47 %, seguido por esponjas 11 %, corales 3 % y el resto por coral fósil. El aporte de materia orgánica en estos ecosistemas resulta favorecer la proliferación y rápido crecimiento de especies efímeras, disminuyendo la presencia de especies filtradoras (Pearson y Rosenberg, 1978; Widdicombe, 2001).
Variabilidad en la densidad de la comunidad de macroinvertebrados y cobertura de la comunidad sésil por la acción del oleaje en áreas del trópico y subtrópico, son registradas (Coates, 1998), siendo mayor la densidad y porcentaje de cobertura de la comunidad en lugares expuestos al oleaje, tendencia contraria a lo evidenciado en el área de estudio de Cove posiblemente al efecto de aguas residuales sobre la localidad protegida, lo cual impulsa el rápido crecimiento de especies oportunistas y mayor oferta alimenticia (Terlizzi et al., 2002). Algunas investigaciones registran un efecto significativo de la descarga de aguas residuales sobre el porcentaje de cobertura total de la comunidad sésil (Roberts et al., 1998); sin embargo, otras estudios evidencian un efecto de la descarga de aguas residuales sobre el porcentaje de cobertura de algunas especies, principalmente algas, pero no en el porcentaje de cobertura total de la comunidad sésil (Terlizzi et al., 2002). Para el área de estudio probablemente el factor de oleaje y contaminación interaccionaron levemente sobre el sistema, sin ocasionar un efecto significativo sobre la comunidad pero si a nivel poblacional.
Variación en el porcentaje de cobertura sésil por el efecto del régimen climático, ha sido detectado (Nuñez et al., 1999; García y Díaz, 2006). Probablemente en el presente estudio no se detectaron diferencias en la densidad y porcentaje de cobertura de la comunidad móvil y sésil, debido a que la investigación abarcó la misma época climática (temporada de lluvias) y al parecer las condiciones de contaminación en el área de estudio no variaron.
La aparición de dos corredores biológicos entre la localidad expuesta y la localidad protegida entre los años 2004 y 2005, debió favorecer el aumento de organismos móviles para el 2006 y disminuir en el porcentaje de cobertura de organismos sésiles entre años debido al intercambio de mejor calidad agua hacía localidad protegida.
En conclusión, respuesta ante factores físicos (acción del oleaje), naturales (Huracanes) y antrópicos (efecto de aguas residuales), fue registrada por organismos móviles que sésiles, ejerciendo estos factores un impacto a nivel poblacional y no a nivel de comunidad; sin embargo, no fue posible detectar el principal factor determinante en la variación espacial y temporal en la población móvil. Se recomienda realizar estudios que incluyan los tipos de organismos sésil y móvil, así como la comunidad y la población, con el fin de inferir una mejor interpretación de los factores que influyen en el hábitat; así mismo tomar datos físico-químicos del área para realizar un mejor seguimiento de las variables en espacio y tiempo y contar con sitios de réplicas control al estudiar el efecto de la contaminación sobre el sistema, evitando atribuciones ambiguas de variación de la comunidad y población por el efecto de aguas residuales y realizar análisis de la interacción de los factores, con el fin de identificar el factor determinante en la comunidad o población. El análisis de los datos debe comprender una baja resolución taxonómica (especies) ya que se ha constatado menor probabilidad de registrar diferencias significativas en la comunidad ante los factores estructurantes por el alto nivel de análisis taxonómico comprendido (Rindi y Battelli, 2005).
comportamiento de los organismos ante condiciones externas en el ambiente, diferenciando la variación de la comunidad por cambios naturales en el sistema frente a cambios antrópicos y proporcionando especies claves o indicadores del sistema, importantes en planes de manejo; por ejemplo, en la contaminación por la descarga de aguas residuales, como especies indicadores de los niveles de disturbio (Paine, 1991; Peters, 1991).
AGRADECIMIENTOS
La autora quiere expresar sus más sinceros agradecimientos a sus padres por su apoyo, al director de trabajo de grado, Luis Alberto Acosta por su orientación y a la Universidad Pontificia Javeriana en su formación académica.
BIBLIOGRAFIA
Andrew, N.L. y R.M. Viejo. 1998. Effects of wave exposure and intraspecific density on the growth and survivorship of Sargassum muticum (Sargassaceae: Phaeophyta). Eur. J. Phycol., 33: 251-258.
Brattröm, H. 1980. Rocky shore zonation in the Santa Marta area, Colombia. Sarsia., 65 (3): 169-222.
Benedetti-Cecchi, L. y F. Cinelli. 1993. Early patterns of algal succession in a midlittoral community of the Mediterrean sea: A multifactorial experinment. J. Exp. Mar. Biol. Ecol., 169: 15-31.
Benedetti-Cecchi, L. 2000. The interplay of physical and biological factors in maintaining mid-shore and low-mid-shore assemblages on rocky coast in the north-west Mediterranean. Oecologia., 123: 406-417.
Bonsdorff, E., E. M. Blomqvist, J. Matilla y A. Norkko. 1997. Coastal eutrophication: causes, consequences and perspectivas in the archipiélago areas of northern Baltic Sea. Est. Coastal Shelf Sci., 44:63-72.
Buschmann, A.H. 1990. The role of herbivory and desiccation on early successional patterns of intertidal macroalgae in southern Chile. J. Exp. Mar. Biol. Ecol., 139: 221-230.
Bustamante, R.H y G.M. Branch. 1996. Large scale patterns and tropic structure of southern African rocky shores: the roles of geographic variation and wave exposure. J. Biogeo., 26: 207-213.
Conell, J.H. 1972. Community interactions on marine rocky intertidal shores. Annual review of ecology and systematics., 3: 169-192.
Coates, M. 1998. A comparison of intertidal assemblages on exposed and sheltered tropical and temperate rocky shores. Global. Ecol. Biogeo. Letters., 7: 115-124.
Davidson, C.I., A.C. Crook y D.K. Barnes. 2004. Quantifying spatial patterns of intertidal biodiversity: Is a movement important? Mar. Ecol., 25 (1): 15-34.
Díaz, R.J y R. Rosenberg. 1995. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanogr. Mar. Biol., 33: 245-303.
Díaz, J.M., G. Díaz-Pulido, J. Garzón-Ferreira, J. Geister, J.A. Sánchez, y S. Zea, 1996. Atlas
de los arrecifes coralinos del Caribe colombiano. Tomo I. Complejos arrecifales
oceánicos. Invemar, Santa Marta. 283p.
Echeverri, O y A. Reye. 1998. Algunos aspectos de la ecología poblacional de Echinometra
lucunter (Linaeus), en el litoral de Inca-Inca, caribe colombiano. Seminario de Investigación – Proyecto II. Univ. Jorge Tadea Lozano. Facultad de Biología Marina. Santa Marta.
Fairweather, P.G. 1990. Sewage and the biota on seashore: assessment of impact in relation to natural variability. Environ. Monit. Assess., 14: 197-210.
García, B. C y Díaz, P.C. 2006. Dynamics of a macroalgal rocky intertidal community in the Colombian Caribbean. Bol. Invest. Mar. Cot., 35: 7-18.
Garrity, S. D. 1984. Some adaptations of Gastropods to physical stress on Tropical rocky Shore. Ecology., 65 (2): 559-574.
Geister, J. 1972. Notas sobre la edad de las calizas coralinas del Pleistoceno marino en las Islas de San Andrés y Providencia (Mar Caribe Occidental, Colombia). Instituto Colombo-Alemán Investiaciones Científicas., 6: 135-140.
Hammond, W y L. Griffiths. 2004. Influence of wave exposure on South African mussel beds and their associated infaunal communities. Mar. Bio., 144: 547-552.
Hutchinson, N y G.A. Williams. 2001. Spatio-temporal variation in recruitment on a seasonal tropical rocky shore: the importance of local versus non-local process. Mar. Ecol. Prog. Ser., 215: 57-68.
INVEMAR. 2000. Informe annual sobre el estado de los recursos marinos y costeros. Programa SINAM. Unidad coordinadora de Información. Santa Marta, Colombia. 63 p.
INVEMAR (REDCAM). 2005. Diagnóstico y evaluación de la calidad ambiental marina en el Caribe y el Pacífico Colombiano. Informe técnico. Santa Marta. 59 p.
Jenkins, S. y R.G Hartnoll. 2001. Food supply, grazing activity and growth rate in the limpet
Kelaher, B y Williams G.A. 1998. Early development of algal assemblages under different regimes of physical and biotic factors on a seasonal tropical rocky shore. Mar. Ecol. Prog. Ser.,172: 61–71.
Kelaher B., J. Castilla y R. Sedd. 2004. Intercontinental test of generality for spatial patterns among diverse molluscan assemblages in coralline algal turf. Mar. Ecol. Prog. Ser., 271: 221-231.
Lawson, G.W. 1956. Rocky shore zonation on the Gold coast. J. Ecol., 44 (1): 153-170.
Lewis, J.R. 1957. Intertidal communities of the northern and western coast of Scotland. Trans. Roy. Soc. Edinb.,63: 185-220.
Littler, M. M y S.N Murray. 1975. Impact of sewage on the distribution, abundance and community structure of rocky intertidal macro-organisms. Mar. Bio., 30: 277-291.
López-Gappa, J.J., A. Tablado y N.H Megaldi. 1990. Influence of sewage pollution on a rocky intertidal community dominated by the mytilid Brachidontes rodriguezi. Mar. Ecol. Prog. Ser., 63: 163-175.
Martins, M.G., R.C. Tompson, S.J. Hawkins, A.I. Neto y S.R. Jenkins. 2008. Rocky intertidal community structure in oceanic island: scales of spatial variability. Mar. Ecol. Prog. Ser., 356: 15-24.
Menge, B.A. 1976. Organization of the New England rocky intertidal community; role of predation, competition and environmental heterogeneity. Ecol. Monogr., 46: 335-393. Monroy, L.M. 2003. Distribución geográfica y estado actual O. synoecina, asociado obligado a
Echinometra lucunter en el caribe colombiano. Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Bogotá, 80 p.
Munda, I.M. 1972. The effects of organic pollution on the distribution of fucoid algae from the Istrian coast (vicinity of Rovinj). Acta Adriat., 23: 329-337.
Núñez, G.S., N.H. López, C.B. García y G.R Navas. 1999. Caracterización y comportamiento bimensual de la comunidad sésil asociada con el litoral rocoso de Bocachica, isla de Tierra Bomba, caribe colombiano. Cienc. Mar.,25 (4): 629-646.
Osorno, A.A y J.M. Díaz. 2006. Explotación, usos y estado actual de la cigua o burgao
Cittarium pica (mollusca: gastropoda: trochidae) en la costa continental del caribe colombiano. Bol. Invest. Mar. Cost., 35: 133-148.
Pasch, J.R. y D.P. Roberts. 2005. Tropical cyclone report hurricane Beta. National Huracan Center.
Paine, R.T., 1974. Intertidal community structure: experimental studies on relationship between a dominant competitor and its principal predator. Oecologia., 15: 93-120.
Palmer, C.S. 2007. Análisis Histórico (1997-2005) de la calidad de aguas costeras de la isla de San Andrés. Tesis., Univ. Nacional de Colombia, Bogotá. 86 p.
Pearson, T.H y R. Rosenberg. 1978. Macrobenthic sucession in relation to organic enrichment and pollution of the marine environment. Oceanogr. Mar. Biol-Annu. Rev. 16: 229-311. Peters, R.H. 1991. A critique for ecology. Cambridge Univ. Press, Cambridge, 366 p.
Rindi, F y C. Batelli. 2005. Spatio-temporal variability of intertidal algal essemblages the Slovenian coast (gulf of Trieste, northern Adriatic sea). Bot. Mar., 48: 96-1.
Roberts, D.E., A. Smith, P. Ajani y A. Davids. 1998. Rapid changes in encrusting marine assemblages exposed to anthropogenic point source pollution: a “Beyond BACI” approach. Mar. Ecol. Prog. Ser., 163: 213-224.
Rodríguez-Ramírez, A. y M. Reyes-Nivia. 2008. Evaluación rápida de los efectos del huracán Beta en la isla providencia (caribe colombiano). Bol. Invest. Mar. Cost., 31 (1): 217-224. Schreider, M.J, T.M. Glasby y A.J. Underwood. 2003. Effects of height on the shore and
Scoppe, S. 1990. Die vergesellshaftung zwischen Acyrtus rubiginosus (Gobiesocidae), Clastotoechus vanderhorsti K (Porcellanidae), Ophiotrix sp. (Ophiotrichidae) und ihrem gesteinsbohrenden wirt Echinometra lucunter (Echinometridae) im felslitoral von Santa Marta, Kolumbien. Msc. Thesis., Justus-Liebig Univer, Guisen, Germany. 68p.
Scoppe, S. 1993. Die karpose um den felsbohrenden seeigel Echinometra lucunter (L.): Untersuchung der lebensraumbedingungen und der biologie der assoziierten Arten. Dissertation, Justus – Liebig Univer, Geiensen, Germany.128 p.
Schoppe, S y W. Bernd. 1996. The boreholes of the sea urchin genus Echinometra (Echinodermata: Echinoidea: Echinometridae) as a microhabitat in tropical South America. Mar. Ecol., 17 (1-3): 181-186.
SIGAM-CORALINA. 2004. Agenda ambiental de San Andrés Islas, (En línea). Disponible en: www.coralina.gov.co/archivos/Sigam CAPITULO%20 I Perfil Ambiental 1.pdf
Stephenson, T.A y A. Stephenson. 1949. The universal features of zonation between tide-marks on rocky shore. J. Ecol., 37 (2): 289-305.
Tablado, A., J.J. López-Gappa y N.H. Magaldi. 1994. Growth of the pulmonate limpet Siphonaria
lessoni (Blainville) in a rocky intertidal area affected by sewage pollution. J. Exp. Mar. Biol. Ecol., 175: 211-226.
Terlizzi, A., S. Fraschetti, P. Guidetti y F. Boero. 2002. The effects of sewage discharge on shallow hard substrate sessile assemblages. Mar.Poll. Bull., 44: 544-550.
Terlizzi, A., D. Scuderi, S. Fraschetti, M.J Anderson. 2005. Quantifying effects of pollution on biodiversity: a case study of highly diverse molluscan assemblages in the Mediterranean. Mar. Biol., 148: 293-305.
Underwood, A.J. 1980. The Effects of Grazing by Gastropods and Physical Factors on the Upper Limits of Distribution of Intertidal Macroalgae. Oecologia., 46 (2): 201-213.
Tabla 1. Resumen de los principales agentes estructurantes en la variación espacial y temporal de la comunidad y población sésil y móvil en el ecosistema litoral Rocoso a nivel global.
Agente Estructurante Tendencia Locación Referencia
Heterogeneidad del sustrato
El tipo de hábitats "grietas" favorece la abundancia de lapas, litorinas y neritas que otros tipos de hábitats
Panamá y Mar Mediterraneo
Garrity (1984) y Benedetti-Cecchi et al. (1999)
Oleaje
Mayor densidad de Echinometra lucunter en localidades expuestas al
oleaje Africa Lawson (1956)
Niveles de marea
Límita la distribución de algas (Lithothamnia, Laurencia, Sargassum y
Dictyopteris) a zonas bajas del litoral Africa Lawson (1956)
Gradiente de Inmersión Aumento de la densidad sésil y móvil en sentido al incremento del gradiente de inmersión Irlanda Davidson et al.(2004) Disponibilidad del sustrato y mortalidad
de Chthamalus spp.
Disminución en el porcentaje de cobertura de sésiles hacía la zona
infralitoral Mediterraneo Benedetti-Cecchi et al.(1999)
Pastoreo
Diferencia del porcentaje de cobertura algal entre las zonas
supralitoral e infralitoral Mediterraneo Benedetti-Cecchi et al.(2000)
Pastoreo y factores físicos
El pastoreo y las condiciones físicas extremas durante las mareas bajas en ausencia de pastoreo; prevee la distribución de algas
foliosas por arriba de su distribución normal en el gradiente vértical Australia Underwood (1980)
Descarga de aguas residuales
Mejillones Brachidontes rodriguezi son reemplazados por
Clorophytas y Cyanophytas Argentina López-Gappa et al.(1990)
Descarga de aguas residuales Reduce la densidad y estimula el rápido crecimiento de lapas Argentina Tablado et al.(1994)
Descarga de aguas residuales
Clorophytas son reemplazadas por Cyanophytas, la diversidad del
ensamblaje disminuye California Litter y Murray (1975)
Descarga de aguas residuales
Aumento del porcentaje de cobertura de algas efímeras y de rápido
crecimiento. En hábitats submareales Italia Terlizzi et al. (2002)
Descarga de aguas residuales
Incrementa la abundancia de polyquetos y disminuye la diversidad de
especies cerca de la tubería de descargue. En hábitats submareales Australia Pearson y Rosenberg (1978)
Descarga de aguas residuales
Ausencia de especies filtradoras en sitios contaminados como el
ascidian solitario Pyura stolonifera. En hábitats submareales Australia Fairweather (1988)
Acción del Oleaje
Mayor densidad de macroinvertebrados y el porcentaje de cobertura de organismos sésiles en localidades expuestas
Australia y Nueva
Zelanda Coates (1998)
Heterogeneidad física del sustrato
Variación en la diversidad y densidad del ensamblaje de moluscos (quitones, prosobranquios, mejillones) asociados a algas coralinas
Australia, Chile e
Istrian Kelaher et al. (2004)
Descarga de aguas residuales
El reemplazado algas perennes (Fucus vesiculosus) por algas
efímeras Mar Baltico Díaz y Rosenberg (1995)
Intensidad y dirección de corrientes
Variación en el porcentaje de cobertura de especies de algas y móviles (Littorinas ylapas)
Archipiélago
Azorean Martins et al.(2008)
Acción del oleaje
Declina la densidad poblacional y el rango de crecimiento de Patella
vulgata con la disminución de exposición al oleaje Europa Jenkins y Hartnoll (2001)
Oleaje y la pendiente del Litoral
Litorales moderamente expuestos al oleaje y con una inclinación suave de la superficie del sustrato aumenta la densidad de Fucus
virsoides y de la comunidad algal asociada Mar Adriático Munda (1972)
Tipo de sustrato
Determinante en la composición de la comunidad algal asociada a
Fucus virsoides. Favoreciendo mayor cobertura algal en sustratos
rugosos e irregulares Mar Adriático Rindi y Batelli (2005)
Acción del oleaje
El pico del porcentaje de cobertura, promedio del tamaño y biomasa
del bivalvo Mytilus galloprovincialis a exposición intermedia al oleaje Sur África Hammond y Griffiths (2004)
Disponibilidad de reclutas Variación en el porcentaje de cobertura de especies sésiles Hong-Kong
Benedetti-Cecchi y Cinelli (1993); Hutchinson y Williams (2001)
Pastoreo
Efecto negativo sobre el porcentaje de cobertura macroalgal de algas erectas (algas filamentosas, foliosas); favoreciendo la cobertura de
algas incrustantes en litorales semi-expuestos al oleaje Hong-Kong Kelaher y Williams (1998) Disponibilidad, dispersión y asentamiento
de propágulos de algas Variación en la abuntancia de especies de algas Australia Andrew y Viejo (1998)
El efecto del Huracan Erin
Reducción en la abundancia del número de individuosTectarius
muricatus Bahamas Emson et al., (2002)
Variación estacional de estrés físico
Variación temporal en la magnitud de colonización algal con mayor cobertura en invierno que en verano.
Mediterraneo y Hong-Kong
Benedetti-Cecchi y Cinelli (1993); Huchinson y Williams (2001)
Competencia inter-específica
Éxito de algunas macroalgas (Coralliaspp Vs Ralfsia expanda) en la
zona infralitoral Hong-Kong Kelaher y Williams (1998)
A pequeña escala espacio horizontal Escala Vértical
A gran escala espacio horizontal
Tabla 2. Resumen de los principales agentes estructurantes en la variación espacial y temporal de la comunidad y población sésil y móvil en litorales de Colombia.
Agente Estructurante Tendencia Ubicación Referencia
Gradiente de Inmersión Determina la zonación de la comunidad sésil y móvil Santa Marta Brasttström (1980)
Acción del oleaje y vientos
Determina el ancho de las zonas; en tiempo seco incremento del ancho de la zona mesolitoral y en
épocas de lluvia de la zona supralitoral Cartagena Núñez et al. (1999)
Microhábitats creados por
Echinometra lucunter
Favorece especies asociadas al erizo como la estrella de mar Ophiothrix synoecina y el pez Acyrtus rubiginosis
Santa Marta e
Isla Gorgona Schoppe y Bernd (1996)
Acción del oleaje
Mayor densidad de Echinometra lucunter en
localidades expuestas
en el mar Pacífico y
Caribe Schoppe (1996)
Tipo de sustrato y oleaje
Sustrato tiporocas metamórficas de tipo filitas o esquistos y rocas calcáreas de origen coralino favoracen el asentamiento de Echinometra lucunter y mayor densidad de la especie registrada en litorales
expuestos. Santa Marta Monrroy (2003)
Sobreexplotación Disminuye la densidad poblacional de Citarium pica
Santa Marta, Guajíra e Islas
del Rosario Osorno y Díaz (2006)
Pendiente y grado de exposición al olejae y corrientes
Una pendiente vértical y mayor influencia del oleaje y corrientes favorece la cobertura de esponjas que
algas. Cartagena Núñez et al. (1999)
Régimen climático y sedimentos
En época de lluvias desplazamiento escalonado de la comunidad sésil y en época seca conforma un grupo
separado. Cartagena Núñez et al. (1999)
La descarga de aguas continentales
Disminución en la densidad promedio de Echinometra
lucunter Santa Marta Monroy (2003)
Eventos parciales de arena en
época seca Reduce la cobertura algal Punta Loma García y Díaz (2006)
Escala Vertical
Escala Horizontal
36 Tabla 3. Conteo de Coliformes totales y fecales (Número mas probable/100ml) para San Andrés (Islas), marcando picos por encima de la norma permisible en Colombia el conteo de coliformes totales en la bahía de Cove durante la estación seca en el 2001 y durante la estación de lluvias en el 2003 y en el conteo de Coliformes fecales en la estación seca del 2001 y 2003.
FUENTE (Palmer, 2007)
Estación seca
Estación lluviosa
Estación seca
Estación lluviosa
Estación seca
Estación lluviosa
Estación seca
Estación lluviosa
Estación seca
Estación lluviosa
Cove 1600 150 - 210 300 9000 300 300 27 4
Cove 16000 150 - 70 300 90 110 170 13 4
2005
Sitio
Coliformes Fecales Coliformes Totales
37 Tabla 4. Kruskal-Wallis test para el análisis de varianza espacial y temporal del porcentaje de cobertura y densidad A) En comunidad sésil y móvil. B) En la población sésil y móvil (comprendiendo las especies dominantes) en el Litoral Rocoso de San Andrés (Cove). *p<0.05;**p<0.01;***p<0.005; ns= No significativo.
A).
B).
Fuente de
variación
df
H
p
df
H
p
df H
p
df
H
p
df H
p
df
H
p
Entre Zonas
2 8.90
0.011**
2 8.04
0.017*
2 7.96
0.018*
2 24.66
<0.001 ***
2 6.43
0.04*
2 10.01
0.006**
Entre
Localidades
1 0.28 0.593 1 0.03 0.849 2 4.64 0.098
1 0.82
0.363
1 5.25
0.021*
1
7.30
0.006**
Entre años
2 4.60
0.1
2 5.46 0.065 1 1.05 0.304
2 14.01
0.0009***
2 13.29
0.001***
2
8.25
0.016*
Tectarius
muricatus
Echininus
nodulosus
Echinometra
Lucunter
Densidad
Rodophyceae
Phaeophyceae
Clorophyceae
Sésil
Móvil
(%) Cobertura
Fuente de variación
df H p df H p
Entre Zonas 2 8.65 0.01 ** 2 0.23 0.891 ns
Entre Localidades 1 0.46 0.49 ns 1 0.008 0.926 ns
Entre años 2 0.53 0.76 ns 2 0.75 0.685 ns
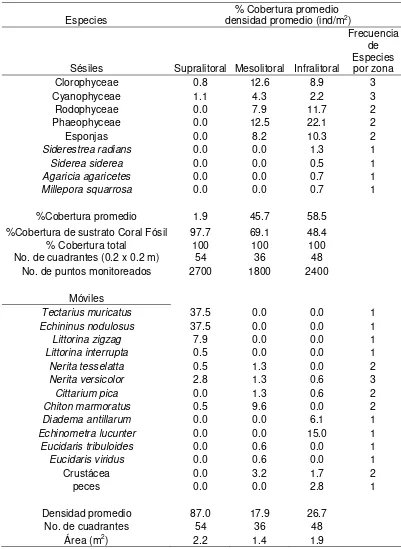
Tabla 5. Comparación espacial entre zonas (Supralitoral, mesolitoral e infralitoral) del porcentaje de cobertura promedio de la comunidad sésil y la densidad promedio de la comunidad móvil en el ecosistema de Litoral Rocoso San Andrés (Cove). Independientemente entre localidades y tiempo.
Especies densidad promedio (ind/m% Cobertura promedio 2)
Sésiles Supralitoral Mesolitoral Infralitoral
Frecuencia de Especies por zona
Clorophyceae 0.8 12.6 8.9 3
Cyanophyceae 1.1 4.3 2.2 3
Rodophyceae 0.0 7.9 11.7 2
Phaeophyceae 0.0 12.5 22.1 2
Esponjas 0.0 8.2 10.3 2
Siderestrea radians 0.0 0.0 1.3 1
Siderea siderea 0.0 0.0 0.5 1
Agaricia agaricetes 0.0 0.0 0.7 1
Millepora squarrosa 0.0 0.0 0.7 1
%Cobertura promedio 1.9 45.7 58.5
%Cobertura de sustrato Coral Fósil 97.7 69.1 48.4
% Cobertura total 100 100 100
No. de cuadrantes (0.2 x 0.2 m) 54 36 48
No. de puntos monitoreados 2700 1800 2400
Móviles
Tectarius muricatus 37.5 0.0 0.0 1
Echininus nodulosus 37.5 0.0 0.0 1
Littorina zigzag 7.9 0.0 0.0 1
Littorina interrupta 0.5 0.0 0.0 1
Nerita tesselatta 0.5 1.3 0.0 2
Nerita versicolor 2.8 1.3 0.6 3
Cittarium pica 0.0 1.3 0.6 2
Chiton marmoratus 0.5 9.6 0.0 2
Diadema antillarum 0.0 0.0 6.1 1
Echinometra lucunter 0.0 0.0 15.0 1
Eucidaris tribuloides 0.0 0.6 0.0 1
Eucidaris viridus 0.0 0.6 0.0 1
Crustácea 0.0 3.2 1.7 2
peces 0.0 0.0 2.8 1
Densidad promedio 87.0 17.9 26.7
No. de cuadrantes 54 36 48
Tabla 6. Comparación espacio-horizontal (entre localidades) del porcentaje de cobertura promedio en la comunidad sésil y densidad promedio de la comunidad móvil en el ecosistema Litoral Rocoso San Andrés (Cove). Independiente a zonas y años.
Especies densidad promedio (ind/m% de cobertura promedio y 2)
Sésiles Localidad Protegida Localidad Expuesta
Frecuencia de especies por localidad
Clorophyceae 15.6 2.9 2
Cyanophyceae 6.7 0.0 1
Rodophyceae 7.8 11.2 2
Phaeophyceae 18.2 9.4 2
Esponjas 0.8 0.3 2
Siderestrea radians 0.5 0.2 2
Siderea siderea 0.7 0.0 1
Agaricia agaricetes 0.0 0.4 1
Millepora squarrosa 0.0 0.3 1
Porites astreoides 0.4 0.0 1
%Cobertura promedio 44.1 25.1
%Cobertura de sustrato coral fósil 56 75
%Cobertura total 100 100
No. de cuadrantes(0.2 x 0.2 m) 63 75
No. de puntos monitoreados 3150 3750
Móviles
Tectarius muricatus 23.8 7.0 2
Echininus nodulosus 12.3 16.7 2
Littorina zigzag 5.2 1.3 2
Nerita tessellatta 0.0 1.0 1
Nerita versicolor 3.2 0.3 2
Cittarium pica 0.8 0.3 2
Chiton marmoratus 0.0 5.3 1
Diadema antillarum 0.0 3.7 1
Echinometra lucunter 0.0 9.0 1
Echinometra viridis 1.0 0.0 1
Eucidaris tribuloides 0.8 0.0 1
Crustácea 2.4 0.3 2
peces 1.2 0.3 2
Densidad Promedio 51.2 44.7
No. de cuadrantes 63 75
[image:40.612.149.487.147.705.2]Tabla 7. Comparación temporal del porcentaje de cobertura promedio en la comunidad sésil y densidad promedio de la comunidad móvil en el ecosistema de Litoral Rocoso San Andrés (Cove). El porcentaje de cambio es representado por los símbolos dónde (+) = ganancia, (-) = pérdida y espacio en blanco ( ) = no cambio respecto al t0 en el tiempo. Independientemente de zonas y años.
Especies 2004 2005 2006 % de cambio
Sésil
Clorophyceae 15.0 6.0 4.9 -
Cyanophyceae 0.9 0.0 0.0 -
Rodophyceae 11.9 10.0 6.9 -
Phaeophyceae 7.2 16.3 16.8 +
Esponjas 0.7 0.4 0.5 -
Siderestrea radians 0.0 0.0 1.0
Siderea siderea 0.3 0.3 0.2 -
Agaricia agaricetes 0.4 0.2 0.0 -
Millepora squarrosa 0.6 0.0 0.0 -
Porites astreoides 0.0 0.6 0.0
% Cobertura promedio 37.0 34.0 30.3 -
%Cobertura de sustrato coral fósil 63 66 70 +
% Cobertura total 100 100 100
No. de cuadrantes 46 46 46
No. de puntos monitoreados 2300 2300 2300
Móvil
Tectarius muricatus 28 16 0 -
Echininus nodulosus 0 0 44 +
Littorina ziczac 2 4 4 +
Littorina interrupta 0 1 0
Nerita tesselatta 0 0 2
Nerita versicolor 1 1 4
Cittarium pica 1 1 0 -
Chiton marmoratus 4 0 4
Diadema antillarum 0 4 2
Echinometra lucunter 10 1 4 -
Eucidaris tribuloides 0 0 1
Eucidaris viridus 0 0 1
Crustácea 3 1 1 -
Peces 2 1 0 -
Densidad Promedio 49 29 66 +
No. de cuadrantes 46 46 46
LISTA DE FIGURAS
Figura 1. Mapa de ubicación del área de estudio, localidad protegida
(Transecto 1 y 2) y localidad expuesta (Transecto 3) en la Bahía Cove, San Andrés
Isla.
Figura 2. Unidad de muestreo. Área del cuadrante de 20x20 cm dividido en
cuadrículas de 2x2 cm para la cuantificación de la comunidad sésil y móvil del Litoral.
A) Numeración de todos los puntos intersectos posibles (81 puntos) en el área del
cuadrante. B) Selección de los 50 puntos intersectos mediante una tabla de puntos
aleatorios, los cuales fueron implementados en el monitoreo permanente para la
cuantificación de sésiles. C) Esquema de la ubicación de los cuadrantes en el perfil
(los puntos dentro del cuadrante indican los organismos en el área). D) Marcación del
Figura 1.
N
E
S O
Bahía de Cove
Carretera Área de Estudio
150 m
Batallón N
S
O E
Isla
2.500m Mar Caribe
Figura 2.
A B