PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
DEPARTAMENTO DE MICROBIOLOGÍA
DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA DE LOS METABOLITOS SECUNDARIOS OBTENIDOS POR FERMENTACIÓN EN MEDIO LÍQUIDO DE Penicillium A14CVSFsp. NATIVO DEL PÁRAMO DE
CRUZ VERDE
DIANA MARÍA RIVERA MEZA
TRABAJO DE GRADO
Presentado como requisito parcial para optar al título de
Microbióloga Industrial Director
JORGE ROBLES CAMARGO PhD.
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL Bogotá, D.C.
DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA DE LOS METABOLITOS SECUNDARIOS OBTENIDOS POR FERMENTACIÓN EN MEDIO LÍQUIDO DE Penicillium A14CVSFsp. NATIVO DEL PÁRAMO DE
CRUZ VERDE
DIANA MARÍA RIVERA MEZA
APROBADO
_______________________________ _______________________ JANETH ARIAS PALACIOS INGRID SCHULER
DIRECTORA CARRERAS DE DECANA ACADÉMICA MICROBIOLOGÍA FACULTAD DE CIENCIAS
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL BOGOTÁ, D.C.
DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA DE LOS METABOLITOS SECUNDARIOS OBTENIDOS POR FERMENTACIÓN EN MEDIO LÍQUIDO DE Penicillium A14CVSFsp. NATIVO DEL PÁRAMO DE
CRUZ VERDE
DIANA MARÍA RIVERA MEZA
APROBADO
______________________________
JORGE ROBLES CAMARGO DIRECTOR
__________________________
LUIS DAVID GÓMEZ JURADO
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL BOGOTÁ, D.C.
NOTA DE ADVERTENCIA
“La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de grado Sólo velará por qué no se publique nada contrario al dogma y a la moral católica y porque las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia”.
AGRADECIMIENTOS
Al Grupo de Investigación de Fitoquímica de la Pontifica Universidad Javeriana (GIFUJ), que permitió el desarrollo de este trabajo.
Al Doctor Jorge Eliecer Robles Camargo por ser el director de este trabajo de grado, por su confianza y guía en este trabajo realizado.
A Andrea García Caycedo MsC, por todas sus enseñanzas, por compartirme su conocimiento, asesoría confianza y brindarme su amistad durante todo este tiempo.
A Jhon Edwar Díaz y Max Martínez por su colaboración y gran ayuda.
TABLA DE CONTENIDO
Pág
1. RESUMEN………..……….. 1
2. INTRODUCCIÓN……….. 2
3. MARCO TEÓRICO………... 3
3.1 Paramos en Colombia………. 3
3.2 Hongos filamentosos………... 3
3.3 Metabolitos secundarios………. 4
4. OBJETIVOS……… 4
4.1 Objetivo general………. 4
4.2 Objetivos específicos………... 4
5. METODOLOGÍA………. 5
5.1 Reactivación de la cepa……… 5
5.2 Elaboración del cultivo monopórico………... 5
5.3 Caracterización morfológica de la cepa……… 5
5.4 Cinética de crecimiento………. 6
5.5 Fermentación……… 6
5.6 Obtención del extracto crudo……….. 6
5.7 Extracción, fraccionamiento y caracterización de los metabolitos secundarios………. 6
5.8 Pruebas de actividad antimicrobiana………. 6
6. RESULTADOS Y DISCUSIÓN………. 7
7. CONCLUSIONES……… 13
8. RECOMENDACIONES………. 14
9. BIBLIOGRAFÍA………... 15
ÍNDICE DE FIGURAS
Pág
ÍNDICE DE ANEXOS
ANEXO 1.
Caracterización macroscópica y microscópica... 17
ANEXO 2.
Cultivo monospórico………...…………..19
ANEXO 3.
Composición de medios de cultivo usados………..… 20
ANEXO 4.
CCD seguimiento producción de metabolitos y Rf... 21
ANEXO 5.
CCD de las fracciones obtenidas………...… 22
ANEXO 6.
Resultados actividad antimicrobiana……….…… 23
ANEXO 7
ABREVIATURAS
AcOEt Acetato de etilo
Cm³ Centímetros cúbicos
CCD Cromatografía de Capa Delgada
CG Cromatografía de gases
DMSO Dimetilsulfóxido
DCM Diclorometano
EP Éter de petróleo
GIFUJ Grupo de investigación de fitoquímica universidad javeriana
g/L Gramo/Litro
g Gramos
h Horas
L Litros
mg Miligramos
µg Microgramos
mL Mililitros
µL Microlitros
µg Microgramo
min Minutos
PDA Papa Dextrosa Agar
Rf Relación de frente
R Replica
DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA DE LOS METABOLITOS SECUNDARIOS OBTENIDOS POR FERMENTACIÓN EN MEDIO LÍQUIDO DE Penicillium A14CVSFsp. NATIVO DEL PÁRAMO DE
CRUZ VERDE
1. RESUMEN
Los hongos filamentos se han caracterizado por ser productores de metabolitos secundarios con gran actividad biológica, en especial los hongos pertenecientes al género Penicillium sp. Colombia cuenta con gran cantidad de
recursos naturales en los cuales se pueden encontrar microorganismos nativos con gran potencial biotecnológico, por esta razón el presente trabajo tuvo como objetivo principal determinar si Penicillium A14CVSF nativo del páramo de Cruz
verde (Cundinamarca), producía en medio de cultivo líquido, metabolitos secundarios con actividad antimicrobiana.
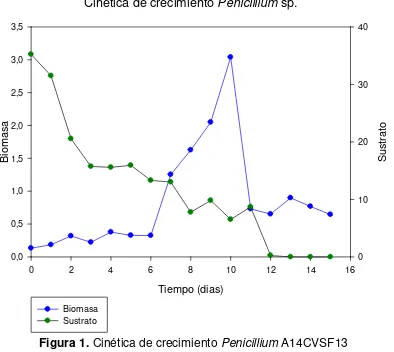
Para alcanzar dicho objetivo se reactivó la cepa que pertenece al banco de cepas del GIFUJ y posteriormente se realizó un cultivo monospórico con el fin de obtener un cultivo con un único genotipo. Se determinaron los parámetros cinéticos de crecimiento de la cepa ya antes mencionada, en medio de cultivo líquido Hanson durante 16 días, la cual arrojó como resultado un desarrollo primario durante los 10 primeros días de crecimiento y a partir del décimo día se empieza a dar un descenso en la producción de biomasa. Durante los 6 días restantes se produjo el desarrollo del metabolismo secundario, agotándose por completo el sustrato en el doceavo día. Estos parámetros cinéticos sirvieron como indicativo para llevar a cabo posteriormente la fermentación en medio de cultivo liquido Hanson con el fin de obtener en el extracto crudo total o fase acuosa los metabolitos secundarios producidos de forma extracelular durante el desarrollo secundario de la cepa.
Al extraer con solventes de baja, alta y mediana polaridad los metabolitos secundarios producidos, mediante la técnica de fraccionamiento liquido-líquido y evaluar la actividad antimicrobiana, se encontró que la fracción de acetato de etilo (alta polaridad), al ser evaluada mediante la técnica de difusión en disco de Kirby-Bauer, presentó actividad antimicrobiana contra las bacterias patógenas Gram positivas Listeria monocytogenes y Staphylococcus aureus al
igual que contra la bacterias Gram negativas Escherichia coli y Pseudomonas aeruginosa.
2. INTRODUCCIÓN
Actualmente la humanidad atraviesa por uno de los problemas con mayor incidencia poblacional, como es la decreciente eficacia de los antimicrobianos que hoy por hoy se encuentran en el mercado (Livermore, 2012). Esta problemática ha tenido tal impacto en la población humana que ha pasado de ser un problema considerado netamente clínico y académico a un problema de carácter político y social de alto nivel, ya que un número considerable de cepas de impacto desfavorable en la salud humana han desarrollado resistencia a los antibacterianos de mayor espectro como es el caso del grupo denominado ESKAPE por las iniciales de las cepas bacterianas Enterobacter spp., Staphylococcus aureus, Klebsiella spp., Acinetobacter baumannii complex., Pseudomonas aeruginosa., y Enterococus spp (García, 2012).
Las tasas elevadas de resistencia a un número importante de antibióticos, no solo han sido consecuencia de la mala implementación de protocolos de los agentes antimicrobianos ya existentes, sino también debido a la disminución progresiva del número de antimicrobianos novedosos comercializados en los últimos años. Ejemplo de esto se ha podido observar en Estados Unidos donde durante el periodo comprendido entre los años 2008 y 2009 en este país solo se introdujo un nuevo antibacteriano al mercado (García, 2012). Caso similar se presenta en España donde durante la última década del presente siglo este país solo ha comercializado cuatro antibióticos nuevos desde el punto de vista estructural y de mecanismo de acción (García, 2012). Estos hechos reflejan la urgente necesidad que existe de disponer de nuevos fármacos activos frente a bacterias de incidencia humana multirresistentes (García, 2012).
Desde el descubrimiento de la penicilina, los hongos micromicetes han sido ampliamente conocidos como productores de metabolitos secundarios con actividad biológica, en especial en la producción de compuestos con actividad antagónica contra otros microorganismos patógenos (Skaltsa, 2006)
Mucor sp., nativas de paramos colombianos, han presentado actividad
antimicrobiana contra distintos géneros bacterianos patógenos de alta incidencia poblacional (García, 2010 y Chaparro, 2010).
Como consecuencia de lo descrito anteriormente, el presente trabajo tuvo como objetivo general determinar si Penicillium A14CVSF13 nativo del páramo
de cruz verde (Cundinamarca), produce en medio de cultivo liquido metabolitos secundarios, con actividad antimicrobiana.
3. MARCO TEÓRICO 3.1 Páramos en Colombia
Los páramos son ecosistemas de gran importancia como reservorio de agua y de un gran número de especies de animales, vegetales y cepas microbianas nativas (Guhl, 1982).Claro ejemplo de esto es el páramo de Cruz verde que se encuentra ubicado en el kilómetro 10 al suroeste de la ciudad de Bogotá D.C, en la vía que conduce al municipio de Choachí (Cundinamarca) (Cuatrecasas, 1958) del cual, en el 2008 gracias a un estudio de Arias y Peñuela (Arias, 2008) y al ser un gran reservorio de organismo y microorganismo, a partir de muestras de suelo se obtuvieron cepas nativas de hongos filamentosos de diferentes géneros entre los que se encuentran Alternaria sp., Aspergillus sp., Cladosporium sp., Fusarium sp., Mucor sp., y Penicillium sp., entre otros.
(Arias, 2008).
3.2 Hongos Filamentosos
Los hongos filamentosos son microorganismos eucariotas, cuya pared celular esta compuesta por glucanos y quitina. La mayoría de los hongos filamentosos tienen metabolismo aerobio y se reproducen de manera sexual o asexual (esporas o conidios) y estos se han caracterizado por producir metabolitos principalmente de carácter secundario (Pontón, 2008).
Los hongos del genero Penicillium, son hongos filamentosos comúnmente
pincel conocidas como fiálides (Webster, 1986) también presentan diferentes tipo de conidióforos siendo monoverticilados
3.3 Metabolitos secundarios
Los metabolitos secundarios son sustancias bioactivas que se han empleado como moléculas antibacterianas, antifúngicas, antiparasitarias, antitumorales y antioxidantes, para ser aplicadas principalmente en farmacología clínica para la terapia humana, pero también son utilizados en la terapia animal, como conservantes de alimentos y en la agricultura como plaguicidas (Donadio, 2005).
4. OBJETIVOS: 4.1 Objetivo General
• Determinar si Penicillium A14CVSF13 nativo del páramo de Cruz verde
(Cundinamarca), produce en medio de cultivo líquido, metabolitos secundarios con actividad antimicrobiana.
4.2 Objetivos Específicos
• Determinar los parámetros cinéticos de la cepa Penicillium A14CVF13
nativa del páramo de Cruz verde y su relación con la producción de metabolitos secundarios en la idiofase.
• Extraer y detectar, mediante fraccionamiento líquido-líquido las sustancias producidas por la cepa de Penicillium A14CVF13 a partir de
fermentación en medio líquido.
• Evaluar la actividad antimicrobiana de las fracciones obtenidas de los metabolitos secundarios derivados del extracto crudo de la fermentación en medio líquido contra las bacterias patógenas Gram positivas
Staphylococcus aureus ATCC 6535 y Listeria monocytogenes ATCC y
las bacterias Gram negativas Escherichia coli ATCC 8739 y
5. METODOLOGÍA:
5.1 Metodología para cumplir el primer objetivo especifico
5.1.1 Reactivación de la cepa: Se reactivó la cepa de Penicillium
A14CVSF13, teniendo en cuenta que esta fue suministrada por el banco de cepas de la línea de Química microbiológica del GIFUJ, obtenida previamente a partir de muestras de suelo del Páramo de Cruz Verde (Arias, 2008). Para la reactivación de la cepa, se sembró una pequeña muestra del suelo en la cual estaba conservada, en PDA y posteriormente esto se llevó a incubar durante 7 días a una temperatura de 25°C. Una vez finalizado el periodo de incubación, se verificó la pureza del cultivo realizando una tinción de azul de lactofenol del micelio del hongo, observando que las características microscópicas y macroscópicas corresponden a la cepa antes señalada (García, 2010).
5.1.2. Elaboración de un cultivo monospórico: con el fin de obtener un cultivo con un único genotipo, se realizó un cultivo monospórico.
Para la obtención del cultivo monospórico se realizó una suspensión de conidios en tween80 al 1% (v/v), seguido de un recuento en cámara de Neubauer, determinando la dilución en base 10, donde se pudo obtener una concentración de 108 conidios/mL. Finalmente se sembró por agotamiento una asada de dicha concentración en medio PDA. Esto se llevó a incubar a 25°C durante 36 horas, hasta observar al primer conidio germinado, el cual posteriormente se le realizó un re-pase o repique en agar PDA (García, 2010).
5.1.4. Cinética de crecimiento: Para lograr obtener los datos de la cinética de crecimiento de la cepa Penicillium A14CVSF, se empleó la
metodología desarrollada por García, en el 2010, en la cual se evaluó el crecimiento de la cepa en medio de cultivo líquido Hanson durante 16 días, realizando muestreos periódicos cada 24 horas, cuantificando biomasa por la técnica de peso seco (García, 2010), y sustrato consumido mediante la técnica de DNS según Miller (Miller, 1959)
5.2 Metodología para cumplir el segundo objetivo especifico.
5.2.1 Fermentación: una vez determinada la cinética de crecimiento de la cepa se procedió a obtener los metabolitos secundarios realizando una fermentación en medio líquido Hanson, para lo cual se necesitó la preparación de un pre-inóculo a partir del cultivo monospórico, el cual correspondía al 10% del volumen final de la fermentación, con una concentración de 108 conidios/mL. (García, 2010).
5.2.2 Obtención del extracto crudo. Una vez terminado el tiempo de la fermentación se realizó un proceso de filtración, para obtener el extracto crudo o fase acuosa, donde se encontraron los posibles metabolitos secundarios extracelulares que posteriormente fueron evaluados (García, 2010).
5.2.3 Extracción, fraccionamiento y caracterización de los metabolitos secundarios: la extracción de los metabolitos presentes en el extracto crudo se realizó mediante el uso de solventes con 3 polaridades diferentes: éter de petróleo (baja polaridad), diclorometano (media polaridad) y acetato de etilo o etanol (alta polaridad) y la detección de los metabolitos secundarios obtenidos se realizó por medio de la técnica de cromatografía de capa fina y cromatografía de gases acoplada a detector de masas, comparando las sustancias obtenidas con la de la base de datos del equipo (García, 2010).
5.3 Metodología para cumplir el tercer objetivo especifico.
antimicrobiana contra bacterias Gram positivas y Gram negativas mediante la técnica de Kirby-Bauer de difusión en disco (Ramírez, 2009). Se realizaron estas pruebas frente a diferentes bacterias Gram positivas como Staphylococcus aureus, y Listeria monocytogenes, y
bacterias Gram negativas como fueron Escherichia coli y Pseudomonas
aeruginosa.
6. RESULTADOS Y DISCUSIÓN:
Al reactivar la cepa de Penicillium codificada como A14CVSF13, suministrada
por el banco de cepas de la línea de Química microbiológica del GIFUJ, proveniente del páramo de Cruz Verde (Arias, 2008), se verificó que la cepa efectivamente corresponde al género Penicillium (ver anexo 1).
Posteriormente con el fin de obtener un cultivo axénico, se realizó un cultivo monospórico (ver anexo 2), garantizando así el desarrollo de un único genotipo. A partir del cultivo monosporico se realizó la siembra de este microorganismo en diferentes medios de cultivo (Ver anexo 1)
Cinética de crecimiento Penicillium sp.
Tiempo (dias)
0 2 4 6 8 10 12 14 16
[image:17.595.104.498.78.430.2]B iom as a 0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 S us tr at o 0 10 20 30 40 Biomasa Sustrato
Figura 1. Cinética de crecimiento Penicillium A14CVSF13
Fuente: Elaboración propia
Como se puede observar en la figura 1, en cuanto a la cinética de crecimiento del microorganismo, este presentó una fase de adaptación significativamente larga de prácticamente cinco días, y posteriormente a esto a partir del sexto día, la cepa de Penicillium A14CVSF13, inició la fase logarítmica, obteniendo
iniciando la producción de metabolitos que no son esenciales en el crecimiento del microorganismo pero que son de gran interés industrial (Kavanagh, 2011), y que son el objetivo principal de este estudio.
[image:18.595.97.497.357.576.2]Junto con los parámetros ya mencionados que se evaluaron durante los 16 días que duró la cinética de crecimiento, también se realizó el seguimiento de los metabolitos producidos por la cepa estudiada mediante la técnica de cromatografía de capa delgada en sílica gel, para la cual se utilizaron dos solventes orgánicos, el éter de petróleo para extraer compuestos de baja polaridad y acetato de etilo para compuestos de alta polaridad. Observándose la separación de sustancias únicamente en el seguimiento de la fracción de acetato de etilo como se puede observar en la figura 2, donde los compuestos aparecieron después del día 12, lo cual coincide con la idiofase, que inició el día 11 (ver anexo 4).
Figura 2. Detección de metabolitos secundarios a partir de la cinética de crecimiento
a. Revelada con Luz UV onda larga 366nm
b. Revelada con Vainillina/H2SO4 Fuente: Elaboración propia
Una vez determinados los parámetros cinéticos para llevar a cabo la producción de metabolitos secundarios por parte de Penicillium A14CVSF13, se procedió a obtener los metabolitos secundarios realizando una fermentación en el mismo medio de cultivo líquido Hanson usado en el modelamiento
cinético, para lo cual se necesitó la preparación de un pre-inóculo a partir del cultivo monospórico, el cual correspondía al 10% del volumen final al cual se trabajó la fermentación, con una concentración de 108 conidios/mL. Se fermentaron 7 litros de medio de cultivo, a temperatura ambiente, durante dieciséis días, con una agitación de 175 rpm, esta última con el fin de proporcionar una transferencia de oxigeno y homogenización de los nutrientes del medio de cultivo con el fin de garantizar un adecuado crecimiento de la cepa (Doran, 1998). Terminado el tiempo de fermentación de procedió a separar la fase acuosa o extracto crudo total, mediante filtración con papel Whatman número 3, y se realizó la extracción de los metabolitos secundarios mediante la técnica de fraccionamiento liquido/liquido usando solventes con 3 polaridades diferentes: éter de petróleo (baja polaridad), diclorometano (media polaridad) y acetato de etilo (alta polaridad); obteniendo los rendimiento que se pueden observar a continuación en la tabla número 1.
Fracción
Obtenida Volumen Fraccionado Cantidad obtenida
Diclorometano 7 Litros 102.4mg
[image:19.595.88.514.367.478.2]Acetato de etilo 7 Litros 130.8 mg
Tabla 1. Rendimiento Producto sustrato de los extractos obtenidos Fuente: Elaboración propia
Aunque los rendimientos en la extracción de los metabolitos no fueron significativamente altos comparados con otros procesos industriales a partir de microorganismos, fueron suficientes para llevar a cabo las pruebas de evaluación de actividad antimicrobiana. A esta producción de metabolitos secundarios también se le realizó detección y separación por medio de la técnica de cromatografía de capa delgada (ver anexo 6).
Teniendo en cuenta que el objetivo principal de este estudio era determinar si
Penicillium A14CVSF13 nativo del páramo de Cruz verde (Cundinamarca),
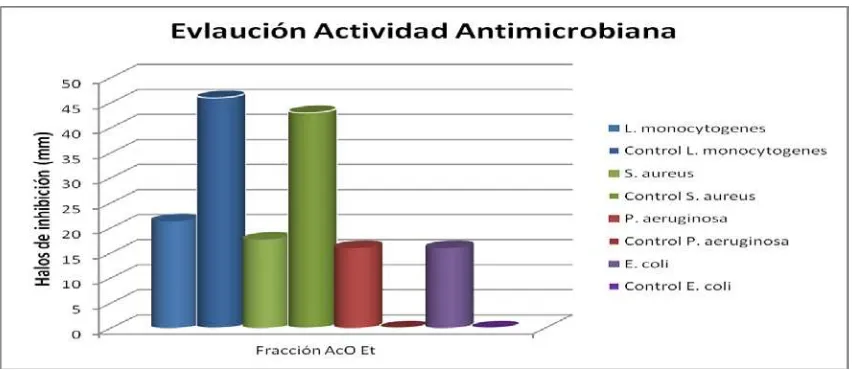
(Ramírez, 2009), para lo cual cada extracto fue preparado diluyendo 13500µg de la fracción evaluada (diclorometano ó acetato de etilo) en 180µL de dimetilsulfóxido (DMSO) e impregnando cada disco con 10µL, obteniendo así una concentración por disco de 750µg de extracto en 10 µL de DMSO. Esta evaluación se realizó por triplicado y además de ello se montó un control negativo de 10µL de DMSO al 100% por disco, y un control positivo usando ampicilina preparada a una concentración de 100µg/10µL. No se evaluó concentración mínima inhibitoria ni concentración máxima tolerada ya que no era objeto de este estudio. Los resultados obtenidos se presentan a continuación en la figura 3 junto con las figuras de los anexos 6 y 7, en lo cuales se puede observar que en el extracto de alta polaridad (acetato de etilo); se encontraran sustancias que produjeron actividad inhibitoria contra Listeria
monocytogenes, Staphylococcus aureus, Pseudomonas aeruginosa y Escherichia coli.
Figura 3. Resultados pruebas actividad antimicrobiana Fraccciòn acetato de etilo (izquierda) y Control positivo Ampicilina (derecha)
Fuente: Elaboración propia
Según la información obtenida al realizar la técnica de cromatografía de gases acoplada a espectrometría de masas; en la fracción de acetato de etilo que presentó actividad inhibitoria, se identificó una gran cantidad de sustancias, de las cuales 39 de éstas, presentaron un porcentaje de coincidencia mayor al 90%. Entre las sustancias identificadas, se obtuvieron compuestos como el 1-metil etilbenceno; el 1,2,4-tri1-metil benceno; el propilbenceno; el 1-etil-3-metilbenceno; 1,2,3-tri1-etil-3-metilbenceno; la acetofenona; el Bicyclo[3.1.1]hept-3-en-2-one; 4,6,6-trimethyl-, (1S)-; el acido hexadecaoico y el acido palmítico, entre otros (ver anexo 6).
Es importante mencionar que autores que Dorman HJ et al, en el 2000; Vukovic
N et al, en el 2007 y Jung EK, en 2009, han reportado algunos de estos
compuestos como metabolitos producidos por plantas de usos común como los son la pimienta, geranio, nuez moscada, orégano y tomillo, entre otras, y que de igual forma mostraron actividad antimicrobiana contra diferentes bacterias patógenas, entre las cuales están Staphylococcus aureus,
Pseudomonas aeruginosa, Escherichia coli y Listeria monocytogenes, la cuales
7. CONCLUSIONES:
• Se obtuvo actividad antibacteriana contra Staphylococcus aureus, Pseudomonas aeruginosa, Escherichia coli y Listeria monocytogenes
con la fracción de acetato de etilo a una concentración de 750µg de la fracción en 10 µL de DMSO.
• Se detectó la presencia de los compuestos: 1-metil etilbenceno, 1,2,4-trimetil benceno, Propilbenceno, 1,2,4-1,2,4-trimetil benceno, 1-etil-3-metilbenceno, 1,2,3-tri1-etil-3-metilbenceno, Acetofenona, Bicyclo[3.1.1]hept-3-en-2-one, 4,6,6-trimethyl-, (1S)-, acido n-Hexadecanoico, acid, hexadecanoico, ácido palmítico y ácido oleico, en la fracción de acetato de etilo, los cuales son reportados bibliográficamente como agentes con actividad antibacteriana.
• Se determinaron los parámetro cinéticos en el crecimiento de Penicillium
8. RECOMENDACIONES:
• Se recomienda ampliar el rango de bacterias para evaluar los extractos, con el fin de obtener un mayor espectro de actividad de dichas sustancias.
• Teniendo en cuenta que en cada extracto se encuentra una gran cantidad de sustancias, se recomienda la implementación de cromatografía en columna, como técnica de separación de los extractos obtenidos en fracciones, con el fin de conocer con mayor certeza cuales son las sustancias que están teniendo la actividad biológica con potencial biocida
• En lo que respecta a la cepa nativa usada, se recomienda que sea identificada su especie, para lo cual se recomienda usar métodos taxonómicos, moleculares y bioquímicos.
• Se recomienda la implementación de cromatografía en columna, como técnica de separación de los extractos obtenidos en fracciones, con el fin de conocer con mayor certeza cuales son las sustancias que están teniendo la actividad biológica con potencial biocida.
• Se recomienda, que para poder entender un perfil metabólico, que pueda indicar la producción de otros metabolitos con potencial biotecnológico por parte de la cepa evaluada, se haga uso de la técnica de resonancia magnética.
BIBLIOGRAFIA
• Arias EL, Piñeros PA. Aislamiento e identificación de hongos filamentos de muestra de suelo de los páramos de Guasca y Cruz Verde. Trabajo de pregrado. Facultad de Ciencias. Pontificia Universidad Javeriana, Bogotá D.C, 2008, 72 p.
• Chaparro A. Aislamiento e identificación de metabolitos producidos por la cepa nativa spg 321 de Mucor circinelloides y evaluación de su
actividad antimicrobiana. Trabajo de Grado de Maestría. Facultad de Ciencias. Pontificia Universidad Javeriana, Bogotá D.C, 2010, 99 p.
• Cuatrecasas J. Aspectos de la vegetación natural de Colombia. Revista académica de Colombia de Ciencia Exactas 1958; 10 (41): 221-264.
• Donadio S, Monciardini P, Alduina R, Mazza P, Chiocchini C, Cavaletti L, Sosio M. Bioactive Microbial Metabolites. The Journal of Antibiotics
2005; 58, 1–26.
• Doran P.M. 1998. Principios de ingeniería de los bioprocesos. Zaragoza, España, Acribia S.A.: p.468
• Dorman HJ, Deans SG. Antimicrobial agents from plants: antibacterial activity of plant volatile oils. Journal of applied microbiology 2000. 88:
308-316
• García JE, García E, Martín A, García E. Antibioterapia para el siglo XXI, antibacterianos para la segunda década ¿Posibilidades o realidades en un futuro?. Revista Española de Quimioterapia 2012; 25 (2): 100-121
• García A, 2010. Obtención de metabolitos secundarios a partir de una cepa nativa de Penicillium sp. SPG 91 y evaluación de su actividad antimicrobiana. Departamento De Cundinamarca. Grupo de
Pontificia Universidad Javeriana. Trabajo de investigación en proceso de publicación.
• Guhl E. Los Páramos Circundantes de la Sabana de Bogotá. Jardín
Botánico José Celestino Mutis. Bogotá, D.C., Colombia 1982.
• Jung EK. Chemical composition and antimicrobial activity of the essential oil of Chrysanthemum indicum against oral bacterial. Journal of
bacteriology and virology 2009. 39 (2): 61-69
• Livermore DM. Current epidemiology and growing resistance of Gram negative pathogens. The Korean Journal of internal medicine 2012. 27
(2): 128-142
• Miller, G. Use of dinitrosalicylic acid reagent of determination of reducing sugar, Analytical chemistry.1959, 3: 426-428.
• Pontón J. La pared celular de los hongos y el mecanismo de acción de la anidulafungina. Revista Iberoamericana de Micología 2008; 25, 78-82
• Skaltsa H, Rancic A, Sokovic M, Karioti A, Vukojevic J. Isolation and structural elucidation of two secondary metabolites from the filamentous fungus Penicillium ochrochloron with antimicrobial activity. Environmental
toxicology and pharmacology 2006. 22, 80-84.
• Vukovic N, Milosevic T, Sukdolak S, Solujic S. Antimicrobial activities of essential oil and methano extract of Teucrium montanu. 2007. 4: 17-20
ANEXO 1
Caracterización macroscópica y microscópica de Penicillium A14CVSFsp Características Macroscópicas Características
Microscópicas
Anverso
Color: Centro verde oliva y borde blanco.
Textura: Correosa y pulverulenta
Reverso
Color: blanco.
Textura: Correosa. Hifas hialinas y septadas, con presencia de
conidióforo, metulas, fialides y conidios globosos
Fuente: Elaboración propia
Anverso Reverso
PDA
Color: Centro verde oliva y borde blanco.
Textura: Correosa y pulverulenta
Color: blanco. Textura: Correosa
Color: Centro verde oliva y borde blanco.
Textura: Correosa y pulverulenta
Color: blanco. Textura: Correosa Presencia de pigmento
difusible en el medio
Extracto de Malta
Color: Centro verde oliva y borde blanco.
Textura: Algodonasa
Color: blanco. Textura: Correosa
Czapek Dox
Color: blanco.
Textura: Algodonasa Textura: Correosa Color: blanco.
Rosa de Bengala
Color: blanco.
Textura: Algodonasa Textura: Correosa Color: blanco.
ANEXO 2
Cultivo Monospórico de la cepa
a. Mosporico en PDA (anverso) b. Monosporico en PDA (reverso) Fuente: Elaboración propia
a
ANEXO 3
Composición medios de cultivo usados
• PGS (PAPA GLUCOSA SULFATO DE AMONIO AGAR)
PAPA 400g/L
SULFATO DE AMONIO (NH4)2SO4) 3g/L
GLUCOSA 20g/L
AGAR-AGAR 15g/L
Esterilizar a 121° C, a 15 psi durante 15 minutos
• MEDIO HANSON
GLUCOSA 20g/L
SULFATO DE AMONIO (NH4)2SO4) 8g/L
FOSFATO MONOBASICO DE POTASIO (KH2PO4) 5g/L
SULFATO DE MAGNESIO (MgSO4) 1g/L
Para la solución de microelementos, se debe preparar 100 mL y adicionar 2 mL por cada litro.
SULFATO FERROSO (FeSO4) 0.1g/100mL
SULFATO DE COBRE (Cu2SO4) 0.0015g/100mL
SULFATO DE ZINC (ZnSO4) 0.016g/100mL
MOLIBDATO DE AMONIO (NH4) Mo7024* 4H2O 0.1g/100mL
DINITROCOBALTO 0.01g/100mL
Esterilizar a 121° C, a 15 psi durante 15 minutos
• EXTRACTO DE MALTA AGAR
EXTRACTO DE MALTA 30g/L
PEPTONA 5g/L
AGAR-AGAR 15g/L
Esterilizar a 121° C, a 15 psi durante 15 minutos
• MUELLER HINTON AGAR
INFUSIÓN DE CARNE 300g/L
ALMIDÓN 1.5g/L
PEPTONA DE CASEÍNA 17.5g/L
ANEXO 4
CCD Fracción Acetato de etilo, seguimiento producción de metabolitos cinética de crecimiento
Fuente: Elaboración propia
Cromatografía en capa fina del extracto obtenido por fermentación en medio liquido Hanson. Fracción Acetato de etilo. Fase móvil
diclorometano y metanol en proporción de 9,5:0,5. A: revelado con luz UV onda larga 336nm. B: Revelado con Vainillina
ANEXO 5
Cromatografía de capa delgada (CCD) de las fracciones obtenidas
a. CCD Fracción AcOEt Revelado Luz UV de longitud onda larga
b. CCD Fracción AcOEt Revelado Luz UV de de longitud onda corta
c. CCD Fracción DCM Revelado Luz UV de de longitud onda larga
d. CCD Fracción DCM Revelado Luz UV de de longitud onda corta
ANEXO 6
Resultados evaluación actividad antimicrobiana fracción AcOEt
[75ug/µL] (mm) R1 (mm) R2 (mm) R3 Promedio (mm) Diámetro Disco (mm)
Inhibición real
(mm) Ampicilina Control +
Listeria
monocytogenes 33 27 25 28 7 21 54
Pseudomonas
aeruginosa 24 23 22 23 7 16 0
Staphylococcus
aureus 25 23 26 25 7 18 49
Escherichia coli ND 19 ND 23 7 16 0
a. Actividad antimicrobiana fracción AcOEt, contra Pseudomonasaeruginosa
Fuente: Elaboración propia R3
R2
R1
+
-b. Actividad antimicrobiana fracción AcOEt, contra Listeria monocytogenes
Fuente: Elaboración propia
a. Actividad antimicrobiana fracción AcOEt, contra Escherichia coli
Fuente: Elaboración propia R3
R2
R1
+
-R3
R2
R1
+
-a. Actividad antimicrobiana fracción AcOEt, contra Staphylococcus aureus
Fuente: Elaboración propia R1
R3
R2
+
-ANEXO 7
a. Cromatograma general (Cromatografía de gases acoplada a masas) Fracción AcOEt
b. Resultado cromatografía de gases acoplada a masas
COMPUESTO ENCONTRADO Tiempo de
retención % Coinciden
cia
Nombre Estructura
1-metil etilbenceno
Fuente:
http://webbook.nist.gov
2.825 min
3.323 min 90 y 97 93
1,2,4-trimetil benceno Fuente: http://webbook.nist.gov 2.825 min 3.408 min 3.455 min
87 y 91 97 97
Propilbenceno
Fuente: http://webbook.nist.gov
3.021 min 94
1-etil-2-metilbenceno Fuente: http://webbook.nist.gov 3.153 min 3.323 min 3.408 min 3.455 min 95 94 95 95 1-etil-3-metilbenceno Fuente: http://webbook.nist.gov 3.153 min
3.323 min 91 93
1-etil-4-metilbenceno 3.153 min
3.323 min 3.768 min
Fuente: http://webbook.nist.gov
1,2,3-trimetilbenceno
Fuente: http://webbook.nist.gov
3.408 min
3.455 min 95 y 97 94
1,3,5-trimetilbenceno
Fuente: http://webbook.nist.gov
3.408 min
3.455 min 97 95
Ciclopropilbenceno
Fuente: http://webbook.nist.gov
3.927 min 93
Indane
Fuente: http://webbook.nist.gov
3.927 min 90
Acetofenona
Fuente: http://webbook.nist.gov
4.260 min 92
1,2,3,5-tetrametilbenceno
Fuente: http://webbook.nist.gov
1,2,3,4-tetrametilbenceno
Fuente: http://webbook.nist.gov
4.837 min 91
Dehydromevalonic lactone
Fuente: http://webbook.nist.gov
5.446 min 91
Bicyclo[3.1.1]hept-3-en-2-one, 4,6,6-trimethyl-, (1S)-
Fuente: http://webbook.nist.gov
6.061 min 93
2-coumaranone
Fuente: http://webbook.nist.gov
6.373 min 91
2(3H)-benzofuranone
Fuente: http://webbook.nist.gov
6.373 min 91
Hydroquinone
Fuente: http://webbook.nist.gov
6.918 min 90
1,4-Benzenediol
Fuente: http://webbook.nist.gov
Indol
Fuente: http://webbook.nist.gov
7.162 min 93
Indolizine
Fuente: http://webbook.nist.gov
7.162 min 90
1H-indole
Fuente: http://webbook.nist.gov
7.162 min 93
1,3-isobenzofurandione (CAS)
7.453 min 91
3,5-dihydroxytoluene
Fuente: http://webbook.nist.gov
8.195 min 96
1,3-benzenediol, 5-methyl (CAS) 8.195 min 90
1H-Cyclopropa[a]naphthalene,
1a,2,3,3a,4,5,6,7b-octahydro-1,1,3a,7-tetramethyl- 8.623 min 92
Valencene 1 8.623 min 91
n-Hexadecanoic acid
Fuente: http://webbook.nist.gov
14.676 min 99
Hexadecanoic acid
Fuente: http://webbook.nist.gov
Acido palmítico 14.676 min 99
3,1,2-Azaazoniaboratine, 2,2-
(1,5-cyclooctanediyl)-4,6-diethyl-2,3-dihydro-5-methyl 14.920 min 97
1-Phenanthrenol,
tetradecahydro-4b,8,8-trimethyl-,
[1R-(1.alpha.,4a.beta.,4b.alpha.,8a.b eta.,10a.alpha.)]-
16.132 min 90
Oleic Acid
Fuente: http://webbook.nist.gov
16.344 min 99
9-Octadecenoic acid (Z)
Fuente: http://webbook.nist.gov
16.344 min 99
[5-methoxy-2-(naphthalen-2-ylazo)-phenyl]-methanol 18.060 min 90
phosphine oxide, benzyl menthyl
methyl- 19.071 min 96
Acido docosanoic 19.860 90
2,6,10,14,18,22-Tetracosahexaene, 2,6,10,15,19,23-hexamethyl-, (all-E) Fuente: http://webbook.nist.gov
21.777min 97
Squalene
Fuente: http://webbook.nist.gov
ANEXO 2
CARTA DE AUTORIZACIÓN DE LOS AUTORES (Licencia de uso)
Bogot á, D.C. , 06 de Febrero 2014
Señores
Bibliot eca Alf onso Borrero Cabal S.J. Pont if icia Universidad Javeriana Cuidad
Los suscrit os:
Diana María Rivera Meza , con C.C. No 1.020.750.292
, con C.C. No , con C.C. No
En mi (nuest ra) calidad de aut or (es) exclusivo (s) de la obra t it ulada:
Determinación de la actividad antimicrobiana de los metabolitos secundarios obtenidos por fermentación en medio líquido de Penicillium A14CVSF sp. nativo del páramo de cruz verde
(por f avor señale con una “ x” las opciones que apliquen) Tesis doct oral Trabaj o de grado X Premio o dist inción: Si No x cual:
present ado y aprobado en el año 2013 , por medio del present e escrit o aut orizo (aut orizamos) a la Pont if icia Universidad Javeriana para que, en desarrollo de la present e licencia de uso parcial, pueda ej ercer sobre mi (nuest ra) obra las at ribuciones que se indican a cont inuación, t eniendo en cuent a que en cualquier caso, la f inalidad perseguida será f acilit ar, dif undir y promover el aprendizaj e, la enseñanza y la invest igación.
En consecuencia, las at ribuciones de usos t emporales y parciales que por virt ud de la present e licencia se aut orizan a la Pont if icia Universidad Javeriana, a los usuarios de la Bibliot eca Alf onso Borrero Cabal S.J., así como a los usuarios de las redes, bases de dat os y demás sit ios web con los que la Universidad t enga perf eccionado un convenio, son:
AUTORIZO (AUTORIZAMOS) SI NO
1. La conservación de los ej emplares necesarios en la sala de t esis y t rabaj os
de grado de la Bibliot eca. x
2. La consult a f ísica (sólo en las inst alaciones de la Bibliot eca) x 3. La consult a elect rónica – on line (a t ravés del cat álogo Biblos y el
Reposit orio Inst it ucional) x
4. La reproducción por cualquier f ormat o conocido o por conocer x 5. La comunicación pública por cualquier procedimient o o medio f ísico o
elect rónico, así como su puest a a disposición en Int ernet x 6. La inclusión en bases de dat os y en sit ios web sean ést os onerosos o
grat uit os, exist iendo con ellos previo convenio perf eccionado con la Pont if icia Universidad Javeriana para ef ect os de sat isf acer los f ines previst os. En est e event o, t ales sit ios y sus usuarios t endrán las mismas f acult ades que las aquí concedidas con las mismas limit aciones y condiciones
x
ANEXO 3
BIBLIOTECA ALFONSO BORRERO CABAL, S.J. DESCRIPCIÓN DE LA TESIS O DEL TRABAJO DE GRADO
FORMULARIO
TÍTULO COMPLETO DE LA TESIS DOCTORAL O TRABAJO DE GRADO
DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA DE LOS METABOLITOS SECUNDARIOS OBTENIDOS POR FERMENTACIÓN EN MEDIO LÍQUIDO DE Peni ci l l i um a14cvsfsp. NATIVO DEL PÁRAMO DE CRUZ
VERDE
SUBTÍTULO, SI LO TIENE
AUTOR O AUTORES
Apellidos Completos Nombres Completos
RIVERA MEZA DIANA MARÍA
DIRECTOR (ES) TESIS O DEL TRABAJO DE GRADO
Apellidos Completos Nombres Completos
ROBLES CAMARGO JORGE ELIECER
FACULTAD CIENCIAS BASICAS PROGRAMA ACADÉMICO
Tipo de programa ( seleccione con “ x” )
Pregrado Especialización Maest ría Doct orado X
Nombre del programa académico MICROBIOLOGÍA INDUSTRIAL
Nombres y apellidos del director del programa académico JANETH ARIAS PALACIOS
TRABAJO PARA OPTAR AL TÍTULO DE: MICROBIOLOGA INDUSTRIAL
PREMIO O DISTINCIÓN (En caso de ser LAUREADAS o t ener una menci ón especi al ):
CIUDAD AÑO DE PRESENTACIÓN DE LA TESIS
O DEL TRABAJO DE GRADO
NÚMERO DE PÁGINAS
BOGOTÁ 1-2013
TIPO DE ILUSTRACIONES ( seleccione con “ x” )
Dibuj os Pint uras Tablas, gráf icos y diagramas Planos Mapas Fot ograf ías Part it uras
X X
SOFTWARE REQUERIDO O ESPECIALIZADO PARA LA LECTURA DEL DOCUMENTO
[image:43.612.80.547.94.656.2]MATERIAL ACOMPAÑANTE
TIPO DURACIÓN (minutos) CANTIDAD FORMATO
CD DVD Ot ro ¿Cuál? Vídeo
Audio Mult imedia Producción elect rónica Ot ro ¿Cuál?
DESCRIPTORES O PALABRAS CLAVE EN ESPAÑOL E INGLÉS
Son los t érminos que def inen los t emas que ident if ican el cont enido. (En caso de duda par a desi gnar est os descr i pt or es, se r ecomi enda consul t ar con l a Secci ón de Desar r ol l o de Col ecci ones de l a
Bi bl i ot eca Alf onso Borrero Cabal S.J en el cor r eo bi bl i ot eca@j aver i ana. edu. co, donde se l es
or i ent ar á).
ESPAÑOL INGLÉS
Met abolit os secundarios Secondary met abolit es Act ividad ant imicrobiana Ant imicrobial act ivit y
Peni ci l l i um sp Peni ci l l i um sp
Met abolismo secundario Secondary met abolism
Cepa nat iva Nat ive st rain
RESUMEN DEL CONTENIDO EN ESPAÑOL E INGLÉS (Máximo 250 palabras - 1530 caract eres)
Resumen Español
La cepa nat iva Peni ci l l i um A14CVSF sp., aislada del páramo de Cruz Verde, produj o met abolit os secundarios con act ividad ant imicrobiana cont ra las cepas bact erianas Li st er i a monocyt ogenes,
St aphyl ococcus aur eus, Escher i chi a col i and Pseudomonas aer ugi osa. La producción de est os
met abolit os f ue llevada a cabo mediant e proceso de f erment ación aerobia, en medio de cult ivo Hanson a una t emperat ura de 25°C durant e 15 días. Se observó la capacidad de la cepa para producir dif erent es met abolit os mediant e la t écnica de cromat ograf ía de capa f ina y la act ividad ant imicrobiana f ue det erminada mediant e por el mét odo de Kirby y la act ividad ant imicrobiana f ue det erminada de acuerdo al mét odo de Kirby-Bauer.
Resumen Ingles
The nat ive st rain Peni ci l l i um A14CVSF sp., isolat ed of Páramo de Cruz Verde produced secondary met abolit es wit h ant imicrobial act ivit y against Li st er i a monocyt ogenes, St aphyl ococcus aur eus,
Escher i chi a col i and Pseudomonas aer ugi osa. The product ion of secondary met abolit es was carried