UNIVERSIDAD AUTóNOMA METROPOLITANA
lztapalapa
,DIVISIóN DE CIENCIAS BIOLóGICAS Y DE LA SALUD
Lic. En Biología Experimental
Servicio Social presentado por
Saú1 Soberanes Arias
Mat. 94327965
OBTENCIóN DE HEPATOCITOS DIFERENCIADOS
Y CRIOPRESERVACI~N
Clave BE.021.99
Asesora: Dra. Concepción Gutiérrez Ruiz.
a.
Introducción
El hígado es la glándula de mayor tamaño en el cuerpo humano. Tiene una masa entre
el 2 y el 5% del peso del cuerpo y se encuentra dividido en dos lóbulos principales y dos
accesorios irrigados con un doble abastecimiento de sangre: la vena porta y la arteria
hepática. Estos canales lo ponen en contacto con endobióticos y xenobióticos así como
substancias tóxicas provenientes del sistema digestivo. En éI se lleva a cabo la
biotransformación hepática, que convierte sustancias hidrofóbicas en compuestos solubles en
agua para eliminarlos por la bilis y orina. Es también el mayor sitio de fagocitosis y su
arquitectura esponjosa le permite regular el volumen sanguíneo (Desmet 1994, Alberts et al,
1989).
Las células parenquimatosas del hígado, los hepatocitos, conforman el 65% de las
células y corresponden al 80% del volumen hepático y son la unidad íüncional de este
órgano. Son responsables de la síntesis, degradación y almacenamiento de un gran número de
sustancias, tienen una hnción importante en el metabolismo de lípidos y carbohidratos y
secretan la mayoría de las proteínas que se encuentran en el plasma sanguíneo. También
participan en el ciclo de la urea, regulación específica del metabolismo de lípidos, forman
bilirrubina y ácidos biliares. Se mantienen conectados con el lumen intestinal por medio de
canalículos y ductos mayores a través de los cuales secretan productos de desecho de su
metabolismo y un agente emulsificante que ayuda a la digestión de grasas: la bilis.
Los hepatocitos se encuentran acompañados por cuatro tipos celulares no
. parenquimatosos asociados con los sinusoides: células endoteliales, macrófagos residentes o
células de Kupffer, células “pit” y células estelares hepáticas (Fawcett 1989).
El ciclo celular de los hepatocitos es lento y está finamente controlado. Sin embargo,
se puede estimular rápidamente cuando se da una destrucción masiva de células. En ratones,
se puede regenerar el 66% de células que han sido escindidas en tan solo dos semanas. La
importancia del balance en la regeneración de todos los tipos celulares del hígado se
demuestra dramáticamente cuando ocurre un desequilibrio, por ejemplo, cuando los
U.
A.
M.
IZTAPALAPA
8lBLlOTECA
intervalos lo suficientemente frecuentes que impidan la regeneración completa entre ataques,
la liberación de varias citocinas estimulan a las células estelares aumentando la producción de
transcriptos de procolágeno, y el hígado es obstruido con tejido conectivo, dejando poco
espacio para que los hepatocitos se multipliquen aún cuando el agente tóxico. ha sido
removido (Desmet 1994). Esta condición es la llamada cirrosis y es, junto con la hiperplasia
regenerativa compensatoria, la principal enfermedad hepática crónica (Alberts et al 1989).
Enfermedades Hepáticas.
Son muchas las enfermedades que afectan a la mayor glándula del cuerpo, y pueden
de origen hereditario o bien, adquiridas. Algunas de ellas son las siguientes:
b
Enfermedad ]Sintornas \Causa
Ictericia I lexceso de bilirrubina
IHepatomegalia
1 I
Trastorno en la secreción de bilis ]causas mecánicas Aumento en el tamaAo del hígado
Presión sanguínea mayor a 4mmHg. la principal causa es la cirrosis Mas que la vena hepática
Presencia de líauido libre en la cavidad Deritoneal
IComa heDático I
IDegeneraciÓn grasa del hígado lexceso de peso IHepatopatía alcoholica ]ingesta de alcohol
Fibrosis
Hepatitis
esclerosante
respuesta contra necrosis o lesiones hepatocelulares
desorganización difusa de la estructura hepática normal por nódulos regenerativos rodeados de tejido fibroso
~ ~ _ _ _
Proceso inflamatorio caracterizado por una necrosis hepatocelular difusa o
virus, laptospirosis, alcohol y fármacos
focal que afecta todos los acinos
I
Inflamación fibrosante de los ldéficit deantitriDsina a-I ( M T I conductos biliares interhepáticos y
I
\ I extrahepáticos
Calculos biliares
I
]Vesícula biliar fibrosa Enfermedad
autoinmune
Hiperreactividad inrnunológica
Enfermedades hereditarias
Deficiencia de antitripsina Alfa-I
Desórdenes en el metabolismo de aminoácidos. -tirosinemia hereditaria
-histidhernia -homocystinuria -hiperfenilalaninemia -Fenilcetonuria
-defectos hereditarios de ureagknesis Des6rdenes de bilirubina
-sindrome de Crigler-Najjar
Desórdenes de slntesis y transporte de bilis Desórdenes en el metabolismo de carbohidratos
-galactosemia
-enfermedad de almacenamiento de glucbgeno
(Gupta et al 1999)
-intolerancia hereditaria a la fructosa -enfermedad de Von Gierke
Protoporfiria eritropoyética Hipercolesterolemia familiar Enfermedad de Gaucher Hemofilia
Deficiencia del factor IX Angioedema hereditario Enfermedad de Niemann-Pick
Desórdenes en el metabolismo de peroxisomas Enfermedad de Wilson
Desórdenes adquiridos -falla hepática aguda -hepatitis viral crónica
-falla hepática crónica y cirrosis
Algunas enfermedades disminuyen en gran medida
l a
calidad de vida de los pacientes,como el síndrome de Crigler-Najjar que es una enfermedad producida por errores en la proteína
uridin difosfoglucoronato (UDP) glucoronosiltransferasa. Esta proteína defectuosa es incapaz de
conjugar bilirrubina, lo cual da como resultado una gran concentración de bilirrubina libre la cual
produce problemas y muerte neurológicos. Para las personas que sufren de este síndrome, el
tratamiento a seguir consiste en fototerapias. También existen enfermedades hepáticas que no
afectan al hígado en si y dan como resultado problemas extrahepáticas como oxalosis hereditaria,
deficiencia del Factor IX y amiloidosis familiar (Lake 1998). Cuando hay falla hepática fulminante (FHF) la peor de las complicaciones se debe al aumento en la presión sanguínea cerebral que causa un edema por la acumulación en la sangre de bilirrubina, alanin-aminotransferasa, fosfatasa alcalina
y urea (Rust, Gores 2000). La mortandad en esos casos es superior al 80% una vez que se ha
alcanzado la encefalopatía de grado IV. (Habibullah et al 1994)
El transplante de hígado se ha investigado tanto en animales como en humanos durante
hepáticas metabólicas (Fox 1999). El enemigo principal del transplante de hígado es la baja
cantidad de órganos disponibles para transplante (Lake 1998, Gupta et al 1999, Strom et al 1997). Esto provoca que al año mueran miles de personas alrededor del mundo mientras están en lista de
espera. En otros casos, el OLT (transplante ortotópico de hígado, siglas en Inglés) es imposible
debido a factores económicos (tiene un costo aproximado de US$28,500) y sociales (como la
religión) o porque no existe la infraestructura adecuada. El transplante ortotópico es un
procedimiento extremadamente complicado para los pacientes, grupos de médicos y los
encargados de cuidar a los pacientes (Gupta et al 1999). Aún con los esfierzos realizados para
conseguir donadores, el número de pacientes en la lista de espera continúa creciendo. En los
EE.UU. el número de donadores y transplantes se incrementó 2.4 veces entre los años 1988 y
1996, mientras el número de pacientes que requieren un órgano aumentó 12.1 veces. La gran falta
de donadores ha suscitado discrepancias sobre a quien se le debe dar prioridad. El aumento de
gente en la lista de espera produce que los pacientes sean tratados cuando su mal está muy
avanzado (Brown, Moonka 1999).
El transplante completo de hígado sigue siendo la mejor opción, pero es caro, requiere
inmunosupresión de por vida y no hay disponibilidad suficiente de órganos (Lake 1998). También
es causa de infecciones como el citamegalovirus que se encuentra asociado con morbilidad y
mortalidad de los receptores, incluida la trombosis arterial hepática temprana. El tratamiento
antiviral en los pacientes transplantados disminuye la incidencia de infecciones hasta en un 50%. La hepatitis es el mayor indicador de transplante ortotópico, especialmente del tipo C (Brown,
Moonka 1999).
En un intento por aumentar el número de donadores, se ha implementado el transplante de
donador viviente, en donde uno de cada 200 donadores presenta complicaciones. Otras
alternativas son el transplante dominó en el cual se utiliza un órgano cadavérico una vez mas
cuando el receptor ha muerto, y el transplante auxiliar en el cual se transplanta un segmento de
hígado sin remover el original (Lake 1998). En modelos animales con falla hepática filminante, la
infusión de extractos citosólicos o medios de cultivo de células hepáticas ha sido demostrada de
por qué son efectivos y hasta qué grado son suficientes (Rust, Gores 2000; Gupta,,Chowdhury
1992). El transplante de hepatocitos se presenta al momento como la mejor solución, pero al igual
que el transplante hepático tiene el problema del uso de inmunosupresores sin los cuales el
transplante no tiene éxito, y aún cuando cada vez hay mejores en el mercado, algunos pacientes
responden negativamente al fármaco y no es posible saberlo hasta que el transplante ha sido
realizado. (Brown, Moonka 1999)
Los hígados bioartificiales (BALs), que utilizan encapsulados de células que se perfinden
con el suero de pacientes extracorporalmente, estan siendo examinados como pruebas terapéuticas
para mantener con vida a pacientes que han desarrollado falla hepática. En caso de tener éxito, su
uso será preferente frente al transplante de hepatocitos, ya que no requiere de células de origen
humano, inmunosuopresión ni periodos de adaptación e integración celular, pero en todo caso el
soporte que son capaces de proporcionar será solamente temporal en lo que se lleva a cabo el
OLT o en lo que se recupera el hígado nativo. (Rust, Gores 2000)
El transplante de hepatocitos mantiene ventajas sobre -el transplante de hígado puesto que
las células aisladas pueden ser criopreservadas para usarse cuando sean requeridas y pudieran ser
modificadas genéticamente para prevenir el rechazo, con lo que se evita la administración de
inmunosupresores. Adicionalmente, el transplante de células no interfiere con el transplante de
hígado en caso de que este sea necesario y se encuentre disponible. (Fox 1999) Una vez
transplantados los hepatocitos donados proliferan expresando hnciones diferenciadas de manera
casi idéntica a su estado natural y se mantienen por el resto de la vida del receptor, tienen un
menor costo económico que el OLT, es un proceso menos traumático al no requerir cirugía (el transplante por técnicas transcateter son simples), las suspensiones celulares son menos
inmunogénicas que los órganos sólidos. El transplante de células puede ser utilizado para
autotransplantes, en los cuales las células del paciente son manipuladas ex vivo y después
reintroducidas al hígado (procedimiento que ha sido ya utilizado en conejos dando buenos
resultados).
Una pequeña cantidad transplantada de hepatocitos puede ser suficiente para crear una
diferencia en la calidad de vida de personas con trastornos metabólicos. Por dar un ejemplo, la
transplantar el 5.5% del total de la masa hepática de quien sufre este trastorno (Lake 1998;
Grompe et al 1999). El transplante de células es considerado como un procedimiento reversible ya
que no se remueve el hígado original. Mas aún, el problema de rechazo del transplante no
representa mayor problema ya que las células no viables son fácilmente rechazadas.
Adicionalmente, los hepatocitos pueden ser criopreservados, un solo donador puede ser suficiente
para varios receptores, pueden utilizarse órganos cuyas condiciones que le impidan el transplante
completo, tiene un costo inicial de aproximadamente el 10% del costo de OLT y en el tratamiento
de desórdenes metabólicos se ahorra la hospitalización. Los hígados que se utilizan serian de todos
modos desechados, dejando mayor cantidad de órganos en buen estado para los pacientes que no
pueden ser tratados con transplante de hepatocitos (Strom et al 1997).
Aislamiento de hepatocitos.
Los primeros esfuerzos que se realizaron para obtener hepatocitos aislados se llevaron a
cabo entre los años 1940 y 1965 con una técnica que destruía las uniones celulares estrechas al
agitar ,rebanadas de hígado en un medio libre de calcio, pero que producía la muerte de la mayoría
de las células.
En el año 1967 Howard y sus colegas obtuvieron hepatocitos de rata intactos. Para ello
utilizaron la colagenasa aislada de Clostridium histolyticum que fuera utilizada por Lasfargues en
la separación de epitelio mamario en 1957 y por Rodbell en la obtención de adipocitos intactos en
1964. El método contenía solución salina balanceada (medio de Hank) libre de calcio y una
. concentración de enzima colagenasa de 0.05%, mas hialuronidasa al 0.1%. Con este método se
obtuvo una sobrevivencia del 3 al 5% de las células hepáticas presentes en el peso total de hígado
tratado.
El uso de medios libres de calcio durante la separación de células dejó de ser utilizado
cuando en 1969, Berry y Friend reconocieron que durante la pefisión de células con estos medios
producen la invaginación de las regiones membranales que contienen desmosomas. Estas
invaginaciones provocan subsecuentemente la formación de endosomas y formación de vacuolas
en un proceso irreversible aún con la restitución de calcio en el medio. Como alternativa se
inventó la separación en dos pasos propuesta por Seglen en 1976. En ella, se utiliza primero un
medio libre de calcio durante 10 minutos al final de los cuales se cambia por otro que contiene
calcio en baja concentración y colagenasa. En este proceso se restituye el calcio a la célula mucho
más rápido que en las separaciones de un solo paso, y es el método que se utiliza hasta nuestros
días, con solo unos pocos cambios como la utilización de enzimas mejor separadas y más
específicas, y el uso de EDTA en la primera etapa (Berry et al 1997). Sin embargo, todavía existen
muchos problemas para aislar hepatocitos de fragmentos grandes de hígado ya que es dificil
adaptar las técnicas de perfhión utilizadas en pequeños roedores hasta animales grandes como
cerdos o humanos debido a la gran cantidad de reactivos que se necesitan, o por que se utilizan
técnicas sin pefisión que presentan muy baja viabilidad y pureza, o se utiliza una perfbsión muy
larga entre 30 y 45 minutos. Los mejores resultados con humanos se obtuvieron al trabajar cortes
entre 5 y 49 gramos. Se cultivaron las células en medio Leibowitz L-15 complementado con
albúmina bovina e insulina el cual se cambió a los 20 minutos por medio Ham F12 complementado
con insulina, albúmina bovina, insulina, suero fetal y penicilina-estreptomicina La viabilidad de las
células fue desde 50% hasta 95%, mas la eficiencia fue muy buena: 1 .4x107 células por gramo de
hígado (Ballet et al 1984).
Las células sembradas se pegan al plástico y se comienzan a agregar durante las primeras 4
horas, y se pueden observar monocapas subconfluentes durante las primeras 24 horas en cultivo.
Las células forman poliedros arreglados en trabéculas los primeros días, cuando la mayoría de los
hepatocitos son binucleados con nucleolos prominentes e inclusiones refringentes presentes en el
citoplasma. Entre los días cuatro y cinco las células se tornan menos regulares y con grandes
proyecciones citoplásmicas; los bordes de las células se vuelven menos notorios, las vacuolas se
acumulan en el citoplasma y no se aprecia división celular.. Finalmente al final de la segunda
semana se desprenden las células de las paredes plásticas. Este destino se puede cambiar con el
uso de cocultivos (de varios tipos celulares) o con la adición de componentes de la matriz
extracelular a las cajas de cultivo, como la fibronectina que facilita la formación de estructuras
elongadas, remiscentes de organización hepática en forma de plato. Tambien ayudan el factor de
crecimiento epidérmico (EGF) y el factor de crecimiento de hepatocitos (HGF), que combinados
con hormonas como noradrenalina o glucocorticoides, o con citocinas como TGF-P, inducen la
máxima expresión de albúmina y otros genes específicos de hígado.
El cultivo de células hepáticas fetales puede ser diferenciado en hepatocitos en una matriz
de fibronectina. Las células se organizan en, estructuras poligonales típicas y le permite a las
células proliferar en presencia de mitógenos. Esto puede ser observado en cultivos sobre colágena,
pero la diferenciación es mayor con la fibronectina. y se sugiere que puede requerirse de la
fibronectina en los procesos regenerativos (Sanchez et al 2000).
Con microscopía electrónica es posible apreciar algunas características de los hepatocitos:
desmosomas bien desarrollados, numerosas uniones estrechas, microvellosidades etc. sin embargo
es dificil encontrar el aparato de Golgi. La secreción de albúmina tuvo un pico a los 5 días de
cultivo (Ballet'et al 1984). Los hepatocitos demuestran hnciones diferenciadas como secreción de
albúmina, almacén de glucógeno, glicólisis, conjugación de bilirrubina, metabolismo de amonio,
expresión génica de citocromo P450 (Strom et al 1999).
Mientras los hepatocitos pueden ser crioconservados para su almacenamiento y transporte,
la eficacia de la conservación es muy variable y depende tanto de factores conocidos como
desconocidos. Finalmente, la separación de hepatocitos humanos es cara, poco eficiente y tardada,
con lo que se hace necesaria la investigación en obtención de células, técnicas de criopreservación,
expansión in vitro de hepatocitos humanos, uso de factores de crecimiento o genes
inmortalizadores, y la posibilidad de xenotransplantes (Fox 1999).
Aún con los avances en el cultivo de hepatocitos, aún no es posible expandir un numero
pequeño de hepatocitos a un número que tenga uso terapéutico. Un acercamiento a este problema
ha sido el utilizar el antigen0 largo del virus de simio 40. Este gen quimérico permite la
proliferación celular a cierta temperatura y se degrada a los 37
"C,
pero presenta el problema deuna posible transformación en células malignas (Strom et al 1999).
22'7542
Transplante de hepatocitos
Desde 1969, año en el que se desarrollo el método de aislamiento de hepatocitos,
numerosos estudios han demostrado que el transplante de estas células pueden ser utilizados para
tratamientos de falla hepática y arreglar desórdenes metabólicos, y ha sido demostrado que es
particularmente bueno en tratamientos de falla hepática en las que el hígado mantiene su
arquitectura normal conservando su potencial restaurador.
El concepto de transplantar células hepáticas se remonta a 1930, cuando Hans Popper
realizó el transplante en la cámara ocular anterior. Sin embargo, la falta de inmunosupresores hizo
.
que el tejido degenerara y desapareciera en unos pocos días o semanas (Gupta, Chowdhuryl992). En estudios animales, el transplante de hepatocitos provoca una disminución en niveles decolesterol mayor al 50% en conejos hiperlipidémicos con deficiencia heredada de receptor a
lipoproteína de baja densidad, y previenen la formación de placas arterioescleróticas en la aorta.
En animales con FHF el transplante de hepatocitos aumenta la sobrevivencia y permite la
recuperación en un gran número de modelos como el de la D-galactosamina, dimetilnitrosamina,
isquemia y heparoctomía hasta del 90%. Puede asimismo revertir la encefalopatía hepática,
prevenir la hipertensión intracraneal en animales con falla hepática isquémica (Strom et al 1999), y
estabilizar los niveles de bilirmbina, prototrombina, amonia y marcadores encefalopáticos (Fox
1999). En un experimento remarcable con ratones transgénicos, se demostró que en situaciones en
donde existe una pérdida repetida de células hepáticas nativas, el transplante de unas cuantas
células adultas diferenciadas puede corregir la falla hepática y repoblar al hígado (Strom et al
1999). Desafortunadamente, algunos de estos reportes sugieren que no es necesario el anclaje de
hepatocitos para resolver los problemas y pueden ser factores hepatotrópicos los que aumentan la
sobrevivencia, como la liberación de sustancias que transitoriamente mejoran el estado metabólico
sistémico mientras el hígado original se recupera (Fox 1999).
El uso de hepatocitos en terapia génica es atractivo, ya que mas que ninguna otra célula los
hepatocitos son capaces de mantener niveles altos de expresión génica (Gupta, Chowdhury 1992).
resistentes que las células endoteliales y las de canalículo biliar, y pueden ser obtenidas en hígados
con hasta 36 horas en fi-ío (Strom et al 1999).
El transplante de hepatocitos ha sido probado en distintos sitios para determinar en cuales
de ellos son capaces de sobrevivir manteniendo su knción. AsÍ mismo, se determina el potencial
terapéutico de las células en modelos de desórdenes metabólicos o insuficiencias hepáticas severas.
Se ha demostrado que las células transplantadas en el hígado, bazo, y otros sitios ectópicos
proveen a los hepatocitos suficientes elementos para que se arreglen en arquitecturas hepáticas
típicas observables a nivel de microscopio óptico y electrónico (Strom et al 1999). De todos los
sitios receptores de hepatocitos, la cama vascular del hígado y la pulpa del bazo aparecen como
los mejores para tratamientos clínicos (Gupta,Chowdhury 1992; Strom et al 1999), con proyectos
muy prometedores de cápsulas intraperitoneales. El transplante de hepatocitos dentro del hígado
permite la disponibilidad de nutrientes portales, contacto con otros hepatocitos y células no
parenquimatosas, la proximidad a factores parácrinos y la habilidad de secretar en el sistema biliar
(Fox 1999). El hígado le confiere a las células transplantadas el microambiente óptimo,
componentes adecuados de la matriz extracelular, factores de crecimiento, nutrientes e interacción
con otras células (Karrer et al 1992). Se ha estimado que la cama hepática sinusoidal puede
acomodar el 25% de la masa hepática original con tan solo un incremento leve transitorio de la
presión porta. Una cantidad mayor transplantada de hepatocitos o igual en otras especies puede
causar hipertensión portal, trombosis y hemorragia hepática (Fox 1999).
Durante el transplante de hepatocitos se activan procesos que ayudan a su integración en el
hígado y a la eliminación de las células que no son viables. L o primero que ocurre es una isquemia
distal producida por el tapón celular que hacen los hepatocitos en los sinusoides. Esto produce un
estrés oxidativo en las células de Kupffer, quienes liberan un cierto número de activadores como
radicales superóxido, que producen la muerte de los hepatocitos no viables y la activación de
macrófagos y fagocitos auxiliares. La activación de los macrófagos produce la liberación de varias
citocinas, como factor de necrosis tumoral, varias interleucinas e interferón gama. Estos
mensajeros activan a las células endotsliales, las cuales responden liberando moléculas de adhesión
las cuales facilitan la entrada de los hepatocitos hacia los platos hepáticos en periodos menores a
originales liberan el factor de crecimiento vascular endotelial (que permeabiliza el endotelio y esta
involucrado en angiogénesis) lo cual permite a las células entrar en los platos hepáticos y quedar
adyacentes a las células del recipiente Los hepatocitos se distribuyen de manera uniforme en el
hígado. A h í forman estructuras plasmáticas como uniones estrechas y canalículos biliares, y al
cabo de varios dias donde quedan atrapados en los espacios sinusoides (7-9 pm) debido al tamaño
de las células (20-40 pm).
Las células que escapan este filtro, son atrapadas en los capilares pulmonares,
donde son limpiados rápidamente. En hígados normales esta translocación no representa ningún
problema, como pacientes con enfermedades metabólicas heredadas y enfermedades donde se
mantiene el hígado intacto sin embargo, en hígados cirróticos y en hipertensiones portas, la
translocación aumenta (15-50% de células transplantadas) y puede causar complicaciones como
' hipertensión pulmonar y arritmias (Gupta et al 1999; Strom et al 1999), pero en hígados necróticos o cirróticos no se sabe hasta que punto es bueno utilizar esta ruta. En cirróticos por
ejemplo un numero considerable de células se traslocan hacia los pulmones. En estos casos donde
la arquitectura del hígado compromete los resultados, la mejor opción es el transplante en la
cámara vascular del bazo, de donde los hepatocitos que emigran son ampliamente entregados al
hígado de una manera segura y reproducible (Gupta et al 1991). Esto puede ser debido al flujo
sanguíneo del páncreas hacia la vena porta (que produce. la entrega hacia el hígado) y el
contraflujo sanguíneo de entrada hacia el páncreas impide la entrada de células transplantadas en
canales venosos porto-sistemicos que produce la entrega hacia los pulmones (Gupta,Chowdhury
1992). En experimentos previos algunas células transplantadas en el bazo fueron localizados en los . espacios portales intrahepáticos después de las primeras 2 horas, y dos días después no eran
localizables en espacios intravasculares pero sí en zonas cercanas a los espacios portos. En
tiempos mayores, fue posible localizar hepatocitos en el páncreas y los pulmones, pero no en
ningún otro tejido examinado (Gupta et al 1991). La deposición de hepatocitos en el bazo es
benéfica ya que permite a las células sobrevivir mucho tiempo y mantener sus hnciones normales.
Son capaces de proliferar y formar estructuras hepáticas en tan solo unos meses, sustituyendo
hasta el 40% del peso de este órgano, formando canalículos biliares y estructuras sinusoidales
La cavidad peritoneal h e poco efectiva al presentar una sobrevivencia de los hepatocitos inferior
y
una mayor respuesta inmune contra productos génicos solubles liberados por las células
transplantadas. Esto no descarta al a cavidad peritoneal ya que su gran capacidad y la gran
superficie le permiten un mayor numero de células transplantadas y la neo-organogenesis. Para
lograrla, se requieren avances en el desarrollo de aislantes biológicos con nuevos materiales y
posiblemente el cotransplante con células promotoras de la sobrevivencia de los hepatocitos
(Karrer et al 1992).
En el siguiente cuadro se muestran los sitios en donde se ha realizado el transplante de
hepatocitos:
Características
T é ~ c a de transplante
Complicaciones potenciales
capacidad Duración de la sobrevivencia Circulación de proteínas secretadas Corrección de
Bolsa de grasa Cavidad cápsula renal Pancreas Bazo Hígado lateral Peritoneal
Percutáneo Percutáneo. laparotomía Laparotomía, Laparotomía, Laparotomía, Requiere pre- percutáneo percutáneo percutáneo por
cultivo en ma- vena porta y bazo
triz extracelular.
(infección, adhe- cirugía cirugía rragia, infección, (trombosis o
siones). ruptura) embolia portal).
minim0 minim0 relacionado con relacionado con bajo. (hemo- moderado.
moderada grande mínima poca poca moderada
< 3 meses < 3 meses < 3 meses < 3 meses años años
si. provoca anti- si provoca anti- desconocido desconocido si.puede inducir si puede inducir
cuerpos cuerpos tolerancia tolerancia
desórdenes me- tabólicos
(Gupta, Chowdhury 1992).
El transplante humano de hepatocitos resurgió en la década de los 70s con tratamientos en
animales gracias al desarrollo de métodos para aislarlas en 1969, y fue utilizado por primera vez
por Mito y Kusano en 1993 cuando inyectaron entre 10 y 600 millones de hepatocitos y factor de
crecimiento epidérmico (para estimular su proliferación) directamente en la región inferior del
bazo de 10 pacientes. Al final del estudio, los investigadores notaron un beneficio clínico en los
pacientes aunque no creyeron que se debiera al tratamiento con hepatocitos, sin embargo, el
reportar la seguridad con la que se pueden aplicar este tratamiento fue por si un gran avance.
I
transplante de hepatocitos fetales en la cavidad peritoneal aumentaban la sobrevivencia de
pacientes con falla hepática fulminante.
Los pacientes con FHF presentan una gran mortalidad. El transplante ortotópico no es la
solución en estos casos por que no existe un soporte hepático temporal (como el que
proporcionan los hígados bioartificiales), y la sobrevivencia de los pacientes que reciben OLT es
después de un año 56% en comparación con el 54% sin transplante. El uso de hepatocitos fetales
para el transplante celular se desarrollo en la India en un experimento para averiguar si este tipo de
tratamiento era benéfico para pacientes que habían desarrollado encefalopatías de grado I11 y IV.
Los resultados demostraron que la sobrevivencia en los pacientes que tenían encefalopatía de 3er
grado íüe del 100% comparada contra el 50% de los controles, y en el caso de encefalopatías de
grado IVa íüe 100% vs 33% y IVb, 20% vs 18% (Habibullah et al 1994).
En los EE.UU. se trataron 11 pacientes mediante la inyección de hepatocitos en la arteria
esplenica. Siete sufrian falla hepática fulminante, y cuatro con falla hepática crónica con
descompensación aguda; todos recibieron menos de 1 &lo9 células. Dos murieron; seis
sobrevivieron el tiempo suficiente para recibir OLT, uno se recuperó y íüe dado de alta, uno murió
de complicaciones intracraneanas y otro h e desconectado del aparato que lo mantenía vivo al
presentar hemorragia intracraneal. En este caso, la falta de significancia estadística en la duración
de la sobrevivencia de los pacientes transplantados respecto a los controles que no heron transplantados impidió concluir que el transplante de células mejoraba la sobrevivencia. Sin
embargo, ocurrieron pequeños cambios en los parámetros clínicos indicadores de daño, como el decremento en el nivel de amonio en la sangre, el mejoramiento de la circulación cerebral,
reducción de la presión craneal y la reducción de encefalopatía.
Otro caso en donde se llevó a cabo el transplante de hepatocitos por vía porta en tres
pacientes con FHF. La sobrevivencia de solo uno de ellos tuvo la duración suficiente para que el
hígado nativo se recuperara, y se tomara la decisión de suspender la inmunosupresión. Sin
embargo, en un grupo de pacientes que presentaban cirrosis alcohólica, el transplante de
hepatocitos resultó suficiente para resolver la anuria y la encefalopatía a las 48h. después del
En el caso de pacientes con defectos metabólicos congénitos se reportan solo tres casos. El
primero, de 5 años de edad tenía un desorden en el ciclo de la urea y deficiencias en la ornitidin-
transcarboxilasa, recibió 1 x109 hepatocitos y demostró cierta mejoría, pero murió 42 días después
del transplante. El segundo caso de 18 semanas con deficiencia de la a-1 antitripsina sobrevivió
después del transplante de hepatocitos, pero fie tratado posteriormente con OLT.
Se ha utilizado el transplante de hepatocitos humanos como un método de soporte para
pacientes en falla hepática fblminante aguda y subaguda mientras esperan el transplante de hígado
y para corregir defectos metabólicos en enzimas del ciclo de urea, sin secuelas patológicas de los
hepatocitos transplantados en el bazo o la vena porta. En estos casos, los niveles de amonio en
suero disminuyeron significativamente, y en cinco de los seis casos hubo mejoras en la presión de
perfbsión cerebral y decrementos en la presión intracraneal (Strom et al 1997). Sin embargo,
algunos intentos de corregir diabetis mellitus tipo I y falla hepática hlminante con transplante de
células epiteliales han sido desastrosos (Lake 1998). Fox y sus colaboradores han corregido
parcialmente el síndrome de Crigler-Najjar tipo I mediante el transplante de hepatocitos' aislados.
Problemas en el transplante de hepatocitos.
Aunque la idea del transplante de hepatocitos luce como una muy buena alternativa de
OLT existen ciertos problemas que no se han podido resolver y por los cuales no se ha podido
estandarizar como una técnica confiable.
Primero. Los hepatocitos son obtenidos de hígados cadavéricos inservibles para transplante
ortotópico por causa de grandes riesgos de falla en las finciones primarias. Sin embargo, es
incierta la capacidad enzimática de los hepatocitos obtenidos de estos hígados.
Segundo, Se desconoce la cantidad de hepatocitos requerida para contrarrestar los
defectos metabólicos. En el caso del síndrome de Crigler-Najjar solamente se ha infundido el 5%
de la masa normal, pero en otro caso en el cual se infbndió una cantidad similar para corregir la
deficiencia en ornitidil transcarbamilasa, solamente el 0.5% de la actividad enzimática normal fue
Tercero. Se desconoce la cantidad exacta de hepatocitos transplantados que sobreviven y
se integran al tejido, así como se desconoce que tanta actividad enzimática puede ser incrementada
mediante infbsiones adicionales de hepatocitos (Lake 1998).
Cuarto. La evaluación de la función y distribución de las células se ve estorbada por
mecanismos de regulación génica desconocidos y por la larga vida de la albúmina y la incidencia
de hepatocitos almacenadores de albúmina.
Quinto. Solamente una pequeña porción de las células transplantadas sobrevive (del 20 al
30%) y son mas afectadas las células que quedan en espacios portales que células en sinusoides
hepáticos (Gupta et al 1999).
Aún con los métodos propuestos para aumentar la masa de hepatocitos transplantados al
inducir su proliferación con hepatoctomía parcial, es necesario hacer estudios que aseguren un
mayor cociente de crecimiento de hepatocitos transplantados respecto a los nativos, o de otro
modo la proporción se mantendrá intacta (Gupta et al 1991). En estudios de repoblación, se ha
demostrado que 1000 células transplantadas son capaces de repoblar el hígado completo. Estas
células adultas son capaces de dividirse 80 veces sin cansar el potencial de replicación. De
cualquier modo, las células transplantadas no aumentan mucho su masa después de entrar en el
hígado en análisis a largo plazo. Esto es compatible con la baja proliferación de las células
originales.
El mayor reto clínico para los hepatocitos transplantados es corregir errores metabólicos,
servir como soporte en falla hepática aguda y complicaciones de enfermedades hepáticas. En el
primer caso, los resultados han sido modestos, y habría que considerar tratamientos de pérdida
parcial de los hepatocitos originales que permitiera una mayor proliferación de los correctores del
defecto. Los estudios de FHF han sido dificiles de evaluar debido a que no hay un modelo animal
reproducible. Y en daño crónico hepático, se ha demostrado que el transplante de hepatocitos es
capaz de mejorar la calidad de vida de los pacientes, y aunque es incapaz de revertir los efectos de
la cirrosis, se puede aumentar la función del hígado mientras se espera un transplante ortotópico,
al tiempo que se mejora la encefalopatía hepática (Gupta et al 1999). Los exámenes post-mortem
revelaron hipertensión grave en todos los sujetos transplantados con evidencias histológicas de
cirrosis micronodular. Este experimento es importante por que es uno de los pocos que estudian la
cirrosis y por que demostró que en este caso lo Único que fbnciona es el transplante de los
hepatocitos en el bazo, siendo inútil el transplante intraperitoneal tanto de hepatocitos como de
células de médula ósea. No se dio ningún caso de que las células transplantaras pegaran en la
cavidad peritoneal (Kobayashi et al 1999).
Aunque el transplante de hepatocitos no provoca alteraciones de la circulación hepática, si
forma momentáneamente una embolia que dura varias horas Gentras se integran los hepatocitos al
tejido y que son evidenciados por daño isquémico leve (Grompe et al 1999).
Algunas anormalidades hepáticas en falla hepática crónica implican deficiencias en
fbnciones sintéticas como hipoalbuminemia y defectos en la coagulación. La corrección de estos
defectos requiere una masa significativa de células y no ha sido probado. El efecto mecánico de
hipertensión porta que puede estar .asociado con la falla hepática no puede ser revertido por el
transplante de hepatocitos, pero no se sabe hasta que punto lo pudiera perjudicar. En pacientes
con trastornos portosistémicos, la translocación de hepatocitos hacia los pulmones causantes de
hipertensión pulmonar o embolia debe ser considerado (Gupta,Chowdhury 1992).
Por ultimo falta todavía mucho por hacer para mejorar el transplante de hepatocitos como
una alternativa definitiva. Los pacientes que reciben las células deben de vivir con
inmunosupresores al igual que en cualquier otro caso de transplante, y corren el peligro potencial
de rechazo. Hasta el momento no se sabe:
1. ¿Cuál es el método mas adecuado y seguro para crear espacios para las células transplantadas
en el hígado humano?
2. ¿Será posible manipular los hepatocitos para terapia génica ex vivo? (Grompe et al 1999) La manipulación genética ex vivo de los hepatocitos pudiera en un hturo cercano, ser la
alternativa a la inmunosupresión. Otra línea de trabajo encabezada por Wen L. y colaboradores
esta tratando de encapsular las células para transplante en una membrana semipermeable que evita
el contacto con anticuerpos y células inmunes, permitiendo la supervivencia indefinida de estas
(Rust, Gores 2000).
A futuro se debe resolver el problema del rechazo con investigaciones que mejoren la
tolerancia. Estos avances serán relevantes en el uso de células xenogénicas (cerdo a hombre) en el
caso que los animales transgénicos sobrepasen rechazos, y aún cuando no es notorio el rechazo
inmunológico de los hepatocitos transplantados, en todos los casos se han dado inmunosupresores
ya que se disputa mucho la inmunogenicidad de los hepatocitos (Lake 1998).
Adicionalmente al problema de la disponibilidad de células para transplante, existen otros
problemas fisiológicos como el límite de células que pueden ser transplantadas o que serán
destruidas antes de acceder a la cama vascular. Todavía se desconocen los factores que
promueven la integración de células transplantadas. Finalmente, es necesario promover la
replicación de hepatocitos transplantados en el caso de terapias contra errores metabólicos de las
células nativas. Experimentalmente, ha sido inhibido el crecimiento de células nativas utilizando
radioterapias dirigidas al hígado y drogas que bloquean el ciclo celular, mientras que se favorece la
proliferación de células transplantadas por oclusión de ramas de la vena porta, cortes parciales de
b. Objetivos.
El presente trabajo buscaba realizar los siguientes objetivos:
1.
2.
3 .
Obtener hepatocitos diferenciados por diferentes métodos que presenten alta viabilidad, y que
sirvan para transplante celular.
Mantener la viabilidad y la diferenciación de los hepatocitos al ser criopreservados y
posteriormente descongelados.
Marcar las células aisladas para estudios de migración en el organismo recipiente. .
c. Metodología.
I. Aislamiento de hepatocitos.
Soluciones:
-Buffer de perfhión:
NaCl 0.142 M. KC1 6.71 m M . Hepes 2.4g/l. NaOH 15 m M . Ajustar el pH a 7.5 y esterilizar por
filtración en papel con poro de 0.22 micrómetros.
-Buffer de colagenasa:
Preparar al momento de ser requerido. A 100 ml del buffer de perlüsión, agregar 50 mg de
colagenasa seca y filtrar en papel poroso de 0.22 micrómetros Agregar 200 pl de CaC12 1M y
calentar en baño de agua a 37°C.
-medios de cultivo
Medio completo Eagle modificado por Dulbecco (DMEM), medio de Williams (W). Se utilizaron
tanto adicionados con insulina y dexametasona como sin adicionar.
Material Biológico:
Se utilizan ratas Wistar de ambos sexos con un peso mayor a 120g. provenientes del
Procedimiento.
Calentar a 37 "C 100 ml del buffer de perfusión y 100 de buffer de colagenasa.. Se prepara
la cánula conectada a una bomba de perfusión con el buffer de perfusión desechando las burbujas.
Anestesiar a la rata con éter en una cámara mediana y esperar de 2 a 3 min. para que se
duerma. No debe sobrepasarse el tiempo por que se corre el riesgo de que la rata muera. Trasladar
la rata anestesiada a la tabla de disección y fijarla.
Limpiar los pelos con alcohol al 70% y proceder a separar la piel sin lastimar el peritoneo.
Abrir el abdomen con un corte largo transversal y separar los intestinos hacia la derecha para
exponer la vena porta. Introducir la cánula previamente purgada con el buffer de pefisión por la
vena porta y fijar a su posición con un hilo. Comenzar la perfbsión a poca velocidad (20mVmin) y
poco a poco ir aumentando hasta que esté a punto de terminarse. El hígado debe cambiar de color
hacia un café pardo según se desplazan los eritrocitos. Cambiar el buffer de pefisión poco antes
de que se termine por el de colagenasa y perfundir hasta que se acabe.
Cortar todas las ligaduras del hígado y colocarlo aislado en un vaso de precipitados estéril.
El resto del procedimiento se lleva a cabo en una campana. Se lava el hígado intacto de 2 a 4
veces con PBS estéril y se pasa a una caja de Petri. Se rompe la cápsula y se deja que se
disgreguen las células en 10 ml de PBS mientras se agita vigorosamente el hígado. Cuando se ha
separado la mayoría de las células se filtra la solución en un embudo cubierto por gasa estéril, y el
filtrado se recupera en tubos para centrífuga. Se separa por centrihgación a 500 rpm durante 1
minuto en una centrífbga clínica. Se desecha el sobrenadante y se resuspende el botón en PBS. Se
repite la centrihgación y la segunda vez se resuspende el precipitado en medio de cultivo -DMEM
o Williams- enriquecido o no con insulina (5pg/ml), dexametasona (O. 1 pM), suero fetal bobino
(5%) y Antibac (20mV1). Se verifica la viabilidad y el número de células mediante la prueba de
exclusión del
a z u l
de tripano en una cámara Neubauer.Se siembra la suspensión celular en una caja de Petri con o sin biomatriz, y se incuba
durante 3 h. para permitir la adhesión celular. Después de este periodo, se lava la caja con PBS y
II.
Prueba de exclusión de azul de tripanoEste procedimiento se llevó a cabo cada vez que se obtenían hepatocitos. El objetivo es
conocer la cantidad relativa de células viables.
Soluciones:
A z u l
de tripano al 0.4% en PBS. Mantener a 4°C.A
0.5 m l . de las células en suspensión, agregar 0.5 ml de la solución de azulde tripano. Estasolución pinta de color azulel núcleo de las células muertas. Al momento colocar una gota de la
nueva solución en la cámara Neubauer. El número de células viables se calcula de la siguiente
manera:
# de células viabledml = promedio de células viables por cuadrado grande de la cámara x dilución x lo4 (Celis, Celis 1994).
DI.
Marcaje Fluorescente.Soluciones: Stock de isotiocianato de fluoresceína (CFSE) 0.5mM en dimetil-sulfóxido (DMSO).
Para preparar se pesan 1.6 mg de CFSE y se disuelven en lOml de DMSO. Guardar a -10°C
cubierto de la luz.
Procedimiento.
Los hepatocitos en suspensión de PBS se diluyen hasta estar en una concentración aproximada de
5x10' celulas/ml. Se agrega la solución CFSE-DMSO hasta lograr una concentración de
fluoresceína de 5.OpM (1/1000 de la solución stock). Se deja reaccionar a 37 "C durante 15 min. al
final de los cuales se detiene la reacción agregando medio de cultivo fresco. Se lava 2 veces y se
siembra de nuevo en cajas de petri o se observa en el microscopio de fluorescencia (Weston,
Parish 1990; Karrer et al 1992).
IV.
Criopreservación.Soluciónes:
Suero fetal bovino adicionado con glicerol al 10%. PARA preparar 10 ml, mezclar 9ml de FCS y 1
ml de glicerol, esterilizar en filtro, guardar en alícuotas de 3 ml a -20°C en frascos estériles
Método.
1. Seleccionar células en la fase logarítmica de crecimiento en el momento de casi alcanzar
confluencia. Es necesario renovar el medio 24 h. antes de la criopreservación.
2. Tripsinisar las células y concentrar en DMEM 2x106 células por ml.
3. Volver a centrihgar y resuspender a 5-6 x106células por ml en FCS y glicerol al 10%.
4. Guardar las células en crioviales de 1 ml y éstos en contenedores resistentes.
5. Guardar los viales a una temperatura de -80°C durante 24 h.. La velocidad de enfriamento
ideal es de 1°C por minuto.
6. Cambiar las cajas de congelación a contenedores de nitrogen0 liquido y mantener en la fase
vaporosa. La temperatura de -80°C es inadecuada para guardar células por periodos largos de
tiempo, y siempre se deben tener células en reserva.
Descongelar.
1. Retirar las ámpulas del nitrógeno líquido. Destapar y sumergir inmediatamente el criovial en
baño de agua a 37°C teniendo cuidado que la tapa no toque el agua.
2. Limpiar completamente alrededor del frasco con etanol al 70%
3. Vaciar el contenido del criovial en 5 m1 de medio DMEM cuando aún tenga hielo y centrihgar
de 1 a 2 minutos a 300g. Resuspender el botón en medio DMEM a 37°C en una botella de
cultivo. Dejar la botella en la incubadora a 37 "C y cambiar el medio a las 2 h, cuando la
mayoría de las células se ha adherido .
d. Actividades Realizadas
En
el transcurso del servicio social se realizaron las siguientes actividades:-Investigación bibliográfica.
-Obtención de hepatocitos de rata con una viabilidad máxima del 95.93%.
-Mantenimiento de cultivos primarios máximo de 2 semanas.
-Marcaje fluorescente de hepatocitos que duró las 2 semanas de cultivo.
-Ensayos de esterilidad con cultivos de líneas celulares humanas y ensayos de marcaje fluorescente
hasta estandarizar la técnica.
-Ensayos de criopreservación con líneas celulares.
e. Objetivos y metas alcanzados
Se logró estandarizar la técnica de aislamiento de hepatocitos con una sobrevivencia
superior al 70%. Se probó y mejoró el método de marcaje fluorescente de las células con una
persistencia mayor a 10 días.
Se ensayó la criopreservación de células humanas para aplicarse cuando sea posible reproducir los hepatocitos in vitro.
f. Resultados y conclusiones
Resultados.
I. Obtención y cultivo de Hepatocitos.
En
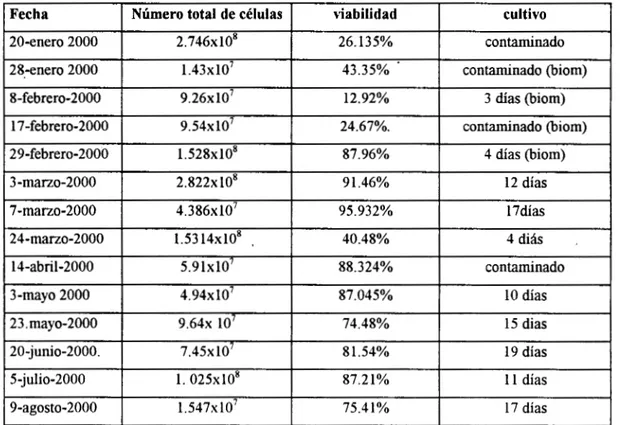
el transcurso del servicio social se hicieron un total de 14 aislamientos de hepatocitos,con un promedio de 1 .O75x1O8 k 8.067~10’ células obtenidas y aisladas por experimento. Hubo un
cambio drástico en el tiempo de sobrevida de las células en cultivo cuando se adicionó en el medio
insulina (pg/ml) y dexametasona (O. 1 pM). Se comprobó que para obtener una alta viabilidad era
muy importante realizar de manera adecuada la pehsión, sin perder tiempo y sin que muera la
rata antes de realizarla. La segunda perfusión con colagenasa se probó a dos concentraciones: 50
mg en 100 m1 y 5 mg en 100
d.
Ambas tuvieron la misma eficacia, pero con la segundaconcentración se ahorra mucho reactivo, por lo que es la que se debe utilizar.
Tanto el medio DMEM como el W resultaron tener la misma eficiencia para mantener los
cultivos primarios, siendo mas importante la adición o no adición de los suplementos antes
mencionados. Sin embargo, ninguno de los medios de cultivo permitió la reproducción in vitro de
las células.
La siembra de células en cajas con biomatriz ayudó a la sobrevivencia de las células
durante los primeros días, pero los mejores resultados se obtuvieron al sembrar las células en
botellas de cultivo sin biomatriz, a la vez que se mejoró la esterilidad de las pruebas. En los casos
donde no se utilizó biomatriz, sobrevivieron menos células durante los primeros días, pero esas
pocas células sobrevivieron por mas tiempo.
En la siguiente tabla se muestran los resultados en la obtención y cultivo de células.
14-abril-2000
17 días 75.41% 1.547~10’
9-agosto-2000
1 1 días 87.21%
1 . 0 2 5 ~ 1 0 ~ 5-julio-2000
19 días 8 1.54%
7 . 4 5 ~ 1 0 ~ 20-junio-2000.
15 dias 74.48%
9 ~10’ 4 ~
23. mayo-2000
10 días 87.045%
4 . 9 4 ~ 1 0 ~ 3-mayo 2000
contaminado 88.324%
5 . 9 1 ~ 1 0 ~
11. Marcaje Fluorescente.
Las células obtenidas los días 5 de julio y 9 de agosto heron utilizadas para el marcaje
fluorescente. Previamente se utlizaron dos concentraciones de la solución CFSE-DMSO en células
humanas para determinar cual era mas eficiente: 5 p M y 10 p M , durante 15 y 30 minutos a 37°C.
La mejor concentración comprobada en el microscopio de fluorescencia íüe lOpM durante 30
minutos.
Los hepatocitos de rata heron marcados al momento de ser extraídos, después de dos
lavadas en PBS, ya que el método requiere que las células estén en suspensión. Se utilizó como
control de sobrevivencia un extracto de las mismas células que no h e marcado y se mantuvo en
PBS los 30 minutos de la reacción. No hubo diferencia entre la sobrevida de las células marcadas y
las que no se marcaron. (1 1 días las células obtenidas el 5 de julio y 17 días del 9 de agosto) Se
comprobó la persistencia de la marca fluorescente en ambos casos una semana después de que
heron sembradas.
111. Criopreservación.
El método de criopreservación no se llevó a cabo en células obtenidas de hígado de ratas
ya que no se reprodujeron in vitro. Para llevar a cabo la criopreservación es necesario que las
células se encuentren en fase logarítmica de crecimiento o de otro modo se corre el riesgo de que
la viabilidad sea muy baja (Celis, Celis 1994). Sin embargo, se ensayó la técnica en líneas célulares
humanas como las Hep G2 para aplicar la misma técnica el día que sea posible reproducir los
cultivos primarios. .
Conclusiones.
El paso mas importante para llevar a cabo un buen aislamiento de hepatocitos, consiste en
hacer una buena pefisión con solución libre de calcio. Para llevar a cabo una buena pefisión es
necesario que la rata no muera anestesiada con éter y se introduzca la cánula en la vena porta con
colagenasa o si se incuba el hígado cortado en pedacitos en la solución de colagenasa, pero se
obtiene un número mayor de células si se pefinde con la solución de colagenasa.
El hecho de asociar la idea de una buena pefisión con una alta sobrevivencia de células
aisladas indica una alta susceptibilidad de los hepatocitos a la anoxia (Seglen 1994) que se crea
cuando se forma un tapón por la coagulación de la sangre; y que es también un factor de pérdida
de viabilidad cuando no se resuspenden las células centrifigadas con rapidez. Para mejorar los
resultados se recomienda burbujear tanto la solución de perfbsión como la de colagenasa con
oxígeno durante la noche anterior al aislamiento (Celis, celis 1994).
E
l
cultivo de hepatocitos es muy dificil (Kusano, Mito 1982; Reid,Jefferson 1984; Tatenoet al 2000) y en la mayoría de los casos se suplementan los medios de cultivo para mejorar el
tiempo de sobrevivencia de las células. Algunos de estos suplementos son nicotidamida,
transferrina, factor de crecimiento de hepatocitos, factor de crecimiento epidérmico y factor de
crecimiento transformante a (Tatento et al 2000); albúmina bobina, insulina, hemisuccinato de
hidrocortisona (Ballet et al 1984); entactina, colágena
IV,
laminina y fibronectina (Sánchez et al2000); Insulina, dexametasona (Mitaka et al 1999; Strom et al 1999) y también se han hecho co-
cultivos con otras células hepáticas no parenquimatosas (Reid, Jefferson 1984; Tatento et al
2000). Los mejores resultados se obtienen al cultivar los hepatocitos con células no parenquimatosas, ya que éstos mantienen su estructura y diferenciación. Sin embargo, para el
transplante celular es tan importante la pureza de la extracción (sólamente hepatocitos) como la
viabilidad de los mismos. En el protocolo del presente trabajo se eligió cultivar las células con
insulina y dexametasona ya que protege a las células de la apoptosis, aunque no mantiene un muy
alto grado de diferenciación ni ayuda a las células a reproducirse como lo hacen los mitógenos y
factores de crecimiento utilizados por Tatento y su grupo de colaboradores. La diferenciación se
puede aumentar con adicionar al medio de cultivo fenobarbital, 3-metil clorantreno y rimpaficina
(Bayliss, Skett 1995).
La dexametasona suprime la expresión del gen de la enzima Oxido Nítrico Sintetasa
inducible (iNOS) dependiente del factor nuclear KB (NF-a), la cual se encuentra expresada en una gran variedad de procesos inmunes e inflamatorios, incluyendo la sepsis, shock hemorrágico,
rechazo de transplantes y enfermedades autoinmunes, y actúa provocando un aumento en la
producción de óxido nítrico (NO) que le confere a las células propiedades crioprotectoras y
antivirales, pero que a mayores cantidades produce daño celular y apoptosis. Los hepatocitos
expresan RNAm del gen iNOS cuando se exponen a factores estimulantes especificos como
citocinas, lipopolisacárido y virus, los cuales provocan la degradación la proteína inhibidora I-KBa
via activación de una ubiquitin-proteosoma. El I-KBa se une al NF-KB y al ser degradada lo deja
libre para que pueda traslocarse hacia el núcleo y unirse al promotor de sus genes blanco. La
dexametasona y otros glucocorticoides aumentan la producción de I-KBa, protegiendo a las
células de la apoptosis producida por NO (De Vera et al 1997).
Aunque no ha sido' posible aumentar el número de células hepáticas mediante la
reproducción in vitro, podría no ser necesario ya que los hepatocitos transplantados en el hígado y
' vaso tienen una capacidad replicativa de hasta 18 veces, suficientes para repoblar el hígado (Gupta
et al 1999), por lo que los esikerzos deben centrarse más en el aislamiento y preservacion de las
células (que en el caso de hepatocitos humanos requiere aislamientos sin pefisión ya que es muy
dificil canalizar segmentos aislados) que en el cultivo y replicación de las células, que es muy
dificil.
En estudios de repoblación, se ha demostrado que 1000 células transplantadas son capaces
de repoblar el hígado completo. Estas células adultas son capaces de dividirse 80 veces sin cansar
el potencial de replicación. De cualquier modo, las células transplantadas no aumentan mucho su
masa después de entrar en el hígado según análisis a largo plazo. Esto es compatible con la baja
h.
Bibliografía.Alberts B. Bray D. Lawis J. Raff M. Roberts K. Watson J.D. Molecular Biology of the Cell. 2nd
Edition, Garland Publishing Inc. USA 1989. Pp 961-963.
Ballet F. Bouma M.E. Wang S.R. Amit
N.
Marais J. Infante R. 1984. Isolation, Culture andCaracterization of Adult Human Hepatocytes from Surgical Liver Biopsies. Hepatology
4
NO
S:849-854Bayliss M.K. Skett
P.
Isolation and Culture of Human Hepatocytes in Methodr in MolecularMedicine: Human Cell Culture Protocols. G.E. Jones editor. Humana Press INC N.J. 1995.
pp 369-389
Berry M.N., Friend D.S. 1969. High-yield preparation of isolated rat liver parenchymal cells.
A
biochemical study. J. Cell Biol. 15: 1-8Berry A.R. Grivell M.B. Phillips J.W. 1997. Isolated Hepatocytes- past, present and future.
Cell Biology and toxicology 13: 223-233.
Brown K.A. Moonka D.K. 1999. Liver transplantation. Current Opinion in Gastroenterology
15 pp 278-282
Celis A, Celis J.E. General Procedures for Tissue Culture in Cell Biology, a laboratory handbook. editor Celis J.E. Academic Press USA. 1994. pp. 12-13.
De Vera M.E. Taylor B.S. Wang Q.I. Shapiro R.A. Billiar T.R. Geller D.A. 1997.
Dexamethasone supresses iNOS gene expression by upregulating IxBc~ and
Desmet V.J. INTRODUCTION. Organizational Principles in The Liver: Biology and
Patobiology. Third Edition. editores Arias I.M. Boyer J.L. Fausto N. Jakoby W.B. et al.
Raven Press ltd. New York 1994. pp. 3-13
Fox I. R. Chowdhury J.R Kaufhan S. Goertzen T. R. Chowdhury N. Warkentin P. Dorko K.
Sauter B. Strom S.C. 1998. Treatment of the Crigler-Najjar syndrome Type I with
Hepatocyte Transplantation. The N. EnglandJ. ofMedicine 338:20 pp 1422-1426.
Grompe M. Laconi E. Shafritz D.A. 1999. Principles of Terapeutic Liver Repopulation.
Seminars in Liver Disease 19: 1
Gupta S. Aragona
E.
Vemuru R.Engraftment and Function
pp 7-14
Bhargava K. Burk R.D. Chowdhury J.R. 1991. Permanent
of Hepatocytes Delivered to the Liver: Implications for
Gene Therapy and Liver Repopulation. Hepatology i4; 1 pp 144-149
Gupta, S. Chowdhury J.R. 1992. Hepatocyte Transplantation: Back to the future. Hepatology
1511. pp 156-162
Gupta S. Gorla G.R. Irani A.N. 1999. Hepatocyte transplantation: Emerging insights into
mechanisms of liver repopulation and their relevance to potential therapies.'Journal of
Hepatology 30: 162- 170-
Gupta S. Bhargava
K.K.
Novikoff P.M. 1999. Mechanism of Cell Engraftment During LiverRepopulation with Hepatocyte Transplantation. Seminars in liver disease 19: 1 pp 15-26
Habibullah C.M. Syed H.I. Qamar A. Taher-Uz 2. 1994. Human fetal hepatocyte
transpalntation in patients with fulminant hepatic failure. Transplantation 58:s. 95 1-
Karrer F.M. Reitz B.L. Hao L. Lafferty K.J. 1992. Fluorescein Labeling of Murine
Hepatocytes for Identification After Intrahepatic Transplantation. Transplantation
Proceedings 24:6 pp 2820-2821
Kobayashi N. Ito M. Nakamura J. Cai J. Hammel J.M. Fox I.J. 1999. Hepatocyte
Transplantation Improves Liver Function and Prolongs Survival in Rats With
Descompensated Liver Cirrhosis. Transplantation Proceedings 3 1 pp 428-429
Kusano M. Mito M. 1982. Observations on the Fine Structure of Long-Survived Isolated
Hepatocytes Inoculated into Rat Spleen. Gastroenterology 82 pp 616-628
Lake J.R. 1998. Hepatocyte Transplantation. The New England Journal of Medicine 338:2Q.
pp '1463-1465
Mitaka T. Sato F. Mizuguchi T. Yokono
T.
Mochizuki Y. 1999. Reconstruction of HepaticOrganoid by Rat Small Hepatocytes and Hepatic Nonparenchimal Cells. Hepatology
2911 pp 11 1-125.
Reid L.M. Jefferson D.M. 1984. Culturing Hepatocytes. and Other Differentiated Cells.
Hepatology 4:3 pp 548-559
Rust
C:
Gores G.J. 2000. Hepatocyte Transplantation In Acute Liver Failure: A NewTherapeutic Option for the Next Millennium? Liver Transplantation 6: 1. pp 4 1-43.
Sánchez
A.
Álvarez A.M. Pagan R. Roncero C. Vilaró S. Benito M. Fabregat I. 2000.Fibronectin regulates morphology, cell organization and gene expression of rat fetal
Seglen P.O. Isolation of Hepatocytes. in Cell Biology, a laboratory handbook. editor Celis J.E.
Academic Press USA. 1994. pp. 96-102
Strom S.C. Chowdhury J.R. Fox I.J. 1999. Hepatocyte Transplantation for the Treatment of
Human Disease. Seminars in Liver Disease 19: 1. pp 39-48
Strom S.C. Fisher R.A. Rubinstein J.A. Barranger R.B. Towbin M. Charron L. Mieles
L.A.
Pisarov K. Thompson M.T. Reyes J 1997. Transplantation of human hepatocytes.
Transplantation Proceedings 29,2 103 -2 106.
Strom S.C. Pisarov K Dorko K. Thompson M.T Schuetz J.D.. Schuetz E.G. 1996. Use of human
hepatocytes to study citocrome P450 gene induction. Methodr Enzimol. 272:388-401
Tateno C. Takai-Kajihara K. Yamasaki C. Sato
H.
Yoshizato K. 2000. Heterogeneity of GrowthPotential of Adult Rat Hepatocytes In Vitro. Hepatology 3 1 : 1 pp 65-74
Wen L Calmus Y. Honiger J. Conti F. Capeau J. Weill
B.
NordlingerB.
1998. Encapsulatedxenogeneic hepatocytes remain functional after peritoneal implantation despite
immunization of the host.
J
Hepatol;29(6):960-8Weston S.
A.
Parish C.R. 1990. New fluorescent dyes for lymphocyte migration studiesAnalisys by flow cytometry and fluorescence microscopy. J. of Immunologycal Methodr