UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA ESCUELA DE BIOQUÍMICA Y FARMACIA
DISEÑO Y DESARROLLO DE ÓVULOS DE KETOCONAZOL
Previo a la obtención del título de Bioquímico Farmacéutico
AUTORES:
Andrea Villagómez. (Tesista)
Dr. Geovanni López. (Director de tesis) Bq. Santiago Ojeda (Co-tutor de tesis)
Loja - Ecuador
CONTRATO DE CESIÓN DE DERECHOS
Yo, Andrea Elizabeth Villagómez Flores declaro conocer y aceptar la disposición del artículo 67 del Estatuto Orgánico de la Universidad Técnica Particular de Loja que en su parte pertinente textualmente dice “Forman parte del patrimonio de la Universidad la propiedad intelectual de investigadores, trabajos científicos o técnicos o tesis de grado que se realicen a través, o con el apoyo financiero, académico o institucional (operativo) de la Universidad”.
Andrea Villagómez Bq. Santiago Ojeda TESISTA CO-TUTOR DE TESIS
Dr.
Baldomar Geovanni López Cevallos. DIRECTOR DE TESIS
CERTIFICA:
Que una vez revisado el proyecto de investigación desarrollado por la Srta. Andrea Elizabeth Villagómez Flores, previo a la obtención del Título de Bioquímico Farmacéutico, se autoriza su presentación final para la correspondiente evaluación.
Loja, julio 2011
AUTORÍA
Las ideas, conceptos, metodologías y resultados desarrollos en el presente trabajo de investigación son de absoluta responsabilidad de su autor.
AGRADECIMIENTO
Un inmenso agradecimiento a mi mamá por brindarme el apoyo económico y espiritual que me permitieron culminar con éxito mis estudios universitarios.
Al PhD. Omar Malagón, director de la Escuela de Bioquímica y Farmacia de la Universidad Técnica Particular de Loja, por brindarme su apoyo para desarrollar las pruebas pertinentes de mi proyecto en los laboratorios del Instituto de Química Aplicada.
Al Dr. Geovanni López y al Bq. Santiago Ojeda, por sus valiosos asesoramientos, que me ayudaron en el desarrollo y la culminación de este trabajo investigativo.
Un agradecimiento especial a Mónica Valdiviezo, Guisella Rivera y a mi primo Luis, quienes colaboraron con paciencia y solidaridad en la realización de este proyecto.
DEDICATORIA
CONTENIDO
Pág CARÁTULA………...I
CONTRATO DE CESIÓN DE DERECHOS……….II
CERTIFICACIÓN DE REVISIÓN DEL TUTOR………...III
CERTIFICACIÓN DE AUTORÍA………...IV
AGRADECIMIENTO……….V
DEDICATORIA………..VI
CONTENIDOS………...VII
ÍNDICE DE TABLAS………...VIII
ÍNDICE DE FIGURAS………...IX
1. RESUMEN.………...1
2. ARTÍCULO………..7
3. INTRODUCCIÓN Y ANTECEDENTES……….8
4. MATERIALES Y MÉTODOS 4.1. Preformulación………...14
4.2. Formulación………....18
4.3. Método Analítico de Producto Terminado……….20
4.5. Validación del Método Analítico (Control Químico)………..27
4.6. Proceso de Manufactura………...29
4.8. Pruebas de Estabilidad Acelerada………..31
5. RESULTADOS Y ANÁLISIS 5.1. Preformulación………33
5.2. Formulación………...40
5.3. Validación del Método Analítico………...42
5.4. Proceso de Manufactura………...55
5.5. Estabilidad Acelerada………....57
5.6. Trámite de Registro Sanitario………...72
6. CONCLUSIONES………...76
7. RECOMENDACIONES……….78
8. BIBLIOGRAFÍA………...79
9. GLOSARIO………..83
ÍNDICE DE TABLAS
Tabla Nº 1. Fórmula de manufactura por lote piloto.
Tabla Nº 2. Investigación bibliográfica del principio activo: Ketoconazol. Tabla Nº 3. Investigación bibliográfica del excipiente: Ovucire.
Tabla Nº 4. Investigación bibliográfica del envase: PEAD. Tabla Nº 5. Certificado de análisis del principio activo. Tabla Nº 6. Certificado de análisis del excipiente. Tabla Nº 7. Certificado de análisis del envase. Tabla Nº 8. Reporte de preformulación.
Tabla Nº 9. Fórmula de óvulos de Ketoconazol.
Tabla Nº 10. Resultados de reproducibilidad del método. Tabla Nº 11. Resultados de repetibilidad del método. Tabla Nº 12. Resultados de precisión del sistema. Tabla Nº 13. Resultados de exactitud del método. Tabla Nº 14. Resultados de linealidad del método. Tabla Nº 15. ANOVA para linealidad del método. Tabla Nº 16. Resultados de linealidad del sistema. Tabla Nº 17. ANOVA para linealidad del sistema.
Tabla Nº 18. Controles físicos y químicos del producto en el mes 0. Tabla Nº 19. Resultados de identificación de degradantes.
Tabla Nº 20. Controles microbiológicos del producto en el mes 0.
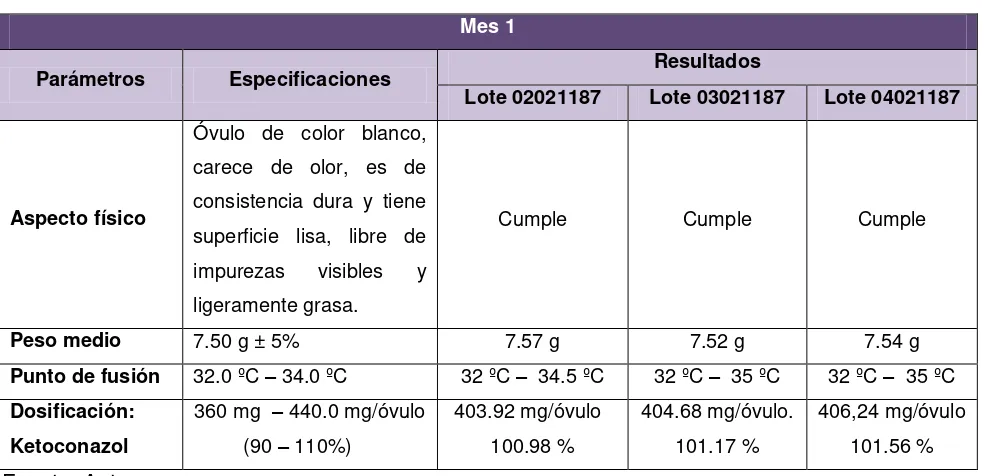
Tabla Nº 21. Resultados de pruebas de estabilidad en condiciones ambientales de Loja en el mes 1.
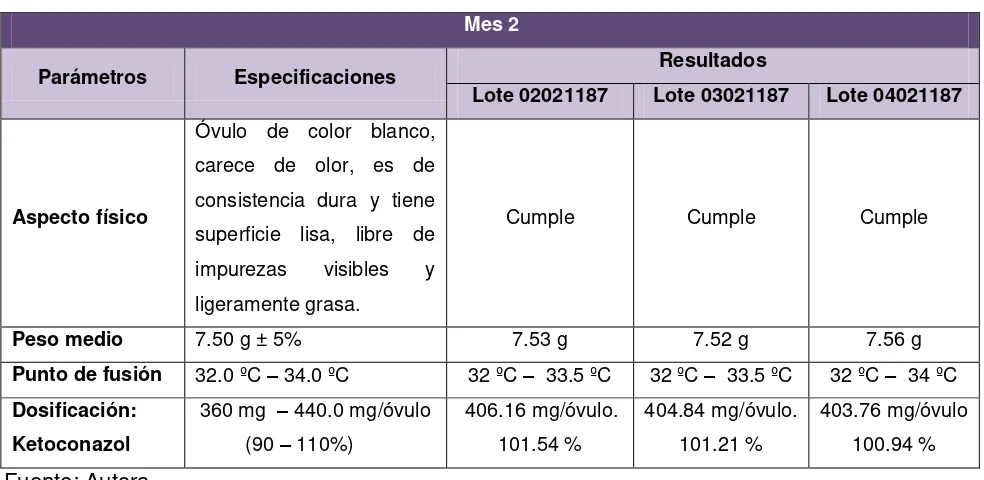
Tabla Nº 22. Resultados de pruebas de estabilidad en condiciones ambientales de Loja en el mes 2.
Tabla Nº 23. Resultados de pruebas de estabilidad en condiciones ambientales de Loja en el mes 3.
Tabla Nº 27. Resultados de pruebas de estabilidad a 45 ºC en el mes 1. Tabla Nº 28. Resultados de pruebas de estabilidad a 45ºC en el mes 2. Tabla Nº 29. Resultados de pruebas de estabilidad a 45 ºC en el mes 3. Tabla Nº 30. Datos de estabilidad para lote 02021187.
Tabla Nº 31. Valores de Ko para el lote 02021187.
Tabla Nº 32. Resultados de ecuación de Arrhenius para 02021187. Tabla Nº 33. Datos de estabilidad para lote 03021187.
Tabla Nº 34. Valores de Ko para el lote 03021187.
Tabla Nº 35. Resultados de ecuación de Arrhenius para 03021187. Tabla Nº 36. Datos de estabilidad para lote 04021187.
Tabla Nº 37. Valores de Ko para el lote 04021187.
Tabla Nº 38. Resultados de ecuación de Arrhenius para 04021187.
Tabla Nº39.Resultados de pruebas de estabilidad microbiológica en condiciones ambientales de Loja en el mes3.
ÍNDICE DE GRÁFICAS
Figura Nº 1. Gráfica de la recta para linealidad del método Figura Nº 2. Gráfica de la recta para linealidad del sistema Figura Nº 3. Gráfica de la ecuación de Arrhenius
Figura Nº 4. Gráfica de Concentración vs Tiempo para el lote 02021187 Figura Nº 5. Gráfica de Concentración vs Tiempo para el lote 03021187 Figura Nº 6. Gráfica de Concentración vs Tiempo para el lote 04021187
1
1. RESUMEN
2
2. ARTÍCULO
DESIGN AND DEVELOPMENT OF KETOCONAZOLE VAGINAL OVULES
Andrea E. Villagómez, B. Geovanni López, E. Santiago Ojeda
Instituto de Química Aplicada. Universidad Técnica Particular de Loja. S/N San Cayetano Alto P.O.Box 11-01-608 Loja - Ecuador.
a*
aevillagomez@utpl.edu.ec
ABSTRACT:
Yeast infections affect millions of women around the world and they are the cause of gynecological more frequent in women in reproductive age. This disease has different etiologies, however the predominant infection is caused by yeast whose most common species is Candida albicans, so the objective of this project was to design and develop vaginal ovules for an effective treatment against the most common etiologic agent of vaginal infections using Ketoconazole (400 mg). The analytical method developed was by UV spectrophotometry, with its respective validation, which assessed the precision, accuracy and linearity of the method and system. For the medicament formulation, we used the suppository base: Ovucire WL 2944 and the manufacturing process to prepare three pilot batches was alveolar filling or directly on the package. The products were subjected to physical, chemical and microbiological controls and tested for accelerated stability during three months. After the stability data were analyzed using the Arrhenius method.
Keywords: Ketoconazole, Ovucire, ovule, accelerated stability.
INTRODUCTION
One of the most common diseases in the female population is vulvovaginitis, which affects millions of women around the world. Approximately 70% of women attending for gynecological problems are diagnosed with this disease. (Valdeiglesias N. et al. 2001)
The word "vulvovaginitis" refers to the different degrees of inflammation of the vulva, vagina, and ectopic endocervical tissue. More than half of cases of this disease are infectious, and the main causes are trichomoniasis, candidiasis and bacterial vaginosis.
Vaginal candidiasis or yeast infection, is the second leading cause of vaginitis in women of reproductive age and Candida albicans has been identified as the species involved in more than 90% of cases . (Azzam M., et al. 2002).
3 ovules as the dosage form for the development of this project.
As for the selection of the active ingredient, Ketoconazole was elected, because it presents some advantages over other antifungal drugs, as either individually or in combination it shows efficacy in the treatment of vaginal candidiasis (vaginal topical or oral ) and it has no systemic adverse effects. (Godinez V et al, 2005)
For the formulation of ovules is used specific excipients, known as bases of suppositories, some examples of these bases are: Akosoft, Akosol, Cremao, CS-34, CS-36 Cremao; hydrogenated vegetable glycerides: Massa estarinum, Massupol, Novato, semisynthetic glycerides: Suppocire, Ovucire, Wecobee, Witepsol. The main application of these suppository bases, it is precisely as a vehicle for rectal or vaginal administration of a variety of drugs for both local and systemic action. For this study, the base used was Ovucire WL 2944.
During drug development, a fundamental step is the validation of analytical methods to be applied during the analysis of finished product, for that reason this thesis validated the analytical method developed by UV spectrophotometry, ensuring compliance with performance characteristics (precision, accuracy and linearity of the method and system) and their acceptance criteria. This ensures the quality of the product as well as providing a high degree of trust, security and quality of results.
The period of validity of the products obtained by the manufacturing of three pilot batches were evaluated using accelerated stability tests, which are intended to provide evidence of how the quality of the drug or product varies with time under the influence of a variety environmental factors such as temperature and humidity. These stability studies also included the respective physical, chemical and microbiological controls in finished product.
2. MATERIALES Y MÉTODOS
Raw material:
Active Ingredient: Ketoconazole Excipient: Ovucire WL 2944 Pachaging: HDPE
2.1. Formulation and manufacture
For ovules, is necessary calculate the displacement facto, this calculation gave a formulation. Then three pilot batched were prepared using the alveolar filling method or directly on the container.
2.4. Analytical method: Validation
For validation of analytical method we evaluated 3 different concentrations of active ingredient: 80%, 100% and 120%, made by two analysts in two periods different of time. The Ketoconazole content was determined by UV spectrophotometry at 270 nm, using methanol as a solvent, the concentration of the standard was of 0.2 mg/mL. The equipment used was a Spectrophotometer (Type: Helios Beta, NC: 9423 UVB 1202E; No: 091602 UVB; V ~ 100 - 240, Hz: 50/60, VA: 180).
2.2. Stability conditions
The Ketoconazole ovules were evaluated during three months at three different conditions: ambient temperature, temperature: 30 °C ± 2° C, relative humidity: 70% ± 5%; and temperature: 45 °C ± 2 °C relative humidity: 75% ± 5%. Also products were taken every month for physical, chemical and microbiological stability evaluations. The physical control included the measurement of melting point that was determined by Melting Equipment. (Brand: Fisher-Johns, volts: 120, amp: 1.4, HZ: 50/60, serial: 4022)
4 Ketoconazole was subjected to degradation whit: H2O2, HCl 0.1 N solution, NaOH 0.1 N solution during 20 days in two different temperatures: ambient and 45 °C. Then these solutions were evaluated by TLC (thin layer chromatography), to consider as absence of degrading, the RF value of solutions must be equal to the standard.
RESULTS AND ANALYSIS
3.1. Formulation
Then of calculate the displacement facto we obtained the formula shown in Table 1.
COMPONENTS
THEORETICAL
FORMULA UNIT REAL FORMULA UNIT PILOT BATCH FORMULA mg/ovule Percentage mg/ovule Percentage
Active: Ketoconazole Excipient: Ovucire WL 2944 400 mg 1600 mg 20% 80% 402.29 mg 1783.97mg 18,40% 81,60% 12068.7 mg 53519.1 mg TOTAL 2000 mg 100% 2186.26
mg
100% 65587.8 mg
Table1. Formula Ketoconazole ovules.
During manufactured process we added a percentage by loss (5%) to the formula.
3.2. Analytical method.
The data analyzed gave the following results:
Precision: coefficient of variation for reproducibility and repeatability of the method and sistem, was less than 2, so this parameter is adopted.
Accuracy: the recovery rate is within the limit of 98.0 - 102.0 thus complies with this parameter.
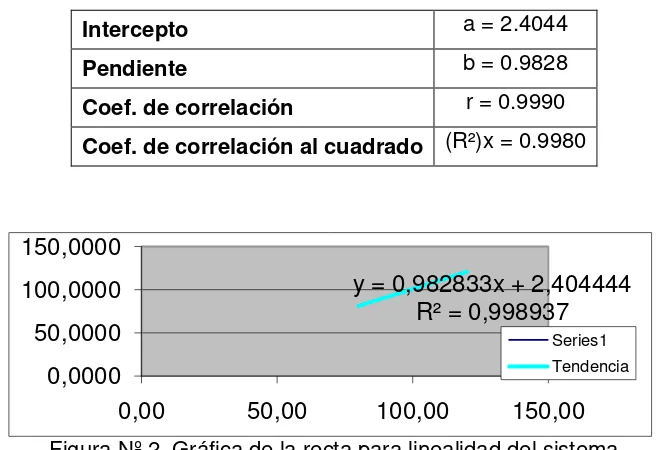
Linearity: met with the test of hypothesis for the slope, the intercept for the correlation coefficient and analysis of variance
requirements and because this results we approved the use of analytical method by spectrophotometry UV to the evaluation of finished product.
3.3. Stability
[image:15.612.327.538.262.376.2]The chemical stability of the product of three batches evaluated by spectrophotometry UV, were analyzed using Arrhenius method, this analysis gave as a result a shelf life above two years. An example of data analyzed is shown in Table 2.
PERIOD OF TIME
CONCENTRATION (%) AMB. LOJA
30 °C 45 °C (months) 16
0 101.68 101.68 101.68
1 100.98 101.02 100.74
2 101.54 100.89 100.83
3 100.65 100.07 99.97 Table 2. Data in Batch 1
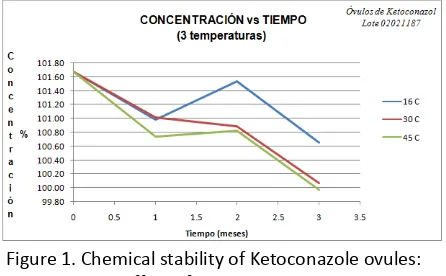
[image:15.612.325.548.511.649.2]Representing data in Table 2, we obtained the Fig. 1, this show the three different temperatures at which the product was subjected; in general the quantification of the active tend to remain constant during the three months of study, because of that, the Arrhenius method (Table 3) give as a result, in this case, a shelf life of 25.02 moths (2.09 years).
Figure 1. Chemical stability of Ketoconazole ovules: effect of temperature.
APPLICATION ARRHENIUS EQUATION
5
TEMP. (°C) 16 30 45 1/T (°K) 0.00346021 0.00330033 0.0031447
Log ABS (ko ) -1.37436579 -0.70117935 -0.6851790
Log A = 6.3210171
(-Ea/R) = -2193.1706
Log K (30°C)= -0.91716975
[image:16.612.332.534.85.218.2]K (30°C)= 0.39964855 Table 3. Arrhenius method
SPECS USP: 90 – 110% t 90 % = (100 - 90)/K(30°C)
t 90%, (30 ºC), ORDER 0 = 25.02 MONTHS 2.09 YEARS
As regards the microbiological stability, the products met the acceptance criteria for the microbiological quality of non-sterile preparations for pharmaceutical use of the USP 32 NF27 for ovuels (Table 4), these results indicate absence of contamination, confirming that the process was done under the rules of proper manufacturing and the packaging used complied with the required tightness.
TEST SPECS
Total count of aerobic
microorganisms / g Maximum 100 ufc/g
Combined total count filamentous fungi and yeasts / g
Maximum 100 ufc/g
Pseudomonas aeruginosa Absence
Staphylococcus aureus Absence
Candida albicans Absence
Table 4. Acceptance criteria for the microbiological quality in ovules
3.4. Degrading Identification
The Table 5 shows the results of the solutions used in this method. Then three months when the ovules were evaluated, the results indicated no presence of degrading, because the RF values of these products corresponded with the standard.
Sample RF Value
Estándar 0.33
Ketoconazole 0.33
HCl Solution 45°C Absence of spot HCl Solution ambient Absence of spot NaOH Solution 45°C Absence of spot NaOH Solution ambient Absence of spot H2O2 Solution 45°C 0.267
[image:16.612.66.294.85.254.2]H2O2 Solution ambient 0.289 y 0.44
Table 5. Results of degrading identification
CONCLUSIONS
- The analytical method by UV visible spectrophotometry at 270 nm, is valid for the quantification of Ketoconazole in ovules, because it meets the guidelines of accuracy, precision and linearity of the method and system.
- The product, whose formulation uses the base of the commercial Gattefossé: Ovucire WL 2944, meets the specifications for physical, chemical and microbiological stability, so we consider this base as suitable for the formulation and manufacture of Ketoconazole ovules.
[image:16.612.61.304.436.563.2]6 References
Abidi S. y Sequeira J. 2000. Procedimiento para la preparación de un supositorio vaginal. Schering Corporation 2000 Galloping Hill Road Kenilworth New Jersey 07033, US. Patente con publicación Nº ES 2 038 161.
Azzam M., Cermeño J., Orellán Y., Penna S. 2002. Vulvovaginitis por Candida spp. y Trichomonas vaginalis en mujeres sexualmente activas. Invest. clín v.43 n.1
Balata G., Mahdi M., Abu Bakera R. 2010. Improvement of solubility and dissolution properties of ketoconazole by solid dispersions and inclusion complexes. Asian Journal of Pharmaceutical Sciences 2010, 5 (1): 1-12
British Pharmaceutical Codex. 12th. 1994. The Pharmaceutical Press. London.
Castillo E., Garibay M., Felio M., Gonzalez J. 2008. Eficacia del ketoconazol y la clindamicina vaginal vs clindamicina oral en la prevención de la rotura prematura de membranas. Ginecol Obstet Mex 2008;76(7):373-380.
Castro M., García C., Cifuentes A., Crego A., Marina M. 2006. Identification and quantitation of cis-ketoconazole impurity by capillary zone electrophoresis–mass spectrometry. Journal of Chromatography A, 1114 pp. 170–177.
Ekiert R., Krezk J. 2009. Determination of azole antifungal medicines using zero-order and derivative uv spectrophotometry. Acta Poloniae Pharmaceutica - Drug Research, Vol. 66 No. 1 pp. 19 - 24.
Enayatifard R., Khalili N., Rahimizadeh M., Morteza-SemnaniK. 2005. Investigation Of Degradation Pathways Of Ketoconazole In Aqueous Media. Trade Science Inc. – India. Vol. 2, Issue 7.
Farhadi K., Maleki R. 2001. A new spectrophotometric method for the determination of Ketoconazole based on the oxidation reactions. Analytical Sciences ,Vol.17 Supplement. The Japan Society for Analytical Chemistry.
Farmacopea de los Estados Unidos de América 30. Formulario Nacional 25. 2007. Vol.1 (1151) Formas Farmacéuticas. pp. 691 – 692.
Faulí C., Aroztegui M., Azemar N., Barbe R., Bel E., Bustamante P. 1993. Tratado de Farmacia Galénica. Primera Edición. Madrid. Cap. 53. pp. 742 – 744.
Francois M., Karel J., Snoeckx E., Carolus L. 2005. Emulsiones tópicas de ketoconazol. Patente Europea: ES 2 240 977 T3.
Godínez V., Garibay M., Mirabent F., Pérez A. 2005. Comparación de la eficacia de la combinación ketoconazol 400 mg + clindamicina 100 mg, con ketoconazol 800 mg + clindamicina 100 mg en vaginitis por Candida y vaginosis bacteriana. Ginecol Obstet Mex 2005; 73: 302-307.
Goodman y Gilman. Las bases farmacológicas de la terapéutica. 2007. 11ª edición. Cap. 49. pp. 1253 -1254.
Katdare A., Chaubal M. 2006. Excipient Development for Pharmaceutical, Biotechnology, and Drug Delivery Systems. Informa Healthcare USA. Cap. 13. pp. 210.
Kedor-HackmannE., Nery M., Miritello M. 1994. Determination of Ketoconazole in Pharmaceutical Preparations by Ultraviolet Spectrophotometry and High Performance Liquid Chromatography. Analytical Letters, Vol. 27, pp: 363 – 376.
7
Hernández J., Vásquez A., Olguín C., Dumet P., Gutiérrez M. y De Zordo D. 2008 Prevalencia de vaginitis mixta en mujeres latinoamericanas según la percepción de los médicos. Preferencia, efectividad e inocuidad de clindamicina más ketoconazol. Ginecología y Obstetricia de México;76(11):652-658.
Holmes KK, Stamm WE. 1999. Lower genital tract infection in women: urethral, cervical and vaginal infections. In: Holmes KK, Sparling PF, Mardh P-A, Lemon SM, et al, editors. Sexually transmitted diseases. 3rd ed. New York: McGraw-Hill.
Lieberman H. et al. 1996. Pharmaceutical Dosage Forms: Disperse Systems. Volume 2. Second Edition, Revised and Expanded. Cap. 12: Suppository Development and Production. pp. 447 – 492
Pimentel B., Reynolds E. 2007. Candidiasis Vaginal. Revista Paceña de Medicina Familiar; 4(6): pp. 121-127
Rowe R., Sheskey P. y Owen S. 2003. Handbook of Pharmaceutical Excipients.. Fifth Edition. Great Britain. pp. 636.
Salazar R, Amela J., Valero E. Gestión de la Calidad en el Desarrollo y Fabricación Industrial de Medicamentos. 2001. 1ª Edición. Barcelona.
Skiba M., Skiba-Lahiani M., Marchais H., Duclos R., Arnaud P. 2000. Stability assessment of ketoconazole in aqueous formulations. International Journal of Pharmaceutics 198, pp: 1–6.
Skoog D., Holler F. 2001. Principios de Análisis Instrumental. 5ª Edición. Editorial McGraw-Hill. España. pp 353.
Sobel J., Faro S., Force R., Foxman B., Ledger W., Nyirjesy P., Reed B., Summers P. Vulvovaginal candidiasis: epidemiologic, diagnostic, and therapeutic considerations. Obstet Gynecol 1998 Feb;178(2): 203-211.
Valdeiglesias Cabrera N, Medrano-Vásquez AO. 2001. Vaginitis en mujeres sexualmente activas. Centro de Salud Urubamba. SITUA 10(19):47-49.
Willard H., Merritt, L. 1991. Métodos Instrumentales de Análisis. Editorial Iberoamericana. pp 157 – 158.
8
3. INTRODUCCIÓN Y ANTECEDENTES
La industria farmacéutica tiene como principal objetivo la obtención y síntesis de productos químicos y biológicos orientados a la prevención o tratamiento de enfermedades; por tal motivo, los laboratorios habitualmente deben realizar tareas de investigación con el fin de introducir nuevos fármacos o tratamientos mejorados; esto involucra un plan de diseño y desarrollo muy bien elaborado, cuyo paso inicial es seleccionar el tratamiento al cual va ir dirigido el medicamento, el mismo que suele basarse en la demanda de los pacientes; es así que los medicamentos que más se desarrollan, son precisamente aquellos cuyas enfermedades son más frecuentes.
Una de las enfermedades más comunes en la población femenina es la vulvovaginitis, que afecta a millones de mujeres en todo el mundo. Aproximadamente el 70% de mujeres que acuden a consulta médica por un problema ginecológico, son diagnosticadas con esta enfermedad. (Valdeiglesias N. et al. 2001)
El término “vulvovaginitis” se refiere a los diferentes grados de inflamación de la vulva, la vagina y el tejido endocervical ectópico. Más de la mitad de los casos de este padecimiento son de origen infeccioso, entre las que destacan las causadas por tricomonas, candidiasis y vaginosis bacteriana, además de las causadas por otros microorganismos (herpes, gonococo, clamidias, etc.)
De todos los agentes etiológicos de infecciones vaginales, la candidiasis vaginal o infección por levaduras, constituye la segunda causa de vaginitis en mujeres en edad fértil, en las que, Candida albicans ha sido señalada como la especie involucrada en más del 90% de los casos. (Azzam M., et al. 2002). En general, la candidiasis se debe a
9
Se estima que tres de cada cuatro mujeres (75%) padecen o padecieron candidiasis; de las cuales un 5% sufre de candidiasis vaginal recurrente. (Holmes et al. 1999). En
muchas ocasiones, los episodios de infección que se repiten en el tiempo son el resultado de nuevas infecciones o tratamientos inadecuados o incompletos. (Hernández J., et al 2004).
Habitualmente los tratamientos se hacen con óvulos, tabletas o cremas vaginales, y pueden durar uno o tres días, aunque en algunos casos se indican óvulos durante una semana. En lo que se refiere al tratamiento de vulvovaginitis recurrentes, en general, la primera línea de actuación es la vía local o tópica, reservando la vía oral para casos de intolerancia o inmunosupresión. (Ziarrusta G. 2002)
Para especificar la forma farmacéutica a diseñar, realizamos un estudio previo de mercado basado en Estadísticas Económicas de Auditorías tales como IMS (International Marketing Services), Data Quest y Close Up, en el que se pudo observar que en la Industria Farmacéutica Ecuatoriana, la participación en el mercado de las presentaciones farmacéuticas de uso vaginal es del 1,91% y se ubica en quinto lugar por debajo de los sólidos orales (66,33%), líquidos orales (16,96%), inyectables (7,47%) y dermatológicos (4,42%). De este grupo de presentaciones de uso vaginal, los óvulos ocupan el primer lugar, seguido de presentaciones como: crema, tableta, solución y gel vaginales.
Una vez establecido el tratamiento o forma farmacéutica y los pacientes a quienes irá dirigido, el siguiente paso es especificar la materia prima; es decir: principio activo, excipientes y envase, cuya aprobación dependerá de su cumplimiento con las especificaciones de la USP 32 NF 27 (United States Pharmacopeia 32 National Formulary 27) y sus respectivos Certificados de Análisis.
10
MEDICAMENTA, por lo que es el líder, obteniendo excelente participación, crecimiento y evolución en el mercado durante los años 2007, 2008 y 2009 (International Marketing Services); esto asegura que, en lo referente a óvulos de Ketoconazol, tendrán escasa competencia en el mercado nacional, situación que siempre es trascendental antes de lanzar un nuevo producto.
Asimismo el Ketoconazol, presenta algunas ventajas con respecto a otros antifúngicos, pues ya sea en forma individual o combinada, demuestra eficacia en el tratamiento de la candidiasis vaginal (tratamiento tópico vaginal o por vía oral); y no tiene efectos adversos sistémicos. (Godínez V et al, 2005)
El desarrollo de una forma farmacéutica frecuentemente sometida a exigencias clínicas, debe ir precedido de dos etapas muy importantes como son la preformulación y formulación del medicamento. La caracterización de las propiedades físicas, químicas y microbiológicas del principio activo y los excipientes, comprobando su estabilidad frente a los principales agentes causantes de degradación, así como la evaluación de posibles incompatibilidades entre el principio activo y sus excipientes, constituye la etapa de preformulación farmacéutica, cuya calidad y organización contribuirán al éxito del desarrollo de medicamentos con tres cualidades fundamentales: estabilidad, seguridad y eficacia. (Faulí C. et al. 1993).
Según la USP 32 NF27 los óvulos son formas farmacéuticas aplicadas por vía vaginal que se incluyen en el grupo de supositorios: “Los supositorios son cuerpos sólidos de diversos pesos y formas, adaptados para la introducción en el recto, vagina u orificio uretral del cuerpo humano. Por lo general se derriten, ablandan o disuelven a la temperatura corporal”.
11
posible en contacto con la parte infectada. (Faulí C. et al. 1993). Es por ello que los
supositorios son adecuados para la mucosa vaginal, pues proporcionan una duración prolongada de la eficacia. (Abidi., et al. 2000)
Para la formulación de supositorios, actualmente, suelen utilizarse excipientes específicos, conocidas como bases de supositorios, mismas que son desarrolladas por diferentes casas comerciales, algunos ejemplos de estas bases son: Akosoft, Akosol, Cremao, CS-34, Cremao CS-36; glicéridos vegetales hidrogenados: Massa estarinum, Massupol, Novata; glicéridos semisintéticos: Suppocire, Ovucire, Wecobee, Witepsol. La principal aplicación de estas bases para supositorios, es precisamente, como vehículo para administración rectal o vaginal de una variedad de fármacos, tanto para acción local como sistémicos.
La selección de una base para óvulos se fundamenta en el conocimiento previo de preformulación, así como en los ensayos llevados a cabo en el laboratorio; esta selección es de vital importancia, puesto que la base de supositorio empleada tiene una gran influencia en la liberación del principio activo incorporado. (USP 32 NF27).
Durante el desarrollo de medicamentos, asimismo, una fase fundamental es la validación de los métodos analíticos a aplicar durante el análisis de producto terminado. La validación consiste en comprobar y certificar con evidencia documentada, que un método, sistema o proceso cumple y se desarrolla tal y como estaba previsto, dentro de intervalos definidos, cumpliendo con características de desempeño (exactitud, precisión y linealidad de método y sistema) y sus criterios de aceptación. Esto garantiza la calidad del fármaco así como también proporciona un alto grado de confianza, seguridad y calidad de los resultados.
12
almacenamiento, cuyo objetivo es determinar los parámetros cinéticos de los procesos de degradación o predecir período de validez; estos deben cumplir con las especificaciones de calidad establecidas por las normas del INH (Instituto Nacional de Higiene y Medicina Tropical “Leopoldo Izquieta Pérez”), mismas que tienen el propósito de proveer evidencia de cómo la calidad del fármaco o producto varía en el tiempo, bajo la influencia de una variedad de factores ambientales, tales como temperatura y humedad.
Como se señaló anteriormente, el organismo técnico que evalúa el cumplimiento a cabalidad de todos los requisitos antes mencionados de un medicamento, para la concesión de Registro Sanitario, en nuestro país es el Instituto Nacional de Higiene y Medicina Tropical “Leopoldo Izquieta Pérez”; por lo que en esta tesis, conjuntamente, expondremos los requerimientos básicos para tramitar el Registro Sanitario, en los cuales el producto de este proyecto cumple.
Dados los argumentos antes expuestos, nuestro estudio tiene como fin cumplir con los siguientes objetivos:
GENERAL:
Diseñar y desarrollar óvulos, utilizando como principio activo: Ketoconazol y como excipiente la base Ovucire WL 2944.
ESPECÍFICOS:
- Investigar la preformulación farmacéutica del principio activo: Ketoconazol para óvulos.
13
- Aplicar el método analítico de producto terminado con su respectiva validación.
- Determinar la estabilidad del medicamento.
14
4. MATERIALES Y MÉTODOS
4.1. PREFORMULACIÓN
La preformulación consistió en dos etapas. En la primera se realizó la investigación bibliográfica de las propiedades físicas y químicas del principio activo, excipiente y envase; y en la segunda etapa se evaluaron, mediante ensayos, los parámetros que a continuación se indican:
4.1.1. Parámetros físico-químicos
Dentro del Certificado de Análisis Bulk Medicines & Pharmaceuticals GmbH (anexo 10.1) y la USP 32 NF 27, constan los siguientes parámetros a medir, en el polvo de Ketoconazol:
a) Aspecto físico: observar minuciosamente el polvo sobre una superficie blanca y anotar sus características.
b) Solubilidad: realizar varias disoluciones de 100 mg de Ketoconazol en 10 mL de agua, metanol y etanol.
c) Punto de fusión: colocar una muestra milimétrica de Ketoconazol en el equipo de punto de fusión y observar detenidamente la temperatura a la cual se funde.
d) Pérdida por secado: secar al vacío a 80 ºC durante 4 horas: no pierde más de 0,5% de su peso.
15
para obtener una solución estándar diluida con una concentración de 1,0 mg/mL. Aplicar porciones separadas de 10 µl de solución prueba y de la solución estándar y una porción de 2 µl de solución estándar diluida a la línea de partida de una placa para TLC. Dejar que se sequen las aplicaciones y desarrollar el cromatograma en una cámara cromatográfica no saturada adecuada con una fase móvil constituida por una mezcla de n-hexano, acetato de etilo, metanol, agua y ácido acético glacial (42: 40: 15: 2: 1:) hasta que el frente de la fase móvil haya recorrido aproximadamente tres cuartos de la longitud de la placa. Retirar la placa de la cámara cerrada y secarla al aire. Revelar las placas y localizar las manchas: la mancha principal obtenida con la solución de prueba tiene aproximadamente el mismo tamaño y el mismo valor de RF que las obtenidas con la solución estándar, y
la suma de las intensidades de toda mancha secundaria obtenida en la solución de prueba no excede la intensidad de la mancha principal obtenida con la solución estándar diluida.
De igual forma en lo que se refiere a la base Ovucire, el Handbook of Pharmaceutical Excipients, requiere los siguientes controles físicos para bases de supositorios:
a) Aspecto físico: observar detenidamente la cera sobre una superficie blanca y anotar sus características.
b) Solubilidad: realizar varias disoluciones de la cera en agua, cloroformo y etanol caliente.
16 o Equipo y material de laboratorio:
Material de vidrio: 4 vasos de precipitación de 50 mL, 2 balones volumétricos de 50 mL, 4 balones volumétricos de 100 mL, 1 probeta de 50 mL, 2 pipetas volumétricas de 5 mL, 2 pipeta volumétricas de 10 mL.
Reactivos: - Agua destilada - Metanol
- Etanol - n-hexano - Acetato de etilo - Ácido acético glacial - Cloroformo
Equipos e Instrumentos:
- Balanza analítica de precisión. (Marca Mettler, modelo: AC 100-8.)
- Espectrofotómetro. (Tipo: Helios Beta; NC: 9423 UVB 1202E; No: UVB 091602; V~: 100 – 240; Hz: 50/60; VA: 180) (Foto 1)
- Equipo de Punto de Fusión. (Marca: Fisher-Johns, volts: 120, amp: 1.4, H.Z: 50/60, serial: 4022) (Foto 2)
- Cámara para TLC.
17 4.1.2. Control Químico
o Dosificación Ketoconazol
Condiciones del Equipo: Espectrofotómetro Detector: UV
Longitud de onda: 270 nm.
o Preparación de las muestras:
Estándar: pesar aproximadamente 100 mg de ER de Ketoconazol en un balón de 100 mL, disolver y aforar con metanol. Tomar una alícuota de 10 mL de esta solución y aforar en un balón de 50 mL con metanol.
Muestra: pesar aproximadamente 402,29 mg de Ketoconazol micronizado que equivale a 400 mg de Ketoconazol, debido a la pureza del 99.43% dada en el certificado de análisis del proveedor (anexo: 10.1) y aforar con metanol en un balón de 100 mL. Tomar una alícuota de 5 mL y aforar con metanol en un balón de 100 mL, para obtener una concentración de 0,2 mg/mL, misma que será igual en el estándar. Homogenizar, filtrar y leer en espectro UV a una longitud de onda de 270 nm.
o Operación: Una vez alcanzadas las condiciones antes citadas en el
espectrofotómetro, realizar 2 lecturas de la muestra y 6 lecturas del estándar, y comparar los resultados. El coeficiente de variación de los 6 estándares no debe ser mayor a 2.0%. (USP 32 NF27)
o Cálculos:
18 Simbología:
Am = Absorbancia de la muestra. Wst = Peso del estándar.
Pst = Porcentaje de pureza del estándar.
AstX = Absorbancia promedio de los 6 estándares.
Wm = Peso de la muestra.
4.2. FORMULACIÓN
La fórmula de composición en el caso de esta tesis fue: Ketoconazol (400mg) como principio activo y la base Ovucire como excipiente o vehículo.
Factor de desplazamiento: debido que la dosificación de óvulos se hace en volumen y que las densidades del principio activo y excipiente son diferentes, se requiere establecer la cantidad de excipiente necesario para la fórmula, calculando el denominado factor de desplazamiento, el cual se define como la cantidad de excipiente, expresada en gramos, desplazada por un gramo de principio activo.
4.2.1. Ensayos para determinar cantidad de excipiente
o Material de laboratorio:
Material de vidrio: 2 vasos de precipitación de 100 mL, 1 varilla de agitación.
Otros materiales: espátula, mechero, termómetro, cápsula de porcelana.
Instrumentos: Balanza analítica de precisión. (Marca Mettler Toledo, d= 0,01g)
o Materias primas:
Principio Activo: Ketoconazol
Excipiente: Ovucire
19 o Procedimiento: (Faulí et al. 1993)
1. Elaborar 3 óvulos solo con excipiente y anotar su peso promedio. (A)
2. Vaciar el contenido de los envases de los 3 óvulos elaborados solo con excipiente en una cápsula de porcelana y fundirlos, primero dos de ellos, añadiendo una cantidad conocida de principio activo (x). Mezclar y verter nuevamente el contenido en los tres envases.
3. Fundir el tercer óvulo solo de excipiente que quedaba y terminar de llenar los 3 envases. Una vez solidificados y bien enrasados mediante espátula, se pesan y se anota su peso promedio (B).
4. Cálculos:
El factor de desplazamiento se calcula mediante la siguiente fórmula: F= A – (B – X)
X Donde:
A= Peso promedio de óvulo solo con excipiente.
B= Peso promedio de óvulo con excipiente y principio activo. X= Gramos del principio activo.
Luego de calcular el factor de desplazamiento, para determinar la cantidad de base necesaria para hacer los óvulos, se utiliza la siguiente fórmula:
M = F −Σ( fS )
Donde:
M = Masa en gramos de la base a utilizar por óvulo. F = Capacidad en gramos del molde.
20
4.3. MÉTODO ANALÍTICO DE PRODUCTO TERMINADO
4.3.1. Control Físico y Químico (Valoración e Identificación del principio activo)
o Material de laboratorio:
Material de vidrio: 2 balones volumétricos de 50 mL, 4 balones volumétricos de 100 mL, 1 probeta de 50 mL, 2 pipetas volumétricas de 5 mL, 2 pipetas volumétricas de 10 mL, cámara para TLC.
Otros materiales: espátula, placas para TLC, termómetro.
o Equipos:
Balanza analítica de precisión. (Marca Mettler, modelo: AC 100-8.)
Espectrofotómetro. (Tipo: Helios Beta; NC: 9423 UVB 1202E; No: UVB 091602; V~: 100 – 240; Hz: 50/60; VA: 180)
Equipo de Punto de Fusión. (Marca: Fisher-Johns, volts: 120, amp: 1.4, H.Z: 50/60, serial: 4022)
o Reactivos: Metanol
4.3.1.1. Control Físico
o Apariencia física o características organolépticas: observar detenidamente el
óvulo y anotar sus principales características.
o Peso promedio: pesar 10 óvulos y calcular el valor promedio y coeficiente de
21
o Punto de fusión: colocar una muestra milimétrica del óvulo de Ketoconazol en el
equipo de punto de fusión y observar detenidamente la temperatura a la cual se funde.
4.3.1.2. Control Químico:
o Dosificación Ketoconazol (Óvulo)
Condiciones del Equipo: Espectrofotómetro Detector: UV
Longitud de onda: 270 nm.
o Preparación de las muestras:
Estándar: pesar aproximadamente 100 mg de ER Ketoconazol en un balón de 100 mL, disolver y aforar con metanol. Tomar una alícuota de 10 mL de esta solución y aforar con metanol en un balón de 50 mL.
Muestra: pesar aproximadamente 2,186 g de óvulos triturados en un balón de 100 mL (equivalente a 400 mg de Ketoconazol, que es la dosis del óvulo), agregar 80 mL de metanol, calentar en baño maría (40 ºC), durante 5 a 10 minutos; en constante agitación, hasta que se disuelva el óvulo, luego aforar con metanol. Tomar una alícuota de 5 mL y aforar con metanol en un balón de 100 mL, para obtener una concentración del 0,2 mg/mL, misma que será igual en el estándar; en caso de observar presencia de grumos, llevar nuevamente la solución a baño maría. Homogenizar, filtrar y leer en espectro UV a una longitud de onda de 270 nm.
o Operación: Una vez alcanzadas las condiciones antes citadas en el
22 o Cálculos:
Simbología:
Am = Absorbancia de la muestra. Wst = Peso del estándar.
Pst = Porcentaje de pureza del estándar. Wx = Peso promedio.
Ast = Absorbancia del estándar.
Wm = Peso de la muestra. 2500 = Factor de dilución.
4.3.2. Control microbiológico
Según las especificaciones de la USP 32 NF27, los productos farmacéuticos de aplicación vaginal deben cumplir con las siguientes pruebas microbiológicas: recuento total de microorganismos aerobios, recuento total combinado de hongos filamentosos y levaduras, identificación de Pseudomonas aeruginosa, Staphylococcus aureus y Candida albicans.
o Equipos e instrumentos: Estufa
Autoclave
Cocineta
Balanza
Cámara de flujo laminar
Baño maría
Incubadora
23 o Medios de cultivo:
Agar de Soya – Tripticaseína (TSA)
Agar Sabouraud Dextrosa (SAB)
Tripticasa Soya Broth (TSB)
Base de caldo tetrationato (TAT)
o Medios de cultivo selectivos: Agar Vogel–Johnson (VJ)
Agar Cetrimida
o Método
Métodos de los capítulos: <61> Pruebas de límites microbianos y <62> Examen microbiológico de productos no estériles: pruebas de microorganismos específicos, de la USP 32 NF27. (pp. 91 – 105)
o Procedimiento:
Preparación de la muestra
1. Preparar los medios de cultivo de acuerdo a las especificaciones del fabricante. 2. Esterilizar los medios de cultivo en autoclave.
3. Dejar enfriar los medios de cultivo hasta 45 °C.
4. Suspender 10 gramos de óvulos de Ketoconazol triturados en 90 mL del medio TAT y agitar durante 15 minutos.
5. Dejar incubar durante 24 horas.
Contaje de Microorganismos aeróbicos totales
1. Tomar 1 mL de la muestra preparada y sembrar por vertido en el medio TSA en cajas Petri.
24 Contaje de hongos, mohos y levaduras.
1. Tomar 1 mL de la muestra preparada y sembrar por vertido en el medio Sabouraud Dextrosa (SAB) en cajas Petri.
2. Incubar durante 48 horas, a 35 °C + 2 3. Preparar un estándar o blanco.
Identificación de Staphylococcus aureus y Pseudomona aeruginosa
1. Tomar 1 mL de la muestra preparada y sembrar en Tripticasa Soya Broth (TSB) 2. Incubar durante 48 horas, a 35 °C + 2.
3. Preparar un estándar o blanco.
Identificación de Candida albicans
1. Tomar 1 mL de la muestra para inocular en 100 mL de Caldo Sabouraud Dextrosa y mezclar.
2. Incubar durante un período de 3 a 5 días a una temperatura de 30 ºC a 35 ºC. 3. Preparar un estándar o blanco.
Si luego de la incubación los caldos Soya Tripticasa y Sabouraud Dextrosa presentan turbidez, se debe llevar a cabo el siguiente procedimiento:
Pruebas de identificación:
1. Tomar un inóculo de la muestra preparada y sembrar por estría en agar Vogel Jonson (Staphylococcus aureus), en agar Cetrimida (Pseudomona aeruginosa) y en agar Sabouraud Dextrosa (Candida albicans).
2. Incubar a una temperatura de 30 ºC a 35 ºC durante un período de 24 a 48 horas.
25
4.4. MÉTODO DE IDENTIFICACIÓN DE DEGRADANTES
El Ketoconazol fue sometido a degradación con H2O2, solución HCl 0,1 N y solución
NaOH 0,1 N; luego los productos obtenidos de cada solución fueron evaluados mediante TLC, comparando con el resultado de TLC del ER Ketoconazol. Los materiales y equipo de laboratorio necesarios fueron los siguientes:
o Material de laboratorio
Material de vidrio: 4 balones volumétricos de 50 mL, 8 balones volumétricos de 25 mL, 1 probeta de 50 mL, 2 vasos de precipitación de 500 mL, 1 varilla de agitación, pipetas de 10, 5 y 1 mL, capilares para siembra de TLC, cámara para TLC.
Otros materiales: espátula, papel filtro, placas para TLC de 1.5 cm x 6 cm.
o Equipos:
Balanza analítica de precisión. (Marca Mettler, modelo: AC 100-8.)
Cámara de luz UV
Incubadora
o Reactivos: Cloroformo
n- hexano
Acetato de etilo
Metanol
Agua
Ácido acético glacial
Ácido clorhídrico
Hidróxido de sodio
Peróxido de hidrógeno
Vainillina
26 4.4.5. Procedimiento: (Skiba M. et al. 2000)
a) Degradación:
1. Someter al principio activo a degradación pesando 25 mg de Ketoconazol y diluir en 25 mL de: H2O2; una solución 0,1 N de HCl y una solución 0,1 N de NaOH;
para obtener soluciones con concentraciones de 1 mg/mL. Colocar cada solución en una estufa a 45 ºC y a temperatura ambiente, durante 20 días.
2. Preparar las placas de TLC para cada una de las soluciones siguiendo el procedimiento que se indica más adelante, que es el mismo para las muestras.
b) Identificación:
1. Transferir a un matraz una cantidad de muestra (óvulo) que corresponda a 50 mg de Ketoconazol y aforar a 50 mL con cloroformo, agitar aproximadamente 2 minutos y filtrar. Repetir este paso para obtener una solución en cloroformo del estándar de referencia de Ketoconazol, que contenga 1 mg/ mL, es decir la misma concentración que las soluciones de degradación preparadas con anterioridad.
2. Aplicar porciones separadas de aproximadamente 10 μL de todas las soluciones de Ketoconazol preparadas en diferentes placas de TLC de medidas: 6 cm de largo por 1.5 cm de ancho.
3. Dejar que las aplicaciones se sequen y desarrollar los cromatogramas en una cámara cromatográfica no saturada con una fase móvil constituida por una mezcla de n-hexano, acetato de etilo, metanol, agua y ácido acético glacial (42:40:15:2:1) hasta que el frente de la fase móvil haya recorrido aproximadamente tres cuartos de la longitud de las placas.
27
prueba se corresponde con el de la mancha principal obtenida a partir de la solución estándar.
5. Revelar las placas utilizando ácido sulfúrico y vainillina; y comparar los diferentes valores de RF.
6. Este método se llevará a cabo durante la primera semana luego de la manufactura y el tercer mes de estabilidad.
4.5. VALIDACIÓN DEL MÉTODO ANALÍTICO (CONTROL QUÍMICO)
o Procedimiento:
La validación del método analítico fue realizada por dos analistas, cada una llevó a cabo los ensayos en dos días consecutivos, haciendo por triplicado cada prueba y realizando seis lecturas de las muestras y estándar. Para obtener los resultados se necesitaron de cuatro días de ensayos.
o Condiciones del Equipo: Espectrofotómetro
Detector: UV
Longitud de onda: 270 nm.
o Preparación de las muestras:
Estándar: pesar aproximadamente 100 mg de ER Ketoconazol en un balón de 100 mL, disolver y aforar con metanol. Tomar una alícuota de 10 mL de esta solución y llevar a un balón de 50 mL diluir, aforar con metanol y homogenizar.
28
maría (40 ºC), durante 5 a 10 minutos; en constante agitación, hasta que se disuelva el óvulo, enfriar y aforar con metanol. Tomar una alícuota de 5 mL, diluir y aforar con metanol en un balón de 100 mL; en caso de observar presencia de grumos, llevar nuevamente la solución a baño maría. Homogenizar, filtrar y leer en espectro UV a una longitud de onda de 270 nm.
Muestra a concentración del 100%: Pesar aproximadamente 2,186 g de óvulos triturados en un balón de aforo de 100 mL (equivalente a 400 mg de Ketoconazol que es la dosis del óvulo), agregar 80 mL de metanol, calentar en baño maría (40 ºC), durante 5 a 10 minutos; en constante agitación, hasta que se disuelva el óvulo, luego aforar con metanol. Tomar una alícuota de 5 mL, diluir y aforar con metanol en un balón de 100 mL; en caso de observar presencia de grumos, llevar nuevamente la solución a baño maría. Homogenizar, filtrar y leer en espectro UV a una longitud de onda de 270 nm.
Muestra a concentración del 120%: Pesar aproximadamente 2,6232 g de óvulos triturados en un balón de aforo de 100 mL (equivalente a 480 mg de Ketoconazol, dosis presente en esta concentración), agregar 80 mL de metanol, calentar en baño maría (40 ºC), durante 5 a 10 minutos; en constante agitación, hasta que se disuelva el óvulo, enfriar y aforar con metanol. Tomar una alícuota de 5 mL diluir y aforar con metanol en un balón de 100 mL; en caso de observar presencia de grumos, llevar nuevamente la solución a baño maría. Homogenizar, filtrar y leer en espectro UV a una longitud de onda de 270 nm.
o Operación: Una vez alcanzadas las condiciones antes citadas en el
29 o Cálculos
Simbología:
Am = Absorbancia de la muestra Conc st = Concentración del estándar. Conc. m = Concentración de la muestra. 80 = Factor de cálculo para 80% 100 = Factor de cálculo para 100% 120 = Factor de cálculo para 120%
A stX = Absorbancia promedio de los 6 estándares.
4.6. PROCESO DE MANUFACTURA
Se basó en el llenado alveolar o directo en el envase. Tres lotes piloto fueron elaborados, de 30 unidades cada uno. Cada envase con el óvulo tuvo un peso promedio de 7.53 g.
o Material de laboratorio:
Material de vidrio: 2 vasos de precipitación de 600 mL, 2 varilla de agitación.
Otros materiales: espátula, mechero, termómetro.
Instrumentos: Balanza analítica de precisión. (Marca Mettler Toledo, d= 0,01g)
o Materias primas:
Principio Activo: Ketoconazol
Excipiente: Ovucire
30 4.6.1. Procedimiento: (Faulí C. et al. 1993)
El procedimiento llevado a cabo fue el siguiente:
1. Tomar precauciones de seguridad mediante el uso de mandil, cofia, guantes y mascarilla.
2. Comprobar la limpieza de los materiales y equipos a utilizar.
3. Verificar que las cantidades de materias primas correspondan a las establecidas en la fórmula, añadiendo un 5% como porcentaje por pérdida, tanto al principio activo como al excipiente (tabla 1):
Tabla Nº 1. Fórmula de manufactura por lote piloto
Componentes Cantidad por lote piloto Porcentaje por pérdida Cantidad total para manufactura por lote piloto
Principio Activo: Ketoconazol
Excipiente: Ovucire
12.0687 g
53.5191 g
0.6034 g
2.6759 g
12.6721 g
56.1950 g
TOTAL 65.5878 g 3.2793 g 68.8671 G
Fuente: Autora
4. Preparar la masa medicamentosa, fundiendo la base Ovucire (excipiente) hasta una temperatura aproximada de 55 ºC, para luego incorporar el principio activo: Ketoconazol agitando hasta el espesamiento de la masa, con el fin de lograr la máxima homogeneidad.
5. Cuando la masa esté a una temperatura aproximada de 40 ºC, verter con la ayuda de una varilla de cristal el total de la masa, repartiéndola de acuerdo a la cantidad de la fórmula unitaria en el número total de envases.
6. Dejar que la masa solidifique, colocando el producto en el refrigerador durante 40 a 45 minutos.
31 4.6.2. Envase:
Respecto a la selección del envase para óvulos, generalmente se utilizan termoformados de PVC, aluminio, entre otros; sin embargo, la poca factibilidad para obtener envases termoformados de PVC o aluminio, nos llevó a utilizar un envase de polietileno de alta densidad (PEAD); pues lo más importante de esta elección es cumplir con requisitos de hermeticidad y esterilidad, de manera que se cumpla con las normas de seguridad e integridad que aseguren la calidad del producto.
4.7. PRUEBAS DE ESTABILIDAD ACELERADA
Apoyado en las especificaciones de las normas del INH vigentes durante el desarrollo de este proyecto (anexo 10.7); los productos de los tres lotes piloto fueron sometidos a estabilidad acelerada durante tres meses. Estas pruebas implicaron las condiciones de almacenamiento: a temperatura ambiente de la ciudad de Loja (16 ºC), a una temperatura: 30 ºC ± 2 ºC y humedad relativa: 70 % ± 5% y a una temperatura: 45 ºC ± 2 ºC y humedad relativa: 75% ± 5%. Los resultados obtenidos durante la primera semana de manufactura y los meses: uno, dos y tres después de la manufactura, se calcularon mediante el método de Arrhenius, el cual permite predecir el tiempo de vida útil del medicamento.
En estas pruebas se incluyeron controles físicos y químicos como: aspecto físico o características organolépticas, peso medio, punto de fusión e identificación de degradantes realizadas al producto terminado de los tres lotes.
o Equipos e instrumentos:
Estufa calibrada a temperatura ambiente.
Estufa calibrada a 30 °C.
Estufa calibrada a 45 °C.
32 o Método
Basado en el método de Estabilidad Farmacéutica del capítulo <1150> de la USP 32 NF 27.
o Metodología
Colocar dentro de cada estufa un desecador que contenga una solución saturada de cloruro de sodio en la base.
Dejar estabilizar la temperatura y humedad relativa en el desecador.
Introducir el producto en cada desecador y tapar herméticamente.
Realizar el control de calidad de producto durante los días 30, 60 y 90. Revisar periódicamente la temperatura y humedad.
4.8. REGISTRO SANITARIO
33
5. RESULTADOS Y ANÁLISIS
5.1. PREFORMULACIÓN:
5.1.1. Investigación bibliográfica:
Comprende la obtención de la información de las características físicas y químicas como: fórmula y peso molecular, nombre químico, estructura, etc., tanto para el principio activo como para el excipiente y envase. Las tablas 2, 3 y 4 indican los datos investigados para la materia prima y envase.
Tabla Nº 2. Investigación bibliográfica del principio activo: Ketoconazol.
Parámetros Resultados
Estructura
Composición C 58.76%, H 5.31%, Cl 13.34%, N 10.54%, O 12.04%.
Nombre Químico cis – 1 - Acetil- 4 - [4 - [[2 - (2,4 - diclorofenil)- 2 -(1H-imidazol-1-ilmetil)-1,3-dioxolan-4-il]metoxi]fenil]piperazina. Fórmula Molecular C26H28Cl2N4O4
Peso Molecular 531.44 Número de
Registro CAS [65277-42-1]
Nombres Comerciales
34
Código del
fármaco R-41400
Acción Terapéutica
Activo por vía oral, antimicótico de amplio espectro.
Referencias bibliográficas: Orally active, broad-spectrum antimycotic. Prepn: J. Heeres et al., Ger. pat. 2,804,096, eidem, U.S. pats. 4,144,346 and 4,223,036 (1978, 1979, 1980, all to Janssen); eidem, J. Med. Chem. 22, 1003 (1979). Pharmacokinetics: E. W. Gascoigne et al., Clin. Res. Rev. 1, 177 (1981); C. Brass et al., Antimicrob. Ag. Chemother. 21, 151 (1982). HPLC determn in human serum: V. L. Pascucci et al., J. Pharm. Sci. 72, 1467 (1983). Series of articles on animal and human studies: Rev. Infect. Dis. 2, 519-692 (1980). Effect on hepatic enzymes in vitro and in vivo: K. N. Buchi et al., Biochem. Pharmacol. 35, 2845 (1986); J. K. Ritter, M. R. Franklin, Toxicol. Letters 36, 51 (1987). Case reports of hepatic toxicity: J. K. Heiberg, E. Svejgaard, Brit. Med. J. 283, 825 (1981); R. Rollman, L. Loof, Brit. J. Dermatol. 108, 376 (1983). Controlled clinical trials: E. A. Petersen et al., Ann. Intern. Med. 93, 791 (1980); W. T. Hughes et al., J. Infect. Dis. 147, 1060 (1983); H. W. Jolly et al., Cutis 31, 208 (1983). Clinical evaluation as inhibitor of steroid synthesis: N. Sonino, N. Engl. J. Med. 317, 812 (1987). Review of pharmacology and therapeutic efficacy: C. A. Sohn, Clin. Pharm. 1, 217 (1982); R. C. Heel et al., Drugs 23, 1-36 (1982). Series of articles on clinical efficacy and therapeutic experience: Drugs Exptl. Clin. Res. 12, 397-427 (1986).
Propiedades
Cristales de 4-metil-2-pentanona, mp 146 deg. DL50 en ratones, ratas, cobayas, perros (mg / kg): 44, 86, 28, 49 iv, 702, 227, 202, 780 por vía oral (talón).
Categoría
Terapéutica Antifúngico. Punto de fusión 146 ºC Temperatura de
almacenamiento
Mantener a una temperatura de 15 ºC y 30 ºC.
35
Tabla Nº 3. Investigación bibliográfica del excipiente: Ovucire
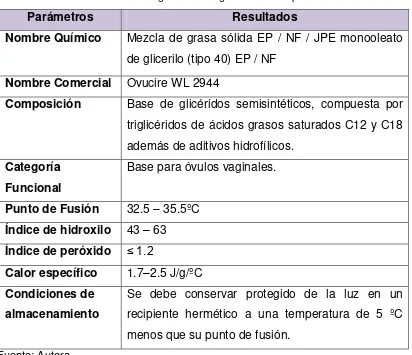
Parámetros Resultados
Nombre Químico Mezcla de grasa sólida EP / NF / JPE monooleato de glicerilo (tipo 40) EP / NF
Nombre Comercial Ovucire WL 2944
Composición Base de glicéridos semisintéticos, compuesta por triglicéridos de ácidos grasos saturados C12 y C18 además de aditivos hidrofílicos.
Categoría Funcional
Base para óvulos vaginales.
Punto de Fusión 32.5 – 35.5ºC Índice de hidroxilo 43 – 63 Índice de peróxido ≤ 1.2
Calor específico 1.7–2.5 J/g/ºC Condiciones de
almacenamiento
Se debe conservar protegido de la luz en un recipiente hermético a una temperatura de 5 ºC menos que su punto de fusión.
Fuente: Autora
Tabla Nº 4. Investigación bibliográfica del envase: PEAD
Parámetros Resultados
Estructura Es un polímero cuya estructura es lineal, sin ramificaciones.
Nombre Químico Polímero de la familia de los polímeros olefínicos: polietileno.
Peso Molecular Se encuentra en el rango entre 200.000 y 500.000 (adimensional)
Composición Es un polímero termoplástico conformado por unidades repetitivas de etileno.
Densidad ≤ a 0.952 g/cm3.
[image:46.612.99.514.485.698.2]36
5.1.2. Control físico y químico de materia prima y envase
[image:47.612.95.517.292.699.2]Los ensayos para los controles físicos y químicos necesarios en esta etapa de preformulación para aprobar la materia prima y envase a utilizar en la manufactura, obedecieron con las especificaciones de la USP32 NF27, Handbook of Pharmaceutical Excipients y Proveedores, por lo que fue factible su uso a lo largo de esta tesis. Los controles se resumen en los certificados de análisis, presentados en las tablas 5, 6 y 7; estos comprenden los parámetros evaluados, las especificaciones para cada parámetro y los resultados de estas evaluaciones.
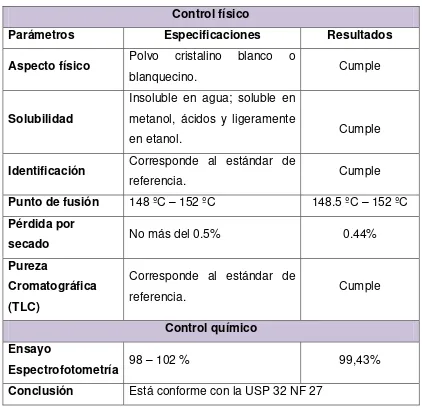
Tabla Nº 5. Certificado de análisis del principio activo Control físico
Parámetros Especificaciones Resultados
Aspecto físico Polvo cristalino blanco o
blanquecino. Cumple
Solubilidad
Insoluble en agua; soluble en metanol, ácidos y ligeramente
en etanol. Cumple
Identificación Corresponde al estándar de
referencia. Cumple
Punto de fusión 148 ºC – 152 ºC 148.5 ºC – 152 ºC Pérdida por
secado No más del 0.5% 0.44%
Pureza
Cromatográfica (TLC)
Corresponde al estándar de
referencia. Cumple
Control químico Ensayo
Espectrofotometría 98 – 102 % 99,43%
37
Tabla Nº 6. Certificado de análisis del excipiente Control físico
Parámetros Especificaciones Resultados
Aspecto físico
Cera de color blanco o blanquecino, cuando se calienta a 50 ºC se funde para dar un líquido incoloro o amarillento.
Cumple
Solubilidad
Soluble en tetracloruro de carbono, cloroformo, éter, tolueno y xileno, ligeramente soluble en etanol caliente; y prácticamente insoluble en agua.
Cumple
Punto de
fusión 32.0 ºC – 34 ºC 32.0 ºC – 34.0 ºC
Conclusión Está conforme con el Handbook of Pharmaceutical Excipients 2006.
Fuente: Autora
Tabla Nº 7. Certificado de análisis del envase Control físico
Parámetros Especificaciones
Material Polietileno de alta densidad
Dimensiones Altura
Ancho de cuerpo
Diámetro menor de rosca Diámetro mayor de rosca Espesor de pared
55.00 ± 0.50 mm 22.00 ± 0.50 mm 11.00 ± 0.50 mm 13.00 ± 0.50 mm Mínimo 0.50 mm
Peso 5.3 ± 0.5 g
Capacidad para envases Cumple con características funcionales Hermeticidad al medio ambiente Cumple con características funcionales Funcionalidad para tapas con
anillo de seguridad
Cumple con características funcionales
38
envases
Descripción del envase Frasco de polietileno de alta densidad de color blanco uniforme, sin ralladuras, liso en sus paredes con tapa blanca.
Fuente: Autora
Dos características de radical importancia que se evaluaron durante esta etapa fueron: la solubilidad del principio activo en metanol, que luego ayudó en el desarrollo del método analítico; y el punto de fusión de la base (punto 4.1.1), el cual, por la forma de administración de la forma farmacéutica, debe ser de alrededor de 37 ºC, y no debería modificarse con la adición del activo.
Los resultados en los estudios de preformulación en general son el inicio para el desarrollo de fórmulas estables, por tanto es importante la presentación de un informe o reporte final que indique la metodología llevada a cabo, este se muestra en la tabla Nº 8, en la que podemos observar caracterización de principio activo y excipiente, así como estabilidad y procesos de optimización.
Tabla Nº 8. Reporte de Preformulación
Reporte de Preformulación: Óvulos de Ketoconazol
Nombre de la compañía: no aplica. Nombre del departamento: no aplica. Fecha: febrero/2010 Página: 1 de 1
Documento Nº: 1 Revisado por: Dr. Hermel Salinas Supervisado por: Dr. Geovanni López. Responsabilidad: Andrea Villagómez
Propósito: Crear una fuente de datos fácilmente asequible, que permita la correcta determinación cuali y cuantitativa de principio activo y excipiente.
39
Metodología:
1. Caracterización de principio activo:
a) Procedimiento analítico: Espectrofotometría UV/Visible. b) Caracterización crítica de propiedades físicoquímicas:
- Descripción y solubilidad: basado en información disponible en web: http://chemicalland21.com/lifescience/phar/KETOCONAZOLE.htm - Identificación: monografía de Ketoconazol de la USP 32 NF27 (pp. 2998
- 3000)
- Punto de fusión: USP 32 NF27 <741> Intervalo o Temperatura de fusión (pp. 319 – 321).
- Pérdida por secado: USP 32 NF27 <731> Pérdida por secado (pp. 315).
- Pureza Cromatográfica: monografía de Ketoconazol de la USP 32 NF27 (pp. 2998)
2. Caracterización de excipiente:
a) Descripción y solubilidad: Handbook of Pharmaceutical Excipients 2006. b) Punto de fusión: Handbook of Pharmaceutical Excipients 2006.
3. Envase.
Observación de: material, dimensiones, peso, capacidad, hermeticidad y resistencia al impacto.
4. Estabilidad Acelerada
Duración: 3 meses.
Condiciones: 30 ºC ± 2 ºC y 70% HR ±5% 45 ºC ± 2 ºC y 75% HR± 5%
5. Procesos de Optimización
Identificación de degradantes: Procedimiento basado en el desarrollado por Skiba M. et al. 2000 y en el proceso de identificación de Ketoconazol tomado
40
Aprobación
Desarrollo del producto: óvulos de Ketoconazol.
Investigación analítica: Método analítico por espectrofotometría UV. Asuntos regulatorios: INH.
Fuente: Autora
5.2. FORMULACIÓN
5.2.1. Justificación de la dosis:
Las cifras plasmáticas máximas de Ketoconazol son 4, 8 y 20 µg/mL, aproximadamente, después de consumir dosis de 200, 400 y 800 mg. La vida media del producto aumenta con la dosis y puede llegar a siete u ocho horas si la dosis es de 800 mg. La dosis habitual en el adulto es de 400 mg orales, una vez al día. En caso de vulvovaginitis por Candida el tratamiento suele durar cinco días (Goodman y Gilman 2007). La dosis usual en óvulos también es de 400 mg y en general los productos en el mercado, como el Tructum de Medicamenta, por ejemplo, utiliza esta dosis.
5.2.2. Cálculos: factor de desplazamiento y masa del excipiente.
Datos:
Peso promedio de óvulo solo con excipiente (A): 15.39 g
Peso promedio de óvulo con principio activo adicionado (B): 15.88 g Gramos del principio activo (X): 1.06 g
5.2.2.1. Factor de desplazamiento
41
F = 15.39 g – (15.88 – 1.06) 1.06
F = 15.39 – 14.82 1.06 F = 0.57/1.06 F = 0.537.
5.2.2.2. Masa del excipiente:
M = F −Σ( fS )
M = 2000 mg – (0.537 x 402.29 mg) M = 2000mg – 216.02973 mg
M = 1783.97 mg = 1.78397 g
Los resultados de los cálculos de factor de desplazamiento y masa de excipiente, permitieron determinar la fórmula necesaria para la elaboración de los lotes piloto; la tabla 9 nos indica las cantidades de cada componente: principio activo y excipiente en la fórmula unitaria teórica, es decir sin el cálculo de factor de desplazamiento y la fórmula unitaria real, que se obtuvo calculando el factor antes mencionado; la fórmula en lote piloto indica la cantidad necesaria para la elaboración de un lote piloto.
Tabla Nº 9. Fórmula de óvulos de Ketoconazol.
Componentes
Fórmula unitaria teórica
Fórmula unitaria
real Fórmula en
lote piloto mg/óvulo Porcentaje mg/óvulo Porcentaje
Principio Activo: Ketoconazol Excipiente: Ovucire 400 mg 1600 mg 20% 80% 402.29 mg 1783.97 mg 18,40% 81,60% 12068.7 mg 53519.1 mg
Total 2000 mg 100% 2186.26 mg 100% 65587.8 mg