PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE BIOLOGÍA
Efecto de la aplicación de Candida guilliermondii (cepa PUJ) sobre dos estadios (adulto y ninfa) de Myzus persicae en Solanum phureja.
JENNIFER PAOLA SARMIENTO DAZA
TRABAJO DE GRADO
Presentado como requisito parcial para optar al título de Bióloga y Microbióloga Industrial
Efecto de la aplicación de Candida guilliermondii (cepa PUJ) sobre dos estadios (adulto y ninfa) de Myzus persicae en Solanum phureja.
JENNIFER PAOLA SARMIENTO DAZA
APROBADO
Gerardo Moreno Durán Ingeniero Agrónomo, MSc.
Director
Adriana Sáenz Aponte Luis David Gómez Méndez Bióloga, MSc Microbiólogo Industrial, MSc
TABLA DE CONTENIDO
1 INTRODUCCIÓN ... 9
2 PLANTEAMIENTO DEL PROBLEMA Y JUSTIFICACIÓN ... 10
3 MARCO TEÓRICO ... 11
3.1 Myzus persicae ... 11
3.2 Solanum phureja ... 13
3.3 Candida guilliermondii ... 15
4 OBJETIVO GENERAL ... 16
4.1 OBJETIVOS ESPECÍFICOS ... 17
5 METODOLOGÍA ... 17
5.1 Siembra de plantas de papa criolla ... 17
5.2 Colección de áfidos ... 17
5.2.1 Identificación de áfidos ... 17
5.2.2 Determinación del ciclo biológico de Myzus persicae ... 18
5.3 Obtención y cultivo de Candida guilliermondii (cepa PUJ). ... 19
5.4 Bioensayos ... 21
5.4.1 Tratamiento por aspersión ... 21
5.4.2 Tratamiento por suspensión ... 21
5.5 Análisis de resultados ... 23
6 RESULTADOS Y DISCUSIÓN. ... 24
6.1 Identificación de áfidos ... 24
6.2 Determinación del ciclo biológico de Myzus persicae ... 24
6.3 Obtención y cultivo de Candida guilliermondii (cepa PUJ) ... 26
6.4 Bioensayos ... 27
6.4.1 Resultados del método de aspersión ... 27
6.4.2 Resultados del método de suspensión ... 34
6.5 Posibles formas de invasión de Candida guilliermondii al interior de ninfas y adultos de Myzus persicae ... 46
6.6 Descripción del comportamiento de Myzus persicae ... 49
7 CONCLUSIONES ... 51
8 RECOMENDACIONES ... 52
4
ÍNDICE DE TABLAS
Tabla 1. Tratamientos con Candida guilliermondii en Myzus persicae…………...22
Tabla 2. Porcentaje de mortalidad de adultos de Myzus persicae por aspersión de agua destilada y Candida guilliermondii………..…..28
Tabla 3. Porcentaje de mortalidad de ninfas de Myzus persicae por aspersión de
agua destilada y Candida guilliermondii………32
Tabla 4. Porcentaje de mortalidad de adultos de Myzus persicae por suspensión de agua destilada y Candida guilliermondii………..36
Tabla 5. Porcentaje de mortalidad de ninfas de Myzus persicae por suspensión de agua destilada y Candida guilliermondii………...……….39
Tabla 6. Tabla resumen de la mortalidad de adultos de Myzus persicae en tratamientos y controles………..42
5
ÍNDICE DE GRÁFICAS
Gráfica 1. Porcentaje de mortalidad de adultos de Myzus persicae por aspersión con agua destilada y Candida guilliermondii a lo largo de las 60h de observación………..28
Gráfica 2. Porcentaje de mortalidad de ninfas de Myzus persicae por aspersión con agua destilada y Candida guilliermondii a lo largo de las 60h de observación………...32
Gráfica 3. Porcentaje de mortalidad de adultos de Myzus persicae por suspensión en agua destilada y Candida guilliermondii a lo largo de las 60h de observación………..36
Gráfica 4. Porcentaje de mortalidad de ninfas de Myzus persicae por suspensión en agua destilada y Candida guilliermondii a lo largo de las 60h de observación………..39
Gráfica 5. Regresión polinómial grado tres………..43
Gráfica 6. Grafica 6. Regresión polinómica para datos de aspersión en adultos y
ninfas de Myzus persicae…………..43
Gráfica 7. Regresión polinómica para datos de inmersión tanto adultos como ninfas de Myzus persicae………..44
Gráfica 8. Consolidación de regresión polinómica de inmersión de áfido ninfas y
adultos de Myzus persicae………45
Gráfica 9. Análisis comparativo de la mortalidad de adultos y ninfas por aspersión e inmersión………..45
6
ÍNDICES DE FIGURAS
Figura 1. Siembra de Solanum phureja en invernadero……….17
Figura 2. Microcosmos para la identificación de la especie y estimación del ciclo biológico………...18
Figura 3. a) Solanum phureja de 1 mes de sembrado y 15cm de longitud. b) Adecuación de plantas de Solanum phureja para la cría de Myzus
persicae………18
Figura 4. a) Modelo de caja de Petri con foliolos frescos de Solanum phureja y 5 áfidos Myzus persicae. b) Modelo de las tres replicas para tratamientos y controles………19
Figura 5. Caldo YGC inocuo e inoculado…..………20
Figura 6. Microscopia de cámara de New Bauer, vista de levaduras en campo de 40X para conteo………..20
Figura 7. a) Concentración 1.87x106 Levaduras/ml y aspersor. b) Modelo de aspersión de 1.87x106 Levaduras/ml de Candida guilliermondii y agua destilada en adultos y ninfas de Myzus persicae para tratamientos……….21
Figura 8. a) Caja de Petri con 1ml de 1.87x106 levadura/ml y cinco áfidos suspendidos. b) Caja de Petri con 1ml de agua destilada y cinco áfidos suspendidos……….22
Figura 9. Tratamiento de desinfección de cada áfido muerto con hipoclorito de sodio al 1% y dos lavados con agua destilada………..…………23
Figura 10. a) Ninfa de Myzus persicae de color verde claro. b) Cauda puntiaguda de Myzus persicae adulto. c) Sifones al final del abdomen con tonalidad más oscura hacia el ápice……….24
Figura 11. a) Desprendimiento de exoesqueleto de ninfa de cuarto instar para iniciar estadio de adulto. b) Exoesqueleto totalmente liberado de la ninfa………..25
Figura 12. a) Ninfa de primer instar de Myzus persicae. b) Ninfa de segundo instar de Myzus persicae. c) Ninfa de tercer instar de Myzus persicae. d) Ninfa de cuarto instar de Myzus persicae. e) Adulto de Myzus persicae…….25
7 proveniente del caldo YGC. c) Microscopía de Candida guilliermondii de colonia aislada en Agar YGC………26
Figura 14. Ausencia de Candida guilliermondii al interior de adultos de Myzus persicae por aspersión de 1ml de levadura a las 12h de aplicación…..29
Figura 15. Presencia presuntiva de Candida guilliermondii al interior de dos adultos de Myzus persicae por aspersión de 1ml de la levadura a las 24h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………29
Figura 16. Presencia presuntiva de Candida guilliermondii al interior de seis adultos de Myzus persicae por aspersión de 1ml de la levadura a las 36h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………..29
Figura 17. Presencia presuntiva de Candida guilliermondii al interior de tres adultos de Myzus persicae por aspersión de 1ml de la levadura a las 48h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………..30
Figura 18. Ausencia de Candida guilliermondii al interior de cinco ninfas de Myzus persicae por aspersión de 1ml de levadura a las 12h de aplicación…32
Figura 19. Presencia presuntiva de Candida guilliermondii al interior de seis ninfas de Myzus persicae por aspersión de 1ml de la levadura a las 24h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………..33
Figura 20. Presencia presuntiva de Candida guilliermondii al interior de cuatro ninfas de Myzus persicae por aspersión de 1ml de la levadura a las 36h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………..33
Figura 21. Ausencia de Candida guilliermondii al interior de adulto de Myzus persicae suspendido en 1ml de Candida guilliermondii concentración 1.87x106 UFC/ml a las 12h de observaciones……….36
Figura 22. Ausencia de Candida guilliermondii al interior de adultos de Myzus persicae suspendidos en 1ml de Candida guilliermondii concentración 1.87x106 UFC/ml a las 24h de observaciones………37
Figura 23. Presencia presuntiva de Candida guilliermondii al interior de adulto de
Myzus persicae en suspensión de 1ml de la levadura a las 24h de aplicación. Vista microscópica (100X) de presunta Candida
8
Figura 24. Presencia presuntiva de Candida guilliermondii al interior de adultos de
Myzus persicae por suspensión en 1ml de la levadura a las 36h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii……….37
Figura 25. Presencia presuntiva de Candida guilliermondii al interior de adultos de
Myzus persicae por suspensión en 1ml de la levadura a las 48h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………..38
Figura 26. Ausencia de Candida guilliermondii al interior de ninfas de Myzus persicae suspendidos en 1ml de Candida guilliermondii concentración 1.87x106 UFC/ml a las 24h de observaciones……….40
Figura 27. Presencia presuntiva de Candida guilliermondii al interior de ninfas de
Myzus persicae por suspensión en 1ml de la levadura a las 36h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………..40
Figura 28. Presencia presuntiva de Candida guilliermondii al interior de ninfas de
Myzus persicae por suspensión en 1ml de la levadura a las 48h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………..40
Figura 29. Presencia presuntiva de Candida guilliermondii al interior de ninfas de
Myzus persicae por suspensión en 1ml de la levadura a las 60h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………..41
Figura 30. Presencia presuntiva de Candida guilliermondii al interior de ninfa de
Myzus persicae por suspensión en 1ml de la levadura a las 60h de aplicación. Vista microscópica (100X) de presunta Candida
guilliermondii………..41
Figura 31. Inserción del estilete de Myzus persicae en hoja de Solanum phureja
tras haberlo asperjado con 1ml de Candida guilliermondii………49
9
1 INTRODUCCIÓN
La papa es uno de los cultivos con más de 100.000 productores ubicados en catorce departamentos en la región Andina, (Sánchez, 2000; Corzo et al., 2003). Este tubérculo es fuente alimenticia en todos los niveles sociales, su cultivo y procesamiento son fuente de empleo, es un producto de exportación, se disponen de alrededor de 200.000 Ha para su cultivo y existen más de 50 empresas que utilizan este tubérculo como materia prima para su producto final (Rodríguez, 1996; Ospina et al., 2009).
Debido a la aparición de diferentes especies de insectos plaga que atacan este cultivo se han formulado estrategias de control de forma separada según las características biológicas y ecológicas de las mismas. Pese a esto el control químico se ha constituido como uno de los métodos más utilizados para contrarrestar estos insectos (Calvache, 1988). Su uso continuo ha generado problemas de contaminación, resistencia de los insectos a los pesticidas, aparición de nuevas plagas potenciales, sustancias residuales recalcitrantes, riesgos laborales, disminución de los enemigos naturales y costos elevados. Es así como la implementación de controladores biológicos ofrece alternativas que permiten disminuir los daños de insectos plaga como los áfidos, protegiendo el ambiente y fauna benéfica existente en el cultivo. (Naranjo, 2001).
Una de las plagas más abundantes en Colombia son los áfidos los cuales ocasionan pérdidas económicas debido a que poseen un amplio rango de hospederos. Estos insectos causan daños como la extracción de fotoasimilados, defoliación de la planta, disminución de la fotosíntesis y favorecen el desarrollo de hongos fitopatógenos, adicionalmente son vectores de virus como Y, A, M y algunas variantes del PVS en cultivo de papa específicamente (Lenne et al., 1989; Sánchez et al., 1991; Davis et al., 2005).
10 tomates y áfidos en plantas de papaya. Igualmente ha sido sometida a varios estudios taxonómicos, moleculares y bioquímicos para tratar de determinar su actividad biológica (Romero, 2001; Vargas, 2002; Albarracín, 2003; Escobar et al., 2008; Martínez, 2010, Borrero, 2011). En este estudio se planteo un ensayo preliminar sobre el efecto de Candida guilliermondii y agua destilada sobre adultos y ninfas de Myzus persicae mediante dos formas de aplicación (aspersión e inmersión) en plantas de Solanum phureja.
2 PLANTEAMIENTO DEL PROBLEMA Y JUSTIFICACIÓN
Los hongos entomopatógenos como Lecanicillium lecanii, Beauveria bassiana y
Metarhizium sp se han estudiado como controladores biológicos de áfidos. Su poca aplicabilidad se debe a que algunos de ellos ejercen un efecto en ninfas únicamente además de las estrictas indicaciones de uso como almacenamiento en temperaturas de refrigeración evitando su uso en zonas que superen los 30ºC (Hincapié et al., 1990). Por otra parte la implementación de parasitoides como
Trioxys angelicae, Trioxys indicus, Trioxys acalephae, Lipolexis oregmae, Lysiphlebus testaceipes, Lysiphlebus ambiguus, Ephedrus persicae y depredadores de las familias Formicidae, Coccinellidae, Chrysopidae y Syrphidae ofrece otras alternativas que resultan más costosas que la implementación de agroquímicos. (Caballero et al., 1972; Beltrán et al., 1972; Ewell, 1988; Persad et al., 2003; Coppler et al., 2007; Russel, 2007; Kavallieratos et al., 2008; Alzate et al., 2008; Salas et al., 2011).
Por lo anterior, la aplicación de insecticidas y fungicidas resulta el método por excelencia por parte de los agricultores ya que en un tiempo corto disminuyen las poblaciones plaga. El mayor problema de su uso continuo son los daños ambientales, resistencia por parte de insectos, aparición de nuevas plagas y disminución de las poblaciones de enemigos naturales (Naranjo, 2001). Dentro de los costos de producción del cultivo de papa criolla en Colombia el 60% se dispone para la adquisición de insumos como fertilizantes y agroquímicos como insecticidas y fungicidas (Zapata et al., 2006). Lo que representa una alta inversión para los productores.
11
et al., (2000) sobre poblaciones de Myzus persicae en plantas de Solanum phureja.
Se ha reportado que esta levadura posee la capacidad de atravesar cortezas de frutos como banano y tomate (Escobar et al., 2008; Infante, 2012) además de una alta producción de enzimas de degradación como glucanasas y quitinasas las cuales ejercen un efecto antagónico sobre hongos fitopatógenos (Zhang et al.,
2008). Adicional a esto, se conoce preliminarmente que Candida guilliermondii se establece fácilmente sobre las sustancias excretadas por áfidos en plantas de
Carica papaya afectando la viabilidad de los insectos (Martínez, 2010).
3 MARCO TEÓRICO 3.1 Myzus persicae
Los áfidos pertenecen al orden Hemíptero, suborden Sternorrhyncha, subfamilia Aphidoidea y familia Aphididae cuentan con alrededor de 4.000 especies a nivel mundial (Cermeli, 1987). En Colombia se han registrado alrededor de 50 especies como Aphis spiraecola, Myzus persicae, Aphis gossypii, Macrosiphum euphorbiae,
Zoxoptera citridicus y Sipha flava entre otros, los cuales causan daños en 112 plantas en su mayoría de importancia económica (Pardey et al., 1977; Cabello et al., 1995). En general son consideradas como especies cosmopolitas (Cermeli, 1987).
12 tiene un periodo reproductivo de 5 a 6 días produciendo un total de 17 individuos específicamente en el caso de plantas de papa (Guarín et al., 2006; Duarte et al., 2011).
La capacidad de volar les confiere a estos insectos un mecanismo de defensa frente a la presencia de depredadores. Igualmente facilita la escogencia de la planta hospedera cuyas condiciones sean las más aptas para su desarrollo. En este proceso de selección los áfidos penetran los tejidos superficiales de la planta con sus estiletes tomando una alícuota de savia el cual es su alimento primordial. La extracción masiva de savia y la liberación de enzimas por parte de los áfidos para la descomposición de las paredes celulares son una de las formas de ocasionar daños en la planta, al igual que la excreción de sustancias que favorece el crecimiento de hongos fitopatógenos como Capnodium sp. el cual afecta la capacidad fotosintética (Cañedo, 1999; Pardey, 1988).
El daño más reportado e importante en plantas de papa es la transmisión del virus Y el cual ocasiona necrosis en las hojas y tubérculos, el virus A genera rugosidad en las hojas al igual que el virus M más enrollamiento y enanismo. Por otra parte, algunas variantes del virus PVS ocasionan un ligero hundimiento de las nervaduras de las hojas y necrosis ya que estos insectos trasmiten saliva dentro de los conductos vasculares de la planta circulando partículas virales atribuyendo hasta un 60% la causa de las enfermedades más importantes en dichas plantas (Hagvar et al., 1991; Hord et al., 1998; Fanigliulo et al., 2011; Hansen et al., 2012). La transmisión de estos virus pueden darse de forma no persistente es decir, el áfido adquiere el virus durante el periodo de prueba de tejidos de plantas infectadas y permanecer dentro de estos insectos por un periodo corto infectando nuevas plantas hospederas sanas. Otra forma es la transmisión persistente en donde el virus permanece dentro del áfido en estado de latencia sin causarle daño, facilitando los procesos de infección a nuevas plantas hospederas ubicadas en grandes distancias (Lenne et al., 1989; Davis et al., 2005).
13 Por otro lado, la utilización de controladores biológicos ha sido otra estrategia para el manejo de esta plaga. Varios estudios han evaluado el efecto de insectos depredadores como Solenopsis invicta de la familia formicidae, coleópteros de la familia Coccinellidae como la especie Harmonia axyridis o pertenecientes al género Scymnus, neurópteros de la familia Chrysopidae como Chrysoperla comanche, Chrysoperla exotera y Chrysoperla carnea y moscas de la familia Syrphidae, sobre la abundancia de los áfidos (Coppler et al., 2007; Russel, 2007; Salas et al., 2011). La utilización de depredadores en campo evidencia varios problemas como su acción generalista ya que disminuyen poblaciones de enemigos naturales al mismo tiempo que de la plaga y su modo de acción no deja muestras de su paso por lo que la forma de determinar su efectividad es mediante el análisis de la población de áfidos (Cermeli, 1987).
Dentro del grupo de los parasitoides utilizados como agentes controladores existen varias especies reportadas tales como Trioxys angelicae, Trioxys indicus, Trioxys acalephae, Lipolexis oregmae, Lysiphlebus testaceipes, Lysiphlebus ambiguus, Ephedrus persicae entre otros (Persad et al., 2003; Persad et al., 2007; Kavallieratos et al., 2008). Finalmente a nivel microbiológico la mayoría de los estudios reportan el uso de hongos entomopatógenos como Lecanicillium lecani, Beauveria bassiana y Metarhizium sp como controladores de poblaciones de
Myzus persicae (Beltrán et al., 1972; Caballero et al., 1972; Jun et al., 2007; Vu et al., 2007; Alzate et al., 2008; Rashki et al., 2009; Ganassi et al., 2010; Tian et al., 2010). El problema de la implementación de estos hongos es que actúan principalmente en estados inmaduros del insecto, además no es conveniente su aplicación en regiones de más de 30ºC y se debe conservar a temperaturas de refrigeración. Se recomienda realizar las aspersiones durante las horas de baja luminosidad y su escasa comercialización se suma a la lista anterior. Todo esto resulta una labor dispendiosa para el agricultor en el momento de la utilización del entomopatógeno razones por las cuales impulsan la aplicación de agroquímicos (Hincapié et al., 1990).
3.2 Solanum phureja
14 retención de humedad y buen drenaje al igual que un pH entre 5.2 y 5.9 con un alto contenido de materia orgánica. Estas condiciones fisicoquímicas favorece el crecimiento de microorganismos como bacterias, hongos y protozoarios los cuales ayudan a la extracción y degradación de nutrientes facilitando la absorción de estos a la planta (Sánchez et al., 2005).
El periodo vegetativo de esta planta es de cuatro a cinco meses lo que indica un desarrollo rápido de los tubérculos ya que anualmente se pueden realizar hasta tres cosechas (Hawkes, 1990; Spooner et al., 2006; Bradshaw et al., 2008). Estas plantas alcanzan una altura aproximada de 60cm con varios tallos los cuales se ramifican. Las flores generalmente son de color lila, blanca o roja de acuerdo a la variedad de la especie. El tubérculo es de tamaño pequeño con forma redonda y el color de su superficie es de diferentes matices de amarillo. Se considera que cada planta puede producir hasta cuarenta tubérculos lo que resulta favorable para el agricultor (Cabezas, 2002; Rodríguez et al., 2009).
En Colombia existen actualmente treinta variedades de papa las cuales se cultivan 30.000 Ha aproximadamente. El 15% de estas hectáreas se utilizan para la producción de papa criolla siendo una de las diez especies con mayor importancia económica a nivel agroindustrial (Zapata et al., 2006). Por otro lado se le adjudica un alto valor nutricional ya que contiene elementos como vitaminas A, B y C además de niacina, tiamina, carbohidratos y minerales como sodio, potasio, calcio, hierro, magnesio y fosforo considerándola como parte de la canasta familiar (Rodríguez et al., 2006). Los departamentos con mayor producción de S. phureja
son Cundinamarca, Boyacá, Nariño y Antioquia en menor medida se encuentran Cauca, Norte de Santander y Santander (Uribe et al., 2011).
Esta planta se ve afectado por plagas y enfermedades adquiridas durante el cultivo, cosecha y almacenamiento. Los insectos y microorganismos plagas que ocasionan mayor daño son la polilla guatemalteca, áfidos como Myzus persicae
15 Los principales estudios que se han realizado con el fin de mejorar este tubérculo se han enfocado en la evaluación de controladores biológicos como depredadores, parasitoides y microorganismos específicamente hongos entomopatógenos como
Lecanicillium lecanii, Beauveria bassiana y Metarhizium sp (Danye et al., 2005; Down et al., 2009; Shan et al., 2010). Además la búsqueda de nuevas plantas resistentes a diferentes plagas mediante experimentación genética (Gutiérrez et al., 2002 Spooner et al., 2007). Es importante aclarar que no se han reportado a la comunidad cientifica estudios de levaduras como controladores biológicos de insectos en plantas de papa criolla.
3.3 Candida guilliermondii
El género Candida pertenece al orden Cryptococcales comprendido por más de ciento sesenta especies de las cuales dieciocho son patógenas careciendo de reproducción sexual por lo que se denominan levaduras imperfectas o asporógenas (Herrera et al., 1998). Esta levadura se encuentra comúnmente en el agua, suelo, restos de plantas y animales, frutos, líquidos fermentados y alimentos lácteos entre otras. Las especies del género Candida normalmente en su fase de germinación son multipolar pero también son capaces de desarrollar seudomicelio y micelio lo que diferencia del género Torulopsis (López et al., 2005).
Las formas vegetativas de la levadura son ovoides o helicoidales, además son microorganismos haploides y el tamaño de su genoma está constituido por 12 Mb, además frente a la coloración de Gram presentan un color purpura (Reedy, 2008; Guayazán, 2010; Borrero, 2011). Las levaduras se reproducen asexualmente por gemación y sexualmente mediante ascosopras o basidiosporas. Si las condiciones ambientales son adecuadas durante la reproducción asexual una yema emerge de la levadura madre separándose lentamente hasta alcanzar un tamaño adecuado (Pasqualotto et al., 2006).
16 y síntesis de metabolitos antifúngicos difusibles y volátiles (Cárdenas, 2004; Zhang
et al., 2008).
Se han realizado varios estudios a partir de una cepa de C. guilliermondii de la Pontificia Universidad Javeriana desde el año 2000 cuando fue aislada y encontrada en frutos de tomates heteroinjertados siendo este el único microorganismos fuera y dentro del fruto. Su primera identificación arrojo como resultado la especie Candida incospicua (Ortegón et al., 2000). En estudios posteriores se evaluó el efecto antagónico de esta levadura con microorganismos presentes en frutos de uchuva en proceso de descomposición, al igual que se estableció la curva de crecimiento y los medios más propicios para su optimo desarrollo (Romero, 2001; Vargas, 2002). Otros estudios que se han realizado con esta cepa fueron la obtención de varios compuestos químicos como acetato de etilo, isopentanol, isobutanol, feniletanol, acido 2-metil butírico seguido por el xilitol en tomate (Albarracín et al., 2003; Jiménez, 2010). Posteriormente se hizo una reclasificación en donde se obtuvo un 99.7% de certeza de que esta cepa corresponde a la especie Candida guilliermondii gracias a la técnica de Api 20C AUX (Escobar et al., 2008). Acompañada de un estudio molecular (Borrero, 2011). Po otra parte un estudio realizado por Rubiano et al.,(2009) evaluó la capacidad de atravesar en corto tiempo la corteza de banano por parte de
Candida guilliermondii al igual que se determinó la concentración más eficiente para realizar deshidratación de frutos. Finalmente uno de los estudios mas reciente con Candida guilliermondii demuestra que dicha levadura es capaza de atravesar la cutícula de tomates a una velocidad de 0.55X10-6 m/h (Infante, 2012).
Es importante resaltar que Candida guilliermondii controla eficientemente a
Rhizopus sp. en tomate (Albarracín, 2003) pero no ha sido reportada como controlador biológico para ninguna plaga insecto, sin embargo se realizó un ensayo preliminar por Martínez (2010), en el cual se evaluó la acción controladora de Candida guilliermondii sobre áfidos en plantas de Carica papaya en condiciones de invernadero. Lo anterior hace que sea novedoso el presente estudio ya que se busca investigar y corroborar si resulta eficiente dicha levadura para disminuir poblaciones de áfidos en plantas de Solanum phureja (papa criolla).
4 OBJETIVO GENERAL
17
4.1 OBJETIVOS ESPECÍFICOS
- Determinar el mejor método de aplicación de Candida guilliermondii para producir el mayor porcentaje de mortalidad en áfidos de la especie Myzus persicae.
- Determinar el tiempo que gasta Candida guilliermondii en producir el mayor porcentaje de mortalidad en áfidos de la especie Myzus persicae en plantas de Solanum phureja.
- Determinar la presencia o ausencia de Candida guilliermondii al interior de adultos y ninfas de Myzus persicae.
5 METODOLOGÍA
5.1 Siembra de plantas de papa criolla
Se sembraron quince tubérculos de papa criolla en materas individuales en el invernadero ubicado en la finca San Javier a una latitud de 5° 3´ 22´´ Norte y una longitud de 73° 55´29´´ Oeste a 2566m.s.n.m.en el municipio de Cogua, vereda Mortiño, propiedad de la Pontificia Universidad Javeriana (Figura 1).
Figura 1: Siembra de Solanum phureja en invernadero (foto de autora)
5.2 Colección de áfidos
Se colectaron alrededor de doce hembras adultas ápteras de la especie Myzus persicae en cultivos de papa criolla en los municipio de Ramiriquí y Tierra Negra en el departamento de Boyacá.
5.2.1 Identificación de áfidos
18
[image:18.612.134.480.118.250.2]et al., 2000; Kim et al., 2007; Down et al., 2009). Se realizaron observaciones periódicas hasta la obtención de nuevos individuos (Figura 2).
Figura 2: Microcosmos para la identificación de la especie y estimación del ciclo biológico. (fotos de autora)
5.2.2 Determinación del ciclo biológico de Myzus persicae
A partir de los nuevos insectos se observó el proceso del ciclo biológico y su duración hasta la obtención de nuevos adultos, con el fin de garantizar que los áfidos provengan de una misma cohorte y sean viables para generar nueva progenie (Le-Tian et al., 2010). Quince ninfas obtenidas se trasfirieron con pincel de punta fina a cuatro plantas jóvenes de papa criolla (Solanum phureja) con un mes de crecimiento y 15cm de longitud, las cuales fueron colocadas al interior de una jaula de madera con tela tipo brisa con el fin de evitar la pérdida de individuos y obtener el aumento de la población (Salazar, 1971; Qi et al., 2011) (Figura 3).
Figura 3: a) Solanum phureja de 1 mes de sembrado y 15cm de longitud. b) Adecuación de plantas de Solanum phureja para la cría de Myzus persicae. (fotos de autora)
[image:18.612.160.489.457.576.2]19 fotoperiodo de 12 horas luz y 12 horas oscuridad hasta observar las apariciones de exoesqueletos indicando el cambio de instar hasta llegar a adultos en un máximo de tres días (Jun et al., 2007; Rashki et al., 2009).
Una vez obtenidos anteriormente los áfidos adultos jóvenes, se transfirieron cinco de ellos a una caja de Petri la cual contenía papel filtro humedecido con agua destilada mas foliolos frescos de Solanum phureja realizando lo anterior por triplicado para un total de 15 áfidos en cada tratamiento. Para los ensayos con ninfas de Myzus persicae se tomaron 70 insectos en estadio de tercer y cuarto instar y se ubicaron en cajas de Petri de la misma forma que los adultos es decir, se utilizaron 12 cajas de Petri para los tratamientos de adultos y 12 cajas para los tratamientos de ninfas (Figura 4).
Figura 4: a) Modelo de caja de Petri con foliolos frescos de Solanum phureja y 5 áfidos Myzus persicae. b) Modelo de las tres replicas para tratamientos. (fotos de autora)
5.3 Obtención y cultivo de Candida guilliermondii (cepa PUJ).
A partir de una solución en refrigeración de caldo YGC (extracto de levadura 5 g/L, D-glucosa 20 g/L, cloramfenicol 0.1 g/L y agua destilada) con Candida guilliermondii cepa PUJ (conservada en el cepario del grupo de investigación UNIDIA de la Pontificia Universidad Javeriana) se dejo aclimatar a temperatura ambiente y se transfirieron 10ml a un erlenmeyer con 90ml del mismo caldo y agitación a 120rpm con el fin de reactivar y estimular el crecimiento del microorganismo dejándolo en incubación por 48 horas a 30°C hasta observar turbidez lo cual está asociado a crecimiento microbiano (Figura 5). Posteriormente se realizó una coloración de Gram para observar la microscopia de la levadura, la pureza de la muestra y la viabilidad de la misma (Merck, 2006; Guayazán, 2010).
[image:19.612.123.496.275.402.2]20 morfología anterior y la obtenida por Guayazán, (2010) quien estandarizó la curva de crecimiento de este microorganismo.
Figura 5: Caldo YGC inocuo e inoculado. (foto de autora)
La concentración a evaluar de Candida guilliermondii (cepa PUJ) fue de 106 UFC/ml ya que esta reportada como la concentración letal del 50% para individuos de Myzus persicae con esporas de hongos entomopatógenos (Yokomi
et al., 2004; Hanh et al., 2007; Rashki et al., 2009; Ganassi et al., 2010; Le-Tian et al., 2010) Por lo tanto, se tomó una muestra de una colonia aislada en Agar YGC y se diluyó en 9ml de agua destilada estéril. Se realizó un conteo en cámara de New Bauer y se realizaron las diluciones en agua destilada estéril necesarias para obtener la concentración deseada en la solución la cual se aplicó (Figura 6) (Ramírez et al., 2005; Falconii, 2009).
[image:20.612.87.530.439.656.2]21
5.4 Bioensayos
Debido a que no existen reportes en la literatura sobe la aplicación de levaduras como control biológico para Myzus persicae, se extrapoló la metodología implementada con esporas de hongos entomopatógenos.
5.4.1 Tratamiento por aspersión
Para la aplicación de esta metodología se utilizo un aspersor de vidrio de 5ml de capacidad con una válvula que permite expulsar el líquido. En reportes de literatura se encontró que las aplicaciones para control de afidos en papa es cuando la presión de la aspersión es de 5 a 10 Kg/cm2 a una velocidad de salida de 3 a 8 Km/h y un volumen de 3 a 25ml/ planta (Hernández et al.,1981).
En adultos y ninfas se asperjo 1ml de agua destilada sobre los áfidos ubicados en los foliolos de Solanum phureja. Lo anterior se realizó en cada una de las tres replicas para un total de 15 adultos y 15 ninfas (Figura 7). Para aspersión con
Candida guilliermondii en adultos y ninfas se asperjo 1ml de la solución de agua destilada mas levadura a una concentración de 1.87x106 Levaduras/ml sobre los áfidos ubicados en los foliolos de Solanum phureja. Lo anterior se realizó en cada una de las tres replicas para un total de 15 adultos y 15 ninfas (Figura 7-Tabla 1).
Figura 7: a) Concentración 1.87x106 Levaduras/ml y aspersor. b) Modelo de aspersión de 1.87x106 Levaduras/ml de Candida guilliermondii y agua destilada en adultos y ninfas de Myzus persicae
para tratamientos. (fotos de autora)
5.4.2 Tratamiento por suspensión
[image:21.612.167.445.383.528.2]22 Tabla No. 1: Tratamientos.
Para los tratamientos con levadura por suspensión para Myzus persicae se transfirieron los cinco adultos de cada replica a cajas de Petri a las cuales previamente se les había depositado 1ml de la solución de agua destilada mas levadura a una concentración 1.87x106 levadura/ml. De igual forma se realizó este procedimiento a las 15 ninfas evaluadas. El tiempo de exposición de los áfidos a la levadura fue de 40 segundos. Transcurrido el tiempo se tomo cada individuo con pincel de punta fina y se transfirió nuevamente a sus montajes correspondientes (Figura 8) (Tabla 1).
Figura 8: a) Caja de Petri con 1ml de 1.87x106 levadura/ml y cinco áfidos suspendidos. b) Caja de Petri con 1ml de agua destilada y cinco áfidos suspendidos. (fotos de autora)
[image:22.612.177.438.385.503.2]23 maceración del áfido. Esto con el fin de asegurar que la levadura que se llegase a aislar proviniera del interior del insecto. Esto se realizó para cada individuo de los tratamientos.
Figura 9: Tratamiento de desinfección de cada áfido muerto con hipoclorito de sodio al 1% y dos lavados con agua destilada. (foto de autora)
Transcurridos los dos días y medio de observaciones, los áfidos que continuaron vivos se les realizaron el mismo procedimiento con el fin de determinar si la levadura se encontraba dentro de los individuos ejerciendo un efecto más lento. Por otra parte, en cada uno de los cuatro tratamientos con agua destilada estéril a los áfidos muertos se les aplico el procedimiento anterior desinfectándolos y realizando el aislamiento en agar YGC. Todas las cajas fueron incubas a 30°C por 36 horas para observar el crecimiento de las unidades formadoras de colonia. Finalmente se tomó una colonia representativa de cada caja con medio de cultivo sembrado para realizar coloraciones de Gram y así comprobar la microscopia de las levaduras encontradas.
5.5 Análisis de resultados
Finalmente se determinó el porcentaje de mortalidad usando la formula de Abbott (Ecuación 1), tiempo de mortalidad de los individuos en cada uno de los tratamientos, presencia o ausencia de Candida guilliermondii en los individuos de la especie Myzus persicae por tratamiento y descripción de los áfidos afectados (Qi et al., 2011). Para el análisis estadístico el mejor método de análisis de datos fue mediante regresiones polinómiales dado que el numero de repeticiones fue tan solo tres siendo pocos datos.
[image:23.612.198.416.133.273.2]24
6 RESULTADOS Y DISCUSIÓN. 6.1 Identificación de áfidos
A partir de los áfidos colectados se realizó la identificación de los mismo mediante la clave propuesta por Torres, (2000) dando como resultado la especie Myzus persicae. Estos insectos presentan un color verde claro, sifones ubicados al final de su abdomen con una tonalidad en la punta más oscura que su cuerpo y un ligero hinchamiento, cauda puntiaguda, tubérculos frontales bien desarrollados, algunos adultos presentan manchas oscuras sobre su abdomen y el largo de sus antenas sobrepasan su cuerpo (Figura 10).
Figura 10: a) Ninfa de Myzus persicae de color verde claro. b) Cauda puntiaguda de Myzus persicae adulto. c) Sifones al final del abdomen con tonalidad más oscura hacia el ápice. (fotos de autora)
Dentro de las características principales para diferenciar los estadios de ninfas y adultos es el tamaño que alcanzan estos últimos con un promedio entre 4mm a 5mm de longitud y el alargamiento de la cauda la cual es un poco mas corta que los sifones (Carrero, 2005).
6.2 Determinación del ciclo biológico de Myzus persicae
25 Figura 11: a) Desprendimiento de exoesqueleto de ninfa de cuarto instar para iniciar estadio de adulto. b) Exoesqueleto totalmente liberado de la ninfa. (fotos de autora)
Figura 12: a) Ninfa de primer instar de Myzus persicae. b) Ninfa de segundo instar de Myzus persicae. c) Ninfa de tercer instar de Myzus persicae. d) Ninfa de cuarto instar de Myzus persicae. e) Adulto de Myzus persicae. (fotos de autora)
[image:25.612.85.513.259.482.2]26 ninfas y adultos de Myzus persicae la adquisición de los nutrientes necesarios para su buen desarrollo. La composición de los fotoasimilados los hacen sustancias ricas en sacarosa, azucares reductores, proteínas, aminoácidos, cetoacidos, fosfato, sulfato, calcio, sodio, magnesio y ácidos orgánicos las cuales son moléculas importantes que participan en los diferentes procesos bioquímicos para el desarrollo de los áfidos (Taiz et al., 2007). Por las condiciones presentadas a los áfidos tanto en la cría como en los bioensayos se evidenció un buen desarrollo de los mismos, dado por la rapidez con la que ocurría la liberación de los exoesqueletos. Según los estudios de Duarte et al., (2011) en promedio cada 48h ocurren los procesos de muda según las condiciones del medio, lo que difiere con lo obtenido ya que en un máximo de 36h se realizaba la liberación del exoesqueleto e inicio del siguiente instar por parte de los áfidos.
6.3 Obtención y cultivo de Candida guilliermondii (cepa PUJ)
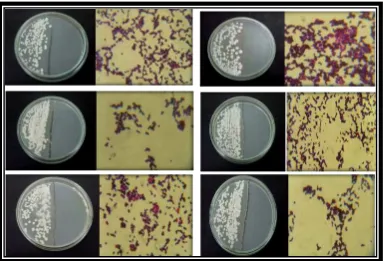
Luego de seguir el procedimiento descrito en la metodología se obtuvo una solución de 100ml de Candida guilliermondii en caldo YGC, en donde se obtuvo como resultado de la coloración de Gram levaduras de color morado con formas redondas y ovoides observándose la mayoría en estado de gemación al igual que la pureza de la muestra. Tras su aislamiento en cajas de Petri con Agar YGC a las 36h de incubación se observaron macroscópicamente colonias blancas redondas, pequeñas de textura cremosa. Al realizar una segunda coloración de Gram a partir de una colonia aislada en el agar se observo la misma morfología mencionada anteriormente (Figura 13). De acuerdo con Guayazán (2010) las características macroscópicas y la morfología microscópica concuerdan con la obtenida en el presente estudio. Posteriormente al diluir una colonia asilada de la caja de Petri con Agar YGC se realizo el recuento en cámara de New Bauer obteniendo una concentración de 1.87x106 levadura/ml la cual se utilizo en los bioensayos de aspersión.
Figura 13: a) Microscopía de Candida guilliermondii en inoculo inicial de caldo YGC. b) Macroscopía de Candida guilliermondii en Agar YGC proveniente del caldo YGC. c) Microscopía de
27
6.4 Bioensayos
6.4.1 Resultados del método de aspersión
Se obtuvo los siguientes resultados después de asperjar 1ml de agua destilada y 1ml de Candida guilliermondii (cepa PUJ) a los adultos y ninfas de Myzus persicae.
6.4.1.1 Aspersión con agua destilada estéril a adultos de Myzus persicae
Para los tratamientos de adultos de Myzus persicae por aspersión de 1ml de agua destilada se evidenció una mortalidad del 27% a las 12h en las tres replicas. Se realizaron los procesos de desinfección, lavado y maceración cuyos productos de los dos últimos se sembraron en el medio de cultivo YGC. Transcurrido el tiempo de incubación de 36h no se obtuvo crecimiento de ningún hongo o levadura en tres cajas. En la cuarta caja restante se observo una pequeña colonia de hongo blanco filamentoso hacia el lado derecho de la caja de Petri siendo esto producto de la siembra del segundo lavado con agua destilada, presentándose posiblemente por contaminación. A las 24h, 36h, 48h y 60h de observación de
Myzus persicae adultos el porcentaje de mortalidad fue del 0% (Tabla 3-Gráfica 1). Pasadas las 60h de observaciones de Myzus persicae los adultos que se mantuvieron vivos se les realizó el proceso de desinfección, lavado y maceración cuyos productos fueron sembrados en cajas de Petri con Agar YGC las cuales se incubaron por 36h a 30°. Transcurrido dicho tiempo se observo ausencia de crecimiento de microorganismos sobre el agar.
6.4.1.2 Aspersión con Candida guilliermondii en adultos de Myzus persicae
Para el tratamiento por aspersión a Myzus persicae con 1ml de Candida guilliermondii concentración de 1.87x106 levadura/ml se observo mortalidad de los áfidos a las 24h con un 13%, seguido del 40% a las 36h, 20% a las 48h y finalmente 0% a las 60h (porcentajes de mortalidad corregidos con la formula de Abbott -ecuación 1) (Tabla 3-Gráfica 1).
En los cuatro insectos muertos a las 12h no se les encontró asilada la levadura en el lado izquierdo de las cajas de Petri donde se sembraron los productos de las maceraciones de cada áfido. Atribuyéndose sus muertes posiblemente a los efectos del método de aspersión al igual que la manipulación ya que fueron los primeros en morir en un tiempo de 12 horas (Figura 14).
28 Gram de una colonia representativa de cada caja de Petri dando como resultado en vista microscópica levaduras de color morado, redondas y ovoides en estado de gemación algunas de ellas correspondiendo presuntamente a Candida guilliermondii (Tabla 7- Figuras 15, 16 y 17). En el lado derecho de las cajas donde se sembró el producto del segundo lavado de cada áfido no se obtuvo crecimiento de ninguna colonia.
Tabla 2. Porcentaje de mortalidad de adultos de Myzus persicae por aspersión de agua destilada y
Candida guilliermondii.
Porcentaje de mortalidad de adultos de Myzus persicae
12h 24h 36h 48h 60h Total
Aspersión de 1ml de
agua destilada 27% 0% 0% 0% 0% 27%
Aspersión de 1ml de
Candida guilliermondii 0% 13% 40% 20% 0% 73%
Porcentaje de mortalidad de adultos de Myzus persicae
Tiempo(horas)
10 20 30 40 50 60
%mo
rt
alid
ad
0 20 40 60 80 100
Porcentaje de mortalidad de adultos de Myzus persicae por aspersion de 1ml de agua destilada. Porcentaje de mortalidad de adultos de Myzus persicae por aspersion de 1ml de Candida guilliermondii.
29 Figura 14: Ausencia de Candida guilliermondii al interior de adultos de Myzus persicae por aspersión de 1ml de levadura a las 12h de aplicación. (fotos de autora)
Figura 15: Presencia presuntiva de Candida guilliermondii al interior de dos adultos de Myzus persicae por aspersión de 1ml de la levadura a las 24h de aplicación. Vista microscópica (100X) de presunta Candida guilliermondii. (fotos de autora)
[image:29.612.116.499.318.579.2]30 Figura 17: Presencia presuntiva de Candida guilliermondii al interior de tres adultos de Myzus persicae por aspersión de 1ml de la levadura a las 48h de aplicación. Vista microscópica (100X) de presunta Candida guilliermondii. (fotos de autora)
Según la tabla 3 y gráfica 1 el mayor porcentaje de mortalidad en adultos de
Myzus persicae por aspersión de 1ml de Candida guilliermondii fue del 40% a las 36h de aplicación. Este tratamiento obtuvo un porcentaje de mortalidad total del 73% pasada las 60h de observaciones. Por lo que la muerte de estos individuos se atribuye a los efectos causados por el método de aplicación dado a la agresividad de esta técnica. Según Lawrence et al., (2009) al evaluar diferentes dispositivos de aspersión se deduce que la distancia y la fuerza de aplicación de la solución puede ocasionar efectos letales en los organismos por lo que resulta un interferente en la investigación.
6.4.1.3 Aspersión con agua destilada estéril en ninfas de Myzus persicae
Para el método de aspersión con 1ml de agua destilada a ninfas de Myzus persicae se obtuvo un porcentaje de mortalidad del 20% a las 12h seguido de un 13% a las 24h de observaciones (Tabla 4-Gráfica 2). Se realizaron los procesos de desinfección, lavado y maceración cuyos productos de los dos últimos se sembraron en el medio de cultivo YGC. Transcurrido el tiempo de incubación de 36h no se obtuvo crecimiento de ningún microorganismo. Hacia las 36h, 48h y 60h de observación de las ninfas de Myzus persicae el porcentaje de mortalidad fue del 0% (Tabla 4-Gráfica 2). Pasadas las 60h de observaciones de Myzus persicae
las ninfas que se mantuvieron vivas se les realizó el proceso de desinfección, lavado y maceración cuyos productos fueron sembrados en cajas de Petri con Agar YGC las cuales se incubaron por 36h a 30°. Transcurrido dicho tiempo se observo ausencia de crecimiento de microorganismos sobre el agar.
6.4.1.4 Aspersión con Candida guilliermondii a ninfas de Myzus persicae
[image:30.612.87.530.70.148.2]31 En las siembras realizadas en las cajas de Petri productos del segundo lavado y maceración de los insectos muertos a las 12h en Agar YGC no se hallaron colonias de Candida guilliermondii por lo que se atribuyen las muertes a los efectos que genera el estrés al que se expuso los insectos (Lawrence et al., 2009) (Figura 18).
32 Tabla 3. Porcentaje de mortalidad de ninfas de Myzus persicae por aspersión de agua destilada y
Candida guilliermondii.
Porcentaje de mortalidad de ninfas de Myzus persicae
Tiempo (horas)
10 20 30 40 50 60
% m
or
talidad
0 20 40 60 80 100
Porcentaje de mortalidad de ninfas de Myzus persicae por aspersion de 1ml de agua destilada. Porcentaje de mortalidad de ninfas de Myzus persicae por aspersion de 1ml de Candida guilliermondii.
Gráfica 2. Porcentaje de mortalidad de ninfas de Myzus persicae por aspersión con agua destilada y Candida guilliermondii a lo largo de las 60h de observación.
33 Figura 19: Presencia presuntiva de Candida guilliermondii al interior de seis ninfas de Myzus persicae por aspersión de 1ml de la levadura a las 24h de aplicación. Vista microscópica (100X) de presunta Candida guilliermondii. (fotos de autora)
Figura 20: Presencia presuntiva de Candida guilliermondii al interior de cuatro ninfas de Myzus persicae por aspersión de 1ml de la levadura a las 36h de aplicación. Vista microscópica (100X) de presunta Candida guilliermondii. (fotos de autora)
[image:33.612.136.477.70.287.2] [image:33.612.128.485.352.512.2]34 mortalidad mas rápido en ninfas asperjadas con agua se presume que estos insectos son muy sensibles al método de aspersión causando la mortalidad de los mismos.
Por otra parte, las ninfas son mucho más sensibles que los adultos ya que estas presentaron mayor mortalidad doce horas antes que los adultos. A pesar de la presencia de sus exoesqueletos la fuerza y distancia con las que se aplicó las soluciones respectivas afecto drásticamente la viabilidad de los mismos (Lawrence
et al., 2009).
En los tratamientos y controles por aspersión tanto en adultos como ninfas en el presente estudio no se controlaron las distancias entre los organismos y el aspersor al igual que el número de aspersiones por individuo. Otro factor influyente fue el desconocimiento de la presión con la que iba dirigida la solución hacia el insecto ocasionando estrés a los individuos especialmente en los instares ninfales los cuales se vieron más afectados por esta técnica en cuanto a tiempo de mortalidad. Igualmente estudios realizados por Kim et al., (2007) y Shan et al.,(2010) quienes realizaron procesos de aspersión de hongos entomopatógenos como Lecanicillium sp. y Metarhizium sp. a Myzus persicae utilizaron dispositivos mecánicos como el rociador Track Sprayer el cual posee un diámetro de 8002micras y a una presión de aspersión de 344.7 KPa y el Automatic Potter Spray Tower respectivamente, lo que disminuye la manipulación de los insectos reduciendo el error humano en la técnica. Por otra parte, los valores reportados según Hernández et al., (1981) la presión utilizada para asperjar una solución a insectos es de 10kg/cm2, velocidad de 8km/h y volumen de 150-300l/Ha.
6.4.2 Resultados del método de suspensión
Se obtuvo los siguientes resultados después de suspender en 1ml de agua destilada y 1ml de Candida guilliermondii (cepa PUJ) a los adultos y ninfas de
Myzus persicae.
6.4.2.1 Suspensión de adultos de Myzus persicae en agua destilada estéril
Para el método de suspensión de Myzus persicae adultos en 1ml de agua destilada, se obtuvo un porcentaje de mortalidad del 13% a las 24h de aplicación (Tabla 5-Gráfica 3). Se realizaron los procesos de desinfección, lavado y maceración cuyos productos se sembraron en el medio de cultivo YGC. Transcurrido el tiempo de incubación de 36h no se obtuvo crecimiento de ningún microorganismo. Hacia las 36h, 48h y 60h de observación de Myzus persicae
35 Pasadas las 60h de observación, los adultos de Myzus persicae que se mantuvieron vivos hasta ese momento se les realizó el proceso de desinfección, lavado y maceración cuyos productos se sembraron en cajas de Petri con Agar YGC las cuales se incubaron por 36h a 30°. Transcurrido dicho tiempo se observo ausencia de crecimiento de microorganismos sobre el agar.
6.4.2.2 Suspensión de adultos de Myzus persicae en Candida guilliermondii
Para el tratamiento de suspensión de adultos de Myzus persicae en 1ml de
Candida guilliermondii a una concentración de 1.87x106 levadura/ml se observo mortalidad de los áfidos a partir de las 12h de aplicación con un porcentaje de mortalidad del 6%, seguido de un 8% a las 24h, 47% a las 36h, 27% a las 48h y 0% a las 60h (porcentajes de mortalidad corregidos con la formula de Abbott -ecuación 1) (Tabla 5-Gráfica 3). El insecto muerto en las primeras doce horas se le realizó el proceso de desinfección, lavado y maceración cuyos productos de los dos últimos fueron sembrados en agar YGC. Transcurridas las 36h de incubación no se obtuvo crecimiento de ningún hongo o levadura al igual que dos de los áfidos muertos a las 24h por lo que se atribuyen las muertes a los efectos que genera el estrés al que se expuso los insectos (Lawrence et al., 2009) (Tabla 7- Figuras 21, 22).
En uno de los áfidos muertos a las 24h se evidenció crecimiento de pequeñas colonias blancas redondas sobre el Agar YGC por lo que se dejo incubar por 12 horas más para observar mejor el desarrollo de las mismas. La microscopia con coloración de Gram revelo levaduras moradas redondas similar a Candida guilliermondii (Figura 23).
En las cajas sembradas con los productos del segundo lavado y maceración de los once áfidos muertos a partir de las 36h hasta las 48h de la suspensión se observo crecimiento de colonias blancas, cremosas, lisas y redondas sobre el Agar YGC y frente a las microscopias con tinción de Gram se observaron levaduras moradas similares a las ya encontradas siendo presuntivamente
36 Tabla 4. Porcentaje de mortalidad de adultos de Myzus persicae por suspensión de agua destilada y Candida guilliermondii.
Porcentaje de mortalidad de adultos de Myzus persicae
Tiempo (horas)
10 20 30 40 50 60
%
m
orta
lida
d
0 20 40 60 80 100
Porcentaje de mortalidad de adultos de Myzus persicae por suspension en 1ml de agua destilada. Porcentaje de mortalidad de adultos de Myzus persicae por suspension en 1ml de Candida guilliermondii.
Gráfica 3. Porcentaje de mortalidad de adultos de Myzus persicae por suspensión en agua destilada y Candida guilliermondii a lo largo de las 60h de observación.
[image:36.612.100.514.240.525.2]37 Figura 22: Ausencia de Candida guilliermondii al interior de adultos de Myzus persicae suspendidos en 1ml de Candida guilliermondii concentración 1.87x106 UFC/ml a las 24h de observaciones. (fotos de autora)
Figura 23: Presencia presuntiva de Candida guilliermondii al interior de adulto de Myzus persicae
en suspensión de 1ml de la levadura a las 24h de aplicación. Vista microscópica (100X) de presunta Candida guilliermondii. (fotos de autora)
Figura 24: Presencia presuntiva de Candida guilliermondii al interior de adultos de Myzus persicae
[image:37.612.180.432.236.348.2] [image:37.612.143.472.411.656.2]38 Figura 25: Presencia presuntiva de Candida guilliermondii al interior de adultos de Myzus persicae
por suspensión en 1ml de la levadura a las 48h de aplicación. Vista microscópica (100X) de presunta Candida guilliermondii. (fotos de autora)
Según la tabla 5 y gráfica 3 el porcentaje de mortalidad de adultos por suspensión en agua destilada fue mayor a las 24h con un 13%. Adjudicando la muerte de los áfidos en el control al posible estrés al que fueron expuestos por el traslado de caja de Petri al igual que la manipulación de los mismos. Por otra parte la mortalidad mayor de adultos por suspensión en Candida guilliermondii fue del 47% a las 36h de aplicación. Este tratamiento obtuvo un porcentaje de mortalidad total del 88% pasada las 60h de observaciones. A los áfidos muertos a partir de las 24h hasta las 48h de observaciones se les encontró presuntivamente Candida guilliermondii en el interior.
6.4.2.3 Suspensión de ninfas de Myzus persicae en agua destilada estéril
Para el método de suspensión de ninfas de Myzus persicae en 1ml de agua destilada se obtuvo una mortalidad a partir de las 12h de aplicación con un 20% seguido de un 0% a las 36h, 48h y 60h (Tabla 6-Gráfica 4). En la siembra de los productos del segundo lavado y maceración de dichos insectos no se observo crecimiento de ningún tipo de colonias sobre el Agar YGC transcurridas las 36h de incubación. Transcurridas las 60h de observación los áfidos que continuaron vivos se les realizó el proceso de desinfección, lavado y maceración cuyos productos de los dos últimos fueron sembrados en cajas de Petri con Agar YGC las cuales se incubaron por 36h a 30°. Transcurrido dicho tiempo se observo ausencia de crecimiento de microorganismos sobre el agar.
6.4.2.4 Suspensión de ninfas de Myzus persicae en Candida guilliermondii
39 desinfección, lavado y maceración cuyos productos de los dos últimos fueron sembrados en agar YGC. Transcurridas las 36h de incubación no se obtuvo crecimiento de ningún hongo o levadura, por lo que se atribuyen las muertes a los efectos que genera el estrés al que se expuso los insectos (Lawrence ., 2009) (Tabla 8- Figura 26). Por el contrario las cajas sembradas con los productos del segundo lavado y maceración de los doce áfidos muerto a partir de las 36h hasta las 60h de la suspensión se observo crecimiento de colonias blancas, pequeñas y cremosas sobre el agar YGC.
[image:39.612.146.427.505.693.2]La microscopia de cada colonia seleccionada por caja de Petri fue de levaduras redondas y ovoideas en estado de gemación y frente a la coloración de Gram se evidenció retención del cristal violeta tomando un color morado dichas estructuras, siendo presuntivamente Candida guilliermondii (Tabla 8- Figuras 27, 28, 29, 30). En el lado derecho de las cajas donde se sembró el producto del segundo lavado de cada áfido no se obtuvo crecimiento de ninguna colonia.
Tabla 5. Porcentaje de mortalidad de ninfas de Myzus persicae por suspensión de agua destilada y
Candida guilliermondii.
Porcentaje de mortalidad de ninfas de Myzus persicae
Tiempo (horas)
10 20 30 40 50 60
%
mo
rt
alidad
0 20 40 60 80 100
Porcentaje de mortalidad de ninfas de Myzus persicae por suspension en 1ml de agua destilada.
40 Gráfica 4. Porcentaje de mortalidad de ninfas de Myzus persicae por suspensión en agua destilada y Candida guilliermondii a lo largo de las 60h de observación.
Figura 26: Ausencia de Candida guilliermondii al interior de ninfas de Myzus persicae suspendidos en 1ml de Candida guilliermondii concentración 1.87x106 UFC/ml a las 24h de observaciones. (fotos de autora)
Figura 27: Presencia presuntiva de Candida guilliermondii al interior de ninfas de Myzus persicae
por suspensión en 1ml de la levadura a las 36h de aplicación. Vista microscópica (100X) de presunta Candida guilliermondii. (fotos de autora)
Figura 28: Presencia presuntiva de Candida guilliermondii al interior de ninfas de Myzus persicae
[image:40.612.127.488.249.398.2] [image:40.612.125.488.463.638.2]41 Figura 29: Presencia presuntiva de Candida guilliermondii al interior de ninfas de Myzus persicae
por suspensión en 1ml de la levadura a las 60h de aplicación. Vista microscópica (100X) de presunta Candida guilliermondii. (fotos de autora)
[image:41.612.136.478.71.239.2]A las 60h quedo un áfido vivo al cual se le realizó el proceso de desinfección y maceración cuyos productos fueron sembrados en Agar YGC, evidenciándose tras las 36h de incubación colonias blancas, pequeñas y cremosas en menor número que las obtenidas anteriormente. En cuanto a la microscopia se observo levaduras moradas, redondas y en gemación frente a la coloración de Gram (Figura 39).
Figura 30: Presencia presuntiva de Candida guilliermondii al interior de ninfa de Myzus persicae por suspensión en 1ml de la levadura a las 60h de aplicación. Vista microscópica (100X) de presunta
Candida guilliermondii. (fotos de autora)
[image:41.612.182.432.396.515.2]42 La manipulación de la transferencia de los insectos afecto la viabilidad de las ninfas ya que estos individuos son más sensibles a cambios bruscos de su medio ambiente. Por lo que se obtuvo un porcentaje a las 12h de los individuos suspendidos en agua destilada. Por el contrario los áfidos muertos en el tratamiento se encontró la levadura Candida guilliermondii en todos los individuos incluyendo en uno de ellos que se encontró vivo a las 60h. Posiblemente la invasión de la levadura tomó más tiempo con respecto a la técnica de aspersión ya que en el proceso de muda al liberar el exoesqueleto pudo llevar consigo las levadura (Hiller et al., 2011). La invasión de la levadura a la membrana basal del insecto se vio afectada ya que los procesos de muda fueron bastante rápidos con un promedio de tiempo de 36h o día y medio.
Tabla 6. Tabla resumen de la mortalidad de adultos de Myzus persicae en tratamientos y controles
+: Insectos positivos con presuntiva Candida guilliermondii al interior. - : Insectos negativos con presuntica Candida guilliermondii.
Tabla7. Tabla resumen de la mortalidad de ninfas de Myzus persicae en tratamientos y controles.
+: Individuos positivos con presuntiva Candida guilliermondii al interior. - : Individuos negativos con presuntica Candida guilliermondii.
43 aplicaciones de la levadura Candida guilliermondii) por el modelo estadístico construido en el análisis; de igual manera se hace hincapié en los puntos máximos de inflexión corroborando las tasas de mortalidad ya explicadas. Es así como, encontrando puntos de inflexión máximos entre las 18h para ninfas y las 48h para adultos. El coeficiente de Determinación se encuentra en 97.4% y 70.7% para ninfas y adultos respectivamente.
Grafica 5. Regresión polinómial grado tres.
44 Para el análisis estadístico de aspersión, tanto para ninfas como para adultos, muestra un punto de inflexión en 24 horas. Con Determinación del 90.4% se observa una tendencia de mortalidad tanto en las ninfas como en los adultos. La tendencia de mortalidad por aspersión en larvas tiene mayor continuidad, con mayor nivel de determinación entre los datos.
Grafica 7. Regresión polinómica para datos de inmersión tanto adultos como ninfas de Myzus persicae.
45 Grafica 8. Consolidación de regresión polinómica de inmersión de áfido ninfas y adultos de Myzus persicae.
Para los datos agregados en inmersión tanto para ninfas como para adultos, se observa punto de inflexión alrededor de 48 horas. Con coeficiente de determinación en 95.8%.
46 En adultos, el coeficiente de determinación es más bajo pero el punto de inflexión en más alto. Por el contrario en ninfas el coeficiente de determinación es del 92.8% pero los datos muestran el punto de inflexión en menor grado.
Grafica 10. Análisis comparativo de la mortalidad de adultos y ninfas por aspersión e inmersión.
Los datos consolidados para adultos y ninfass, tanto en aspersión como inmersión muestran puntos de inflexión alrededor de las 36 horas, con un coeficiente de determinación del 93.3%
Se hace necesario aclara que los porcentajes de mortalidad obtenidos en los bioensayos con agua destilada fueron altos debido a los proceso de manipulación de los insectos y falta de estandarización de la metodología. Como se menciona anteriormente en el texto es necesario conocer la fuerza, distancia y garantizar el mismo número de aspersión que reciba cada individuo para evitar influencia de dichos factores sobre la viabilidad de los insectos y así poder obtener resultados mucho más rigurosos. También se evidencio un crecimiento de colonias sobre el Agar YGC como producto de la maceración de cada insecto sin embargo no se garantiza que dichas formas sean pertenecientes a la especie Candida guilliermondii y que su presencia no sea producto de levadura la cual se halla encontrado en el exoesqueleto para el momento de la maceración.
6.5 Posibles formas de invasión de Candida guilliermondii al interior de ninfas y adultos de Myzus persicae