METODOLOGÍA SINTÉTICA
APLICADA A LA SÍNTESIS DE
FÁRMACOS
TEMA 9
Fármacos contra la diabetes
Índice
1. Introducción 1
2. Tipos de diabetes 1
3. Insulina 1
3.1. Receptor de insulina 3
4. Resistencia a insulina 4
5. Glucagón 5
6. Fármacos contra la diabetes 5
7. Síntesis de antidiabéticos 6
7.1. Metformina 6
7.2. Sulfonilureas 7
7.2.1. Glipizida 8
7.2.2. Gliburida (glibenclamida) 9
7.2.3. Glimepirida 10
7.3. Tiazolidindionas 10
7.3.1. Rosiglitazona 11
7.3.2. Pioglitazona 12
7.4. Meglitinidas 13
7.4.1. Nateglinida 13
7.4.2. Repaglinida 14
7.4.2.a. Análisis retrosintético 14
7.4.2.b. Síntesis 14
7.5. Inhibidores de la alfa-glicosidasa 16
7.6. Inhibidores de la dipeptidil peptidasa-4 16
7.6.1. Linagliptina 17
7.6.1.a. Análisis retrosintético 17
7.6.1.b. Síntesis 18
7.6.1.c. Cuestiones 20
7.6.2. Sitagliptina 20
7.6.2.a. Análisis retrosintético 20
7.6.2.b. Síntesis 21
7.6.2.c. Cuestiones 23
7.6.3. Alogliptina 23
7.6.3.a. Análisis retrosintético 23
7.6.3.b. Síntesis 23
Fármacos contra la diabetes
1. Introducción
La diabetes es una enfermedad caracterizada por la excesiva presencia de glucosa en la sangre y la orina debida a la disminución de la secreción de la hormona insulina o a una deficiencia o alteración de su mecanismo de acción.
El término diabetes procede del griego diabétes, que hacía referencia al compás abierto al cual semeja una persona andando. En medicina, la diabetes se emplea para definir la enfermedad caracterizada por la poliuria. El término diabetes ya se empezó a usar en el siglo I de nuestra era por Areteo de Capadocia, que lo empleó en su sentido etimológico de tránsito o
paso, en alusión a la excesiva expulsión de orina.
A la palabra diabetes se le añade el término mellitus, que procede del griego melli que significa miel. En 1674 el médico inglés Thomas Willis usó la combinación diabetes mellitus para referirse a una variante de la diabetes en la cual la orina tenía un matiz amarillento que la hacía asemejarse a un disolución acuosa de miel. Otra explicación para el uso del término mellitus radica en que, antiguamente, los médicos solían probar la orina de los pacientes para examinarla, encontrando un sabor dulzón por la presencia de glucosa en la misma en aquellos pacientes que sufrían diabetes. El término diabetes mellitus se generalizó como contraposición al término diabetes insípida, enfermedad que no está causada por un desorden en los níveles de glusosa sino por una alteración en la hormona antidiurética, que provoca una excesiva producción de orina.
2. Tipos de diabetes
Diabetes mellitus tipo 1. Este tipo de diabetes, que solía denominarse diabetes juvenil o
insulinodependiente, se diagnostica, por lo general, en niños, adolescentes o adultos jóvenes, y es debida a una nula, o mínima, producción de insulina por el organismo.
Diabetes mellitus tipo 2. En el pasado esta enfermedad se consideraba la diabetes de la edad adulta, pues no atacaba a los jóvenes, aunque en la actualidad este trastorno afecta también a
ciertos niños. La diabetes mellitus tipo 2 es una enfermedad metabólica caracterizada por altos niveles de glucosa en la sangre debido a la resistencia celular a las acciones de la insulina. Así, los adipocitos, los hepatocitos y las células musculares no responden de manera correcta a la insulina haciéndose resistentes a la misma, lo que impide la entrada de la glucosa en las células y su consiguiente acumulación en la sangre.
Diabetes mellitus gestacional. Es una forma de diabetes inducida por el embarazo. No se
conoce una causa específica de este tipo de enfermedad. Puede deberse a la acción de ciertas hormonas del embarazo las cuales reducen la capacidad que tiene el cuerpo de utilizar y responder a la acción de la insulina. Este tipo de diabetes suele desaparecer una vez que la mujer ha dado a luz. Aquellas mujeres que la han tenido, así como sus bebés, tienen mayores probabilidades de contraer diabetes mellitus tipo 2 en el futuro.
3. Insulina
En 1869, Paul Langerhans, por aquel entonces estudiante de medicina en Berlín, encontró unos grupos de células en el páncreas que, más adelante, fueron denominados islotes de
Langerhans. Estos islotes contienen las células beta encargadas de la producción de la insulina y
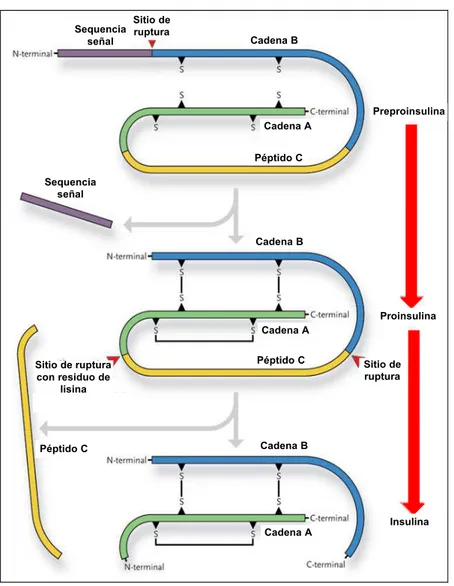
La insulina, término que proviene del latín insula (isla), es una hormona polipeptídica formada por 51 aminoácidos. La insulina es una proteína pequeña que plantea un desafío a las células ya que es difícil, a partir de una pequeña proteína, lograr una estructura estable plegada. En el caso de la insulina este problema se resuelve mediante la síntesis de una cadena de proteína más larga que se pliega adecuadamente. Así, en el retículo endoplasmático rugoso de las células beta del páncreas se genera la preproinsulina que es convertida en proinsulina que se estabiliza adicionalmente mediante la formación de tres puentes disulfuro por oxidación (véase la figura 9.1). Una vez sintetizada, la proinsulina es transportada al aparato de Golgi donde es empaquetada dentro de vesículas secretoras. Allí, las proteasas cortan la cadena peptidica sobrante generando el péptido C y la insulina, constituida por dos cadenas pequeñas conectadas por dos puentes disulfuro intercadena y uno intracadena (véase la figura 9.1).
Sequencia señal
Insulina Preproinsulina
Proinsulina Sitio de
ruptura Sequencia
señal Cadena B
Cadena A
Sitio de ruptura Cadena B
Cadena A
Cadena B
Cadena A Péptido C
Péptido C
Péptido C Sitio de ruptura
con residuo de lisina
Figura 9.1. Representación de la síntesis de la insulina
Canal de K+ Canal de Ca2+
Entrada de Ca2+
Glucosa Transportador de glucosa
Metabolismo
ATP
Cierre del canal de K+
Despolarización de la membrana
Estimulación de la exocitosis
Liberación de insulina
Figura 9.2. Representación del proceso de liberación de la insulina
Además de su papel en la regulación del metabolismo de la glucosa, la insulina también cumple otras funciones en el organismo ya que estimula la lipogénesis, disminuye la lipólisis y aumenta el transporte de aminoácidos en las células. La insulina también actúa como factor de crecimiento ya que es estructural y funcionalmente similar a otros tres factores de crecimiento como el IGF-1 (Insulin-like Growth Factor-1), el IGF-2 y la relaxina. La estructura terciaria de la insulina y de estas tres moléculas es similar y todas exhiben actividad promotora del crecimiento. Así, la insulina estimula y modula la transcripción y la translocación de proteínas, el crecimiento celular, la síntesis de ADN y la replicación celular, efectos que comparte con los factores de crecimiento IGF-1 e IGF-2 y con la relaxina.
3.1. Receptor de insulina
El receptor de la insulina es un receptor extracelular acoplado a enzima con actividad tirosina quinasa (véase el tema 8). El receptor está formado por dos subunidades α y dos subunidades β. Ambos tipos de subunidades son sintetizadas desde un pro-receptor único codificado por un gen localizado en el cromosoma 19. La proteína sintetizada es escindida en dos fragmentos que generan la subunidad alfa y la subunidad β. Las dos subunidades alfa se encuentran en el lado extracelular de la membrana y se unen entre sí mediante puentes disulfuro. Las dos subunidades β se insertan en la membrana celular y se unen a las subunidades alfa mediante enlaces disulfuro (véase la figura 9.3). La actividad tirosina-quinasa reside en la parte de las subunidades β insertada en el citoplasma celular.
Insulina Insulina
Membrana Citoplasma
Dominios Tirosina Quinasa Región
sensible a proteasas
Dominios SH2 P1 3-Quinasa
Figura 9.3. Representación del receptor de insulina
La PIP3 activa la proteína transportadora de la glucosa [GLU] que capta la glucosa del medio extracelular y la transporta al interior de la célula.
La fosfotirosina fosfatasa activada por la fosforilación de la IRS-1 induce la fosforilación de proteínas nucleares lo que, a su vez, activa la síntesis de proteínas y lípidos.
La GRB-2 no tiene una actividad enzimática intrínseca, pero une la IRP-1 con la vía metabólica de la proteína Ras que está implicada en el crecimiento y el metabolismo de las células.
La acción indirecta de la insulina sobre otras otras proteínas P-SH2 pone en marcha otras vías de señalización intracelular que activan la síntesis de glucógeno.
4. Resistencia a insulina
En el metabolismo de una persona normal las concentraciones elevadas de glucosa estimulan al páncreas para que libere insulina, que activa a sus receptores ubicados en células del hígado, de los músculos y del tejido adiposo. La activación de los receptores pone en marcha, entre otras acciones, el mecanismo de entrada de la glucosa en las células con la consiguiente producción de energía.
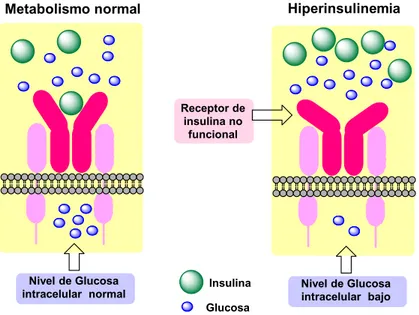
La resistencia a la insulina, también conocida como hiperinsulinemia, es una deficiencia metabólica en la cual el cuerpo no puede utilizar la insulina de forma eficiente debido, fundamentalmente, a que la hormona no puede unirse adecuadamente con el receptor. La hiperinsulinemia se acompaña de una sobreproducción pancreática de insulina y de altos niveles de glucosa en sangre (hiperglucemia) que causan la diabetes mellitus tipo 2 (véase la figura 9.4).
Insulina Glucosa Nivel de Glucosa
intracelular normal Nivel de Glucosa intracelular bajo Hiperinsulinemia Metabolismo normal
Receptor de insulina no funcional
Figura 9.4. Representación de la resistencia a insulina
La resistencia a la insulina es un proceso multifactorial que involucra tanto factores genéticos como factores adquiridos. Hay que tener en cuenta una serie de factores de riesgo que pueden predisponer al desarrollo de esta enfermedad, como el sobrepeso, familiares con diabetes mellitus tipo 2, presión arterial alta, altos niveles de colesterol y triglicéridos y nula o escasa actividad física.
El tratamiento de la hiperinsulinemia es, en primera instancia, de orden no farmacológico, recomendándose realizar dietas hipocalóricas de, más o menos, 20 calorías por kilo de peso, potenciando el consumo de ácidos grasos monoinsaturados, como aceite de oliva, y la realización de ejercicio controlado.
Si esta terapia no disminuye la hiperinsulinemia ni la hiperglucemia se recetan al paciente fármacos que ayuden a la terapia inicial.
5. Glucagón
El glucagón es una hormona peptídica que contiene 29 aminoácidos. El glucagón actúa en el metabolismo del glucógeno y es sintetizada por las células alfa del páncreas. Estimula los procesos catabólicos e inhibe los procesos anabólicos.
El principal mecanismo regulador para la secreción de glucagón es el nivel de glucosa en sangre. Así, cuando los niveles de glucosa aumentan se produce una inhibición en la secreción de glucagón y un aumento en la secreción de insulina, mientras que cuando la glucemia disminuye aumenta la secreción de glucagón y disminuye la de insulina.
En el hígado el glucagón tiene un efecto hiperglucemiante ya que promueve la glucogenólisis mediante activación de la glucógeno fosforilasa e inactivación de la glucógeno sintasa. También promueve la neoglucogénesis a partir de aminoácidos.
El glucagón también influye en el metabolismo de los lípidos ya que estimula la producción de la lipasa hormono sensible facilitando el desdoblamiento de los triglicéridos y el aumento de la concentración de ácidos grasos en sangre.
El glucagón también provoca un aumento en el catabolismo nitrogenado incrementando la pérdida por orina de urea, creatinina y ácido úrico.
Figura 9.5. Representación del sistema insulina-glucagón
6. Fármacos contra la diabetes
Los enfermos aquejados de diabetes mellitus tipo 1 se ven obligados a tomar insulina para controlar sus niveles de glucosa en sangre ya que el páncreas no produce insulina.
La diabetes tipo 2 puede controlarse mediante una combinación de fármacos, dieta adecuada y actividad física. Hay disponibles seis tipos de medicamentos para la diabetes en forma de píldora:
.- Biguanidas (metformina)
.- Sulfonilureas
.- Tiazolidindionas
.- Meglitinidas
.- Inhibidores de la alfa-glucosidasa
.- Inhibidores de la dipeptidil peptidasa-4 (DPP-4)
7. Síntesis de antidiabéticos 7.1. Metformina
En 1918 se descubrió la capacidad antiglucimiante de la planta Galega officinalis que contiene compuestos de tipo biguanida como la galegina y la sintalina.
H2N N
NH2
Galegina
H2N N
NH2
N H2N NH2
Sintalina
La metformina es una biguanida de síntesis que se receta como primer medicamento oral en los pacientes diagnosticados de diabetes mellitus tipo 2. Este tipo de pacientes diabéticos tiene un ritmo de gluconeogénesis tres veces mayor de lo normal y la administración de metformina logra disminuir esta tasa en más de un tercio. Además de la reducción de la gluconeogénesis, la metformina reduce la glucogenolisis hepática y la absorción de glucosa por el tracto gastrointestinal.
La metformina aumenta la actividad IP3 quinasa del receptor de insulina lo que provoca una mayor utilización de la glucosa por parte de los tejidos periféricos al incrementar la sensibilidad de éstos a la insulina.1
La metformina se obtiene por reacción del clorhidrato de dimetilamina 9.1 con la 2-cianoguanidina 9.2 en tolueno. La reacción proporciona el clorhidrato de metformina (véase el esquema 9.1).
Esquema 9.1
7.2. Sulfonilureas
Las sulfonilureas más empleadas en el tratamiento de la diabetes mellitus tipo 2 son la glipizida, la gliburida y la glimepirida (véase la figura 9.7).
Figura 9.7. Estructuras de la glipizida, gliburida y glimepirida
Las sulfonilureas se unen a los canales de potasio dependientes de ATP de las células pancreáticas beta Esta acción inhibe el reflujo hiperpolarizante del ión potasio provocando un
1 Hundal, R.; Krssak, M.; Dufour, S.; Laurent, D.; Lebon, V.; Chandramouli, V.; Inzucchi, S.; Schumann,
potencial de membrana más positivo. La despolarización abre los canales de calcio dependientes del voltaje aumentando la exocitosis de los gránulos transportadores y provocando, finalmente, la secreción de la insulina (véase la figura 9.2).
Parece ser que las sulfonilureas también reducen la producción de glucosa en el hígado y disminuyen la lipólisis, o degradación de grasas por los adipocitos. Las sulfonilureas pueden también estimular la liberación de somatostina y disminuir la secreción de glucagón por parte de las células alfa en los islotes de Langerhans.
Los efectos secundarios de las sulfonilureas pueden incluir aumento de peso y un nivel bajo de sodio en la sangre. Las sulfonilureas pueden tomarse solas o con metformina, pioglitazona (una tiazolidindiona) o insulina.
7.2.1. Glipizida
La glipizida bloquea los canales de potasio dependientes de ATP de las membranas de las células pancreaticas beta, lo que provoca despolarización, entrada de calcio y liberación de insulina. En el esquema 9.2 se indica una síntesis de glipizida que parte del ácido 5-metilpirazin-2-carboxílico 9.3. La conversión de este compuesto en el cloruro de ácido 9.4 va seguida de la reacción con 4-(2-aminoetil)bencenosulfonamida 9.5, lo que proporciona la pirazinsulfonamida 9.6. La reacción de este compuesto con isocianato de ciclohexilo permite la obtención de la glipizida.
Esquema 9.2
En el esquema 9.3 se indica una síntesis de la 4-(2-aminoetil)bencenosulfonamida 9.5 que se inicia con la acetilación de la 2-feniletan-1-amina 9.8. La reacción SEAr con el ácido
clorosulfónico proporciona el cloruro de 4-(2-acetamidoetil)bencenosulfonilo 9.10. La amonólisis de este compuesto conduce a la sulfonamida 9.11 por por saponificación proporciona el compuesto 9.5.2
2 Zhang, H.; Zhang, Y.; Wu, G.; Zhou, J.; Huang, W.; Hu, X. Bioorg. Med. Chem. Lett. 2009, 19, 1740–
Esquema 9.3
7.2.2. Gliburida (glibenclamida)
La síntesis de la gliburida es similar a la de la glipizida y se indica en el esquema 9.4.
Esquema 9.4
7.2.3. Glimepirida
Como todas las sulfonilureas, la glimepirida actúa como un secretagogo de insulina (un segretagogo es una sustancia que hace que otra sustancia sea liberada o secretada). La glimepirida reduce el nivel de glucosa en sangre mediante la estimulación de la liberación de insulina por las células beta del páncreas y mediante la inducción de aumento de la actividad de receptores de insulina intracelulares. La glimepirida presenta algunas ventajas en relación con la gliburida. Así, la gliburida se asocia con una incidencia de hipoglucemia de hasta 20-30%, sin embargo con la glimepirida estos porcentajes bajan al 2-4%. En respuesta a la hipoglicemia, la gliburida interfiere la supresión homeostática del proceso de secreción de insulina, mientras que la glimepirida no exhibe este efecto. La gliburida disminuye la secreción de glucagón en reacción a la hipoglucemia, mientras que la glimepirida no lo hace.
Esquema 9.5
Una síntesis de la pirrolidona 9.15 se describe en el trabajo de Gurjar y colaboradores.3 La
secuencia sintética se indica en el esquema 9.6 y se inicia con la C-etilación del acetilacetato de etilo 9.31 mediante enolización con dimetilamina seguida de reacción con sulfato de dietilo. El producto de la reacción, compuesto 9.22, se transforma en la cianohidrina 9.23 por reacción con cianuro sódico en DMF. La hidrogenación a presión del nitrilo, en presencia del catalizador de Ni-Raney y anhídrido acético, conduce a la N-acetilpirrolidona 9.24 que por N-desacetilación proporciona la pirrolidona 9.15.
Esquema 9.6
7.3. Tiazolidindionas
Las tiazolidindionas incrementan la acción de la insulina con lo que producen disminución de los niveles de glucemia. Estos fármacos se unen a los receptores activados por proliferadores de peroxisomas PPARs (del inglés Peroxisome Proliferator-Activated Receptors) los cuales, después de su activación, migran al ADN y regulan la transcripción de genes específicos que controlan el metabolismo de los hidratos de carbono y de los ácidos grasos. Los PPARs se localizan en la mayoría de los tejidos, siendo el PPARa la forma más abundante en el hígado y el músculo esquelético, mientras que el PPARg se localiza principalmente en el tejido adiposo. Los ligandos naturales de los PPARs son los ácidos grasos poliinsaturados y algunos
eicosanoides, sin embargo, también son activados por compuestos como los fibratos y las tiazolidindionas.
En el grupo de las tiazolidindionas se incluyen la rosiglitazona y la pioglitazona. Estos fármacos pueden usarse solos o en combinación con otros medicamentos para la diabetes. Sus efectos secundarios son el aumento de peso, la retención de líquidos y el aumento del colesterol LDL.
Figura 9.8. Estructuras de la rosiglitazona y de la pioglitazona
7.3.1. Rosiglitazona
En el esquema 9.6 se indica una síntesis de la rosiglitazona tomada de la publicación de S. L. Gaonkar y H. Shimizu.4
Por un lado se sintetizó la tiazolidin-2,4-diona 9.24 por reacción del ácido cloroacético con la tiourea en agua bajo irradicación con microondas (esquema 9.6)
NH2 H2N
S O
OH
Cl + H2O
MW, 140ºC
S HN HN O
S HN
O O 9.25 9.26
9.27 9.28
Esquema 9.6
Por otro lado, la reacción SNAr de la 2-cloropiridina 9.29 con el 2-(N-metilamino)etanol 9.30, inducida mediante irradiación con microondas a 140ºC, proporcionó el piridinalcohol 9.31 (esquema 9.7). La reacción SNAr de este compuesto con 4-fluorobenzaldehído 9.32 se llevó a
cabo también bajo irradiación con microondas, en este caso a 85ºC y en una mezcla agua-etanol en presencia de KOH y de hidrogensulfato de tetrabutilamonio (TBAHS) como catalizador de transferencia de fase. La reacción proporcionó el compuesto 9.33 que se sometió a condensación de Knoevenagel con la tiazolidin-2,4-diona 9.28 bajo irradiación con microondas en tolueno, en presencia de piperidina, ácido acético y SiO2. La reacción condujo al compuesto 9.34 que se convirtió en rosiglitazona mediante reducción con Mg en MeOH.
Esquema 9.7
7.3.2. Pioglitazona
En el esquema 9.8 se indica una secuencia sintética para la pioglitazona que se inicia con la reacción SNAr del piridinalcohol 9.35 sobre el 4-fluorobenzonitrilo 9.36.5 El producto de esta
reacción, compuesto 9.37, por reducción de la función nitrilo en presencia del catalizador de Ni-Raney y de ácido fórmico se convirtió en el piridinbenzaldehído 9.38. La condensación de Knoevenagel con tiazolidin-2,4-diona 9.28, en presencia de piperidina, condujo al compuesto 9.39 que se transformó en la pioglitazona por hidrogenación del doble enlace.
Esquema 9.8
7.4. Meglitinidas
El modo de acción de las meglitinidas, también denominadas metiglinidas, es similar al de las sulfonilureas ya que actúan estimulando la secreción de insulina mediante inhibición de los canales de potasio dependientes de ATP de las células pancreáticas beta. Esto provoca la despolarización de las células beta y la apertura de los canales de calcio dependientes de voltaje. El aumento del calcio intracelular induce la fusión de los gránulos transportadores de insulina con la membrana celular lo que incrementa la secreción de insulina.
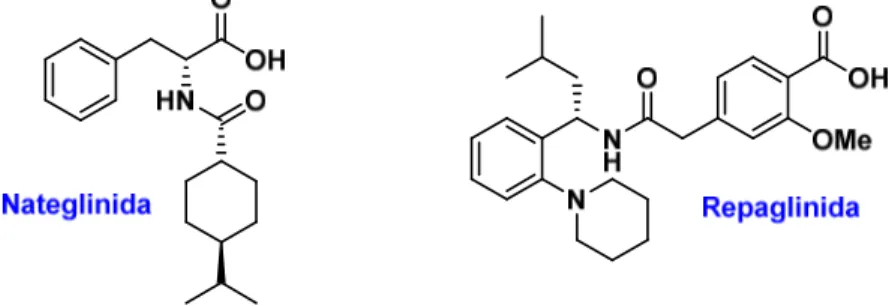
Las meglitinidas tienen un comienzo de acción rápido (30 minutos), y de corta duración, circunscrito al periodo postprandial (el que tiene lugar después de las comidas). En la figura 9.8 se indican las estructuras de las meglitinidas empleadas en el tratamiento de la diabetes mellitus tipo 2.
Figura 9.8. Estructuras de la nateglinida y de la repaglinida
7.4.1. Nateglinida
En el esquema 9.8 se describe una síntesis de la nateglinida tomada de la publicación de
B. Chandrasekhar y colaboradores.6 El compuesto de partida es el ácido 4-isopropilbenzoico 9.40 que por hidrogenación en presencia del catalizador de Adams proporciona el ácido 4-isopropilciclohexanocarboxílico 9.41 como mezcla de isómeros cis/trans.
Esquema 9.9
La esterificación de 9.41 con cloruro de tionilo en metanol conduce al 4-isopropilciclohexanocarboxilato de metilo 9.42 el cual se somete a isomerización mediante calentamiento con hidruro sódico. Este proceso enriquece la mezcla en el isómero trans obteniéndose una mezcla de trans-4-isopropilciclohexanocarboxilato de metilo 9.43 y cis-4-isopropilciclohexanocarboxilato de metilo 9.44 en proporción 6:1. La saponificación de la mezcla seguida de cristalización permite la obtención del ácido trans-4-isopropilbenzoico 9.45 puro. El acoplamiento peptídico se llevó a cabo del siguiente modo. Por un lado el ácido 9.45 se convirtió en el correspondiente anhidrido mixto mediante reacción con cloroformiato de etilo en presencia de trietilamina en una mezcla acetona/agua. Por otro lado, la D-fenilalanina se ionizó por reacción con trietilamina en una mezcla acetona/agua, a la que se le añadió luego morfolina. La mezcla que contenía el aminoácido ionizado se añadió sobre el anhidrido mixto, lo que proporcionó directamente la nateglinida.
7.4.2. Repaglinida
7.4.2.a. Análisis retrosintético
En el esquema 9.10 se indica un análisis retrosintético para la repaglinida que se inicia con la escisión del enlace amida. Esta operación genera el acidoéster 9.46 y la diamina 9.47. El diácido se obtendrá del 2-metoxi-4-metilbenzoato de metilo 9.48 y la diamina se sintetizará a parir del 2-clorobenzonitrilo 9.49.
Esquema 9.10
7.4.2.b. Síntesis
En el esquema 9.11 se indica la secuencia sintética que permite la conversión del 2-metoxi-4-metilbenzoato de metilo 9.50 en el ácido 4-(carboximetil)-2-metoxibenzoico 9.46 y que está tomada de la publicación de W. Grell y colaboradores.7 La secuencia se inició con la bromación
radicalaria de la posición bencílica. Este proceso condujo al 4-(bromometil)-2-metoxibenzoato de metilo 9.51. El desplazamiento SN2 del halógeno con cianuro proporcionó el
4-(cianometil)-2-metoxibenzoato de metilo 9.52. La metanolisis ácida de la función nitrilo condujo al acidoéster 9.46.
7 Grell, W.; Hurnaus, R.; Griss, G.;Sauter, R.; Rupprecht, E.;Mark, M.; Luger, P.; Nar, H.; Wittneben,
Esquema 9.11
En la publicación de W. Grell y colaboradores se pueden encontrar varios métodos para la preparación enantioselectiva de la (S)-3-metil-1-(2-(piperidin-1-il)fenil)butan-1-amina 9.47. Una de las secuencias sintéticas que permite la obtención de este compuesto se indica en el esquema 9.12. N NH2 Cl CN 9.47 9.53 HN + N CN N O 9.56 N N N N H
1) i-BuMgBr, reflujo tolueno/THF, 2) HCl ac., 0ºC
(S)-1-fenetilamina TiCl4/NEt3 tolueno, 0ºC H2/Raney-Ni
EtOH H2/Pd-C 10%
EtOH, HCl ac.
140ºC 9.54 9.55 9.57 9.58 N N H O OMe OH O Repaglinida OMe COOMe 9.46 HOOC 1)
CDI (o N,N-DCCD) 2) NaOH ac.
Esquema 9.12
El proceso se inició con la reacción SNAr del 2-clorobenzonitrilo 9.53 por reacción con la
inducido po carbonildiimidazol o por N,N-diciclohexilcarbodimida, seguido de hidrólisis básica de la función éster.
7.5. Inhibidores de la alfa-glucosidasa
Los inhibidores de la alfa-glucosidasa bloquean la acción de la enzima alfa-glucosidasa encargada de la hidrólisis de la sacarosa y del almidón, que es el polisacárido que se encuentra en el pan, las pastas y las patatas. La inhibición de esta enzima intestinal disminuye la absorción de carbohidratos desde el tracto digestivo, reduciendo así los picos en los niveles de glucosa después de las comidas. La acarbosa y el miglitol son los dos inhibidores de la alfa-glucosidasa que se recetan en la actualidad en el tratamiento de la diabetes. La acarbosa es un oligosacárido
de origen microbiano y el miglitol es un iminoazúcar.
Figura 9.9. Estructuras de la acarbosa y del miglitol
7.6. Inhibidores de la dipeptidil peptidasa-4
La enzima dipeptidil peptidasa-4 (DPP-4) es una serina-aminopeptidasa que se encarga de degradar las incretinas, hormonas producidas en el intestino tras la ingesta de alimentos.
Existen dos tipos de incretinas: el polipéptido inhibidor gástrico GIP (en inglés insulinotropic polypeptide) y el péptido similar al glucagón tipo 1 GLP-1 (en inglés glucagon like peptide 1).
El GIP es producido por las células K que se encuentran en el duodeno y la primera parte del yeyuno, mientras que el GLP-1 es sintetizado en las células L que se encuentran principalmente en el íleon y el colon.
El GLP-I es un péptido que contiene 29 aminoácidos y deriva del procesamiento post-translacional del proglucagon en el intestino delgado. Tanto el GIP como el GLP-1 son secretados en respuesta al consumo oral de alimentos, sobre todo los ricos en grasas e hidratos de carbono. Tras su liberación pasan a sangre y se unen a sus receptores específicos antes de ser metabolizados por la enzima dipeptidil peptidasa-4 (DPP-4).
El GLP-1 y el GIP aumentan la biosíntesis de la insulina y la secreción de ésta por las células beta pancreáticas. El GLP-1 también inhibe la secreción de glucagón y la producción de glucosa hepática.
Figura 9.10. Acción de los inhibidores de DPP-4
Las estructuras de algunos inhibidores de la DPP-4 empleados en el tratamiento de la diabetes se indican en la figura 9.11.
Figura 9.11. Estructuras de la linagliptina, sitagliptina y alogliptina
7.6.1. Linagliptina
La linagliptina es un inhibidor de la DPP-4 que se utiliza sola o en combinación con metformina y/o una sulfonilurea e insulina en el tratamiento de la diabetes mellitus tipo 2. La linagliptina se une eficazmente a la DPP-4 de forma reversible lo que resulta en una prolongación de los niveles de incretina activa, en un aumento de la secreción de insulina y en la disminución de la secreción de glucagón. La linagliptina se une selectivamente a la DPP-4 y muestra una selectividad in vitro 10.000 veces mayor frente a otras dipeptidil peptidasas como la DPP-8 o la DPP-9.
7.6.1.a. Análisis retrosintético
Esquema 9.13
7.6.1.b. Síntesis
En el esquema 9.14 se indica la reacción de obtención de la (clorometil)-4-metilquinazolina 9.61 por ciclocondensación entre la aminofenil metil cetona 9.63 y el 2-cloroacetonitrilo 9.64.8
Esquema 9.14
En el esquema 9.15 se indica la síntesis de la haloxantina 9.62 (X=Br) que se inició con la condensación de la metilurea 9.65 con el ácido cianoacético 9.66 mediante calentamiento en presencia de anhídrido acético.9 La reacción produjo la correspondiente cianoacetilurea 9.67 que
mediante tratamiento básico se convirtió en el 1-metil-6-aminouracilo 9.68. La nitrosación en C5 del anillo de pirimidina con nitrito sódico en ácido acético condujo al compuesto 9.69 que por reducción con ditionito de sodio dio el 1-metil-5,6-diaminouracilo 9.70. El calentamiento de este compuesto en presencia de ácido fórmico generó una amida que se cicló en medio básico para dar la xantina 9.71. La bromación del núcleo de xantina en C8 se consiguió mediante reacción con bromo molecular y acetato sódico en ácido acético y permitió la obtención de la bromoxantina 9.72. Por último, la N-alquilación con bromuro de propargilo en DMF en presencia de diisopropiletilamina condujo a la xantina funcionalizada 9.62.10
8 Huang, Y.; He, X.; Wu, T.; Zhang, F. Molecules 2016, 21, 1041-1051.
9 Lafleur,K.; Huang, D.; Zhou, T.; Caflisch, A.; Nevado, C. J. Med. Chem. 2009, 52, 6433–6446.
10 Eckhardt, M.; Langkopf, E.; Michael Mark, M.; Tadayyon, M.; et al. J. Med. Chem. 2007, 50, 6450–
O HN N N N Br Me O 9.62 O NH2 NH Me 9.65 + N O HO 9.66 O HN NH N Me O 9.67 90ºC 60ºC
Ac2O NaOH O
HN
N NH2
Me O 9.68 NaNO2
AcOH-H2O 25ºC
O HN
N NH2
NO Me O NH4OH, 50ºC
Na2S2O4
O HN
N NH2
NH2 Me O 1) HCOOH reflujo 2) NaOH reflujo O HN N N H N Me O
Br2, NaOAc AcOH, 65ºC O HN N N H N Br Me O
BrCH2C C DIPEA, DMF 9.69 9.70 9.71 9.72 CH3 Esquema 9.15
La (R)-3-aminopiperidina N-protegida 9.60 (grupo protector ftalimido) se sintetizó del modo que se indica en el esquema 9.16.11 La hidrogenación de la 3-aminopiridina 9.73 proporcionó la
3-aminopiperidina racémica 9.74 que se convirtió en la ftalimida racémica 9.75 por reacción con anhídrido ftálico. La resolución con ácido D-tartárico permitió la obtención de la ftalimida 9.60 de configuración R.
Esquema 9.16
Los pasos finales en la síntesis de la linagriptina se indican en el esquema 9.17. Así, la reacción SN2 entre la pirazina 9.61 y la xantina 9.62 se consiguió mediante reacción en
presencia de carbonato sódico en N-metil-2-pirrolidona (NMP) a 140ºC.7 Esta reacción
proporcionó el compuesto 9.76 que se sometió a reacción SNAr con la (R)-3-aminopiperidina
N-protegida 9.60 en NMP en presencia de diisopropanolamina a 140ºC. El proceso SNAr llevó al
compuesto 9.71 que se convirtió en linagriptina mediante reacción con etanolamina en una mezcla THF-H2O a 60ºC.
Esquema 9.17
7.6.1.c. Cuestiones
1) Proponga un mecanismo para la siguiente reacción:
7.6.2. Sitagliptina
La sitagliptina es un inhibidor de la DPP-4. Su acción inhibitoria provoca un aumento de las concentraciones plasmáticas de las formas activas de GLP-1 y GIP.
La sitagliptina está indicada en asociación con metoformina en aquellos pacientes con diabetes mellitus tipo 2 en los que la monoterapia con metformina, junto a la dieta y el ejercicio, no consiga un control glucémico adecuado. También se receta en combinación con una sulfonilurea cuando no se logra el control glucémico y/o cuando la metformina no es adecuada debido a contraindicaciones o intolerancia.
7.6.2.a. Análisis retrosintético
Esquema 9.18
7.6.2.b. Síntesis
En el esquema 9.19 se indica la síntesis del aminoácido 9.71. El compuesto de partida es la 3,4-difluoroanilina 9.82 que se convitió en el 1,2,4-trifluorobenceno 9.83 mediante pirolisis de la sal de diazonio 9.84.12
NH2 F F 9.82 N2 F F F F F F F F O Cl 9.83 9.84 9.85
o-difluorobenceno PCl5 80ºC, 1h F F F Cl Cl Cl KOH tolueno/etanol 80ºC F F F OH O 185ºC
BF3·Et2O
t-BuONO
O Cl Cl
AlCl3, 70ºC
9.86 9.87 ClCOCOCl DMF F F F Cl O 9.88 TMSO O O OTMS BF4
BuLi, THF, -60ºC luego HCl HN O OH F F F O O OH F F F 9.78 9.89 O O OMe F F F SOCl2 MeOH
(S)-BinapRuCl2, HBr
H290 psi, MeOH, 80ºC
OH O OMe F
F F MeOH, H2O
NaOH OH O OH F F F 9.81 9.80 9.90 BnONH2·HCl, EDCI
HOBt, THF OH O NHOBn F F F 9.91 N O F F F BnO PPh3
DIAD LiOH, H2O THF, MeOH 9.92
OBn
Esquema 9.19
Para la introducción de la cadena lateral se procedió del siguiente modo. En primer lugar se llevó a cabo una acilación Fiedel-Crafts del 1,2,4-trifluorobenceno 9.84 por reacción con el cloruro del ácido 2-cloroacético. Esta reacción condujo a la trifluoroaril clorometil cetona 9.85 la cual, por tratamiento con pentacloruro de fósforo, se transformó en el tricloroderivado 9.86. Cuando este compuesto se calentó con hidróxido de potasio en una mezcla tolueno/etanol se obtuvo el ácido 2-(2,4,5-trifluorofenil)acético 9.87.13 Este ácido se convirtió en el
correspondiente cloruro de ácido 9.88 el cual se trató con el enolato lítico generado por reacción del bis-trimetilsilileseter del ácido malónico con butil-litio. El producto de la reacción se convirtió en el ácido 3-oxo-4-(2,4,5-trifluorofenil)butanoico 9.78 mediante hidrolisis de los sililésteres y descarboxilación in situ.14
La esterificación de 9.89 fue seguida de la hidrogenación asimétrica del carbonilo cetónico en presencia de (S)-BinapRuCl2 y condujo al β-hidroxiéster9.90.15 Después de la saponificación
de la función éster, el ácido resultante 9.80 se convirtió en la N-benciloxiamida 9.91 mediante reacción de acoplamiento peptídico con EDCI y 1-hidroxibenzotriazol. El tratamiento de 9.91 con trifenilfosfina y azodicarboxilato de diisopropilo provocó la reacción de Mitsunobu intramolecular y condujo a la oxazetidina 9.92 la cual, por reacción con hidróxido de litio, proporcionó el N-benciloxiaminoácido 9.93.15
En el esquema 9.20 se indica la síntesis de la triazolopiperazina 9.79. El compuesto de partida es la cloropirazina 9.93. La reacción SNAr con hidracina proporciona el compuesto 9.94
que por acilación con anhídrido trifluoroacético condujo a la bis-trifluorohidrazida 9.95. El calentamiento de este compuesto con ácido polifosfórico (PPA) provocó la reacción de ciclación y llevó a la triazolopiracina 9.96. Finalmente, la hidrogenación de 9.96 en presencia de Pd sobre carbón proporcionó la triazolopiperacina 9.79.15
Esquema 9.20
Los últimos pasos en la síntesis de la sitagliptina se indican en el esquema 9.21. Este compuesto se obtuvo por acoplamiento de tipo peptídico entre el ácido 9.78 y la triazolopiperacina 9.79 seguido de hidrogenolis de la parte de benciloxiamina con Pd/C.15
13Tartaggia, S.; Caporale, A.; De Lucchi, O. Patente: US2014/58126 A1, 2014
14 Zhu, Y.; Xia, S.; Zhu, M.; Yi, W.; Cheng, J.; Song, G.; Li, Z.; Lu, P. Eur. J. Med. Chem. 2010, 45,
4953-4962
NH2 O
N N
N N F
F F
CF3
Sitagliptina
HN O OH F
F F
HN N
N N CF3 +
9.78 9.79 OBn
EDCI, NMM
CH3CN HN O N
N N
N F
F F
CF3
H2, Pd/C
9.97 OBn
Esquema 9.20
7.6.2.c. Cuestiones
1) Explique mecanísticamente la siguiente reacción:
2) Explique mecanísticamente la siguiente reacción:
7.6.3. Alogliptina
La alogliptina es un potente inhibidor altamente selectivo de la DPP-4 ya que es más de 10.000 veces más selectiva para DPP-4 que para otras enzimas como DPP-8 y DPP-9.
La alogliptina mejora el control glucémico mediante el increcmento de la liberación de insulina y la disminución de los niveles de glucagón.
7.6.3.a. Análisis retrosintético
pirimidona se sintetizará mediante reacción de cicloadicion entre la urea 9.100 y el malonato 9.101. La urea se obtendrá del 2-(aminometil)benzonitrilo 9.102.
O N
N O
Alogliptina
N NH2 CN O N N O X CN HN NHP IGF O N N O OH CN O NH NH CN O O RO RO NH2 CN 9.98 9.60 9.99 9.100 9.101 9.102 Esquema 9.21 7.6.3.b. Síntesis
El 2-(aminometil)benzonitrilo 9.102 se obtiene a partir del 2-(bromometil)benzonitrilo 9.103 mediante conversión en el 2-(azidometil)benzonitrilo 9.103 seguida de hidrogenación quimioselectiva de la función azida (véase el esquema 9.22).16
O N
N O
Alogliptina P=H N NHP CN O N N O Cl CN HN NHBoc O N N O OH CN O NH NH CN NH2 CN 9.98 9.105 9.99 9.100 9.102 Br CN 9.103 N3 CN
CH3N=C=O Et3N, CH2Cl2 NaN3 H2, Pd/C
9.104 EtO O O OEt 9.101 NaOEt, EtOH
K2CO3, DMF
POCl3 acetona MeOH 9.106 P=Boc PhCOOH EtOH Esquema 9.22
La reacción de 9.102 con el isocianato de metilo proporciona la urea 9.100. Cuando este compuesto se calienta a refujo de etanol en presencia de malonato de dietilo y etóxido sódico se obtiene la hidroxipirimidindiona 9.99. La cloropirimidindiona 9.98 se preparó mediante reacción de la hidroxipirimidindiona 9.99 con oxicloruro de fósforo. Cuando 9.98 se calentó a 75ºC en DMF en presencia de la (R)-3-aminopiperidina N-Boc protegida 9.105 se provocó el desplazamiento nucleofílico del cloro, mediante un proceso Michael-retroMichael, con la
16 (a) Rittle, K. E.; Barrow, J. C.; Cutrona, K. J.; Glass, K. L.; et al. Bioorg. Med. Chem. Lett. 2003, 13,
correspondiente obtención del compuesto 9.106. La N-Boc desprotección con ácido trifluoroacético proporcionó la aligliptina en forma de sal de trifluoroacetato.17
7.6.3.c. Cuestiones
1) Explique mecanísticamente la siguiente conversión:
O N
N O
Cl CN O
N N O
OH CN 9.99
POCl3
9.98