INSTITUTO NACIONAL DE SALUD PÚBLICA
CENTRO DE INVESTIGACIONES SOBRE
ENFERMEDADES INFECCIOSAS
TESIS TITULADA:
“Factores de riesgo asociados al comportamiento de anticuerpos contra
las proteínas E4 y E7 del Virus del Papiloma Humano tipo 16, en parejas
heterosexuales”
Que presenta:
Tanya Plett Torres
Para obtener el grado de
Doctora en Ciencias de la Salud con área de concentración en
Enfermedades Infecciosas
JURADO DE EXAMEN DE GRADO:
Presidente: Dr. Vianney Ortíz Navarrete
Secretaria: Dra. Ma de Lourdes Gutiérrez Xicotencatl
Primer sinodal: Dr. Bernardo Hernández Prado
Segundo sinodal: Dr. Luis Padilla Noriega
Tercer sinodal: Dra. Berenice Illades Aguiar
Sitio donde se desarrolló la tesis y apoyo financiero:
DEDICATORIA
A Valentina, mi regalito de Dios. A León, el amor de mi vida. A mi madre, el ejemplo a seguir. A mi padre, nuestro ángel de la guarda.
Alguna vez me entretuve con un sueño. Me tomó, lo solté y le di mil vueltas. Lo aprendí, me lo puse,
fui su dueño. Y pensé que era cosa resuelta. Y soñé que soñaba que era mi traje. Y así fue por la tierra, por los mares, por los cielos, las noches y los días. Y así fui con mi sueño que sabía y
comenzó a soñar que me soñaba.
AGRADECIMIENTOS
Agradezco a la Dra. Lourdes Gutiérrez Xicotencatl por su amable dirección en este trabajo, por el tiempo que tomó diariamente en su supervisión y en la discusión sobre el tema.
Agradezco al Dr. Aurelio Cruz Valdez, Dr. Eduardo Lazcano Ponce y al Dr. Alberto Monroy García su asesoría y el tiempo que tomaron en resolver mis interminables dudas.
Agradezco a los miembros del jurado por su amable atención y por sus acertados comentarios.
Agradezco al M. en C. Adolfo Pedroza Saaverdra, Biól. Minerva Maldonado Gama y Biól. Ana González por su invaluable apoyo técnico y moral en el desarrollo de este trabajo.
ÍNDICE
I. Resumen 1
II. Marco teórico 2
1. Características generales del virus 2
2. Aspectos clínicos y patológicos de las infecciones por HPV 8
3. Importancia en salud pública de la infección por el HPV 10
4. Respuesta inmune contra el virus 15
III. Justificación 20
IV. Hipótesis 20
V. Objetivo general 20
VI. Objetivos particulares 20
VII. Metodología 22
1. Selección de la población 22
2. Tipificación del HPV en las muestras biológicas 23
3. Detección de anticuerpos séricos contra las proteínas E4 y E7 del HPV16 24
4. Manejo de la información 29
5. Análisis estadístico de los resultados 30
6. Limitaciones del estudio 30
VIII. Resultados 31
1. Clonación del gen que codifica para las proteínas E4 y E7 del HPV16 31 2. Expresión in vitro y purificación de las proteínas E4 y E7 del HPV16 33
3. Estandarización del sistema Slot Blot 34
4. Medición basal en mujeres 36
5. Seguimiento de mujeres 60
6. Análisis basal de los hombres 87
7. Seguimiento de hombres 116
IX. Discusión 144
X. Conclusiones 164
XI. Bibliografía 166
1
I.
RESUMEN
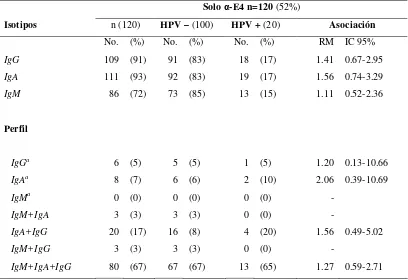
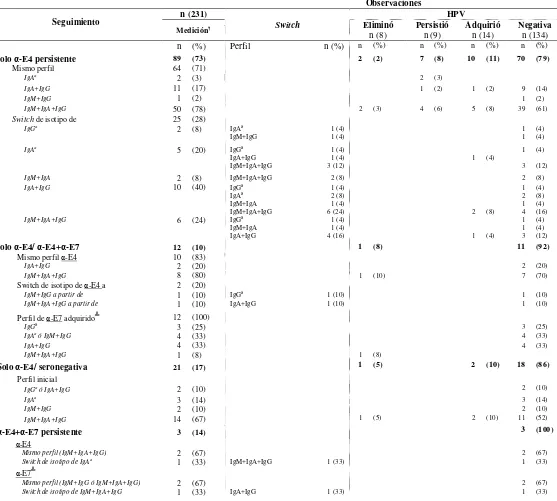
El Cáncer cervico-uterino (CC) es una de las primeras causas de muerte en mujeres en edad productiva en nuestro país. Por desgracia, el diagnóstico de la enfermedad se lleva a cabo con técnicas que detectan estadios avanzados de la misma. Por esta razón, el desarrollo de procedimientos para la detección temprana es una herramienta eficiente para reducir el número de muertes por esta enfermedad. La causa necesaria para el desarrollo del CC es la infección persistente por tipos oncogénicos del HPV. De esta forma, el diagnóstico se ha enfocado a la detección de la infección y a la descripción de la historia natural de la misma en hombres y mujeres. Por otra parte, se ha propuesto la detección de anticuerpos como una alternativa para elucidar el curso de la infección y el diagnóstico temprano de la enfermedad. En este sentido, la detección de anticuerpos contra las proteínas tempranas del virus ha llevado a proponer marcadores de lesiones tempranas (anti-E4) y de cáncer (anti-E7), así como de replicación viral activa en genitales masculinos (anti-E4).
En este estudio nos avocamos a diseñar, estandarizar y utilizar el sistema Slot Blot para la detección y descripción de la respuesta sistémica de anticuerpos contra las proteínas E4 y E7 del HPV16 en hombres y mujeres pareja sexual. Contrario al ELISA simple utilizado en estudios previos, el Slot Blot fue más sensible y permitió la detección de ambos marcadores en el mismo sujeto. Los anticuerpos y la infección fueron más frecuentes en los jóvenes, relacionándose los anticuerpos al tiempo de actividad sexual, parejas sexuales recientes, tipo de parejas sexuales, fumar, a la falta de aseo y a la circuncisión. La frecuencia de anti-E4 fue mayor que la de anti-E7 con el paso del tiempo y en ausencia de la infección, siendo los perfiles de isotipos IgM+IgA+IgG e IgA+IgG los más frecuentes para anti-E4 e IgA y/o IgG para anti-E7, anticuerpo que prácticamente siempre se detectó junto con anti-E4. Los hombres presentaron una mayor frecuencia de generación y persistencia de anticuerpos y más diversa respuesta de perfiles anti-E7 y/o anti-E7, resultados que coinciden con la mayor frecuencia de infecciones más transitorias que las mujeres. En ellas, los perfiles de isotipos encontrados sugieren que la infección por tipos de bajo riesgo es más transitoria que la de los oncogénicos, mientras que en los hombres, ambos grupos virales presentan infecciones con curso similar. La persistencia viral no mostró la presencia de anti-E7 ni de respuesta primaria, sugiriendo etapas prolongadas de replicación activa. Todas las mujeres infectadas y que presentaron con lesiones de bajo grado fueron positivas a tipos virales de bajo riesgo y al perfil IgA+IgG anti-E4, sugiriendo que este perfil se encuentra frecuentemente en este tipo de lesiones. De tal forma, la detección de anti-E7 sugiere la eliminación de infecciones recientes ó etapas iniciales en aquellas en curso donde comienza la expresión de E4, y por el contrario, la detección exclusivamente de anti-E4 sugiere exposición al HPV ó infecciones en etapa de replicación viral abundante.
2
II.
MARCO TEÓRICO
1. Características generales del virus
El Virus del Papiloma Humano (HPV; siglas del Inglés Human Papillomavirus), pertenece a la familia
Papillomaviridae (de Villiers, et al., 2004; Bernard, 2005) que genera viriones con forma icosahédrica, no envueltos, que miden aproximadamente 55 nm formados por las proteínas de cápside y el genoma viral (zur Hausen, 2000). Estos virus poseen un genoma de DNA circular de doble cadena de 7 a 8 Kb conformado por marcos abiertos de lectura de expresión temprana (E) y tardía (L) que dan lugar a 2 proteínas virales estructurales (L1 y L2) y de 6 a 8 productos de genes tempranos (E1 a E8) (Fig. 1). Las regiones E y L se encuentran separadas por una región de 400 a 1000 pb denominada región larga de control de expresión (LCR; del Inglés Long Control Region) que es poco conservada entre los miembros de la familia Papillomaviridae y que contiene regiones de acción cis necesarias para promover (P97) y aumentar la expresión viral (Syrjänen & Syrjänen, 1999; de Villiers, et al., 2004). La transcripción de los genes virales del HPV se lleva a cabo en una sola dirección (hebra positiva), dando lugar a una gran variedad de mRNAs por los múltiples patrones de
splicing, generando que algunas de estas moléculas sean traducidas como proteínas de fusión y otras como policistrónicas (Collier & Oxford, 2000).
3 a) Replicación viral
La infección por HPV puede ser productiva cuando es activa ó persistente, ó puede ser latente cuando el virus carece de replicación (zur Hausen, 2000). Los miembros de la familia Papillomaviridae pueden unirse a una gran variedad de células, sin embargo, la producción de viriones solo se logra en el laboratorio en cultivos de queratinocitos epiteliales ó fibroblastos (Müller, et al., 1995; Volpers, et al., 1995). En el tejido cervical, las células de la capa basal del epitelio (indiferenciadas) son en las que se establece la infección y se piensa que el virus llega a esta capa por una ruptura del tejido (Doorbar, 2005). Las proteínas de la cápside interaccionan con la superficie de las células para la entrada del HPV (Unckell, et al., 1997; Kawana, et al., 2001), siendo esta interacción con moléculas muy comunes en todos los tejidos, tales como los glicosa-aminoglicanos de sulfato de heparán (Joyce, et al., 1999). Una vez que ha penetrado la célula por vesículas cubiertas de clatrina ó caveolas (Bousarghin, et al., 2003), el HPV pierde la cápside y comienza la transcripción a bajo nivel de los genes E6 y E7 debido a factores propios de las células basales que interactúan con el promotor P97 en el LCR (Middleton, et al, 2003). Además de los factores celulares, en este sitio existen enhancers específicos de células epiteliales y de queratinocitos, cajas TATA para la unión de factores de transcripción celulares como TFIID, secuencias Sp-1 y AP-1 y elementos de respuesta a glucocorticoides y progesterona (Butz & Hoppe-Seyler, 1993; Tan, et al., 1994; Conger, et al., 1999; Lewis, et al., 1999; Middleton, et al., 2003; Longworth & Laimins, 2004; Doorbar, 2005). La expresión de E6, una proteína nuclear básica de aproximadamente 150 aminoácidos, lleva a la proteólisis por ubiquitinación de la proteína celular p53 (encargada de mantener la integridad del DNA celular) (Münger, et al., 1992; Farthing & Vousden, 1994; Rapp & Chen, 1998; Hangstermann, et al., 2001). Al mismo tiempo, E7, una fosfoproteína nuclear ácida de aproximadamente 98 aminoácidos, se asocia con p105 Rb (proteína de Retinoblastoma) hipofosforilada promoviendo la liberación de E2F, factor de transcripción temprana que promueve la fase S del ciclo celular además de generar transformación celular (Kanda, et al., 1988; Münger, et al., 1992).
4 liberación de p53 y pRB hipofosforilada para continuar con la diferenciación celular, la expresión de otros factores de transcripción y tRNAs que favorecen el progreso del ciclo celular (Steger & Corbach, 1997; Tindle, et al., 2002). Por otra parte, este proceso presenta una autoregulación de la expresión de E1 y E2: E2 modula la expresión de E1 y el splicing del mRNA de E6, regulando diferencialmente la expresión de ambas proteínas virales (Hubert & Laimins, 2002).
La proteína E4 se encuentra principalmente en el citoplasma de células infectadas con replicación activa y cierto grado de diferenciación (Pray & Laimins, 1995; Doorbar, et al., 1997; Middleton, et al., 2003). Esta proteína es traducida de un transcrito E1^E4 para formar una proteína de fusión que contiene los primeros 5 aminoácidos de E1 y prácticamente todo el ORF de E4. En verrugas, la proteína existe como especies de múltiples pesos moleculares que se forman por combinación de la proteólisis progresiva del extremo N-terminal, la oligomerización y la fosforilación. Las especies que resultan de la proteólisis son las de 17 kDa en las células parabasales de manera coincidente con el inicio de la replicación viral, y las de 16, 10 y 11 kDa que se acumulan progresivamente hasta ser las más abundantes en los queratinocitos superficiales, células donde existe una abundante expresión de las proteínas de cápside y ensamblaje de partículas virales (Doorbar, et al., 1988; Middleton, et al., 2003; Knight, et al., 2004). En el tejido cervical de lesiones de bajo grado, la expresión de E4 coincide con la replicación viral, mientras que en lesiones de alto grado la proteína se expresa solamente en la capa superficial del epitelio o es prácticamente ausente (Fig. 2) (Crum, et al., 1990; Palefsky, et al., 1991; Doorbar, et al., 1997; Middleton, et al., 2003). Aún se desconoce el efecto patogénico de la proteína E4, sin embargo, se sabe que esta proteína forma parte del 20% al 30% de las proteínas de verrugas, es ácida, se fosforila, se expresa antes de L1 y se une a Zinc, citoesqueleto y citoqueratinas (Gaillard, et al., 1992; Roberts, et al., 1994a; 1994b; Pray & Laimins, 1995; Doorbar, et al., 1997; Wang, et al., 2004). La unión al citoesqueleto ha llevado a sugerir que E4 puede alterar el proceso normal de queratinización para promover el ciclo viral y generar el colapso del citoesqueleto y favorecer la salida de las partículas virales (Gaillard, et al., 1992). Por otra parte, se ha observado que las especies de E4 de 16 kDa generan paro celular en G2, promueven la replicación del genoma celular y morfología nuclear aberrante, sugiriendo que permiten mantener la amplificación eficiente del genoma viral en queratinocitos en diferenciación (Knight, et al., 2004). De igual manera, la presencia del gen de E4 parece importante para la regulación de la expresión de las proteínas tempranas (E1^E2, E1, E4 y E5), la amplificación del DNA viral y la inhibición de la expresión prematura de L1 y L2 (Rush, et al., 2005; Wilson, et al., 2005). Otra proteína que se piensa que se expresa al mismo tiempo que E4 es E5, una proteína hidrofóbica de 80 aminoácidos que se sugiere es necesaria para mantener el estímulo de proliferación celular dado por la cascada de señalización del EGFR y la baja degradación del receptor por la inhibición de la ATPasa H+ endosomal (DiMaio, 1994; Syrjänen & Syrjänen, 1999). De esta forma, E5 parece complementar las funciones de E6 y E7 (McMurray, et al., 2001)
5 promotor en la región tardía para dar lugar a viriones maduros que son liberados a la capa externa del epitelio escamoso por muerte celular (zur Hausen, 1991; Syrjänen & Syrjänen, 1999; Collier & Oxford, 2000). Estas proteínas se polimerizan de manera espontánea previa unión del DNA del HPV al extremo N-terminal de la secuencia de L2 (Hagensee, et al 1993; Zhou, et al., 1994; Fligge, et al., 2001). Asimismo, la viabilidad viral se asegura con la maduración de la cápside gracias a la formación de puentes disulfuro intermoleculares entre los capsómeros adyacentes de L1, especialmente cuando el DNA se ha empacado (Buck, et al., 2005). De esta forma, la estabilidad de los viriones lleva a su liberación a la superficie externa del epitelio escamoso por muerte celular (zur Hausen, 1991; Syrjänen & Syrjänen, 1999). La unión de las proteínas del HPV a diversas proteínas celulares se resume en la Tabla I.
Tabla I. Funciones de los productos génicos del HPV.
Proteínas virales Funciones Unión a productos celulares
Tempranas
E1 Replicación del DNA viral y
mantenimiento episomal Desconocida
E2 Transcripción viral y replicación,
transformación Proteína A, factor C, PCNA, factor IIA
E4 Se desconoce hasta el momento Citoqueratinas
E5 Proteína transformante, inhibición de
la degradación de EGFR EGFR, ATPasa de H
+, PDGF, p125
E6 Proteína transformante E6-AP, E6-BP, p53
E7 Proteína transformante p105RB, p107, p130, p300, AP-1,
TBP, p33cdk2, ciclina A Tardías
L1 y L2 Principales proteínas de cápside Glicosa-aminoglicanos
*PCNA: Antígeno nuclear de proliferación celular; EGFR: Receptor del factor de crecimiento epidermal; PDGF: Factor de crecimiento derivado de plaquetas; E6-AP: Ligasa de la proteína ubiquitina, TBP: Proteína de unión a cajas TATA; AP-1: Familia de factores de transcripción como c-Jun y c-Fos; E6-BP: Proteína de probable unión a calcio (Huibregtse, et al.,1991; Münger, et al.,1992; DiMaio, et al.,1994; Chen, et al.,1995; Syrjänen & Syrjänen, 1999; Joyce, et al., 1999; zur Hausen, 2000).
6 cervicales de alto grado y en todo el epitelio en cáncer cervical, tumores donde ya no existe la expresión de E4 y de proteínas de cápside (Fig. 2). Estos hallazgos muestran que la integración del DNA viral al genoma celular representa un evento importante en la carcinogénesis cervical ya que, por la sobre-expresión de E6 y E7, se origina la inmortalización celular (Band, et al., 1990; Münger, et al.,1992; Jeon & Lambert, 1995; zur Hausen, 2000), bloqueo de la diferenciación celular, displasia y células anérgicas al TNF-α (siglas en Inglés; Tumour
Necrosis Factor) y TGF-β (siglas del Inglés; Transforming Growth Factor) (Syrjänen & Syrjänen, 1999: zur Hausen, 2000). Además de aumentar la estabilidad del transcrito de E6 y E7 (Jeon & Lambert, 1995), la integración puede causar re-arreglos cromosomales. Esta integración ocurre de manera aleatoria, siendo los sitios más comunes los puntos de translocación ó de expresión de oncogenes. En células provenientes de cáncer cervical invasor, la integración del genoma viral se ha encontrado frecuentemente en regiones con el gen myc, en secuencias rearregladas o amplificadas de c-myc ó en tumores con la proteína c-myc sobre-expresada (Ocadiz, et al., 1987; Koopman, et al., 1999; Sastre-Garau, et al., 2000). Todos estos mecanismos oncogénicos del HPV, han llevado a que los tipos de alto riesgo como HPV16 y HPV18 sean declarados por la IARC (siglas en Inglés;
International Agency for Research on Cancer) como carcinógenos humanos (Syrjänen & Syrjänen, 1999).
b) Tipos de HPV
7 Fig. 2. Expresión secuencial de las proteínas del HPV en el cérvix. A) Epitelio cervical normal. Se piensa que el virus llega a la capa basal por una ruptura del tejido donde comienza la baja expresión de E7. Conforme la célula migra y se diferencia, comienza la expresión de E1, E2, E4, la replicación viral y se reprime E7. La expresión de E4 se detecta justo antes de L1 y ambas proteínas se encuentran hasta las capas superiores del epitelio cervical. B) Expresión de las proteínas virales en lesiones cervicales de bajo grado (LSIL) y de alto grado (HSIL). La expresión de E7 se observa hasta 1/3 del epitelio cervical en LSIL, observándose la expresión de la proteína E4, la replicación del DNA viral y las proteínas de cápside en capas más superficiales del epitelio. Conforme avanza el grado de la lesión, la expresión de la proteína E7 se desplaza a capas más superficiales del epitelio hasta llegar al punto donde esta proteína se expresa en todo el tejido debido a la integración del genoma viral y ausencia de E2. En este caso, la expresión de E4 y la replicación del genoma viral disminuye hasta ser prácticamente nula (infección abortiva) (esquema modificado de Middleton, et al., 2003).
8 intraepiteliales cervicales de alto grado que el prototipo (6%) (Zhebe, et al., 1998) por lo que se han asociado al desarrollo de la enfermedad (Xi, et al., 2002). Estas variantes han presentado diferencias con el prototipo en cuanto a una mayor eficiencia de la proteína E6 para degradar p53 (Stöppler et al., 1996), una mayor actividad de P97 (Veress et al., 1999; Kämmer, et al., 2000) y de generar focos de transformación debido a re-arreglos en el LCR (Tornesello, et al., 2000). Asimismo, además de su relación con el CC, existe asociación de la presencia de variantes de E6 del HPV16 con la supervivencia a la enfermedad, el HLA y el polimorfismo de p53 (Brady, et al., 1999).
2. Aspectos clínicos y patológicos de las infecciones por HPV
La palabra Papillomaviridae, incluye a la raíz Griega –oma que significa tumor (Collier & Oxford, 2000) y hace referencia a las lesiones que llegan a causar enfermedad en piel y mucosas por medio de verrugas que pueden ser malignas o benignas dependiendo del tipo de HPV que las causa (Tabla III).
a) Lesiones benignas
-Verrugas cutáneas: el virus es transmitido por piel infectada ya sea por contacto directo y entra al nuevo hospedero por abrasiones cutáneas formando lesiones verrugosas en cualquier parte de la piel (Collier & Oxford, 2000).
-Verrugas genitales: Estas verrugas son adquiridas por contacto sexual, aparecen de 1 a 8 meses después de la infección y generalmente ocurren en asociación con otras infecciones como gonorrea y clamidiosis. Estas lesiones son llamadas condilomas acuminados y comúnmente se encuentran alrededor del glande y prepucio, en el meato de la uretra, la uretra, el ano, recto, perineo, vulva y ocasionalmente en vagina y cérvix (de Villiers, 1989; Wikström, et al., 1995; Collier & Oxford, 2000).
b) Lesiones malignas
9 Tabla II. Características de las diversas especies de HPV de acuerdo al género en el que son agrupadas.
Familia: Papillomaviridae
Género Especie Tipo Sito preferente de infección Propiedades
Alpha-papillomavirus 1 HPV32, 42 Mucosa Bajo riesgo, lesiones benignas, oral ó genital 2 HPV10, 3, 28, 29, 78, 94 Cutáneos Bajo riesgo, E5 biológicamente diferente 3 HPV61, 72, 81, 83, 84 Mucosa Bajo riesgo
4 HPV2, 27, 57 Cutáneos Verrugas, benigno, E5 biológicamente diferente 5 HPV26, 51, 69, 82 Mucosa Oncogénicos, lesiones benignas 6 HPV53, 30, 56, 66 Mucosa Oncogénicos; lesiones benignas 7 HPV18, 39, 45, 59, 68, 70 Mucosa Oncogénicos
8 HPV7, 40, 43 Mucosa ó cutáneos Verrugas
9 HPV16, 31, 33, 35, 52, 58, 67 Mucosa Oncogénicos, lesiones malignas
10 HPV6, 11, 13, 44, 74 Mucosa Bajo riesgo, lesiones benignas. HPV-6 en carcinoma verrugoso
11 HPV34, 73 Mucosa Oncogénicos
12 RhPV 1 Mucosa Lesiones genitales en monos Rhesus
13 HPV54 Mucosa Bajo riesgo
14 candHPV90 Mucosa Bajo riesgo
15 HPV71 Mucosa Bajo riesgo
Beta-papillomavirus 1 HPV5, 8, 12, 14, 19, 20, 21, 25, 36, 47, 93 Cutáneos Epidermodisplasia verruciformisó en sujetos inmunosuprimidos. Benignas o malignas
2 HPV9, 15, 17, 22, 23, 37, 38, 80 Cutáneos
Epidermodisplasia verruciformis
ó en sujetos inmunosuprimidos. Benignas o malignas
3 HPV49, 75, 76 Cutáneos Lesiones benignas
4 HPVcand92 Cutáneos Pre- and lesiones malignas
5 HPVcand96 Cutáneos Lesiones pre- ó malignas
Gamma-papillomavirus 1 HPV4, 65, 95 Cutáneos Cuerpos de inclusión intracitoplásmicos
2 HPV8 Cutáneos -
3 HPV50 Cutáneos -
4 HPV60 Cutáneos -
5 HPV88 Cutáneos -
Mu-papillomavirus 1,2 HPV1, 63 Cutáneos Cuerpos de inclusión intracitoplásmicos Nu-papillomavirus 1 HPV41 Cutáneos Sitios de unión de E2 modificados
Los géneros Delta, Epsilon, Zeta, Eta, Theta, Iota, Kappa, Lambda, Xi, Omikron y Pi no se incluyen en esta tabla ya que son aislados de especies no humanas (modificada de de Villiers, 2004).
10 una lesión de alto grado muestra células anormales en todas las capas del epitelio. Las consideraciones anteriores, han llevado a clasificar a las lesiones escamosas intraepiteliales (SIL; siglas en Inglés Squamous
Intraepitelial Lesions) como de bajo grado (LSIL; siglas en Inglés Low-grade Squamous Intraepithelial
Lesions), a las lesiones premalignas que solo involucran menos de la mitad del epitelio como de grado 1, a las que involucran hasta el segundo tercio del epitelio como de grado 2 y a la diplasia severa ó carcinoma (HSIL; siglas en Inglés High-grade Squamous Intraepithelial Lesions) dada por un epitelio sin diferenciar, como grado 3. Asimismo, las lesiones se nombran de acuerdo al sitio donde se encuentran, por ejemplo, si la lesión se localiza en cérvix, se nombra Neoplasia Intraepitelial de Cérvix (NIC) 1, 2 ó 3, dependiendo del grado de la displasia (Benda, 1994).
Tabla III. Genotipos de HPV que se encuentran principalmente en lesiones benignas y malignas.
Tipo de la lesión Sitio Tipos de HPV
Predominantemente benignas
Verrugas comunes Piel corporal 2 , 4
Verrugas plantares y en palmas Manos y pies 1 , 2 , 4
“Verrugas del carnicero” Manos 7
Verrugas planas Piel corporal 3
Verrugas genitales (condilomas acuminados) Cérvix, vulva, pene 6, 11, 42, 44, 51, 83 Papiloma laríngeo juvenil Laringe 6, 11
Lesiones potencialmente malignas o malignas
Verrugas planas Piel 10
Papulosis “arqueada” Vulva y pene 16
Neoplasia intraepitelial premaligna o maligna Cérvix, pene
6, 11, 16, 18, 26, 30, 31, 34, 35, 39, 40, 42, 43, 45, 51, 52, 56, 57, 58, 59, 61, 62, 64, 67-71, 74, 81, 82
Carcinoma Cérvix, pene 6, 11, 52, 54, 56, 58, 55, 58, 69 16, 18, 31, 33, 35, 39, 45, 51,
Papiloma/ carcinoma Laringe 16
Epidermodisplasia verruciforme Piel corporal 5, 8, 9, 10, 12, 14, 15, 17, 19-29
* Tipos de HPV fuertemente asociados a cáncer en negritas (Orth, et al., 1978, de Villiers, 1989; Berhout, et al., 1995; Collier & Oxford, 2000; zur Hausen, 2000; Bernard, 2005).
3. Importancia de la infección por el HPV en salud pública.
a) Infección por HPV en mujeres y cáncer ano-genital
11 sido de aproximadamente 3 500 casos nuevos anualmente en mujeres de edad promedio de 48 años (Lazcano, et al., 1996).
La asociación de este padecimiento con la infección por HPV fue propuesta entre 1974 y 1976 y fue hasta 1983 y 1984 que se aislaron los HPV16 y HPV18 en este tipo de lesiones. Desde entonces, se ha estimado que más del 50% de la población mundial sexualmente activa ha estado infectada por uno o más tipos de HPV en algún momento de su vida (Baseman & Koutsky, 2005). Asimismo, se ha observado que el DNA viral se encuentra en el 99% de los tumores y la mayoría de éstos, poseen DNA viral integrado al genoma celular (zur Hausen, 2000) por lo que se considera su infección como un factor necesario para el desarrollo de la enfermedad (Walboomers, et al., 1999; Bosch, et al., 2002).
La prevalencia de HPV en mujeres sanas es alrededor del 15% (Lazcano-Ponce, et al., 2001a; Kjaer, et al., 2002; Baseman & Koutsky, 2005) siendo el HPV16 (14%) y tipos de la misma especie (HPV33, 52, 58) los más frecuentes (Lazcano-Ponce, et al., 2001a; Kjaer, et al., 2002), mientras que HPV16 es el tipo oncogénico más común en cáncer cervical en el mundo (50%) seguido de HPV18, 31, y 45 (20%) (Palefsky, et al., 2000). Asimismo, se ha observado que las mujeres de población general presentan infecciones múltiples con una frecuencia menor (20%) (Lazcano-Ponce, et al., 2001a; Molano, et al., 2003) a la encontrada en trabajadoras sexuales (28%) (Juárez-Figueroa, et al., 2001).
12 Fig. 3. Distribución de muertes por tumores malignos en mujeres mexicanas
(http://www.inegi.org.mx/lib/olap/general_ver4/MDXQueryDatos.asp).
b) Infección por HPV en hombres
Poco se sabe sobre la historia natural de la infección por HPV en el hombre principalmente por la falta de una técnica estándar para el examen de genitales y de toma de muestra para la determinación del DNA viral (Weaver, et al., 2004). Entre los problemas para la toma de muestra, se encuentra la baja participación masculina, los datos discordantes cuando se realiza la auto-toma, lo dolorosa que es el realizarla en uretra y la baja sensibilidad en muestras tomadas a lo largo del pene (surco, prepucio), de orina y semen (Ostrow, et al., 1986; Kyo, et al., 1994; Lazcano-Ponce, et al., 2001b; Hernández, et al., 2006). Asimismo, no se ha determinado si la toma de muestra adecuada debe ser con hisopo o con papel adhesivo, ya que parece que el último promueve una mayor toma de células y mayor posibilidad de detectar el virus (Weaver, et al., 2004). Por otra parte, existe una alta variabilidad en la prevalencia de HPV de acuerdo al sitio de toma de muestra, siendo la más alta para los genitales externos (escroto, surco balano prepucial y glande), seguida de la encontrada en uretra, meato uretral, surco balano prepucial, prepucio y el glande (van Doornum, et al., 1992; Aguilar, et al., 2006; Plett-Torres, et al., 2007).
13 como de infecciones múltiples (alrededor del 50%) (Kyo, et al., 1994; Baken, et al., 1995; Wikström, et al., 1995; Franseschi, et al., 2002; Weaver, et al., 2004; Kjaer, et al., 2005; Lajous, et al. 2005; Hernández, et al., 2006; Plett-Torres, et al., 2007). Entre los factores que se han asociado a la presencia del DNA del HPV en el hombre se encuentra la edad, donde los hombres más jóvenes son los que presentan una mayor prevalencia de la infección (Lajous, et al., 2005; Vaccarella, et al., 2006) y de adquisición de la misma (Lajous, et al., 2005) aunque en algunas poblaciones masculinas la infección no se asoció con la edad de manera significativa (Lazcano-Ponce, et al., 2001b; Franceschi, et al., 2002; Kjaer, et al., 2005; Partridge, et al,, 2007; Plett-Torres, et al., 2007). En contraste, el número creciente de parejas sexuales se asocia con la infección por HPV en el hombre (Franceschi, et al., 2002; Vaccarella, e tal., 2006), en especial, en los últimos 8 meses (Partridge, et al., 2007) y sobre todo si se trata de parejas sexuales ocasionales y trabajadoras sexuales (Vaccarella, et al., 2006). El hombre también presenta infección por HPV clasificada como persistente (en 2 mediciones continuas) en alrededor del 20% de los participantes (Kjaer, et al., 2005; Lajous, te al., 2005), siendo más de la mitad debida por el mismo tipo viral (Kjaer, et al., 2005; Partridge, et al., 2007). Asimismo, la adquisición de la multiplicidad de la infección ó la adquisición de tipos virales nuevos es frecuente en aquellos que ya se encuentran infectados ó que fuman (Kjaer, et al., 2005). Otras variables que también se han asociado con la infección son el aseo de los genitales después de la relación sexual (Vaccarella, et al., 2006) y la circuncisión (Aynaud, et al., 1994; Aynaud, et al., 1999; Castellsagué, et al., 2002; Baldwin, et al., 2003; Lajous, et al., 2005), arrojando resultados contradictorios respecto a su efecto protector para la infección por HPV.
Los estudios sobre la prevalencia y comportamiento de la infección por HPV en el hombre realizados en nuestro país han arrojado los siguientes resultados: a) una alta prevalencia de la infección en jóvenes y en militares (mayor del 40%) utilizando la misma técnica de toma de muestra y tipificación del DNA viral, b) los tipos virales oncogénicos son más frecuentes que los de bajo riesgo, siendo muy alta su prevalencia en militares (mayor al 80% en infectados), c) existe una elevada prevalencia de infecciones múltiples, en especial en militares, por tipos virales oncogénicos, d) contrario a poblaciones masculinas de otros países donde el HPV16 es el tipo viral más frecuente, el HPV59 es el tipo viral más prevalente en los reportes sobre hombres mexicanos (Lazcano-Ponce, et al., 2001b; Lajous, et al., 2005; Aguilar, et al., 2006; Vaccarella, et al., 2006; Plett-Torres, et al., 2007).
c) Cáncer de próstata, de pene y anal asociado a la infección por HPV
14 el HPV33 ha sido un factor de riesgo para el cáncer de próstata (Adami, et al., 2003). De manera contraria, la asociación entre la infección por HPV y cáncer de pene ha sido controversial ya que se ha detectado DNA viral en el 20 al 70% de los casos (Lowy, et al., 1994; Carter, et al., 2001; Rubin, et al., 2001), en especial si los sujetos son positivos al HIV (siglas en Inglés; Human Immunodeficiency Virus) (Watson, 2005), siendo el HPV16 el tipo viral más frecuente (Rubin, et al., 2001) y desconociendo si la presencia del DNA viral se debe a la simple prevalencia tan alta de la infección en hombres, o bien, a que el virus se encuentre integrado al genoma celular, similar a lo encontrado en cáncer cervical. Por último, se ha observado que el 76.3% de los hombres con cáncer anal, presentan DNA de HPV16 (Carter, et al., 2001), especialmente en aquellos hombres positivos al HIV (Hagensee, et al., 1997; Goldie, et al., 1999; Chin-Hong & Palefsky, 2002).
d) HPV y cáncer de cabeza y cuello
El cáncer de cabeza y cuello es el sexto tipo de cáncer más frecuente en el mundo e involucra a zonas como labios, cavidad oral, nariz, senos paranasales, nasofaringe, orofaringe, laringe, esófago, glándulas salivales, amígdalas y tejidos de la oreja. La incidencia global de este tipo de enfermedad se calcula en 650 000 personas anualmente, siendo los hombres más afectados que las mujeres (4:1). Entre los factores de riesgo que se han asociado al desarrollo de cáncer de cabeza y cuello es el fumar, el consumo de alcohol y la infección por HPV (Herrero, et al., 2003). Respecto al HPV, se ha encontrado que la prevalencia del virus en lesiones cancerosas de diferentes sitos anatómicos de la cabeza y el cuello varía del 4% al 51% siendo generalmente el HPV16 el más frecuente (18-95%) y el que se encuentra en mayor proporción (86%) integrado al genoma celular (Syrjänen, 2005). Asimismo, se han encontrado tipos de bajo riesgo como HPV6 y HPV11 en cáncer laríngeo incluso con integración del genoma viral (Major, et al., 2006).
e) Importancia de la infección por HPV en parejas sexuales y el papel del género en la transmisión del
virus
15 La importancia de la infección por el HPV en el hombre radica en la alta prevalencia del DNA viral que el género ha llegado a presentar en sus genitales (43%) (Lazcano-Ponce, et al., 2001b), además de que se puede encontrar DNA del HPV en la uretra distal (van Doornum, et al., 1992) sin presentar lesiones virales malignas debidas a la infección persistente, posiblemente porque eliminan infecciones agudas más rápidamente que la mujer (van Doornum, et al., 1994; Thomas, et al., 2001). De esta forma, al ser la infección por el HPV inadvertida en el hombre, éste puede transmitirla a su pareja sexual y generarle un problema de salud a largo plazo. Al respecto, se ha observado que la prevalencia del DNA del HPV (7%) en esposos de mujeres con cáncer cervical in situ o invasivo, es similar al de mujeres sanas (6%) (Thomas, e al., 2001) y factores como presentar condilomas en pene, neoplasia intraepitelial en pene (Campion, et al., 1985; Kyo, et al, 1994), no presentar circuncisión (Castellsagué, et al., 2002), frecuentar un número elevado de trabajadoras sexuales (mujeres con alta prevalencia de HPV), reportar un número elevado de parejas sexuales en la vida y falta de uso del condón (Zunzunegui, et al., 1986), son factores de riesgo para el desarrollo de neoplasias en cérvix y CC en la pareja femenina.
4. Respuesta inmune contra el virus
Diversos factores minimizan la exposición del HPV al sistema inmune ya que el virus no infecta ni se multiplica en células presentadoras de antígeno localizadas en el epitelio, no lisa queratinocitos y no genera viremia. De igual manera, al no existir un modelo animal en el cual estudiar la respuesta inmune contra el HPV, los diversos estudios al respecto se han llevado a cabo en humanos.
a) Respuesta inmune celular
16 avanzadas la activación de Th1 puede ser neutralizada por el aumento en la secreción del receptor de IL-2 ó por la sobre respuesta Th2 (de Gruijl, et al., 1999; Konya & Dillner, 2001). Asimismo, la alta frecuencia de infecciones recurrentes, persistencia viral, de verrugas cutáneas y genitales, cáncer cervical, anal y de pene en sujetos positivos al HIV demuestran la importancia de la respuesta de los linfocitos T en la eliminación de la infección por HPV (Stanley, et al., 2009)
Respecto a la presencia y actividad de células dendríticas, se ha demostrado que en verrugas cutáneas, condilomas y lesiones NIC que presentan DNA viral, existe un bajo número de estas células, en comparación con las existentes en tejido normal (Wu, 1994; Konya & Dillner, 2001; Scott, et al., 2001) e incluso su actividad y morfología se encuentra alterada (Jimenez-Flores, et al., 2005). De igual manera, se ha observado que las células dendríticas en el epitelio cervical de mujeres con lesiones asociadas al HPV, se encuentran en el estroma
del tejido, muestran un estadio inmaduro y secretan citocinas inmunosupresoras (TGF-β, IL-10 e IL-13) (Tindle, 2002; Kobayashi, et al., 2004).
b) Respuesta inmune humoral
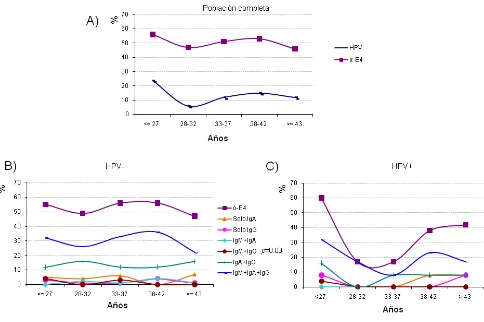
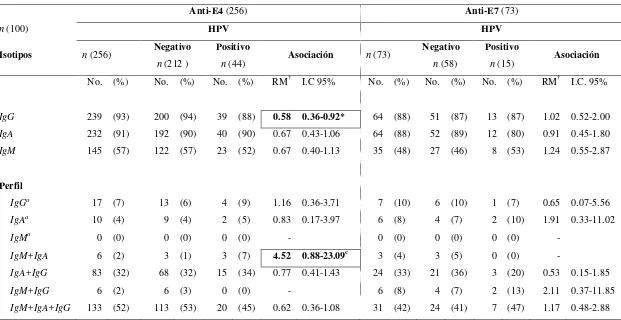
i. Respuesta de anticuerpos en la población general: la detección de anticuerpos dirigidos contra antígenos del HPV por ELISA (siglas en inglés; Enzyme Linked Immunosorbent Assay) en la población general se ha tratado de utilizar como un marcador de exposición acumulada de la infección. Hasta el momento, son pocos los estudios al respecto y el consenso de los resultados indica que la seroprevalencia contra antígenos como VLPs (siglas del Inglés; Virus-Like Particles) del HPV16, -18 y –33 aumenta conforme aumenta la edad, siendo del 50% en individuos mayores de 50 años (Hamsíková, et al., 1998) y del 35% en población general (Marais, et al., 2000; Michael, et al., 2008). Por otra parte, la seroprevalencia de tipos virales cutáneos es alta (32.1%) y de tipos de mucosas es baja (7.6%) en niños de 1-14 años de edad, valores que se revierten en sujetos que han iniciado su vida sexual (Michael, et al., 2008). Variables como la edad (>20 años) y el número de parejas sexuales se asocian a la presencia de anti-VLP-16 en mujeres, mientras que en hombres, edades tempranas de inicio de la vida sexual (18 años) y un tiempo de actividad sexual mayor de 10 años, se asocian a estos anticuerpos (Stone, et al., 2002). En cuanto a los anticuerpos contra proteínas tempranas del HPV, se ha reportado que la seroprevalencia contra péptidos de E2, E4 y E7 alcanza un máximo de los 21 a los 35 años, siendo las más elevadas para E4 (35%) y E2 (30%) (Hamsíková, et al., 1998).
ii. Respuesta de anticuerpos en mujeres: el estudio simultáneo de la detección del DNA del HPV en
17 péptidos sintéticos de L1, L2, E2, E4 y E7 del HPV16 y proteínas recombinantes de E4 y E7 de este último tipo viral. Asimismo, estas metodologías han sufrido modificaciones encaminadas a mejorar su sensibilidad y especificidad, siendo la IET y el Multiplex Luminex los sistemas más sensibles y específicos hasta ahora. A la par, en un afán de correlacionar la serología encontrada con el DNA viral, se han utilizado diversas técnicas como PCR con oligonucleótidos específicos que amplifican regiones de L1 y E6, Southern Blot, Dot Blot, Reverse Line Blot y Captura de Híbridos para detectar el DNA del HPV en cérvix (Gutierrez-Xicotencatl, et al., 2009).
En general, se ha observado que la seroconversión a anticuerpos anti-cápside ocurre entre los 6 y 18 meses después de haber detectado el DNA viral en la mujer (Carter, et al., 1996), anticuerpos que son detectables por muchos años (af Geijersstam et al., 1998). La seroprevalencia de anticuerpos contra cápside se ha llevado a cabo en diversas poblaciones femeninas. Se ha observado que la prevalencia de anti-VLP16, -18, -31 y -58 es más elevada en trabajadoras sexuales (62%) que en mujeres de población general (10%) (Touzé, et al., 2001). En cuanto a mujeres con lesiones asociadas al HPV, se ha observado que la presencia de HPV de bajo riesgo como HPV6 en el 94% de condilomas anogenitales correlaciona con la seropositividad a IgG anti-VLP-6 detectada por ELISA simple en todas las mujeres que presentan este tipo verrugas, debido a la infección productiva y persistente que las genera (Greer, et al. 1995). En cuanto a tipos virales oncogénicos, se ha demostrado la especificidad de los anticuerpos anti-cápside ya que existe una asociación significativa entre la presencia de anticuerpos de tipo IgG anti-VLP-16 y la presencia de HPV16 (Carter, et al., 1996). De igual manera, se han asociado los anticuerpos contra otros tipos virales oncogénicos (Matsumoto, et al., 2003) y el grado de la lesión en cérvix (Wideroff, et al., 1995; Sasagawa, et al., 2003; Nonnenmacher, et al., 2004), siendo la seroprevalencia del 50% en mujeres con lesiones de alto grado, en comparación con el 16% del grupo control (Wideroff, et al., 1995) posiblemente porque las lesiones de alto grado son el resultado de infecciones productivas y persistentes. De esta forma, se ha determinado que existe 4.7 veces más posibilidad de encontrar anticuerpos contra VLP16 (ELISA de captura) y DNA del HPV16 en mujeres con cáncer cervical escamoso (Carter, et al. 2001). Igualmente, la presencia de IgG anti-cápside de HPV16, -18, -31 y -45 se asocia positivamente a la infección persistente por el tipo viral correspondiente, a más de 2 parejas sexuales en la vida, a la seropositividad por otro tipo viral (Wang, et al., 2003; Matsumoto, et al., 2003) y al CC (Sasagawa, et al., 2003). De forma similar y en relación al cáncer oral, se ha observado que la presencia de IgG anti-VLP16 se asocia al cáncer de la cavidad oral (RM = 1.5 I.C.95% 1.1-2.1) y de orofaringe (RM = 35 I.C.95% 2.1-5.9) (Herrero, et al., 2003).
18 anticuerpos contra E4 está asociada a condilomas y lesiones NIC I-III (Pedroza-Saavedra, et al., 2000; Rincón, 2002; Vázquez-Corzo, 2003), siendo su detección, junto con anticuerpos contra Ras, posibles marcadores de lesiones premalignas (Pedroza-Saavedra. et al., 2000; Rincón, 2002; Vázquez-Corzo, el al., 2003). Por otro lado, en cuanto al cáncer oral, se ha observado que la presencia de anticuerpos contra E6 y/o E7 se asocia fuertemente a esta enfermedad (RM = 2.9 I.C.95% 1.7-4.8) y al cáncer orofaríngeo (RM = 9.2 I.C.95% 4.8-17.7) (Herrero, et al., 2003). Asimismo, se ha observado que los hombres con cáncer de cabeza y cuello tienden a presentar con mayor frecuencia anticuerpos anti-E6 y/o E7 del HPV16 que las mujeres con esta enfermedad y son más frecuentes en pacientes sin recurrencia y mejor sobrevida que aquellos negativos a estos marcadores serológicos y a p16 (Smith, et al., 2010).
19 iii. Respuesta de anticuerpos en hombres: se han detectado diferencias entre la seropositividad a VLPs y el género. Al respecto, se ha observado que la seroprevalencia de IgG contra VLP-16 detectada por ELISA simple en hombres que acuden a clínicas de Enfermedades de Transmisión Sexual (ETS) es del 19%, significativamente menor que la encontrada en mujeres (50%) (Svare, et al., 1997), posiblemente porque en ellos se genera una menor frecuencia de ciclos virales productivos que llevan a un control temprano de la infección. Asimismo, la presencia de condilomas en pene y su asociación con anticuerpos contra el HPV muestra que el 16% de los hombres que presentan estas lesiones son seropositivos para VLP6 (Greer, et al., 1995) y se han encontrado estos anticuerpos en hombres después de la detección del DNA viral, con niveles que aumentan continuamente, conforme avanza el tiempo de infección (productiva) generando mayores niveles de IgG que de IgA e IgM (Wikström, et al. 1995). Por otro lado, hombres que han reportado condilomas muestran una mayor seroprevalencia de IgG e IgA contra VLP6 (35 y 22%, respectivamente) en comparación con los que presentan lesiones visibles (27 y 23%) y el grupo control (10 y 9%) (Wikström, et al., 1997) posiblemente porque la infección está en proceso de control.
20
III.
JUSTIFICACIÓN
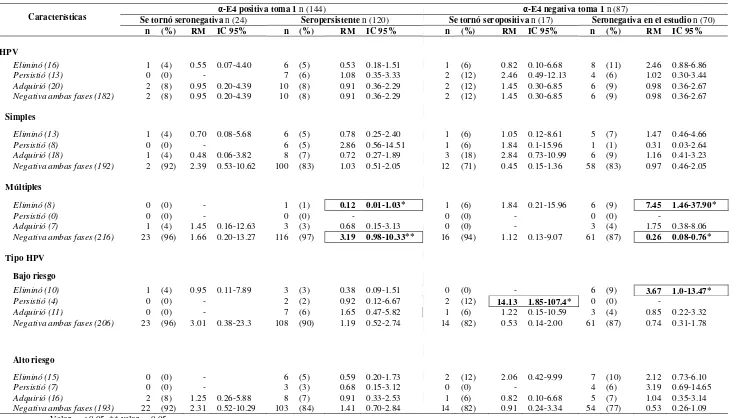
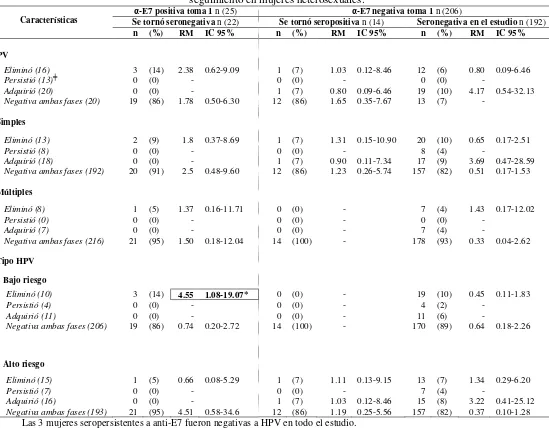
El estudio de la presencia de HPV en genitales masculinos no es tan extenso como lo que se ha realizado en mujeres, principalmente por no existir una técnica estándar para la toma de muestra. Dentro de los pocos estudios realizados en hombres se ha observado que en México el 43% presentan DNA del HPV y el 19% pertenecen a tipos virales de alto riesgo. En contraste con la alta prevalencia de la infección por HPV, se sabe que la frecuencia de lesiones genitales visibles en esta población es baja (alrededor del 1%). Por otro lado, se han realizado estudios de seroprevalencia a VLP16 en poblaciones mixtas donde el 19% de los hombres son seropositivos. Asimismo, se ha determinado que la prevalencia de inmunoglobulinas anti-E4 en hombres sanos es del 12% y de anti-E7 es del 6% y se asocian principalmente a la infección por HPV16 en uretra. Por otro lado, estudios de seroprevalencia en la población femenina han permitido identificar que la presencia de anticuerpos séricos contra E7 indica la aparición de lesiones NIC III o cáncer cervical hasta en un 80%, mientras que la presencia de anticuerpos contra E4 y Ras puede ser indicadora de la presencia de lesiones premalignas en cérvix.
De esta forma, el realizar un estudio que permita detectar el comportamiento de la aparición y el perfil de anticuerpos contra proteínas tempranas del HPV16 como E4 y/o E7 en parejas heterosexuales regulares, permitirá determinar, si la aparición de los diferentes isotipos se relaciona con la conducta sexual de hombres y mujeres pareja sexual y con la adquisición, eliminación y persistencia de la infección.
IV.
HIPÓTESIS
En los hombres, la generación de isotipos anti-E4 IgA e IgG anti-E4 se asociará a la infección activa por HPV, establecida y reciente. Mientras que, la persistencia del isotipo IgG anti-E4 y/o anti-E7, se asociará a la infección viral persistente.En las mujeres, la persistencia de anticuerpos anti-E7, en específico de IgG se asociará a la infección persistente por HPV.
V.
OBJETIVO GENERAL
Determinar el comportamiento de los isotipos contra E4 y E7 del HPV16 y sus determinantes de riesgo durante el transcurso de la infección en hombres y mujeres pareja sexual.
VI.
OBJETIVOS PARTICULARES
• Producir y purificar las proteínas E4 y E7 del HPV16.
21
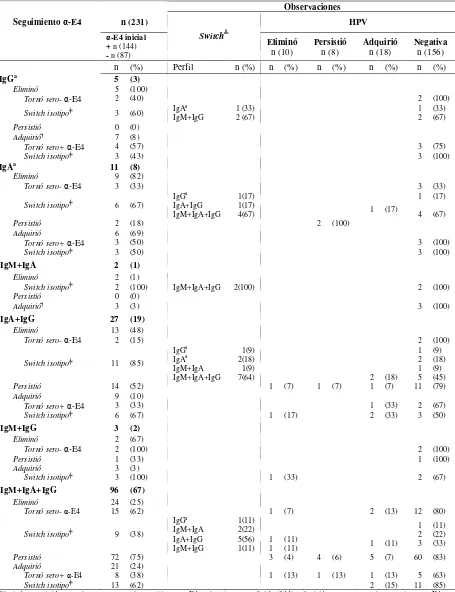
• Determinar la prevalencia, generación, eliminación y persistencia en suero de los perfiles de isotipos contra las proteínas virales E4 y E7 del HPV 16 durante 18 meses de seguimiento.
• Determinar el riesgo de desarrollar, mantener o eliminar los diferentes perfiles de isotipos E4 y anti-E7 de acuerdo a características sociodemográficas y de conducta sexual de los participantes.
• Determinar el riesgo de desarrollar, mantener o eliminar los diferentes perfiles de isotipos E4 y anti-E7 de acuerdo a cambios en la infección por HPV (adquisición, eliminación o persistencia).
22
VII.
METODOLOGÍA
1. Selección de la población
Se realizó un estudio donde se reclutaron 500 parejas heterosexuales en la unidad de salud de Texcoco de la secretaría de Salud del Estado de México entre el año 2003 y 2008 con el fin de estudiar factores de riesgo asociados a la infección por HPV en hombres y mujeres de manera independiente y como pareja sexual. De estas 500 parejas partimos para el análisis del comportamiento de anticuerpos anti-E4 y anti-E7.
1.1. Elección de los participantes
Se reclutaron mujeres y sus parejas sexuales regulares masculinas que asistieron voluntariamente a recibir los servicios de salud la unidad de salud de Texcoco. La edad de los participantes fue mayor de 14 años y la definición de su pareja regular fue: toda aquella de su sexo opuesto con la que ha tenido contacto sexual durante
los últimos 6 meses.
1.2. Criterios de inclusión y exclusión
Inclusión: Parejas heterosexuales regulares, mayores de 14 años, sanos residentes en Texcoco (Estado de México) que aceptaron participar en el estudio mediante consentimiento informado.
Exclusión: Aquellas parejas heterosexuales, regulares mayores de 14 años que no aceptaran participar en el estudio.
1.3. Medición basal y seguimiento de los participantes
A los hombres y mujeres participantes, se les aplicó un cuestionario estandarizado encaminado a determinar las características sociodemográficas y de conducta sexual en la medición inicial. Tanto en la medición inicial y a los 18 meses se tomaron muestras de raspado cervical y de descamación de pene y meato uretral para determinar la presencia del DNA del HPV por hibridación en línea reversa (Roche ®) y una muestra de sangre para la detección de anticuerpos.
1.4. Recolección de muestras, datos clínicos y del cuestionario
23 método anticonceptivo), cáncer de mama, historia sexual (estado civil, edad de primera relación sexual, características de parejas sexuales, infecciones de transmisión sexual), historia sexual con trabajadoras en el sexo comercial (número, uso de condón), estado de salud y hábitos sexuales (infecciones de transmisión sexual, parejas masculinas, circuncisión, aseo antes y después de relaciones sexuales), conocimiento acerca de la prueba de Papanicolaou (uso), conocimiento sobre el HPV (existencia de la infección, transmisión) y el hábito de fumar (número de cigarros, fuma actualmente).
Para la toma de muestra en genitales masculinos, una enfermera entrenada tomó células de pene utilizando un cepillo Cytobrush® Plus GT humedecido en solución amortiguador de fosfatos (Na2HPO4 10 mM, KH2PO4 1.8 mM) tomando muestra de toda la superficie del tercio medio del escroto, del glande y se retrajo el prepucio para tomar células del surco balano prepucial, rotando y cepillando enérgicamente de abajo hacia arriba y en sentido contrario a las manecillas del reloj. Para la toma de muestra de meato uretral, se presionó hacia abajo el pene para abrir el meato uretral y se tomó la muestra de células con un hisopo Accellon Multi-Biosampler Swab® (Mediscand Hollywood, FL) humedecido con amortiguador de fosfatos, girándolo en sentido contrario de las manecillas del reloj. Los cepillos e hisopos con células destinadas para la detección del DNA cervical se colocaron en un tubo con 20 mL de PBS (NaCl 150 mM, KCl 2.7 mM, Na2HPO4 1.01M, KH2PO4 1.76 mM, pH 7.2) correctamente rotulado y se guardaron en congelación a –20 °C. Para el caso de la citología cervical y
detección de lesiones, estos procedimientos se llevaron acabo de acuerdo al protocolo sugerido por la Dra. Patricia Alonso del Departamento de Patología del Hospital General de México siguiendo lo establecido en la NOM-014-SSA2-94. Se tomaron 10 mL de sangre para extraer el suero de cada sujeto. El suero se guardó en
alícuotas de 1 mL y 200 µL a -70°C. Alícuotas de 20 µL en uso para el ensayo serológico se mantuvieron a -20
°C.
2. Tipificación de HPV en las muestras biológicas
La determinación de DNA del HPV se llevó a cabo en el Instituto Nacional de Salud Pública en el laboratorio 7 utilizando el ensayo en tiras por hibridación en línea reversa (Bauer, et al. 1991; Gravitt, et al., 1998) comercializada por Roche. Brevemente, se amplificó el DNA del HPV por PCR utilizando los oligonucleótidos específicos para L1 biotinilados MY09 (CGTCCMARRGGAWACTGATC) y MY11 (GCMCAGGGWCATAAYAATGG). Asimismo, se utilizó como control de la muestra la amplificación del gen
de la β-globina con los oligonucleótidos GH20 (GAAGAGCCAAGGACAGGTAC) y PC04
(CAACTTCATCCACGTTCACC) biotinilados. Al finalizar la amplificación del DNA, las muestras positivas, se hibridaron en tiras de nylon que contienen 37 sondas específicas para HPV y 2 para concentraciones altas y bajas
24 3. Detección de anticuerpos séricos contra las proteínas E4 y E7 del HPV16
La presencia de anti-E4 y anti-E7 en suero fue detectada utilizando el sistema Slot Blot. Dicho sistema se diseñó y estandarizó en todos sus procesos involucrando la clonación de los genes de E4 y E7 en un vector de expresión in vitro, la estandarización de la purificación de los antígenos por cromatografía de afinidad a Níquel y la estandarización del sistema Slot Blot utilizando el sistema biotina-estreptoavidina y quimioluminiscencia para detectar la reacción antígeno-anticuerpo.
3.1. Obtención del antígeno
Los genes de las proteínas E4 y E7 del HPV16 que se amplificaron fueron introducidos en los sitios de restricción para las enzimas Xho I y Bam H1 del vector de clonación pIVEX 2.4b Nde (Roche). Este vector permite la expresión de las proteínas con 6 residuos contiguos de Histidina en el extremo amino terminal y posee el gen de la resistencia a la ampicilina como marcador de selección (Fig. 1).
3.1.1. Amplificación de los genes de E4 y E7
Se diseñaron los oligonucleótidos para la amplificación de los genes de E4 y E7 del HPV16 según la secuencia reportada en KO2718 NCBI. Para la amplificación de E4 se diseñaron los oligonucleótidos E4a
(CCGCTCGAGGCAACGAAGTATCCTCTCCTGAAA) y E4b
(CGGGATCCCCTATGGGTGTAGTGTTACTAT) y para E7 los oligonucleótidos E7a
(CCGCTCGAGCATGGAGATACACCTACATTG) y E7b (CGGGATCCCTTATGGTTTCTGAGAACAGAT). Los oligonucleótidos incluyeron los sitios de restricción y bases para el reconocimiento por Xho I y Bam HI, bases para mantener el marco de lectura y la secuencia nucleotídica de los 8 primeros aminoácidos de la proteína. Dichos oligonucleótidos fueron sintetizados en la unidad de síntesis del Instituto de Biotecnología de la UNAM por el método de fosfito-triester en el sintetizador automatizado 391 (Applied Biosystems) y se utilizaron después de ser extraídos con solución amoniacal con n-butanol, secados y resuspendidos en agua esterilizada.
Los genes de E4 y E7 fueron amplificados a partir de los plásmidos pGEX16-E4 donado por el Dr. J. Doorbar y pSV2-E7 reportado en Kanda, et al., 1988. Para cada reacción de amplificación se utilizó MgCl2
3mM, 1 pmol/µL del oligonucleótido sentido ó antisentido, 25 ng del DNA plasmídico, 0.6 U de DNA
polimerasa de alta fidelidad (Ultma I, Perkin Elmer) y 16 µL de aceite mineral. Se llevaron a cabo los siguientes
ciclos de amplificación: 1 ciclo (6 min 95°C), 35 ciclos (30 s 95°C, 30 s 55°C, 1 min 72°C), 1 ciclo (15 min
25 Figura 1. Características del plásmido pIVEX2.4b Nde (Roche).
3.1.2. Restricción de los productos de PCR conBam H1 y Xho I
Se eliminó el aceite mineral y los productos de PCR en 50 µL de reacción se precipitaron con 80 µL de cloroformo-alcohol isoamílico (24:1), 2 volúmenes de etanol absoluto y 0.2 de acetato de amonio 7.5 M. Tras su
resuspensión en 25 µL de agua estéril, se digirió todo el volumen del producto de PCR y 25 µg del vector
pIVEX2.4b Nde por 2 h a 37°C con la enzima Xho I (Gibco) y posteriormente con Bam HI (Biolabs). Como control se utilizó la restricción de pIVEX2.4b Nde con solo una enzima de restricción.
3.1.3. Purificación de pIVEX2.4b Nde y de los productos de PCR digeridos
El vector digerido se purificó a partir de electroforesis en gel de agarosa de bajo punto de fusión 1%-TAE (Tris–acetato 0.04 M, EDTA 1 mM), incubando con 5 volúmenes de la solución de extracción (Tris-HCl 20 mM,
EDTA 1mM pH 8.0) por 10 min a 65 °C y extrayendo con el mismo volumen de fenol (pH 8.0 equilibrado con Tris-HCl 0.1 M), con cloroformo: fenol (a volúmenes iguales) y con cloroformo. El vector se precipitó 20 min a
-70 °C con 0.2 volúmenes de acetato de amonio 10 M y 2 volúmenes de etanol absoluto frío, se lavó con etanol
al 70% y resuspendió en 50 µL de agua estéril. Los productos de PCR digeridos se purificaron a partir de electroforesis en geles de poliacrilamida al 8%-TBE (Tris-Borato 0.045 M, EDTA 1 mM) (Dybczynski &
Plucienniczak, 1988). El fragmento de gel se incubó toda la noche con 500 µL de la solución de extracción
26 volúmenes de acetato de amonio 10 M y 2 volúmenes de etanol absoluto frío. Finalmente, se lavó con etanol
70% y resuspendió en 50 µL de agua estéril (Sambrook, et al., 1989). La pureza del vector y productos de PCR
digeridos fue D.O.260nm/280nm≥ 1.7.
3.1.4. Ligación y transformación
En 20 µL de reacción de ligación se incubaron de 2 a 10 moles de producto de PCR digerido con 1 mol de
pIVEX2.4b Nde digerido, 2 µL del amortiguador para la ligasa de T4, 200 UI de la ligasa de T4 (Biolabs) y 20
µL de aceite mineral por toda la noche a 16 °C. Células de Escherichia coli DH5α provenientes de un cultivo en medio LB líquido (bacto-triptona 1%, extracto de levadura 0.5%, NaCl 0.5%, pH 7.0) con D.O.600nm = 0.5-1.0 obtenidas por centrifugación a 5 000 rpm (Sorvall®), se resuspendieron en medio TSB (LB líquido, PEG 3000 o 6000 10%, DMSO 5%, MgCl2 10 mM y MgSO4 10 mM) para su transformación. Se transformaron 60 µL de
células competentes con 8 µL de cada ligación por choque térmico a 42 °C por 1 min y 1 h a 37°C y se
sembraron en medio sólido LB (agar 1%) con ampicilina 50 µg/mL (Chung, et al., 1989). Las clonas obtenidas
se cultivaron en 10 mL de medio LB líquido-ampicilina 50 µg/mL para su congelación a -70 °C con 15% de glicerol estéril.
3.1.5. Verificación de la presencia del gen E4 ó E7 en las clonas obtenidas
Se realizó una minipreparación de plásmido de cada una de las clonas obtenidas para verificar la presencia del gen de E4 ó E7. Una pastilla bacteriana proveniente de 5 mL del cultivo de toda la noche se incubó en hielo
por 10 min con 500 µL del amortiguador de lisis (Tris pH 8.0 25 mM, EDTA 10 mM, sacarosa 15%, lisozima 2 mg/mL) y por 10 min con 1 mL de solución alcalina (NaOH 0.2 M, SDS 1%). La mezcla se incubó en hielo por
10 min con 750 µL de acetato de potasio 5M, se centrifugó por 10 min 13 000 rpm (Eppendorf microfuge) y el
sobrenadante se incubó con 50 µg de RNAsa libre de DNAsa (Amersham Life Sciences) por 1 h a 37°C. Se extrajo la fase acuosa 2 veces con 1.25 mL de cloroformo fenol (1:1) por centrifugación a 13 000 rpm
(Eppendorf microfuge) por 5 min a 4°C, se precipitó el plásmido con 2 volúmenes de etanol absoluto y 0.2
volúmenes de acetato de amonio 7.5 M a -70 °C por 15 min, se lavó con 5 mL de etanol 70% y se resuspendió
en 50 µL de agua estéril. Se restringió el plásmido de cada clona con las enzimas Xho Iy Bam HI para obtener los insertos de 258 pb correspondiente al gen de E4 y de 294 pb correspondiente al gen de E7.
3.1.6. Purificación a gran escala del plásmido y secuenciación de los genes de E4 y E7
Se purificó el plásmido de las clonas seleccionadas que contienen el gen de E4 ó E7 utilizando el estuche
Endofree Plasmid Maxi Kit (QIAGEN®). En breve, se colocaron 5 mL de cultivo de 8 h a 37°C de cada clona (LB-ampicilina 50 µg/mL) en 250 mL de medio LB-ampicilina 50µg/mL fresco y se incubó toda la noche a
27 resuspendieron en 10 mL del amortiguador P1 (Tris-HCl 50 mM pH 8.0, EDTA 10 mM, RNAsa 100 µg/mL).
Posteriormente, se adicionaron 10 mL del amortiguador P2 (NaOH 200 mM, SDS 1%), se incubaron a temperatura ambiente por 5 min, se adicionaron 10 mL del amortiguador P3 frío (acetato de potasio 3M, pH 5.5), se filtró el lisado y se incubó en hielo por 30 min con 2.5 mL de amortiguador ER (buffer de eliminación de endotoxinas). Una vez equilibrada la columna de intercambio aniónico sílica-DEAE (dietil-amino-etanol) con10 mL de amortiguador QBT (NaCl 250 mM, MOPS 50 mM pH 7.0, isopropanol 15%, Tritón X-100 0.15%),se cargóel filtrado, se eluyó el plásmido con 15 mL de amortiguador QN (NaCl 1.6 M, MOPS 50 mM, pH 7.0, isopropanol 15%) y se precipitó con 10.5 mL (0.7 volúmenes) de isopropanol a temperatura ambiente. Se
centrifugó a 11 000 rpm (Sorvall®) por 30 min a 4°C, se lavó con 5 mLde etanol 70% libre de endotoxinas y se
disolvió en 150 µL de agua estéril libre de endotoxinas. La concentración y pureza del plásmido purificado debió
ser D.O. 260 nm/280 nm >1.7 para su secuenciación y ensayos de traducción in vitro.
Para la secuenciación, se colocaron 750 ng del plásmido purificado, 5 pmol/µL (1 µL) del
oligonucléotido específico o el oligonucléotido T7 llevados a 16 µL de reacción con agua estéril. Los plásmidos
se secuenciaron en la unidad de secuenciación del Instituto de Biotecnología de la UNAM por el método Taq FS
Dye Terminator Cycle Sequencing Fuorescence-Based Sequencing. La secuencia de E4 y E7 en las clonas obtenidas fueron analizadas utilizando el programa Bio-Edit y se compararon con la secuencia reportada para estas proteínas (K02718 NCBI) utilizando el servidor EXPASy, el programa BLAST y SIM. La clona cuya secuencia del gen de E4 o E7 fue 100% idéntica a la reportada fue la que se utilizó para la síntesis de la proteína por traducción vitro.
3.1.7. Expresión de proteínas in vitro
Para la expresión de E4 y E7 in vitro, se siguieron las recomendaciones del manual RTS application
manual for cell-free protein expression (Roche) y el manual de uso del aparato RTS 900 (Roche). Se reconstituyeron los reactivos liofilizados del estuche (lisado de E. coli, mezcla de reacción, mezcla de alimentación, mezcla de aminoácidos y metionina) y se mezclaron según el manual para cargar la cámara de síntesis (525 µL de lisado de E. coli, 225 µL de mezcla de reacción, 270 µL de aminoácidos, 30 µL de metionina
y 15 µg en 50 µL de plásmido) y la de alimentación (8.1 mL de mezcla de alimentación, 2.65 mL de mezcla de
aminoácidos, 300 µL de metionina). Se utilizó también el plásmido control del estuche que posee el gen de la proteína verde fluorescente (GFP; del inglés Green Fluorscent Protein) ya que esta proteína fue utilizada como control en los ensayos de Slot Blot. Se incubaron las reacciones de traducción in vitro de E4 y E7 por 24 h a
22°C a 900 rpm y de GFP por 20 h a 30°C a 120 rpm. Terminada la síntesis, se almacenaron las proteínas a
-70°C en alícuotas de 250 µL con EGTA 10 mM y urea 6M.
La expresión de las proteínas se detectó por Western Blot (Pedroza-Saavedra, et al., 2001). Para ello, se separaron 20 µg de las proteínas de la mezcla de la traducción in vitro por SDS-PAGE 15% a 45 V toda la
28 las proteínas fueron cargadas en amortiguador 5X (Tris-HCl 50 mM pH 6.8, DTT 100 mM, SDS 2%, azul de bromofenol 0.1%, glicerol 10%) y urea 4M. Posteriormente, las proteínas fueron transferidas a membranas de nitrocelulosa PROTRAN® (Schleichel & Schuell) en cámara de tanque (BIORAD Trans-Blot Cell) con amortiguador de transferencia (Tris base 24 mM, glicina 0.2 M, etanol 23.3%) por 5 h a 200 V en refrigeración. Después de ser bloqueada la membrana por 30 min a temperatura ambiente con PBS-leche 10%-Tween 0.05%,
se lavó 3 veces por 10 min con PBS-Tween 0.05% y se incubó toda la noche a 4 °C en agitación constante con el primer anticuerpo diluido en PBS-Albúmina Sérica Bovina (BSA; del inglés Bovine Serum Albumin) 5%-Tween 0.05%- azida de sodio 0.02%. Los anticuerpos utilizados fueron el anticuerpo monoclonal de ratón (mAb) anti-E7 HPV16 (Santa Cruz) en dilución 1: 2 000, mAb de ratón anti-His6 (Roche) 1:1 000 para detectar GFP, y suero humano de mujer con CC 1: 500 para detectar E4. Después de lavar la membrana 4 veces con PBS-Tween 0.05%, se incubó 1 h a temperatura ambiente con el segundo anticuerpo diluido en PBS-leche 5%-Tween 0.05% de la siguiente manera: inmunoglobulinas de cabra anti-ratón conjugadas con peroxidasa 1:5 000 (DAKO) e inmunoglobulinas de cabra anti-humano conjugadas con peroxidasa 1:10 000 (Sigma). La reacción antígeno-anticuerpo se visualizó por quimioluminiscencia utilizando el estuche Western Lightning Chemiluminiscence
Reagent Plus (Perkin Elmer) y placas radiográficas Kodak Medical X-ray general purpose blue.
3.1.8. Purificación de los antígenos por cromatografía de afinidad a níquel
Para la purificación de los antígenos (E4, E7 y GFP), se utilizó la resina Ni NTA (QIAGEN) según las recomendaciones del fabricante (The QIAexpressionistTM) y lo reportado por Yang DH, et al., 2003 con ciertas modificaciones. Una vez equilibrada la resina con el amortiguador 1 (NaH2PO4 1.16mM, Na2HPO4 18.84mM,
NaCl 50mM, SDS 0.2%, Urea 8M, pH 7.8), se diluyeron 12 µg de proteína de la traducción in vitro en el amortiguador A (NaH2PO4 1.16 mM, Na2HPO4 18.84 mM, SDS 0.2%, Urea 8M, pH 7.8) e incubó la resina toda la noche a 4°C. Se empacó la mezcla de la resina-antígeno en una columna (Poly-Prep chromatography columns BIORAD), se recuperó el líquido y lavó 2 veces con el amortiguador 1. Se eluyó la proteína con el amortiguador 2 (NaCl 500 mM, fosfato 20 mM, SDS 0.2%, pH 6.0) y las fracciones se almacenaron en fluoruro de
fenil-metil-sulfonilo (PMSF, SIGMA) 2 mM a -70°C hasta su uso.
Las proteínas se visualizaron por SDS-PAGE 15% por tinción con azul de coomassie, tinción con plata y Western Blot. Se colocaron 16 µL de cada fracción en buffer de carga 5X y urea 4M para su corrimiento electroforético como descrito con anterioridad. Para la tinción con azul brillante de coomassie se colocó el gel en una solución del colorante al 0.25% en ácido acético, metanol al 10% por 4 h a temperatura ambiente y se destiñó con una solución de metanol 30%-ácido acético 10%. La tinción con plata se llevó a cabo con el estuche
29 La cantidad de proteína en cada elución se determinó por Western Blot utilizando una curva patrón de proteína E7 previamente purificada de 50, 25, 12.5, 6.25, 3 y 1.5 ng. Las placas radiográficas fueron escaneadas para su análisis con el programa Image J versión 1.33u.
3.1.9. Detección de anticuerpos en suero por Slot Blot
Se determinó la presencia de anticuerpos contra E4 y E7 utilizando la cámara HYBRI-SLOTTM Manifold (Schleichel & Schuell). Membranas de nitroceulosa PROTRAN® (Schleichel & Schuell) de 11.5 cm X 3.5 cm se humedecieron por 5 min con agua 5 veces destilada y posteriormente con el amortiguador 1 (NaH2PO4 1.16 mM, Na2HPO4 18.84 mM, pH 7.8). Se diluyeron los antígenos en urea 6M-azida de sodio 0.02% hasta una
concentración 0.1ng/µL de E4, y 0.125 ng/pozo de E7 y GFP y se colocaron 100 µL/pozo de cada dilución y del diluyente. Se fijaron los antígenos por 30 min a temperatura ambiente en una solución de glutaraldehído 0.5% en PBS (Jeon, et al., 2002) y se lavaron las membranas 3 veces por 10 min con PBS. Una vez bloqueadas por 30
min con PBS-Tween 0.2%-Leche 10%, se cortaron tiras que se incubaron toda la noche a 4°C con el sueros humano diluido en PBS-Tween 0.2%-BSA 5%-Azida de sodio 0.02% (mujer 1:4000; hombre 1:3000). Después de 6 lavados de 20 min con PBS-Tween 0.2%, las tiras se incubaron por 1h a temperatura ambiente con el segundo anticuerpo biotinilado (Jackson Immunoresearch) diluido en PBS-Tween 0.2%-leche 5% (anti-inmunoglobulinas humanas 1: 100 000; anti-IgG humana 1: 70 000, anti-IgA humana 1: 15 000, anti IgM-humana 1:250 000). Tras 6 lavados de 20 min con PBS-Tween 0.2%, las tiras se incubaron por 1 h a temperatura ambiente con estreptoavidina-peroxidasa (USB) diluida 1:25 000 con PBS-Tween 0.2%. Se colocó el reactivo de quimioluminiscencia después de 4 lavados por 20 min con PBS-Tween 0.2% y se expusieron las placas radiográficas por 5 y 20 min. Tanto el agua como las soluciones ocupadas en el ensayo se filtraron y esterilizaron en autoclave según el caso. La presencia de E4 y E7 se detectó en la misma tira y para sujetos con medición inicial y final, la determinación de anticuerpos se realizó en el mismo ensayo. Un sujeto fue positivo a anti-E4 y/o anti-E7 si presenta una banda en el sitio donde fue colocado el antígeno.
4. Manejo de la información
Los datos provenientes del cuestionario y del examen clínico se colocaron en una base de datos a la cual se le añadieron a los provenientes de la determinación serológica para su análisis estadístico utilizando el programa STATA 10.
5. Análisis estadístico de los resultados
5.1. Definición de variables