UNIVERSIDAD AUTONOMA METROPOLITANA
/DIVISION DE CIENCIAS BIOLOGICAS Y DE LA SALUDA QUIEN CORRESPONDA:
Por medio de la presente se hace constar que el (la):
M. EN B.E. ENRIQUE MENDIETA M. del Departamento de CIENCIAS DE LA SALUD
de la División de Ciencias Biológicas y de la Salud, asesoró el siguiente Servicio Social:
J
Mecanismos de protección al daño genético
/
TITULOMATR~CULA 89226 175
PERIODO
JALUMNO Elizabeth Miranda Tello
JLICENCI ATURA Biología Experimental J
Septiembre 30, 1998 a Noviembre 3, 199>
Se extiende la presente para los fines que al interesado convengan, en la Ciudad de México, D.F. a veinticinco de Noviembre de mil novecientos noventa y ocho.
A T E N T A M E N T E "Casa Abierta al Tiempo"
M. SE
' 3
UNIDAD IZTAPALAPA
-E
m
E:
UNIVERSIDAD AUTONOMA
METROPOLITANA
DIVISION DE CIENCIAS ElOLOGlCAS Y DE
U
SALUDDR. JOSE LUIS ARREDONDO FIGUEROA
DIRECTOR
LIC. JULIO DE LARA ISASSl
COORDINADOR D E SISTEMAS ESCOLARES
Presente
Por este medio se hace constar que el alumno Elizabeth Miranda Tello (89226175) de
la
Licenciatura en Biología Experimental concluyó su Servicio Social. que fue realizado enel Proyecto “Mernnismos de protección a1 daño genético” bajo la asesoría del Biol. Jorge Serment Guerrero y el M. en B.E. Enrique Mendieta M.
Se extiende la presente para los fines que al interesado convengan, a diez de Noviembre de
mil novecientos noventa y ocho.
.
1 ,UNIDAD LTAPALAPA
i
.
Av. MichoacOn y La Purísima, col. Mnüna. D.F. C.P. G934O.TeI: (5) 724-4579. Fax (5) 612-80-83
..
DESARROLLODELPROYECTO
Construcción de cepas mutantes de
E.coli
sensibles a radiaciónINTRODUCCION
La vida de cada organismo y su continuidad de generación en generación depende en gran parte de la información heredable codificada en la doble hebra de DNA.' Estructuralmente el DNA es un polinucleótido cuyos monómeros se unen mediante enlaces fosfodiéster. Cada nucleótido tiene en su composición, una base nitrogenada, un azúcar (desoxirribosa), y una molécula de ácido fosfórico. Las bases nitrogenadas de las que está formado pueden ser 4; entre ellas, dos purinas (adenina y guanina) y dos pirimidinas (citosina y timina).' La secuencia específica de bases a lo largo de la cadena polinucleotidica determina las propiedades biológicas del polimero. La doble hélice puede visualizarse como el resultado del arrollamiento conjunto sobre un eje común de dos cadenas de nucleótidos helicoidales de orientación dextrógira. Ambas cadenas entran en contacto mediante puentes de H que se forman entre los extremos hidrofilicos de las bases.
La relación entre las bases de la doble hélice se llama cornplementariedad, porque cada base de una hebra es correspondida con otra base, por puentes de hidrógeno. Por cada adenina que se proyecta hacia el eje común de la doble hélice, ha de proyectarse una timina desde la cadena opuesta, de manera que llene el espacio entre hebras mediante el establecimiento de dos puentes de H;
mientras que por cada guanina que se proyecte hacia una citosina, se formarán tres (fig. 1).
Las fuerzas hidrofóbicas, el apilamiento y las fuerzas iónicas tienen efecto sobre la estabilidad y conformación de la doble hélice, sin embargo, el DNA es altamente reactivo, y puede interactuar con numerosos agentes físicos y
químicos. Los mecanismos de reparación de daño, son factores de estabilidad, ya que cualquier modificación química a la molécula frecuentemente causa la muerte celular y otras veces puede producir mutaciones cuyo efecto biológico es impredecible 2*3
.
de detectar distorsiones en la estructura de la doble hélice
',
lo que las conduce aponer en marcha diversos mecanismos de reparación que pueden ser de gran trascendencia para lograr una mutagenesis controlada.' En el caso específico de
-
€.coli dichos mecanismos se dividen básicamente en tres sistemas.'*'
..
.Figura 1 .Apareamiento de bases en el ADN. Las bases complementarias son adenina- timina (A-T) o utosina
-
guanina (C-O). Entre A y T existen dos puentes de hidrógeno, mientras que entre C yG hay tres.
I .
,*”
..
...
0,
Mecanismos de reparación del DNA en 1) De reparación contra el daño
Específicos
+
Fotorreacüvación+
Respuesta adaptativa al daño por alquilaciónlnespecíficos
+
Reparación por escisión de bases+
Rep. Por escisión de nucleótidos+
Rep. Metildingida de bases mal incorporadas (mismatch repair) 2) De recuperación de la información+
Reparación por recombinación 3) De tolerancia y reparación inducibles+
Respuesta al estress oxidativo+
Resp. AI choque térmico+
Resp. SOSMecanismos de reparación contra el daño
Específicos. Actúan reconociendo
sólo
cierto tipo de daño en el DNA, y producen enzimas de reparación muy particulares; entre estos tenemos la fotorreactivación y la respuesta adaptativa.a) Fotorreadivación.
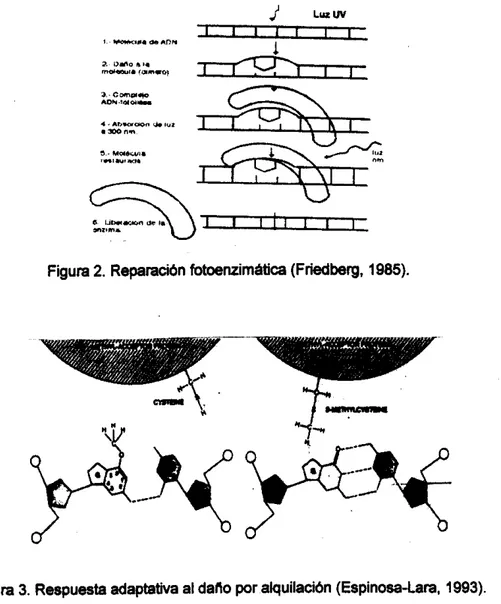
La luz UV es el agente físico que produce un cierto tipo de daño en el DNA, donde dos pirimidinas adyacentes se unen covalentemente formando un anillo de ciclobutano. Son conocidos como dlmeros de pinmidinas y son muy estables aún a pH y temperaturas extremas. Este daño se repara por la acción de una enzima DNA-fotoliasa, la cual contiene dos cromóforos absorbentes de luz, que al momento de captar fotones, funcionan transfiriendo un electrón al dímero; llevando a cabo el rompimiento del anillo de ciclobutano, y por lo tanto la normalización de la molécula.sn ’O (fig. 2).
b)
Respuesta adaDtativa al daño Dor alauilaciónd
i
I
I
11
d
liiil
Y
Figura 2. Reparaci6n fobnzirnatica (Friedberg. 1985).Figura 3. Respuesta adaptaiba al daño por alquilau6n (Espinosa-Lam, 1993)
Inespecíficos. Este tipo de mecanismos puede intervenir en la reparación
de diversos daños, mediante la escisión y eliminación de un tramo de DNA, y posterior reconstitución del mismo a su estado original.
a) ReDaración Dor escisión de bases
En este tipo de reparo una base no complementario se remueve del DNA en tres pasos: primero, una DNA-glicosilasa produce hidrólisis de la unión N- glucosídica entre la desoximbosa y la base, produciéndose un sitio AP (apurínico o apinmidínico); en segundo lugar, enzimas endonucleasas AP, hidrolizan el enlace fosfodiéster adyacente al sitio AP, el azúcar abásico es entonces removido de su sitio; por último, el nucleótido correcto es reemplazado por acción conjunta de las DNA-polimerasa y de la ligasa. (fig. 5).
b)
ReDaración Dor escisión de nucleótidosEsta corrección se efectúa por un complejo proteico que actúa sobre diferentes lesiones de diversos orígenes. En la primera parte, la proteína UvrA se une de manera inespecífica al DNA dafíado formando un complejo inestable; enseguida se une la proteína UvrB y se incrementa la estabilidad del complejo y la especificidad por el sitio dafíado. A continuación una tercera proteína UVIC se une al resto del complejo, provocando dos incisiones a ambos lados de la lesión; una a 8 nucleótidos de distancia del lado 5' y otra a 4 o 5 nucleótidos del lado 3 . Este fragmento se libera con la ayuda de la helicasa 111 creándose un hueco en el DNA. Los nucleótdos faltantes se introducen por la acción de la DNA polimerasa I, empleando como molde la cadena complementaria, y el filamento se sella por la DNA-tigasa.'. 'O (fig. 6).
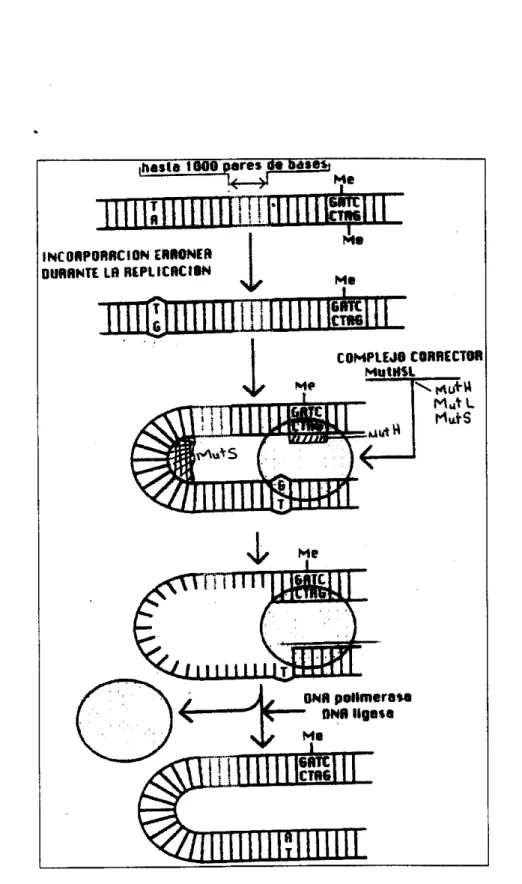
C) ReDaración metildiriaida (mismatch repaiQ
Este sistema elimina los errores que pueden ocurrir durante la síntesis de DNA; normalmente
está
activo y elimina dispandades GT, AC, AA y GG, para elloI
b
I ,.
ig
I'
I'
r .
rm I .
+
I-
Figura 5. Reparaci6n por escisi6n de bases (Friedberg. 1985).
.r 4
I
a
o
.* MeYCOlPORRClON ElñüNER
u n n m LR REPLICWIW
L I I
Figura 7. Reparacan metildirigida de bases mal incorporadas (mismatch repair) (Espinosalara. 1993).
.. .. ..
I
':cii
tB
, 3 'Mecanismos de recuperación de la información
a\ ReParación MX recomb ¡nación
Por medio del mecanismo de recombinación se pueden reparar ciertas anomalías en el DNA. Por ejemplo, cuando hay dímeros de timina, la polimerasa se salta
este
punto, y reinicia la duplicación unos mil nucleótidos después; elespacio no copiado se llena por acción de la proteína RecA, la cual tiene actividad recombinante que permite la transferencia de la región faltante desde el DNA homólogo de doble filamento. AI mismo tiempo ocurre la síntesis del fragmento faltante, iniciando por el extremo 3' de la cadena molde; los extremos entonces se sellan con la DNA-ligasa, produciéndose las dos dobles cadenas independientes.6s'0 (fig. 6).
Mecanismos de tolerancia y reparación inducibles
Los organismos que utilizan 02, están expuestos a los productos de procesos normales como la respiración. Dichos productos incluyen al ion superóxido ( 002 ), per6xido de hidrógeno (oH202) y el ion hidroxilo
(.OH).
Estos pueden actuar sobre Iípidos, proteínas, membranas y sobre cualquier componente del DNA, ya que son altamente reactivos. EnE.coli
se ha observado la acción de diversas enzimas que protegen a la dlula del dano producido por estos agentes. El sistema mas conocido es el controlado por el gen oxyR, que regula en forma positivala
transcripción de 9 proteínas (peroxidasas, catalasas, etc.), y protege a la célula contra radicales oxidantes.b)
ResDuesta al choaue térmicoEs el mecanismo que protege a la dlula contra los daflos producidos por un aumento excesivo en la temperatura, en estas condiciones generalmente se incrementa la síntesis de proteínas; en la respuesta se controla por el gen hptR que es un regulador positivo de 19 genes como el rpoD, que codifica la subunidad sigma de la RNA polimerasa, entre otros:
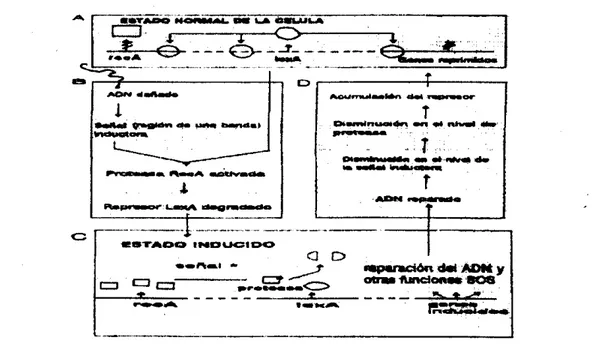
c) Sistema $OS
por recombinación, entre otros. Una vez reparado el daño se pierde la señal de inducción, Red\ regresa a sus funciones normales, aumentan
los
niveles de LexA y se reprime todo el sistema. La consecuencia final del SOS, es una mayor tolerancia al daño, aunada a un aumento general de la frecuencia de mutaciones, pero que incrementa la probabilidad de supervivencia celular.6'" (fig. 9).El cromoensayo es una prueba colorimétrica que constituye un método muy sensible para detectar genotoxicidad, el cual
está
basado en lascaracterísticas inducibles del sistema SOS, y fue ideado por Quillardet y Hofnung, quienes construyeron una cepa de €.coli en la que por medio del bacteriófago vu, fusionaron el gen lacZ dentro de SUA. El primero codifica para la enzima inducible p-galactosidasa y el segundo pertenece a la vía SOS de E.coli, y es uno de
los
primeros que se activa para inhibir la división celular.
Se dice que la P-galactosidasa es una enzima inducible, que en condiciones normales en E m i i se halla a razón de unas 5 moléculas por bacteria, y se requiere para degradar la lactosa en galactosa y glucosa; en las cepas formadas para el cromoensayo, el gen de la lactosa está ausente, por
lo
que lasíntesis de p-galactosidasa quedó asociada al sistema SOS de manera que cuando hay lesiones en el DNA se induce esta vía, y la actividad de la enzima indica a su vez daño genético.
Figura 8. Mecanismo de reparación por recombinación (Fnedberg,l985).
Figura 9. Modelo del Sistema regulador SOS.
A) Estado en crecimiento normal de las células, B) Transición al estado inducido, C) Estado inducido,
D)
Transición al estado normal de crecimiento (Cuapio, 1995).Q
n
d
I
a
ñ
ü
I
z
8
o
I I I I/
-a
I
8
33
s
0
o
i
-4
3 Cea
0m
5
b
C
u
w
‘C Cc
.C ct
t
3. La radiación como agente mutag6nico
.
La radiactividad se define como la desintegración espontánea de los átomos de ciertos elementos, con la emisión simultánea de radiación electromagnética o de partículas. El término radiación indica un fenómeno físico en el cual la energía atraviesa el espacio. La radiación juega un importante papel en los procesos biológicos y en la evolución de la vida en el planeta; puede ser ionizante o no ionizante; lo primero cuando es tal la energía, que puede cambiar un electrón de su órbita; lo segundo, cuando llega al electrón, lo excita, pero no es capaz de moverlo de su órbita.indican a continuación: Existen diferentes productos de
la desintegración radiactiva, los cuales se
La radiación gamma es muy penetrante, debido a su corta longitud de onda e interactua con la materia por tres mecanismos, dependiendo de la energía que pierda: el primero de ellos es el efecto fotoeléctrico, donde la radiación gamma es de baja energía y el fotón desaparece después de expulsar un electrón de un orbital atómico, normalmente un orbital K. El efecto compton se da con rayos
. *.
La radiación ionizante, se ha demostrado que produce efectos directos e indirectos sobre la molécula de DNA, provocando desde daños en las bases hasta rupturas de banda sencilla y doble (en el primero de los casos) o producción de radicales libres (en el segundo) por el efecto de hidrólisis del agua, los wales se ha demostrado que también dañan la moléculas".
Los
mecanismos por los wales contrarresta los tipos de daño producidos por la radiación ionizante en su DNA, están regulados por una familia de genes llamados rec, más aún, el tipo de daño inducido por los radicales libres es tolerado por el mecanismo de respuesta al estrés oxidativo en el cual intervienen genes como oxyR'.OBJETIVO GENERAL
+
Construir y aislar cepas mutantes de la enterobacteriau ,
cuyasensibilidad al daño genético por radiación gamma, pueda ser detectada por el
método colorirnétrico de cromoensayo.
OBJETIVOS PARTICULARES
+
Construir y aislar mutantes sencillos deficientes en el gen recN.+
Construir y aislar mutantes dobles deficientes enlos
genes recN, oxyR.+
Aplicar técnicas de propagación y aislamiento de cultivos bacterianos.+
Aplicar técnicas de lisado y titulación viral, transducción y aislamiento de mutantes bacterianos.l
,..
p
METODOLOGIA
Se llevó a cabo en tres partes:
a) Construcción de cepas
.
Preparación del lisado de PI
Método de transducción
1
Aislamiento de transductantes Transducción genera Titulación del mismob)
CaracterizaciónAntibióticos
Pruebas de sensibilidad Mitomicina C (MMC)
Radiación UV
Ensayo cualitativo de la p-galactosidasa a HzOz
c) Inducción de las funciones SOS Cromoensayo con radiación gamma
a) Construcción de cepas.
En la siguiente tabla se citan las cepas utilizadas para la construcción de mutantes; bacterias donadoras, receptoras y las cepas esperadas.
I
Igual a PQ30 pero AoxyR4,btuB,sin Tnl O
IN250 X PQ30
Preparación de lisado del faao P1
Se sembró la bacteria donadora en medio Luria Bertrani LB (líquido), adicionado con el respectivo antibidtico
(si
es resistente a alguno), y se incubó por 24 horas. Se tomaron 0.6ml
de bacteria y 0.25ml
de suspensión de fago P1 (preparado a partir deEmii
C600 a concentración de 4.0 x10'
partículasformadoras de placa por mi), y se mezclaron en un matraz de 250 ml, conteniendo 10
ml
de LB líquido+
0.025ml de KCI al 0.05M; incubándose de 2 a 3 horas hasta la lisis (cuando el líquido se observa casi transparente). Se agregaron 0.1 a 0.2 mlde cloroformo y se incubó con agitación por 10 minutos, se centnfugó a 10
O00
I **
Marcador
Ampicilina (A) Tetraciclina (T)
H 2 0 2
Mitomicha C (MMC) Radiación UV
p
Concentración
1 Omglml 1 Omg/ml 2pgglml 2pglml
Diferentes dosis, tiempoldependientes
B
n
I c
r
l
.Il
Titulación del faao PI
Se cultivó
Mi
en medio líquido LB, durante 24 horas y se preparan cajascon medio LB sólido. Se preparan tubos de ensaye con 2 ml de solución SM para
hacer diluciones (-2, 4, -6, -7 y -8) con el fago recién obtenido. Posteriormente se
agregaron 0.1 ml de bacteria C600 y 0.1 ml de las diluciones (-6, -7, -8), y se colocaron en bario multiblock a 37°C. A cada uno de los tubos se les agregaron 2.5 rnl de agar de superficie, agitando perfectamente, y se vacio todo a placas con medio LB sólido. Una vez que gelificó se incubaron las cajas a 37°C durante 24
horas y posteriormente se realizó el conteo de placas de lisis para determinar la concentración del fago por m1.14
Técnica de transducción Y aislamiento
Se preparó un cultivo de 24 horas de la bacteria receptora, en medio LB
líquido con el antibiótico al cual tiene resistencia. Se prepararon cajas con medio
LB selectivo, conteniendo los antibióticos que seleccionan contra las bacterias
donadoras y receptoras. Se centrifugó el cultivo de 24 horas a 10
O00
rpm durante10
minutos; se desechó el sobrenadante y se resuspendieron las bacterias ensolución MC. Se incubo con agitación constante durante
15
minutos. Semezclaron volúmenes iguales de bacteria y fago a diluciones (-2, 4, -6) y se incubaron otros 5 minutos. Se sembraron 0.1 mi de esta mezcla en cada una de las cajas y se incubaron de 24 a 48 horas a 37' C. AI cabo del tiempo de incubación, se examinaron las cajas y se aislaron las colonias visibles, que son los presuntos transductantes; éstos fueron sembrados en medio líquido y después de 24 horas de incubación se aislaron en cajas individuales con medios selectivos para resistencia a antibiótico~'~
.
b) Caracteriracibn.
Para caracterizar los transductantes aislados se hicieron pruebas de sensibilidad a varios agentes, así como ensayos cualitativos para la enzima
p-
galactosidasa.
- ' , .
I
I
Compuestos
1
2
3
4
7
10 1 ml de medio LB
+
.O2 ml de bacteria7-12 1 ml de medio LB+lactosa 3% + 0.02
ml
de bacteria13-1 8 1
ml
LB+lactosa 3%+
Acido Nalidixico. (2pdml)+
.O2
ml
de bacteria1
ml
LB+lactosa 3% + MMC (.052p9/ml ) +0.02 mlde bacteria -
19-24
c) Inducción de las funciones SOS con radiación gamma.
Inducción SOS (cromoensavo)
Se mantuvo
al
transductante en crecimiento nocturno en LB con antibióticoy se tomó una alícuota de 0.2
ml
de bacteria en 10ml
deLB
para llevarla acrecimiento logarítmico hasta 0.5 de absorbancia. Se centrifugó la muestra por 10
minutos a 10,000 rpm y
el
botón se resuspendi6 en igual volúmen de buffer defofatos (0.02 M). Se pusieron 2 ml de suspensión en cada tubo
y
se irradiaron adiferentes dosis (8, 16, 32, 64 y 100 Gy).
De manera simultánea se pusieron
2
ml de medio LB en estufay
una veza 37%, y luego de este lapso se le pusieron 3 gotas de cloroformo, el cual se dejó actuar por 2 minutos.
Se colocaron en una gradilla dos series de tubos para colorímetro; la primera serie contenía 2.7ml del amortiguador específico para p-galactosidasa y la segunda 2.7 ml del amortiguador para fosfatasa alcalina, a los cuales se les agregaron 0.3 ml de bacteria. Se agregaron finalmente 0.5
ml
del sustrato específico para cada enzima ONPG' para la p-galactosidasa y PNPP" para la fosfatasa alcalina. AI ser hidrolizados por las enzimas respectivas se liberó un cromóforo que produjo una tonalidad amarilla.Una vez agregado el sustrato, se incubó a 37% hasta que se alcanzó una coloración amarilla continua, y se midió la absorbancia de cada muestra con un colorímetro, así como el tiempo en que se realizó la lectura. La coloración indica la actividad de las enzimas,
lo
que en el caso de la p-galactosidasa es función dela cantidad de datio producido en el
Una vez obtenidos los valores de absorbancia se calculó la relaci6n entre las unidades de actividad enzimática de p-galactosidasa y de fosfatasa alcalina mediante la fórmula:
A4mp = t p
FR
=
donde:&lQp *
@
&
p
=
Absorbancia a 420nm de p-galactosidasa
hm
P=
Absorbancia a 420 nm de fosfatasa alcalinatp
=
Tiempo de incubación de p-galactosidasa después de agregado el sustrato tP=
Tiempo de incubación de fosfatasa alcalina después de agregado el sustratoSe obtuvieron los valores R, para cada tratamiento y para el testigo, y con estos datos se calculó el factor de inducción (FI), que es el cociente del R de cada tratamiento entre el del testigo.
F.R. tratado
F.R. testigo
F.I.
= -
* O
-
nitrofenil- p-
D-
galactopimnosaRESULTADOS Y CONCLUSIONES
+
Los mutantes elegidos por su mayor inhibición en las pruebas de sensibilidad, fueronsometidos al estudio cualitativo de la enzima P-galactosidasa; aquí la revelación del color amarillo en
los
pozos que contenían MMC o Ac. Nal., nos hizo elegir de entre las aproximadamente 500 cepas, aquellas que produjeron mayor acidez al medio, ya que esta señal es indicativa de la síntesis de tal enzima.+
En las gráficas 1-5, se muestranlos
factores de inducción de las 5 cepas mutantes elegidas, a las cuales seles
aplicó el m4todo de cromoensayo, luego de tratarlas con diferentes dosis de radiación gamma. En todas las gráficas se omitieronlos
datos para 16 y 32 Gy, ya que
el
factor de inducción presentó un comportamiento proporcional ( a mayor dosis mayor factor de inducción).+
Los
mutantes: 20-111 (recN) y 13-111, 13-IV, 15-1 y 15-V (recN, oxyR), fueronescogidos por tener factores de inducción mayores de 9 para
el
primero, y hasta de 41 para la cepa 13-111 (gráfica 2).+
Con estos resultados observamos que se logró la obtención de un mutante sencillo(2O-lll), cuya sensibilidad al efecto de la radiación gamma fue
el
mas considerable;n.
-.
Expuirnento: IRRADIACION CON GAMMAS
O 20 40 80 80
Doal. oy
I '7
I
..
Tmnaduotinb 15-111 mcN,oayR
Exparimu~kx IRRADlAClON CON GAMMAS
45
40
35
30
c
0
3
252
d
j
2oU
15
10
5
O
O 20 40 80 e4
Tran.duc<.llb 134V NCN, Ow
."
Tniuduct.nt. 164 ncN.oxyR
Transductant. 154 mN,oxyR
Exprlrnenbx IRRADIACION CON OAMMAS
16
14
12
10
P
- a 8
i
u.
8
4
2
BIBLIOGRAFIA
1. Howard-Flanders,P.(1981).lndu~ble repair of DNA. Sci. Am.245256-264.
2. Devlin, T.M., (1985) Bioqulmica. Reverté. Tomo 1. Barcelona, 1099 pp.
3. EspinosaLara, A., (1993). Mecanismos de reparación de datios a la molécula del
Acido Desoximbonudeiw. Rev. Lat. Amer. Microbiol., 351 17-1 36.
4. Suárez, S., (1997). Influencia de
los
genes reC0 y red en la respuesta a radiaciónUV y algunos mutágenos químicos. Tesis de Licenciatura. Facultad de Ciencias.
U.A.E.M. 74 pp.
5. Cuapio,
P.,
(1995). Construcción y aislamientode
mutantes deW
sensibles aradiación. Tesis de licenciatura. Facultad de Estudios Superiores "Zaragoza"
U.N.A.M., 50 pp.
6. Sennent, J., (1992). Inducción por radiación gamma de las funciones SOS en cepas
de
€.coli
con diferentes capacidades de reparación. Tesis de Licenciatura.Facultad de Ciencias, U.N.A.M. 50
pp.
7. Sancar, A. y Sancar, G, (1988). DNA repair enzymes. Ann. Rev. Biochem 57:2907.
8.
Sancar, A., (1994). Mechanism of DNA excision repair. Science 266:1954-1956.9. Friedberg, E.C. (1985). DNA repair. W.H. Freeman, Nueva
York.
613 pp.1 O. Modrich,
P.,
(I 994). Mismatch repair, genetic stability and cancer. Science.ll.Walker, G.C., (1987). The SOS response of €.coli. En: Escherichia coli and
Salmonella fyphimutium. Cellular and Molecular Biology. Niedhardt, F.C., et-al. Eds.
Am. Soc. Microbiol. 2:1346-1357. Washington. DC.
lZ.Quillardet, P.
Y
M. Hofnung., (1985). The SOS chromotest, a colorimetric bacterialassay for genotoxins: procedures. Mutat. Res. 147:65-78.
266:1959-I 960.
13.Campbell, R., (1990). El manejo de las radiaciones nucleares. Fondo de Cultura
14. Miller, J.H., (1972). Experiments in molecular Genetics. Cold Spring Harbor. New
Económica, México, D.F.
Luria Bertrani líquido (todo exepto *)
Buffers
Ys
olucionespH 7.4 y h i d~
61.62 250 mi
CaClT
Agua bidestilada CaC12
I
I
1000 1 l l . O g mlTris 1M*
I
Tris hidroximetilaminometanoI
121.0 a-
pH 7.4
Agua bidestilada IO00 ml
100 ml
a
Amortiguador P para fosfatasa alcalina
sns
I I nTris hidroxiaminometano (C$lrrNOJ)
I
121 g--
-
I ISe ajusta a pH 8.8 y se afora a un I ¡ ¡