UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA
La Universidad Católica de Loja
ÁREA BIOLÓGICA
TÍTULO DE INGENIERO EN INDUSTRIAS AGROPECUARIAS
Evaluación de antioxidantes provenientes de subproductos en
productos procesados (bebidas)
TRABAJO DE TITULACIÓN
AUTORA:
Ludeña Rojas, Michelle María
DIRECTORA:
Guamán Balcázar, María del Cisne, Mgtr.
II
APROBACIÓN DE LA DIRECTORA DEL TRABAJO DE TITULACIÓN
Magister
María del Cisne Guamán Balcázar
DOOCENTE DE LA TITULACIÓN
De mi consideración:
El presente trabajo de titulación: “Evaluación de los antioxidantes provenientes de subproductos en productos procesados (bebidas)”, realizado por Michelle María Ludeña Rojas, ha sido orientado y revisado durante su ejecución, por cuanto se aprueba la presentación del mismo.
Loja, septiembre de 2015
f)_____________________________
III
DECLARACIÓN DE AUTORÍA Y CESIÓN DE DERECHOS
―Yo Ludeña Rojas Michelle María, declaro ser autora del presente trabajo de titulación: “Evaluación de antioxidantes provenientes de subproductos en productos procesados (bebidas)”, de la Titulación de Ingeniera en Industrias Agropecuarias, siendo María del Cisne Guamán Balcázar, directora del presente trabajo; y eximo expresamente a la Universidad Técnica Particular de Loja y a sus representantes legales de posibles reclamos o acciones legales. Además certifico que las ideas, conceptos, procedimientos y resultados vertidos en el presente trabajo investigativo, son de mi exclusiva responsabilidad.
Adicionalmente declaro conocer y aceptar la disposición del Art. 88 del Estatuto Orgánico de la Universidad Técnica Particular de Loja que en su parte pertinente textualmente dice: ―Forman parte del patrimonio de la Universidad la propiedad intelectual de investigaciones, trabajos científicos o teóricos y tesis de grado o trabajos de titulación que se realicen con el apoyo financiero académico o institucional (operativo) de la Universidad‖
f:____________________________
Ludeña Rojas Michelle María
IV
DEDICATORIA
V
AGRADECIMIENTO
A Dios y a mi familia por ser el soporte de mi vida.
A la Universidad Técnica Particular de Loja, principalmente a la Titulación de Ingeniería en
Alimentos, al personal docente por su orientación y enseñanza, de manera especial a la
Ing. María del Cisne Guamán por su amabilidad y predisposición a ayudar.
VI
ÍNDICE DE CONTENIDOS
APROBACIÓN DE LA DIRECTORA DEL TRABAJO DE TITULACIÓN ... II DECLARACIÓN DE AUTORÍA Y CESIÓN DE DERECHOS ... III DEDICATORIA ... IV AGRADECIMIENTO ... V ÍNDICE DE CONTENIDOS ... VI
RESUMEN ... 1
ABSTRACT ... 2
INTRODUCCIÓN ... 4
1. REVISIÓN DE LITERATURA ... 5
1.1 Mandarina ... 6
1.2 Subproductos ... 6
1.3 Antioxidantes ... 7
1.4 Compuestos fenólicos y capacidad antioxidante ... 8
1.5 Métodos de cuantificación de fenoles totales y capacidad antioxidante ... 9
1.5.1 Determinación de fenoles totales por el método Folin-Ciocalteau. ... 9
1.5.2 Capacidad secuestrante de radicales libres mediante el método ABTS. ... 10
1.5.3 Poder antioxidante de reducción férrica FRAP. ... 10
1.5.4 Capacidad secuestrante de radicales libres mediante el método DPPH. ... 10
2. OBJETIVOS DEL PROYECTO ... 11
2.1 General ... 12
2.2 Específicos ... 12
3. MATERIALES Y MÉTODOS ... 13
3.1 Muestras ... 14
3.1.1 Materia prima ... 14
3.1.2 Subproducto (obtención de agua de lavado) ... 14
3.1.3 Elaboración de bebida con subproductos ... 15
3.2 Método experimental ... 16
3.2.1 Preparación de muestra ... 16
3.2.2 Determinación de fenoles totales. ... 17
3.2.3 Cuantificación de actividad antioxidante. ... 17
3.2.4 Determinación de retención antioxidante. ... 21
3.2.5 Caracterización de la bebida de mandarina con subproductos. ... 21
3.3 Diseño experimental ... 21
VII
4.1 Caracterización de materia prima y bebida ... 23
4.1.1 Análisis fisicoquímico ... 23
4.1.2 Análisis del contenido de fenoles totales y capacidad antioxidante ... 24
4.2 Estabilidad de antioxidantes frente al proceso de pasteurización ... 26
4.3 Estabilidad de características físico químicas frente al almacenamiento. ... 28
4.4 Estabilidad de antioxidantes frente al almacenamiento ... 30
CONCLUSIONES ... 35
RECOMENDACIONES ... 36
BIBLIOGRAFÍA ... 37
VIII
ÌNDICE DE FIGURAS
Figura 1. Estructura de la fruta de mandarina ... 6
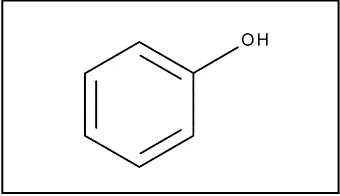
Figura 2. Estructura química del fenol ... 8
Figura 3. Mandarinas (Citrus reticulata) ... 14
Figura 4. Subproducto………..14
Figura 5. Agua de lavado del subproducto ... 14
Figura 6. Proceso de elaboración de la bebida con subproductos ... 16
Figura 7. Determinación de fenoles totales mediante el método de Folin-Ciocalteau. ... 17
Figura 8. Determinación de actividad antioxidante mediante método ABTS. ... 18
Figura 9. Determinación de actividad antioxidante mediante método DPPH ... 19
IX
ÍNDICE DE GRÁFICAS
Gráfica 1. Sólidos solubles de la bebida, comparada con zumos de fruta. ... 23 Gráfica 2. pH de la bebida, comparado con zumos de fruta. ... 24 Gráfica 3. Acidez de la bebida, comparada con zumos de fruta. ... 24 Gráfica 4. Análisis de fenoles totales en la bebida con subproductos, frente al proceso de
X
ÍNDICE DE TABLAS
Tabla 1. Clasificación de los principales compuestos fenólicos de origen vegetal, de acuerdo a su
estructura química básica. ... 9
Tabla 2. Pruebas del subproducto aplicado en la bebida. ... 15
Tabla 3. Formulación de la bebida con subproducto. ... 15
Tabla 4. Caracterización fisicoquímica del zumo, subproducto y bebida. ... 23
Tabla 5. Análisis antioxidante (ABTS, FRAP, DPPH) en zumo, subproducto y bebida. ... 24
Tabla 6. Retención antioxidante frente al proceso de pasteurización. ... 27
Tabla 7. Caracterización fisicoquímica de la bebida y medición de estabilidad durante el tiempo de almacenamiento. ... 29
Tabla 8. Retención antioxidante frente al proceso de almacenamiento. ... 31
XI
ÍNDICE DE ANEXOS
Anexo A. Cuantificación de fenoles totales ... 44
Anexo B. Cuantificación de capacidad antioxidante por el método ABTS ... 48
Anexo C. Cuantificación de capacidad antioxidante por método DPPH ... 53
Anexo D. Cuantificación de capacidad antioxidante por método FRAP ... 56
Anexo E. Cálculo de porcentaje de retención antioxidante ... 59
Anexo F. Determinación de características fisicoquímicas ... 60
1 RESUMEN
El objetivo del presente proyecto fue determinar la estabilidad de antioxidantes frente al proceso de pasteurización y tiempo de almacenamiento en una bebida elaborada con subproductos de mandarina (agua de lavado). La bebida se pasteurizó a 93ºC por 30 segundos y se almacenó durante 2 meses a temperatura de refrigeración (0-5ºC). Se determinó fenoles totales por el método Folin-Ciocalteau y actividad antioxidante por los métodos: ABTS, DPPH, y FRAP. Los compuestos fenólicos y la capacidad antioxidante medida por el método DPPH no mostraron cambios después del proceso de pasteurización, a diferencia de los métodos ABTS y FRAP donde se observó una ligera disminución. El contenido de compuestos fenólicos y la capacidad antioxidante determinada por los métodos ABTS y FRAP disminuyeron 8,5%, 11,9% y 19,7% respectivamente, mientras que la capacidad antioxidante medida por el método DPPH mostró un aumento de 8,8%, al final del almacenamiento.
2 ABSTRACT
The object of this project was to determine the antioxidant stability facing the pasteurization process and storage time in an elaborated beverage with sub-products of mandarin (waste water). The drink was pasteurized at 93°C for 30 seconds and stored for 2 months at a refrigeration temperature (0-5ºC).Total phenols were determined by the Folin-Ciocalteau method and antioxidant activity using ABTS, DPPH and FRAP methods. Phenolic compounds and antioxidant capacity measurement used by the DPPH method did not show changes after the pasteurization process, unlike the ABTS and FRAP methods, which showed a slight decreased. The content of phenolic compounds and antioxidant capacity determined by ABTS and FRAP methods decreased 8.5 %, 11.9 % and 19.7 % respectively, while the antioxidant capacity as measured by DPPH method showed increased of 8,8% at the end of storage.
3
LISTA DE ABREVIATURAS
ABTS: ácido 2, 2`Azinobis-3-etil-benzotiazolin-6 sulfónico
DPPH: 2,2-difenil-1-picrilhidrazilo
dd: destilada
Et: estándar
ET: equivalentes de Trolox
FRAP: poder antioxidante de reducción férrica
GAE: equivalentes de ácido gálico
HCl: ácido clorhídrico
MeOH: metanol
mL: mililitro
mg: miligramo
N: normal
nm: nanómetro
L: litro
rpm: revoluciones por minuto
SP: solución patrón
ST: solución de trabajo
T: temperatura
TPTZ: 2,4,6-Tripyridyl-s-Triazine
t: tiempo
µmol: micromol
µg: microgramo
4
INTRODUCCIÓN
Los cítricos son las frutas más cosechadas en el mundo (Marín, Soler-Rivas, Benavente-García, Castillo, & Pérez-Alvarez, 2007). En la actualidad su producción mundial se encuentra por encima de las 120 millones de toneladas, parte de esta producción es destinada a la comercialización como fruta fresca y un 40% a la industria de zumos, proceso que genera aproximadamente 20 millones de toneladas de subproductos (Londoño, Sierra, Álvarez, Restrepo, & Pássaro, 2012) como cáscara, pulpa adherida y semillas, representando del 40 al 50% del peso total de la fruta (Arthey, Ashurst, & González, 1997). Estos subproductos son destinados en parte a la elaboración de abono orgánico y alimentación animal, el resto constituye un serio problema de contaminación ambiental (Bozell & Petersen, 2010).
Las frutas cítricas son una gran fuente de compuestos bioactivos, como antioxidantes, los cuales juegan un papel muy importante en la nutrición del ser humano (Fernández, Zhi, Aleson, Pérez, & Kuri, 2005); los flavonoides cítricos se encuentran relacionados con propiedades saludables para el ser humano, actuando como anticancerígenos, antivirales, y antiinflamatorios (Kaur & Kapoor, 2001). Actualmente se da mucho énfasis en el estudio de los subproductos cítricos, descubriéndose que estos presentan una alta cantidad de compuestos fenólicos (mayoritariamente flavonoides) y capacidad antioxidante (Viuda‐ Martos, Fernandez‐Lopez, Sayas‐Barbera, Sendra, & Perez‐Alvarez, 2011), de igual forma, representan una importante fuente de aceites esenciales, pectinas, pigmentos naturales, y otros (Milena, Montoya, & Orozco, 2008; Vargas & Pinargote, 2001). Según Martínez et al. (2014) los subproductos pueden representar un contenido de compuestos bioactivos similar o incluso mayor que el producto comestible final.
5
6 1.1 Mandarina
La mandarina (Citrus reticulata) es un fruto del árbol mandarino, descendiente de la familia
de las rutáceas, del genero Citrus (Pamplona, 1995). Pertenece al grupo de los hesperidios (Campero, Frías, Zamora, Tereschuk, & Albarracín, 2009), y en su estructura se pueden diferenciar partes como el flavedo, albedo, endocarpio y semillas (ver figura 1); en el endocarpio (pulpa) se encuentran numerosos gajos contenidos de zumo (Micó, 2014). Este fruto se encuentra compuesto principalmente por agua, sin embargo en su composición despunta la fibra dietética con un contenido de 1,8 g/100g y los compuestos fenólicos con 192 mg Eq AG/100g (Hernandez, 2010), entre sus componentes destacan algunas sustancias fitoquímicas como flavonoides, limonoides y estructuras vitamínicas con actividades antioxidantes, como ácido ascórbico, tocoferoles y carotenoides, representando de este último un elevado contenido, de los cuales predominan el α -caroteno, β-criptoxantina y el β-caroteno (Gutiérrez, 2012).
De la producción mundial de cítricos, el 30,6% es de mandarina, la mayor parte de esta producción proviene de países como China, Brasil, Japón, Marruecos y Estados Unidos, siendo una de las frutas más apetecidas en el mundo, por su sabor y aroma (López, 2014). Según el III Censo Nacional Agropecuario MAGAP (2000), en Ecuador existe una superficie plantada de 12.873 hectáreas, con una producción de 10.731 toneladas de mandarina.
Figura 1. Estructura de la fruta de mandarina
Fuente: Londoño , Sierra, Álvarez, Restrepo, & Pássaro, (2012)
1.2 Subproductos
En los procesos agroindustriales se generan una importante cantidad de residuos orgánicos, a los cuales llamamos subproductos (Olivera, 2013). Estos ―residuos‖ generados por plantas y animales no son clasificados como peligrosos, sin embargo generan un importante volumen de desechos, que en parte son destinados a la elaboración
Flavedo
Albedo
Pulpa
7
de abono y alimentación animal (J. Hernández, 2013). Además de estos usos, los subproductos provenientes de frutas pueden ser empleados en la alimentación humana, obtención de biogás, extracción de aceites esenciales, pectinas, flavonoides y otros (Milena et al., 2008). Particularmente los cítricos son destinados a la elaboración de jugos, originando grandes cantidades de subproductos (cáscara, pulpa, semilla) (Viuda et al., 2009), los cuales poseen entre sus principales componentes: agua, azúcares solubles, fibra, ácidos orgánicos, aminoácidos, minerales, aceites esenciales, flavonoides y vitaminas; encontrándose en distintas cantidades, dependiendo de factores como estado de madurez y fracción de la fruta (Londoño et al., 2012). Martínez, Hualpa & Figueroa (2014) sostienen que en cítricos como limón, naranja y mandarina se desecha del 15 al 32% de la fruta (albedo y flavedo), los cuales abarcan altas cantidades de sustancias como fibra dietaría, antioxidantes y antiinflamatorios.
El albedo, flavedo y semillas de los cítricos poseen un alto contenido de compuestos bioactivos. Partes como los sacos del zumo son un subproducto comestible que se puede usar para formular zumos especiales o bebidas sintéticas con contenidos significativos de pectina y fibra alimentaria (Mazza, 2000). Además, las cortezas cítricas presentan un elevado valor en contenido de carotenoides y antiocianinos, los cuales aportan los colores rojo-naranja y rojo oscuro-azul, respectivamente, siendo de enorme importancia en la Industria en zumos y bebidas sin alcohol. Por tal razón la extracción de pigmentos de estos residuos ha sido investigada, para su aprovechamiento industrial (Arthey et al., 1997).
Estudios demuestran que los subproductos de mandarina poseen una alta cantidad de fibra dietaria total, además de buenas propiedades tecno-funcionales como capacidad de retención de agua, capacidad de retención de grasa y capacidad de hinchamiento (Maldonado, 2014; Pérez, 2014). Es así como subproductos ricos en fibra dietaria y antioxidantes son regularmente incorporados en alimentos como bebidas, cárnicos, productos de panificación entre otros y su uso está relacionado con sus propiedades nutricionales y tecnológicas (Martínez et al., 2014).
1.3 Antioxidantes
En alimentos como los cítricos, están presentes muchas sustancias capaces de evitar o reducir la intensidad de las reacciones de oxidación, estas sustancias se denominan ―antioxidantes‖ y se encuentran en los alimentos ya sea por su naturaleza o producto de su procesamiento (Damodaran, Parkin, & Fennema, 2010).
8
(radicales libres), los cuales pueden reaccionar con algunos compuestos presentes en el organismo, llegando a producir un daño en la célula (Venereo, 2002). Los radicales libres son moléculas inestables, que tienen uno o más electrones desapareados en su última orbita (Patiño, 2000), siendo moléculas altamente reactivas; es decir cuando un electrón carece de pareja, una molécula se une fácilmente a este para volverse una molécula estable, y como producto se obtiene una reacción química, la cual puede producir cambios irreversibles en el organismo (Balch, 2000). Se ha asociado a los radicales libres con enfermedades como la artritis reumatoidea, enfermedad de parkinson, e intoxicaciones por fármacos como el paracetamol, sin embargo, se encuentran implicados también en procesos naturales tales como la práctica deportiva y el envejecimiento (M. Hernández & Sastre, 1999).
Los antioxidantes confieren una protección contra los radicales libres, neutralizándolos al unirse a sus electrones libres; de tal manera que sus componentes se han asociado con un menor índice de mortalidad por cáncer y enfermedades del corazón (Balch, 2000; Ordoñez-Santos, Hurtado Aguilar, Ríos Solarte, & Arias Jaramillo, 2014). Entre las sustancias antioxidantes se encuentran las vitaminas, flavonoides, antocianinas, carotenoides y ácidos fenólicos (Kaur & Kapoor, 2001).
1.4 Compuestos fenólicos y capacidad antioxidante
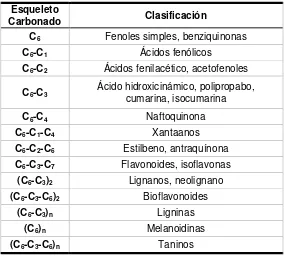
[image:19.595.204.374.619.717.2]Los compuestos fenólicos constituyen una de las más abundantes familias del reino vegetal, siendo los productos más importantes del metabolismo secundario de los vegetales, y se encuentran presentes en muchas frutas, vegetales y bebidas, contribuyendo con el color y propiedades sensoriales como el amargor y la astringencia (Macheix & Fleuriet, 1990); forman parte de un grupo muy heterogéneos de unos 10,000 compuestos, comprendiendo desde simples moléculas como el ácido fenólico hasta compuestos altamente polimerizados como los taninos (ver tabla 1) (Balch, 2000; Hernandez, 2010; Taiz & Zeiger, 2006). En cuanto a su estructura química, ―son sustancias que contienen un anillo aromático en común, con uno o más grupos hidroxilo‖,(Ver figura 2) (M. Hernández & Sastre, 1999).
[image:20.595.145.432.100.358.2]
9
Tabla 1. Clasificación de los principales compuestos fenólicos de origen vegetal, de acuerdo a su estructura química básica.
Esqueleto
Carbonado Clasificación
C6 Fenoles simples, benziquinonas C6-C1 Ácidos fenólicos
C6-C2 Ácidos fenilacético, acetofenoles
C6-C3 Ácido hidroxicinámico, polipropabo, cumarina, isocumarina
C6-C4 Naftoquinona
C6-C1-C4 Xantaanos
C6-C2-C6 Estilbeno, antraquínona C6-C3-C7 Flavonoides, isoflavonas
(C6-C3)2 Lignanos, neolignano (C6-C3-C6)2 Bioflavonoides
(C6-C3)n Ligninas
(C6)n Melanoidinas (C6-C3-C6)n Taninos Fuente:Hernandez (2010)
El parámetro que determina la capacidad que tiene un compuesto antioxidante para evitar que su sustrato se oxide se denomina ―actividad antioxidante‖ (Restrepo, Narváez, & Restrepo, 2009), siendo otorgada principalmente a los flavonoides y el ácido ascórbico en las frutas cítricas (Fernández et al., 2005). Estudios han demostrado que tanto la parte comestible de la fruta, como los subproductos generados por estas (cáscaras, tejido), poseen una alta capacidad antioxidante (Ghasemi, Ghasemi, & Ebrahimzadeh, 2009; Gutiérrez, 2012).
1.5 Métodos de cuantificación de fenoles totales y capacidad antioxidante
1.5.1 Determinación de fenoles totales por el método Folin-Ciocalteau.
10
1.5.2 Capacidad secuestrante de radicales libres mediante el método ABTS.
El radical ABTS•+ es generado químicamente por la reacción estequiométrica del persulfáto
de potasio y ABTS, dando una coloración verde-azulado. Este radical reacciona con los compuestos polifenólicos contenidos en la muestra, oxidándolos y generando la formación de ABTS (incoloro). De esta manera se obtiene la decoloración del ABTS•+, la cual es
directamente proporcional a la actividad antioxidante (Arnao, Cano, & Acosta, 2001; Re et al., 1999).
1.5.3 Poder antioxidante de reducción férrica FRAP.
Es un método indirecto, basado en el poder de un antioxidante para reducir el complejo férrico en ferroso, evaluando la capacidad reductora por transferencia de electrones (Mercado, Carrillo, Wall, López, & Álvarez, 2013). Cuando el ion férrico es reducido a su forma ferrosa, adquiere un color azul que presenta un máximo de absorción de 593nm (Benzie & Strain, 1996). Es una reacción de corta duración, presentando una mayor intensidad de color azul, cuanto mayor contenido antioxidante posee la muestra analizada.
1.5.4 Capacidad secuestrante de radicales libres mediante el método DPPH.
11
12 2.1 General
Determinar la estabilidad de antioxidantes en una bebida elaborada con subproductos de mandarina, frente al proceso de pasteurización y tiempo de almacenamiento.
2.2 Específicos
Cuantificar fenoles totales y capacidad antioxidante (ABTS, DPPH, FRAP) en el zumo y subproducto de mandarina.
Cuantificar fenoles totales y capacidad antioxidante (ABTS, DPPH, FRAP) en la bebida elaborada con subproductos de mandarina, antes y después del proceso de pasteurización.
13
14 3.1 Muestras
3.1.1 Materia prima
Se trabajó con mandarina (Citrus reticulata), adquirida en el Mercado Central de la ciudad
[image:25.595.301.461.553.703.2]de Loja. Se realizó una limpieza superficial con abundante agua para su posterior empleo. Las mandarinas limpias fueron descascaradas para hacer uso de la pulpa, de la cual se realizó la extracción del zumo.
Figura 3. Mandarinas (Citrus reticulata) Fuente: La autora
3.1.2 Subproducto (obtención de agua de lavado)
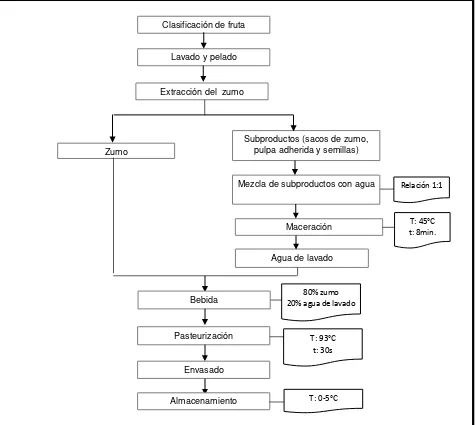
Excluyendo la cáscara por su fuerte sabor amargo, se trabajó con el resto de subproductos de la extracción del zumo: sacos de zumo, pulpa agotada y semillas. Para obtener el agua de lavado se realizó una maceración, utilizando condiciones previamente determinadas por el grupo de investigación del Departamento de Ciencias Agropecuarias y Alimentos de la UTPL. Se mezclaron los subproductos con agua (relación 1:1), y se mantuvieron a 45ºC durante 8 minutos, en constante agitación; posteriormente el extracto fue filtrado usando coladores de 2 mm de diámetro aproximadamente, obteniéndose así el agua de lavado.
Figura 4. Subproducto Figura 5. Agua de lavado del subproducto Fuente: La autora Fuente: La autora
15
3.1.3 Elaboración de bebida con subproductos
Se desarrollaron cuatro formulaciones de bebida, con diferentes porcentajes y partes de subproducto. De las cuatro pruebas realizadas, la bebida que presentó mejor olor, sabor y color, fue la número uno (ver tabla 2), debido a que presenta el menor porcentaje de amargor, el cual es aportado principalmente por la corteza.
Tabla 2. Pruebas del subproducto aplicado en la bebida.
Nro. Parte usada del subproducto Agua de lavado % Zumo %
1 Sacos de zumo, pulpa agotada y semillas 20 80
2 Sacos de zumo, pulpa agotada y semillas 40 60
3 Corteza, sacos de zumo, pulpa agotada y semillas 30 70 4 Corteza, sacos de zumo, pulpa agotada y semillas 10 90 Fuente: La autora
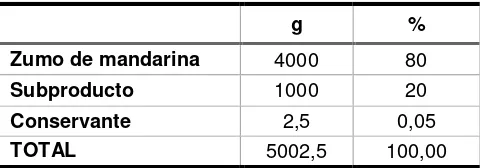
[image:26.595.167.407.376.460.2]En la formulación de la bebida se adicionó como conservante sorbato de potasio, para alargar su conservación. En la tabla 3 se detalla la formulación.
Tabla 3. Formulación de la bebida con subproducto.
Fuente: La autora
La bebida se sometió a un proceso de pasteurización a 93ºC durante 30 segundos (Cano, Sánchez-Moreno, de Ancos, & Plaza, 2003), con el objetivo de inactivar las enzimas y destruir gérmenes causantes de alteraciones como levaduras y hongos (Fellows, 2000). La bebida se envasó en caliente para producir vacío, en botellas de vidrio previamente esterilizadas, se enfriaron con agua a 10ºC. Las muestras se almacenaron durante 8 semanas en refrigeración (0-5ºC) y protegidas de la luz.
Se realizó una bebida control, siguiendo el procedimiento previamente descrito, con la diferencia que en esta se reemplazó el 20% de subproducto, por agua destilada.
g %
Zumo de mandarina 4000 80
Subproducto 1000 20
Conservante 2,5 0,05
[image:27.595.52.528.65.490.2]
16
Figura 6. Proceso de elaboración de la bebida con subproductos Fuente: La autora
3.2 Método experimental
3.2.1 Preparación de muestra
De la bebida se tomó 10mL de muestra y se centrifugó por 30 minutos a 2800rpm. De la muestra se preparó una dilución 1:11 (muestra:agua), la cual se filtró a vacío y se almacenó en tubos plásticos a temperatura de congelación para su posterior análisis.
Clasificación de fruta
Lavado y pelado
Extracción del zumo
Zumo
Subproductos (sacos de zumo, pulpa adherida y semillas)
Mezcla de subproductos con agua
Bebida
Pasteurización
Envasado
Almacenamiento
Relación 1:1
80% zumo 20% agua de lavado
T: 93°C t: 30s
T: 0-5°C
Agua de lavado
T: 45°C t: 8min.
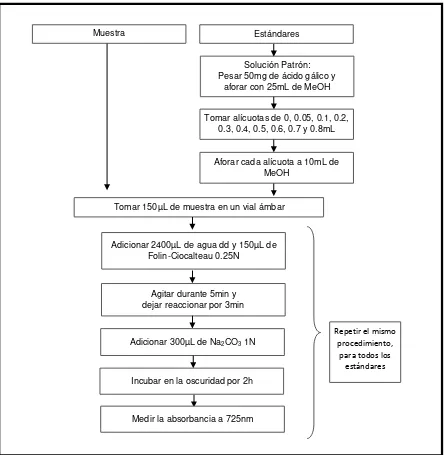
17 3.2.2 Determinación de fenoles totales.
[image:28.595.67.512.162.617.2]El contenido de fenoles totales se cuantificó siguiendo la metodología de Thaipong, Boonprakop, Crosby & Cisneros (2006). Se construyó una curva patrón, usando ácido gálico como estándar. Los resultados se expresaron en microgramos equivalentes de ácido gálico por mililitro de muestra (µg GAE/mL de muestra).
Figura 7. Determinación de fenoles totales mediante el método de Folin-Ciocalteau. Fuente: La autora
3.2.3 Cuantificación de actividad antioxidante.
Se emplearon tres métodos para la cuantificación de actividad antioxidante: ABTS, DPPH y FRAP.
Muestra Estándares
Solución Patrón: Pesar 50mg de ácido gálico y
aforar con 25mL de MeOH
Tomar alícuotas de 0, 0.05, 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7 y 0.8mL
Aforar cada alícuota a 10mL de MeOH
Tomar 150µL de muestra en un vial ámbar
Adicionar 2400µL de agua dd y 150µL de Folin-Ciocalteau 0.25N
Agitar durante 5min y dejar reaccionar por 3min
Adicionar 300µL de Na2CO3 1N
Incubar en la oscuridad por 2h
Medir la absorbancia a 725nm
Repetir el mismo procedimiento,
18
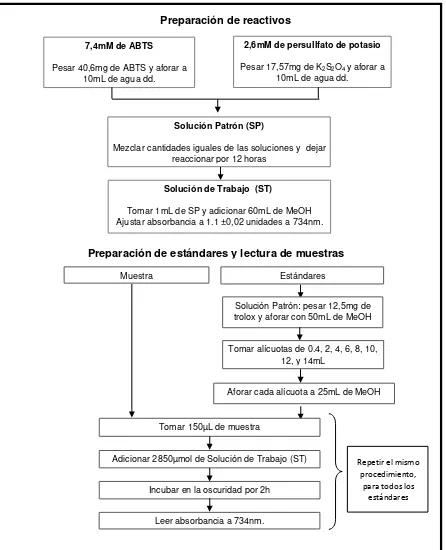
[image:29.595.67.513.159.709.2]3.2.3.1 Capacidad secuestrante de radicales libres mediante el método ABTS. Para el ensayo ABTS se sigue el procedimiento según Arnao et al. (2001) con algunas modificaciones. Se construyó una curva patrón, usando Trolox como estándar. Los resultados se expresaron como micromoles equivalentes de Trolox por mililitro de muestra (µmol ET/mL de muestra).
Figura 8. Determinación de actividad antioxidante mediante método ABTS. Fuente: La autora
Preparación de reactivos
Muestra Estándares
Solución Patrón: pesar 12,5mg de trolox y aforar con 50mL de MeOH
Tomar alícuotas de 0.4, 2, 4, 6, 8, 10, 12, y 14mL
Aforar cada alícuota a 25mL de MeOH
Tomar 150µL de muestra
Adicionar 2850µmol de Solución de Trabajo (ST)
Incubar en la oscuridad por 2h
Leer absorbancia a 734nm.
2,6mM de persullfato de potasio
Pesar 17,57mg de K2S2O4 y aforar a 10mL de agua dd.
7,4mM de ABTS
Pesar 40,6mg de ABTS y aforar a 10mL de agua dd.
Solución Patrón (SP)
Mezclar cantidades iguales de las soluciones y dejar reaccionar por 12 horas
Solución de Trabajo (ST)
Tomar 1mL de SP y adicionar 60mL de MeOH Ajustar absorbancia a 1.1 ±0,02 unidades a 734nm.
Repetir el mismo procedimiento,
para todos los estándares
19
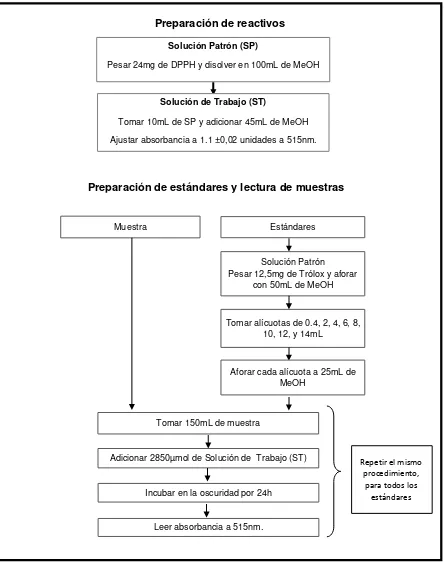
[image:30.595.67.511.142.704.2]3.2.3.2 Capacidad secuestrante de radicales libres mediante el método DPPH. Se sigue el método de Brand-Williams, Cuvelier & Berset (1995). Se construyó una curva patrón, usando Trolox como estándar. Los resultados se expresaron como micromoles equivalentes de Trolox por mililitro de muestra (µmol ET/mL de muestra).
Figura 9. Determinación de actividad antioxidante mediante método DPPH Fuente: La autora
Solución Patrón (SP)
Pesar 24mg de DPPH y disolver en 100mL de MeOH
Solución de Trabajo (ST)
Tomar 10mL de SP y adicionar 45mL de MeOH
Ajustar absorbancia a 1.1 ±0,02 unidades a 515nm.
Preparación de reactivos
Muestra Estándares
Solución Patrón Pesar 12,5mg de Trólox y aforar
con 50mL de MeOH
Tomar alícuotas de 0.4, 2, 4, 6, 8, 10, 12, y 14mL
Aforar cada alícuota a 25mL de MeOH
Tomar 150mL de muestra
Adicionar 2850µmol de Solución de Trabajo (ST)
Incubar en la oscuridad por 24h
Leer absorbancia a 515nm.
Repetir el mismo procedimiento,
para todos los estándares
20
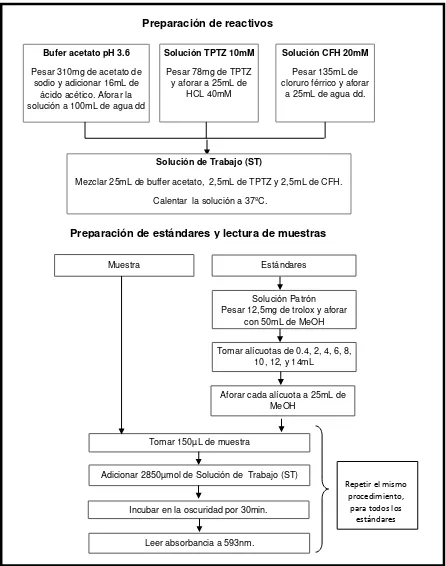
3.2.3.3 Poder antioxidante de reducción férrica (FRAP).
El método que se sigue es el planteado por Benzie y Strain (1996). Se construyó una curva patrón, usando Trolox como estándar. Los resultados se expresaron como micromoles equivalentes de Trolox por mililitro de muestra (µmol ET/mL de muestra).
[image:31.595.65.511.139.705.2]
Figura 10. Determinación de actividad antioxidante mediante método FRAP Fuente: La autora
Bufer acetato pH 3.6
Pesar 310mg de acetato de sodio y adicionar 16mL de
ácido acético. Aforar la solución a 100mL de agua dd
Solución TPTZ 10mM
Pesar 78mg de TPTZ y aforar a 25mL de
HCL 40mM
Solución CFH 20mM
Pesar 135mL de cloruro férrico y aforar
a 25mL de agua dd.
Solución de Trabajo (ST)
Mezclar 25mL de buffer acetato, 2,5mL de TPTZ y 2,5mL de CFH.
Calentar la solución a 37ºC.
Preparación de reactivos
Muestra Estándares
Solución Patrón Pesar 12,5mg de trolox y aforar
con 50mL de MeOH
Tomar alícuotas de 0.4, 2, 4, 6, 8, 10, 12, y 14mL
Aforar cada alícuota a 25mL de MeOH
Tomar 150µL de muestra
Adicionar 2850µmol de Solución de Trabajo (ST)
Incubar en la oscuridad por 30min.
Leer absorbancia a 593nm.
Repetir el mismo procedimiento,
para todos los estándares
21
3.2.4 Determinación de retención antioxidante.
El porcentaje de retención antioxidante se calculó siguiendo la metodología de Jiménez‐ Monreal, García‐Diz, Martínez‐Tomé, Mariscal, & Murcia (2009).
Los cálculos se detallan en el anexo E.
3.2.5 Caracterización de la bebida de mandarina con subproductos.
Para caracterizar las muestras y evaluar su calidad durante el almacenamiento en un tiempo de ocho semanas, se midieron cuatro parámetros: sólidos solubles totales, acidez, pH y color (Del Caro, Piga, Vacca, & Agabbio, 2004), siguiendo las normas oficiales de la AOAC 1990. Los análisis se realizaron por triplicado.
3.2.4.1 Sólidos solubles totales (SST).
La medición de sólidos solubles se realizó con el refractómetro portátil modelo 30PX, marca METTLER TOLEDO, previamente calibrado con agua destilada. La muestra se homogenizo, y se tomó la medida directamente. Los valores se expresaron en °Brix.
Los datos se detallan en el anexo F.
3.2.4.2 Acidez titulable.
La acidez se midió siguiendo el método de la AOAC 942.15. Se tomó 10mL de muestra y se añadió 90mL de agua destilada para diluir. A la dilución se añadió 300µL de fenolfataleína y se procedió a titular con hidróxido de sodio 0,1N. Los valores se expresaron como porcentaje de ácido cítrico.
Los cálculos y datos se detallan en el anexo F.
3.2.4.3 pH.
El pH se midió usando el potenciómetro SevenEasy pH, marca METTLER TOLEDO, previamente calibrado. La lectura se realizó de forma directa, con la muestra homogenizada.
Los datos se detallan en el anexo F.
3.3 Diseño experimental
22
23 4.1 Caracterización de materia prima y bebida
4.1.1 Análisis fisicoquímico
[image:34.595.138.452.505.626.2]En la caracterización fisicoquímica del zumo, subproducto (agua de lavado) y bebida con subproductos, se encontró que todas las muestras son diferentes entre sí (ver tabla 4), sin embargo se observa una cercanía entre los valores de zumo y bebida, a diferencia del subproducto.
Tabla 4. Caracterización fisicoquímica del zumo, subproducto y bebida.
Zumo de mandarina
Subproducto de mandarina
Bebida con subproducto
Sólidos solubles (ºBrix) 13,20±0,46a 6,00 ±0,17c 12,37±0,08b
pH 3,35±0,01c 3,58 ±0,01a 3,44±0,00b
Acidez (% ácido cítrico) 1,10 ±0,00a 0,44 ±0,01c 1,01±0,01b Cada valor es la media con la desviación estándar de tres réplicas experimentales. Los valores que no comparten una letra son significativamente diferentes.
Fuente: La autora
El subproducto de mandarina reporta valores de pH y sólidos solubles próximos a los evaluados por Viuda‐Martos et al. (2011) en el agua de lavado obtenida de los residuos (cáscara, pedazos de pulpa y otros restos vegetales) dejados de la extracción del zumo de naranja, encontrando valores de 4,56 ± 0,02 para pH y 7,16 ± 0,02 ºBrix para sólidos solubles.
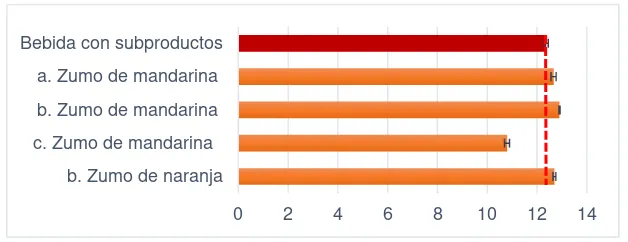
El zumo y la bebida muestran características fisicoquímicas (pH, acidez y sólidos), similares a las estudiadas por Tárrega (2011), Betoret (2011) y Acevedo, Montiel & Avanza (2004) en zumos de mandarina y naranja (ver gráfica 1, 2 y 3).
Gráfica 1. Sólidos solubles de la bebida, comparada con zumos de fruta. Fuente: a) Tárrega (2011), b) Betoret (2011), c) Acevedo et al. (2004)
0 2 4 6 8 10 12 14 b. Zumo de naranja
24
Gráfica 2.pH de la bebida, comparado con zumos de fruta.
Fuente: a) Tárrega (2011), b) Betoret (2011), c) Acevedo et al. (2004).
Gráfica 3. Acidez de la bebida, comparada con zumos de fruta.
Fuente: a) Tárrega (2011), b) Betoret (2011), c) Acevedo et al. (2004).
4.1.2 Análisis del contenido de fenoles totales y capacidad antioxidante
[image:35.595.139.447.252.373.2]Las propiedades antioxidantes de los compuestos fenólicos se deben principalmente a sus propiedades redox, que les permite actuar como agentes reductores, donadores de hidrógeno (Rice-Evans, Miller, & Paganga, 1997).
Tabla 5. Análisis antioxidante (ABTS, FRAP, DPPH) en zumo, subproducto y bebida.
Zumo Subproducto Bebida con subproductos
Bebida Control Fenoles Totales (µg
GAE/mL) 898,1 ± 14,7 a 821,0 ±22,3 b 892,9 ± 13,4a 749 ± 9,28c
ABTS (µmol ET/mL) 4,76 ± 0,13 a 4,83 ± 0,05 a 4,63 ± 0,06a 3,95 ± 0,08b
FRAP (µmol ET/mL) 4,86 ± 0,19 a 3,63 ± 0,26 bc 3,96 ± 0,11b 3,23 ± 0,09c
DPPH (µmol ET/mL) 3,11 ± 0,08 a 2,74 ± 0,03 c 2,95 ± 0,02b 2,78 ± 0,06c
Cada valor es la media con la desviación estándar de tres réplicas experimentales. Los valores que no comparten una letra son significativamente diferentes.
Fuente: La autora
En bibliografía no se encontró información que detalle el contenido de fenoles totales en subproductos de mandarina transformados a agua de lavado; en el presente trabajo se determinó este contenido usando el método Folin-Ciocalteau, encontrándose un valor de 821,0 ± 22,3 µg GAE/L(ver tabla 5).
0 0,5 1 1,5 2 2,5 3 3,5 4 b. Zumo de naranja
c. Zumo de mandarina b. Zumo de mandarina a. Zumo de mandarina Bebida con subproductos
0 0,5 1 1,5 2 2,5
b. Zumo de naranja c. Zumo de mandarina
25
En el zumo de mandarina se encontró un contenido de fenoles totales de 898,1±14,7 µg GAE/mL resultando mayor al del subproducto, siendo ambos superiores a los encontrados por Rekha et al. (2012) en el zumo fresco de mandarina (800 µg GAE/mL) y por Gardner, White, McPhail, & Duthie (2000) en zumos comerciales de fruta y vegetales (755 µg GAE/mL en naranja, 591 µg GAE/mL en naranja jaffa, 535 µg GAE/mL en toronja, 537 µg GAE/mL en toronja rosada, 504 µg GAE/mL en naranja florida, 339 µg GAE/mL en manzana, 358 µg GAE/mL en piña y 293 µg GAE/mL en jugo vegetal).
Los subproductos y zumos cítricos poseen actividad antioxidante y antirradical, que puede ser atribuida al contenido de compuestos fenólicos y flavonoides (Tárrega, 2011; Viuda et al., 2009). Para determinar la capacidad que tienen estos compuestos de captar radicales libres, se usaron tres métodos: ABTS, DPPH y FRAP. Cada método es basado en un principio diferente, por lo cual es necesaria una combinación de métodos, con el objetivo de expresar la capacidad antioxidante total de las muestras (Velázquez 2012).
En el método ABTS usado para medir la capacidad antioxidante, se observa una relación entre el zumo y subproducto (ver tabla 5), constatando valores superiores al zumo de mandarina analizado por López (2014) y Tárrega (2011), quienes reportan valores de 2,26 ± 0,5 µmol ET/mL y 1,02 ± 0,04 µmol ET/mL respectivamente. Rapisarda et al. (1999) estudiaron el jugo de 14 variedades de naranja, encontrando actividad antioxidante en un rango de 0,74 ± 0,04 µmol ET/mL a 7,05 ± 0,08 µmol ET/mL, según su variedad. Las muestras de zumo y subproducto de mandarina, estudiadas en la presente investigación evidencian poseer una actividad antioxidante relativamente alta, al ser comparados con el estudio anteriormente descrito.
En la tabla 5 se observa que el zumo contiene una capacidad antioxidante mayor que el subproducto, al ser evaluados por los métodos DPPH y FRAP. Del Caro et al. (2004) determinaron la capacidad secuestrante de radicales libres (DPPH) en el zumo de naranja, presentando una capacidad antioxidante de 4,12 µmol ET/mL, resultando superior a lo encontrado en el zumo de mandarina (3,11 µmol ET/mL) y subproducto (2,74 µmol ET/mL) analizados en el presente trabajo.
La bebida con subproductos de mandarina presenta un contenido de compuestos fenólicos y capacidad antioxidante cercano al zumo y diferente a la bebida control (ver tabla 5), demostrándose así que la sustitución del 20% de agua simple por agua de lavado de subproductos, aporta con una importante cantidad de compuestos fenólicos y capacidad antioxidante en la bebida.
26
preciso y fácil para la determinación de actividad antioxidante en frutas y vegetales, este resulta ser menos sensible a los antioxidantes hidrófilos (Gil, Tomás-Barberán, Hess-Pierce, Holcroft, & Kader, 2000), a diferencia del método ABTS, que mide la actividad de compuestos de naturaleza hidrofílica y lipofílica (Re et al., 1999).
4.2 Estabilidad de antioxidantes frente al proceso de pasteurización
.
Cada valor es la media con la desviación estándar de tres réplicas experimentales. Los valores que no comparten una letra son significativamente diferentes.
Gráfica 4. Análisis de fenoles totales en la bebida con subproductos, frente al proceso de pasteurización.
Fuente: La autora
Debido a los ingredientes usados en su elaboración: zumo de mandarina y sus subproductos, se obtiene una bebida rica en provitamínicos A y carotenoides (encargados de la coloración naranja del alimento) como β-caroteno y β-criptoxantina (Tuni, Carbajal, Forneiro, & Vives, 2013), siendo estos poseedores de capacidad antioxidante. Los carotenoides son sensibles a la luz y al calor excesivo, haciéndolos vulnerables al procesado y almacenamiento (Damodaran et al., 2010). En los alimentos conservados por calor se producen reacciones químicas y físicas que influyen en el valor nutritivo del alimento (Rees, Bettison, & Maluenda, 1994), siendo esta la principal causa de modificación del contenido de antioxidantes naturales en los alimentos (Kaur & Kapoor, 2001).
En la gráfica 4 se observa que el contenido de compuestos fenólicos no muestra diferencia significativa antes y después del proceso de pasteurización a 93°C por 30s; comportándose de igual manera que el jugo de ciruela, en donde según Donovan, Meyer, & Waterhouse (1998), tampoco se producen cambios en los compuestos fenólicos frente al proceso de pasteurización.
901,8 892,9
800 820 840 860 880 900 920
µ
g
G
A
E
/
mL
Bebida sin pasteurizar Bebida pasteurizada
27
Cada valor es la media con la desviación estándar de tres réplicas experimentales. Los valores que no comparten una letra son significativamente diferentes.
Gráfica 5. Análisis decapacidad antioxidante (ABTS, FRAP, DPPH) en la bebida con subproductos, frente al proceso de pasteurización.
Fuente: La autora
En la gráfica 5 se muestra que la capacidad antioxidante muestra una reducción en dos de los tres métodos usados para su determinación, siendo la medición por el método DPPH, la que no muestra cambios en su contenido, concordando con el estudio efectuado por Plaza et al. (2006), quienes no distinguen modificación en la actividad antioxidante (DPPH determinado por EC50) del jugo de naranja sometido al proceso de pasteurización a 70ºC
[image:38.595.114.458.53.250.2]durante 30 segundos.
Tabla 6. Retención antioxidante frente al proceso de pasteurización.
Método de determinación %retención %degradación
Fenoles totales 99,04 0,96
ABTS 92,05 7,95
DPPH 98,01 1,99
FRAP 90,41 9,59
Fuente: La autora
El poder antioxidante de reducción férrica (FRAP), evaluado en la bebida con subproductos presenta una degradación de 9,6% (ver tabla 6) después de ser sometida al tratamiento térmico, degradación que resulta similar a la evaluada por Velázquez (2012) en el jugo de naranja, frente al proceso de pasteurización a 90ºC durante 1 minuto, encontrándose una pérdida de 10,2%1 en el método FRAP y 7,6%1 en el método ABTS, atribuyendo su
disminución a las pérdidas de ácido ascórbico y carotenoides.
1 % calculado en la presente investigación, en base a los datos obtenidos por el autor mencionado. 5,03 4,38 3,01 4,63 3,96 2,95 0 1 2 3 4 5 6
ABTS FRAP DPPH
µmo
l
E
T/mL
Bebida sin pasteurizar Bebida pasteurizada
28
Según Acevedo, Montiel, & Avanza (2004), la pasteurización es necesaria para prolongar la vida útil de los jugos, encargándose de eliminar microorganismos patógenos y reducir la actividad enzimática, sin embargo también disminuye la calidad del producto, causando un descenso de la actividad antioxidante, siendo el jugo de mandarina uno de los jugos cítricos más sensibles a la temperatura. Sin embargo a pesar de la disminución observada en la capacidad antioxidante de la bebida frente al tratamiento térmico, esta sigue siendo un alimento rico en antioxidantes, ya que su degradación es mínima y no anula su contenido. Damodaran et al. (2010) argumentan que las altas temperaturas aceleran las reacciones que ocurren a baja velocidad a temperatura ambiente, produciendo perdidas por oxidación, contrario a esto, se ha demostrado que los tratamientos a altas temperaturas y tiempos cortos (HTST) mejoran la retención de nutrientes lábiles en el proceso térmico, es decir la disminución de compuestos fenólicos depende del tiempo y temperatura de pasteurización.
4.3 Estabilidad de características físico químicas frente al almacenamiento.
Se determinó pH, acidez y sólidos solubles en la bebida. Estas mediciones se realizaron semanalmente durante el tiempo de almacenamiento, para evaluar calidad y estabilidad físico química (Rodrigo et al., 2003); en la tabla 7 se detalla el comportamiento de cada parámetro, donde no se observa una variación entre semanas en el transcurso de su almacenamiento a temperatura de refrigeración. Kaanane, Kane & Labuza (1988) estudiaron el efecto del tiempo y la temperatura de almacenamiento en las características fisicoquímicas del jugo de naranja procesado, encontrando que los parámetros de pH, acidez y solidos solubles, no muestran variaciones durante el almacenamiento de 14 semanas, al igual que Del Caro et al. (2004), quienes tampoco reportaron diferencias significativas en el zumo de naranja almacenado durante 15 días a 4ºC.
[image:40.842.71.753.154.302.2]
29
Tabla 7. Caracterización fisicoquímica de la bebida y medición de estabilidad durante el tiempo de almacenamiento.
Semana 1 Semana 2 Semana 3 Semana 4 Semana 5 Semana 6 Semana 7 Semana8 SOLIDOS SOLUBLES TOTALES (ºBrix)
12,37 ± 0,06ab 12,1 ± 0,26b 12,47 ± 0,31ab 12,97 ± 0,32a 12,57 ± 0,35ab 12,97 ± 0,06a 13,00 ± 0,17a 13,00 ± 0,17a
pH
3,43 ± 0,00a 3,42 ± 0,00ab 3,43 ± 0,01ab 3,42 ± 0,01ab 3,41 ± 0,00b 3,42 ± 0,01ab 3,42 ± 0,00ab 3,41 ± 0,00b
ACIDEZ (% ácido cítrico)
1,01 ± 0,01ab 0,89± 0,05b 1,05 ± 0,04ab 1,17 ± 0,04a 1,22 ± 0,01a 1,17 ± 0,10a 1,12 ± 0,13ab 1,15 ± 0,01ab
30
4.4 Estabilidad de antioxidantes frente al almacenamiento
Las bebidas pasteurizadas se refrigeraron a una temperatura de 0-5°C, con el fin de evitar el crecimiento de microorganismos y frenar las transformaciones enzimáticas (Fellows, 2000). El almacenamiento posterior al tratamiento térmico tiene un pequeño pero significativo efecto en el contenido de compuestos nutritivos en los alimentos (Damodaran et al., 2010).
Se evaluó la estabilidad antioxidante de la bebida con subproductos durante el almacenamiento de 2 meses, en refrigeración y mantenido en oscuridad. Se cuantificó semanalmente la cantidad de fenoles totales y capacidad antioxidante por los métodos ABTS, DPPH y FRAP.
El contenido de fenoles totales evaluados en la bebida, presentó altibajos entre las semanas de almacenamiento (ver tabla 9), lo cual puede ser resultado de la exactitud usada en su determinación, sin embargo se constata una evidente disminución al comparar la semana inicial con la final, verificándose una degradación de compuestos fenólicos de 8,52% (ver tabla 8), frente al proceso de almacenamiento. Klimczak, Malecka, Szlachta & Gliszyńska-Świglo (2007) experimentan resultados similares, al evaluar la estabilidad de fenoles totales en jugo de naranja, observándose una degradación de 6,53%2 al segundo
mes de almacenamiento.
Gráfica 6. Comparación de fenoles totales de jugos comerciales con la bebida con subproductos de mandarina.
Fuente: a.Gardner et al. (2000), La autora
2 % calculado en la presente investigación, en base a los datos obtenidos por el autor mencionado. 755
591
535 537 504
339 358
31
Gardner et al. (2000) estudiaron el contenido de fenoles totales en diferentes jugos de fruta comerciales, los cuales van en un rango de 293 a 755 µg GAE/mL, evidenciando así que aunque en la bebida con subproductos se observa degradación al segundo mes de almacenamiento, esta sigue manteniendo una alta cantidad de fenoles al ser comparada con otros jugos comerciales (ver gráfica 6).
Gráfica 7. Estabilidad de la capacidad antioxidante de la bebida con subproductos, frente al proceso de almacenamiento.
Fuente: La autora
La actividad antioxidante evaluada de forma general, no sigue una tendencia uniforme durante su almacenamiento (ver gráfica 7), sin embargo al final de este, se observó una disminución en la mayoría métodos usados para su cuantificación.
Tabla 8. Retención antioxidante frente al proceso de almacenamiento. Método de
determinación retención % degradación % incremento %
Fenoles totales 91,48 8,52 -
ABTS 88,12 11,88 -
DPPH 108,81 - 8,81
FRAP 80,30 19,70 -
Fuente: La autora
Arena, Fallico & Maccarone (2001) estudiaron la actividad antioxidante en el jugo de naranja, confirmando que esta, se encuentra estrictamente relacionada con la concentración de ácido ascórbico y que según Miller & Rice-Evans (1997) es el compuesto de mayor contribución de capacidad antioxidante. El ácido ascórbico es generalmente
0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50 4,00 4,50 5,00
S1 S2 S3 S4 S5 S6 S7 S8
µmol
ET
/
m
L
Tiempo de almacenamiento (semanas)
32
degradado por procesos de oxidación que son estimulados en la presencia de luz, oxígeno, calor, peróxidos y enzimas (Plaza et al., 2006).
Se evidenció una disminución de capacidad antioxidante en los métodos ABTS y FRAP (ver tabla 9), a diferencia de Arena et al. (2001) quién asegura obtener una capacidad antioxidante (ABTS) casi constante en jugos comerciales de naranja, almacenados durante 60 días a 2 y 20ºC.
Piljac-Žegarac, Valek, Martinez, & Belščak, (2009) estudiaron la estabilidad durante el almacenamiento en refrigeración de varios jugos de fruta (grosellero negro, arándano, granada, fresa y cereza), los cuales inicialmente presentaron una capacidad secuestrante de radicales libres (DPPH), en un rango de 3,25 a 5,68 µmol ET/mL con un promedio de 3,95 µmol ET/mL, resultando similar al valor inicial de la bebida (3,95 µmol ET/mL), analizada en esta investigación; sin embargo luego de 29 días de almacenamiento Piljac-Žegarac et al. (2009) constataron una disminución de capacidad antioxidante en todos los jugos, a excepción del jugo de granada el que mostró un incremento del 6%, cercano al encontrado en la bebida con un 8,8% (ver tabla 8).
33
Gráfica 8. Comparación de capacidad antioxidante medida por el método ABTS en jugos frescos y comerciales con la bebida con subproductos de mandarina.
Fuente: a. Arena et al. (2001) b. Velázquez (2012) c. Mezadri, Villaño, Fernández-Pachón, García-Parrilla, and Troncoso (2008) d. La autora.
La capacidad secuestrante de radicales libres medida por el método ABTS en la bebida, reporta una degradación de 11,9% al cabo de su almacenamiento. Aunque se observa una evidente pérdida, la bebida muestra una capacidad antioxidante de 4,08 ± 0,13 µmol ET/mL al final de los dos meses de almacenamiento, y al ser comparada con distintos jugos frescos y comerciales (ver gráfica 8), se verifica que su capacidad antioxidante es conservada en gran medida, resultando incluso superior a la de jugos frescos y comerciales de naranja y acerola estudiados por Arena et al. (2001), Velázquez (2012) y Mezadri et al. (2008).
Es así como la bebida con subproductos de mandarina presenta un comportamiento similar al de muchos jugos de naranja frescos y comerciales, destacándose el alto contenido de compuestos fenólicos y capacidad antioxidante aun después de haber pasado por los procesos de pasteurización y almacenamiento.
5,08
4,18
2,73
6,04
2,03
4,63
4,08
0 1 2 3 4 5 6 7
µmo
l
ET/mL
[image:45.842.61.781.125.333.2]
34
Tabla 9. Evaluación de actividad antioxidante de la bebida con subproducto, durante su almacenamiento.
Cada valor es la media con la desviación estándar de tres réplicas experimentales. Los valores que no comparten una letra son significativamente diferentes. Fuente: La autora
Semana 1 Semana 2 Semana 3 Semana 4 Semana 5 Semana 6 Semana 7 Semana 8
FENOLES TOTALES
(µg GAE/mL) 892,9 ± 13ab 873,7 ± 9b 856,5 ± 13bc 926,1 ± 19a 862,9 ± 11b 928,4 ± 19a 878,9 ± 15b 816,8 ± 16c
CAPACIDAD ANTIOXIDANTE
(µmol ET/mL)
Método
ABTS 4,63 ± 0,06
a 4,55 ± 0,11ab 4,69 ± 0,13a 4,78 ± 0,13a 4,46 ± 0,13ab 4,22 ± 0,13bc 4,00 ± 0,16c 4,08 ± 0,13c
Método
FRAP 3,96 ± 0,11a 3,47 ± 0,14abc 3,31 ± 0,29c 3,37 ±0,15bc 3,84 ± 0,21ab 2,97 ± 0,16cd 2,56 ± 0,14d 3,18 ± 0,15c
Método
35
CONCLUSIONES
El agua de lavado obtenido de los subproductos de mandarina presentó un contenido de 821,0 mg GAE/L en fenoles totales y una capacidad antioxidante de 2,74 µmol ET/mL por el método DPPH, 3,63 µmol ET/mL por el método FRAP y 4,83 µmol ET/mL, por el método ABTS.
El proceso de pasteurización aplicado (93°C por 30 segundos) en la bebida, modificó la actividad antioxidante evaluada por los métodos ABTS y FRAP, observándose una disminución (p>0,05), no obstante la cuantificación de fenoles totales y capacidad antioxidante evaluada por el método DPPH, no presentaron degradación.
Al cabo del almacenamiento durante dos meses en refrigeración, se constató que la bebida sufrió una degradación del 8,5% en fenoles totales, 11,9% en la capacidad antioxidante medida por el método ABTS y 19,7% por el método FRAP. Opuesto a esto se observó un aumento del 8,8% en la capacidad antioxidante medida por el método DPPH.
36
RECOMENDACIONES
En futuras investigaciones se recomienda completar el estudio de estabilidad de antioxidantes con un estudio microbiológico para comprobar la efectividad del proceso de pasteurización y evaluar la inocuidad de la bebida durante su almacenamiento.
37
BIBLIOGRAFÍA
Acevedo, B., Montiel, M., & Avanza, J. (2004). Estudio cinético de la degradación de la actividad antioxidante hidrosoluble de jugos cítricos por tratamiento térmico.
FACENA, 20, 91-95.
AOAC. (2005). Official methods of analysis of AOAC international. Washington, USA.
Arena, E., Fallico, B., & Maccarone, E. (2001). Evaluation of antioxidant capacity of blood orange juices as influenced by constituents, concentration process and storage.
Food Chemistry, 74(4), 423-427. doi: 10.1016/S0308-8146(01)00125-X
Arias, M. D. (2009). Caracterización físico-químico y sensorial de nabiza y grelo (Brassica
rapa L.) Retrieved from
https://books.google.es/books?id=OLsQF9t4A7oC&pg=PA128&dq=determinaci%C 3%B3n+de+fenoles+totales&hl=es&sa=X&ei=30tdVZWHNvSKsQSd9oCACA&ved= 0CCkQ6AEwAg#v=onepage&q=determinaci%C3%B3n%20de%20fenoles%20totale s&f=false
Arnao, M. B., Cano, A., & Acosta, M. (2001). The hydrophilic and lipophilic contribution to total antioxidant activity. Food Chemistry, 73(2), 239-244. doi:
10.1016/S0308-8146(00)00324-1
Arthey, D., Ashurst, P. R., & González, J. B. (1997). Procesado de frutas. Saragoza,
España: Acribia.
Balch, P. A. (2000). Recetas nutritivas que curan Retrieved from
https://books.google.es/books?id=TrDJvmggG-IC&pg=PA47&dq=radicales+libres&hl=es&sa=X&ei=YShZVdaSLojzggTCpYDgDA& ved=0CE8Q6AEwCA#v=onepage&q=radicales%20libres&f=false
Benzie, I. F., & Strain, J. (1996). The ferric reducing ability of plasma (FRAP) as a measure of ―antioxidant power‖: the FRAP assay. Analytical biochemistry, 239(1), 70-76. doi:
10.1006/abio.1996.0292
Betoret, M. E. (2011). Efecto de la presión de homogeneización sobre el tamaño de
partícula y las propiedades funcionales de los zumos. Universidad Politécnica de
Valencia, España. Retrieved from
https://riunet.upv.es/bitstream/handle/10251/12533/Ester%20Betoret%20Tesis%20 Master.pdf?sequence=1&isAllowed=y
Bocco, A., Cuvelier, M.-E., Richard, H., & Berset, C. (1998). Antioxidant activity and phenolic composition of citrus peel and seed extracts. Journal of agricultural and food chemistry, 46(6), 2123-2129.
Bourgeois, C., Mescle, J., & Zucca, J. (1994). Microbiología alimentaria (Vol. 1). España:
38
Bozell, J. J., & Petersen, G. R. (2010). Technology development for the production of biobased products from biorefinery carbohydrates—the US Department of Energy’s ―top 10‖ revisited. Green Chemistry, 12(4), 539-554.
Brand-Williams, W., Cuvelier, M., & Berset, C. (1995). Use of a free radical method to evaluate antioxidant activity. LWT-Food Science and Technology, 28(1), 25-30.
Campero, E. V., Frías, F., Zamora, G., Tereschuk, M. L., & Albarracín, P. (2009). Determinación de flavonoides en mandarinas de Tucumán.
Cano, M., Sánchez-Moreno, C., de Ancos, B., & Plaza, L. (2003). Elaboración y conservación de zumos de naranja: efecto de nuevas tecnologías sobre su calidad sensorial y nutricional. ANS. Alimentación, nutrición y salud, 10(4), 108-119.
Damodaran, S., Parkin, K. L., & Fennema, O. R. (2010). Química de alimentos de
Fennema (3 ed.). España: Acribia.
Del Caro, A., Piga, A., Vacca, V., & Agabbio, M. (2004). Changes of flavonoids, vitamin C and antioxidant capacity in minimally processed citrus segments and juices during storage. Food Chemistry, 84(1), 99-105. doi: 10.1016/S0308-8146(03)00180-8
Donovan, J. L., Meyer, A. S., & Waterhouse, A. L. (1998). Phenolic composition and antioxidant activity of prunes and prune juice (Prunus domestica). Journal of
agricultural and food chemistry, 46(4), 1247-1252.
Fellows, P. (2000). Tecnología del procesado de los alimentos: principios y prácticas (2
ed.). España: Acribia.
Fernández, J., Zhi, N., Aleson, L., Pérez, J., & Kuri, V. (2005). Antioxidant and antibacterial activities of natural extracts: application in beef meatballs. Meat science, 69(3),
371-380.
Gardner, P. T., White, T. A., McPhail, D. B., & Duthie, G. G. (2000). The relative contributions of vitamin C, carotenoids and phenolics to the antioxidant potential of fruit juices. Food Chemistry, 68(4), 471-474.
Ghasemi, K., Ghasemi, Y., & Ebrahimzadeh, M. A. (2009). Antioxidant activity, phenol and flavonoid contents of 13 citrus species peels and tissues. Pak J Pharm Sci, 22(3),
277-281.
Gil, M. I., Tomás-Barberán, F. A., Hess-Pierce, B., Holcroft, D. M., & Kader, A. A. (2000). Antioxidant activity of pomegranate juice and its relationship with phenolic composition and processing. Journal of agricultural and food chemistry, 48(10),
4581-4589.
Gutiérrez, J. B. (2012). Calidad de vida, alimentos y salud humana: fundamentos
39
Hernandez, A. G. D. (2010). Tratado de nutrición: Composición y calidad nutritiva de los
alimentos (Vol. 2). Madrid, España: Ed. Médica Panamericana.
Hernández, J. (2013). Utilización de la cáscara de naranja como fuente de fibra, prebiótico
y antioxidante en productos cárnicos cocidos. Universidad Autónoma Metropolitana,
México
Hernández, M., & Sastre, A. (1999). Tratado de nutrición Retrieved from
https://books.google.es/books?id=SQLNJOsZCIwC&pg=PA717&dq=radicales+libre s&hl=es&sa=X&ei=YShZVdaSLojzggTCpYDgDA&ved=0CD4Q6AEwBQ#v=onepag e&q=radicales%20libres&f=false
Jiménez‐Monreal, A., García‐Diz, L., Martínez‐Tomé, M., Mariscal, M., & Murcia, M. (2009). Influence of cooking methods on antioxidant activity of vegetables. Journal of food
science, 74(3), H97-H103.
Kaanane, A., Kane, D., & Labuza, T. (1988). Time and temperature effect on stability of Moroccan processed orange juice during storage. Journal of food science, 53(5),
1470-1473.
Kaur, C., & Kapoor, H. C. (2001). Antioxidants in fruits and vegetables–the millennium’s health. International journal of food science & technology, 36(7), 703-725.
Klimczak, I., Małecka, M., Szlachta, M., & Gliszczyńska-Świgło, A. (2007). Effect of storage on the content of polyphenols, vitamin C and the antioxidant activity of orange juices. Journal of food composition and analysis, 20(3), 313-322. doi:
10.1016/j.jfca.2006.02.012
Larrañaga, I. J., Carballo, J. M., Rodríguez, M. d. M., & Férnandez, J. A. (1998). Control e
higiene de los alimentos. España: McGraw-Hill.
Londoño, J., Sierra, J., Álvarez, R., Restrepo, A. M., & Pássaro, C. P. (2012). Aprovechamiento de los subproductos citrícolas.
López, A. B. (2014). Efecto del zumo de mandarina sobre el estrés oxidativo: estudio
experimental y en patologías mediadas por radicales libres. Univeresidad de
Valencia, Valencia, España.
Macheix, J.-J., & Fleuriet, A. (1990). Fruit phenolics. Estados Unidos: CRC press.
MAGAP. (2000). III Censo Nacional Agropecuario. Ecuador: Retrieved from
http://sinagap.agricultura.gob.ec/resultados-nacionales.
Maldonado, D. I. (2014). Subproductos cítricos como fuente de Fibra Dietaria. Universidad
Tecnica Particular de Loja Loja, Ecuador.
40
Martínez, R., Hualpa, D., & Figueroa, G. (2014). Potencial de los subproductos agroindustriales como ingredientes alimentarios. Alimentaryá.
Mazza, G. (2000). Alimentos funcionales: aspectos bioquímicos y de procesos. Saragoza,
España: Acribia.
Mercado, G., Carrillo, L. D. l. R., Wall, A., López, J. A., & Álvarez, E. (2013). Compuestos polifenólicos y capacidad antioxidante de especias típicas consumidas en México.
Nutrición Hospitalaria, 28(1), 36-46. doi: 10.3305/nh.2013.28.1.6298
Mezadri, T., Villaño, D., Fernández-Pachón, M., García-Parrilla, M., & Troncoso, A. (2008). Antioxidant compounds and antioxidant activity in acerola (Malpighia emarginata DC.) fruits and derivatives. Journal of food composition and analysis, 21(4),
282-290.
Micó, M. J. (2014). Métodos de análisis de fibra y determinaciones físico-químicas en
cítricos para el módulo de control alimentario del ciclo formativo de dietética.
España: 3Ciencias.
Milena, S., Montoya, L. J., & Orozco, F. (2008). Valorización de residuos agroindustriales-frutas-en Medellím y el sur del valle del Aburrá, Colombia. Rev. Fac. Nal. Agr. Medellìn, 61(1), 4422-4431.
Miller, N. J., & Rice-Evans, C. A. (1997). The relative contributions of ascorbic acid and phenolic antioxidants to the total antioxidant activity of orange and apple fruit juices and blackcurrant drink. Food Chemistry, 60(3), 331-337.
Molyneux, P. (2004). The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. Songklanakarin J Sci Technol, 26(2), 211-219.
Nicoli, M. C., Anese, M., Parpinel, M. T., Franceschi, S., & Lerici, C. R. (1997). Loss and/or formation of antioxidants during food processing and storage. Cancer letters,
114(1), 71-74.
Olivera, E. M. (2013). Evaluación de subproducto obtenido en la elaboración de jugos de
mango y guayaba como fuente de fibra antioxidante. Universidad Auntónoma de
Querétano, México.
Ordoñez-Santos, L. E., Hurtado Aguilar, P., Ríos Solarte, O. D., & Arias Jaramillo, M. E. (2014). Concentración de carotenoides totales en residuos de frutas tropicales.
Producción+ Limpia, 9(1), 91-98.
Pamplona, J. D. (1995). Alimentos que curan (pp. 94). Retrieved from
https://books.google.es/books?id=1fxzqvrLoZsC&printsec=frontcover&dq=ALIMENT OS+QUE+CURAN&hl=es&sa=X&ved=0CCEQ6AEwAGoVChMIhaz9mILqxgIVhYsN Ch0y4wAP#v=onepage&q=ALIMENTOS%20QUE%20CURAN&f=false
Patiño, J. F. (2000). Lecciones de cirugía Retrieved from