1 EVALUACIÓN DE LA EFICACIA DE 3 DESINFECTANTES, FRENTE A CEPAS DE Listeria monocytogenes AISLADAS DE INDUSTRIA CÁRNICA
COLOMBIANA
ANDRÉS FERNANDO HERRERA DE LA HOZ
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
2 EVALUACIÓN DE LA EFICACIA DE 3 DESINFECTANTES, FRENTE A CEPAS DE Listeria monocytogenes AISLADAS DE INDUSTRIA CÁRNICA
COLOMBIANA
ANDRÉS FERNANDO HERRERA DE LA HOZ
APROBADO
JANETH ARIAS
Directora carrera Microbiología Industrial
INGRID SCHULLER Decana Académica
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
3 EVALUACIÓN DE LA EFICACIA DE 3 DESINFECTANTES, FRENTE A CEPAS DE Listeria monocytogenes AISLADAS DE INDUSTRIA CÁRNICA
COLOMBIANA
ANDRÉS FERNANDO HERRERA DE LA HOZ
ANA KARINA CARRASCAL Directora de Tesis
4 NOTA DE ADVERTENCIA
Artículo 23 de la Resolución N° 13 de Julio de 1946 “La Universidad no se hace responsable por los conceptos
5 0. TABLA DE CONTENIDO
1. Resumen (pág.7)
2. Introducción (pág.8)
3. Justificación (pág.9)
4. Marco teórico (pág.9)
4.1. Producción de derivados cárnicos en Colombia (pág. 9)
4.2. Prevalencia en Colombia de L. monocytogenes en derivados cárnicos (pág.10)
4.3. Limpieza y desinfección en la industria de derivados cárnicos (pág.10)
4.4. Desinfectantes (pág.11)
4.4.1. Sales de Amonio Cuaternario (QAC‟s) (pág.11)
4.4.2. Guanidinas y Biguanidinas (pág.11) 5. Objetivos (pág.12)
5.1. Objetivo general (pág.12)
5.2. Objetivos específicos (pág.12)
6. Metodología (pág.12)
6.1. Diseño de la Investigación (pág.12)
6.1.1. Hipótesis (pág.12)
6.1.2. Prueba de Hipótesis (pág.12)
6.1.3. Población de Estudio y Muestra (pág.12)
6.1.3.1. Población universo (pág.12) 6.1.3.2. Población en estudio (pág.13)
6.1.3.3. Población muestra (pág.13)
6.1.4. Muestreo (pág.13)
6.1.5. Variables de estudio (pág.13)
6.2. Procedimiento (pág.13)
6.2.1. Suspensión bacteriana (pág.13)
6.2.1.1. Cultivos de primera generación de los organismos de prueba (pág.13)
6.2.1.2. Cultivos de trabajo de los organismos de prueba (pág.13)
6.2.1.3. Suspensión bacteriana de prueba (pág.14)
6.2.1.4. Recuento de las suspensiones bacterianas de prueba (pág.14)
6.2.2. Solución del producto sometido a prueba (pág.14)
6.2.3. Solución Neutralizante (pág.15)
6.2.4. Método de dilución-neutralización (pág.15)
6.2.4.1. Generalidades (pág.15)
6.2.4.2. Procedimiento de prueba para verificar la actividad bactericida de los productos (pág.15)
6.2.4.3. Recuento de la mezcla de la prueba (pág.15)
6.2.5. Cálculo de la disminución de viabilidad en la mezcla de prueba (pág.15)
6.2.6. Cálculo del porcentaje de efectividad de cada concentración de desinfectante (Análisis estadístico) (pág.16)
7. Resultados (pág.16)
7.1. Resultados (pág.16)
7.2. Resultados del análisis inferencial (pág.17)
8. Discusión (pág.17)
6 10. Recomendaciones (pág.21)
11. Bibliografía (pág.22)
7 1. RESUMEN
Para evitar problemas de salud pública y favorecer el desarrollo del sector económico de derivados cárnicos, en Colombia, se debe llevar a cabo la implementación adecuada de procesos de limpieza y desinfección, lo que implica calificar los agentes desinfectantes utilizados en su desarrollo, de manera que se eviten adaptaciones de resistencia en Listeria monocytogenes o su persistencia en las instalaciones de procesamiento. Por ello, en el presente estudio y mediante la aplicación de la NTC 5150, se determinó la efectividad bactericida en suspensión, de 3 desinfectantes con Alquil-dimetil-bencil cloruro de amonio (ADCA), Poli hexametilen-biguanida (PHMB) y Cloruro de Cetilpiridinio (CCP), como principio activo, sobre 40 cepas de L. monocytogenes aisladas de industrias cárnicas Colombianas. Según los resultados obtenidos y los parámetros del estudio, los desinfectantes que demostraron ser inefectivos fueron: el desinfectante B, a base de PHMB, en todas sus concentraciones (B1, 0.5% v/v; B2, 1% v/v; B3, 2% v/v) y tiempos de contacto evaluados (5 y 15 minutos); y el desinfectante C, a base de CCP, en un tiempo de contacto de 5 minutos, para las concentraciones C1 (0.2% v/v) y C2 (0.4% v/v;). Al presentarse tolerancia en varias de las cepas obtenidas de chorizo, canal de cerdo y utensilios para el procesamiento de carne, se presume su posible persistencia en las instalaciones de origen. Se considera al uso de dosis sub-letales, como la principal causa del fenómeno de adaptación evidenciado sobre el desinfectante A y especialmente sobre el B.
1. ABSTRACT
8 2. INTRODUCCIÓN
L. monocytogenes, es un microorganismo patógeno emergente de gran importancia para la industria de procesamiento de carnes por su capacidad para convertirse en microorganismo persistente de sus instalaciones („„in-house
flora‟‟) y en un contaminante habitual de sus productos terminados, de acuerdo
a varias de sus cualidades inherentes como: 1. Su naturaleza como microorganismo ubicuo y habitante común del intestino de ganado ovino, porcino y caprino; 2. Su capacidad para crecer en condiciones de anaerobiosis, pH ácido (4.2), salinidad y temperaturas de refrigeración (hasta de 0ºC); 3. y especialmente por su capacidad de adhesión a diferentes tipos de superficies, por medio de la formación de películas (1-3). Tan relevante es su capacidad de supervivencia en las instalaciones de procesamiento de derivados cárnicos, que recientemente se han desarrollado varios estudios por organizaciones como la FAO (Food and Agriculture Organization), la Organización Mundial de la Salud, la FDA (Food and Drug Administration) y la Secretaría Distrital de Salud (SDS) de Bogotá, para determinar estrategias para su control (1).
En el caso particular del estudio llevado a cabo por la SDS de Bogotá, entre Septiembre de 2001 y Agosto de 2004, el resultado de prevalencia para L. monocytogenes encontrado de 11.7% y el alto índice de no aceptabilidad de los derivados cárnicos evaluados, reflejó importantes problemas en la calidad de sus materias primas y/o sus procesos de manipulación, que pueden ser responsables de contaminación tanto de las instalaciones de procesamiento como del producto en sí (4). Para evitar este tipo de inconvenientes, es fundamental llevar a cabo procesos de limpieza y desinfección, en las instalaciones de la industrias cárnica, cuya efectividad esté garantizada por procedimientos de validación y en los cuales se califique la adecuada actividad bactericida de los agentes desinfectantes utilizados.
En Colombia, actualmente existe la norma NTC 5150 del ICONTEC específicamente desarrollada para calificar la actividad bactericida de desinfectantes utilizados en plantas alimentos y que describe un método en suspensión para determinar esta capacidad in vitro, según la disminución en la concentración celular, de los microorganismos utilizados, luego de realizada la prueba (5). Para calificaciones que provean información “in situ”, más cercana al desempeño en campo de los agentes desinfectantes no existen en el país normas que describan esta clase de procedimientos, pero el Comité Europeo de Normalización (CEN), de donde la norma original proviene (Norma UNE EN 1040:1997), propone normas adicionales que se desarrollan en fases posteriores a los resultados del desarrollo de ensayos como el de la NTC 5150 (6).
9 3. JUSTIFICACIÓN
Las tendencias actúales que rigen el consumo de alimentos, exigen cada vez más una gama de alimentos de calidad, nutritivos y de fácil preparación. Los consumidores disponen de menos tiempo para ocuparlo en la preparación de comida o en cenas en su lugar de residencia, por ello su creciente interés en alimentos que requieran de poca o ninguna preparación post-compra, para ser consumidos (7). Como ejemplo actual de este tipo de alimentos, se encuentran en el mercado aquellos derivados cárnicos (jamones, salchichas, mortadelas, -etc.) denominados como Listos Para Consumo (LPC) y que por sus características inherentes (consumo normalmente en crudo; ausencia de cocción o de cualquier otro tipo de elaboración adicional luego de su compra, -etc.) son considerados como susceptibles para ser el sustento de diferentes tipos de microorganismos patógenos, incluyendo a L. monocytogenes (3).
Para evitar que este tipo de derivados cárnicos, sufran contaminaciones por L. monocytogenes, mediante el Decreto 3075 de 1997 (8) y el Decreto 1500 de 2007 (9) son exigidas materias primas de excelente calidad y programas de limpieza y desinfección que se lleven a cabo en las plantas de procesamiento de carnes, como estrategia para el control de bacterias alteradoras y especialmente de aquellas formadoras de biopelículas. Pero aunque este proceso debería ser suficiente para este objetivo, distintos factores como la inadecuada utilización de desinfectantes, ha generado inconvenientes de tolerancia frente a ellos e ineficacia en la eliminación de este tipo de microorganismos; el uso de concentraciones menores a las necesarias para alcanzar un efecto letal suficiente, en el tiempo de desinfección utilizado, permiten la supervivencia de la cantidad indicada de microorganismos que puedan desarrollar mecanismos de tolerancia mediante adaptaciones fenotípicas, alteraciones genéticas o mediante la adquisición de genes, que generen cualidades de resistencia a futuros procesos de desinfección (10). Para prevenir esta clase de inconvenientes y disminuir la probabilidad de problemas de contaminación durante el procesamiento de alimentos, se necesita predecir la efectividad en planta de los agentes desinfectantes utilizados y dar sustento a su uso como herramienta adecuada en el control de microorganismos indeseables, según pruebas de calificación de desinfectantes indicadas por organismos de Normalización indicados (11-13).
4. MARCO TEÓRICO
4.1. Producción de derivados cárnicos en Colombia
10 subproductos cárnicos son distribuidos a través de hipermercados, tiendas especializadas y tiendas al detal (14).
Para el período comprendido entre los meses de octubre y diciembre de 2010, el sacrificio de ganado vacuno representó una variación positiva de 4,3% y 4,7% en la cantidad de cabezas sacrificadas y peso en canal respectivamente, en comparación con el mismo período del año 2009. De igual manera y en el mismo período, el sacrificio de porcinos representó una variación positiva de 9,0% en cabezas y de 12,7% de peso en canal (15). Así mismo, la producción de carnes frías y embutidas resultó en una variación positiva, según los últimos datos reportados por el Departamento de Planeación Nacional (DPN) para el período comprendido entre los años 2006 a 2007 y en los cuales el valor de la producción en miles de pesos llegó a ser de 916.299.948 y 992.467.324, respectivamente (16). Aunque se considera que la producción ganadera de carne y sus derivados alcanza a satisfacer la demanda del mercado local, la admisibilidad de los productos cárnicos colombianos en el mercado internacional se encuentra frenada por debilidades en estándares de productividad y de competitividad, especialmente a nivel sanitario (17).
Para solucionar los inconvenientes que están interrumpiendo los avances alcanzados por la industria cárnica colombiana a nivel comercial, en el 2010 se expidió el documento aprobado del Consejo Nacional de Política Económica y Social (CONPES) 3676, en el que se determinan las estrategias para la lograr la admisibilidad de los productos cárnicos colombianos en los mercados de interés y para alcanzar el principal objetivo del documento: “consolidar la política sanitaria y de inocuidad para las cadenas de la leche y carne bovinas como componente esencial de la competitividad del sector, del mejoramiento de la salud pública y del acceso real a los mercados nacional e internacional”(17).
4.2. Prevalencia en Colombia de L. monocytogenes en derivados cárnicos
En el documento CONPES 3676 de 2010, se reconocen varios inconvenientes sanitarios, cuya formulación se fundamenta en resultados de estudios llevados a cabo en la última década, sobre el seguimiento a microorganismos patógenos (1). Particularmente en la producción de cárnicos, el estudio de prevalencia de L. monocytogenes en derivados cárnicos, llevado a cabo por la SDS de Bogotá durante el 2001 al 2004, arrojó como resultado una prevalencia general del 11.2% de este patógeno en 1075 muestras de derivados cárnicos LPC, y un 37.7% de no aceptabilidad microbiológica de las 1611 muestras de derivados cárnicos analizadas. Entre las diferentes causas propuestas por el estudio, principalmente se encuentran fallas en la manipulación, las materias primas y posibles contaminaciones cruzadas con microorganismos indeseables (4), todas ellas relacionadas con consecuentes contaminaciones de las instalaciones de procesamiento.
4.3. Limpieza y desinfección en la industria de derivados cárnicos
11 Este proceso consta de manera general de dos etapas consecutivas para cumplir su principal objetivo de producir productos seguros y aumentar su
calidad y vida útil: 1º) Una etapa “mecánica”, en la que se remueven residuos
de materia orgánica y 2º) Un etapa de desinfección, en la que las superficies limpias entran en contacto con un desinfectante, a una concentración y por un tiempo indicado. Se considera, que para que este proceso genere el efecto esperado, las características de ambas etapas deben ser determinadas de manera cuidadosa y de acuerdo a resultados de pruebas de eficacia preliminares y respectivas (13).
4.4. Desinfectantes
Los desinfectantes son agentes antimicrobianos que a diferencia de los antibióticos no poseen una especificidad alta y buscan eliminar una gran variedad de microorganismos, en diferentes tipos de industrias (19). Su efectividad depende de factores como la carga antimicrobiana, el pH, la dureza del agua, el tipo de microorganismo objetivo, la formación de Biofilms, su concentración, el tiempo de contacto, entre otros muchos factores (20).
Cualquier tipo de desinfectante utilizado en la industria de alimentos, debe ser elegido según el tipo de proceso llevado a cabo, el tipo de material de sus superficies, y el tipo de microorganismos predominantes y su desarrollo. Además, debe presentar ciertas características, como: no liberar residuos tóxicos o que afecten las propiedades sensoriales del alimento, ser efectivo, seguro, fácil de usar y de enjuagar (19). De manera particular, en el presente estudio únicamente se evaluaron dos tipos de ellos.
4.4.1. Sales de Amonio Cuaternario (QAC)
Estos tipos de desinfectantes también denominados quats, son compuestos de amonio en los que el Nitrógeno se encuentra unido a cuatro compuestos orgánicos. El Nitrógeno adquiere una carga positiva y junto a sus cuatro radicales orgánicos forman la parte catiónica de la molécula, generalmente, su parte aniónica viene siendo un radical de Cloro o Bromo. Aunque su mecanismo de acción no está completamente comprendido, se cree que actúa rodeando la membrana externa de la célula y generando daños en la integridad estructural de la pared, esto produce, rompimiento gradual de la pared celular, liberación de componente internos y/o inhibición de actividad enzimática. Entre sus ventajas se encuentran: ser inodoro e incoloro; no ser tóxico, ni corrosivo, ni irritante; ser altamente estable en diferentes temperaturas, el tiempo y frente a residuos de materia orgánica; presentar capacidad de penetración y de actividad residual (21).
4.4.2. Guanidinas y Biguanidinas
12 el generar menor cantidad de espuma que los QACs, su baja toxicidad y su particular efectividad frente a bacterias (22).
5. OBJETIVOS
5.1. General
Determinar la eficacia de 3 desinfectantes, sobre cepas de L. monocytogenes aisladas de distintas plantas de procesamiento de productos cárnicos, y entendida como la reducción en 5Ulog bajo las condiciones de prueba de la NTC 5150.
5.2. Objetivos específicos
Establecer la concentración más efectiva del desinfectante A, a base de ACBA, sobre cepas de L monocytogenes aisladas de distintas plantas de procesamiento de productos cárnicos, según su respectivo porcentaje de efectividad.
Establecer la concentración más efectiva del desinfectante B, a base de PHMB, sobre cepas de L monocytogenes aisladas de distintas plantas de procesamiento de productos cárnicos, según su respectivo porcentaje de efectividad.
Establecer la concentración más efectiva del desinfectante C, a base de CCP, sobre cepas de L monocytogenes aisladas de distintas plantas de procesamiento de productos cárnicos, según su respectivo porcentaje de efectividad.
6. METODOLOGÍA
6.1. Diseño de la Investigación 6.1.1. Hipótesis
Hipótesis de nulidad (Ho): La concentración recomendada por el fabricante no inhibe el 90% de las cepas de L. monocytogenes, en el tiempo evaluado
Ho: μ ≤ 90 %
Hipótesis alterna (Hi): La concentración recomendada por el fabricante inhibe más del 90% de las cepas de L. monocytogenes, en el tiempo evaluado
Hi: μ > 90 %
Nota: el resultado se estimo para un 95% de confianza
6.1.2. Prueba de Hipótesis
La prueba de hipótesis para proporciones, se desarrollo utilizando la herramienta de Excel MegaStat versión 10.1 2/14/2007.
6.1.3. Población de Estudio y Muestra 6.1.3.1. Población universo
13 6.1.3.2. Población en estudio
Cepas de L. monocytogenes encontradas en plantas de procesamiento de productos cárnicos, en Colombia.
6.1.3.3. Población muestra
40 cepas aisladas de distintas plantas de procesamiento de cárnicos en Colombia (El número de cepas evaluadas, según su fuente, se resume en la Tabla Anexa 3.)
6.1.4. Muestreo
Las 40 cepas utilizadas en el estudio, se obtuvieron a partir del banco de cepas de L. monocytogenes aisladas de distintas plantas de elaboración de derivados cárnicos. El muestreo se realizó a conveniencia con las primeras 40 cepas identificadas como L. monocytogenes.
[image:13.595.81.518.342.494.2]6.1.5. Variables de estudio
Tabla 1. Descripción de las variables de estudio
Tipo de
variable Variable Descripción Unidad de Medida
Independiente Tipo de desinfectante Cualitativa Nominal -
Independiente Concentración de cada desinfectante Cuantitativa continua de razón g/L, %m/v
Dependiente Disminución de la concentración celular Cuantitativa continua de razón UFC/ml
Dependiente Efectividad de desinfección (>5
Ulog/tiempo de contacto) Cualitativa nominal
Efectivo/No efectivo
6.2. Procedimiento
Para la evaluación de la actividad bactericida de cada desinfectante se llevó a cabo la metodología descrita por la NTC 5150 (5)
6.2.1. Suspensión bacteriana
6.2.1.1. Cultivos de primera generación de los organismos de prueba Los cultivos de primera generación, se obtuvieron a partir del banco de L. monocytogenes recuperadas de plantas de procesamiento de cárnicos, del laboratorio de microbiología de alimentos de la Pontificia Universidad Javeriana.
6.2.1.2. Cultivos de trabajo de los organismos de prueba
14 6.2.1.3. Suspensión bacteriana de prueba
A partir del cultivo de trabajo de cada cepa de L. monocytogenes recuperada (véase el numeral 6.2.1.2), ser realizaron suspensiones de prueba en tubos de vidrio tapa rosca y con 20 ml de Agua Triptona Bufferada. Cada suspensión fue homogenizada y llevada hasta una concentración de 108 UFC/ml con ayuda del patrón Numero 1 de Mc Farland (3*108 UFC/ml). Cada suspensión de prueba,
se mantuvo a 20 °C±1 °C en baño termostatado con agua y se utilizó antes de 2 h.
Para el control de la concentración de cada suspensión bacteriana de prueba, se prepararon diluciones 10-6 y 10-7, utilizando como diluyente Agua Triptona Bufferada. Cada dilución fue sembrada por profundidad en medio TSAYE fundido y por duplicado, para su recuento posterior luego de 24 – 48 horas de incubación a 37 ± 1 °C
6.2.1.4. Recuento de las suspensiones bacterianas de prueba
Para el recuento de las suspensiones bacterianas de prueba, se desecharon todas aquellas que no permitieron su recuento. Las placas presentes en cada caja, se contaron hasta un máximo de 300 colonias para determinar el número de unidades formadoras de colonias (UFC) en cada una, a las 24 y 48 horas. El número de colonias a tener en cuenta, luego de ambos recuentos, fue aquel que presentará el número más alto de colonias para cada muestra. La determinación del número de unidades formadoras de colonias se realizó según el anexo 1.
6.2.2. Solución del producto sometido a prueba
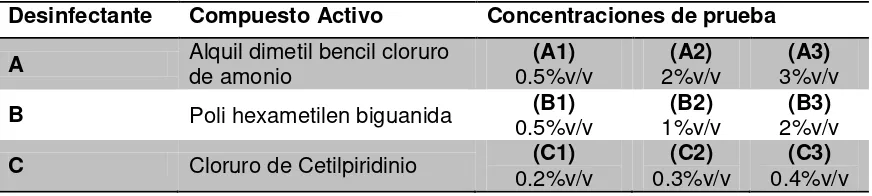
Para la prueba se utilizaron 3 desinfectantes distintos (A, B y C) y cada uno se probó en tres concentraciones distintas dentro del rango de trabajo recomendado por el fabricante (ver Tabla 2). La menor concentración trabajada para cada desinfectante, es la más baja de su rango de trabajo y la mayor la más alta.
Tabla 2. Compuestos activos de cada desinfectante utilizado para la prueba de dilución-neutralización y respectivas concentraciones de prueba
Desinfectante Compuesto Activo Concentraciones de prueba
A Alquil dimetil bencil cloruro de amonio 0.5%v/v (A1) 2%v/v (A2) 3%v/v (A3)
B Poli hexametilen biguanida 0.5%v/v (B1) 1%v/v (B2) 2%v/v (B3)
C Cloruro de Cetilpiridinio 0.2%v/v (C1) 0.3%v/v (C2) 0.4%v/v (C3)
[image:14.595.81.517.562.660.2]15 6.2.3. Solución Neutralizante
En principio, para cada tipo de desinfectante evaluado, se validó un neutralizante adecuado, de acuerdo al procedimiento descrito en el Anexo 2. El neutralizador validado para 5 min ± 10 s de contacto de neutralización, resultó ser una solución de polisorbato 80 (30 g/l), laurilsulfato de sodio 4 (g/l) y lecitina (3 g/l); como diluyente se utilizó una disolución tampón de fosfato (KH2PO4,
0.25 mol/l) ajustada a pH 7,2 ± 0,2 con NaOH 1 mol/l en agua. Para la preparación de la solución neutralizante, 8ml del neutralizante se colocaron en tubos de vidrio junto con 1ml de agua destilada.
6.2.4. Método de dilución-neutralización 6.2.4.1. Generalidades
Antes de arrancar la prueba, se permitió que todos los reactivos (solución del producto a prueba, suspensión bacteriana de prueba, neutralizador) alcanzaran el equilibrio térmico a la temperatura de 20°C ± 1°C, utilizando un baño de agua controlado a esa temperatura. El resto del ensayo se condujo bajo estas condiciones de temperatura.
6.2.4.2 Procedimiento de prueba para verificar la actividad bactericida de los productos
Una vez los reactivos alcanzaron la temperatura indicada, 1ml de la suspensión del microorganismo se añadió al tubo con 9ml de la solución desinfectante de prueba, se mezcló e inmediatamente se inicio la medición del tiempo con un cronómetro. La solución resultante se volvió a colocar en el baño de agua controlado.
Después de transcurridos 5 min (1er tiempo de contacto), 1 ml de la solución anterior, se transfirió al tubo con 9 ml de la solución neutralizante. Luego de 5 min ± 10 s de neutralización, 1 ml de esta solución se recuperó y se sembró en profundidad y por duplicado en Agar TSAYE, la incubación de llevó a cabo durante 48h a 36 ± 1ºC.
El mismo procedimiento se realizó para el 2º tiempo de contacto (15 min).
6.2.4.3. Recuento de la mezcla de la prueba
Para el recuento de la mezcla de prueba, se desechó cualquier placa que no permitiera su recuento. Las placas presentes en cada caja, se contaron hasta un máximo de 300 colonias para determinar el número de UFC en cada una a las 24 y 48 horas, el número más alto de colonias para cada caja, luego de cada tiempo, fue el tenido en cuenta. La determinación del número de unidades formadoras de colonias se realizó mediante la ecuación 1.
Ecuación 1. Ecuación para calcular el recuento viable de la mezcla de prueba, el factor de dilución es 10-1. (Rp = Recuento de prueba; c = Sumatoria del numero de colonias en cada
placa; n = número de placas tenidas en cuenta para el recuento) (5)
16 Para el cálculo de la disminución de la viabilidad se utilizó la ecuación 2.
Ecuación 2. Ecuación para calcular la reducción de viabilidad en la mezcla de prueba. (Ri = Recuento inicial de la suspensión de prueba; Rp = Recuento de mezcla de prueba) (5)
La reducción de la viabilidad de cada caso (tiempo de contacto y concentración, de cada desinfectante) se consideró efectiva, sí luego de la prueba la disminución fuese mayor a 5 Ulog.
6.2.6. Cálculo del porcentaje de efectividad de cada concentración de desinfectante (Análisis estadístico)
Para un nivel (cada tiempo de contacto):
Nota: Para cada concentración y tiempo de contacto.
Ecuación 3. Ecuación para calcular la efectividad de cada concentración de desinfectante, para cada tiempo de contacto (EC = Porcentaje de efectividad). Para conocer el número de cepas analizadas según origen, ver Anexo 3.
Para dos niveles (para cada tiempo de contacto y cada fuente de origen), se utilizó la ecuación 3. pero tomando el total de cepas con disminuciones efectivas de viabilidad, para cada origen de muestra (ver Anexo 3.), cada tiempo de contacto y cada concentración de desinfectante evaluada.
El tiempo de contacto y la concentración, de cada desinfectante, se consideró efectiva, si el porcentaje obtenido en el estudio brindó resultados suficientes para afirmar su efectividad en más del 90% de los casos que se evalúa, en términos de significancia estadística y con una seguridad del 95%.
7. RESULTADOS
7.1. Resultados
Para el desinfectante A, el porcentaje de efectividad fue de 100% para todas las concentraciones y tiempos de contacto evaluados, es decir fue capaz de reducir 5 UL en todos los casos. Para el desinfectante C, en las concentraciones C1 (0.2%v/v) y C2 (0.3%v/v) se presentaron reducciones 97.5% y de 95%, respectivamente, en las demás concentraciones la efectividad fue del 100%.
17 5 minutos
Concentraciones de cada desinfectante A1 A2 A3 B1 B2 B3 C1 C2 C3
E fec tiv idad de D es inf ec ción (%) 0 20 40 60 80 100 15 minutos
Concentraciones de cada desinfectante A1 A2 A3 B1 B2 B3 C1 C2 C3
E fec tiv idad desi nf ec ción (%) 0 20 40 60 80 100
efectividad igual o menor al 87.5%, sugiriendo que no es efectivo para las cepas evaluadas (Ver gráfico 1 y 2).
Los porcentajes de efectividad de los desinfectante B y C, según la fuente el origen de cada cepa evaluada, se encuentran en el gráfico 3 y 4 respectivamente. No se incluyeron los datos del desinfectante A por ser todos del 100%.
Los porcentajes de efectividad que se encontraron por debajo del 90%, para el desinfectante B, se presentaron en tres fuentes particulares (ver gráfico 3.): chorizo (5/6 casos), canal de cerdo (6/6casos) y utensilios (5/6 casos); en promedio el porcentaje de efectividad de aquellos casos por debajo del 90%, fue del 83.3%, 81.82% y de 66,7 % respectivamente. Para el desinfectante C, el único porcentaje de efectividad menor al 90%, se encontró en ensayos realizados sobre cepas obtenidas de muestras de chorizo (ver gráfico 4.) y fue del 83.3%.
Nota: casos hace referencia al número de concentraciones evaluadas para el desinfectante, en cada tiempo de contacto
7.2. Resultados del análisis inferencial
De acuerdo a la prueba de hipótesis realizada para los porcentajes de efectividad de cada concentración según el tiempo de contacto (Ver Gráfico 1 y 2.), únicamente las concentraciones que fueron efectivas sobre el total de las cepas y que poseen un p<0.05 que brindan resultados suficientes para confirmar una efectividad mayor al 90%, en términos de significancia estadística fueron.: 1) todas las concentraciones evaluadas para el desinfectante A; 2) todas aquellas evaluadas para el desinfectante C, en 15 minutos de contacto; y 3) la mayor concentración evaluada para el desinfectante C (0.4%v/v), en 5 minutos de contacto.
8. DISCUSIÓN
De acuerdo a los resultados obtenidos y según los términos del estudio, todas las concentraciones evaluadas para el desinfectante A, a base de ACBA,
Desinfectante A Desinfectante B Desinfectante C
18 fueron efectivas (ver numeral 6.2.6.) además, los resultados de su desempeño fueron muy similares a los obtenidos para el desinfectante C, cuyo principio activo es el CCP (Ver Gráfico 1 y 2.). Aunque ambos desinfectantes poseen una sal de Amonio cuaternario como principio activo, el número de carbonos del radical alquilo del CCP pudo disminuir la capacidad de solubilidad del desinfectante C y de manera proporcional su velocidad de acción en las concentraciones de 0,2% v/v (C1) y 0,3% v/v (C2), para un tiempo de contacto de 5 minutos (ver gráfico 1.) (23). El número de carbonos de los radicales alquilo de los QACs puede aumentar su hidrofobicidad, y en consecuencia limitar: a) la unión de su porción catiónica con fosfolípidos presentes en la pared celular de L. monocytogenes, b) su ingreso hasta la membrana citoplasmática y al interior celular, y c) su capacidad de alterar funciones de permeabilidad y de actividades enzimáticas vitales para la célula (19, 22).
En estudios realizados sobre superficies de alimentos, el CCP ha sido evaluado en salchichas (1%v/v) (23) o carne de res (0,5%v/v) (24); en ambos casos el CCP demostró ser efectivo para la eliminación de L. monocytogenes. Un estudio previo realizado en suspensión con el mismo principio activo, sobre microorganismos como Staphylococcus aureus, Enterococcus faecium, Escherichia coli, Pseudomonas aeruginosa y Candida albicans, demostró ser efectivo únicamente frente a bacterias Gram-positivas, lo que fue corroborado en este caso, por la efectividad observada del desinfectante C sobre las cepas de L. monocytogenes (Gram positivas), evaluadas en el presente estudio (25).
19
Tiempo de contacto (min)
5 min 15 min
Ef ec tiv idad C oncentrac ión 1 (%) 0 20 40 60 80 100
Tiempo de contacto (min)
5 min 15 min
Ef ec tiv idad C oncentrac ión 1 (%) 0 20 40 60 80 100
Tiempo de contacto (min)
5 min 15 min
Ef ec tiv idad Concentrac ión 2 (%) 0 20 40 60 80 100
Tiempo de contacto (min)
5 min 15 min
Ef ec tiv idad C oncentrac ión 3 (%) 0 20 40 60 80 100
Tiempo de contacto (min)
5 min 15 min
Ef ec tiv idad C oncentrac ión 2 (%) 0 20 40 60 80 100
Tiempo de contacto (min)
5 min 15 min
Ef ec tiv idad C oncentrac ión 3 (%) 0 20 40 60 80 100 Chorizo Canal de cerdo
Jamón
Salchicha Utensilio Carne º
Gráfico 3. Efectividad de cada concentración trabajada del desinfectante B, según fuente de origen de las cepas evaluadas.
20 En el caso del desinfectante B, los porcentajes de efectividad obtenidos reflejan deficiencias en su acción bactericida (ver gráfico 1 y 2.) y especialmente, sobre las cepas de L. monocytogenes obtenidas a partir de 3 fuentes específicas: chorizo, canal de cerdo y utensilios (Ver gráfico 4.). De manera similar, las fallas presentadas en la efectividad del desinfectante C, se dieron también en 2 de las fuentes antes mencionadas: chorizo y canal de cerdo (Ver gráfico 5.). De alguna manera, la tolerancia presentada por las cepas obtenidas de estas fuentes, frente a estos dos desinfectantes, podría relacionarse con su persistencia particular, en las instalaciones y equipos de las plantas de chorizo y canal de cerdo muestreadas, debido a que en ciertos casos, la tolerancia de L. monocytogenes frente a ciertos desinfectantes, ha sido atribuida a su posible persistencia en ciertas instalaciones de procesamiento de cárnicos (31). De no ser así, esta condición también podría ser atribuida a: a) fallas en el proceso de rotación del desinfectante B (29, 31, 32) y/o a b) su uso en tiempos de contacto y/o en concentraciones sub-letales (27). De ambas situaciones, es relevante considerar que tratándose de tolerancia a desinfectantes, el evitar la segunda, parece ser la herramienta más indicada y recomendada en la prevención de generación de adaptaciones de supervivencia en microorganismos como L. monocytogenes (33), porque aunque el empleo de rotación de desinfectantes ha sido recomendado para este mismo objetivo, otros estudios también han resaltado su ineficiencia (31) o incluso su responsabilidad en generar mayores respuestas de adaptación en los microorganismos objetivo (28, 29, 33).
En estudios anteriores para desinfectantes con PHMB como principio activo, algunos ensayos se han llevado a cabo en bacterias Gram positivas, como: S. aureus (ATCC 6538), E. faecium (ATCC 6057) (34) y S. epidermidis (ATCC 17917) (35).En el caso de ensayos en suspensión, concentraciones del 0,02% de PHMB demostraron ser efectivas en la eliminación de bacterias Gram positivas como S. aureus y E. faecium, pero en este ensayo se evaluó el desinfectante en proporciones mucho mayores al inoculo de prueba (0,1ml de inoculo de 108 UFC/ml, por cada 10ml de solución desinfectante) (34). Por otro lado, en ensayos de dilución en tubo, la acción del PHMB se reportó como
“pobre” frente a la eliminación S. epidermis, teniendo en cuenta la proporción
de inoculo/desinfectante (1ml/9ml) evaluada en este último ensayo (35), el desempeño del PHMB podría ser más cercano al observado en el presente estudio.
21 9. CONCLUSIÓN
De acuerdo a los parámetros del estudio, el único desinfectante que no demostró ser eficiente en ninguno de los casos evaluados, fue el desinfectante B; el desinfectante C únicamente demostró ser inefectivo en un tiempo de contacto de 5 minutos, para las concentraciones C1 (0.2%v/v) y C2 (0.3%v/v). En el resto de los casos, los desinfectantes A y C, a base de QCAs, demostraron presentar una efectividad superior al 90% y de manera estadísticamente significativa. En los casos que se presentó tolerancia de algunas cepas de L. monocytogenes, este fenómeno podría deberse a factores inherentes del microorganismo o a características propias de cada uno de los principios activos, de cada desinfectante.
De manera descriptiva, no se encontró diferencia entre los porcentajes de efectividad del desinfectante A, por lo que no se pudo determinar la concentración y tiempo de contacto más efectivo, respectivamente. En el caso del desinfectante B, ningún caso de ensayo resultó efectivo (Porcentaje de efectividad >90%). Y en cuanto al desinfectante C: para los 5 minutos de contacto, la concentración más efectiva fue la C3; para 15 minutos de contacto, los porcentajes de efectividad fueron los mismos y la concentración más efectiva no se pudo determinar.
La efectividad observada en esta prueba para los desinfectantes evaluados, se determinó en condiciones ideales de desinfección y sin utilizar ninguna condición limitante real de su acción bactericida, como: mayor concentración de células, formación de biopelículas o presencia de materia orgánica interferente. Debido a esto, los resultados obtenidos aunque no son suficientes para respaldar la utilización en campo de estos desinfectantes, en cada uno de los casos evaluados, sí lo son para descartarlo en caso de no haber cumplido con el parámetro de efectividad establecido por el estudio; según las condiciones de ensayo, su desempeño debió ser completamente satisfactorio.
Debido a la tolerancia que ciertas cepas de L. monocytogenes, de fuentes particulares, presentaron frente a algunos de los desinfectantes evaluados, cabe la posibilidad de que exista una relación directa entre estas cualidades de tolerancia y la persistencia estas cepas, en las instalaciones de procesamiento de cárnicos de donde se obtuvieron.
Por último, es importante resaltar, que la gran importancia de este tipo de pruebas radica en su papel como herramienta de prevención del desarrollo de capacidades de tolerancia a agentes desinfectantes, por microorganismos patógenos como L. monocytogenes, debido a que evitan el uso de estas sustancias en condiciones sub-letales y responsables de este tipo de inconvenientes, muy posiblemente en mayor medida que la no rotación de desinfectantes.
10. RECOMENDACIONES
22 el estudio, de manera que se sustente su desempeño adecuado, en condiciones de campo. Además, se debería determinar la presencia de adaptaciones de supervivencia, en las cepas tolerantes identificadas por el estudio, ya que este tipo de mecanismos también podrían estar asociados con la resistencia a antibióticos, por eso se sugiere relacionar las cepas que presentaron tolerancia a ciertos desinfectantes, en el presente estudio, con aquellas que presentaron resistencia a antibióticos en el estudio de Velazco 2010 (36), realizado anteriormente con las mismas cepas del presente estudio.
11. BIBLIOGRAFÍA
1. Codex Alimentarius. DIRECTRICES SOBRE LA APLICACIÓN DE PRINCIPIOS GENERALES DE HIGIENE DE LOS ALIMENTOS PARA EL CONTROL DE LISTERIA MONOCYTOGENES EN LOS ALIMENTOS. CAC/GL 61 – 2007, 30p.
2. Even H, Bjørn-Arne L, Ole-Johan R, Traute V, Georg K, Truls N. Molecular epidemiology and disinfectant susceptibility of Listeria monocytogenes from meat processing plants and human infections. International Journal of Food Microbiology 2004; 96, 85– 96
3. FAO, OMS. Evaluación de riesgos de Listeria monocytogenes en alimentos listos para el consumo - Resumen interpretativo. Serie de evaluación de riesgos microbiológicos. 2004, 88p.
4. Vera H, Ferro CJ, Triana LM. Prevalencia de Listeria moncytogenes en derivados cárnicos cocidos para consumo directo analizados en el laboratorio de salud pública, Bogotá 1 de septiembre 2001‐ 31 agosto de 2004. 2006, 20p.
5. ICONTEC. NTC 5150: Antisépticos y desinfectantes químicos. actividad bactericida básica. Método de prueba y requisitos (FASE 1). 2003, 34p. 6. Martinez J. What is Disinfectant Validation?
http://pharmtech.findpharma.com/pharmtech/article/articleDetail.jsp?id=3112 52 Consultado el 25 de Febrero de 2011.
7. Ortiz SM. El consumo y el consumidor Colombiano. IAlimentos 2011; 19, 10 8. Colombia, Presidencia de la República (1997), “Decreto 3075 de 1997, Por
el cual se reglamenta parcialmente la Ley 09 de 1979 y se dictan otras,
disposiciones”, en Diario Oficial, núm. 43205, 31 de Diciembre de 1997,
Bogotá.
9. Colombia, Ministerio de la Protección Social (2007, 4 de Mayo), “Decreto número 1500 de 2007 (Mayo 4), por el cual se establece el reglamento técnico a través del cual se crea el Sistema Oficial de Inspección, Vigilancia y Control de la Carne, Productos Cárnicos Comestibles y Derivados Cárnicos Destinados para el Consumo Humano y los requisitos sanitarios y de inocuidad que se deben cumplir en su producción primaria, beneficio, desposte, desprese, procesamiento, almacenamiento, transporte,
comercialización, expendio, importación o exportación”, en Diario Oficial,
núm. 46.618, 4 de mayo de 2007, Bogotá.
10. Chapman JS. Disinfectant resistance mechanisms, cross-resistance, and co-resistance. International Biodeterioration & Biodegradation 2003; 51, 271
23 11. Buckingham-Meyer K, Goeres DM, Hamilton MA. Comparative evaluation of biofilm disinfectant efficacy tests. Journal of Microbiological Methods 2007; 70, 236–244
12. Holah JT, Lavaud A, Peters W, Dye KA. Future techniques for disinfectant efficacy testing. International Biodeterioration & Biodegradation 1998; 41, 273-279
13. Wirtanen G, Salo S. Disinfection in food processing – efficacy testing of disinfectants. Reviews in Environmental Science and Bio/Technology 2003; 2, 293–306
14. Departamento nacional de planeación (DNP). Cadenas productivas: Estructura, comercio internacional y protección. DNP, Colombia. 2004, 516p.
15. Dane. Sacrificio de ganado: Comunicado de Prensa - IV trimestre de 2010.
http://www.dane.gov.co/files/investigaciones/boletines/sacrificio/cp_sacrificio _IVTrim10.pdf Consultado el 25 de Febrero de 2011
16. DNP. Análisis de cadenas productivas – cárnicos.
http://www.dnp.gov.co/PortalWeb/LinkClick.aspx?fileticket=CqpNix4ZJ5E%3 d&tabid=996 Consultado el 25 de Febrero de 2011
17. CONPES. Documento CONPES 3676: Consolidación de la política sanitaria y de inocuidad para las cadenas láctea y cárnica. Bogotá D.C., Colombia. 2010, 84p.
18. Navratilova P, Schlegelova J, Sustackova A, Napravnikova E, Lukasova J, Klimova E. Prevalence of Listeria monocytogenes in milk, meat and foodstuff of animal origin and the phenotype of antibiotic resistance of isolated strains. Vet. Med. – Czech 2004; 49 (7), 243–252
19. Denyera SP, Stewartb GS. Mechanisms of action of disinfectants. International Biodeterioration & Biodegradation 1998; 41, 261-268
20. Mara D, Hora N. Handbook of Water and Wastewater Microbiology: Microbial response to disinfectants. Academic Press. Londres, Inglaterra. 2003, 819 p.
21. Marriott NG, Gravani RB. Principles of Food Sanitation. Quinta Edición. Food Science Text Series. Nueva York, Estados Unidos. 2006, 413 p.
22. Paulus W. Directory of Microbicides for the Protection of Materials. Springer Netherlands. 2005, 787p.
23. Singh M, Gill VS, Thippareddi H, Phebus RK, Marsden JL, Herald TJ, Nutsch AL. Antimicrobial Activity of Cetylpyridinium Chloride against Listeria monocytogenes on Frankfurters and Subsequent Effect on Quality Attributes. Journal of Food Protection 2005; 8 (9), 1823-1830
24. Lima K, Mustapha A. Inhibition of Escherichia coli O157:H7, Listeria monocytogenes and Staphylococcus aureus on sliced roast beef by cetylpyridinium chloride and acidified sodium chlorite. Food Microbiology 2007; 24, 89–94
25. Suller MTE, Russell AD. Antibiotic and biocide resistance in methicillin-resistant Staphylococcus aureus and vancomycin-resistant enterococcus. Journal of Hospital infection 1999; 43, 28I-29I
24 27. Ayla S,ENER*, Ayhan TEMI・Z Efficacy of some commercial disinfectants against the bacterial isolates from a poultry slaughterhouse in Turkey. Annals of Microbiology 2007; 57 (1), 101-108
28. Aarnisalo K, Lundén J, Korkeala H, Wirtanen G. Susceptibility of Listeria monocytogenes strains to disinfectants and chlorinated alkaline cleaners at cold temperatures. LWT 2007; 40, 1041–1048
29. Ruiz Z, Poutou RA, Carrascal AK. Review: Resistencia antimicrobiana y a desinfectantes de Listeria spp. NOVA-Publicación Científica EN CIENCIAS BIOMÉDICAS 2008; 10 (6), 101-236
30. Holah JT, Lavaud A, Peters W, Dye KA. Future techniques for disinfectant efficacy testing. International Biodeterioration & Biodegradation 1998; 41, 273-279
31. Gandhi M, Chikindas ML. Review; Listeria: A foodborne pathogen that knows how to survive. International Journal of Food Microbiology 2007; 113, 1–15
32. Heira E, Lindstedta B, Røtterudb O, Vardunda T, Kapperuda G, Nesbakkenb T. Molecular epidemiology and disinfectant susceptibility of Listeria monocytogenes from meat processing plants and human infections. International Journal of Food Microbiology 2004; 96, 85– 96
33. Alonso-Hernando A, Capita R, Prieto M, Alonso-Calleja C. Adaptation and croos adaptation of Listeria monocytogenes and Salmonella enterica to poultry decontaminant. The Journal of Microbiology 2009; 47 (2),142-146 34. Müller G, Kramer A. In vitro action of a combination of selected antimicrobial
agents and chondroitin sulfate. Chemico-Biological Interactions 2000; 124, 77–85
35. Sakuma S, Reeh B, Dang D, Harris MG. Comparative efficacies of four soft contact lens disinfection solutions. International Contact Lens Clinic 1996; 23, 234-241
36. Velazco, A. (2010), Detección de la susceptibilidad antimicrobiana de aislamientos de Listeria monocytogenes “Trabajo de grado”, Bogotá D.C.
25 12. ANEXOS
Anexo 1. Cálculo del recuento viable de la suspensión bacteriana de prueba (ufc/ml)
Los recuentos viables de la suspensión bacteriana de prueba se calcularon según los principios descritos en la norma ISO 7218 de la forma siguiente:
a) Para el cálculo de los recuentos viables solo se utilizaron recuentos de colonias que fuesen inferiores a 300 ufc/placa. Para que el resultado fuera válido, los recuentos viables se calcularon utilizando al menos un par de placas, que tuviesen más de 15 y menos de 300 colonias. Si las placas de dos diluciones estaban en este intervalo, se calcula el número de ufc/ml como la media ponderada de los recuentos. Si las placas de solamente una de las diluciones están en este intervalo, se calcula la media aritmética de los recuentos.
b) Para el cálculo de la media ponderada (en ufc/ml), se utilizó la fórmula siguiente:
Ecuación Anexa 1. En donde:c, es la suma de las colonias contadas sobre todas las placas que se tienen en cuenta; n1, es el número de placas que se toman en cuenta en la primera dilución; n2, es el número de placas que se toman en cuenta en la segunda dilución; y d, es el factor de dilución correspondiente a la primera dilución que se toma en cuenta.
Los resultados calculados se expresaron con dos cifras significativas. Para ello se realizó un redondeo en el cual, si la última cifra era inferior a 5, la cifra precedente no se modificaba; si la última cifra era superior a 5, la cifra precedente se aumentaba en una unidad; si la última cifra era igual a 5, se redondeaba la cifra precedente a la cifra par más cercana. Se procedió paso a paso hasta expresar el resultado con dos cifras significativas.
c) De lo anterior se desprende que el número de ufc/ml se expresó por un número comprendido entre 1,0 y 9,9 multiplicado por la potencia de 10 apropiada.
d) Para el cálculo de la media aritmética se procedió según la ecuación 1.
Anexo 2. Validación del método de dilución-neutralización
A 2.1. Preparación de la suspensión bacteriana
A 2.1.1. Cultivos de primera generación de los organismos de prueba Los cultivos de primera generación, se obtuvieron a partir del banco de L. monocytogenes recuperadas de plantas de procesamiento de cárnicos, del laboratorio de microbiología de alimentos de la Pontificia Universidad Javeriana
A 2.1.2. Cultivos de trabajo de los organismos de prueba
26 Cada siembra se incubó por 18 h - 24 h a 37 ± 1 °C, para su uso como fuente de la suspensión bacteriana de prueba. En caso de no poderse utilizar el primer subcultivo de trabajo, se realizaron no más de 3 repiques de cada subcultivo realizado para cada cepa, siempre y cuando estos hubieran sido mantenidos todo el tiempo en el incubador.
A 2.1.3. Suspensión bacteriana de prueba
A partir del cultivo de trabajo de cada cepa de L. monocytogenes recuperada, ser realizaron suspensiones de prueba en tubos de vidrio tapa rosca y con 20 ml de Agua Triptona Bufferada. Cada suspensión fue homogenizada y llevada hasta una concentración comprendida entre 6x102 ufc/ml y 3 x 103 UFC/ml, con ayuda del patrón Numero 1 de Mc Farland (3*108 UFC/ml) y posteriores diluciones. Cada suspensión de prueba, se mantuvo a 20 °C±1 °C en baño de agua controlado y se utilizó antes de 2 h.
Para el control de la concentración de cada suspensión bacteriana de prueba, se preparó una dilución 10-1, utilizando como diluyente Agua Triptona Bufferada, la cual fue sembrada por profundidad en medio TSAYE fundido y por duplicado, para su posterior recuento luego de 24 – 48 horas de incubación a 37 ± 1 °C
A 2.1.4. Recuento de la suspensión bacteriana de prueba (Nv).
Para el recuento de las suspensiones bacterianas de prueba, se desecharon todas aquellas que no permitieron su recuento. Las placas presentes en cada caja, se contaron hasta un máximo de 300 colonias para determinar el número de unidades formadoras de colonias (UFC) en cada una, a las 24 y 48 horas. El número de colonias a tener en cuenta, luego de ambos recuentos, fue aquel que presentará el número más alto de colonias para cada muestra. La determinación del número de unidades formadoras de colonias se realizó según el anexo 1.
A 2.2. Preparación de la solución del producto sometido a prueba
Este procedimiento se llevó a cabo según el numeral 6.3., pero la única concentración evaluada fue la mayor para cada desinfectante y no se agregaron únicamente 1 ml de agua destilada, a cada tuvo con la solución desinfectante, se agregaron 2ml de agua destilada por cada 8ml de solución desinfectante.
A 2.3. Prueba de validación del neutralizante A 2.3.1. Generalidades
Antes de arrancar la prueba, se dejó que todos los reactivos (solución del producto a prueba, suspensión bacteriana de prueba, neutralizador) alcanzaran el equilibrio térmico a la temperatura de 20°C ± 1°C, utilizando un baño de agua controlado a esa temperatura. El resto del ensayo se condujo bajo estas condiciones de temperatura.
27 8,0 ml del neutralizador especificado en el numeral 6.2.3., se colocaron en cada uno de dos recipientes de capacidad adecuada. Luego ambos recipientes se llevaron a 20 °C ± 1 °C en baño de agua controlado.
Para el control de toxicidad del neutralizador, se añadió 1,0 ml de agua destilada al primer recipiente.
Para el control del método de dilución-neutralización, se añadió 1,0 ml de la solución del producto a ensayar, preparada como se describe en el literal A 2.2., al segundo recipiente.
A continuación de este procedimiento, cada solución se mezcló y se dejó en contacto durante 5 min ± 10 s. Pasado este tiempo, se añadió 1,0 ml de la suspensión bacteriana preparada para la validación (véase el literal A 2.1.3.) a cada uno de los recipientes y se mezcló. Por último, se dejó reposar a 20 °C ± 1 °C durante 30 min ± 1 min cada solución y se recuperó una muestra de 1,0 ml de cada uno de los recipientes para su siembra en profundidad y por duplicado en agar TSAYE. Cada siembra se incubó a 37 ºC ± 1 °C y por 24-48 h.
A 2.3.3. Recuento del control de la toxicidad del neutralizador (Nx) y del control de dilución-neutralización (Nv)
Para el recuento del control de la toxicidad del neutralizador y del control de dilución-neutralización, se desechó cualquier placa que no permitiera su recuento. Las placas presentes en cada caja, se contaron hasta un máximo de 300 colonias para determinar el número de UFC en cada una a las 24 y 48 horas, el número más alto de colonias para cada caja, luego de cada tiempo, fue el tenido en cuenta. La determinación del número de unidades formadoras de colonias se realizó mediante la ecuación 1., tanto para el control de la toxicidad del neutralizador (Nx) como para el control de dilución-neutralización (Ny).
A 2.4. Verificación de la metodología y validación del método de dilución-neutralización para la concentración del producto sometido a la prueba
[image:27.595.94.509.559.750.2]28 Tabla Anexa 3. Resumen del
número de cepas evaluadas, según su fuente
Total de muestras analizadas
Chorizo 6
Canal de
cerdo 20
Jamón 4
Salchicha 6
Utensilio 3
Carne 1
Total 40
[image:28.595.80.518.90.510.2] [image:28.595.201.378.548.761.2]
Tabla Anexa 2. Resultados para la validación del neutralizante utilizado en el estudio
Anexo 3. Origen de cada cepa evaluada en el estudio y respectiva cantidad Desin fe ct an te E nsa yo
Recuento viable (UFC/ml) Suspensión
bacteriana de prueba (véase el numeral A 2.1.4.)
(N)
Control de toxicidad con el neutralizador (véase el numeral A
2.3.3.) (Nx)
Control de dilución- neutralización (véase el numeral A
2.3.3.) (Ny)
A
1 2*103 >3*103 >3*103
2 1,5*103 2,7*103 1,6*103
3 1,5*103 2,6*103 1,9*103
4 2,8*103 >3*103 2,7*103
5 2,8*103 2,6*103 2,7*103
B
1 2*103 >3*103 >3*103
2 1,5*103 2,7*103 1,7*103
3 1,5*103 2,6*103 1,9*103
4 1,9*103 4,1*102 2,7*102
5 1,9*103 4,4*102 3,3*102
6 2,8*103 >3*103 2,9*103
7 2,8*103 2,6*103 2,8*103
C
1 1,5*103 2,7*103 1,7*103
2 1,5*103 2,6*103 2,6*103
3 1,9*103 4,1*102 2,7*103
4 1,9*103 4,4*102 3,3*103
5 2,8*103 >3*103 2,9*103
29 Anexo 4. Estructura molecular de los componentes activos de cada desinfectante evaluado
Tabla anexa 4. Estructura molecular de los componentes activos de cada desinfectante evaluado (22).
Desinfectante A Desinfectante B Desinfectante C
Alquil dimetil bencil cloruro de
[image:29.595.45.553.159.299.2]