Alteraciones energéticas del síndrome metabólico implicadas en la neurodegeneración y Alzheimer
Texto completo
(2) UNAM – Dirección General de Bibliotecas Tesis Digitales Restricciones de uso DERECHOS RESERVADOS © PROHIBIDA SU REPRODUCCIÓN TOTAL O PARCIAL Todo el material contenido en esta tesis esta protegido por la Ley Federal del Derecho de Autor (LFDA) de los Estados Unidos Mexicanos (México). El uso de imágenes, fragmentos de videos, y demás material que sea objeto de protección de los derechos de autor, será exclusivamente para fines educativos e informativos y deberá citar la fuente donde la obtuvo mencionando el autor o autores. Cualquier uso distinto como el lucro, reproducción, edición o modificación, será perseguido y sancionado por el respectivo titular de los Derechos de Autor..
(3) JURADO ASIGNADO:. PRESIDENTE:. DR. JESUS FERNANDO MONTIEL AGUIRRE. VOCAL:. M. en C. LUCIA CORNEJO BARRERA. SECRETARIO:. Dra. KARLA GUADALUPE CARVAJAL AGUILERA. 1er. SUPLENTE: Dra. ILIANA ELVIRA GONZALEZ HERNANDEZ 2° SUPLENTE:. DRA. LAURA CARMONA SALAZAR. SITIO DONDE SE DESARROLLÓ EL TEMA: LABORATORIO DE NUTRICIÓN EXPERIMENTAL, INSTITUTO NACIONAL DE PEDIATRÍA. ASESOR DEL TEMA: Dra. KARLA GUADALUPE CARVAJAL AGUILERA SUSTENTANTE (S): JOCELINE AIDEE BAIRES LÓPEZ.
(4) Contenido RESUMEN: ...................................................................................................................................................................1 LISTADO DE ABREVIATURAS .............................................................................................................................1 LISTADO DE TABLAS Y FIGURAS .....................................................................................................................3 1.- INTRODUCCIÓN..................................................................................................................................................2 2.- MARCO TEORICO ..............................................................................................................................................4 2.1.-DEFINICIÓN DE SÍNDROME METABÓLICO ..........................................................................................4 2.2.-DEFINICIÓN DE ALZHEIMER ......................................................................................................................5 2.2.1.-HIPOCAMPO E HIPOTÁLAMO: FUNCIONES Y DAÑO EN LA ENFERMEDAD DE ALZHEIMER ............................................................................................................................................................6 2.2.2.-FORMACIÓN DE Aβ ................................................................................................................................6 2.2.3.-PROTEÍNA TAU (τ) ...................................................................................................................................8 2.3.- FACTORES DE RIESGO QUE COMPONEN AL SÍNDROME METABÓLICO ............................8 2.3.1.-DIABETES ........................................................................................................................................................8 2.3.2.-RESISTENCIA A LA INSULINA........................................................................................................9 2.3.3.-OBESIDAD ..............................................................................................................................................9 2.3.4.-DISLIPIDEMIAS ...................................................................................................................................10 2.3.5.-HIPERINSULINEMIA .........................................................................................................................11 2.3.6.-HIPERTENSIÓN ..................................................................................................................................12 2.4.-VÍAS METABÓLICAS DAÑADAS EN EL SÍNDROME METABÓLICO ......................................12 2.4.1.-CINASA DEPENDIENTE DE AMP (AMPK) ................................................................................13 2.4.2.-PROTEÍNA CINASA B (AKT) ..........................................................................................................14 2.5.- RELACIÓN SÍNDROME METABÓLICO Y ENFERMEDAD DE ALZHEIMER .......................15 2.6.-ESTRÉS OXIDATIVO Y LA ENFERMEDAD DE ALZHEIMER ....................................................17 2.6.1.-ALTERACIONES EN EL METABÓLISMO Y LA ENFERMEDAD DE ALZHEIMER ......18 2.7.- USO DEL FÁRMACO METFORMINA EN LA ENFERMEDAD DE ALZHEIMER Y EL SÍNDROME METABÓLICO ..............................................................................................................................20 2.8.- MODELOS UTILIZADOS PARA EL ESTUDIO DE LA ENFERMEDAD DE ALZHEIMER RELACIONADOS CON EL SÍNDROME METABÓLICO .........................................................................21 3.- PLANTEAMIENTO DEL PROBLEMA .....................................................................................................22 4.-OBJETIVOS ......................................................................................................................................................23 5.-HIPÓTESIS .......................................................................................................................................................23 6.-DISEÑO EXPERIMENTAL...........................................................................................................................24.
(5) 7.- METODOLOGÍA.............................................................................................................................................25 7.1.-INDUCCIÓN DEL SÍNDROME METABÓLICO..................................................................................25 7.2.-EXTRACCIÓN Y LISIS DE TEJIDOS ...............................................................................................25 7.3.- MEDICIÓN DE PARAMETROS BIOQUÍMICOS .........................................................................26 7.4.-CUANTIFICACIÓN DE PROTEÍNAS ...............................................................................................27 7.5.-WESTERN BLOT ....................................................................................................................................28 7.6.-ACTIVIDAD DE LA ENZIMA CREATINA CINASA .......................................................................29 7.7.-ANÁLISIS ESTADÍSTICO ....................................................................................................................30 8.- RESULTADOS ...............................................................................................................................................31 8.1.- MODELO DE SÍNDROME METABÓLICO ....................................................................................31 8.2.- ACTIVACIÓN DE LA PROTEÍNA AKT ...........................................................................................33 8.3.- ACTIVACIÓN DE LA PROTEÍNA AMPK .......................................................................................34 8.4.- EXPRESIÓN DE LA PROTEÍNA APP COMO MARCADOR DE LA NEURODEGENERACIÓN ............................................................................................................................35 8.5.- ACTIVIDAD ESPECIFÍFICA DE LA ENZIMA CREATINA CINASA ......................................36 9.- DISCUSIÓN.....................................................................................................................................................37 9.1 MODELO DE SÍNDROME METABÓLICO .......................................................................................37 9.2.- FOSFORILACIÓN DE LA PROTEÍNA AKT ..................................................................................38 9.3.- FOSFORILACIÓN DE LA PROTEÍNA AMPK .............................................................................40 9.4.- EXPRESIÓN DE APP COMO MARCADOR DE NEURDEGENERACIÓN .........................41 9.5.- ACTIVIDAD DE LA ENZIMA CREATINA CINASA......................................................................42 10.- CONCLUSIONES ........................................................................................................................................44 11.-BIBLIOGRAFÍA..............................................................................................................................................45.
(6) LISTADO DE ABREVIATURAS. τ: Proteína Tau Aβ: Amiloide Beta AHA: Asociación Americana del Corazón AKT: Proteína Cinasa B AMP: Adenosin Monofosfato AMPK: Cinasa dependiente de AMP APP: Proteína Precursora de Aβ ATPIII: Adult Treatment Panel III BACE1: γ-secretasa CK: Enzima Creatina Cinasa CK-BB: Creatina Cinasa cerebral DM: Diabetes Mellitus EA: Enfermedad de Alzheimer EGIR: European Group for the Study of Insulin Resistance. GAA: Glucemia alterada en ayunas. HDL: High Density Lipoprotein. IDF: International Diabetes Federation IMC: Índice de Masa Corporal PCr: Fosfocreatina.
(7) NAF: Fluoruro Sódico NaPii: Pirofosfato de sodio NHLBI: Instituto Nacional del Corazón, Sangre y Pulmón OMS: Organización Mundial de la Salud RI: Resistencia a la Insulina RNS: Especies Reactivas de Nitrógeno ROS: Especies Reactivas de Oxígeno SM: Síndrome Metabólico SNC: Sistema Nervioso Central TG: Triglicéridos TGA: tolerancia a la glucosa alterada.
(8) LISTADO DE TABLAS Y FIGURAS. Tablas Tabla 1: Criterios utilizados para el diagnóstico del Síndrome Metabólico Tabla 2: Niveles patológicos de lípidos para el diagnóstico de riesgo cardiovascular Tabla 3: Niveles de presión utilizados para el diagnóstico de enfermedades cardiovasculares. Tabla 4: Características del modelo de rata con Síndrome Metabólico Tabla 5: Actividad de CK en hipocampo e hipotálamo Figuras Figura 1: Prevalencia de demencia en el mundo Figura 2: Principales causas de muerte a nivel mundial. Figura 3: Procesamiento de APP para la formación de Aβ Figura 4: Relación Síndrome metabólico y Enfermedad de Alzheimer Figura 5: Esquema general de las reacciones que se llevan a cabo en el método de Lowry Figura 6: Activación de la proteína AKT Figura 7: Activación de la proteína AMPK Figura 8: Expresión de APP como marcador de la neurodegeneración.
(9) RESUMEN: El Síndrome metabólico se define como un cuadro caracterizado por la agrupación de factores de riesgo cardiovascular (aumento de triglicéridos con disminución de colesterol HDL, hipertensión arterial y obesidad abdominal) asociado a la resistencia a la insulina la cual de acuerdo a esta definición, es la principal responsable. La enfermedad de Alzheimer, se define como una enfermedad neurodegenerativa caracterizada clínicamente por la pérdida progresiva de la memoria y demás funciones cognitivas, afectando principalmente a personas de edad avanzada. En los últimos años, se ha demostrado que cada uno de los factores que componen al Síndrome metabólico son factores de riesgo para desarrollar la enfermedad de Alzheimer. Objetivo: estudiar la relación que existe entre los desequilibrios energéticos y algunos marcadores de neurodegeneración en el hipocampo e hipotálamo en modelos animales con SM. Metodología: Se indujo el Síndrome metabólico a ratas macho tipo Wistar mediante una dieta de sacarosa al 30% en el agua de beber por 16 semanas. Una vez terminadas estas semanas se separaron 8 ratas y se les dio un tratamiento de metformina de 100mg/kg peso corporal por 4 semanas y como control se utilizaron ratas con agua simple ad libitum. Se extrajo el hipocampo, e hipotálamo de los animales de cada grupo para posteriormente mediante la técnica de Western Blot observar la activación de las proteínas AMPK y AKT involucradas en el metabolismo energético, así como la presencia de la proteína APP como marcador de la neurodegeneración. Se midió también la actividad de la enzima creatina cinasa, la cual es reguladora de la energía celular en el cerebro y es sensible al estrés oxidativo. Resultados: Se encontró un aumento en las proteínas AMPK y AKT en los grupos con Síndrome metabólico dando un indicio de una etapa de compensación a etapas tempranas del síndrome metabólico. En cuanto a la proteína APP, existe una tendencia al aumento de está en el grupo con síndrome metabólico mientras que el grupo con metformina presenta un incremento significativo en comparación a los otros grupos. Para el caso de la enzima creatina cinasa, se observa una disminución en la actividad del grupo con síndrome metabólico, comparado con el control mientras que cuando se les da el tratamiento con metformina, se regenera la actividad de la enzima dando un indicio de una posible actividad protectora por parte del fármaco. Conclusiones: El estado energético de los tejidos cerebrales analizados se encuentra disminuido en el síndrome metabólico a pesar de que es una etapa temprana, lo que indica que a pesar de que las vías metabólicas involucradas en esta patología, la vía de la insulina y de la glucosa, no se encuentran dañadas, por el contrario se encuentra en una etapa de compensación puesto que el papel de la insulina y la glucosa es de suma importancia en el cerebro para mantener adecuadamente sus funciones evitando un daño mayor. 1.
(10) 1.- INTRODUCCIÓN La demencia es un síndrome que implica el deterioro de la memoria, el intelecto, el comportamiento y la capacidad de realizar actividades de la vida diaria. La enfermedad de Alzheimer (EA) es la causa de demencia más común, acapara entre un 60% y 70% de los casos, la cual se encuentra como uno de los principales retos en cuanto a salud pública a los que el mundo se enfrenta hoy en día. Existen cerca de 44 millones de personas alrededor del mundo con algún tipo de demencia, en México se estima que existen cerca de 800,000 personas afectadas (Figura 1).. Figura 1: Prevalencia de demencia en el mundo. Asociación Internacional de la Enfermedad de Alzheimer 2009. [1] En los últimos años se ha tratado de demostrar que la enfermedad de Alzheimer se encuentra estrechamente relacionada con cada uno de los factores de riesgo que componen al síndrome metabólico como son la obesidad, dislipidemias, presión arterial alta, resistencia a la insulina y enfermedades cardiovasculares las cuales son la principal causa de muerte en el mundo. Cada año aumenta la prevalencia de estas enfermedades lo que puede implicar a su vez, un aumento en la prevalencia de la enfermedad de Alzheimer[2]. 2.
(11) Figura 2: principales causas de muerte a nivel mundial [3]. Se utilizó un modelo animal de síndrome metabólico y se extrajeron tejidos cerebrales, específicamente el hipocampo y el hipotálamo para analizar mediante técnicas semicuantitativas la activación de algunas proteínas involucradas en las vías más importantes para el síndrome metabólico que se encuentran dañadas en esta patología así como la presencia de las proteínas implicadas en la Enfermedad de Alzheimer. Por otro lado, se habla de que el estado metabólico de los tejidos involucrados se encuentra dañado por lo que se midió la actividad de una enzima muy sensible al estrés oxidativo presente en ambas patologías, la creatina cinasa (CK), presente en las mitocondrias y así observar el nivel de daño en los tejidos.. 3.
(12) 2.- MARCO TEORICO 2.1.-DEFINICIÓN DE SÍNDROME METABÓLICO El síndrome metabólico (SM) se describió por primera vez en 1988 por Reaven y le dio el nombre de Síndrome X que se define como un cuadro caracterizado por la agrupación de factores de riesgo cardiovascular (aumento de triglicéridos con disminución de colesterol HDL, hipertensión arterial y obesidad abdominal) asociado a la resistencia a la insulina la cual de acuerdo a esta definición, es la principal responsable. A partir de esta definición diversas organizaciones e instituciones han modificado la definición así como los parámetros bioquímicos para el diagnóstico del síndrome metabólico. Tabla 1: Criterios utilizados para el diagnóstico del síndrome metabólico [4]. MEDICIÓN. OMS. EGIR. ATPIII. AHA/NHLBI. IDF. CLÍNICA. 3 de las. más de dos. 3 de los. 3 de las. más de dos. siguientes. de las. siguientes. siguientes. de las. alteraciones. siguientes. alteraciones. alteraciones. siguientes. alteraciones. INSULINO. GAA, TGA,. Insulina. RESISTENCIA. DM tipo 2 o. plasmática˃. disminución. percentil 75. alteraciones. No. No. No. a la sensibilidad a la insulina. OBESIDAD. IMC ˃30 y/o. Cintura ≥95. Cintura. Cintura ≥102. Cintura ≥del. relación. cm en. ≥102 cm en. cm en. umbral. cintra. varones y. varones y. varones y. definido. cadera˃0.9. ≥80 cm en. ≥88 cm en. ≥88 cm en. para cada. en varones. mujeres. mujeres. mujeres. grupo étnico. o ˃0.85 en. 4.
(13) mujeres. DISLIPIDEMIA. TG≥150. TG≥150. TG≥150. TG≥150. TG≥150. S. mg/dL y/o. mg/dL y/o. mg/dL. mg/dL*. mg/dL*. HDL <35. HDL <35. mg/dL en. mg/dL en. varones o. varones o. <39 mg/dL. <39 mg/dL. en mujeres.. en mujeres.. o HDL<40. o HDL*<40. o HDL*<40. mg/dL en. mg/dL en. mg/dL en. varones o. varones o. varones o. <50 mg/dL. <50 mg/dL. <50 mg/dL. en mujeres.. en mujeres.. en mujeres.. PRESIÓN. ≥140/90 mm ≥140/90 mm ≥130/85 mm ≥130/85 mm. ≥130/85 mm. ARTERIAL. Hg. Hg*. GLUCEMIA. Hg. Hg. Hg*. GAA,TGA o. Glucemia. Glucemia* en Glucemia*. DM tipo 2. en. ayunas˃110. en. ayunas˃110. mg/dL. ayunas˃110. mg/dL OTROS. mg/dL. Micro albuminuria. * o en tratamiento con fármacos. 2.2.-DEFINICIÓN DE ALZHEIMER La enfermedad de Alzheimer (EA), se define como una enfermedad neurodegenerativa caracterizada clínicamente por la pérdida progresiva de la memoria y demás funciones cognitivas,. afectando. principalmente. a. personas. de. edad. avanzada.. Neuropatológicamente, en la EA se encuentran principalmente 2 tipos de lesiones: i) Placas neuríticas causadas principalmente por una acumulación extracelular del péptido Amiloide β (Aβ) el cual se acumula en las arterias intra-cerebrales dando como resultado una angiopatía amiloidal cerebral la cual se observa en más del 80% de los pacientes con la EA; y ii) las marañas neurofibrilares ocasionadas por una hiperfosforilación de la proteína Tau (τ). La hipótesis en la EA sugiere que la aparición de las dos lesiones antes mencionadas, es un evento fundamental que conlleva al desarrollo eventual de la enfermedad; mientras que las demás patologías son eventos secundarios [5]. 5.
(14) 2.2.1.-HIPOCAMPO E HIPOTÁLAMO: FUNCIONES Y DAÑO EN LA ENFERMEDAD DE ALZHEIMER En el presente estudio se decidió trabajar con el hipocampo e hipotálamo debido a que ambos tejidos se ven afectados con la EA. El hipocampo es una pequeña estructura que forma parte del sistema límbico y juega un papel muy importante en la memoria y la navegación espacial. Se localiza dentro del lóbulo temporal por debajo de la superficie de la corteza [6]. En la Enfermedad de Alzheimer, el hipocampo es una de las principales estructuras en sufrir daño ya que conlleva a problemas de memoria y desorientación que son los principales síntomas de esta enfermedad. El hipotálamo es una pequeña estructura cerebral ubicada debajo del tálamo y por encima del tronco encefálico, juega un papel muy importante en la interacción neuroendocrina entre el Sistema Nervioso Central (SNC) y la periferia [7]. Ha surgido evidencia que indica que la inflamación en el hipotálamo y el estrés en el retículo endoplásmico son eventos críticos en la resistencia a la insulina periférica encontrada en los desórdenes metabólicos. ([8],[9],[10],[11]). A pesar de que este órgano se ha olvidado en la EA, un estudio en 2014, por Gomes y colaboradores mostraron que las especies de oligómeros de Aβ inducen el estrés oxidativo en una línea celular de hipotálamo [12].. 2.2.2.-FORMACIÓN DE Aβ La proteína Aβ se deriva del rompimiento proteolítico de la proteína precursora de Aβ (APP) por medio de algunas secretasas, existen dos formas de procesar APP: bajo condiciones normales, la enzima α-secretasa se adhiere a APP dentro del dominio del Aβ y se libera un fragmento llamado α-APPs la cual previene la formación amiloidal para que posteriormente mediante la acción subsecuente de γ-secretasa genere un péptido corto con una región C-terminal de Aβ llamado P3 la cual no es dañina.. 6.
(15) En el caso de la EA,. la enzima β-secretasa inicia con la producción del amiloide. rompiendo en el extremo amino terminal de la APP generando un ectodominio llamado β-APPs unido a un fragmento carboxilo terminal llamado C99. El paso final en la producción del amiloide ocurre cuando el fragmento C99 es roto por γ-secretasa y conlleva a la formación de los péptidos de Aβ que varían de 39 a 43 residuos de aminoácidos y con un peso aproximado de 4kD. Aβ40 es la forma más abundante mientras que Aβ42 la más hidrofóbica y la causante de la formación de las placas neuríticas. El mecanismo de toxicidad producida por las formas oligoméricas no se encuentra del todo claro, sin embargo, se ha propuesto que pueden inhibir la degradación proteosomal lo que favorece la muerte neuronal [5]. Así mismo se ha observado que en la secuencia de aminoácidos de Aβ, la metionina 35 juega un rol importante promoviendo la actividad oxidativa; de tal manera, que se ha propuesto que los oligómeros amiloidales se pueden insertar en la bicapa lipídica y, consecuentemente, causar daño oxidativo a las proteínas y otras biomoléculas [2].. Figura 3: Procesamiento de APP para la formación de Aβ [5]. 7.
(16) La toxicidad de Aβ es dependiente del estado conformacional, tamaño del péptido y concentración [2]. Se ha propuesto que la formación intracelular del Aβ precede la formación de placas neuríticas; sugiriendo que la acumulación de este péptido dentro de las células es un evento temprano en la progresión de la enfermedad.. 2.2.3.-PROTEÍNA TAU (τ) Es una proteína mayor asociada a microtúbulos, altamente soluble y estable al calor. En la EA, la proteína experimenta oligomerización lo que conlleva a la formación de filamentos helicoidales pareados que llevan al desarrollo de las placas neuríticas. Se ha reportado que τ induce la disfunción mitocondrial, llevando a deficiencias energéticas severas y la generación de ROS y especies reactivas de nitrógeno (RNS), la cual también perturba la integridad de membranas biológicas e inducen el daño sináptico. Estudios in vivo e in vitro han reportado que las fibrillas y oligómeros de Aβ también inducen conversión de la proteína τ monomérica a su forma β-plegada rica en oligómeros tóxicos. Otros cofactores en la agregación de τ son iones metálicos como Fe2+ y Al3+ los cuales llevan consigo actividad redox y coexisten en las marañas neurofibrilares [2].. 2.3.- FACTORES DE RIESGO QUE COMPONEN AL SÍNDROME METABÓLICO 2.3.1.-DIABETES Se define como una enfermedad crónica que aparece cuando el páncreas no produce insulina suficiente (Diabetes tipo 1) o cuando el organismo no utiliza eficazmente la insulina que produce (Diabetes tipo 2). La insulina es una hormona que regula la glucosa en sangre y ambos tipos de diabetes ocasionan que exista un aumento de glucosa en la sangre lo que se conoce como hiperglucemia. 8.
(17) En el mundo hay más de 347 millones de personas con diabetes. Se calcula que en 2012 fallecieron 1,5 millones de personas como consecuencias del exceso de azúcar en la sangre en ayunas. Más del 80% de las muertes por diabetes se registran en países de ingresos bajos y medios [13].. 2.3.2.-RESISTENCIA A LA INSULINA La resistencia a la insulina (RI), se da cuando órganos como hígado y músculo se hacen resistentes a la acción de la hormona dando como resultado un aumento de la concentración de la glucosa fuera del hígado y por lo tanto, disminución en el metabolismo de la glucosa por otros órganos. En diferentes estudios se ha demostrado que el síndrome metabólico es debido a una falla en las vías metabólicas de la glucosa, y daños en la vía de la insulina, la cual es muy importante para el balance energético corporal [14].. 2.3.3.-OBESIDAD La OMS define a la obesidad y al sobrepeso como una acumulación anormal o excesiva de grasa que puede ser perjudicial para la salud. Se detecta mediante el índice de masa corporal (IMC) el cual se calcula mediante la talla y el peso. 𝐼𝑀𝐶 =. 𝑝𝑒𝑠𝑜 (𝑘𝑔) 𝑡𝑎𝑙𝑙𝑎2 (𝑚). De acuerdo a la OMS y a la norma mexicana NOM-043-SSA2-2012 un IMC igual o superior a 30 indica obesidad e igual o superior a 25 implica sobrepeso. La causa fundamental para esta patología es un desequilibrio energético entre las calorías consumidas y las gastadas debido principalmente al aumento de la ingesta de alimentos hipercalóricos ricos en grasas, sal y azucares pero bajo en vitaminas así como el descenso de la actividad física. La obesidad y el sobrepeso traen consigo enfermedades no transmisibles como son enfermedades cardiovasculares (primera causa de muerte en el mundo), diabetes,. 9.
(18) trastornos en el aparato locomotor como osteoartritis; convirtiéndose así en el principal problema de Salud en México y en el mundo. En 2012, alrededor de 44 millones (6,7%) de menores de 5 años tenían sobrepeso o eran obesos, mientras que en 1990 eran solo 31 millones (5%) [15].. 2.3.4.-DISLIPIDEMIAS Los lípidos son un heterogéneo grupo de moléculas de carbono de cadena larga que comparten ciertas propiedades de insolubilidad en agua, pero que presentan muchas otras diferencias y características individuales. Su importancia viene marcada por cuatro características. fundamentales:. Como. reserva. energética,. principalmente. los. triacilgliceroles, como componentes de las membranas biológicas, como emulsionantes de otros compuestos para facilitar la digestión y por último, participan en la regulación metabólica, formando parte a nivel molecular de hormonas, vitaminas, prostaglandinas, entre otras. Las dislipidemias son un conjunto de patologías caracterizadas por alteraciones en las concentraciones de los lípidos sanguíneos, componentes de las lipoproteínas circulantes, a un nivel que significa un riesgo para la salud. Es un término genérico para denominar cualquier situación clínica en la cual existan concentraciones anormales de colesterol: colesterol total, colesterol de alta densidad, colesterol de baja densidad o triglicéridos. Las dislipidemias constituyen un factor de riesgo mayor y modificable de enfermedades cardiovasculares, especialmente de la enfermedad coronaria [16].. 10.
(19) Tabla 2: Niveles patológicos de lípidos para el diagnóstico de riesgo cardiovascular Niveles patológicos de lípidos (mg/dL) según categorías de riesgo cardiovascular global Categorías. Col-LDL. Col-HDL. Triglicéridos. Bajo. ≥160. ≤35. Alto. ≥130. ≤35. ≥200. Máximo. ≥100. <45. ≥160. de riesgo CV ≥200. Gobierno de Chile, Ministerio de Salud, 2000 [16].. 2.3.5.-HIPERINSULINEMIA El concepto de resistencia a la insulina fue descrito por Himsworth desde hace más de 60 años; ya desde esa época se consideró su posible participación etiopatogénica en el curso clínico de las enfermedades metabólicas. En la actualidad, la resistencia a la insulina se considera como un tronco común fisiopatológico de algunas enfermedades como la diabetes mellitus, la hipertensión arterial y la obesidad central, además de estar presente en individuos intolerantes a la glucosa o incluso en el 25% de sujetos delgados, aparentemente sanos con tolerancia normal a la glucosa. La resistencia a la insulina es una condición en la cual, por diferentes factores, la insulina produce una respuesta tisular menor a la esperada y, por consiguiente, condiciona aumento de la insulina sérica “hiperinsulinemia” para compensar la ineficiencia de la hormona. La RI es un concepto bioquímico-molecular que se traduce una menor eficiencia biológica de la insulina al actuar sobre sus diversos órganos blanco, existiendo varias causas atribuibles a la misma hormona o al comportamiento de su receptor o receptores específicos [17].. 11.
(20) 2.3.6.-HIPERTENSIÓN La hipertensión arterial es uno de los factores de riesgo modificable de mayor prevalencia en el mundo. Participa en el desarrollo de la enfermedad aterosclerótica cardiovascular, en la morbimortalidad por eventos cardiacos, cerebrovasculares, insuficiencia renal y enfermedad vascular periférica. La hipertensión arterial disminuye la calidad de vida y la supervivencia de la población, por lo que es un reto importante para la salud pública [18]. Tabla 3: Niveles de presión arterial utilizados para el diagnóstico de enfermedades cardiovasculares [17]. Categoría. Sistólica (mm Hg). Nivel de presión. Diastólica (mm Hg) y/o. Óptima. <120. <80. Normal. 120-129. 80-84. Normal alta. 130-139. 85-89. Grado 1 (leve). 140-159. 90-99. Grado 2 (moderada). 160-179. 100-109. Grado 3 (extrema). 180 o más. 110 o más. Sistólica pura. 140 o más. <90. Diastólica pura. <140. 90 o más. Sístole-diastólica. 140 o más. 90 o más. Tipo de hipertensión. * Para definir categoría por nivel de presión en el caso de que un valor tenga una categoría y otro valor otra categoría, se tomará la categoría correspondiente al valor más alto de las dos.. 2.4.-VÍAS METABÓLICAS DAÑADAS EN EL SÍNDROME METABÓLICO Como se sabe, la insulina y la glucosa son dos de las moléculas que se ven incrementadas durante el SM por lo que las vías metabólicas que se dañan durante esta patología son aquellas que las involucran, principalmente la vía de la cinasa dependiente de AMP (AMPK), la cual se considera que es una de las vías más importantes en el 12.
(21) desarrollo del síndrome metabólico, ya que al estar disminuida la actividad de la AMPK, la glucosa en sangre se mantiene elevada y esto a su vez puede contribuir a que se desarrolle RI, mecanismo celular que se ha propuesto subyace las complicaciones en esta patología [19]. Durante muchos años se ha estudiado a la proteína AKT y su vía metabólica ya que es responsable de diferentes señales metabólicas, y de estrés ambiental así como la regulación. de. la. supervivencia,. crecimiento,. diferenciación. y. otras. funciones. homeostáticas. Dentro de las señales metabólicas, AKT se encarga de la señalización de insulina, ya que se activa por la presencia de insulina en el organismo lo que ocasiona que el transportador de glucosa GLUT4, el cual es dependiente de insulina se transloque y comience con el metabolismo de glucosa [20].. 2.4.1.-CINASA DEPENDIENTE DE AMP (AMPK) Una proteína que se ha demostrado como clave en el desarrollo del síndrome metabólico es la proteína AMPK, la cual es un heterotrímero que comprende una subunidad catalítica α y dos subunidades regulatorias β y γ. Esta proteína se activa por fosforilación en el aminoácido Threonina 172 de la subunidad catalítica al estímulo de AMP, que significa una baja de energía en la célula; una vez activa regula las vías catabólicas que generan ATP e inhibe las vías anabólicas que consumen ATP [19]. Existen activadores para la AMPK que tratan de corregir las fallas en las vías metabólicas y que hoy en día se utilizan comúnmente como tratamientos contra la diabetes como son la metformina, la cual incrementa la sensibilidad de insulina y activa AMPK. Este fármaco no activa directamente a la proteína, se ha encontrado que inhibe el complejo I de la cadena transportadora de electrones, lo que disminuye la energía en la célula [21]. En estudios actuales se ha demostrado que AMPK en el cerebro, especialmente en el hipotálamo, incrementa la ingesta de alimento y su inhibición la disminuye, debido a que el hipotálamo se encarga de la regulación hormonal [22]. 13.
(22) Inhibición de la actividad de AMPK, ya sea farmacológicamente o genéticamente, ha demostrado ejercer efectos neuroprotectores en la isquemia cerebral. AMPK regula la síntesis de proteínas la cual desempeña un papel crítico en la plasticidad sináptica para la memoria de largo plazo y larga duración [23]. Debido a lo anterior, se puede concluir que la síntesis de proteínas mal regulada se encuentra implicada en la patogénesis de la EA al haber daño en la sinapsis de las neuronas. AMPK es activada por varios tipos de estrés celular que disminuyen las cantidades de ATP, como es el caso del estrés oxidativo que se encuentra presente en la EA, Se ha demostrado que existe una estrecha relación en la hiperfosforilación de AMPK y las alteraciones de plasticidad sináptica en la EA dentro del cerebro tanto de humanos como de ratas transgénicas para la EA, encontrando que la señalización de AMPK subyace la disfunción sináptica asociada a la EA. Se habla de que la activación en respuesta un desequilibrio pequeño de la homeostasis energética lleva a que AMPK juegue un papel de protección y de restauración de la homeóstasis del metabolismo energético; sin embrago, durante un prolongado y/o grave daño ocasionado por el estrés celular que ocurre en cualquier fase del envejecimiento o la EA, la capacidad de AMPK para. equilibrar la homeostasis energética se ve comprometida y comienzan a. amplificarse los daños causados por el estrés celular [24].. 2.4.2.-PROTEÍNA CINASA B (AKT) La proteína PKB o mejor conocida como AKT pertenece a una vía de señalización compleja que coordina y controla una serie de factores de crecimiento y receptores de insulina así como otros receptores membranales [25]. La familia de proteínas AKT incluye tres proteínas homologas, conocidas como AKT1, AKT2 y AKT3 encontradas en células de mamíferos [26]. Estas proteínas son heterodímeros compuesto de una unidad catalítica llamada p110 y una unidad regulatoria conocida como p85 que dirige la unión con el receptor, la activación y la localización de la enzima.. 14.
(23) AKT se localiza transitoriamente en la membrana plasmática durante la activación y, una vez activada, induce la fosforilación de un número de proteínas nucleares y citosólica que regulan diversas funciones celulares incluyendo el crecimiento, la supervivencia, proliferación y la diferenciación celular. Además de sus papeles vitales en la supervivencia, la señalización de AKT está implicada en la diferenciación neuronal a través de la glucógeno sintasa quinasa 3b (GSK-3b). AKT migra al núcleo, como un resultado del tratamiento con factores de crecimiento, en las células neuronales y protege las neuronas de la estimulación de apoptosis en el núcleo a través de la interacción proteína-proteína. La manipulación de la actividad de AKT nuclear en las neuronas tiene un potencial terapéutico, sobre todo en lesiones cerebrales y enfermedades neurodegenerativas como el Alzheimer y la enfermedad de Parkinson, debido a la naturaleza anti-apoptótica de esta proteína [20].. 2.5.- RELACIÓN SÍNDROME METABÓLICO Y ENFERMEDAD DE ALZHEIMER En los últimos años, ha aumentado el número de estudios que relacionan la demencia con los trastornos metabólicos. El síndrome metabólico puede influir en el riesgo a padecer demencia clínica y convertirse. en un. factor de riesgo para desarrollar. y. acelerar enfermedades asociadas a neurodegeneración, como la EA [27]. Es posible que cada factor que constituye el SM se encuentre involucrado en el desarrollo del proceso neurodegenerativo que da como resultado la aparición de la demencia, la característica principal de la EA, y otras alteraciones neuronales como son la pérdida del control motriz y otras funciones básicas. Una característica remarcable es la producción elevada de especies reactivas de oxígeno (ROS) la cual disminuye los sistemas antioxidantes como son superóxido dismutasa y catalasa, y causa, como una consecuencia, aumenta los niveles de metabolismo oxidativo, el cual afecta la estructura celular, causando daño neuronal [5].. 15.
(24) Se cree que la RI participa en el metabolismo de APP y de τ ya que aumenta la acumulación de Aβ y la formación de las placas neuríticas. Se han encontrado dos principales mecanismos patofisiológicos de la RI en el cerebro: 1) pérdida progresiva de la respuesta a la insulina de las neuronas causadas por el factor relacionado a la nutrición. 2) Daño en el equilibrio ligando-receptor de insulina por las alteraciones patológicas en la composición de la membrana lipídica y probablemente una expresión disminuida en la membrana. La RI promueve la lipólisis que genera lípidos tóxicos como ceramidas los cuales dañan la señalización de insulina, la función mitocondrial y viabilidad celular. Las ceramidas son moléculas lipídicas de señalización con un amplio rango de efectos modulatorios incluyendo la proliferación celular, movilidad, plasticidad, inflamación, apoptosis y la resistencia a la insulina. Ceramidas, esfingosinas y otros lípidos tóxicos son lípidos solubles por lo que pueden cruzar rápidamente la barrera sangre-cerebro por lo que existe la hipótesis de que las ceramidas generan, en el contexto de esteatosis hepática que se encuentra en coexistencia con la obesidad, la regulación o proliferación de la neurodegeneración, ya que ésta desencadena una cascada de señales que da como resultado la RI [2]. Hablando de las vías metabólicas que se encuentran involucradas para el metabolismo de la glucosa y que se ha demostrado que para el caso de la RI se encuentran dañadas, en estudios actuales se ha demostrado que AMPK en el cerebro, especialmente en el hipotálamo, incrementa la ingesta de alimento y su inhibición la disminuye, debido a que el hipotálamo se encarga de la regulación hormonal [22]. Se ha estudiado a la Diabetes tipo II la cual se sugiere que es consecuencia de la RI y que además aumenta el riesgo de desarrollar enfermedades neurodegenerativas, principalmente EA. La hipercolesterolemia, se sugiere que puede contribuir a la disfunción cognitiva ya que se encuentra ligada a la atrofia del hipocampo, así como problemas con la memoria y aprendizaje. 16.
(25) El cerebro utiliza glucosa, proveniente del flujo sanguíneo cerebral, como la principal fuente de producción de energía. Se sabe que el metabolismo energético de las neuronas es afectado en el cerebro por la EA y que su deficiencia de energía puede ser atribuida a los cambios en la toma de glucosa dependiente de insulina y el daño en las distintas proteínas que participan en el metabolismo energético. Se ha tratado de explicar cómo es que los niveles de colesterol puede afectar el metabolismo de Aβ ya que el cerebro es el órgano que contiene la mayor cantidad de colesterol en el cuerpo (aproximadamente el 25%). El colesterol es el principal componente de la mielina y de las membranas de las neuronas y glías, también participan en el mantenimiento de la plasticidad neuronal haciéndolo importante para el sistema nervioso central. Se ha propuesto que el metabolismo y vida media de APP puede ser alterada por daños en la fluidez membranal debido a los cambios en el nivel de colesterol. Un aspecto muy importante en la relación entre la producción del amiloide y la hipercolesterolemia reside en la actividad de γ-secretasa pues su actividad es dependiente de los niveles de colesterol. La disminución de este lípido por completo inhibe la actividad de esta secretasa. La hipertensión, otro factor del SM implicado en la EA, tiene una correlación positiva con las placas neuríticas y las marañas neurofibrilares ya que incrementan la permeabilidad vascular en el cerebro acompañado de la extravasación de proteínas a través del cruce celular-endotelial [2].. 2.6.-ESTRÉS OXIDATIVO Y LA ENFERMEDAD DE ALZHEIMER Se ha especulado que los radicales libres producidos durante el estrés oxidativo son importantes patológicamente en la EA y otras enfermedades neurodegenerativas. El estrés oxidativo puede ser definido como un desequilibrio entre producción de especies reactivas de oxígeno (ROS) y/o su eliminación. Se propone que el estrés oxidativo se encuentra implicado en la EA a través de los cambios en el estado redox del cerebro de pacientes con EA [2]. 17.
(26) El estrés oxidativo en el Alzheimer ha sido evidente en los cerebros de los pacientes con esta enfermedad los cuales muestran niveles mayores de proteínas oxidadas, peroxidación de lípidos, oxidación de DNA y RNA así como modificaciones en los niveles de glucosa en sangre y la presencia de ROS. El amiloide induce. a las ROS y su. sobreproducción; este incremento se debe también a una reducción de la actividad de las enzimas antioxidantes, las cuales incrementan la oxidación de proteínas, resultado de una función disminuida del sistema proteosomal el cual altera el catabolismo de proteínas oxidadas; favoreciendo los procesos neurodegenerativos observados en los pacientes con EA. Se ha demostrado que el estrés oxidativo crónico y la subsecuente formación de 4hidroxinonenal puede contribuir a la hiperfosforilación de τ e inducir cambios conformacionales que pueden llevar al ensamble de τ y a la formación de marañas neurofibrilares [2].. 2.6.1.-ALTERACIONES EN EL METABÓLISMO Y LA ENFERMEDAD DE ALZHEIMER En la célula eucariótica, las mitocondrias son los orgánelos responsables de proveer la energía necesaria para los procesos metabólicos celulares bajo condiciones aeróbicas. En las neuronas, las mitocondrias tienen particular importancia a través de su alta tasa metabólica aeróbica y morfología compleja, su papel como el proveedor de ATP como fuente de energía para la liberación y reciclaje de neurotransmisores. La inhibición del metabolismo energético altera el procesamiento de APP favoreciendo la producción de los fragmentos peptídicos de Aβ que se acumulan fácilmente acelerando la formación de las características de la EA. Una enzima mitocondrial importante para la EA es la creatina cinasa (CK) la cual tiene 4 isoformas. categorizadas así de acuerdo a su expresión en diversos tejidos y su. distribución subcelular (citosólica o mitocondrial). La generación de ATP, a través de la actividad de CK, es crítica para la función del sistema Nervioso Central (SNC). El sistema CK/ fosfocreatina (PCr) funciona como un buffer temporal de energía, así como 18.
(27) regulador de la energía celular. Mantiene la relación ATP/ADP previniendo un aumento en el ADP intracelular incluso en situaciones de alto consumo energético [28]. CK es crucial para el metabolismo energético celular en el cerebro por lo que cualquier perturbación en la función de esta enzima puede alterar el proceso normal de APP lo que da como resultado la acumulación de Aβ. La función de CK puede encontrarse alterada en EA, llevando a déficits en el mantenimiento de los niveles de energía óptimos y alterando, el suministro de energía en las glías, neuronas y sinapsis. Las isoformas de CK son altamente susceptibles al estrés oxidativo. En el cerebro, CK citosólica existe como un homodímero conocido como CK cerebral (CK-BB) y su función es fundamental para la eficiencia del metabolismo energético en el cerebro; además de iniciar y regular la apoptosis o necrosis de estas células. Se ha mostrado que ratones con una expresión baja de CK-BB muestran conexiones fibrosas mohosas anormales en el hipocampo lo que causa distintas funciones cognitivas como es el aprendizaje espacial. El circuito CK en el cerebro contribuye al manejo del abastecimiento de la energía para las funciones neuronales [5]. Se ha reportado que la activación experimental de circuito energético de CK, por la suplementación de creatina en la dieta, notablemente mejora la integridad celular de cultivos neuronales sujeta a manipulaciones tóxicas [28].. AKT. CK CITOSÓLICA. RECEPTOR INSULINA. AMPK. CK MIT.. Figura 4: Relación síndrome metabólico y alzheimer. (Modificado de [5]) 19.
(28) 2.7.- USO DEL FÁRMACO METFORMINA EN LA ENFERMEDAD DE ALZHEIMER Y EL SÍNDROME METABÓLICO La metformina es una biguanida (1,1-dimetilbiguanida), las cuales se identificaron de la planta Gallena Officinalis y cuyos extractos se utilizaban en la edad media para la Diabetes por su propiedad antiglucemiante. El principal efecto de este fármaco es disminuir la producción hepática de glucosa e incrementar la captación de glucosa periférica, por lo que se ha convertido en el principal fármaco prescrito antidiabético [29]. A pesar de que se utiliza desde 1957, aún se desconoce el mecanismo exacto por el cual la metformina reduce la cantidad de glucosa y lípidos. La metformina disminuye la hiperglicemia sin aumentar la estimulación de la secreción de. insulina, promover. ganancia de peso o causar hipoglicemia. Así mismo, metformina tiene efectos benéficos en la circulación de lípidos que incrementan el riesgo cardiovascular [30]. Se sabe que la metformina es un activador indirecto de la proteína AMPK la cual, como se ha mencionado anteriormente, es una proteína clave para el metabolismo de glucosa. Al ser activada por el fármaco, mejora algunas patologías clave del SM [29]. Para el caso de la EA, el uso de la metformina tiene controversias pues algunos estudios indican que el tratamiento con metformina disminuye parcialmente la fosforilación de la proteína Tau [31, 32] o que disminuyen la formación del péptido Aβ por la inhibición de la γ-secretasa (BACE1), una proteína clave en la formación del péptido Aβ [33]. Por otro lado, Yaomi Chen en 2009 mostro que la metformina en la EA aumenta los niveles del péptido Aβ a través de la regulación positiva de BACE1 y al tener animales tratados con metformina e insulina, disminuye la cantidad del péptido amiloidal [34]. Con lo anterior podemos deducir que no se sabe, exactamente, el efecto que tiene este fármaco antidiabético en la EA.. 20.
(29) 2.8.- MODELOS UTILIZADOS PARA EL ESTUDIO DE LA ENFERMEDAD DE ALZHEIMER RELACIONADOS CON EL SÍNDROME METABÓLICO En los recientes estudios en donde se trata de demostrar la relación entre las dos patologías antes mencionadas, se han utilizado distintos modelos: 2007 Zhen-guo Li en Estados Unidos utilizó dos modelos de rata con diabetes generada de manera espontánea, uno con diabetes tipo 1 llamado BB/Wor-rat, y el modelo con diabetes tipo 2 llamado BBZDR/Wor-rat a los cuales se les midieron parámetros bioquímicos de la diabetes como insulina y glucosa en sangre. Así mismo se observó la actividad de algunas proteínas implicadas en la señalización de insulina y la presencia de las proteínas o péptidos involucrados en la patología de la EA [35]. 2009 Yaomi CHen en Estados Unidos utilizo dos modelos distintos para mostrar la relación entre el SM y la EA. El primero es neuronas primarias y el otro una línea celular llamada N2a695 que son neuroblastomas que expresan Aβ40/Aβ42. En este estudio se midió el efecto que tiene la metformina en la generación del péptido Aβ a través de las secretasas involucradas en su formación, principalmente BACE1 o mejor conocida como β-secretasa [34]. 2009, en Australia, Yazi D. Ke y colaboradores utilizaron un modelo transgénico de ratón que expresa el gen P301L para Tau humano, la cual es una de las proteínas implicadas en los problemas cognitivos y demencia para la EA, a la cual se le indujo, mediante una dosis de estreptozotocina, diabetes tipo 1 ya que este fármaco causa una deficiencia a la insulina instantánea. Se midió la fosforilación de la proteína Tau tanto en el modelo de rata sin estreptozotocina como con el tratamiento para observar cómo es que la deficiencia a la insulina afecta la fosforilación de esta proteína [36]. 2014 Ignacio Pedrós en Barcelona utilizó un modelo de la EA llamado APPswe/PS1dE9 el cual es un ratón transgénico que expresa APP humano y de ratón en conjunto con una sobreexpresión de una variante del gen PS1dE9 que hace que se generen cantidades muy altas del péptido Aβ humano, las cuales son relacionadas con la EA. En este modelo se midieron parámetros bioquímicos para observar la patología del SM así. 21.
(30) como algunas proteínas relacionadas a la EA y sus blancos en algunas vías de señalización involucradas en ambas patologías [37]. Para el presente estudio, se utilizó un modelo de rata con SM, el cual se induce por una dieta de sacarosa al 30% por 16 semanas, y en el cual se observó la presencia de la proteína APP como marcador de neurodegeneración para una etapa temprana del SM. El modelo utilizado fue establecido por Guadalupe Baños en 1997, en el cual se demostró que mediante una dieta alta en hidratos de carbono, en este caso sacarosa por un tiempo de 12 a 17 semanas, se incrementa el nivel de triglicéridos, de lipoproteínas, glucosa e insulina en sangre y a la par la presión sanguínea [38]. Debido a lo anterior, el modelo de dieta con sacarosa se considera un modelo valido para el SM pues cumple con los criterios establecidos por la OMS y la ATPIII para el diagnóstico del SM. El modelo utilizado se encuentra en una etapa temprana del SM y en una etapa de prediabetes por lo que para complementar el presente estudio se necesitaría tener un modelo con una etapa más avanzada del SM para medir como se ven afectados los marcadores de neurodegeneración medidos.. 3.- PLANTEAMIENTO DEL PROBLEMA La cantidad de estudios que relacionan al síndrome metabólico y a la enfermedad de Alzheimer ha aumentado debido a que se sugiere que cada uno de los factores que componen al síndrome metabólico puede encontrarse relacionado y ser un factor de riesgo para la enfermedad de Alzheimer. Debido a lo anterior, se trata de encontrar nuevos blancos terapéuticos para mejorar la calidad de vida de las personas con esta patología pues hoy en día las enfermedades neurodegenerativas se presentan en etapas tempranas a lo que se encontraba descrito, así mismo la población con enfermedades metabólicos aumenta a nivel mundial y en el país siendo un caso preocupante a nivel salud. 22.
(31) 4.-OBJETIVOS GENERAL: estudiar la relación que existe entre los desequilibrios energéticos y algunos marcadores de neurodegeneración en el hipocampo e hipotálamo en modelos animales con SM. ESPECIFICOS: -. Generar el modelo animal con síndrome metabólico. -. Suministrar un tratamiento de metformina de 4 a 5 semanas y observar los efectos que tiene tanto en el SM como en la EA.. -. Mediante la técnica de Western Blot determinar. la activación de algunas. proteínas involucradas en el metabolismo energético. -. Mediante Western Blot identificar cambios en la presencia de algunas proteínas involucradas en la Enfermedad de Alzheimer en el hipocampo e hipotálamo.. -. Cuantificar la actividad de la enzima Creatina Cinasa (CK) como marcador del metabolismo energético en el hipocampo e hipotálamo.. 5.-HIPÓTESIS El síndrome metabólico se encuentra estrechamente relacionado con la Enfermedad de Alzheimer al encontrarse presencia de las proteínas iniciadoras de la patología de la EA en el hipocampo e hipotálamo, así como una disminución en el estado energético de los tejidos estudiados.. 23.
(32) 6.-DISEÑO EXPERIMENTAL 2( ratn macho WiIUr de 2509'. 1. USIS de tejidos. .¡. Se form an 6 grupal de 4 rM as distrrburdn homogéneamente. Cuantificar aón de prOlerna. por método de Lowry. /. I 2 grupos con agua de beber natura l y co mda 9d lil:>tum por 16 se manas,. 4 grupos con dieta de. ActNidad de la enzima Creati na Cinasa (CK). saca rOsa a130% en el ag ua de beber co mida 9dlibtumporl 6 se manas,. 1. Prepar ación de muestras de hip ocampo e hi potélamo,. Western Elo !: Electr ofore sis, transferencia a membr ana de P\{lF ,. 2 9rup os de rata s COn tr atamie nt o metform in a (1 OOm¡¡Mg p,c,) de 6 a 7 semanas , Incuboción con anticu e'pos espeelfeos. RegIstro semanal de pe so. 41101""'''''0' ). Med,oón de tngicér idos al term .. a, l,atamrentos. Silc.lic,o de ratas y exlr¡CaÓn de teJ,dos (24 ratas). MueSlr.. se congelaron hasta su procesa miento. '"'. R.... elado de la membrana por qu,m'okJm,n'scencra. AnáliSIS denuom étrrco me dianle el software Quantity One. Aná li sis de resu ltado s. 24.
(33) 7.- METODOLOGÍA 7.1.-INDUCCIÓN DEL SÍNDROME METABÓLICO Se trabajó con 24 ratas macho tipo Wistar con un peso aproximado de 250 a 300 g, las cuales fueron divididas homogéneamente en 6 grupos de 4 ratas cada una. 4 grupos tuvieron una dieta de sacarosa de marca comercial, al 30% en el agua ad libitum para así inducirles el síndrome metabólico; los 2 grupos restantes se utilizaron como grupos control a los cuales se les dio agua simple ad libitum. Todos los grupos fueron alimentados con la misma dieta sólida durante 16 semanas [38]. Se llevó un control de peso semanal y al término de las 16 semanas de tratamiento, se midieron triglicéridos en sangre de todos los grupos en ayuno de 6 horas. 8 ratas con tratamiento de sacarosa al 30% en el agua fueron separadas para administrarles diariamente Metformina vía oral (100 mg/ kg p.c) durante 6 semanas realizando de nuevo la medición de triglicéridos una vez concluido este tiempo.. 7.2.-EXTRACCIÓN Y LISIS DE TEJIDOS Para la extracción de tejidos, las ratas fueron sacrificadas mediante una sobre dosis de pentobarbital se decapitaron y se extrajo el cerebro, de donde se disectó rápidamente el hipotálamo e hipocampo los cuales se congelaron en nitrógeno líquido y almacenados a -70°C hasta su análisis. Se obtuvo, al momento del sacrificio, sangre de la rata la cual se centrifugo, con ayuda de la centrifuga 5804R de la marca Eppendorf, a 3000 rpm a 4°C por 15 min para obtener los sueros sanguíneos y posteriormente medir los marcadores bioquímicos indispensables para establecer el síndrome metabólico. Los sueros se almacenaron a -70°C hasta su análisis. Se realizó la lisis de tejidos con ayuda del homogeneizador Politron de Pro Scientific Inc., mediante 0.75 mL por muestra de buffer de lisis al hipocampo e hipotálamo extraído. 25.
(34) El buffer se compone por HEPES 50 mM, EDTA 1 mM, EGTA 1 mM, KCl 50 mM, glicerol-3-fosfato 5 mM, tritón X-100 al 0.10%, NaF 50 mM, NaPPi 5 mM, antes de usarlo se le debe de añadir DTT 1 mM, PMSF 0.2 mM, ortovanadato previamente activado con pH de 10 a una concentración 1 mM y antiproteasas (COMPLETE MINI de Roche) de acuerdo a las especificaciones del fabricante (Ver anexo); el motivo de que estos reactivos se le añadan al momento del uso es debido a que la vida media de estos es corta. (Los reactivos son de SIGMA). Las anti proteasas adicionadas al buffer se añaden debido a que en la lisis, las células liberan proteasas que degradan las proteínas de interés; lo anterior se realizó con el fin de obtener la mayor cantidad de proteína posible ayudándonos además, de un movimiento mecánico que en este caso es la centrifugación de las muestras por 30 min a 12000 rpm y una temperatura de 4°C.. 7.3.- MEDICIÓN DE PARAMETROS BIOQUÍMICOS Triglicéridos: La medición de triglicéridos en sangre se realizó al término de las 16 semanas de tratamiento con sacarosa o con dieta normal y al termino del tratamiento con metformina, se realizó con un ayuno de 6 horas utilizando el instrumento Accutrend GCT mediante el uso de tiras reactivas. Glucosa: La medición de glucosa de los grupos con los tres tratamientos distintos, se realizó en ayuno de 12 horas, al momento del sacrificio utilizando el glucómetro Optium Xceed de la marca Abbot mediante tiras reactivas. Insulina: la medición de insulina se realizó con la sangre recolectada y centrifugada al momento del sacrificio de las ratas de los tres tratamientos, se realizó mediante un método ELISA se cuantifico la cantidad de insulina en sangre con ayuda del kit Rat High Range Insulin ELISA de ALPCO INMUNOASSAYS y se calculó mediante programas estadísticos. HOMA: El índice HOMA se calculó de acuerdo a la fórmula:. 26.
(35) 𝑖𝑛𝑠𝑢𝑙𝑖𝑛𝑎(𝜇𝑔/𝑚𝐿) × 𝑔𝑙𝑢𝑐𝑜𝑠𝑎( 22.5. 𝑚𝑚𝑜𝑙 𝐿 ). Grasa abdominal: Al momento del sacrificio de las ratas, se extrajeron los cojinetes de grasa epididímales y se pesaron.. 7.4.-CUANTIFICACIÓN DE PROTEÍNAS La cuantificación de proteínas se realizó mediante el método de Lowry que consiste en una reacción de reducción del reactivo de Folin-Ciocalteu (ácidos fosfomolíbdico y fosfotugsténico) y la oxidación de tirosina, triptófano, cisteína y cistina de las cadenas polipetídicas el cual mediante un complejo de cobre genera un color azul que es visible a 580 nm; una vez realizada la lectura se calcula la concentración de proteínas de cada muestra mediante una curva patrón o de calibración a partir de una solución patrón de BSA (albumina sérica bovina) de 1 mg/mL.. Figura 5: Esquema general de las reacciones que se llevan a cabo en el método de Lowry [39]. Una vez que se han cuantificado las proteínas se procede a preparar las muestras para realizar el método de Western Blot y la medición de la actividad de la enzima (CK), eligiendo que se utilizarían 80 µg de proteína de cada muestra para el caso de Western Blot debido a que es una cantidad adecuada para comparar los niveles de las proteínas de interés y 50 µg de proteína para la actividad enzimática. 27.
(36) 7.5.-WESTERN BLOT El método de Western Blot consiste en cinco pasos principales: electroforesis, transferencia a una membrana de PVDF, bloqueo, incubación con anticuerpos y revelado [40]. Electroforesis: Una vez que las muestras se encuentran cuantificadas, se preparan en buffer de carga compuesto de Tris HCl 60 mM, Glicerol 20%, SDS al 2%, azul de bromofenol 0.1%, y β-mercaptoetanol al 10% con la finalidad de ayudar a que las proteínas se desnaturalicen y se puedan observar. El gel con el que se trabajarán las muestras, consta de dos partes una parte concentradora, al 4% de acrilamida, en la parte de arriba y otra separadora, al 10% de acrilamida, en la parte de debajo de mayor tamaño que la anterior. Es importante cargar junto con las muestras un marcador de peso molecular, el utilizado en este caso es el marcador Prestained Protein Marker de Cell Signaling, para identificar a la proteína de interés mediante su peso molecular. Se realiza la electroforesis en un buffer de corrida compuesto por Tris 25 mM, SDS 0.1% y Glicina 192 mM ajustado a un pH 8.3. Se comienza con 80 V y cuando las muestras comienzan a estar en la parte separadora del gel, aproximadamente de 30 a 40 min se cambia el voltaje a 120 V y se espera a que el colorante desaparezca del gel lo que tomaba de 120 a 150 min dando un total de 2.5 a 3 h. En cuanto a la transferencia, se transfiere a una membrana de PVDF (Millipore) previamente activada con metanol, en una cámara semiseca por 60 min a 0.3 A. Los geles y las membranas previamente se sumergen en un buffer de transferencia compuesto por Tris 48 mM, SDS al 0.037%, Glicina 39 mM, Agua y metanol al 10% durante 10 minutos para equilibrarlas a estas condiciones. Al final de la transferencia, la membrana se incuba con leche descremada al 3% para bloquear las zonas con ausencia de proteínas y así evitar la unión no específica de los anticuerpos.. 28.
(37) Se realiza la incubación con el anticuerpo específico de la proteína que se desea ver, en leche al 3%, 1 h a temperatura ambiente o toda la noche a 4°C para posteriormente, realizar la incubación con el anticuerpo secundario 1 h a temperatura ambiente. Los anticuerpos utilizados fueron: anti-pAMPK fosforilado en Th172 hecho en conejo 1:1000 (Cell Signaling); anti AMPKα hecho en conejo1:1000 (Cell Signaling), anti-pAKT fosforilado en Ser 473 hecho en conejo 1:1000 (Cell Signaling); anti AKT(pan) hecho en conejo 1:1000 (Cell Signaling); anti APP hecho en ratón 1:1000 (Millipore), anti-Actina hecho en conejo 1:10000 (Sigma) Por último, se revela la membrana mediante una reacción de quimioluminiscencia con ayuda de luminol de la marca Millipore y se obtienen los resultados documentando la quimioluminiscencia en el equipo Chemi Doc de Biorad, mediante el software Quantity one para posteriormente analizarlos estadísticamente.. 7.6.-ACTIVIDAD DE LA ENZIMA CREATINA CINASA Para el caso de la medición de la actividad enzimática se tomaron 50 µg de proteína para observar la cantidad de ATP generada a través de esta enzima mediante la siguiente reacción: 𝐹𝑜𝑠𝑓𝑜𝑐𝑟𝑒𝑎𝑡𝑖𝑛𝑎 + 𝐴𝐷𝑃 ⇌ 𝐶𝑟𝑒𝑎𝑡𝑖𝑛𝑎 + 𝐴𝑇𝑃. 𝑝𝐻: 6.7. Debido a que la molécula de ATP no se observa por métodos de espectrofotometría, se decide realizar una reacción acoplada mediante la cual se mide la cantidad de NADPH que es visible a 340 nm y es estequiométricamente igual a la producción de ATP: Hexoquinasa. 𝐴𝑇𝑃 + 𝐺𝑙𝑢𝑐𝑜𝑠𝑎. ⇌. 𝐺𝑙𝑢𝑐𝑜𝑠𝑎 6 − 𝑃 + 𝐴𝐷𝑃. G6PDh. 𝐺6𝑃 + 𝑁𝐴𝐷𝑃. ⇌. 6 − 𝑓𝑜𝑠𝑓𝑜𝑔𝑙𝑢𝑐𝑜𝑛𝑎𝑡𝑜 + 𝑁𝐴𝐷𝑃𝐻 + 𝐻 +. 29.
(38) El buffer base se encuentra compuesto por HEPES 50 mM, EGTA 1 mM, glucosa 20 mM y MgCl 4 mM a un pH de 6.7 que es el óptimo para que la enzima actué correctamente. Antes de su uso se le añaden los reactivos necesarios para comenzar la reacción, los cuales son Fosfocreatina (PCr) 1 M, ADP 0.5 M, NADP 0.1 M y AMP 0.5 M. Se utiliza 1mL del buffer completo y se adiciona la cantidad de proteína elegida, y se adiciona 5 µL de la enzima acoplante que es Glucosa-6-fosfato deshidrogenasa con Hexoquinasa de Roche diluida 1:5 en el buffer base. Se observa la reacción mediante el espectrofotómetro Cary 100 Bio de Varian, a 340 nm durante 8 minutos. Se obtendrá una curva sigmoidea de la cual se tomara la pendiente de la parte lineal de la curva la cual es la ΔAbs para posteriormente mediante la siguiente ecuación obtener la actividad total de la enzima. 𝑨𝒄𝒕𝒊𝒗𝒊𝒅𝒂𝒅 𝒕𝒐𝒕𝒂𝒍 =. ∆𝑨𝒃𝒔 𝟔. 𝟐𝟐 ∗ 𝑽𝒐𝒍. 𝒎𝒖𝒆𝒔𝒕𝒓𝒂(𝒎𝑳). 𝑨𝒄𝒕𝒊𝒗𝒊𝒅𝒂𝒅 𝒆𝒔𝒑𝒆𝒄í𝒇𝒊𝒄𝒂 =. 𝒂𝒄𝒕𝒊𝒗𝒊𝒅𝒂𝒅 𝒕𝒐𝒕𝒂𝒍 𝝁𝒈 𝒑𝒓𝒐𝒕𝒆í𝒏𝒂. 7.7.-ANÁLISIS ESTADÍSTICO ANOVA de un factor con una p= 0.05 y posteriormente la prueba T de student para definir entre que grupos existía una diferencia, se utilizó una p≤0.05.. 30.
(39) 8.- RESULTADOS 8.1.- MODELO DE SÍNDROME METABÓLICO Parámetro. Grupo. Grupo. control. n=8. SM Grupo. n=8 Triglicéridos (mg/dL) Peso inicial (g) Peso. final. (g) Incremento de peso (g). 160.8±44. metformina n=8. *270.2±88. *256.3±56. 237.08±21.85 244.70±21.30. 248.71±18.89. 433.6±34.53. 461.36±40.04. 469.9±38.70. 196.5±13. 216.6±19. 221.2±20. 11.3±4.4. *16.1±7. *18.16±6.1. 5.6±0.4. *9.2±0.2. ^6.24±0.47. 132.1±5.5. 131.3±9.1. *^115.7±9.4. 1.8±0.3. *2.8±0.4. ^1.93±0.31. ANOVA de una vía p=0.05 T student para diferencia entre grupos *p≤0.05 VS control ^p ≤0.05 vs SM. Grasa abdominal (g) Insulina (ng/mL) Glucosa (mg/dL) HOMA. Tabla 4: características del modelo de rata con síndrome metabólico.. 31.
(40) Como se muestra en la tabla 1, observamos que el modelo experimental tiene elevados los triglicéridos, la grasa abdominal y la insulina en comparación con el grupo control lo que concuerda con lo establecido por la OMS y el ATPIII para el diagnóstico del SM. Una vez que comprobamos que el síndrome metabólico se encuentra establecido en nuestro modelo experimental, se procede a realizar Western Blot para observar el estado de las vías metabólicas y algunos marcadores de neurodegeneración.. 32.
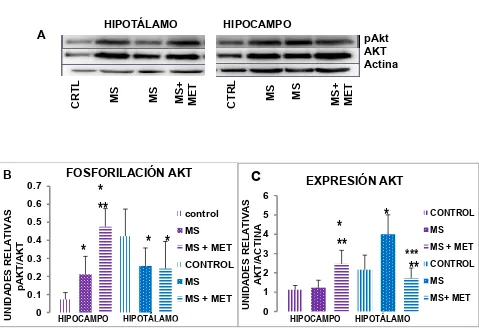
(41) 8.2.- ACTIVACIÓN DE LA PROTEÍNA AKT. * **. 0.5 0.3. *. control. * *. MS MS + MET CONTROL MS. 0.1. MS + MET HIPOCAMPO. HIPOTÁLAMO. 5 4 3. pAkt AKT Actina MS+ MET. MS. MS. C 6. 0.2 0. CTRL. MS+ MET. FOSFORILACIÓN AKT. 0.6 0.4. HIPOCAMPO. UNIDADES RELATIVAS AKT/ACTINA. UNIDADES RELATIVAS pAKT/AKT. 0.7. MS. CRTL. B. MS. HIPOTÁLAMO. A. EXPRESIÓN AKT. * **. *. CONTROL MS. ***. **. 2 1 0. MS + MET CONTROL MS MS+ MET. HIPOCAMPO. HIPOTÁLAMO. Figura 6. A) Imágenes representativas del Western Blot. B) Fosforilación relativa en el hipocampo e hipotálamo. C) Expresión total de Akt en hipocampo e hipotálamo. Prueba T student para la diferencia entre grupos *p≤0.05 VS control, **p≤0.05 VS MS, *** p=0.06 VS control. Para el caso del hipocampo, en el panel B, se observa el grupo de síndrome metabólico presenta una fosforilación mayor de la proteína AKT en comparación del grupo control a pesar de que la cantidad de proteína total es la misma (panel C). El grupo con tratamiento de metformina presenta una fosforilación aun mayor que el grupo control (panel B) y el de síndrome metabólico y a la vez tiene una cantidad mayor de proteína total que los otros dos grupos (panel C).. 33.
(42) 8.3.- ACTIVACIÓN DE LA PROTEÍNA AMPK HIPOTÁLAMO. HIPOCAMPO. A. pAMPK AMPK. 1.2 1. ***. CONTROL MS. 0.8 0.6 0.4 0.2 0. * **. MS+MET CONTROL MS MS+MET. HIPOCAMPO HIPOTÁLAMO. SM+ MET. SM. SM. CTRL. SM. SM+ MET. C. FOSFORILACIÓN AMPK. UNIDADES RELATIVAS AMPK/ACTINA. UNIDADES RELATIVAS pAMP/AMPK. B. SM. CRTL. ACTINA. EXPRESIÓN DE AMPK 0.6 0.5. * **. 0.4. *. *. MS MS+MET. 0.3. CONTROL. 0.2. MS. 0.1 0. CONTROL. MS+MET HIPOCAMPO HIPOTÁLAMO. Figura 7. A) Imágenes representativas del Western Blot. B) Fosforilación relativa de AMPK en hipocampo e hipotálamo C) Expresión total de AMPK en hipocampo e hipotálamo.. Prueba T student. para diferencia entre grupos. *p≤0.05 VS control,. **p≤0.05 VS SM, *** p=0.06 VS control. En la figura 7, al igual que para la proteína AKT, el grupo de SM en el hipocampo presenta una mayor fosforilación de la proteína (panel B), a pesar de que no existe alguna diferencia significativa en la expresión de la proteína total (panel C). El grupo con tratamiento de metformina presenta una menor fosforilación de la proteína (panel B), a pesar de que la cantidad de proteína total es mucho mayor a los otros dos grupos (panel C), este es un resultado inesperado ya que de acuerdo a lo reportado en la literatura, la metformina es un fármaco que activa indirectamente la fosforilación de la proteína AMPK. Para el caso del hipotálamo no se encontró diferencia significativa en la fosforilación de la proteína para ningún grupo a pesar de que los grupos SM (panel B) y con tratamiento de 34.
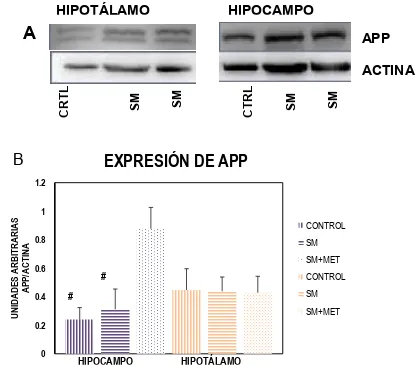
(43) metformina presentan una mayor cantidad de proteína total en comparación con el grupo control (panel C).. 8.4.- EXPRESIÓN DE LA PROTEÍNA APP COMO MARCADOR DE LA NEURODEGENERACIÓN HIPOTÁLAMO. HIPOCAMPO. A. APP. B. SM. SM. CTRL. SM. SM. CRTL. ACTINA. EXPRESIÓN DE APP 1.2. UNIDADES ARBITRARIAS APP/ACTINA. 1 CONTROL 0.8. SM SM+MET. 0.6 0.4. #. CONTROL SM. #. SM+MET 0.2 0. HIPOCAMPO. HIPOTÁLAMO. Figura 8. A) Imágenes representativas del Western Blot. B) Expresión de la proteína. APP. en. hipocampo. e. hipotálamo. como. marcador. de. la. neurodegeneración. Prueba t student para diferencia entre grupos # p≥0.05 vs SM+MET.. En la figura 8, se observa que tanto para hipocampo como para hipotálamo, no se encuentra una diferencia significativa en la fosforilación de AMPK entre los. grupos 35.
(44) control y SM, sin embargo existe un aumento de la expresión de la proteína en el grupo que tuvo tratamiento de metformina. Para el caso del hipotálamo, no se encuentra diferencia significativa entre los grupos, para los niveles de expresión de la proteína. 8.5.- ACTIVIDAD ESPECIFÍFICA DE LA ENZIMA CREATINA CINASA. nmol/min/mg. Control. SM. SM+metformina. 8.7±3.44. 6.8±0.9* 5.6±0.5*”. proteína HIPOCAMPO. HIPOTÁLAMO 10.12±0.71 4.8±0.8* 7.3±1.1*” Tabla 5. Actividad de CK en hipocampo e hipotálamo. n=4. *p≤0.05 vs control,” p≤0.05 vs. SM. En la tabla 3, se observa que para ambos tejidos la actividad de la enzima CK en el grupo experimental con síndrome metabólico, presenta una disminución y para el caso del grupo tratado con metformina, en el hipocampo disminuye aún más que el grupo son síndrome metabólico y el control. Por el contrario, para el hipotálamo, cuando se le da el tratamiento con metformina, se regenera la actividad significativamente aunque no alcanza los niveles del grupo control.. 36.
Figure

![Figura 2: principales causas de muerte a nivel mundial [3].](https://thumb-us.123doks.com/thumbv2/123dok_es/5373691.101962/11.612.182.463.65.346/figura-principales-causas-muerte-nivel-mundial.webp)
![Figura 3: Procesamiento de APP para la formación de Aβ [5].](https://thumb-us.123doks.com/thumbv2/123dok_es/5373691.101962/15.612.87.393.400.666/figura-procesamiento-app-formacion-ab.webp)
![Figura 4: Relación síndrome metabólico y alzheimer. (Modificado de [5])](https://thumb-us.123doks.com/thumbv2/123dok_es/5373691.101962/27.612.55.556.443.680/figura-relacion-sindrome-metabolico-alzheimer-modificado.webp)
Documento similar
"No porque las dos, que vinieron de Valencia, no merecieran ese favor, pues eran entrambas de tan grande espíritu […] La razón porque no vió Coronas para ellas, sería
Cedulario se inicia a mediados del siglo XVIL, por sus propias cédulas puede advertirse que no estaba totalmente conquistada la Nueva Gali- cia, ya que a fines del siglo xvn y en
Porcentaje de radiación solar interceptada (RSI; 0,35 - 2,5 µm) y de radiación fotosintéticamente activa interceptada (RFAI) a lo largo del ciclo de cultivo para las
El síndrome metabólico (SM) es un conjunto de factores de riesgo, que requie- ren la presencia de obesidad de predominio central, dislipemia, hipertensión arterial y resistencia a
En cuarto lugar, se establecen unos medios para la actuación de re- fuerzo de la Cohesión (conducción y coordinación de las políticas eco- nómicas nacionales, políticas y acciones
En el capítulo de desventajas o posibles inconvenientes que ofrece la forma del Organismo autónomo figura la rigidez de su régimen jurídico, absorbentemente de Derecho público por
1. LAS GARANTÍAS CONSTITUCIONALES.—2. C) La reforma constitucional de 1994. D) Las tres etapas del amparo argentino. F) Las vías previas al amparo. H) La acción es judicial en
Volviendo a la jurisprudencia del Tribunal de Justicia, conviene recor- dar que, con el tiempo, este órgano se vio en la necesidad de determinar si los actos de los Estados