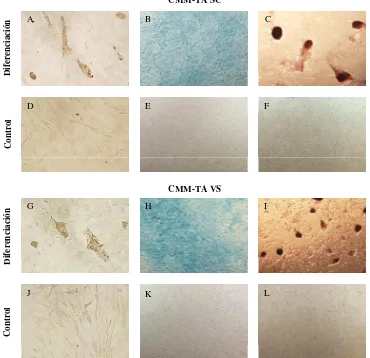
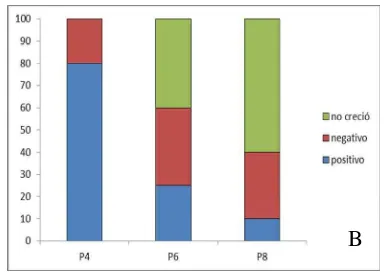
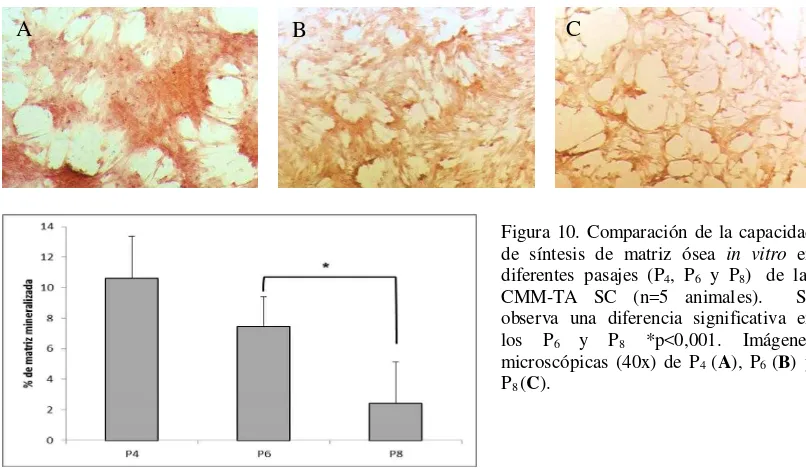
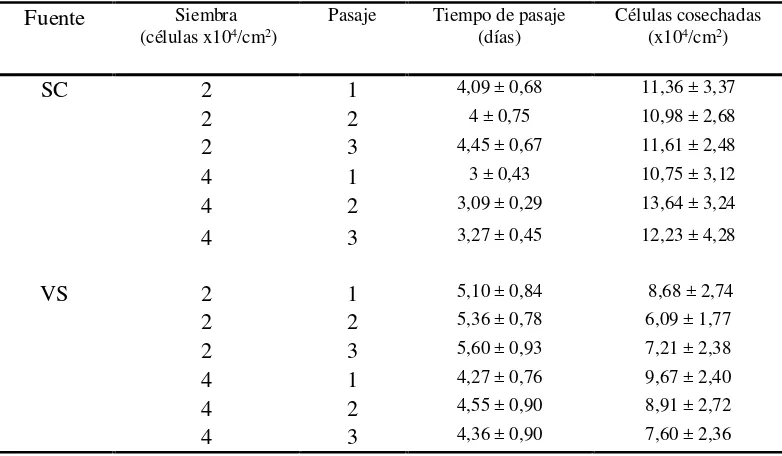
Caracterización de las células madre mesenquimales caninas derivadas de tejido adiposo (CMM-TA) extraídas de dos sitios diferentes"- Evaluación del efecto de diferentes fuentes de extracción de tejido adiposo y pasajes celulares sobre la habilidad prolife
Texto completo
Figure

Documento similar
We have generated and characterized seven human induced pluripotent stem cell (iPSC) lines derived from peripheral blood mononuclear cells (PBMCs) from a single family,
Shahdadfar A, Fronsdal K, Haug T (2005) In vitro expansion of human mesenchymal stem cells: choice of serum is a determinant of cell proliferation, differentiation, gene expression,
Percutaneous intramyocardial delivery of mesenchymal stem cells induces superior improvement in regional left ventricular function compared with bone marrow
Figure 3 Effects of acute and allogenic intravenous (i.v.) administration of bone marrow-derived mesenchymal (BM-MSC) and adipose tissue-derived mesenchymal (AD-MSC) cells on
human mesenchymal stem cells from bone marrow and adipose tissue under xeno-free conditions for cell therapy. Stem Cell
Human cancer cells show predominant expression of NANOGP8, whereas pluripotent cells (embryonic stem cells and embryonal carcinoma cells) express the NANOG variant
In humans, telomerase activity is restricted to embryonic development, embryonic stem (ES) cells, germ cells, adult stem cell compartments, certain types of Figure 3:
A novel lentiviral vector targets gene transfer into human hematopoietic stem cells in marrow from patients with bone marrow failure syndrome and in vivo in humanized mice.. The