UNIVERSIDAD
AUTóNOMA
hlETKOt’OLITANr.4
ETAPALAPA
_ _ _ _ ”
DIVISION DE ClENClAS BIOL-OGICAS Y DE !.A SALUD.
DINLMICA
DEL
VIH
EN
UN
PROGRESOR LENTO
HACIA SIDA
BAJO
LA
ACCIóN
DE UNA
QUINIIOTERrlPIA
COiMBINADA.
TESINA
QUE PAKX OBTENER EL TITULO DE:
P R E S E N T A :
BIOLOGO EXPERliC1ENl’AL
ANGEL MARTiNEZ GALICIA.
“Cualesquiera que hayan sido nuestros
logros, alguien nos ayud6 siempre a alcan~arlos”
Con adrniracicin y profundo agradecimiento .i MAIMA ESTHER Por toda una vida de lucha, que cristaliza en la mayor Herencia que pudiera recibir: mi formacih profesional.
Con c.1 rnris profundo agradecimiento A MIS TIOS: GUADALUPE, ROSA MARIA, SOCORRO, JAVIER
Y MIGUEL ANGEL por todo el apoyo y estimulo de superacicin que me infundieron.
A cada uno de mis maestros por los conocimientos que me Brindaron y por su infinita paciencia al haccrlo, de verdad MIL GRACIAS.
Un agradecimiento especial a cada uno de mis compañeros de la subdireccih tknica de Alumbrado Público del Gobierno del Distrito Federal por su apoyo y facilidades
otorgadas para la realización dc cstc trabajo.
A la memoria de mis Abuelos los señores .Juan Galicia Montcs y Angela Balcal-ar Perez
Y de corazón
...
A aquella quien fuera la primera profesora en mi vida académica hace unos ayeres:
Un agradecimiento especial:
AI director de mi tesina el Dr.
Jorge
X. Velasco Hernández por la oportunidad brindada para integrarme a su grupo de investigación, abriéndome las puertas a mundo que no conocía antes y que de verdad es fascinante; además de su gran entusiasmo y compromiso mostrados por éI y su grupo de trabajo durante la realización de este proyecto reflejan su extraordinaria calidad humana, ejemploque comparten cada uno de los miembros de este grupo.
AI Q.F.B.
José
Antonio Garcia, compañero de grupo y asesor de la parte biológica de'este trabajo, cuyos puntos de vista imparciales ysu
impresionante caudal de conocimientos en inmunología fueron fundamentales para llevar a buen puerto este proyecto, mismás
sinceros agradecimientos por los conocimientos yconsejos impartidos.
A la Dra. Catherine Garcia por impartirme todos los conocimientos necesarios en el manejo de las ecuaciones diferenciales y sus aplicaciones a la biología, y por estimularme a saber cada día
más
y superarme. Alguien con una extraordinaria calidadcomo
investigadora y ser humano.AI Dr. Raúl Alva Garcia, por su apoyo y entusiasmo con que compartió sus vastos
.' conocimientos en estas áreas de frontera en biología, así como sus oportunos
consejos. Además por ser alguien muy especial como maestro y persona ya que sus clases me sirvieron de estimulo para llamar mi atención sobre la nueva
biología.
Al M.C. Eduardo Casas, por su apoyo y apertura de ideas durante el desarrollo de
mi
Pdl,
sin duda alguien con una extraordinaria calidad como ser humano y maestro.A cada uno de los compañeros de la licenciatura en biología experimental por motivarme al alcanzar mi objetivo. Un agradecimiento especial para la bióloga experimental Alejandra González Paredes y
los
futuros biólogos experimentales Jorge Ortega Diaz, Juan M. Garcia, Angelica Quintana, Adelina Garcia, Diana Villar y Bentham Borrayas quienes han estado al tanto de mis avances, porsu
amistad y apoyo durante todo mi PDI.A quienes han sido
mis
profesores durante las diferentes etapas dela
licenciatura. En especial para los profesores: Jose Guadalupe Reyes Victoria de quien aprendí el gusto por las matemáticas, Rodolfo Velasco y Rafaela Tapia quienes me introdujeron al fascinante mundo delos
rnicroorganismos,a
Joaquín Herreray Hector Serrano por sus útiles consejos y apoyo, Francisco Alarcon por los conocimientos impartidos y por último a José Ramírez Pulido y Irma Lira por
compartir conmigo sus conocimientos vastos en zoología y evolución, cosa que hacían con un gran gusto que contagiaba a todos los que estabamos en sus
U.
A.
M.
12TAPALAPA
BIELIOTECA
"Si viviéramos en un planeta donde nunca cambia nada, habría poco que hacer.
No
habría nada que explicarse.No
habría estimulo para la ciencia. Y si viviéramos en un mundo impredecible, donde las cosas cambian de modo fortuito o muy complejo, seríamos incapaces de explicarnos nada. Tampoco en este caso podría existir la ciencia.Pero
vivimos en un universo intermedio, donde las cosas cambian, aunque de acuerdo a estructuras, a normas, o según nuestra terminología, a leyes de la naturaleza. Si lanzo un palo al aire, siempre cae hacia abajo. Si el Sol se pone por el oeste, siempre a la mañana siguiente sale por el este. Y así comienza a serposible
explicarse las cosas. Podemos hacer ciencia y por mediación de ellapodemos perfeccionar nuestras vidas."
R E S U M E N .
La aplicación de quimioterapia combinada en
un
progresor de bajo riesgohacia
SlDA
(progresor lento) a sido uno delos
puntos más controvertidosdesde la aparición de
los
agentes antirretrovirales. Se especula que laaplicación de quimioterapia combinada en pacientes con conteos de CD4
superiores a 500/mm3 no muestra evidencia de beneficio alguno, y que tal
medida solo traería como consecuencia la activación
del
proceso infeccioso,estimulando incluso la aparición de mutantes del VIH resistentes
a
los
fármacos
en cuestión.
Otrosen
cambio creen que aun con unconteo
superior
a
los
500 CD4/mm3 es indispensable la aplicación de tratamientopara reducir
el monto del reservorio.
El modelo matemático aplicado a esta investigación es
el
desarrollado porPerelson y
Ho
en 1996, con la inclusión de la ecuación logística parael
crecimiento regulado de las c6lulas T no infectadas. Por lo que en este
modelo se analiza la dinámica de tres poblaciones: Células TCD4 no
infectadas, TCD4 infectadas y virus infecciosos, sin quimioterapia,
con
monterapia y quimioterapia combinada.
Los
gráficosobtenidos de
las simulaciones muestran quela
quimioterapiacombinada (IRT
+
IP) sobresale en cuanto a resultados por sobre lamonoterapia; la respuesta de
la
poblaci6n de células TCD4 no infectadas esnotable ya que esta se incrementan del valor inicial (600) hasta casi 1000
CD4/mm3 que
es muy cercano a
los
valores de referencia b6sales (1200CD4/mm3 ). La viremia tarnbib disminuye considerablemente alcanzando
niveles de hasta 18 virioneslml,
sin
sobrepasar los 30 viriones/ml en sumáximo, lo que contrasta con los valores entre 40 y 50 virionesl ml
obtenidos con la monoterapia. Sin embargo no existe una diferencia muy
marcada en la disminución de las
TCD4
infectadas con monoterapia y conquimioterapia combinada (de apenas 6 CD4/mm3 ), lo que puede ser
indicativo de la formación de reservorios para el VIH, sin embargo la
diferencia 'con tratamiento y sin tratamiento en este ultimo caso si es
notable, lo que significa una disminución en el número de TCD4 que sirvan
de reservorio para el VIH. Hechos que parecen apuntar a una aparente
reconstitución del sistema inmune.
La información obtenida de este trabajo puede ser de utilidad en el
El 5 de junio de 1981 en la revista Morbidity and Mortality Weekley Review
editada por los CDC (centros para el control de enfermedades) de Estados Unidos
de América, se describe el caso de cinco jóvenes afectados por una forma rara de
neumonía provocada por Pneumocvstis carinii. Además de tratarse de una
enfermedad poco común, todos los casos mostraban evidencia de una profunda
inmunodeficiencia caracterizada por un número anormalmente bajo de linfocitos T
CD4'. La anterior descripción constituye propiamente el "acta de nacimiento" del
síndrome de inmunodeficiencia adquirida, ahora conocido como SlDA (Romero,
1998).
Actualmente se estima que 34 millones de personas están infectadas con el virus
de la inmunodeficiencia humana
(VIH),
de las cuales 24 millones(aproximadamente el 70%) se encuentran en Africa. En las diferentes regiones del
mundo la enfermedad muestra patrones modificados en su propagación y
síntomas; por ejemplo, en Africa los infectados por VIH tienen 11 veces más
probabilidades de morir en los primeros 5 años de enfermedad y 100 veces más
probabilidades de desarrollar el denominado sarcoma de Kaposi, un cáncer aun
no vinculado a otro virus( The International AIDS conference, 2000). En nuestro
pais el ultimo informe indica la notificación de poco m i s de 4370 casos nuevos
hasta el primer trimestre del 2000 en todo el temtorio nacional (Dirección general
de estadística de la SSA).
La evolución clínica de la enfermedad presenta diferentes etapas, entre las que se
puede mencionar daño constitucional, en la que el enfermo pierde peso muy
digestivo. Más tarde aparece la etapa de infecciones oportunistas, por organismos
patógenos diversos, dando lugar a enfermedades como neumocistosis,
toxoplasmosis, criptosporidiosis, asperguiliosis, candidosis, tuberculosis, herpes
(simplex y zoster), enfermedad citomegálica, infecciones bacterianas de etiología
diversa (salmonelosis, sifilis, faringitis). Cuando el paciente no recibe tratamiento
específico contra
el
VIH y ha logrado sobrevivir a enfermedades oportunistas,la
última etapa de la enfermedad es la de daño sistémico a diferentes órganos,aparatos y sistemas (Valdespino, 1995).
El establecimiento de las nuevas terapias antirretrovirales activas o TARA en
español (o el anteriormente conocido HAART en ingles) han llevado a un control
de la viremia como no se había observado antes en la historia de la epidemia; lo
que se ha evidenciado por pruebas clínicas y de laboratorio que sugieren un
restablecimiento de la actividad inmune normal en un número significativo de
pacientes, logrando niveles no detectables de carga viral. Además muchas de las
infecciones oportunistas refractarias a tratamiento como la candidiasis,
tuberculosis e infección por citomegalovirus remiten a largo plazo después de la
aplicación de la terapia antirretroviral (Powderly, 1998).
MARCO TEóRICO.
VIRUS DE
LA
INMUNODEFICIENCIA HUMANA.El VIH pertenece a la familia Rettuviridae. Los retrovirus se encuentran
ampliamente distribuidos en la naturaleza (mamíferos, aves, reptiles, anfibios y
peces), son capaces de producir en las células infecciones latentes a
largo
plazo yprogresiva, enfermedades mortales que incluyen el síndrome de consunción y la
degeneración del sistema nervioso central (SNC). Se han identificado dos
variantes íntimamente relacionadas de ViH el 1 (característico en la mayor parte
del mundo) y el 2, que es más común de los países africanos, y se encuentran
emparentados con el virus de la inmunodefíciencia simia (SIV). Ambos se
diferencian en estructura genómica y antigenicidad, con solo el 40% de hornología
en su secuencia de ácidos nucleicos (Abbas, 1999).
l. Estructura.
La estructura característica de una partícula infecciosa de VIH consta de 2
cadenas idénticas de ARN, de aproximadamente 9.2 kilobases(kb) de longitud
cada una, rodeadas de una cubierta de proteínas vírales que a su vez está
rodeada por una envoltura formada por una bicapa fosfolipídica derivada de la
membrana celular del hospedero, aunque incluye proteínas de membrana
codificadas por el virus. El VIH comparte con todos
los
retrovirus conocidos elementos tales como repeticiones terminales largas (LTR) al final de cadagenoma, que regulan la integración viral en el genoma del hospedero; expresion
génica del virus y replicación viral; secuencias Gag, que codifican para las
proteínas p25 y p17, derivadas de un precursor común (p55), proteínas que
forman parte de la cubierta; secuencias Env, que codifican para gp120 y gp41
(glucoproteínas de la envoltura) y las secuencias pol que codifican para la
transcriptasa reversa, endonucleasas, proteasas y integrasas virales requeridas
para replicación viral. Además de otros 6 genes reguladores, que incluyen vpr, vif,
tat, rev, nef, y vpu, cuyos productos controlan la replicación viral de varias
2.
CICLO VITAL.Las células blanco del VIH son las denominadas células T, más específicamente,
los
linfocitos T CD4+, que orquestan las respuestas de defensa del cuerpo contra las infecciones. El VIH reduce drásticamente el número de linfocitos T y con ellodeja al cuerpo muy vulnerable a una amplia gama de organismos causantes de
infecciones. Una vez que el VIH entra en contacto con el linfocito se une a una
molécula de superficie del mismo, conocida como CD4, que actúa como receptor,
permitiendo el paso del virus a través de la membrana celular. Los correceptores
del virus que se unen al receptor del linfocito son los recientemente descritos
receptores de las quimiocinas CCR5 y CXCR4 (Dittmar, 1997). Incluso se piensa
que una delección en el gen que codifica para el correceptor CCRS (CCR51132)
juega un papel importante en la progresión hacia SIDA, individuos homocigotos
para el mismo están protegidos contra
la
infección por VIH, mientras que aquellos que son heterocigoticos paraCCR5A32
presentan baja carga viral (estado pre-SIDA) y progresion tardía hacia SIDA (Sullivan, 2001). Una vez dentro de la
célula, el VIH esta listo para transferir su material genético.
Una vez que e l virión del VIH penetra la célula, las enzimas del complejo
nucleoproteínico se hacen activas y comienza el ciclo reproductor
del
virus. Lacubierta de nucleoproteinas del virus se desestructura, el genoma ARN del VIH
se transcribe a
la
forma del ADN de doble hélice por acción de la transcriptasadel ADN viral en el genoma de la célula hospedera. A esta forma integrada del
ADN del VIH se denomina provirus. Una vez integrado este provirus en el genoma
de la célula, no hay forma de eliminarlo. Sin embargo para que se produzca la
enfermedad como tal pueden pasar desde algunos meses hasta años, cuando el
ADN viral se activa, comenzando una nueva transcripción, es decir el ADN viral
sintetizará de nuevo ARN viral que es liberado del nricleo de la célula hacia
el
citoplasma de la misma en donde tomará parte de la membrana celular para
completar su estructura externa. En este punto del ciclo infeccioso intervienen
proteínas producidas por el virus utilizando la maquinaria celular y que le son
indispensables para completar su replicación. La tarea de corte de estas
proteínas es llevada a cabo por la enzima proteasa, que funciona como una tijera:
recorta la cadena proteíca, y forma fragmentos del tamaño necesario para
construir las nuevas proteínas del virus. Una vez completo el virus, estos salen de
la célula infectada en busca de otras células a las cuales infectar. Los puntos de
actividad enzimática donde se están centrando las estrategias de quimioterapia
anti-VIH en la retrotranscriptasa y proteasa (Crandall, 1999).
3. INMUNOLOGfA DE LA INFECCIÓN POR VIH.
La infección por el VIH produce una aiteración de
la
función de los sistemasinmunitarios específicos e innatos. Se destacan más los defectos en la inmunidad
l. La mayoría de las manifestaciones de inmunodeficiencia, incluyendo
infecciones y tumores, se deben a una falta de células T CD4'. De la cifra
normal de 1200/mm3 se puede pasar a menos de 100/mm3 en un SlDA
plenamente desarrollado. Para que esto suceda pueden transcurrir varios
meses o años (hasta más de 10 años en algunos individuos). Dado que
los
T CD4' son esenciales paralos
procesos inmunitarios celulares y humorales frente a varios microorganismos, la pérdida de estos linfocitos esla causa de que los pacientes con VIH se hagan susceptibles a múltiples
infecciones y neoplasias. La mayor parte de estas infecciones y neoplasias
ocurren cuando que el número de células T CD4' cae por debajo de las
200
células por mm3 .11. La inmunodeficiencia por VIH también puede deberse a alteraciones que
son independientes de la disminución de los linfocitos. O sea que aparecen
alteraciones en la función del sistema inmunitario en la infección por VIH
con recuentos normales de células T CD4' .
La reducción de CD4' en una infección por VIH puede deberse a efectos directos
e indirectos. Entre los primeros se tiene la lisis de CD4' (causada por la gemación
viral), el efecto citopático de la unión de gp120 al CD4 recién sintetizado
o
reciclado, lo que da lugar a la formación de células multinucleadas gigantes o
sincicios letales tanto para las células T infectadas como no infectadas por VIH,
grandes cantidades de ácidos nucleicos vírales no funcionales tóxicos para las
células infectadas, interferencia de la síntesis y expresión de proteínas celulares.
Los efectos indirectos se caracterizan por lisis indirecta a causa de una respuesta
inhibición de la maduración en el timo de las células T CD4' y apoptosis debida al
entrecruzamiento del CD4 por la gp120 soluble (Abbas, 1999).
Otros
dos tipos celulares también pueden influir en la infeccióil por VIH, estos sonlos fagocitos mononucleares y las células dendríticas foliculares. Los macrófagos
son relativamente resistentes a los efectos citopáticos del VIH, probablemente
debido a la necesidad de una elevada expresión de CD4 para la citotoxicidad
inducida por el virus; sin embargo, pueden infectarse por fagocitosis de otras
células infectadas, o endocitosis mediada por el receptor-
Fc
de los viriones VIHrecubiertos de anticuerpos. Aunque los rnacrófagos pueden infectarse, no son
destruidos por el virus, pudiendo convertirse en reservorios del mismo. De hecho
la cantidad de macrófagos infectados supera a la de iinfocitos T en diversos tejidos
de pacientes infectados por el VIH (Farreras, 1996).
Se
han observado respuestas inmunitarias específicas humorales y celularescontra
el,
VIH, con una respuesta temprana similar contra cualquier virus, y de hecho la mayoría de los virus presentes en células T infectadas y en el plasma sondestruidos. Sin embargo esta respuesta no es suficiente para destruir a todos los
virus y en la mayor parte de los casos la infección acaba por superar
al
sistemainmunitario. Esto como consecuencia de la destrucción de las células protectoras
por el virus y de
la
gran variabilidad genética del mismo, producto dela
elevadatasa de errores en la transcripción inversa.
Lo
que permite al virus evadir no solola respuesta inmunitaria sino también a los fármacos empleados en su contra
MARCO DE
REFERENCIA.
TRATAMIENTO DE LA INFECCIóN POR VIH.
l . Técnicas Diagnosticas.
La nueva generación de drogas antiiirales (Apéndices 2 y 3) y la amplia
disponibilidad de
las
pruebas PCR para determinar la carga viral, han abierto unnuevo sendero para el tratamiento del VIH.
Hoy
en día se posee información sobre la rapidez con que el virus se replica, dónde se reproduce y cómo respondea
Ics
tratamientos, por lo que la investigación sobre SIDA se centra actualmenteen la forma como se usan los fármacos, por
lo
que se espera una mayor efectividad en el combate contra la infección (SIDNETS, 1998).La determinación de la situación más aproximada de cada paciente respecto a
la
relación hospedero-parásito, y el establecimiento de un pronóstico puede
obtenerse recurriendo a algunas variables, medidas por técnicas de laboratorio,
dos de
las más
importantes son: la determinación y cuantificación de linfocitos TCD4' y la estimación de la carga viral.
A. Cuantificación de CD4.
La cuantificación de linfocitos totales da una información general de las
condiciones de' respuesta del sistema inmune, pero con la determinación del
número linfocitos T CD4' se puede establecer muy cercanamente la posibilidad de
alguna infección oportunista; se sabe que por debajo de los 500
/mm3
laposibilidad de infección por Candida es muy alta; con cifras entre 200 y 500 las
infecciones más frecuentes son neumonía neumoukica, tuberculosis pulmonar,
sarcoma de Kaposi; con cifras menores de 200 /mm3 , pueden presentarse
patologías tales como: neumonía por P.carinii, enfermedad herpética discriminada,
toxoplasmosis, criptococosis crónica, micrmporidiosis, tuberculosis extrapulmonar,
o leucoencefalopatía multifocal progresiva; cantidades menores a 50 incrementan
la probabilidad de infección generalizada, debida a citomegalovirus y el complejo
Mycobacten'urn avivurn (Terrés, 1998).
B. Carga viral.
La estimación de la carga viral en sangre, aunque no refleja la situación en los
tejidos ni en cada una de las estructuras que componen al cuerpo humano, sí
proporciona una idea de
los
niveles de virus que se han alcanzado en el paciente por el qvance lento pero progresivo de la infección causada por el VIH. La cargaviral permite conocer hasta dónde ha ganado terreno el virus en la relación
hospedero-parásito, en el entendido que ante cargas vírales muy elevadas el
hospedero ya no presenta acciones de defensa útiles y por lo tanto el virus va
dominando la relación, el sistema inmune es incapaz de proteger y el daño en el
organismo será creciente(CastiIlo, 1998).
Los resultados de la prueba de carga viral se expresan como el número de copias
de RNA del VIH por
mililitro
de plasma (copias por ml) y puede variar de menos de400 copias
por
ml a vanos millones de copias por ml. Se ha encontrado que 10sniveles de carga viral se correlacionan directamente con el tiempo de progresión y
de supervivencia y se ha observado que, a menor carga viral, es mayor el tiempo
que se requiere para progresión de la enfermedad y de supervivencia. Es
frecuente expresar la carga viral en forma de un logaritmo de base 10; por
ejemplo, si en una primera determinación se encuentran 100,000 copias del virus
por mililitro, entonces:
La
disminución de 1 log, es igual a la disminución en un factor de 10 delnúmero de copias, es decir, una disminución a 1 O000 copias por mililitro.
La disminución de 2
log,
es igual a la disminución en factor de 100 del númerode copias, es decir, una disminución a 1 O00 copias/ml.
Una disminución de 3
log,
es igual a la disminuciónen
un
factor de 1000 del número de copias, es decir, a 100 copiaslml.Las variaciones de 0.3 log de una muestra inicial a otra pueden deberse a
variaciones en la técnica, mientras que las que presentan cambios mayores a 0.5
log reflejan cambios reales. Por
lo
tanto, para considerar que un tratamiento esefectivo, los cambios no deberán ser mayores a 0.5 log (Castillo, 1998).
Usando como parámetros la carga viral y el número de linfocitos CD4, se puede
establecer en términos generales, aunque todavia de forma cambiante, que con
conteos de
CD4
por debajo de 50 células por mm3 y cargas virales por arriba de50000 copiadmi, el pronostico será muy grave, con grandes posibilidades de
2. Qumioterapia.
El descubrimiento de la actividad de la zidovudina contra el VIH ha alentado
siempre la posibilidad de curación como la meta más importante en el tratamiento
del
SIDA. La aparición de nuevos medicamentos antirretrovirales, suscombinaciones y la elección del momento adecuado para emplearlos, crea
grandes expectativas sobre la posibilidad de supresión total de la actividad viral:
en unos pocos años la infección ha pasado de ser una infección inevitablemente
mortal a una con gran potencial de tratamiento a largo plazo.
El conocimiento de la historia natural de la enfermedad y la determinación de
desarrollo de complicaciones, primero a través de la medición de linfocitos T CD4'
y el número de copias de VIH en suero, hace posible prevenir el desarrollo de
infecciones oportunistas y así modificar la progresión de la enfermedad. Además
la cuantificación viral proporciona un parámetro muy sensible de respuesta al
tratamiento (Deyton, 1996).
Inmediatamente después de la infección primaria, una población de T CD4' de
memoria (en reposo) hospeda una población viral en estado de latencia (provirus),
que la convierte en un reservorio del virus refractario al tratamiento. Un tratamiento
durante esta etapa temprana, disminuiría la magnitud del reservorio (cosa que no
sucede durante la terapéutica tardía);
lo
que la situaría como teóricamente ideal para un posible tratamiento. Sin embargo ningún tratamiento garantizala
supresión completa del virus durante tanto tiempo (la vida media de los T 0 4 ' de
memoria es en promedio de 23 años), por lo que la erradicación total del virus es
una meta poco realista (Ponce de León, 2000). El reto actual es primero el
tiempo, y el estimular la liberación del virus de los reservorios donde se encuentra.
Un primer paso es lograr una supresión potente y duradera con el mínimo de
efectos secundarios y mayor apego posible por parte del paciente al tratamiento.
Pronto el número de antivirales llegará a 15 medicamentos, lo que produce 204
combinaciones triples y 1028 cuádruples,
lo
que hace imposible evaluarclínicamente todos estos tratamientos, por ello se recomienda al médico limitarse
a combinaciones que efectivamente hayan demostrado beneficios tangibles
(Rangel-Frausto, 2000).
1. Medicamentos.
La terapéutica actual depende de la disponibilidad de 3 grupos principales de
medicamentos:
lnhibidores nucleósidos de la transcriptasa reversa (NRTls). Bloquean la
transcripción reversa (la creación del ADN viral) por ser pedazos señuelos para
.
construir el ADN.
0 lnhibidores no nucleosidos de la transcriptasa reversa (NNRTls). Interrumpen
la transcripción reversa, por atarse a la enzima, impidiendo su funcionamiento.
0 lnhibidores de la proteasa (IPS). Bloquean la acción de la proteasa, enzima que
corta las cadenas de proteínas del VIH en fragmentos específicos para crear
una partícula viral funcional.
Otros medicamentos que están aún en fase experimental podrían incorporarse a
los
esquemas de tratamiento ya existentes. Estos son: inhibidores de la integrasa,ejemplo de este tipo de inhibidores; otros son
los
denominados inhibidores de fusión (p. ej., el T-20 de Trimers, Inc).Estos
últimossolcl
disponibles en U.S.A. .Hasta el momento
los
úniccs disponibles sonlos
primeros tres grupos mencionados líneas arriba (Info-red SlDA Dpto. de Salud de Nuevo México). Ennuestro país
solo
se encuentran disponibleslos
dos primeros grupos (Rangel- Frausto, 1998).11. Combinaciones de medicamentos.
El establecimiento de nuevas terapias antirretrovirales activas (TARA), han
llevado a un control de la viremia como no se había observado antes en
el
desarrollo de la epidemia. Las evidencias clínicas y de laboratorio sugieren
el
restablecimiento de la actividad inmune en un número significativo de pacientes
con VIH una vez que se ha alcanzado
la
supresión de la viremia, es decir, cuandose logran niveles no detectables de carga viral (Pontesilli,, 1999).
Las combinaciones de medicamentos que funcionan bien conjuntamente son:
-
Nucléosido-nucléosido. Son las combinaciones más estudiadas a nivelmundial.
-
lnhibidor de la proteasa más dos nuclósidos. Combinación más potente que laanterior. Produce una mayor y más prolongada reducción de la cantidad de
virus en la sangre. Esta terapia ofrece las mejores probabilidades de controlar
la infección por VIH durante un largo tiempo.
-
Un no nucléosido y dos nucléosidos. Combinación igualmente potente que la-
Un no nucléosido y un inhibidor de proteasa. Las interacciones entrelos
medicamentos de esta combinación varían de una persona a otra, pudiendo
interferir uno con la actividad del otro. Se recomienda manejo precautorio de
este esquema hasta que se completen más estudios clínicos.
Hasta el momento se estudian otras 4 posibles combinaciones, pero aún se
desconoce el régimen más seguro y efectivo (Markowitz, 1997).
Cabe señalar que tales aseveraciones no son exactas para el 100% de
los
casos(como sucede en muchos fenómenos biológicos). Debido a la variabilidad genética
inherente a cada individuo, por lo que la aparición de efectos secundarios y aún
los
efectos benéficos de tales tratamientos cambian de un individuo a otro (Hirsh,1998).
3. Categorías de pacientes según el riesgo de progresión a SIDA.
El inteyalo entre la infección primaria o el síndrome retroviral agudo (si ocurre) y
el desarrollo de las condiciones que señalan la evolución hacia el estado de
inmunosupresión y SlDA es muy variable, pero en general tiene un promedio de 8
años. Sin embargo se han descrito casos en
los
que aparecen infecciones gravescaracterísticas de SlDA sólo dos años después de la exposición al virus, y en el
otro extremo, individuos con más de 10 años sin datos clínicos ni inmunológicos
de progreso de la infección. Durante este lapso de silencio clínico el individuo no
presenta una morbilidad diferente a la de la población seronegativa de su
comunidad, aunque la replicación viral continua, en pequeña escala, en los
ganglios linfáticos, con efectos inmunológicos e histopatobgicos que han sido bien
identificados (Romero, 1998). Dos marcadores inmunológicos relevantes de
evolución hacia el SIDA lo constituyen sin duda el numero de linfocitos CD4/mm3
y la carga viral (particutas víraleslml) mencionadas anteriormente. Precisamente
con base en estos marcadores puede establecerse de manera aproximada (más
no absoluta) el riesgo de evolución a SIDA. Se ha encuadrado a los pacientes en
3 categorias de riesgo:
i> Progresores "lentos" o supervivientes a largo plazo:
Son pacientes que permanecen asintomáticos por periodos inusualmente largos
(superiores a los 10.5 años) y que mantienen títulos elevados de linfocitos CD4
mayores a 500/mm3 . Las explicaciones de este fenómeno apuntan en dos
direcciones: 1) factores de baja patogenicidad del VIH, y 2) menor susceptibilidad
genética del hospedero mediante una respuesta inrnunológica distinta.
Estos
pacientes se caracterizan por cepas de VIH con baja virulencia (baja actividad
citotóxica), baja carga viral (menos de 20,000 copias por ml), ausencia de
anticuerpos promotores (que facilitan la entrada a macrófagos y células
CM),
intensa respuesta antiviral de células CD8 (por conservar una subpoblación capaz
de sintetizar factor antiviral celular
o
FAC), preservación estructural de10s
ganglios linfáticos y recientemente se puede agregar la mutación en el gen que
codifica para el correceptor CCR5 (CCR5632) mencionada en un apartado
anterior (Sullivan, 2001). Tales pacientes constituyen menos del 1% de 10s
casos.
ii) Progresores promedioPacientes con promedio de supervivencia de 10.5
por conteos de
CD4
entre 200 y 499/mm3 y cargas virales entre 20000 y50000 copias por ml.
iii) Progresores rápidos:
Constituyen poco menos del 30% de
los
casos. Entre la infección yla
muerteexiste un periodo inferior a
los
5 años. Se caracterizan por un conteo de CD4 inferior a las 200/mm3 y cargas vírales elevadas por arriba de las 50000 copiaspor mi. (Reyes-Terán, 1994)
PROPUESTA:
Uno
de los aspectos poco explorados y que mayor controversia han causado, esla aplicación de quimioterapia combinada en pacientes con bajo riesgo de
evolución hacia SlDA (progresores lentos). Algunos especialistas proponen que un
tratamLento en fases tempranas puede ser benéfico para el paciente prolongando
el periodo de aparición de
los
síntomas característicos del SlDA (Ponce de León,2000); otros, sin embargo, promueven la idea de que este trae escasos beneficios
o ninguno al paciente en cuestión, y que en muchos casos podría ser perjudicial
por la pronta aparición de cepas resistentes a los antirretrovirales
o
inducir enmuchos casos la expresión rápida de la enfermedad (Schooley, 1999). Por lo que
el presente trabajo pretende analizar la dinámica de la infección en progresores
lentos bajo la acción conjunta de dos antivirales ( un inhibidor de la transcriptasa
reversa y de la proteasa) utilizando el modelo propuesto por Perelson y Ho (1 996),
empleando datos chicos, así como valores numéricos en
los
parámetros usadosOBJETIVOS:
General: Analizar la dinámica de la infeccion por WIH (numero de T CD4"
infectadosho inftxtados y carga viral) a lo largo del tiempo en un progresor de
bajo riesgo hacia SlOA caracterizado por permanecer asintomático por periodos
superiores a los 10.5 años y con títulos de CD4/mm3 superiores a 500 (Reyes-
Terán, 1994), bajo la acción de una quimioterapia combinada utilizando el modelo
de Perelson y Ho con base a datos clínicos y parámetros numéricos no usados
antes
en
otros
modelos similares, con elfin
de obtener una poyección aproximada de la dinámica real de la infección en un progresor debajo
riesgo.Objetivos individuales:
1. Analizar la dinámica normal de las células T CD4' infectadasho infectadas y
carga viral en el plasma de un progresor de bajo riesgo.
2. Analizar la dinámica de las células T CD4" infectadasho infectadas y carga
viral en un progresor de bajo riesgo, bajo monoterapia, con un NRTl y/o con
un IP.
3. Analizar la dinámica de las células CD4 infectadash0 infectadas y carga viral
bajo la acción de una biterapia NRTI-IP.
4. Comparar entre sí las dinámicas bajo mono- y biterapia, así como cada una de
estas con la- dinámica normal de las células CD4 infectadash infectadas y
carga viral en el plasma de un progresor de bajo riesgo.
incrementando asimismo el número de células T no infectadas a niveles
superiores a
los
obtenidos en una monoterapia.EL MODELO.
Dadas
las
características del progresor lento (asintornatico por un periodo detiempo superior a
los
10.5 años y conteos de TCD4 no infectados entre 500 y 700),la
aplicación de un modelo matemático resulta ideal, ya que nos permitehacer una proyección muy cercana de
lo
que sucedería en un período de tiempo determinado con sus conteos de TCD4 no infectados/infectados y carga viral .El modelo que se empleará para
el
presente trabajo est:a basado en el articulo deAlan Perelson y David D. Ho (Perelson y Ho, 1996), introduciendo en este la
ecuación logística para la dinámica de las células T CD4 no infectadas.
El modelo original de Perelson y Ho incluye a los siguientes elementos ( o
compartimentos):
Dinámica de las células T infectadas.
Dinámica de las partículas vírales infecciosas.
El modelo asume que el VIH-1 infecta a sus blancos, que son
las
&lulas T noinfectadas a una tasa constante (denominada tasa de infección "k). Antes del
comienzo de la quimioterapia la dinámica de estos compartimentos puede
TNFECTADAS POR CDJ' infectadas de virus perdidas por
UNIDAD DE por unidad de unidad de tiempo
TEMPO tiempo
I I I
viriones
INFECCISOS infecciosos
por unidad de tiempo
infecciosos perdidos por unildad de tiempo
Aquí se considera que la población de células T no infectadas se mantiene
constante en el tiempo. Para la aplicación de agentes antirretrovirales se
introducen en ambos compartimentos los términos: (1- ~ F ! T ) en el primer cajón del
compartimento (1) y (l-qp,) en el primer cajón del compartimento 2, donde T)RT y
rpl denotan los indices de efectividad para los inhibidores de la transcriptasa
reversa y de la proteasa respectivamente. Para un inhibidor hipotético con 100%
de efectividad la población de células infectadas y de virus infecciosos decaería
exponencialmente hasta extinguirse. Este modelo sih embargo tiene sus
restricciones, ya que fue diseñado para un periodo de tiempo corto (no mayor de 8
días) y por ello se considera la población de células T CD4' no infectadas
constante, sin embargo para periodos mayores de tiempo se requiere considerar
a esta última no constante. Para ello se introduce un tercer cornpartimento en el
modelo orginal este es:
INFECTADAS
POR UNIDAD
En los apendices 4 y 5 se describen los parámetros y el modelo completo.
RESULTADOS.
La
aplicación del modelo de Perelson y Ho modificado con la introducción de lapoblación de T CD4' no infectadas arroja los siguientes resultados con un conteo
de 600 CD4/mm3 :
PANEL 1. PROGRESOR LENTO SIN QUIMIOTERAPIA.
La figura 1 muestra dos picos, uno mínimo y otro máximo entre los 400 y 850
CD4/mm3 en los primeros 60 días de medición, después entre los 60 y 300 días se
observan fluctuaciones con picos extremos que van disminuyendo hasta
estabilizarse ligeramente arriba de los 500 CD4/mm3.
En cuanto a la población de T CD4' infectadas, dentro de los primeros 60 días su
número se incrementa de manera drástica hasta
10:s
120 CD4/mm3 paradescender de igual forma hasta casi 12 CD4/mm3 a los 60 días, después de este
tiempo y hasta casi los 300 días el número de T CD4' se estabiliza ligeramente
arriba de las 36 CD4/mm3.
La población de virus infecciosos también se incrementa notablemente hasta casi
los 180 virionedml. dentro de los primeros 60 días para después irse estabilizando
PANEL 2. MONOTERAPIA CON IRT YIO IP
Monoterapia con
IP:
(Fig., 4-6)Se incrementa de manera notable el número de T CD4" hasta ligeramente arriba
de las 1000 CD4/mm3 para después regresar casi al valor inicial dentro de
los
primeros 80 días, después hay un nuevo aumento no iian espectacular como alinicio, hasta que la población se estabiliza
en
alreded~or de las 750 CD4/mm3después de
los
240 días.La población de T CD4' infectadas se incrementa hasta casi arriba de las 70
CD4/mm3 para luego disminuir a casi menos de 20 en los primeros 80 días de
tratamiento, para luego incrementarse hasta casi 40 a
los
120 días y finalmente estabilizarse en 32 CD4/mm3después de los 300 días de tratamiento.Con respecto a los virus infecciosos, en los primeros 80 días su número aumenta
hasta casi 80 T CD4' para luego disminuir hasta casi 2CI viriones/ml , después de
este intervalo hay un ligero incremento hasta poco menos de 50 viriones/ml. a
continuación la población viral se estabiliza en 40 virioners/ml. después de los 240
días.
Monoterapia con IRT:
La figura 7 muestra un incremento inicial hasta 950 para luego disminuir a casi 550
CD4/mm3 en los primeros 80 días de quimioterapia, post.eriormente entre
los
80 y90 días hay un ligero incremento hasta casi 750 CD4/mm3 , para luego
En la fig. 8, se incrementa a casi 70 para luego disminuir a menos de 16 CD4/mm3
dentro de los primeros 80 días , posteriormente hay run incremento hasta casi
40
CD4/mm3, para finalmente establizarse en casi 24 a los 240 días.
En cuanto
a
la poblaciórr viral (fig. 9), dentro de los primeros 80 días esta alcanzaniveles de hasta 120 viriones/ml , baja a 60 después de este intervalo y se
equilibra finalmente en cerca de 36 viriones/ml.
PANEL 3. QUIMIOTERAPIA COMBINADA (Fig. 10-12)
Los
efectos son más evidentes en este caso, el número de T CD4' no infectadosse eleva
a
casi
por arriba de las 1 1 O0 CD4/mm3 en losl primeros 120 días, bajandoa menos de 900 después de este intervalo, hasta estalbilizarse en 960 CD4/mm3 a
los
240
dias. Hasta el número de T CD4' infectados no sobrepasa los 30CD4/mm3 y se estabiliza entre las 15 y 18 CD4/rnrn3
a
los 240 dias.La carga viral apenas alcanza las 30 viriones/ml. en su pico mas alto y se
estabiliza en casi 21 viriones/ml. después de los 240 dias.
Las
gráficas correspondientes a cada panel pueden consultarse en el apéndice l.DISCUSIÓN Y CONCLUSIONES.
1. Progresor lento sin tratamiento:
En
este caso, las fluctuaciones iniciales en las poblaciones de T CD4'no
infectadodinfectados y virus infecciosos pueden interpretarse como resultado dela respuesta montada por el sistema inmune contra la infección por
el
VIH, sobretodo en los primeros 60 días de la infección como puede apreciarse en los gráficos
una elevada carga viral
la
cual se asocia con un alto grado de replicación del VIH; también puede observarse una notable disminución en el número de T CD4'asociado
al
aumento de T CD4' infectados (figuras 1 y 2). Cabe señalar lacontrarregulación de los niveles de replicación viral observados en la figura 1 de
350 hasta 550, que puede considerarse leve, sin llegar a los niveles de referencia
basales (1 200 CD41mm3 ). Asimismo la elevada viremia disminuye a títulos bajos
en un corto periodo de tiempo. Estos resultados coinciden con lo que en la
literatura se denomina síndrome retroviral agudo ("periodo de ventana"), después
de este periodo, en
los
gráficos se puede observar que las tres poblaciones se estabilizan después delos 300
dias, fenómeno que se denomina establecimientode
2.
I.
Se
en
la infección (Reyes-Terán, 1994).
Progresor lento bajo monoterapia:
Monoterpia con IP:
observa prácticamente una dinámica parecida a la anterior pero con diferencia
los niveles de los de T CD4' no infectados/infectados y población de virus
infecciosos.
Eí número de T CD4' alcanza niveles cercanos a
110s
valores de referenciabásales, regresa casi a su valor inicial y se estabiiira
por
cercade
los
750 CD4/mm3, o sea 200 T CD4' más que sin quimioterapial (fig. 4). La viremia inicialdisminuye de casi 180 virionedml a casi 80 viriones/ml. en su pico máximo, o sea
una diferencia de 100 viriones/ml, y se establece en poco más de 30 virionedml.,
comparado con los casi 60 viriones/ml, lo que representa una diferencia de 60, la
II. Monoterapia con IRT:
Los
gráficos deT
CD4'
no infectadas entreIP
y1R.T
muestran poca diferencia entre si, ambos se acercan alos
niveles de referencia básales, existiendo una ligera diferencia a favor del IP en el pico máximo, sin embargo el conteo seestablece en 650 CD4/mm3 lo que marca una diferencia de
poco
mas de 100 CD4/mm3 entre ambas monoterapias. También la población de virus infecciososmuestra
una diferencia de 10 viriones/rnl. a favor d ela
IP.
Sin embargo enel
conteo de T CD4' infectados
el
número de estos, es inferior para la monoterapiacon IRT que con la aplicación de IP,
lo
que podriaser
explicado por el hecho de que los IP actúan en una fase posterior del ciclo vital del virus con respecto alos
IRT que actúan en una fase mas temprana del misnio (inicio y final del mismo
respectivamente).
Obviamente existen diferencias notables con cualquier monoterpia con respecto a
la ausencia de quimioterapia, mejorando la situación inmunologica del paciente.
111. Quimioterapia combinada.
Aquí,
los
niveles deT
CD4' no infectados casi retornan1 alos
niveles de referencia básales (con una diferencia de 60 CD4/mm3 ) enlos
primeros120
días y seestablecen en 960 CD4/mm3
lo
que es muy superior a lo logrado con cualquier monoterapia (con una diferencia de T CD4' de entrle200 y 300 por milímetrocu bico).
La viremia también disminuye notablemente, alcanzando como máximo 30
numero de T CD4" infectadas no sobrepasa las 30 células infectadas por milímetro
cubico y se establece en poco menos de 18 CD4hm3 , lo cual no muestra
diferencias muy marcadas con respecto a
la
monoterapia (de menos de 6 conIRT),
lo
que permite inferir que tales células se convierten en reservorio del virus. Con respecto a las oscilaciones observadas entre los O y 200 días, estas puedenhallarse asociadas a
la
carga viral, hecho que se ha observado en estudiosclínicos realizados en pacientes con conteos de T CD4' superiores a
los
500/mm3, sin tratamiento, donde estas fluctuaciones en la carga viral se encuentran ligadasestrechamente con múltiples infecciones agudas menores de una semana de
duración (Vidal, 1998). Este mismo fenómeno se ha observado con la aplicación
de tratamientos dirigidos contra las infecciones oportunistas (como vacunaciones o
tratamiento con antibióticos), solo que en este caso también pueden observarse
adicionalmente reacciones alergicas ligeras. Es precisamente estos antecedentes
los que .refuerzan la idea de que la aplicación de quimioterapia antirretroviral en
pacientes con conteos de T CD4' superiores a 500/mrn3 puede perjudicar al
paciente en vez de ayudarlo (Chapman, 2000).
IV. Conclusiones finales:
Se puede ver que la quimioterapia combinada ofrece difeirencias sustanciales con
respecto a la monoterapia con un
solo
antirretroviral. Con Ita primera prácticamenteel
sistema inmunologico literalmente se "restaura"al
alcanzar condiciones muycercanas a
las
queposeía
antes dela
infección, sin embargo el virus no eseliminado totalmente del organismo. El que el VIH no sea eliminado del
sobrevivir a vigorosa reacción de recuperación del sistema inmune, entre estas: el
desarrollo de numerosos y variados epitopos, la elevada tasa de mutación del
virus y su capacidad para sobrevivir como provirus dentro de la célula invadida
lo
que hace al VIH refractario a cualquier tratamiento (Abbas, 1999). Sin embargotales hechos no pueden ser explicados
por
el presente modelo.PERSPECTIVAS FUTURAS.
Se
ha
propuesto recientemente dos tipos de estrategia, unaes
el
empleo conjuntode interferon con quimioterapia Combinada con
el
fin cle “sacar” al virus delos
reservorios donde se oculta y eliminarlos con los antirretrovirales; otra idea es lade aplicar una quimioterapia combinada intermitente (;Hatano, 2000), es decir
aplicar por un periodo
corto
de tiempo la quimioterapia (entre 6 y 12 meses) y cuando se lograra estabilizar la infección descontinuarla por un periodo corto, nomayor
a
los 2 meses para reanudarla nuevamente (o antes si la respuesta no esfavorable), se cree que una situación así podría mantenerse por periodo mínimo
de 2 años y un máximo de hasta 5 años,
lo
que representlaria una ventaja desde ‘elpunto de vista económico por el costo de
los
fármacos y por la disminución deefectos adversos.
Un aspecto que
no
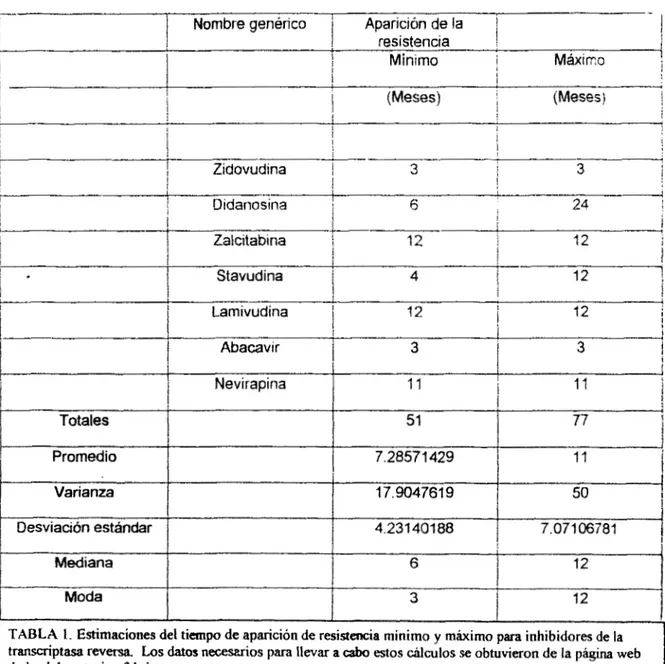
se ha considerado en este modelo es el de resistencia a losantin-etrovirales (Apéndice 3), para ello seria necesario introducir en el modelo
usado en este trabajo lo que se denomina oscilaciones antigenicas (es decir
variación de epitopos). Las T CD4- (T CD8’ ) montar una fuerte respuesta a
múltiples epitopos (hasta
íO9
según Abbas, Ho y algunos otros autores), lo queorganismo se relaciona en parte con la evasión de!l VIH a esta respuesta por
variación antigenica.
El
montar un modelo que considere tales variantes requeriríade un número de ecuaciones considerable que escapa a los alcances de este
trabajo (Nowak, 1995). I
BIBLIOGRAFIA:
Abbas, A.K., Lichtrnan, A.
H.
Y
Pober,J.
S.,
1999. lnmunologia celular y molecular, 3a. Edición McGraw-Hill, México. Capitulo 21.I Análisis de la situación
del
SIDA y las ETS del primer trimestre de 1998. SlDAlETS1998, 4:48-62.
Crandall, K. A., 1999. The evolution of HIV,
J.
Hopkins Llniversity Press, E.U.A.Castillo-Torres, N., Barriga Angulo, G., Arumir Escorza,
C.,
Solías Trejo, (1998). Carga viral y subpoblaciones linfocitarias en la infección con VIH-1. Comparación entre sus determinaciones básales. Revista Mexicana de Patología Clínica, Vol. 45, 159-1 61.CastillÓ-Torres, N., Baniga Angulo, G.,
Solís
Trejo, M., Arumir Escorza, C., (1 998). Carga viralen
el síndrome de inmunodeficiencia adquirida. Estudio comparativo de3 métodos. Revista Mexicana de Patología Clínica,
Vol.
45, 155-1 58.Dittmar, M.T., McNight, A., Simmons, G.,Weiss, R.A., Simmons, P. (1 997). Tropism and co-receptor use. Nature, 385:495-496.
Deyton, L. (1996). Importance of surrgoate markers in the evolution of antiviral therapy for HIV infection. J A W , 276: 159-1 60.
Epidemioiogia
del
SIDANIH en México. Salud Pública tie Mexico, 1995, Vol. 37, 6:520-524.Fennec F.J., White, D.O., (1994). Medical Virology, Fourth edition. Academic. Press. E.U.A.
Guerra Marquez, A., (1997). Significado, procedimientos y recomendaciones para el uso de la cuantificación de la carga viral en
la
infección por VIHISIDA. SIDA- ETS, Febrero-
Abril, Vol. 3, 1:27-30.Hatano, H., Vogel, S., et.al., 2000. Pre-HAART HIV burden aproximates post- HAART viral levels following interruption of therapy in paitients with sustained viral suppression. AIDS, 14:1357-1363.
Hirsch,
M.S.,
Conway, B., D’Aquila, R.T., (1998). Antiretroviral drug resistance testing in adults with HIV infection: implications for clinical management. JAMA, 27911984-1991.Info-red SIDA Nuevo México (Dpto. de Salud). Medicamentos contra
el
VIH (abril, 1999).Kirschner,
D.
And Webb,G.F.,
(1997). A mathematical model of combined drug therapy of HIV Infection. Journal of theoretical Medicine, vol. 1 :25-34.Chapman, L.E., Green, T.A., et.al., (2000). Effect events on plasma HIV-I RNA
levels in persons with CD4+ T-lymphocyte counts of more than 500 x
lo6
cellsA.AIDS, 141-1 135-1 11 146.
Magis,
R.C.,
Esquivel, P.L., Lbpez, M.C., (1999). Experiencia en el Manejo del paciente con VIH entre médicos de la secretaria de salud. Salud Pública de México, 41 :460-65.Markowitz, M., (1997). Terapia combinada para la infección por VIH. International association of physicians in AIDS care, 2: 1-8.
Nowak, M.A., May, R.M., et.al., (1995). Antigenic oscillations and shifting inmunodominance in HIV-1 infections. Nature, 375606-1 ‘I.
Ponce de León, S., Rangel-Frausto, S., (2000). SIDA aspectos clínicos y terapéuticos. McGraw-Hill Interamericana, México.
Powderly, W.G., Landy, A., (1998). Recovery of the immune system with antirretroviral therapy. The end of opportunism?. JAMA, 280(1):72-77.
Pontesilli, O., Kerthot,
S.,
Noterrnans, D.W., (1999). Functional recostitution and human immunodeficiency virus-1-specific cell mediated immunity during highly active antirretroviral therapy.J.
Infect. Dis., 180:76-86.Perelson, A S . , Neumann, A.U., Markowitz, M., Leonard, J.M., and
Ho,
D.D.,Reyes-Terán, G., Alcocer-Varela,
J.,
(1994). Pstoaenesis de la infeccicn por V!V-1. Rev. Invest. Clín., 46:113-147.
Romero,
C.R.,
(1998).La
patología chicaen
la evaluación pronóstica y terapéutica del paciente con SIDA.Revista
Mexicana de Patología Clínica, Voi.45: 135-36.
Rangel-Frausto M.S., Ponce de León S, Villasís-Kiever A, Ruíz-Palacios,
G.M.
.HIV patients survival in Mexico:
the
importance ofprophylaxis
and
antiviral
treatment. Proceedings of the 1 2tth World AIDS Conference, Geneve 1998;Abstract 121 11.
Schooley, R., (1999). Immunologic effects and^ side effects of succesfull antirretroviral therapy. Clin. Infect. Dis., 29:8-12.
Suilivan, A.D., Wigginton,
J.,
Kirschner, (2001). The ,coreceptor mutation CCR5A32 influences the dynamics of HIV epidemics and is selected forby HIV.
PNAS (to appear).Terrés, A.M., (1998). Estado actual de la evolucióin y manejo del paciente HIV positivo con métodos de laboratorio. Revista Mexiccrna de Patología Ciinica, Vol.
45: 137-1
53.
The XI11 International AIDS conference, Durban Sudafnca año 2000.
Vidal,C., Garcia,
F.,
Romeu,
J.,
etal., (1998). Lack of evidence of stable viral (oadset-point in early stage asymptomatic patients with chronic HIV-1 infection. AIDS,
12: 1285-1 289.
A P E N D I C E 1.
GFIÁFICOS OBTENIDOS
DE
LAS SIMULACIONES.PANEL 1. Progresor lento sin tratamiento:
FIG. 1 Dinámica de las TCD4 no infectadas.
FIG 2. Dinámica de TCD4 infectadas.
FIG. 3. Dinámica de virus infecciossos.
PANEL 2. Progresor lento con monoterapia.
FIG. 4 Dinámica de las TCD4 no infectadas bajo mo,noterapia con iP
FIG. 5. Dinámica de TCD4 infectadas bajo monoterapia con IP.
FIG. 6. Dinámica de virus infecciosos bajo monoterapia con IP.
FIG. 7
-
9.
Mismas dinámicas pero bajo acción deun
IRT.PANEL 3. Progresor lento con quimioterapia combinada.
FIG. 10-12. Dinámicas idénticas a las anteriores pero con quimioterapia
combinada: IRT + IP.
La notación para las variables en los gráficos se
cambio
por conveniencia para unmejor manejo de las mismas en
el
programa empleado en su cálculo (apéndice 5).O
E-r
H
’ L
k
z
H
I
',
""- "-""
I i I
N
O
ti
c
d
H
O O
N
I
’ ....
I
I
I
I ! I
O
z
O
u
E
d
O
c
n
m
mW
.-
u
F4
H
O
u
e!
z
r 1 t t I I I I LO O
c-
i
I I I !
O
(D O d- o cv
O
u
.d
w
E-c
O
OO
O
7
i
""-
"_
"-"-- ". -
I
I
-""
O
m O
O
O O
00 O b
- 0 O d O - N m C d- cu O
- w
-
T
Ij
i
i I
I I
O
(o N m O
- 0 O
d-
O
co
Y
03 O
d
O
-d
P
- N O m
“Q O
N
O
co
T
O
co
"" -. . ."_
- 0
w
O
O
o CY
O
w N
n
cn
m
D
.-
Wc
O
co
O
m
G
E
d
O
5
n
u- ON
O
d
5
0
wo
Q
/
,
I
,
..
". --
- 0
*
O
N O
(3
h
m
v)
-u
"
W
-
N
O
W
M
v
6
es
5
0
O
A P E N D I C E 2.
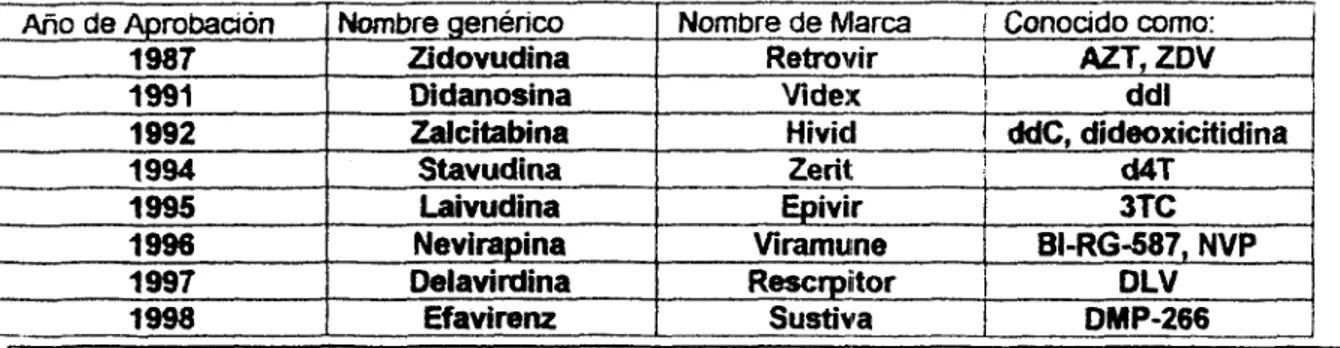
CUADRO DE MEDICAMENTOS CONTRA
EL
VIHAiio de Aprobaaon
1987 ' Nombre genérico Nombre de Nlarca ! Conocido como:
Viramune
f
El-RG-587, NVP Nevirapina1996
3TC Epivir
Laivudina 1995
I
ZeriC I d4T
Stavudina
1994 Hivicl
!
ddC, dideoxicitidina ,Zalcitabina 1992
Videx 1 ddl
Didanosina 1991
Retrovir i I AZT, ZDV Zidovudina
I
1997 Delavirdina Rescrpiitor I I DLV
L. 1998 Efavirenz SuscI'wa DMP-266
Cuadro I . Inllibidores r:ucleosidos de la trarmriptasa reversa (NRTIs). Mormaciim obtenida directamente de
la uanina web de los laboratorios fitbricantes v Infored-SIDA Nuevo México.
Cuadro 2. Inhibidores de la prdeasa (U's). Mornación obtenida del PLM (45'. Edición), e infored-SLDA