UNIVERSIDAD NACIONAL DE QUILMES
Departamento de Ciencia y Tecnología
MICROBIOLOGÍA GENERAL
Trabajo Práctico Nº 1: Bioseguridad en el Laboratorio de Microbiología.
Técnicas de Esterilización.
Las prácticas de laboratorio de este curso requieren la manipulación de organismos vivos, por lo que a efectos de proteger a las personas de posibles infecciones y al material contra contaminaciones, es fundamental la implementación de técnicas microbiológicas apropiadas.
Considerar que todas las muestras son peligrosas (los microorganismos son potencialmente patógenos dependiendo de las circunstancias y la dosis)
y como tales hay que tratarlas.
Las siguientes consideraciones deben tenerse siempre presentes en cualquier tipo de manipulación de material biológico:
9 Las manos toman contacto con distintas fuentes de infección, y sin que tengamos
noción clara de sus movimientos las llevamos a la boca o a los ojos. Debe eliminarse la costumbre de morder lápices que se apoyan en cualquier superficie debe eliminarse.
9 El laboratorio no es un lugar apto para el consumo de alimentos o bebidas, ya que
existe la posibilidad de ingerir sustancias contaminadas por accidente.
DENTRO DEL LABORATORIO: - NO FUMAR
- NO BEBER
- NO COMER
- NO MAQUILLARSE
9 No pipetear jamás con la boca ningún medio de cultivo (inoculado o no) o reactivo
químico. Para esta tarea se deberá hacer uso de propipetas.
9 Cuando se ingresa al laboratorio sólo deberán llevar guardapolvos, cuadernos de
apuntes, guía de trabajos prácticos, lápices y rotuladores. Por ningún motivo se deben dejar libros, mochilas o bolsos sobre las mesadas.
9 Las mesadas deben decontaminarse al comenzar y al finalizar el trabajo práctico y
en caso de derrame de cualquier sustancia potencialmente peligrosa.
9 Se deben lavar las manos con jabón o detergente líquido y secarlas con toallas de
papel al inicio del práctico, después de haber manipulado material infeccioso y al abandonar el laboratorio.
9 Si la tarea lo requiere, se deben utilizar guantes quirúrgicos que disminuyen la
posibilidad de contaminación o lastimaduras.
9 El uso del guardapolvo debe estar restringido únicamente al interior del laboratorio.
El guardapolvo debe lavarse periódicamente y, a fin de evitar el contacto con la ropa de calle, se debe guardar en bolsas de polietileno limpias.
9 Las puertas y ventanas del laboratorio se deberán mantener siempre cerradas para
9 No colocar los instrumentos contaminados (tales como ansas y pipetas), directamente sobre las mesadas. Las ansas deben esterilizarse por incineración en la llama del mechero. Las pipetas y las puntas de las micropipetas deberán colocarse, una vez utilizados, en los recipientes de descarte que contienen hipoclorito.
9 Todos los materiales se decontaminarán antes de eliminarlos o de limpiarlos para
su reutilización.
9 Una vez finalizado el trabajo práctico todo el material utilizado debe colocarse en
bateas plásticas con desinfectante para luego lavarse con detergente y enjuagarse con agua corriente.
9 Bajo ningún concepto se debe dejar material contaminado sobre las mesadas. Al
finalizar el práctico el encargado del grupo deberá ubicar las botellas con medio de cultivo y el resto de los materiales en el lugar donde le indicará el instructor.
9 Siempre se deberá trabajar con el cabello recogido, para mayor seguridad se
recomienda el uso de cofias.
9 Cuando sea necesario transportar tubos de ensayo hacerlo siempre en gradillas,
para evitar posibles accidentes y la contaminación de los mismos.
9 Si se rompen frascos o cajas que contienen cultivos cubrir inmediatamente estos
con toallas de papel absorbente y saturarlas con solución desinfectante, luego de 15 minutos remover las toallas y desechar los residuos envolviéndolos en papel y colocarlos en las bolsas de residuos adecuadas para su posterior inactivación en autoclave.
9 Para rotular el material deberán utilizarse etiquetas o cintas adecuadas. El rótulo
sobre vidrio comúnmente desaparece en el proceso de autoclavado del material.
9 Durante el práctico se debe hablar sólo lo imprescindible, ya que la saliva es una fuente importante de contaminantes. Por la misma razón se debe reducir al mínimo el movimiento en el laboratorio.
9 Si se trabaja con cultivos de hongos u otros microorganismos esporulantes, la
manipulación de los mismos deberá ser rápida y eficiente para evitar la diseminación de esporas en el ambiente del laboratorio.
USO DEL AUTOCLAVE
Esterilización por calor húmedo: Este procedimiento se lleva a cabo en aparatos denominados autoclaves. Se utiliza el vapor de agua como agente conductor del calor y es el método más empleado en Microbiología. La operación puede llevarse a cabo a presión atmosférica (100ºC) o a presiones superiores, lográndose así temperaturas más elevadas. En el manómetro del autoclave el cero corresponde a la presión atmosférica. Cuando el manómetro marca una atmósfera, a esa presión hay que sumarle la presión atmosférica para obtener la presión real.
La relación entre la presión que marca el manómetro y la temperatura alcanzada en el autoclave, esta dada en la siguiente tabla:
Temperatura (ºC) Presión (atm)
La esterilización se logra a temperaturas superiores a los 100ºC. Generalmente se emplea una atmósfera por encima del la presión normal, lo que corresponde a una temperatura de 121ºC. El poder de penetración del vapor a esta temperatura es muy elevado, lo suficiente como para destruir las esporas dentro de los 15 y 20 minutos. El tiempo del proceso depende del volumen a esterilizar.
Existen varios tipos de autoclave; durante el trabajo práctico se utilizará el autoclave de Chamberland.
AUTOCLAVE DE CHAMBERLAND
Consiste en una caldera de cobre sostenida por una camisa externa metálica de forma cilíndrica en cuya parte inferior y por debajo de la caldera, se encuentra la fuente de calor (mechero a gas o resistencia eléctrica). La caldera lleva en su interior un doble fondo desmontable y perforado sobre el cual se coloca el material a esterilizar. La parte superior se cierra con una tapa de bronce que ajusta perfectamente mediante una junta de amianto grafitado o goma siliconada y una serie de tornillos de bronce. La tapa presenta tres elementos que comunican con el interior de la caldera: el manómetro, la válvula de seguridad y la llave de salida de vapor o espita.
Instrucciones para su uso:
1) Colocar agua destilada en la caldera procurando que su nivel no alcance los objetos que se colocarán en su interior. Al material a esterilizar sólo debe llegar vapor.
2) Colocar dentro de la caldera el material a esterilizar debidamente acondicionado. 3) Cerrar el autoclave ajustando los tornillos de su tapa, en posición cruzada, a fin de
asegurar un cierre parejo y hermético. De esta manera se prolonga la vida útil de la junta de la tapa, cuyo espesor debe ser homogéneo en todo su recorrido.
4) Abrir la espita y encender la fuente de calor.
5) Asegurar el correcto estado de la válvula de seguridad. La espita (permite la salida de vapor) debe estar abierta para desalojar el aire interior, hasta que salga un chorro continuo y abundante de vapor (la temperatura de trabajo, por ejemplo 121ºC, se alcanzará a la presión de 1 atm sobre la normal si dentro del autoclave existe solamente vapor en equilibrio con líquido). Todo el aire que hubiese originalmente en el recinto debe eliminado y reemplazado por vapor. Si queda aire dentro de la cámara de esterilización, la presión de vapor será mas baja que la indica el manómetro y por lo tanto la temperatura resultará inferior a 121ºC.
6) Purgar el aparato abriendo y cerrando tres veces la espita para eliminar totalmente los restos de aire.
7) Cerrar la espita. El agua se calentará en el interior del autoclave y la presión de vapor aumentará hasta el valor deseado. Una vez alcanzada la temperatura y presión, el vapor saldrá por la válvula de seguridad.
8) Cuando se alcanza la temperatura de trabajo, debe regularse la fuente de calor para estabilizar la presión. A partir de ese momento se comienza a contar el tiempo de esterilización.
UNIVERSIDAD NACIONAL DE QUILMES
Departamento de Ciencia y Tecnología
MICROBIOLOGÍA GENERAL
Trabajo Práctico Nº2: Microscopía I. Preparación de extendidos. Manejo
del microscopio óptico.
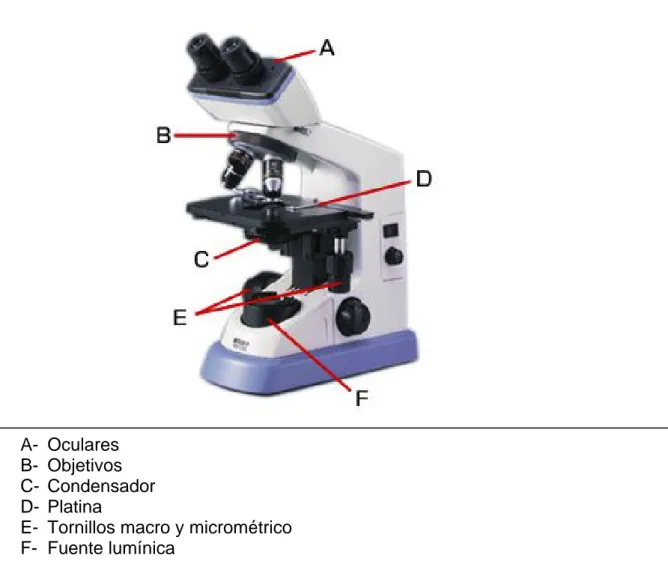
Figura 1: Componentes del microscopio óptico compuesto
Debido a que los microscopios son aparatos económicamente costosos, es necesario utilizarlos con mucho cuidado y responsabilidad. Por lo tanto desde el comienzo se deben respetar las siguientes reglas:
1. Remover todos los materiales innecesarios de la mesa de trabajo.
2. Conectar correctamente todos los cables del aparato.
3. Limpiar el sistema de lentes: Las partículas de polvo disminuyen la eficiencia
del microscopio. Los oculares deben limpiarse varias veces con papel especial para lentes; nunca deben utilizarse toallas de algodón. Si la lente de inmersión se encuentra muy sucia con aceite, limpiarla utilizando papel para lentes
A- Oculares
B- Objetivos
C- Condensador
D- Platina
embebido en xilol. El xilol debe removerse inmediatamente con papel para lentes embebido con etanol al 95% y luego se debe secar.
El cumplimiento de los siguientes pasos aseguran un uso correcto y eficiente del microscopio:
1. Ubicar el portaobjetos con la muestra en los clips de la platina y moverlo hacia el centro, directamente sobre la fuente de luz.
2. Poner en posición la lente de menor aumento. Bajar el cuerpo del microscopio hasta la distancia de trabajo apropiada.
3. Observar a través de los oculares. Con el tornillo macrométrico enfocar la muestra. Para definir la imagen y poder observar en detalle, ajustar la misma con el tornillo micrométrico.
4. Rutinariamente también se ajusta la fuente de luz mediante una perilla o diafragma que gradúa la intensidad de la fuente lumínica.
5. La mayoría de los microscopios son bifocales, es decir que cuando una de las lentes está en foco, la otra también lo estará.
6. Una vez que se enfoca correctamente la muestra con la lente de baja resolución, la preparación puede observarse con el objetivo de inmersión. Para ello se debe colocar una gota de aceite sobre el portaobjetos, directamente sobre el área a visualizar. A continuación se ubicará el objetivo de inmersión.
7. Elevar el condensador para poder observar óptimamente la muestra.
8. Durante la observación microscópica, siempre es necesario observar varias áreas del preparado. Esto se logra recorriendo el mismo con la lente de menor resolución, para luego realizar la observación con el objetivo de inmersión. Durante este procedimiento se deberá ir ajustando la definición de la imagen con el tornillo micrométrico. Luego de la observación es necesario limpiar todas las lentes con papel seco.
La morfología bacteriana puede examinarse de dos formas:
9 observando las bacterias vivas (sin coloración o utilizando colorantes muy
diluidos).
9 observando las bacterias fijadas, como células muertas, las que se deben colorear.
MORFOLOGIA BACTERIANA
La formas bacterianas básicas son tres:
Las formas mencionadas se pueden encontrar en organismos individuales o agrupados. La denominación de los agrupamientos y algunos ejemplos se citan en el cuadro siguiente:
Diplococos (pares de cocos) Cadenas de cocos
Racimos (cúmulos de cocos) Tétradas (cuatro cocos)
Sarcinas (paquetes cuboidales) Estreptobacilos (bacilos en cadena)
Empalizada (bacilos paralelos al eje longitudinal)
Streptococcus pneumoniae Streptococcus spp.
Staphylococcus Aerococcus Sarcina Lactobacillus Corynebacterium
Cocos
La visualización de los microorganismos vivos es más difícil pues la mayoría de éstos son incoloros y carecen del contraste suficiente con el medio en el cual se encuentran.
COLORANTES
Los colorantes se pueden definir químicamente como compuestos orgánicos que contienen anillos de benceno más un grupo cromóforo (grupo químico portador de color pero que no tiñe) y un grupo auxocromo (grupo químico que tiñe).
La capacidad de un colorante de unirse a componentes macromoleculares celulares, tales como proteínas o ácidos nucleicos, depende de la carga eléctrica que posee el grupo cromóforo y de la carga eléctrica del componente celular a ser coloreado.
Los colorantes ácidos son compuestos aniónicos; es decir el grupo cromóforo exhibe carga negativa y por lo tanto se unirán fuertemente a los componentes celulares que posean carga positiva. Las proteínas celulares que poseen carga positiva se unirán al cromóforo aniónico del colorante ácido. Como ejemplo podemos citar al ácido pícrico el cual produce un cromóforo aniónico.
Los colorantes básicos son catiónicos, la ionización del grupo cromóforo exhibe carga positiva y por lo tanto posee una alta afinidad por los componentes celulares cargados negativamente. Los ácidos nucleicos, y diferentes proteínas celulares poseen esta carga y podrán unirse al cromóforo catiónico del colorante básico. Como ejemplo se puede citar al azul de metileno, el cual produce un cromóforo catiónico. Los colorantes básicos son los que comúnmente se utilizan para las coloraciones bacterianas. La presencia de cargas negativas en la superficie bacteriana produce repulsión electrostática con la mayoría de los colorantes ácidos evitando que los mismos penetren a las células.
PREPARACIÓN Y FIJACIÓN DE BACTERIAS PARA COLORACIÓN
El material a ser observado debe fijarse sobre el portaobjetos. Si este procedimiento no se realiza, las células se lavarán durante los distintos pasos de la coloración.
La técnica a emplear utiliza calor para adherir las células al portaobjetos, matándolas. 1. Con un ansa colocar una gota del cultivo sobre el portaobjetos. Si se trata de un
cultivo sólido, primero se coloca una gota de agua y luego se toma la muestra tocando apenas con el ansa una colonia aislada..
2. Esparcir la muestra, formando un film delgado.
3. Secar el portaobjetos al aire o manteniéndolo a 60 cm de la llama de un mechero. 4. Cuando el film esté seco, pasar el portaobjetos tres veces por la llama del mechero
rápidamente.
El agente de fijación ideal es aquél que preserva las estructuras de las células en sus respectivas formas y posiciones sin producir la aparición de artefactos. Aunque el calor es el agente de fijación más utilizado, también se pueden emplear alcoholes y otros compuestos químicos.
TINCION SIMPLE
PROTOCOLO EXPERIMENTAL
Se utilizarán cultivos líquidos y sólidos de distintos microorganismos que han sido incubados durante 24-48 hs.
Los reactivos a emplear serán los siguientes:
9 Azul de metileno 9 Cristal violeta 9 Carbol fucsina
PROCEDIMIENTO
1. Preparar extendidos de los organismos según la técnica descripta anteriormente. Todos los extendidos deben ser fijados al calor.
2. Rotular con etiqueta todos los portaobjetos.
3. Ubicar el portaobjetos en la cubeta de tinción y cubrir el extendido con el colorante indicado durante el tiempo que se menciona:
Carbol fucsina: 15 a 30 segundos Cristal violeta: 20 a 60 segundos Azul de metileno: 1 a 2 minutos
4. Lavar el extendido con agua destilada para remover el exceso de colorante. Durante este paso, mantener el portaobjetos en forma paralela al chorro de agua a fin de reducir la pérdida de microorganismos por lavado a partir de la preparación. 5. Dejar secar los extendidos al aire.
6. Observar los extendidos bajo el microscopio utilizando el objetivo de inmersión.
TINCIÓN NEGATIVA
La tinción negativa requiere el uso de un colorante ácido como la tinta china o la nigrosina. Este colorante posee un cromóforo cargado negativamente. Debido a que la superficie celular también posee carga negativa, el colorante no penetrará a las células. De esta forma las células no teñidas son fácilmente discernibles contra el fondo coloreado.
La aplicación práctica de este tipo de tinciones es permitir la observación de forma y tamaño natural de los microorganismos ya que no se realiza fijación del material, y las células no están sujetas a los efectos del calor ni agentes químicos fijadores. Mediante esta técnica es posible ver bacterias difíciles de teñir, como algunos espirilos.
PROCEDIMIENTO
1. Coloque una ansada de nigrosina cerca del borde de un portaobjetos limpio.
2. Usando técnica estéril, coloque una ansada de cultivo en la gota de nigrosina y mezcle bien.
3. Utilizando el borde de otro portaobjetos y en ángulo de 30º empuje para formar un extendido delgado.
4. Seque al aire sin fijación. Examine los extendidos bajo objetivo de inmersión.
OBSERVACIONES Y RESULTADOS
1. Elegir un campo representativo para cada organismo. 2. Dibujar la morfología y disposición que se observó a escala.
UNIVERSIDAD NACIONAL DE QUILMES
Departamento de Ciencia y Tecnología
MICROBIOLOGÍA GENERAL
Trabajo Práctico Nº3: Microscopía II: Coloraciones simples,
diferenciales y especiales.
TINCIONES DIFERENCIALES
Las coloraciones diferenciales requieren el uso de al menos tres reactivos químicos que se aplican secuencialmente al extendido fijado. El primer reactivo se conoce como colorante primario. Su función es la de impartir color a todas las células.
El segundo reactivo es el agente decolorante y para establecer contraste se utiliza como tercer reactivo, un segundo colorante.
1) TINCION DE GRAM
La coloración diferencial más importante utilizada en bacteriología es la tinción de Gram, llamada así en honor al investigador que la desarrolló. Esta coloración divide a las bacterias en dos grandes grupos, Gram positivas y Gram negativas, clasificación es de importancia para la diferenciación e identificación de las bacterias.
La coloración de Gram utiliza cuatro reactivos.
COLORANTE PRIMARIO: CRISTAL VIOLETA:
es un colorante básico que tiñe a las células de color violeta.
MORDIENTE: IODURO DE GRAM (LUGOL):
Este reactivo forma un complejo insoluble cuando se une al colorante primario.
AGENTE DECOLORANTE: ALCOHOL–ACETONA:
Este reactivo sirve tanto como solvente de lípidos y como agente deshidratante.
CONTRACOLORANTE: SAFRANINA: Este es el reactivo final, se utiliza para colorear de rojo o rosado a aquellas células que fueron previamente decoloradas.
Unicamente las Gram negativas podrán tomar éste color, en tanto que las Gram positivas retendrán el color púrpura del colorante primario.
Las diferencias observadas entre bacterias Gram positivas y Gram negativas se deben a la naturaleza física de sus paredes celulares. El peptidoglucano en sí mismo no se tiñe, sino que actúa aparentemente como barrera de permeabilidad previniendo la pérdida de cristal violeta. Durante el procedimiento las bacterias se tiñen primero con cristal violeta y luego se tratan con ioduro para promover la retención del colorante. En las Gram positivas, el decolorante encoge los poros de la gruesa capa de peptidoglucano, de forma que el complejo cristal violeta- ioduro es retenido durante la decoloración y las bacterias permanecen púrpura. En cambio el peptidoglucano de las Gram negativas es muy delgado, con menor número de puentes peptídicos y tiene poros de mayor tamaño que las Gram positivas. El tratamiento con decolorante también puede extraer suficientes lípidos de la membrana externa de la pared Gram negativa e incrementar aún más la porosidad de la pared. Por estas razones la solución decolorante remueve más fácilmente el complejo colorante- mordiente a partir de las bacterias Gram negativas.
completo el complejo CV-I, produciendo que los organismos gram-negativos aparezcan como Gram positivos.
2. Es necesario que los extendidos se laven con agua entre las aplicaciones de los reactivos. Esto remueve el exceso de los mismos y prepara al extendido para el próximo paso de coloración.
3. Las mejores preparaciones de Gram se obtienen a partir de cultivos frescos, es decir, a partir de cultivos que no exceden las 48 horas de incubación. Cuando los cultivos son viejos, especialmente si se trata de bacterias Gram positivas, los microorganismos tienen la tendencia de perder su capacidad de retener el colorante primario y pueden aparecer como Gram variables, esto quiere decir que bajo el microscopio algunas células aparecerán púrpuras y otras rosadas o rojas.
PROCEDIMIENTO
1. Limpiar adecuadamente los portaobjetos en los cuales se realizarán los extendidos.
2. Mediante técnica estéril, preparar extendidos de cada uno de los microorganismos en forma separada.
3. Preparar un extendido que consista en una mezcla de una bacteria Gram positiva y Gram negativa, esto se realiza colocando una gota de agua sobre el portaobjetos y luego transferir una ansada de cada uno a la gota de agua. Mezclar y expandir el inóculo con movimientos circulares del ansa.
4. Secar los extendidos al aire y fijarlos por calor.
5. En la batea de coloración, cubrir el extendido con cristal violeta durante 1 minuto. 6. Lavar con agua, recordando que el chorro de la misma debe correr en forma
paralela a la superficie del extendido.
7. Cubrir el extendido con solución lugol durante 1 minuto. 8. Lavar nuevamente con agua.
9. Decolorar con la solución etanol/acetona. 10. Lavar con agua.
11. Cubrir con safranina durante 45 segundos. 12. Dejar secar el extendido al aire.
13. Examinar en el microscopio con objetivo de inmersión.
OBSERVACIONES Y RESULTADOS
1. Dibujar las observaciones realizadas, indicando la amplificación total utilizada. Describir las observaciones de acuerdo a la morfología y disposición de las células. 2. Describir el color observado en cada caso.
3. Clasificar los microorganismos observados en Gram positivos y Gram negativos.
Escherichia coli
Morfología celular:
Forma
Arreglo celular
Color
Reacción de Gram
2) TINCION DE BACTERIAS (bacilos) ACIDO ALCOHOL RESISTENTES (BAAR)
TECNICA ZIEHL-NEELSEN
La mayoría de las bacterias se colorean por tinción simple o por tinción de Gram, pero
existen algunas especies de los géneros Mycobacterium y Nocardia que son
resistentes a estas coloraciones y pueden teñirse calentándolos con carbolfucsina. El calentamiento permite la entrada del colorante dentro de las células. Una vez que las mismas han tomado la carbolfucsina, resisten la decoloración aún aplicando una mezcla de ácido-alcohol como agente decolorante. Como consecuencia de esta propiedad, estos organismos se clasifican como ácido-alcohol resistentes y se visualizan de color rojo, en tanto que si el colorante puede ser extraído por el decolorante, los microorganismos se clasifican como acido-alcohol no resistentes y utilizando esta técnica aparecerán celestes debido a la contracoloración con azul de metileno. Esta diferencia característica entre las micobacterias y los otros microorganismos se debe al alto contenido lipídico de la pared celular de las primeras, en la que el peptidoglucano está unido mediante enlaces covalentes a un polímero de ácido micólico- galactosa- arabinosa.
M.tuberculosis y M. leprae representan bacterias que son patogénicas para los humanos, esta técnica es de vital importancia para el diagnóstico y la identificación de estos organismos.
COLORANTE PRIMARIO: CARBOL FUCSINA: La carbol fucsina es un colorante fenólico que es soluble en la cera de las paredes de las micobacterias, por lo tanto puede penetrarlas y permanecer retenida en ellas. La penetración de este colorante es intensificada mediante tratamiento con calor. Todas las células aparecerán rojas.
AGENTE DECOLORANTE: ACIDO-ALCOHOL (HCl 3%-Etanol 95%): Antes de la decoloración el extendido debe enfriarse, esto permite que la cera solidifique. Una vez aplicado el agente decolorante, las células ácido-alcohol resistentes resisten la decoloración, debido a que el colorante primario es más soluble en la cera de la pared que en el agente decolorante. Por lo tanto el colorante primario será retenido y las micobacterias permanecerán rojas.
Este no será el caso con los organismos ácido-alcohol no resistentes los cuales carecen de la pared de cera. El colorante primario será fácilmente removido y las células quedarán incoloras.
CONTRACOLORANTE:
PROCEDIMIENTO
1) Limpiar adecuadamente los portaobjetos en los cuales se realizaran los extendidos.
2) Mediante técnica estéril, preparar extendidos de cada uno de los microorganismos en forma separada.
3) Secar al aire y fijar por calor.
4) Cubrir el extendido con carbol fucsina e incubar bajo calor durante 5 minutos. Precaución: Se debe evitar que el colorante se evapore, agregar más si es necesario. También se debe evitar que el colorante hierva. Esto se logra controlando la temperatura de calentamiento.
5) Lavar el extendido con agua. Enfriar el extendido.
6) Decolorar con ácido-alcohol. Este reactivo se agrega gota a gota hasta que los restos de carbol fucsina desaparezcan del extendido.
7) Lavar con agua.
8) Cubrir el extendido con azul de metileno durante 2 minutos. 9) Lavar con agua.
10) Secar al aire y observar al microscopio bajo objetivo de inmersión.
TINCIONES ESPECIALES
Este tipo de procedimientos se utiliza para poner en evidencia algunas estructuras subcelulares. La mayoría de las técnicas utilizan más de un colorante en forma secuencial.
a) Técnicas para tinción de esporas
TÉCNICA SCHAEFFER-FULTON
COLORANTE PRIMARIO:
VERDE DE MALAQUITA: Las cubiertas de las esporas no aceptarán fácilmente el colorante primario. Para que este pueda penetrar, es necesario aplicar calor. Luego de cubrir con el colorante primario, se debe calentar el extendido, tanto las células vegetativas como las esporas aparecerán de color verde.
AGENTE DECOLORANTE:
AGUA: Una vez que las esporas aceptan el colorante verde de malaquita, no podrán ser decoloradas con agua. Las esporas permanecerán verdes. Por otro lado, el colorante no muestra una alta afinidad por los componentes de las células vegetativas, el agua lo remueve y las células quedarán incoloras.
CONTRACOLORANTE:
SAFRANINA: Este colorante se utiliza como contraste para teñir las células vegetativas incoloras, éstas absorben el colorante y aparecerán rojas. Las esporas retendrán el color verde del colorante primario.
PROCEDIMIENTO
2. Mediante técnica estéril, preparar extendidos de cada uno de los microorganismos en forma separada.
3. Secar los extendidos al aire y fijarlos por calor. 4. Cubrir el extendido con papel de filtro
5. Cubrir cada extendido con verde de malaquita e incubar en calor durante 2 a 3 minutos. Precaución: No se debe evaporar el colorante. Se debe evitar que el colorante hierva.
6. Enfriar los extendidos, lavar cuidadosamente con agua. 7. Cubrir cada extendido con safranina durante 30 segundos. 8. Lavar cuidadosamente con agua.
8. Secar al aire y examinar al microscopio bajo objetivo de inmersión.
TÉCNICA de DORNER
Esta es una técnica muy similar a la anterior y los principios teóricos son los mismos. En este caso se utiliza carbol fucsina como colorante primario, agua como decolorante y nigrosina como contracolorante.
Las esporas se verán de color rojo, el resto de la bacteria incolora, sobre un fondo negro.
PROCEDIMIENTO
1. Limpiar adecuadamente los portaobjetos en los cuales se realizarán los extendidos.
2. Preparar una suspensión del cultivo a examinar en 1 ml de agua destilada. 3. Añadir 1 ml de carbol fucsina.
4. Colocar en baño de agua hirviendo durante 10 minutos. 5. Colocar una ansada de la suspensión sobre el portaobjetos. 6. Colocar una ansada de nigrosina. Mezclar y extender. 7. Dejar secar el extendido al aire.
8. Observar al microscopio bajo objetivo de inmersión.
b) Técnica de Anthony para tinción de cápsula:
La composición química de la cápsula así como su grosor, varía de acuerdo a la especie bacteriana. Por lo general, están compuestas de polisacáridos, polipéptidos y glicoproteínas. La presencia de cápsula se relaciona con la virulencia de la cepa bacteriana, ya que esta estructura protege al microorganismo de la actividad fagocítica de las células del huésped.
PROCEDIMIENTO
1. Limpiar adecuadamente los portaobjetos en los cuales se realizarán los
extendidos.
2. Transferir una ansada de cultivo al portaobjetos, dejar secar al aire. NO FIJAR
POR CALOR
3. Colocar cristal violeta durante 4- 7 min. 4. lavar con sulfato de cobre al 20 %. 5. Dejar secar el extendido al aire.
6. Observar al microscopio bajo objetivo de inmersión.
1. Dibujar a escala las observaciones realizadas. Indicando la amplificación total utilizada.
2. Describir el aspecto y la localización de la cápsula
Diagrama de un campo representativo
Morfología celular:
Forma
Arreglo celular
Color
Reacción de Gram
TINCIÓN CON COLORANTE NARANJA DE ACRIDINA
El colorante Naranja de Acridina es altamente carcinogénico porque se intercala en el ADN y además tiene afinidad por las cadenas de ARN mensajero. Esta propiedad se usa para determinar si una bacteria u otro organismo están metabólicamente activos o no. La producción de ARN mensajero que posteriormente se convertirá en proteínas es una medida de que el microorganismo presenta un metabolismo activo por tanto se deduce que está vivo. Si por el contrario la cantidad de ARNm es baja el colorante se une mayoritariamente al ADN dando una coloración verde lo que quiere decir que está muerto o se encuentra en un estado fisiológico metabólicamete inactivo. Al unirse al ARNm da una coloración naranja.
PROTOCOLO
1. Las bacterias se lavan por centrifugación con un buffer fosfato 1M.
2. Se coloca una alícuota de 25µl de buffer fosfato 1M en un microtubo que contiene la muestra y se adiciona una alícuota igual de Naranja de acridina 0,025 %.
3. Se incuba por 10 minutos a temperatura ambiente.
4. Se colocan 10µl sobre un porta objeto se cubre con un cubre objetos y se observa en fresco bajo microscopio de fluorescencia con luz UV.
OBSERVACIONES Y RESULTADOS
UNIVERSIDAD NACIONAL DE QUILMES
Departamento de Ciencia y Tecnología
MICROBIOLOGÍA GENERAL
Trabajo Práctico Nº4: Técnicas para cultivo de micro organismos
Objetivos:
El alumno deberá familiarizarse con:
1. El equipamiento de laboratorio y los medios de cultivo necesarios para obtener y mantener cultivos puros.
2. El manejo de material estéril y el procedimiento necesario para obtener subcultivos de microorganismos.
3. El aislamiento de microorganismos a partir de una muestra mixta.
4. Las características morfológicas de los microorganismos crecidos en cultivos puros.
Subcultivo: técnica aséptica
a) Flamear el ansa de inoculación.
b) Quitar las tapas a los tubos y flamear la boca de los mismos.
c) Enfriar el ansa y sumergirla en el caldo a fin de tomar las bacterias. Con este inóculo, estriar la superficie de un agar inclinado; colocar las bacterias sobre un portaobjetos, distribuirlas sobre una placa de Petri o transferirlas a otro tubo con medio líquido.
d) Flamear nuevamente la boca de los tubos e) Taparlos.
Microbiología General
En la naturaleza los microorganismos existen como poblaciones mixtas. A pesar de esto, nuestro conocimiento en microbiología se ha llevado a cabo estudiando especies aisladas, las cuales se cultivan en ambientes libres de contaminación por otras formas de vida.
Los microorganismos necesitan nutrientes adecuados y un medio ambiente favorable. El medio de cultivo debe contener los nutrientes esenciales para el crecimiento microbiano y se deben aportar las condiciones óptimas para el mismo (pH, presión osmótica y oxigenación).
Si consideramos la gran cantidad de sustratos que los microorganismos pueden metabolizar, tendremos una idea de la variedad de sustancias que se pueden utilizar como medios de cultivo.
Ya que la mayoría de los estudios de laboratorio deben llevarse a cabo con cultivos puros o axénicos, debemos ser capaces de esterilizar medios y mantenerlos en dicha condición
y de inocular un medio estéril con un cultivo sin contaminarlo (técnica aséptica).
Debido a que los microorganismos están siempre presentes en el aire y en las superficies de los instrumentos, equipamiento y mesadas del laboratorio, pueden servir como fuente de contaminación externa e interferir con los resultados experimentales, a menos que se utilicen las técnicas apropiadas durante la manipulación del material estéril.
Para la obtención de un cultivo, se transfiere un determinado número de células (inóculo)
a un medio estéril. En el procedimiento de inoculación el ansa en anillo o en punta debe ser esterilizada al rojo mediante flameo en la llama del mechero, inmediatamente antes y después de la transferencia del inóculo. Este procedimiento destruye los microorganismos de la superficie de estos instrumentos. Se debe calentar completamente el ansa, y la porción inferior del mango de la misma, sobre la llama oxidante del mechero.
Las bocas de los frascos y tubos que contienen medio o cultivos de microorganismos deberán flamearse inmediatamente después de abrirlos y antes de cerrarlos. Frascos y tubos no deben permanecer abiertos más de lo necesario y, mientras estén abiertos, siempre deben mantenerse cerca de la llama del mechero.
Además de destruir los microorganismos que se encuentran en la boca de los frascos y tubos, la llama del mechero crea corrientes de convección hacia afuera que disminuyen la chance de contaminación.
Después de la inoculación, el cultivo se incuba en un ambiente adecuado, en condiciones
apropiadas para el crecimiento. Se entiende por crecimiento al desarrollo de una
población de células a partir de unas pocas (crecimiento de la población por
reproducción). La masa de células hijas se vuelve visible como turbidez en medio líquido
o como una población aislada (colonia) en el medio sólido.
Se entiende por colonia a un gran número de células bacterianas que crecen sobre la superficie de un medio sólido y que resultan visibles al ojo desnudo como una entidad discreta. Se asume que una colonia deriva de una sola célula y por lo tanto representa un clon de la misma, constituyendo una fuente de cultivo puro.
Una forma fácil de preparar medios sólidos es mediante el agregado de un agente solidificante a un caldo, el cual se endurecerá al enfriarse. El agente que se utiliza
comúnmente es el agar-agar. Este compuesto se obtiene a partir de determinadas
Microbiología General
esterilización. Es de fácil manejo en el laboratorio y aunque los diferentes tipos comerciales tienen distintas propiedades físicas según el método de purificación utilizado, el agar comúnmente funde entre 97ºC-100ºC. Durante el enfriamiento, se solidifica entre 40ºC-42ºC. Por lo tanto, se pueden incubar microorganismos en un amplio intervalo de temperaturas, sin riesgo que el medio se licúe. Usualmente se utiliza en una concentración de 1,5% -1,8% que otorga al medio la dureza suficiente como para impedir un crecimiento confluente.
Otro agente solidificante que puede utilizarse para fines específicos es la gelatina (colágeno hidrolizado) en concentraciones de 12%-15%, pero ésta se licúa a temperaturas superiores a los 25ºC y muchas bacterias la hidrolizan, utilizándola como fuente de nutrientes (aminoácidos).
La sílica gel se utiliza como agente solidificante en cultivos de microorganismos autótrofos, para los cuales la materia orgánica debe ser excluida del medio. Este sólo sirve como medio de soporte para el crecimiento de los microorganismos.
Comúnmente se utilizan dos tipos de medios de cultivo:
a) Medios definidos: Se preparan adicionando cantidades precisas de los distintos componentes orgánicos e inorgánicos de alta pureza. En estos medios, se conoce la concentración de c/u de los componentes, variando la composición de los mismos en función del microorganismo a aislar.
b) Medios complejos: Contienen los ingredientes necesarios para el crecimiento de la mayoría de los microorganismos, aunque no se conocen todos los componentes del medio ni sus cantidades exactas; muchos son productos de digestión ácida o enzimática de tejidos vegetales, carne, caseína, levaduras, etc. que proporcionan aminoácidos, vitaminas y minerales. En estos compuestos también están presentes algunos glúcidos, aunque en muchos casos se suplementa los medios con algún azúcar en particular.
Los extractos más utilizados en los caldos nutritivos son los siguientes:
Extracto de carne: Preparado a partir de carne desprovista de tendones y grasa, que se somete a una ligera proteólisis. Este extracto constituye una base de alto valor nutritivo.
Extracto de levadura: Se obtiene por extracción acuosa de levadura de cerveza
autolisada. Por su elevado contenido en vitaminas ofrece excelentes condiciones de
crecimiento.
Peptona de carne: Se obtiene por degradación proteolítica de carne mediante tripsina o pepsina.
Peptona de caseína: Se obtiene por la degradación proteolítica de caseína mediante tripsina. Por su elevado contenido de triptofano es adecuada para los medios de cultivo destinados para el ensayo de indol.
TRANSFERENCIA DE MICROORGANISMOS EN FORMA ASEPTICA (Subcultivo)
Microbiología General
El ansa de inoculación debe esterilizarse flameándola en el mechero. Una vez realizado
este paso, NUNCA SE DEBE APOYAR EL ANSA SOBRE LA MESADA, ésta debe
mantenerse cerca de la llama para permitir que se enfríe.
Si la transferencia se realizara a partir de un stock de microorganismos que se encuentra en tubos, los pasos a seguir son:
1. Desajustar las tapas sin abrir los tubos.
2. El tubo con el cultivo y el tubo que será inoculado deberán sostenerse con la palma de la mano que no sostiene el ansa. Ambos tubos se mantendrán separados en forma de V (ver figura).
3. Destapar los tubos tomando las tapas entre los dedos meñique y medio. Evitar que los bordes de las tapas toquen las manos.
4. Removidas las tapas, mantenerlas siempre en la mano que sostiene el ansa. JAMÁS
DEBEN APOYARSE LAS TAPAS SOBRE LA MESADA.
5. Flamear los cuellos de los tubos.
6. Enfriar el ansa estéril tocando la pared interna del tubo, antes de tomar el inóculo. 7. Dependiendo del medio de cultivo se utilizará un ansa en punta o en anillo. El ansa en
anillo se utiliza para tomar una muestra de cultivo proveniente de un medio líquido. Se pueden utilizar cualquiera de las dos para la obtención del inóculo proveniente de un agar recto o inclinado, tocando cuidadosamente la superficie del medio sólido. El ansa en punta se utiliza para transferir microorganismos a un agar recto, por punción profunda, provenga el inóculo de un medio sólido o líquido.
El ansa se introduce dentro del tubo a inocular:
• En el caso de un medio líquido, el ansa se agita para resuspender los
microorganismos que contiene el anillo;
• En un agar recto, el ansa en punta se introduce en línea recta (punción), sin llegar
a tocar el fondo del tubo, y se retira siguiendo la línea de inserción.
• En un agar inclinado (pico de flauta), se siembra sobre la superficie, deslizando
suavemente el ansa en zigzag.
8. Después de la inoculación, se flamean los cuellos de los tubos y se colocan las tapas en el mismo orden en que se removieron.
9. El ansa se flamea, nuevamente, para la destrucción de los microorganismos remanentes.
CULTIVO EN CALDO
Una forma simple de obtener un cultivo de bacterias, es hacerlas crecer en un medio líquido.
El crecimiento bacteriano en caldo se puede visualizar de diferentes formas: a) Turbidez: Se visualiza como una opalescencia.
b) Formación de película: Una pequeña masa de células flota en la parte superior del medio.
c) Sedimento: Un depósito de células descansa en la parte inferior del medio, pero se puede resuspender si se agita cuidadosamente.
Microbiología General
Si hay gas disuelto en el caldo, aparecerán burbujas cuando éste se agite o al introducir el ansa. Otra forma de detectar producción de gas es colocar un pequeño tubo de vidrio, en forma invertida, dentro del caldo. El gas se observará como una burbuja dentro del tubo invertido. Este método se utiliza generalmente cuando se llevan a cabo pruebas de fermentación de hidratos de carbono, para comprobar la producción de gas.
Procedimiento
1. Rotule con una etiqueta dos tubos estériles y dos frascos de penicilina, sin retirar la tapa.
2. Agregue, a cada tubo, 5 ml de caldo nutritivo y 10 ml a los frascos de penicilina, con pipeta estéril y en condiciones de asepsia.
3. Inocule cada tubo o frasco con un cultivo puro que se le suministrará al inicio del práctico.
4. Incube los tubos y frascos a 37ºC, durante 24-48 hs.
5. Examine los cultivos en caldo buscando evidencias de crecimiento. Observe si existe formación de película o sedimento antes de agitar el tubo o frasco. Algunas células pesadas, como levaduras, sedimentan completamente dejando la parte superior del caldo prácticamente estéril, por ello y como precaución de rutina durante las transferencias, hay que asegurarse que el inóculo esté en suspensión.
AGAR INCLINADO
Un agar inclinado también llamado agar en pico de flauta, es un tubo con medio agarizado que se coloca en ángulo para enfriarse. De esta forma endurece con una superficie fácilmente inoculable con un ansa, en la que es posible cultivar microorganismos aeróbicos y anaeróbicos facultativos.
Los tubos con agar (inclinado o recto) son formas comunes de mantener un stock de cultivos.
Los tubos con agar recto resultan ventajosos cuando se necesitan condiciones anaeróbicas o de microaerofilia.
Procedimiento
1. Fundir el Agar Nutritivo a Baño María.
2. Agregar Agar Nutritivo fundido a dos tubos estériles y enfriarlos en posición inclinada.
3. Cuando el medio esté sólido, inocular la superficie de un tubo con Escherichia coli
utilizando un ansa, moviéndola en zigzag desde la parte inferior del tubo hacia la
superior. Inocular la superficie del segundo tubo con Micrococcus luteus.
4. Incubar los tubos a 37 ºC durante 24-48hs.
5. Examinar y describir el tipo de crecimiento desarrollado en la superficie del agar. (ver figura)
SIEMBRA EN PROFUNDIDAD EN AGAR BLANDO (TOP AGAR)
Esta técnica es útil para visualizar movilidad microbiana. Se utiliza Agar Nutritivo, pero en concentración de 0,6%.
Microbiología General
1. Fundir el Agar Nutritivo 0,6% a Baño María.
2. Agregar aproximadamente 10 ml de medio fundido a cada uno de los tubos y dejar enfriar en posición vertical.
3. Una vez solidificado el medio, flamear el ansa en punta, tomar con ella el cultivo e introducirla en línea recta (punción) sin llegar a tocar el fondo del tubo, luego retirarla siguiendo la línea de inserción.
4. Cerrar el tubo y flamear nuevamente el ansa. 6. Incubar los tubos a 37ºC durante 24-48hs. 7. Examinar y describir el tipo de crecimiento.
TECNICAS PARA AISLAMIENTO DE CULTIVOS PUROS
Los cultivos puros deben contener una única especie de microorganismo. De esta manera son adecuados para el estudio de sus propiedades morfológicas y bioquímicas.
AISLAMIENTO DE COLONIAS
La técnica requiere una reducción del número de microorganismos en el inóculo inicial. La disminución del tamaño de la población asegura que, después de la inoculación, las células individuales estén suficientemente separadas entre sí, en la superficie del agar, como para obtener el aislamiento de las diferentes especies presentes.
9 Agotamiento por estría en placa:
Técnica de dilución en superficie que implica esparcir el inóculo, con un ansa, sobre la superficie de una placa con medio sólido.
Existen varios procedimientos. En particular realizaremos las estrías en cuadrante (ver figura).
1. Flamear y enfriar el ansa. Colocar una ansada del cultivo en la superficie del agar (área 1), dispersar rápida y suavemente el inóculo sin arar el agar. Cerrar la placa. 2. Flamear y enfriar nuevamente el ansa, rotar la caja de petri 90º. Tocar con el ansa 2 o
3 veces un extremo del área 1 y hacer varias estrías a través del área 2. En ningún momento el ansa deberá tocar nuevamente el área 1.
3. Flamear y enfriar nuevamente el ansa y rotar la caja de petri 90º. Repetir el procedimiento anterior estriando el área 3.
4. Rápidamente, sin cerrar la caja, y sin volver a flamear el ansa, girar la caja de petri 90º y realizar la última estría (área 4), en forma abierta. Evitar que el ansa toque cualquiera de las áreas previamente estriadas.
5. Rotular la base de cada placa de petri con rotulador indeleble, indicando: medio de cultivo, microorganismo inoculado, fecha y nombre.
6. Incubar en estufa a 30ºC-37ºC durante 24-48 hs.
7. Una vez obtenidas las colonias observar la morfología de las mismas y describirlas. El flameo del ansa, en los puntos indicados, es para efectuar la dilución del cultivo a fin que unos pocos microorganismos se encuentren estriados en cada área.
9 Siembra con Espátula de Drigalsky:
Microbiología General
por la llama para esterilizarla. Una vez fría, esparcir uniformemente el inóculo sobre el agar, con movimientos rotatorios, hasta que se absorba completamente el líquido. 2. Cerrar la placa y volver la espátula al recipiente con alcohol.
3. Incubar en estufa a 30ºC-37ºC durante 24-48 hs.
4. Una vez obtenidas las colonias, observar la morfología de las mismas y describirlas.
Técnicas de diluciones seriadas. Recuento de viables en placa.
Considerando que una colonia bacteriana se desarrolla a partir de una única célula, la técnica de recuento de viables en placa permite determinar el número de bacterias o UFC (unidades formadoras de colonia) presentes originalmente en una muestra a analizar. Para asegurar un recuento exitoso, el numero de colonias no debe ser mayor a 250, ya que las colonias están demasiado cercanas una de otra como para distinguirlas claramente, ni menor a 25 colonias por razones estadísticas. Con el objeto de garantizar una cantidad aceptable de colonias se hacen diluciones seriadas de la muestra, y una alícuota de las diluciones se siembra en placas con medio de cultivo sólido. La posterior incubación de las mismas permitirá el desarrollo de colonias que puedan contarse.
La técnica que utilizaremos implica esparcir el inóculo sobre la superficie del agar con ayuda de la espátula de Drigalsky.
PROCEDIMIENTO:
1. Rotular los tubos de ensayos estériles desde 10-1 hasta 10-6.
2. Rotular la placas con agar nutritivo con el valor de la última dilución que se siembra (considerar el factor de dilución aportado por la alícuota que se toma de la última dilución).
3. Medir la DO a 600 nm de una alícuota del cultivo (considerar que una DO de 0,1
equivale aproximadamente 5.107 UFC/ml para los cultivos de E. coli). Estimar la
concentración del cultivo inicial. Considerar que el volumen de la cubeta es 1 ml. Utilizar una cubeta con medio de cultivo sin inóculo como blanco.
4. Realizar los cálculos para las diluciones seriadas las cuales permitan a partir de la
siembra de 100 μl de la última dilución obtener entre 30 a 300 colonias.
5. Realizar las diluciones seriadas según los cálculos.
6. Sembrar 100 μl de la última dilución por duplicado.
7. Incubar a 37ºC durante 24 – 48 horas.
8. Contar las colonias y realizar los cálculos necesarios para obtener la concentración bacteriana en la muestra original.
PRESERVACION DE CULTIVOS MICROBIANOS
Los cultivos microbianos pueden preservarse para evitar la necesidad de subcultivarlos periódicamente. Los principales métodos utilizan congelación o desecación.
La preservación a corto plazo se puede lograr mediante un número variado de técnicas las que dependerán de la especie de microorganismo que se desea preservar.
Los microorganismos aerobios pueden mantenerse durante un par de meses en agar inclinado refrigerado.
Algunos anaerobios facultativos, para los cuales el oxígeno puede resultar perjudicial, son preservados en agar recto refrigerado. Para eliminar el oxígeno y evitar evaporación se aplica una capa de aceite mineral o vaselina estériles sobre la superficie del agar, una vez inoculado.
Microbiología General
deben repicarse periódicamente. Además, los cultivos refrigerados durante largos períodos pueden mutar.
La conservación de las bacterias a largo plazo se puede lograr por congelación o deshidratación. La mayoría de los cultivos sobreviven bastante bien si son congelados en una mezcla 1:20 con glicerol estéril, manteniendo la temperatura a –20ºC o -80ºC. También se pueden conservar dentro de viales sellados, manteniéndolos desde -100ºC a –200ºC en nitrógeno líquido.
Uno de los métodos más utilizados para conservar a largo plazo es la técnica de congelación-desecación llamada liofilización.
El cultivo se resuspende en alguna sustancia que lo proteja (por ejemplo, una solución de glucosa al 30% en caldo nutritivo y suero comercial de caballo o bien, leche estéril fortificada con sacarosa al 5%), dentro de un vial o tubo de vidrio; se congela rápidamente con una mezcla de hielo seco-alcohol, se deseca por evaporación bajo vacío, y finalmente se sella el vial.
Los cultivos procesados de esta forma pueden conservarse durante años. Un alto porcentaje de la población microbiana sobrevive a la liofilización, por lo cual prácticamente no existe selección de variantes genéticas más resistentes. La elevada tasa de supervivencia, comparada con los otros métodos de preservación, asegura la estabilidad y homogeneidad genética de la población microbiana.
ATCC (American Type Culture Collection) posee un gran número de microorganismos y
virus que se encuentran comercialmente disponibles en forma liofilizada.
American Type Culture Collection: 12301 Parklawn Drive, Rockville, Maryland 20852 USA.
1
3 2
4
Microbiología General UNIVERSIDAD NACIONAL DE QUILMES
Departamento de Ciencia y Tecnología
MICROBIOLOGÍA GENERAL
Trabajo Práctico Nº5: Actividades bioquímicas utilizadas para identificación de microorganismos
Objetivos:
Que los alumnos se familiaricen con las técnicas bioquímicas básicas para la identificación de microorganismos y que desarrollen el criterio que les permita seleccionar los ensayos adecuados para la caracterización de un microorganismo determinado.
Introducción:
El estudio de las interrelaciones de los microorganismos y su medio ambiente bajo determinadas condiciones físicas, químicas y biológicas, se llama ecología microbiana y su objetivo práctico es lograr un conocimiento tal que contribuya al control de especies patógenas en medicina, a mejorar el rendimiento de las reacciones fermentativas y a mejorar y aumentar la producción en la industria alimenticia.
Para determinar que microorganismos viven en un hábitat dado, cada especie presente debe ser aislada en un cultivo puro para su posterior identificación.
Esta tarea puede ser simplificada probando características particulares como requerimientos nutricionales o de temperatura, productos metabólicos, etc.
Los microbiólogos han encontrado ventajoso imponer combinaciones particulares de condiciones ambientales en muestras con flora mixta, con el objetivo de favorecer el desarrollo de un microorganismo sobre sus competidores. Por ejemplo: ajustar el pH del medio alrededor de 4 previene el crecimiento de la mayoría de las bacterias, promoviendo el de levaduras y mohos. Excluir el oxígeno del medio ambiente, impide el desarrollo de
los aerobios estrictos. Si tanto oxígeno como nitrógeno son excluidos (pero el gas N2 está
presente) sólo desarrollará los anaerobios fijadores de N2.
El número de combinaciones de condiciones selectivas es muy grande, sin embargo, más de un tipo de microorganismo puede crecer en cualquier medio selectivo, por lo que para asegurar cultivos puros, frecuentemente se estría un medio sólido con un inoculo procedente de un medio líquido de enriquecimiento.
Una o dos transferencias del cultivo a través de un medio líquido eliminan la mayoría de los microorganismos competidores, capaces de sobrevivir algunas generaciones con los nutrientes que estaban presentes en la muestra original.
La transferencia de cultivo en desarrollo a un segundo frasco de medio selectivo diluye los nutrientes contaminantes.
Como regla general, los medios selectivos y los de enriquecimiento deben aproximarse a los requerimientos nutricionales mínimos de una especie. De esta forma se puede limitar y definir el tipo de desarrollo más precisamente que si se incluyen sustancias orgánicas complejas que estimulen el crecimiento de una población heterogénea.
Como mencionamos antes, las razones para separar e identificar microorganismos son variadas:
1. Determinación de los patógenos responsables de las enfermedades infecciosas. 2. Selección y aislamiento de cepas de microorganismos fermentativos necesarios para
Microbiología General
3. Aislamiento y desarrollo de cepas adecuadas para el mejoramiento de la industria de ciertos alimentos como yoghurt, queso, etc.
4. Comparación de actividades bioquímicas con propósitos taxonómicos.
Los esquemas de identificación de bacterias están basados en una variedad de características que incluyen: morfología, fisiología, patogenicidad, serología e información molecular.
Uno de los primeros pasos en la identificación es la tinción diferencial. Una de ellas es la tinción de Gram (ya vista). Otra es la de Ziehl-Nielsen (ácido-alcohol resistente), la que se utiliza para un grupo más limitado de microorganismos (los pertenecientes a los géneros Mycobacterium y Nocardia).
La apariencia de los cultivos en los medios de laboratorio (forma de las colonias y pigmentación) es una herramienta taxonómica valiosa. También lo es la capacidad de un microorganismo de utilizar ciertas sustancias (sustratos) para producir cambios y productos químicos que pueden ser testeados o reconocidos.
Los test serológicos se utilizan principalmente en la identificación de especies o grupos
dentro de los géneros Streptococcus y Salmonella, evidencian las respuestas inmunes
que ocurren con el suero sanguíneo. Por ejemplo, el procedimiento denominado Prueba de Aglutinación, ensayos de ELISA y Western blot.
Es fundamental reconocer el hecho de que en condiciones naturales existe un equilibrio entre las células de una especie y su ambiente, tal que favorece la continuación de ésa dada especie en ése ambiente en particular. Esta suposición es la base de nuestro
esquema de identificación pues se asume que, a pesar de la gran variabilidad de
especies, ciertos microorganismos se encontraran en ciertos hábitats y que sus reacciones serán lo suficientemente consistentes como para permitir su identificación.
Cabe mencionar que una cepa vieja puede perder algunas de sus características
distintivas en el laboratorio; por ejemplo, los Streptococcus pierden la capacidad de
fermentar ciertos azúcares, las Pseudomonas la de producir pigmentos, las Salmonellas
su patogenicidad. Estos cambios hacen atípico al microorganismo e imposibilitan una descripción rígida. Con frecuencia también se aíslan microorganismos atípicos de ambientes naturales, pero esta variación entre individuos y poblaciones es la regla entre
las especies vivas. Así, aunque resulte conveniente usar para el diagnóstico ciertos
aspectos fácilmente reconocibles, éstos no son suficientes para una completa separación taxonómica.
Con este objetivo los microbiólogos comparan una gran cantidad de caracteres diferentes o similares.
El conjunto de todas las reacciones químicas es el metabolismo celular y las transformaciones bioquímicas que ocurren dentro y fuera de la célula están gobernadas por las enzimas. Las actividades enzimáticas son ampliamente utilizadas para identificar bacterias ya que mediante las pruebas bioquímicas se pueden separar en especies distintas que se encuentran muy relacionadas.
EXOENZIMAS (Enzimas extracelulares)
Actúan sobre sustancias fuera de la célula.
Microbiología General
generalmente son hidrolíticas, degradan las macromoléculas a sus bloques constituyentes de menor peso molecular.
ENDOENZIMAS (Enzimas intracelulares)
Funcionan dentro de la célula y son responsables de la síntesis de los constituyentes protoplasmáticos y la producción de energía a partir de las sustancias asimiladas.
Esta transformación es necesaria para la supervivencia celular y el funcionamiento constituyendo por lo tanto la base del metabolismo celular.
Como resultado del proceso metabólico, los productos son excretados hacia el medio extracelular, la determinación de estos productos permite la identificación de sistemas enzimáticos específicos así como la identificación y clasificación de microorganismos.
ENZIMAS EXTRACELULARES
1. ENSAYO DE HIDRÓLISIS DE ALMIDON
El almidón es un polímero de alto peso molecular compuesto de unidades repetidas de glucosa unidas entre sí por puentes glicosídicos. La degradación de esta macromolécula requiere primero la presencia de amilasa que lo hidroliza a polisacáridos más cortos llamados dextrinas y por último a moléculas de maltosa. La hidrólisis final de este disacárido, catalizada por la acción de la enzima maltasa, da moléculas de glucosa solubles que pueden ser transportadas dentro de la célula y por medio de la glucólisis producir energía.
En el ensayo se utiliza agar almidón para verificar la acción o no de la amilasa
El medio está compuesto de agar nutritivo suplementado con almidón como sustrato, la detección de la actividad hidrolítica, luego del periodo de crecimiento, se determina verificando la ausencia o presencia del sustrato en el medio.
El almidón en presencia de iodo imparte una coloración azul indicando la ausencia de amilasa (resultado negativo). Si el mismo ha sido hidrolizado, se verá una zona clara alrededor de las colonias (resultado positivo).
2. ENSAYO DE HIDROLISIS DE LIPIDOS
Los lípidos son componentes de alto peso molecular. La degradación de éstos se lleva a cabo por enzimas extracelulares (las lipasas), que clivan los puentes éster adicionando una molécula de agua para formar glicerol y ácidos grasos.
Una vez asimilados dentro de la célula, estos componentes pueden ser metabolizados para producir energía o ingresar a diferentes vías metabólicas para la síntesis de diversos componentes citoplasmáticos.
Experimentalmente, para demostrar la actividad hidrolítica de las lipasas, se utiliza un agar tributirina. Este es un agar nutritivo suplementado con el triglicérido tributirina el cual sirve de sustrato. El mismo forma una emulsión que opalece el medio. Luego de la inoculación e incubación mostrará áreas claras alrededor de las colonias (lipólisis positiva) si el microorganismo es capaz de secretar lipasas.
3. ENSAYO DE HIDROLISIS DE CASEINA
Microbiología General
enzimas extracelulares (proteasas). De esta forma, los aminoácidos solubles de bajo peso molecular, pueden ser incorporados y utilizados por los microorganismos para la síntesis de diferentes proteínas.
Experimentalmente, para demostrar la actividad hidrolítica de las proteasas, se utiliza agar-milk. Este es un agar nutritivo suplementado con leche en polvo que contiene el sustrato caseína. Este medio resulta ser opaco, que luego de la inoculación e incubación mostrará áreas claras alrededor de las colonias (proteólisis positiva) si el microorganismo es capaz de secretar proteasas.
4. ENSAYO DE HIDROLISIS DE GELATINA
La gelatina es una proteína producida por la hidrólisis del colágeno, un componente importante del tejido conectivo y tendones en los animales. Por debajo de los 25ºC la gelatina se mantiene sólida. Por encima de dicha temperatura, se licúa.
La licuefacción es llevada a cabo por algunos microorganismos capaces de producir gelatinasas (enzimas que hidrolizan a la gelatina a aminoácidos), una vez que ha ocurrido esta degradación, no se restablece la solidificación aún a 4ºC.
Experimentalmente, se utiliza agar –gelatina.
Este es un caldo nutritivo suplementado con gelatina al 12% la cual sirve como sustrato a la vez que opalece y solidifica el medio.
Luego de la inoculación e incubación durante 48 horas, los cultivos se colocan en baño de hielo durante 40 minutos, los cultivos que permanecen líquidos demuestran actividad gelatinasa positiva.
ENZIMAS INTRACELULARES
1. DEGRADACION DE HIDRATOS DE CARBONO
Los microorganismos degradan hidratos de carbono de diferentes formas, dependiendo de las enzimas con que cuentan. Algunos son capaces de fermentar azúcares, como la glucosa, mientras que otros sólo usan la vía aeróbica. Los anaerobios facultativos son enzimáticamente competentes para usar ambas vías (aeróbica y anaeróbica). Finalmente existen microorganismos que carecen de la capacidad de oxidar glucosa por cualquier vía.
De esta forma, la capacidad, o falta de ella, de un organismo para degradar un azúcar simple, una combinación de azúcares o algún otro carbohidrato, proporciona información para la clasificación de las especies bacterianas.
En el proceso fermentativo, los hidratos de carbono sufren degradación anaeróbica con producción de ácidos orgánicos (láctico, fórmico o acético) que puede ir acompañada por la producción de gases tales como hidrógeno o dióxido de carbono.
La degradación de la glucosa por fermentación ocurre mediante la vía Embden-Meyerhof o también conocida como la vía glicolítica. En esta vía un mol de glucosa es convertido en dos moles de piruvato, el cual es el principal intermediario de esta vía de degradación. Posteriormente la degradación final del piruvato dependerá del tipo de microorganismo. La variedad de los productos finales resultantes definen las diferentes capacidades fermentativas del microorganismo.
Si se incluye un indicador de pH en el medio de crecimiento, se puede detectar fácilmente la formación de ácidos. Los indicadores más utilizados son el Rojo fenol, que vira al
Microbiología General
La producción de gas puede detectarse mediante la aparición de burbujas en un vial invertido (campana de Durham) si el microorganismo se encuentra en un medio líquido, o por rupturas del agar si éste se encuentra en medio sólido.
Los microorganismos oxidativos, los cuales son incapaces de fermentar los hidratos de carbono, forman ácido sólo en la superficie del agar, bajo condiciones aeróbicas.
El ensayo de OXIDO/FERMENTACION se lleva a cabo inoculando dos tubos de agar OF, el cual contiene un determinado azúcar y un indicador de pH. Uno de los dos tubos se cubre con una fina capa de vaselina estéril. Después de la incubación, los cultivos fermentadores producirán el viraje del indicador al amarillo en ambos tubos, mientras que los cultivos oxidativos, sólo en los primeros milímetros de la superficie del agar que no está completamente cubierto por la vaselina.
La incapacidad de fermentar u oxidar un hidrato de carbono no significa que no exista crecimiento. El microorganismo puede utilizar, como fuente de energía, otros nutrientes del medio, por ejemplo las peptonas. Estas son degradadas a aminoácidos, los cuales posteriormente sufrirán un proceso de desaminación oxidativa que les permitirá proporcionar el esqueleto carbonado para su ingreso en el Ciclo de Krebs y participar en la producción de energía. Estas reacciones liberan amoníaco, el cual se acumula en el medio aumentando el pH del mismo. Cuando esto ocurre, el indicador rojo fenol vira al rojo.
2. ENSAYO HIERRO -TRIPLE AZUCAR (TSI)
Básicamente este ensayo se utiliza para discriminar entre miembros de Enterobacteriaceae y de otros bacilos intestinales Gram negativos.
La diferenciación se fundamenta en las diferencias en los patrones de fermentación de carbohidratos y la producción de sulfuro de hidrógeno que presentan los diferentes grupos de microorganismos intestinales.
Para facilitar la observación de los patrones de utilización de carbohidratos, comúnmente se utilizan agar TSI inclinado los cuales contienen lactosa y sacarosa al 1% y glucosa al 0,1%, para la detección de la utilización de estos sustratos.
Como indicador de pH se utiliza rojo fenol el cual permite detectar la fermentación de carbohidratos mediante el viraje de rojo-naranja a amarillo en presencia de ácidos.
El agar inclinado se inocula en profundidad con un ansa recto sólo en la superficie recta, en tanto que sobre la superficie inclinada se siembra en zigzag. Luego del periodo de incubación, se determinan las actividades fermentativas de los microorganismos de la siguiente forma:
1. Agar inclinado alcalino (rojo) y superficie recta ácida (amarilla) con o sin producción de gas (ruptura o no del agar): Unicamente fermenta glucosa. El microorganismo primero degrada la glucosa. Debido que este sustrato se encuentra en una concentración mínima, la pequeña cantidad de ácido producido en la superficie del agar es oxidada rápidamente. Las peptonas del medio también son utilizadas en la producción de álcali. En la porción recta del agar, la reacción ácida se mantiene debido a que en esta región la tensión del oxígeno es reducida.
Microbiología General
alcalina se encuentra presente tanto en la superficie inclinada como en la superficie recta.
3. Agar inclinado ácido (amarillo) y superficie recta ácida (amarilla) con y sin producción de gas: En este caso puede ocurrir la fermentación de la lactosa o de la sacarosa o de ambas. Debido a que estas sustancias se encuentran en mayor concentración, sirven de sustrato para las actividades fermentativas en forma continua durante el periodo de incubación lo cual se evidencia por el mantenimiento de la acidez del medio en ambas superficies.
Para la obtención de resultados precisos es importante observar los cultivos dentro de las 18 a las 24 horas de incubación. Esto es para asegurarse que el microorganismo utilizó por completo los carbohidratos como sustrato y luego comience a utilizar las peptonas teniendo lugar al final del periodo la producción de amoníaco.
El agar TSI contiene tiosulfato de hierro, éste se utiliza como sustrato para la producción de sulfuro de hidrógeno, y sulfato ferroso.
Después de la incubación, únicamente los cultivos que son capaces de producir sulfuro de hidrógeno producirán un precipitado oscuro, sulfuro ferroso, que se forma por la reacción entre el sulfuro de hidrógeno y el sulfato ferroso presente en el medio.
Para la diferenciación de los bacilos intestinales de acuerdo con las reacciones en agar TSI ver la figura correspondiente.
3 ENSAYO I M V i C
La identificación de los bacilos entéricos es de vital importancia para controlar las infecciones intestinales producidas por contaminación alimenticia o aguas servidas.
Los grupos de bacterias que se pueden encontrar en el tracto intestinal de los humanos y
mamíferos inferiores se clasifican como miembros de la familia Enterobacteriaceae, los
cuales son bacilos cortos, gramnegativos, no formadores de esporas y fermentadores de glucosa. Los miembros más comunes de esta familia son:
1. Patógenos: Miembros de los géneros Salmonella y Shigella.
2. Patógenos ocasionales: Miembros de los géneros Proteus y Klebsiella.
3. Flora intestinal normal: Miembros del género Escherichia y Enterobacter, los cuales
son habitantes saprófitos del tracto intestinal.
Los organismos entéricos además pueden subdividirse en fermentadores de lactosa y no fermentadores de lactosa. (Ver gráfico correspondiente).
Para la diferenciación de los principales grupos de Enterobacteriaceae comúnmente se
utilizan las propiedades bioquímicas y las reacciones enzimáticas en presencia de ciertos
sustratos. Uno de los ensayos más utilizados es el I M V i C el cual incluye los siguientes
test: Indol –Rojo de Metilo, Voges-Proskauer y la utilización de Citrato (Citrato Simmons).
a) TEST DE PRODUCCION DE INDOL