ESTUDIO PRELIMINAR DE LA OBTENCION Y EVALUACION DE LOS COMPONENTES DE UN INMUNOENSAYO EN LA IDENTIFICACIÓN
DE Listeria monocytogenes EN GANADO BOVINO
DIANA CAROLINA DUQUE CASTRO CAROLINA VARÓN FLÓREZ
TRABAJO DE GRADO Presentado como requisito parcial
Para optar al título de
Microbióloga(s) Agrícola y Veterinario
Orlando Alfredo Torres. Director
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS BASICAS
CARRERA DE MICROBIOLOGIA AGRICOLA Y VETERINARIA Bogotá, D.C.
NOTA DE ADVERTENCIA
Artículo 23 de la Resolución N° 13 de Julio de 1946
ESTUDIO PRELIMINAR DE LA OBTENCION Y EVALUACION DE LOS COMPONENTES DE UN INMUNOENSAYO EN LA IDENTIFICACIÓN
DE Listeria monocytogenes EN GANADO BOVINO
DIANA CAROLINA DUQUE CASTRO CAROLINA VARÓN FLÓREZ
APROBADO
________________________ Orlando Alfredo Torres García
Medico Veterinario, M.Sc. Director
________________________ ________________________ Martín Alonso Bayona, M.Sc. Gustavo Arbelaez, Mv, Phd.
ESTUDIO PRELIMINAR DE LA OBTENCION Y EVALUACION DE LOS COMPONENTES DE UN INMUNOENSAYO EN LA IDENTIFICACIÓN
DE Listeria monocytogenes EN GANADO BOVINO
DIANA CAROLINA DUQUE CASTRO CAROLINA VARÓN FLÓREZ
APROBADO
“DEDICAMOS ESTE PROYECTO ESPECIALMENTE A
NUESTROS PADRES QUE NOS BRINDARON SU CARIÑO Y
ESFUERZO INCONDICIONAL PARA CULMINAR NUESTROS
ESTUDIOS PROFESIONALES, A NUESTRA FAMILIA Y A
TODAS AQUELLAS PERSONAS QUE CON SU APOYO Y
DEDICACIÓN, ESTUVIERON A NUESTRO LADO PARA
HACER POSIBLE ESTE PROYECTO”
MIL GRACIAS…
AGRADECIMIENTOS
En primer lugar agradecemos a Dios por darnos esta oportunidad en nuestra vida y habernos premiado con tan hermosas familias, que con su constante apoyo, esfuerzo y dedicación nos permitieron alcanzar las metas propuestas.
Al Dr. Orlando Alfredo Torres, por confiar plenamente en nuestros conocimientos y que con su paciencia e incondicional ayuda nos dio las bases necesarias para sacar adelante este proyecto.
A nuestros amigos quienes con su humor y amistad, alegraron este camino a veces tan difícil.
A la Dra. Sofía Duque del laboratorio de Parasitología del Instituto Nacional de Salud, al laboratorio de Alimentos y Parasitología de la Universidad Javeriana, por el préstamo de equipos para desarrollar este proyecto.
Al Dr. Jairo Oviedo Medico Veterinario, por sus tan valiosos contactos.
A la Fundación del Instituto de Inmunología de Colombia del Dr. Manuel Elkin Patarroyo, por facilitarnos algunos de los reactivos para este propósito.
TABLA DE CONTENIDOS
1. Introducción 1
2. Marco Teórico 2
2.1. Historia 2
2.2. Listeriosis en Animales 3
2.3. Estructura Celular Bacteriana 5
2.4. Taxonomía de Listeria sp. 7
2.5. Caracteres descriptivos de Listeria monocytogenes 8
2.5.1. Morfología 8
2.5.2. Características del Crecimiento 8 2.5.3. Pruebas Bioquímicas para su identificación 10
2.5.4. Patogenia 11
2.5.5. Patogenicidad 12
2.5.6. Aspectos Inmunológicos 13
2.5.7. Aspectos Moleculares 14
2.5.8. Proteínas asociadas al proceso infeccioso 15
2.5.8.1. Internalinas 15
2.5.8.1.1. Internalina A (InlA) 17 2.5.8.1.2. Internalina B (InlB) 17
2.5.8.2. ActA 18
2.5.8.3. p60 19
2.6. Antecedentes en estudios serológicos y dificultades en el diagnóstico de Listeria monocytogenes 20 2.7. Caracteres Descriptivos de Staphylococcus aureus 23
2.7.1. Morfología 23
2.7.2. Características de Crecimiento 23 2.7.3. Pruebas bioquímicas para su identificación 23
2.7.4. Patogenia 24
2.8. Caracteres Descriptivos de Streptococcus pyogenes 27
2.8.1. Morfología 27
2.8.2. Características de Crecimiento 27 2.8.3. Pruebas bioquímicas para su identificación 28
2.8.4. Patogenia 29
2.8.5. Aspectos Moleculares 29 2.8.5.1. Proteína M de los Streptococcus 30 2.9. Antígenos estructurales pertenecientes a L.
monocytogenes, S. pyogenes y Staphylococcus
aureus que presentan reacción cruzada 31
2.9.1. Toxinas Thiol activadas 33 2.10. Métodos para el Análisis de Proteínas 34 2.10.1. Extracción de Proteínas 34 2.11. Cuantificación de la concentración de proteínas por el
método de Bradford 35
2.11.1. Fundamento 35
2.12. Caracterización de Proteínas 36
2.12.1. Electroforesis 36
2.12.2. Electroforesis en geles de poliacrilamida 37
2.12.3. SDS-PAGE 38
3. Planteamiento del problema y Justificación 39 3.1. Planteamiento del problema 39
3.2. Justificación 41
4. Objetivos 43
4.1. Objetivo General 43
4.2. Objetivos específicos 43
5. Materiales y Métodos 44
5.1. Muestra 44
5.1.1. Listeria monocytogenes 44 5.1.2. Staphylococcus aureus 44 5.1.3. Streptococcus pyogenes 45
5.2.1. Escalamiento para obtener Biomasa de Listeria
monocytogenes 46
5.2.1.1. Preinóculo 46
5.2.1.2. Inoculo 46
5.2.2. Escalamiento para obtener Biomasa de Streptococcus
pyogenes y Staphylococcus aureus 47
5.3. Recuperación de la Biomasa por el Método de Filtración 47 5.4. Preparación del Buffer de ruptura 48
5.5. Criofractura 48
5.6. Sonicación 49
5.7. Cuantificación de la concentración de proteínas 50 5.7.1. Preparación del reactivo de Bradford 51 5.7.2. Procedimiento del ensayo de Bradford 51
5.8. Electroforesis 51
5.9. Proceso de inmunización del cobayo 54 5.10. Purificación de IgG por el método de diálisis 56
6. Resultados y Discusión 58
6.1. Resultado de la estandarización del cultivo para optima
cantidad de biomasa de microorganismos 58 6.2. Resultado de la concentración de biomasa por filtración 60 6.3. Resultados del protocolo de estandarización de la
criofractura 60
6.4. Resultados de la determinación de las proteínas
totales por el método de Bradford 63 6.5. Resultados de la comparación electroforética de las
proteínas de las bacterias post-ruptura (L.
monocytogenes, S. aureus y S. pyogenes) 64
7. Conclusiones 73
8. Recomendaciones 74
9. Referencias Bibliográficas 75
INDICE DE FIGURAS
Figura 1. Pared celular Gram-positiva y Gram-negativa 6 Figura 2. Proceso infeccioso Listeria monocytogenes 14 Figura 3. Estructura del Azul de Coomassie 35 Figura 4. Espectros de Absorbancia del Azul de Coomassie 36 Figura 5. Cepa de Listeria monocytogenes 44 Figura 6. Cepa de Staphylococcus aureus 45 Figura 7. Cepa de Streptococcus pyogenes 45 Figura 8. Escalamiento para la obtención de biomasa 46 Figura 9. Reactivos del Buffer de Ruptura 48 Figura 10. Sonicador del Instituto Nacional de Salud 49 Figura 11. Proceso de sonicación 50 Figura 12. Disposición de las muestras en el Gel de
Poliacrilamida para la posterior electroforesis 52 Figura 13. Cámara de Electroforesis Hoefer Pharmacia
Biotech 53
Figura 14. Tinción del gel con Azul de Coomassie y
posterior distinción 54
Figura 15. Inoculación del cobayo hembra con L.
monocytogenes inactivada 55
Figura 16. Proceso de dialisado del suero 56 Figura 17. IgG de cobayo anti-Listeria 57 Figura 18. Coloración de Gram: Listeria monocytogenes
(Bacilos Gram (+)) 58
Figura 19. Coloración de Gram: Staphylococcus aureus
(Cocos Gram (+)) 58
Figura 20. Coloración de Gram: Streptococcus pyogenes
(Cocos Gram (+) en cadenas) 59
Figura 21. Corrido electroforético demostrando bandas
Figura 22. Gel con escasez de bandas debido al Buffer
de ruptura 63
Figura 23. Concentración de proteínas totales por el
método de Bradford 64
Figura 24. Comparación de los geles en cuanto a la
concentración de las muestras 65 Figura 25. Resultado final del Electroferograma en donde se presentan las proteínas post-ruprura de las
bacterias 66
Figura 26. Gel teñido con plata evidenciando bandas
INDICE DE TABLAS
RESUMEN
Existen varios métodos diagnóstico que permiten la identificación de Listeria monocytogenes, entre ellos se encuentran métodos bacteriológicos que son importantes para su aislamiento, además estos métodos son sensibles y no muy costosos; sin embargo este procedimiento microbiológico rutinario es algo dispendioso, retardando la identificación del microorganismo en estudio.
Las pruebas serológicas utilizadas actualmente son de altos costos, además las investigaciones se han limitado a efectuar tan solo aislamientos de este patógeno en busca de sus características bioquímicas mas no se ha profundizado acerca de su estructura molecular. Adicionalmente, estas pruebas por mucho tiempo han sido algo inestables con carencia de especificidad y sensibilidad, además se han evidenciado reacciones cruzadas con otros microorganismos gram positivos que puede convertirse en una dificultad a la hora de desarrollar un diagnóstico.
Esto nos lleva a plantear el desarrollo de un estudio preliminar de la obtención y evaluación de los componentes de un Inmunoensayo, con la preparación de proteínas de Listeria monocytogenes, proporcionando una serie de herramientas y estandarización de técnicas inicialmente, con el objeto de ejecutar a largo plazo su diagnóstico a bajos costos, proporcionando una alternativa para establecer eficazmente prevalencias en estudios epidemiológicos.
resultados indican que puede existir al menos una proteína para ser utilizada como blanco diagnóstico en futuras investigaciones.
ABSTRACT
There are various methods that permits the identification of Listeria
monocytogenes, among them, there are appropriate bacteriological
methods that allow their isolation, in addition, these methods are sensitive and non expensive, however, this standard microbiological procedure is some laborious, making time consuming the identification of the microorganism under consideration.
The serological test used at the moment are of high costs, the investigations have also been limited to make so single isolations of this pathogenic in search of their biochemical characteristics but it has not been deepened about their molecular structure. Additionally, these tests for a lot of time have been something unstable with lack of specificity and sensibility, crossed reactions have also been evidenced with other microorganisms gram positive that it can become a difficulty when developing a diagnosis.
This takes us to outline the development of a preliminary study of the obtaining and evaluation of the components of an Immunoassay, with the preparation of proteins of Listeria monocytogenes, providing a series of tools and standardization initially of technical, in order to executing long term their diagnosis at low costs, providing an alternative to establish prevails efficiently in epidemic studies.
The results indicate that it can exist a protein at least to be used as diagnostic target in future investigations.
1. INTRODUCCIÓN
Las bacterias pertenecientes al género Listeria son bacilos gram-positivos
cortos, regulares, no esporulados, ni ramificados, que suelen observarse
en disposición individual o formando cadenas cortas. Las especies de
Listeria están muy extendidas en el medio ambiente; se han aislado del
suelo, materia vegetal en putrefacción, aguas residuales, comida animal,
pollo fresco y congelado, alimentos frescos y procesados, queso, leche no
procesada, desechos de los mataderos, así como en el tracto digestivo de
humanos y animales asintomáticos; además esta bacteria se ha aislado
de variadas especies de mamíferos, aves, peces, crustáceos e insectos.
El diagnóstico que se lleva a cabo para identificar Listeria spp. por
métodos bacteriológicos son importantes ya que se puede obtener un
cultivo puro del organismo, además estos métodos son sensibles y no
requieren equipos sofisticados y caros; sin embargo algunas de las
desventajas de este grupo de métodos incluye el prolongado tiempo que
se requiere en el procedimiento, alta manipulación de las muestras, el
requerimiento de diferentes químicos, reactivos y medios, la posibilidad de
contaminación con otros microorganismos, incluyendo el
sobrecrecimiento, la observación potencial de variantes atípicas del
organismo blanco y la subjetividad relativa involucrada cuando se
interpreta el crecimiento bacteriano en medios selectivos o diferenciales;
además, este procedimiento microbiológico rutinario es algo dispendioso,
retardando la identificación del microorganismo en estudio.
Por esta razón el presente trabajo pretende desarrollar un estudio
preliminar de la obtención y evaluación de los componentes de un
inmunoensayo en la identificación de Listeria monocytogenes en ganado
bovino que permita un acercamiento a la identificación de esta como
2. MARCO TEÓRICO
2.1. HISTORIA
La primera descripción publicada de Listera monocytogenes, la cual fue
rápidamente referenciada, fue descrita por Murray et. al en 1926; este
observó seis casos de muerte repentina de conejos jóvenes en 1924, en
el establecimiento de crianza animal del Departamento de Patología de la
Universidad de Cambridge y tales casos ocurrieron en los siguientes
quince meses. Las características más interesantes se presentaron por la
enfermedad y el incremento de la mortalidad provocada en una
investigación (Ryser & Marth, 1999).
Según Ryser & Marth (1999), existen algunos agentes patogénicos
responsables de brotes los cuales han marcado la historia de humanos
por siglos, por ejemplo, Vibrio cholerae o Yersinia pestis; pero la historia
de Listeria monocytogenes y Listeriosis es reciente: esto comenzó
inicialmente en 1924. El primer diagnóstico confirmado en un humano fue
de un soldado que sufrió de meningitis al final de la primera guerra
mundial y después de este caso no se validaron observaciones.
En 1927 Pirie, Sudafricano, observó que un germen era la causa de una
infección generalizada conocida con el nombre de “Enfermedad del río
Tiger”, en la que se producen necrosis focales del hígado (Merchat &
Packer, 1975).
Al no encontrarse ninguna especie similar al hallado por él, ni un genero
adecuado en que clasificarlo propuso la creación de un nuevo agente en
honor a Lord Lister por lo que lo llamo “Listerella hepatolytica”; después
de varios descubrimientos, Murray y Pirie enviaron sus cepas a la
Leningham, junto con los otros dos decidieron llamar a esta bacteria
“Listerella monocytogenes” (Murray, 1963; Pirie, 1940).
Sin embargo en 1939, la Comisión Judicial del Comité Internacional en
Bacteriología Sistemática rechazo el nombre genérico “Listerella”;
después de varios años numerosos nombres fueron usados para designar
Listeria monocytogenes: “Bacterium monocytogenes hominis” y después
“Listerella hominis” por Nyfedt, entre otros (Ryser & Marth, 1999).
Listeria monocytogenes fue reconocido como patógeno humando por
primera vez en 1929 y desde 1983 es considerado como un
microorganismo oportunista que causa infecciones alimentarías,
principalmente por la ingestión de alimentos crudos. En Colombia desde
1993 se han reportado casos de Listeriosis en neonatos y es cada vez
más frecuente esta infección en pacientes inmunosuprimidos, por lo cual
hace pensar que la Listeriosis debe considerarse una infección de
consideración en nuestro país (Vanegas et.al, 2003).
2.2. LISTERIOSIS EN ANIMALES
Lo reportado por Low y Donachie (1997), demuestra que la Listeriosis es
de gran importancia veterinaria, y las manifestaciones clínicas primarias
en ganado son aborto, encefalitis y mastitis; además es una enfermedad
infecciosa que afecta a las personas y se encuentra cada vez con mayor
frecuencia; las manifestaciones patológicas engendradas por este
microorganismo son muy diversas y se presentan ya sean como
infecciones generalizadas septicémicas y localizadas e inaparentes
(Daguet et. al, 1977).
Listeria monocytogenes, un patógeno intracelular facultativo, es
responsable de infecciones graves de alimentos en humanos y puede
incluyendo rumiantes de granja (ovejas, ganado vacuno y cabras)
(Nightingale, et al, 2004).
Según Hirsh & Zee (1999), los rumiantes son los animales domésticos
que son atacados con mayor frecuencia. Las principales formas de
listeriosis son la septicemia, la meningoencefalitis y el aborto. En los
ovinos la manifestación habitual de las infecciones por L. Ivanovii es el
aborto. La listeriosis se presenta en todo el mundo, en especial en los
climas templados.
Mientras los animales infectados y ambientes agrícolas contaminados
parecen causar rara vez las infecciones humanas directamente, según lo
dicho por Nightingale (2004), los productos de comida animal -derivados
que no son procesados antes de consumo (leche cruda)- y las comidas
crudas del origen de planta que han sido contaminadas por estiércol de
animales infectados o mudar de pelo representan enlaces directos entre
las infecciones humanas y L. monocytogenes en animales y ambientes de
la granja. Por ejemplo, en 1981 un brote que involucraba 42 casos de
listeriosis humana en Nueva Escocia fue vinculado con el consumo de
ensalada de col. Esta ensalada había sido fabricada de col cosechada de
campos fecundados con estiércol de ovejas sin tratar que había sido
obtenido de una granja con una historia de listeriosis en ovinos.
En rumiantes, L. monocytogenes causa encefalitis e infecciones uterinas
principalmente. Las infecciones uterinas son caracterizadas por los
abortos o septicemia en neonatos. La forma encefalítica de listeriosis
animal es caracterizada por señales neurológicas, incluyendo salivación
excesiva, giros y parálisis facial unilateral (Low & Donachie, 1997;
Rebhum, 1995; Smith & Sherman, 1994). Además, L. monocytogenes
puede causar infecciones en ojos y queratitis en rumiantes; estos
síntomas han sido vinculados con la inoculación directa del ojo con L.
L. monocytogenes puede ser liberado de la materia fecal de animales
clínicamente afectados; sin embargo los animales sanos también pueden
tener latente a L. monocytogenes (Pell, 1997). Los estudios múltiples han
mostrado que hasta el 50% de muestras fecales coleccionadas de
animales sin síntomas clínicos de listeriosis (incluyendo ganado vacuno,
ovejas, cabras, cerdos y carne de ave) podrían contener L.
monocytogenes (Meng & Doyle, 1997).
2.3. ESTRUCTURA CELULAR BACTERIANA
La naturaleza química de la superficie celular bacteriana es importante en
la etiología de las enfermedades bacterianas, porque es esta superficie la
que interactúa realmente con la superficie de las células blanco y
fagocitos (Mayberry-Carson et.al, 1984).
La forma celular ha sido un criterio importante en la descripción y
clasificación de especies bacterianas. Según Cabeen y Jacobs-Wagner,
(2005), esto se refleja en la taxonomía de muchas especies que son
nombradas de acuerdo a la característica morfológica de cada una de
ellas como cocos en forma esférica, bacilos en forma de barra y
espiroqueta para su forma espiral; siendo estas formas permitidas gracias
a la pared celular bacteriana con su capa de Peptidoglicano la cual
mantiene la forma de la célula y la protege contra la presión osmótica.
La mayoría de las bacterias tienen una pared que mantiene su forma
celular y la protege contra la lisis osmótica. En lo descrito por Cabeen y
Jacobs-Wagner (2005), la fuerza y la rigidez conferida por la pared celular
resulta de la capa de Peptidoglicano, la cual es una estructura
macromolecular covalente de cadenas firmes de glicano que son
atravesadas por puentes peptídicos flexibles. El peptidogligano
comprende dos subunidades de polisacáridos, N-acetilglucosamina y
Hay dos clases generales de pared celular bacteriana, la primera se
distinguió por Hans Christian Gram basado en la diversa retención del
colorante cristal violeta. La pared celular Gram positiva, esta compuesta
por una gruesa multicapa de peptidoglicano que envuelve la membrana
citoplasmatica, con un espesor entre 20 y 80 nm, en donde el ácido
teicoico y el ácido lipoteico se extienden desde la capa de peptidoglicano
hasta la membrana citoplasmática (Figura 1a). La pared de las células
Gram negativas esta compuesta por una membrana externa ligada a una
única capa de peptidoglicano por finas lipoproteínas. El peptidoglicano se
localiza en el espacio peripalsmático que esta creado entre las
membranas interna y externa, la cual incluye poros que dejan pasar
moléculas hidrofílicas a través de la membrana y moléculas de
lipopolisacaridos que se extienden dentro del espacio extracelular (Figura
[image:23.595.206.415.378.610.2]1b) (Cabeen & Jacobs-Wagner, 2005).
Figura 1. Pared celular Gram-positiva y Gram-negativa
Teniendo en cuenta la composición de la pared celular, en este estudio se
utilizaron microorganismos (Listeria monocytogenes, Staphylococcus
aureus y Streptococcus pyogenes), identificados en el grupo de las
2.4. TAXONOMIA DE Listeria spp.
En los últimos años, la posición taxonómica de las especies de Listeria ha
sido objeto de mucho trabajo y debate. La novena y mas reciente edición
del Manual Bergey de Bacteriología Sistemática (Seeliger & Jones, 1986)
admite cinco especies claramente distinguibles (L. monocytogenes, L.
innocua, L. welshimeri, L. seeligeri y L. ivanovii) mientras que L.
denitrificans, L. grayi y L. murrayi se clasifican como especies insertae
sedis (de clasificación incierta) (Bell & Kyriakides, 1998).
Sin embargo, dos especies de este género son las únicas patógenas:
Listeria monocytogenes, asociada con infección en humanos y animales y
Listeria ivanovii, asociada únicamente con infección en animales (Seeliger
& Jones, 1986). Adicionalmente, el género Listeria pertenece a la
subdividsión de Clostridium junto con Staphylococcus, Lactobacillus y
Brochothrix (Rocourt & Cossart, 1997).
Aunque L. monocytogenes fue clasificada por un tiempo por el Manual de
Bergey´s de Bacteriología Determinativa en la familia
Corynebacteriaceae, se lista en la última edición de Bergey´s junto con
Lactobacillus, Erysipelothrix, Brochothrix, y otros géneros, en una sección
titulada Regular, Bacilos Gram positivos no esporulados. La taxonomía
intra e intergenérica de la bacteria de el género Listeria ha sido un
problema durante varios años. L. monocytogenes era la única especie
reconocida hasta 1961; L. denitrificans, L. grayi, y L. murrayi se
agregaron al género en 1961, 1966, y 1971, respectivamente (Rocourt,
1982; citación tomada de Farber & Peterkin, 1991). Todo los serovares de
las cinco cepas mostraron una B-hemólisis fuerte y se propusieron como
una especie separada, L. bulgarica, por Ivanov en 1975. Esta especie se
Las cepas no patogénicas de L. monocytogenes pertenecientes al serovar
6 fueron reconocidas como una nueva especie, L. innocua (Seeliger &
Jones, 1986). L. welshimeri y L. seeligeri fueron adicionadas en 1983. El
género se relaciona estrechamente al género Brochothrix; los dos de
estos géneros ocupan una posición entre Lactobacillus y Bacilos, y se
relaciona más a distancia al Estreptococo, Lactococcus, Enterococcus,
Staphylococcus.
2.5. CARACTERES DESCRIPTIVOS DE Listeria monocytogenes
2.5.1. Morfología
El género Listeria consiste en un grupo de bacterias de forma bacilar,
Gram positivas de bajo contenido de G+C relacionado a Bacillus,
Clostridium, Enterococcus, Streptococcus y Staphylococcus. Listeria spp.
son anaerobios facultativos de 0.4 por 1 a 1.5 µm , no forman esporas, no
tienen cápsula y son móviles de 10 a 25°C (Vázquez et. al, 2001;
Allerberger, 2003).
Se presenta aislado, en parejas en forma de V o paralelos, y en cortas
cadenas de tres a seis elementos. Griffin y Robbinns han demostrado
que Listeria monocytogenes tiene un máximo de cuatro flagelos perítricos,
cuando crece a la temperatura del laboratorio, pero cuando se
cultiva a 37° C pueden encontrarse formas aflageladas en su mayoría,
escaso porcentaje con un solo flagelo y muy pocas con dos o tres
(Merchant & Packer, 1975).
2.5.2. Características del Crecimiento
Los microorganismos del género Listeria según Hirsh & Zee (1999), son
anaerobios facultativos que crecen mejor en una atmósfera con tensión
de oxigeno y tensión de CO2 aumentada. Su crecimiento tiene lugar entre
de crecer a temperaturas de refrigeración, pero su crecimiento es lento a
esta temperatura (Juntilla et. al, 1998; Muñoz et. al, 1998; Allerberger,
2003). Crecen en los medios ordinarios del laboratorio, preferiblemente a
pH básico o neutro.
En otras publicaciones, se ha visto que la adición de Telurito potásico en
proporción de 0.05% al agar Triptosa es conveniente para el aislamiento
de Listeria monocytogenes, este compuesto químico inhibe el crecimiento
de la mayor parte de las bacterias Gram negativas. Las colonias de
Listeria son negras, con tono verdoso en la periferia, en agar sólido las
colonias son circulares, lisas y transparentes. A la luz reflejada son grises
y por luz oblicua se ven azul-verdes. En agar sangre se observan
pequeñas colonias rodeadas de una estrecha zona de hemólisis beta. En
caldo se produce un ligero enturbiamiento y un sedimento granular
bastante denso (Merchant & Packer, 1975).
En medio semisólido produce una forma de sombrilla típica pino invertido,
creciendo cerca de un centímetro y medio de la superficie porque es un
organismo naturalmente microaerofílico. Informes recientes indican que
L. monocytogenes y L. innocua difieren en la movilidad y producción de
flagelina a 37º C; en donde la primera es inmóvil y produce poca flagelina
mientras que la segunda se comporta de manera opuesta (Jorgensen et.
al, 1995; Kathariou et. al, 1990).
De acuerdo con Ryser & Marth (1999), los factores de crecimiento para
Listeria incluyen Cistina, Leucina, Isoleucina, Arginina, Metionina, Valina,
Cisteina, Riboflavina, Biotina, Tiamina y Acido Tióctico. El crecimiento es
estimulado por Fe+3 y Fenilalanina; la Glucosa y la Glutamina son
2.5.3. Pruebas Bioquímicas para su Identificación
Tabla No 1. Actividad Bioquímica de L. monocytogenes
PRUEBA RESULTADO
Requerimientos de oxígeno Facultativa y microaerofílica
β – hemólisis Positiva
Crecimiento a 35 °C Positiva
Catalasa Positiva
Oxida Negativa
RMVP Positivo
Citrato No utiliza
Indol No produce
H2S Negativa
Nitratos No reduce
Hidrólisis de urea Negativa
Hidrólisis de caseína Negativa
Hidrólisis de gelatina Negativa
Hidrólisis de celulosa Negativa
Hidrólisis de esculina Positiva
Hidrólisis de hipurato sódico Positiva
Fermentación de glucosa Positiva
Fenilalanina desaminasa, ornitasa,
lisina, arginina descarbixilasa
No produce
Movilidad Positiva de 20 – 25 °C y negativa a
37 °C
CAMP – S. aureus Positiva
CAMP – R. equi Negativa
Fosfatasa Positiva
[image:27.595.130.488.178.758.2]2.5.4. Patogenia
La listeriosis es una importante enfermedad producida por alimentos que
causa una considerable morbilidad y relativamente altas tasas de
mortalidad. Se estima que la infección de L. monocytogenes causa
aproximadamente 2.500 casos de enfermedades serias, tanto como 500
muertes por año en los Estados Unidos. Los factores de riesgo para
Listeriosis incluyen edad (> 65 años), mujeres embarazadas, virus
infeccioso de la inmunodeficiencia humana, terapia inmunosupresiva,
diabetes, enfermedades del riñón y cáncer (Notermans et. al, 1998).
Casos esporádicos de Listeriosis pueden ser causados por el serotipo de
Listeria monocytogenes 4b, ½ a, o ½ b; sin embargo epidemias humanas
de Listeriosis en los Estados Unidos y Europa son usualmente causadas
por el serotipo 4b, la razón para esta asociación no se conoce (Charles et.
al, 2002).
Adicionalmente la patofisiología de la infección de Listeria en humanos y
animales todavía es pobremente entendida. La mayoría de la información
disponible se deriva de la interpretación epidemiológica, clínica y de
observaciones histopatológicas realizadas en infecciones experimentales
en animales.
Como la comida contaminada es la fuente mayor de infección en brotes
epidémicos y casos esporádicos, el tracto gastrointestinal es el sitio
primario de entrada de los organismos patogénicos de Listeria dentro del
huésped. El curso clínico de la infección usualmente comienza cerca de
20 horas después de la ingestión de comida altamente contaminada en
casos de gastroenteritis, considerando que el período de incubación para
la invasión es generalmente de más tiempo, alrededor de 20 a 30 días;
períodos de incubación similares han sido reportados en animales para
gastroenteritis y enfermedad invasiva (Dijkstra, 1987; Gitter,1986;
Vázquez-Boland, 1996; citación tomada de la revisión de literatura de
2.5.5. Patogenicidad de Listeria monocytogenes
La heterogeneidad en la virulencia de L. monocytogenes ha sido
observada en varios estudios en vivo (ratón) e in Vitro (cultivos celulares),
pero en la mayoría de casos una correlación clara entre el nivel de
virulencia y el origen o tipo de características de la cepa puede no estar
establecida.
El mas claro ejemplo es proporcionado por el serovar 5 específico de L.
ivanovii, el cual se recupera casi exclusivamente de rumiantes,
especialmente en la oveja. En estos animales las cepas serovar 5 causan
infecciones perinatales pero no encefalitis, la manifestación clínica más
típica de la listeriosis ovina (Dennos, 1975). La evidencia viene del hecho
que sólo 3 de los 12 serovares conocidos de L. monocytogenes, 1/2a,
1/2b, y 4b, son considerados para más de 90% de humanos y casos
animales de listeriosis, aunque se encuentran a menudo otros serovares,
como 1/2c, como contaminantes de comida.
Entre los serovares asociados a la listeriosis, las cepas 4b causan
alrededor de 50% de casos de listeriosis en el mundo, pero las cepas de
grupos antigénicos 1/2 (1/2a, 1/2b, y 1/2c) predominan en aislamientos de
alimentos (Boerlin, 1991). Esto sugiere que las cepas del serovar 4b están
mas adaptadas a los tejidos mamarios del huésped que las cepas del
serogrupo 1/2.
Un número de observaciones sugiere que puede haber diferencias en el
tropismo patogénico entre las cepas de L. monocytogenes . En humanos,
por ejemplo el serovar 4b se ha encontrado que ocurre más
frecuentemente en casos fetomaternales que en casos no asociados al
embarazo. En ovejas, las dos formas clínicas principales de la infección
de L. monocytogenes es meningoencefalitis y aborto (Vázquez-Boland et.
Así un grupo de cepas (serovares 1/2by 4b) contenidas según Vázquez
(2001), son aisladas de humanos, epidemias de brotes en alimentos y
aislamientos de casos esporádicos en humanos y animales, otros
serovares (serovares 1/2a, 1/2c, y 3a) contienen cepas de ambos casos
animales y humanos pero no son aislados de epidemias de brotes
alimenticios en humanos, mientras un tercer grupo serovar (4a) contiene
solo aislamientos animales.
2.5.6. Aspectos Inmunológicos
En muchos estudios de biología celular en las infecciones de Listeria
monocytogenes se usan líneas celulares de macrófagos y epitelio. Los
macrófagos activamente ingieren Listeria monocytogenes, pero la
internalización de la bacteria por células no fagocíticas normalmente es
accionado por los productos específicos de la bacteria (Ryser & Marth,
1999).
Los mecanismos de patogenicidad no son comprendidos con claridad,
pero la infección depende de una variedad de factores que incluyen el
estado inmunitario del hospedador, la cantidad de inoculo y la virulencia
especifica de la cepa de Listeria monocytogenes (Rocourt, 1994).
Sin embargo Torres y colaboradores (2005), sugieren que la razón por la
que Listeria monocytogenes causa infección esta explicada en la
capacidad de inducir fagocitosis en células del sistema mononuclear
fagocítico, seguida de la replicación dentro de estos y la transferencia
directa a células vecinas.
El ciclo de vida intracelular de Listeria comienza cuando el patógeno
primero aparece dentro de una vacuola, el cual es posteriormente lisado
por la mayoría de las bacterias ingeridas permitiendo que Listeria
empieza a replicar allí, las células que permanecen en el fagosoma
mueren y son digeridas (Ryser & Marth, 1999).
Seguido del inicio de la replicación intracelular, descrito por Ryser y Marth
(1999), Listeria monocytogenes induce a la nucleación de filamentos de
actina en el huésped, el cual forma una nube alrededor de la célula
bacteriana. Los filamentos de actina luego son cambiados hacia un
extremo polar el cual consiste de un filamento corto de actina y proteínas,
las cuales estabilizan esta estructura. La formación de este extremo en
un polo de la célula bacteriana produce una fuerza propulsiva que mueve
[image:31.595.187.436.333.525.2]a Listeria por el citoplasma de la célula huésped.
Figura 2. Proceso infeccioso de L. monocytogenes
2.5.7. Aspectos Moleculares
Existen diferentes tipos de proteínas que actúan en los procesos de
invasión y adhesión en las células fagocíticas; la invasión por Listeria
monocytogenes es diferente, normalmente se da en los tipos de células
de mamíferos no fagocíticas, incluyendo fibroblastos humanos y murina,
células epiteliales, hepatocitos y células endoteliales humanas (Ryser &
El único mecanismo conocido que permite la unión covalente de las
proteínas de la superficie de la pared celular de bacterias Gram positivas
a la célula hospedero requiere de una secuencia motivo conservada
LPXTG (Leu – Pro – X – Thr – Gly, donde X es cualquier aminoácido)
seguida de un dominio hidrofóbico de 20 aminoácidos y una cola de
aminoácidos cargados positivamente (55 aa) (Cossart, 2000b; Dhar,
2000; Cabanes et. al, 2002; citación tomada de la revisión de literatura de
Torres et. al, 2005). En el genoma de Listeria monocytogenes se han
detectado 41 genes que codifican para las proteínas LPXTG (Gaillard,
1991).
Adicionalmente el patógeno bacteriano Listeria monocytogenes, explota la
maquinaria de las células huésped permitiendo al patógeno entrar dentro
de las células y extenderse de célula a célula. Tres proteínas de superficie
bacterianas son cruciales para este proceso: Internalina (lnlA) y lnlB, las
cuales median la entrada dentro de las células, y ActA, la cual induce la
polimerización de la actina en un polo de la bacteria y promueve la
movilidad intracelular e intercelular (Cossart & Bierne, 2001).
2.5.8. Proteínas asociadas al proceso infeccioso 2.5.8.1. Internalinas (InlA, InlC2, InlD to InlF)
Las internalinas son los productos de las proteínas de una familia de
genes asociados-virulencia encontrados en Listeria spp.. Los primeros
miembros de esta familia caracterizados son InlA y InlB, codificado por el
operón inlAB, los cuales fueron identificados en L. monocytogenes por un
Screaning en un banco de mutantes de transposones-inducidos. InlA
muestra una función como un invasor, mediando la internalización
bacteriana de las células epiteliales no fagocíticas (Gaillard et. al, 1991
Listeria monocytogenes es un patógeno invasivo intracelular que infecta
huéspedes animales desde el lumen intestinal. Una vez dentro del
huésped, esta bacteria invade células eucarióticas y se replica
intracelularmente, escapando de la respuesta inmune humoral. La
habilidad de L. monocytogenes de entrar en las células eucarióticas se
ha remontado a una familia de proteínas de superficie secretadas, las
internalinas. Se han encontrado siete miembros de la familia de las
internalinas (InlA a InlC, InlC2, y InlD a InlF) y todas se han encontrado
para compartir ciertos rasgos estructurales (Dramsi, 1997; Gaillard, 1997;
citación tomada de la revisión de literatura de Navarre, 1999). InlA, InlC2,
e InlD a InlF poseen una especie de pared celular (C-terminal) que ordena
las sucesiones; InlB es el blanco sobre la célula (Brawn, 1997); y InlC es
secretada (Doman et. al, 1997).
L. monocytogenes es capaz de penetrar o invadir varias líneas celulares,
y estudios genéticos llevan a la identificación de dos genes bacterianos
envueltos en la invasión de células no fagocíticas. Estos dos genes inlA y
inlB están organizados en un operón y codifican las proteínas de
superficie con considerables secuencias homólogas. El incremento de la
evidencia sugiere que lnlA y lnlB media la invasión en diferentes tipos de
células (Braun et al., 1998 ).
Así mismo, L. monocytogenes entra a las células mamarias induciendo su
propia fagocitosis. La proteína internalina de Listeria (lnlA) media la
adhesión bacteriana y la invasión de células epiteliales en el intestino a
través de interacciones específicas con el receptor E-caderina de la célula
huésped.
Teniendo en cuenta lo citado por Schubert (2002), L. monocytogenes
invade las células huésped para ganar acceso a un ambiente rico en
nutrientes mientras va evadiendo los mecanismos de defensa celular de
bacteria patogénica frecuentemente se aprovecha de mecanismos de
defensa (Pieters 2001 y Kahn et al. 2002). A través de interacciones
específicas con receptores de superficie.
2.5.8.1.1. Internalina A (InlA)
lnlA fue la primera molécula identificada permitiendo a L. monocytogenes
invadir células no fagocíticas tales como el epitelio intestinal (Gaillard et
al., 1991). lnlA es suficiente para la adhesión e induce a la captación
dentro de las células epiteliales. El blanco de las eucariotas es el receptor
de superficie E – caderina. Extracelularmente la E caderina asegura la
adherencia firme de las células epiteliales vecinas a través de
interacciones en las uniones de adherencia en su lado basolateral
(Uemura, 1998).
Es una proteína de superficie de Listeria requerida para la penetración al
interior de las células no fagocíticas (Nirvia et. al, 1999; Pandiripally et. al,
1999; Santiago et. al, 1999; citación tomada de Torres et. al, 2005). La
internalina A forma parte de la familia multigénica de internalinas junto con
las internalinas E, F, G y H las cuales son están involucradas en el
proceso invasivo de Listeria monocytogenes, pero son importantes para la
colonización del tejido del hospedero “in vivo” (Kajava, 1998;
Raffelsbauer, 1998; Schubert, 2001; citación tomada de Torres et. al,
2005).
2.5.8.1.2. Internalina B (InlB)
Es una proteína de 630 aminoácidos que contiene un peptido señal, una
región LRR constituida por una región cap N- terminal pequeña y una
región tubular extensa ligeramente curva constituida de motivos lamina b
seguidos de hélices, una región IR que simula una inmunoglobulina y una
región carboxiterminal (Jonquieres, 1999; Schubert, 2001; Bierne, 2002;
Cabanes et. al, 2002; Marino, 2002; citación tomada de Torres et. al,
epiteliales, fibroblastos, hepatocitos y endoteliales. La interacción entre la
InIB con la célula huésped no es completamente clara, pero se conoce
que intervienen moléculas de la superficie como lo son gC1q-R y el
receptor de la tirosin quinasa (Braun et al, 2000; Shen et al, 2000).
2.5.8.2. ActA
ActA es una proteína ácido-amino 639 que está anclado en la membrana
bacteriana por los ácidos amino carboxi-terminal 26. ActA tiene una masa
molecular calculada de 67 kDa, aunque esta migra en geles de
poliacrilamida dodecil sulfato de Sodio a 90 kDa (Kocks, 1992). La
expresión de la ActA es notablemente incrementada dentro de las células
mamarias.
Varias cepas constitutivamente sobrexpresadas de ActA han facilitado su
purificación y han sido usadas en ensayos de motilidad. ActA de células
infectadas con Listeria migran como tres polipéptidos distintos, como un
resultado de esta fosforilación durante el crecimiento celular (Brundage,
1993). La fosforilación parece ocurrir en los residuos dentro de la región
repetida rica en prolina.
La porción entera amino Terminal de la proteína madura, ácidos amino 30
a 263, es esencial para la polimerización de la actina en células
infectadas por Listeria. La eliminación de ácidos amino 50 a 60 lleva a la
pérdida de la habilidad de ensamblar filamentos de actina en células
mamarias infectadas (Lasa, 1995; citación tomada de la revisión de
literatura de Goldberg, 2001). Un fragmento que consiste en aminoácidos
de ActA 30 a 263 es suficiente para la motilidad en extractos
citoplasmáticos cuando se ha limitado artificialmente a la superficie
bacteriana.
Varios modelos indican que tan solo una proteína bacteriana simple es
eventos de polimerización responsables del movimiento intracelular; esta
proteína es ActA, el producto del gen actA (Vázquez et. al, 2001). El
papel central de ActA en la motilidad intracelular de Listeria y la virulencia
fue inicialmente revelada por el fenotipo inusual de un mutante isogenico
ActA de Listeria monocytogenes en tejidos infectados en cultivos celulares
(Kocks et. al, 1992).
Esta proteína de superficie es un factor importante de virulencia
primariamente envuelto en la motilidad basada en la actina, esto también
sugiere que juega un papel en la toma de la internalina-independiente de
L. monocytogenes en las células epiteliales ( Kuhn et. al, 1997).
2.5.8.3. p60
La p60 es la proteína más secretada de todos los aislamientos de L.
monocytogenes, pero esta también se encuentra en las superficies de la
misma bacteria. En contraste a otros factores de virulencia, p60 es
también una enzima metabólica esencial de L. monocytogenes puesto
que posee la actividad de la hidrolasa mureina la cual parece estar
involucrada en al último paso de la división celular (Ryser & Marth, 1999).
Esta proteína que esta asociada con la pared celular bacteriana es la
responsable de la invasión intestinal y la supervivencia “in vivo” de Listeria
monocytogenes (Hess et. al, 1996).
La proteína p60 tiene una actividad de hidrolasa - mureina requerida para
su formación normal y esencial para la viabilidad celular lo que hace
difícil de determinar el papel preciso de p60 en la virulencia porque las
mutaciones del iap son letales. Se ha mostrado recientemente que la p60
es un antígeno importante en la respuesta proteccionista contra L.
2.6. ANTECEDENTES EN ESTUDIOS SEROLÓGICOS Y DIFICULTADES EN EL DIAGNÓSTICO DE Listeria monocytogenes
La Listeriosis es una enfermedad muy conocida de animales,
particularmente de rumiantes en que es a menudo asociado con el
consumo de forraje conservado en silos de pobre calidad.
Así, los rumiantes y su ambiente pueden representar una fuente
importante de contaminación de comida e infecciones para los humanos.
La serología sería una herramienta útil para estudios epidemiológicos
apuntados a clarificar el papel del ganado en la epidemiología de la
listeriosis. Sin embargo, el uso de la serología para el estudio de listeriosis
se ha obstaculizado en el pasado por las actuaciones bastante pobres de
las pruebas disponibles (Bille et al, 1999; citación tomada de la revisión
bibliográfica de Boerlin et al, 2003).
Estudios epidemiológicos de enfermedades bacterianas requieren
métodos para diferenciar aislamientos mas allá de los niveles de especies
y subespecies. Una variedad de tipos de procedimientos han sido
aplicados en diferentes especies bacterianas. Distintos tipos de métodos
en curso incluyen serotipificación, modelos de fermentación
(biotipificación), modelos de resistencia a antibióticos, pirolisis de
espectofotometría de masas, análisis de ácidos grasos, tipos de fagos, y
electroforesis con enzimas (Wiedmann et al, 1996).
Además, existen métodos que diferencian cepas bacterianas en las bases
de las características de secuencias de los ácidos nucleicos los cuales
han sido también utilizados; ejemplos de estos incluyen tipificación de
plásmidos, análisis de restricción de enzimas, RAPD, PCR, entre otros,
los cuales proveen la identificación de las especies y el tipo. Aunque
varios de estos métodos han sido estudiados, la mayoría de ellos todavía
aislamientos y algunos están limitados a una sola especie (Wiedmann et
al, 1996; Allerberger, 2003).
Adicionalmente, según Bourry (1997), cuando Listeria monocytogenes es
detectada en algunas muestras sucesivas de leche en grandes
cantidades el examen bacteriológico de cada animal en la manada es
llevado a cabo para identificar al animal responsable de la contaminación;
los métodos bacteriológicos usados son costosos, consumen mucho
tiempo y las muestras deben ser tomadas asépticamente; Además estos
métodos pueden ser inapropiados por lo tanto algunas infecciones de
Listeria no pueden ser identificadas. Así mismo debido a que el nivel de
excreción de L. monocytogenes en leche es variable, con menos de 10
UFC/ml de leche en algunos casos, la identificación de animales
infectados por cultivo directo es difícil y por lo tanto sería necesario un
paso de enriquecimiento en el examen bacteriológico.
Los métodos microbiológicos tradicionales aún son el “Gold Standard”
para la identificación y detección rutinaria de Listeria. La utilidad de
métodos moleculares en esta área es obvia. Quizás, la característica más
atractiva es el aumento del tiempo en la identificación. Es posible que con
estos métodos se alcance la identificación apropiada de organismos en
una fracción de tiempo requerida por métodos tradicionales. Sin
embargo, la necesidad de obtener aislamientos viables como un
prerrequisito para buscar la fuente de la infección, asegurará la
sobrevivencia del tradicional método microbiológico (Allerberger, 2003).
Sin embargo, para el diagnóstico de Listeriosis, las pruebas serológicas
han sido por mucho tiempo herramientas inestables, con carencia de
sensibilidad así como especificidad. Además, una proporción alta de
reacciones falsas-positivas por las reacciones cruzadas antigénicas con
componentes de otros organismos gram-positivos se han observado
(Hudak, et al, 1984). La listeriosis es una enfermedad muy importante,
severamente restringidas por la naturaleza inespecífica y falta de
sensibilidad de las pruebas serológicas actualmente disponibles (Berche,
et al, 1990).
Además de algunas de estas limitaciones en el campo serológico y
microbiológico, Listeria monocytogenes como se mencionó anteriormente,
posee un importante factor de virulencia (Listeriolisina O), producida por
todas las cepas patogénicas de Listeria monocytogenes; LLO está, por lo
tanto, antigénicamente relacionado con otras toxinas Sulfidrilo- activadas
producidas por miembros del género Streptococcus, Bacillus, Clostridium
y Listeria (Christopher et al, 1992).
Es importante destacar, que en investigaciones de la patogénesis de
listeriosis se ha identificado muchos factores de virulencia específicos
para L monocytogenes que podrían servir como antígenos para nuevas
pruebas serológicas mejoradas. Recientemente la listeriolisina O (LLO)
un factor importante de virulencia producido por todas las cepas
patogénicas de listeria monocytogenes , ha sido identificado como un
antígeno candidato para llevar a cabo un ensayo serológico. Anticuerpos
de LLO mostraron ser indicadores fiables de infecciones experimentales
en estudios de inmunoblot (Low & Donachie, 1991). Por lo tanto a lo largo
de este estudio es de gran importancia destacar este factor de virulencia
(LLO) que posiblemente puede proporcionar una gran ayuda en el
diagnóstico de Listeria monocytogenes pues estudios revelan que puede
ser de gran ayuda en estudios epidemiológicos.
Adicionalmente los costos de estas pruebas, son bastantes elevados
permitiendo que tan solo exista un acceso restringido a esta clase de
procedimientos; por eso es necesario llevar a cabo un estudio preliminar
de la obtención y evaluación de los componentes de un inmunoensayo
para la identificación de Listeria monocytogenes en ganado bovino a
(Staphylococcus aureus, Streptococcus pyogenes), lo cual se propone a
lo largo de este estudio; la aceptación de un nuevo método solo será real
si las extensas pruebas y la validación demuestran que el método puede
ser suficientemente sensible, específico, de uso fácil y no demasiado
costoso (Beumer & Hazeleger,2003).
2.7. CARACTERES DESCRIPTIVOS DE Staphylococcus aureus
2.7.1. Morfología
Según Carter (1989), son cocos Gram positivos que se presentan en
parejas y en racimos; son aerobios y anaerobios facultativos, catalasa
positivos, oxidasa negativos, inmóviles, asporógenos y fermentativos.
2.7.2. Características de crecimiento
Las colonias son relativamente grandes, elevadas, puntiformes y opacas,
de consistencia cremosa a las 24 horas de incubación en un medio
primario. En ocasiones, las colonias de Staphylococcus en medios de
agar, se pueden confundir con la de algunos Streptococcus. La
diferenciación se lleva a cabo rápida y fácilmente mediante la prueba de
catalasa. Los Staphylococcus descomponen el peroxido de hidrógeno
(catalasas positivos, pero no los Streptococcus) (Koneman, 1989).
[image:40.595.107.517.598.743.2]2.7.3. Pruebas Bioquímicas para su Identificación
Tabla No 2. Actividad bioquímica de Staphylococcus aureus
PRUEBA RESULTADO
FAMILIA MICROCACEAE
TINCIÓN GRAM +
MOVILIDAD NEGATIVA
CATALASA POSITIVA
COAGULASA POSITIVA
HEMOLISIS B POSITIVA
PIGMENTO POSITIVO
MALTOSA A2 (REACCIONES VARIABLES)
PRODUCCIÓN DE ÁCIDO (PAB) (+ 90% DE LAS CEPAS POSITIVAS SON ACIDAS)
MANITOL ACIDO
DNasa POSITIVA
NOVOBIOSINA SUSCEPTIBLE
(Carter & Chengappa, 1994)
2.7.4. Patogenia
Staphylococcus aureus es una bacteria oportunista, patógeno,
responsable de diversas enfermedades animales y humanas. Este
microorganismo esta asociado con la colonización asintomática de las
superficie de mucosas y piel de humanos normales; sin embargo
Staphylococcus también causa infecciones en heridas y desarrolla un
potencial invasivo induciendo a la Osteomielitis, Endocarditis y
Bacteremia (Fattom et. al, 1996).
Teniendo en cuenta lo dicho por Hirsh y colaboradores (1999), el
mecanismo predominante en la filogenia de los Estafilococos es la
supuración y la formación de abscesos. Es posible que las especies que
poseen leucocitos sensibles la leucocidina sean un factor a tener en
cuenta en la patogenia, y que las actividades citotóxica y letal de la toxina
Varios constituyentes de la envoltura celular (cápsula, proteínas y
peptidoglicano) tienen propiedades antifagocitarias. Adhesinas no
identificadas (proteínas o hidratos de carbono) se unen a los receptores
de fibronectina del hospedador (Hirsh & Zee, 1999).
2.7.5. Aspectos moleculares
Lo propuesto por Hirsh y Zee (1999), indica que la pared celular esta
formada por proteínas y polisacáridos. Una proteína (factor de
agregación, coagulasa de unión) habitualmente existente tanto en S.
aureus como en S. hyicus, reacciona in vitro con el fibrinogeno para dar
una reacción parecida a la aglutinación. Otra proteína, la proteína A,
produce agregación por combinarse con el fragmento Fc de las
inmunoglobulinas.
Esta se halla presente como componente de superficie en la mayor parte
de las cepas virulentas de S. aureus. Tienen una especial capacidad para
unirse a la región Fc de la inmunoglobulina G y por esta razón quizá
intervenga en la patogenia. De esta proteína depende la conglutinación,
prueba serológica de utilidad. Cuando se añaden anticuerpos IgG
específicos a Estafilococos que poseen proteína A, se produce
conglutinación cuando se trata de un antígeno homólogo (Carter, 1989).
La proteína A se ha usado como un sistema modelo para estudiar la
fijación de proteínas de superficie en las bacterias Gram – positivas. El
precursor de la proteína A citoplasmática es exportado y procesado para
generar el anclaje a especies durante un minuto en su síntesis. La
especie anclada es accesible a la proteasa en la superficie bacteriana y
requiere la liberación enzimática de la pared celular del Staphylococcus
para la solubilidad (Wiley &Schneewind, 1999).
internalización dentro de las células huésped puedan beneficiar la
progresión de la infección. Primero las infecciones localizadas de S.
aureus frecuentemente causan metástasis y pueden llegar a ser
sistémicas por diseminación a través del sistema vascular (Gottlieb et al.,
2000; Petti et al., 2002). Staphylococcus aureus debe cruzar la línea de
las células endoteliales, un proceso que debe envolver un paso de
internalización celular. Adicionalmente, la internalización dentro de las
células circulantes tales como macrófagos, puede facilitar mucho más
lejos su diseminación. Segundo, un establecimiento intracelular puede
proveer un ambiente protector para la internalización de la bacteria (Lowy,
1998).
Existen otros factores de virulencia tales como las toxinas alfa y delta de
S. aureus, las toxinas mejor caracterizadas en este grupo; las toxinas
restantes leucosidina y gama hemolisina son mencionadas solo
brevemente, desde que no esta claro que sean toxinas formadoras de
poro. Sin embargo ellas exhiben secuencias similares a las alfa toxinas
(toxinas formadoras de poro), por lo tanto, ellas también pueden ser
toxinas formadoras de poro (Tweten, 1995).
Las alfa toxinas fueron las primeras proteínas citolíticas a ser identificadas
como toxinas formadoras de poro (Fussle,et al, 1981)). La gama
hemolisina y la leucosidina tienen dos sistemas de componentes que son
contenidos en un mismo operon y dos partes de proteínas comunes que
son requeridas para la actividad; Finck-Barbancon et. al (1991), sugieren
que la leucocidina es una proteína formadora de poro, pero no se
evidencia que la gama hemolisina sean toxinas formadoras de poro. Las
delta toxinas son absolutamente diferentes de muchas otras toxinas
bacterianas citolíticas, ya que son un polipéptido corto de 26 aminoácidos,
Aislamientos clínicos de S. aureus normalmente secretan proteínas
citolíticas llamadas alpha hemolisinas o alpha toxinas las cuales han sido
implicadas como un gran factor de virulencia en experimentos de
infecciones en animales. Las alpha toxinas se unen a las membranas de
varias células eucariotas, resultando en grupos. La unión de las alpha
toxinas en la membrana blanco es un paso en la inducción de lesiones
funcionales (Gray & Kehoe, 1984).
2.8. CARACTERES DESCRIPTIVOS DE Streptococcus pyogenes
2.8.1. Morfología
Los Streptococcus son cocos Gram positivos que se presentan formando
parejas o cadenas, tiene una forma que varia de redonda a células
bacilares cortas, de 1 μm de diámetro aproximadamente. La formación de
cadenas es variable, aunque unas especies (por ejemplo S. Equi) siempre
forman cadenas (Hirsh & Zee, 1999).
La clasificación del género ha sido ampliamente estudiada. Fue
previamente dividido en cuatro grupos: Streptococcus enterico, láctico,
Viridans y Piogenico (Sharpe et. al, 1966); los miembros de este genero
tiene un contenido G + C de 34 a46 mol % y son patogénicos para
humanos y animales, algunas especies se encuentran como miembros de
la flora normal de la boca y el tracto gastrointestinal (Bascomb & Manafi,
1998).
2.8.2. Características de crecimiento
Estos microorganismos tienen unas características de crecimiento
bastante exigentes que son adecuadamente satisfechas por los medios
que contiene sangre o suero. Tras su incubación a 37° C durante una
noche, los Streptococcus crecen formando colonias trasparentes, que
Además, las colonias son redondas, lisas, brillantes y parecidas a gotas
de rocío; las variedades coloniales son: Colonias de tipo mucoide (Ácido
ialuronico), colonias mates (mucha proteína M, virulentas) y colonias de
aspecto satinado (poca proteína M, poco virulentas) (Carter, 1989).
Adicionalmente esta familia incluye aerobios y anaerobios facultativos,
que generalmente son catalasa negativos, que obtienen su energía
mediante fermentaciones (Bascomb & Manafi, 1998).
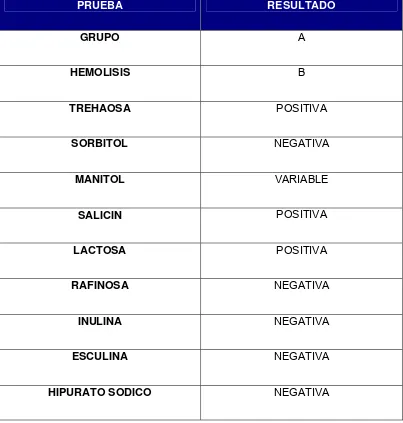
[image:45.595.109.512.311.734.2]2.8.3. Pruebas Bioquímicas para su Identificación
Tabla No 3. Actividad bioquímica de Streptococcus pyogenes
PRUEBA RESULTADO
GRUPO A
HEMOLISIS B
TREHAOSA POSITIVA
SORBITOL NEGATIVA
MANITOL VARIABLE
SALICIN POSITIVA
LACTOSA POSITIVA
RAFINOSA NEGATIVA
INULINA NEGATIVA
ESCULINA NEGATIVA
NaCl al 65% NEGATIVO
CATEGORÍAS PIOGENO
(Carter & Chengappa, 1994)
2.8.4. Patogenia
El grupo Streptococcus pyogenes coloniza la garganta o la piel, siendo
responsables de numerosas infecciones supurativas y secuelas no
supurativas. Como patógenos ellos desarrollan mecanismos complejos
de virulencia evitando la defensa por parte del huésped. Este
microorganismo causa faringitis bacteriana, fiebre escarlata e impetigo
(Bisno, 1995; Wannamaker, 1970).
Las interacciones patógeno huésped ocurren debido a la construcción de
ligandos en la superficie del Streptococcus a receptores específicos en la
célula huésped (Cunningham, 2000). Existen constituyentes celulares
antifagocíticos y citotoxinas de los Streptococcus que son posibles
factores de virulencia (Hirsh & Zee, 1999).
El ácido lipoteicoico interviene en la adherencia de S. pyogenes a la
fibronectina a las células de la orofaringe, y de los Streptococcus del
grupo B a las células de los niños. La proteína M es una probable
adhesina de S. equi y de los Streptococcus del grupo B en los adultos.
Así mismo provocan fenómenos inflamatorios que pueden dar lugar a
supuración y a la formación de abscesos (Hirsh & Zee, 1999).
2.8.5. Aspectos moleculares
Las proteínas que están integradas en la pared celular de organismos
Gram positivos o en otras membranas de organismos Gram negativos ,
pueden tener una variedad de funciones; estas proteínas incluyen
En el grupo de Streptococcus la expresión de la pared celular esta
asociada a las proteínas de superficie Petidasa C5a, proteína M y el
receptor de tipo Iia IgG Fc (van der Woude & Bäumler, 2004).
2.8.5.1. Proteína M de los Streptococcus
Según lo descrito por Wiley, (1999) la familia M de las proteínas de
superficie de los Streptococcus está compuesta por las proteínas Emm
(clase I y II), Mrp (FcrA), y Enn. Los miembros de la familia de proteínas
M son moléculas diméricas alargadas alfa- helicoidales enrolladas que
pueden unir una variedad de componentes incluyendo Igs, fibrinógenos,
kininógenos, plasminógeno y albúmina, así como factores que inhiben la
deposición de complemento en la superficie bacteriana.
La designación de la "proteína de M" ha sido tradicionalmente reservada
para los miembros de la familia M que se conocen por poseer
propiedades antifagocíticas considerando que las proteínas son similares.
Distintos laboratorios han encontrado que las proteínas Mrp y Emm
pueden tener propiedades antifagocíticas en una cepa dada (Wiley &
Schneewind, 1999).
Streptococcus pyogenes posee un factor de virulencia similar a Listeria
monocytogenes; la Streptolisina O (SLO) se enlaza al colesterol en las
membranas celulares de los glóbulos rojos, causando lisis y se reportan
algunos efectos neurológicos, incremento de la permeabilidad capilar, e
induce a la necrosis termal en conejos (Alouf, 1980).
En otros procedimientos, estudios directos del papel de SLO durante
infecciones, recientemente revelan que la contribución de SLO a la
virulencia de Streptococcus pyogenes fue limitado en un modelo de
infección invasiva de desmonecrosis de murina (Limbago, et. al, 2000).
Adicionalmente existen otros factores como la Streptolisina S (SLS), la
2.9. ANTÍGENOS ESTRUCTURALES PERTENECIENTES a L. monocytogenes, S. pyogenes y Staphilococcus aureus QUE PRESENTAN REACCIÓN CRUZADA
Existen antígenos de gran importancia entre las bacterias mencionadas,
que desempeñan un papel importante en la actividad patogénica por parte
de estos microorganismos y que a su vez presentan reacciones cruzadas.
La hemolisina de L. monocytogenes es reorganizada como un factor
mayor de virulencia (Cossart & Mengaud, 1989); la hemolisina, designada LLO (análogo a SLO) fue primero aislado de cultivos de sobrenadantes de
L. monocytogenes y mostró ser una citolisina sulfidrilo activadas (SH),
mostrando propiedades con otras proteínas de este grupo tales como
SLO (Golden, et al., 1988).
La listeriolisina O (LLO, peso molecular: 58 KDa) es una hemolisina
soluble en agua producida por Listeria monocytogenes (Mackey, B &
Derrick, C. 1987; Tomado de la revisión de literatura de Balamurugan
Sampathkumar, 1999), la cual es una citotoxina destructora de
membrana; además es una proteína extracelular producida por L.
monocytogenes la cual es responsable para la actividad hemolítica en
células de sangre (Balamurugan Sampathkumar, 1999).
Es considerada como uno de los factores de virulencia mas importantes
de Listeria spp.; esta ayuda a las células bacterianas en la liberación de
macrófagos huésped en la lisis de el límite de la membrana de vacuolas
fagocíticas en estas células (Leimeister- Watcher et al, 1992). La
listeriolisina O actúa formando poros en la membrana de fagocitos, los
cuales habilitan a listeria a escapar y ser libre e invadir otros fagocitos
En 1941,Harvey y Faber, demostraron por primera vez la producción de
una hemolisina soluble por L. monocytogenes; Jenkins et al (1964),fueron
los primeros en proveer evidencia que la hemolisina de Listeria es similar
en función y antigenicidad a SLO de S. pyogenes. La hemolisina es
inhibida por el colesterol, el pH óptimo es 7 y tiene propiedades
citotóxicas en células fagocíticas. También pueden ser involucradas en la
disrupción de membranas fagosomales. Esta toxina se le dio el nombre
de LLO y una de sus características principales fue determinada; su pH
óptimo bajo (5.5) y rangos de pH a que es activa (4.5 a 6.5).
Geoffroy, (1987) provee la primera evidencia inequívoca que la hemolisina
de L. monocytogenes es una citolisina relacionada con SLO
perteneciendo a la familia dependiente de colesterol, toxinas formadoras
de poro (CDTX).
Se ha demostrado el papel realizado por LLO en el ciclo de las
infecciones intracelulares de Listeria spp. patogénica, como un mediador
de la disrupción de la membrana del fagosoma. LLO no solo media la lisis
de fagosomas primarios formados después de la toma de la bacteria
extracelular, sino que también es requerida para el escape eficiente de L.
monocytogenes de la vacuola de doble membrana que forma en el paso
de célula a célula (Gedde, et al, 2000).
El poro o las lesiones causadas por LLO probablemente facilitan el
acceso de fosfolipasas de listeria a sus substratos, llevando a la
disolución total de la barrera física que delimita el compartimento del
fagosoma.
La familia CDTX de citolisinas tiene 23 miembros reorganizados de
diferentes géneros de bacterias Gram- positivas las cuales son muy
similares en estructura (40 a 70 % de similaridad en secuencia de