Introducción
La enfermedad periodontal y la enfermedad cere-brovascular son procesos muy prevalentes en per-sonas de edad avanzada. Según una encuesta de sa-lud oral realizada en España en 2010, el 10,4% de las personas de 65-74 años presenta bolsas periodon-tales profundas y el 13,7% de esa misma cohorte de edad sufre una pérdida de inserción clínica muy elevada (6-8 mm) [1]. En el caso de la enfermedad cerebrovascular, los estudios epidemiológicos su-gieren una incidencia de 150 casos por 100.00 habi-tantes y año, sin contar los accidentes isquémicos transitorios, y una prevalencia de 4.000-8.000 casos por 100.000 habitantes [2]. Las enfermedades cere-brovasculares constituyen un grave problema de salud pública en los países industrializados con una edad media de vida alta de la población. Es la pri-mera causa de incapacidad en la edad adulta.
La periodontitis es una enfermedad inflamatoria crónica multifactorial producida por una infección bacteriana de los tejidos de soporte que rodean los dientes [3]. Generalmente, el diagnóstico clínico de esta patología se basa en la aparición de bolsas pe-riodontales y aumento de su profundidad, en la pérdida de inserción clínica, y en la presencia y ex-tensión de pérdida ósea alveolar radiográfica. El término ‘enfermedad periodontal’ implica no sólo todos los tipos de periodontitis (las más frecuentes son la crónica, agresiva y necrosante) [4], sino tam-bién otras condiciones, como la gingivitis, que co-rresponde a un estado reversible que se diagnostica
mediante la presencia y extensión de la inflamación gingival, asociada frecuentemente con el sangrado en el sondaje.
La enfermedad cerebrovascular engloba en un sentido amplio a la isquemia (infartos cerebrales) y la hemorragia (hemorragia cerebral), aunque se pue-de dar una combinación pue-de ambas lesiones (infartos hemorrágicos), lo que no es raro en el caso de infar-tos de origen embólico o venoso. El reparto propor-cional de los diferentes tipos de enfermedades cere-brovasculares varía según los diferentes estudios. De forma general, se podría decir que los acciden-tes isquémicos transitorios incluyen el 16,4% de los casos, infartos aterotrombóticos (35%), infartos car-dioembólicos (20%), infartos lacunares (18%), he-morragias cerebrales (15,1%) e infartos de naturale-za no determinada (24%) [5]. Los distintos meca-nismos fisiopatológicos implicados en cada entidad clínica les confieren unas características deternadas. De especial interés y singularidad es la mi-croangiopatía cerebral o enfermedad del pequeño vaso implicada en la producción de infartos lacuna-res, leucoaraiosis, microsangrados y hemorragias in-tracerebrales asociadas a hipertensión arterial. Esta entidad es de gran importancia, ya que es la prime-ra causa de demencia vascular y la segunda de in-farto cerebral.
En los últimos años han sido numerosos los es-tudios publicados que han intentado relacionar am-bas enfermedades am-basándose en el grupo poblacio-nal implicado, los mecanismos fisiopatológicos si-milares que intervienen en ambos procesos, y las
Asociación entre la enfermedad periodontal y la
enfermedad cerebrovascular. Revisión de la bibliografía
Yago Leira, Miguel Blanco, Juan Blanco, José Castillo
Resumen. La enfermedad periodontal y la enfermedad cerebrovascular son procesos muy prevalentes en personas de avanzada edad. Diversos estudios han demostrado una asociación entre ambos, aunque existen diferencias metodológi-cas que dificultan la interpretación de los resultados. El objetivo de este artículo es realizar una revisión crítica de los estu-dios publicados sobre esta asociación. Se incluyen 11 estuestu-dios prospectivos y 11 estuestu-dios retrospectivos, y se analizan las distintas variables metodológicas (población de estudio, diagnóstico de enfermedad periodontal, definición de enferme-dad cerebrovascular, variables ajustadas, seguimiento y odds ratio/riesgo relativo). Además, se analizan diferentes meca-nismos patogénicos que pueden influir en la progresión e interrelación entre ambos procesos.
Palabras clave. Asociación. Bacteriemia. Enfermedad cerebrovascular. Inflamación. Periodontitis. Riesgo.
Departamento de Periodoncia; Facultad de Odontología; Universidad de Santiago de Compostela (Y. Leira, J. Blanco). Servicio de Neurología; Complejo Hospitalario Universitario; Universidad de Santiago de Compostela (M. Blanco, J. Castillo). Santiago de Compostela, A Coruña, España.
Correspondencia:
Dr. Yago Leira Feijóo. Departamento de Periodoncia. Facultad de Odontología. Universidad de Santiago de Compostela. Rúa Entrerríos, s/n. E-15782 Santiago de Compostela (A Coruña).
E-mail:
yagoleira@gmail.com
Aceptado tras revisión externa:
12.02.15.
Cómo citar este artículo:
Leira Y, Blanco M, Blanco J, Castillo J. Asociación entre la enfermedad periodontal y la enfermedad cerebrovascular. Revisión de la bibliografía. Rev Neurol 2015; 61: 29-38.
evidencias de tipo clínico y epidemiológico que afec-tan a ambas entidades.
Los objetivos del presente artículo son revisar los estudios de asociación (transversales, casos y con-troles, y cohortes) publicados hasta diciembre de 2014 sobre la relación causal entre enfermedad pe-riodontal y enfermedad cerebrovascular, así como analizar los mecanismos fisiopatológicos implica-dos en estos implica-dos procesos.
Estudios sobre la asociación entre enfermedad
periodontal y enfermedad cerebrovascular
La potencial asociación entre enfermedad periodon-tal y enfermedad cerebrovascular se ha estudiado en la comunidad científica desde finales de los años ochenta y principios de los noventa [6]. En las tablas I y II se presentan los estudios retrospectivos [7-17] y prospectivos [18-28] más relevantes publicados sobre la relación entre ambos procesos. De forma general, se puede concluir de estos estudios que la enfermedad periodontal guarda una estrecha rela-ción con la enfermedad cerebrovascular y que po-dría constituir un potencial factor de riesgo para su desarrollo. De forma global, se puede afirmar que los pacientes con enfermedad periodontal activa tie-nen casi el doble de riesgo de desarrollar algún tipo de enfermedad cerebrovascular [29]. Sin embargo, el análisis detallado de estos estudios en los que se fun-damenta esta conclusión presenta importantes limi-taciones en cuanto a definición de la enfermedad y selección de pacientes, así como metodología de re-gistro y seguimiento, que dificultan el análisis e in-terpretación de los resultados observados.
En primer lugar, las definiciones de enfermedad periodontal y enfermedad cerebrovascular no son homogéneas en los distintos grupos de estudio, lo que dificulta la interpretación de los resultados y su posible comparación. En muchos estudios, el diag-nóstico de enfermedad periodontal se realiza úni-camente mediante la pérdida [11,13,16,22-24] o au-sencia dentaria [7,26], sin tener en cuenta su causa. Procesos de alta prevalencia, como la caries o un traumatismo dentario, podrían ser algunas de las etiologías frecuentes de la pérdida de un diente, o incluso la extracción dentaria por motivos ortodón-cicos. La autoevaluación, es decir, la utilización de cuestionarios mediante los cuales el sujeto incluido en el estudio informa sobre si padece o no perio-dontitis, sin llevar a cabo ningún tipo de explora-ción periodontal [20,21], también es un método utilizado en los estudios prospectivos que incluyen un gran número de sujetos. Respecto a esto,
recien-temente se publicó un estudio que incluía a 39.863 mujeres, en el cual eran ellas mismas las que infor-maban sobre si padecían periodontitis incidental o prevalente [28]. Sin embargo, la enfermedad perio-dontal tiene que ser diagnosticada basándose en una exploración clínica en la cual se deben registrar variables como la profundidad de la bolsa en el son-daje [14,17,19,25,27], el nivel de inserción clínico [8-12,14,15] e incluso el índice de placa [9,10,14,17, 27], el índice gingival [9,10,17] o el sangrado en el sondaje [14,27], así como la movilidad dentaria y la destrucción de los tejidos de soporte del área com-prendida entre las raíces de los molares [27]; todo ello acompañado de pruebas radiográficas para de-tectar la pérdida de hueso alveolar [9,17,25,27], siempre utilizadas de manera complementaria y no como único método diagnóstico [18]. En cuanto a la definición de enfermedad cerebrovascular, el prin-cipal problema en la evidencia disponible es que al-gunos estudios analizan conjuntamente a los suje-tos que han padecido un ictus isquémico y una he-morragia cerebral [7,8,22,26,27], sin tener en cuenta sus diferentes mecanismos fisiopatológicos y facto-res de riesgo vascular asociados. En alguno de los estudios realizados, la enfermedad cerebrovascular es clasificada en ictus mortal o no mortal [7,20,22, 23], sin especificar el tipo de ictus. Aunque, en oca-siones, se ha estudiado la influencia de la enferme-dad periodontal en el infarto isquémico solo [17,18, 21,24,28] o en conjunto con el ataque isquémico transitorio [8-10,14,25], la evidencia acerca de la enfermedad neurovascular asintomática [16], el ic-tus hemorrágico aislado [15] o los infartos lacuna-res [30] es muy limitada. Además, hay estudios en los que no se especifica el tipo de ictus que se está analizando [11,13], lo que dificulta su interpretación y la posible extrapolación de sus resultados. Sólo un estudio [9] de asociación entre enfermedad perio-dontal y enfermedad cerebrovascular analiza los distintos subtipos de ictus isquémico.
de-tectan con mayor frecuencia en la población de edad avanzada [1,2].
El tamaño muestral puede ser otra de las varia-bles que dificultan la comparación entre estudios debido a la diferencia en sus diseños. El número de sujetos incluidos en los estudios de casos y contro-les era de entre 47 [17] y 300 [9,10] en el grupo con-trol, y de entre 48 [17] y 303 [9,10] en el grupo de casos. Sin embargo, en los estudios de cohortes, el tamaño muestral era muy superior, tanto en los es-tudios de cohortes como en los transversales, y os-cilaba en los primeros entre 1.137 [25] y 867.256 [26] participantes, y en los transversales, entre 659 [16] y 22.862 [13] sujetos.
En cuanto al tiempo de seguimiento de los estu-dios prospectivos, también se puede observar mu-cha variabilidad en los distintos estudios realizados. El estudio que presenta mayor seguimiento es el de Tu et al [23], en el que la cohorte de sujetos partici-pantes fue seguida durante 57 años. Mucho menor fue el período de seguimiento de otros estudios. Por ejemplo, un estudio en el que se siguió a una cohor-te de individuos chinos durancohor-te cinco años [22], o aquél en el que se evaluó durante siete años y me-dio a una cohorte de sujetos daneses [24]. Este gran abanico de años hace que resulte difícil comparar un estudio con otro y más aún compararlos con es-tudios de carácter retrospectivo.
La mayoría de los estudios analizados en esta re-visión incluye el registro de variables de factores de riesgo vascular conocidos y que han sido incluidos en el análisis estadístico, lo que facilita el reconoci-miento diferencial de la enfermedad periodontal como posible factor de riesgo vascular. Por lo tanto, mediante un modelo de regresión logística, los fac-tores de confusión más comúnmente ajustados fue-ron la edad [7-16,18-23,25-28], el sexo [7-15,19,22, 23,27], la diabetes mellitus [7-13,15,16,19-21,25,26, 28], la hipertensión [7-21,25,26,28], el tabaquismo [7-16,18-28], el colesterol [7,8,11,17,19,21,25, 26,28] o el índice de masa corporal [8,11,12,15,18-21,23, 25,28], para así poder detectar si la periodontitis en sí misma es un factor de riesgo de enfermedad ce-rebrovascular.
Tanto los estudios retrospectivos como los pros-pectivos mostraron un amplio rango de asociación entre enfermedad periodontal y enfermedad cere-brovascular.
Los estudios retrospectivos mostraron una odds ratio (OR) que oscilaba entre 1 y 8,5, mientras que en los prospectivos el riesgo relativo (RR) oscilaba entre 1 y 2,8. Hay que ser cautos a la hora de tener en cuenta estos datos, ya que estos valores de aso-ciación están basados en variables clínicas muy
dis-tintas, como pueden ser el edentulismo [7,24], la pérdida dentaria [13,16,22,23,26] o la pérdida ósea alveolar [17,18,25]. Sin embargo, hay estudios me-todológicamente más correctos en los que se utili-zan parámetros clínicos periodontales como varia-bles de estudio, como son el nivel de inserción o la profundidad en el sondaje [8-11,14,19,25,27]. Ba-sándose en estos registros, se puede diagnosticar la enfermedad periodontal e informar de su grado de gravedad y así poder diferenciar entre periodontitis y gingivitis, y a su vez poder ser capaces de discer-nir entre periodontitis leve, moderada o avanzada [12,27], así como clasificar la enfermedad según su extensión (localizada o generalizada). Al analizar en profundidad las OR y los RR de todos los estu-dios prospectivos y retrospectivos, se observa que hay estudios que no alcanzan significación estadís-tica debido a la variabilidad de su intervalo de con-fianza [7,11,14,20,23,27]. Si se analiza la asociación que muestran los estudios basándose en la enfer-medad cerebrovascular, se puede observar que, de-bido a la falta de homogeneidad a la hora de defi-nirla, resulta complicado comparar un estudio con otro. Algunos estudios incluyen isquemia cerebral y hemorragia de forma conjunta [7,8,12,22,23,26,27], por lo que las OR o los RR obtenidos no se sabe a qué tipo de patología cerebrovascular correspon-den. En otros casos, se estudió de forma individua-lizada el ictus isquémico y el hemorrágico [19]. Sólo en un estudio se investigó la asociación de los dife-rentes subtipos de isquemia cerebral [9], y se obser-vó que los ictus que estaban más asociados con la periodontitis avanzada era los de origen indeter-minado, los cuales mostraron una OR de 13,2 (2,6-64,7), seguidos de los de origen aterotrombótico. En el estudio de Kim et al [15] se evaluó la influen-cia de la periodontitis en el ictus hemorrágico, y se encontró una asociación positiva entre la periodon-titis avanzada y la hemorragia cerebral. En dos es-tudios que investigaron la asociación de la gingivitis y el ictus isquémico [7,19] se concluyó que no exis-tía ninguna asociación entre ambas entidades.
Mecanismos fisiopatológicos implicados
en la relación entre enfermedad
periodontal y enfermedad cerebrovascular
fre-Tabla I. Estudios retrospectivos. Población de estudio Diagnóstico periodontal Enfermedad cerebrovascular Variables ajustadas Odds ratio
(intervalo de confianza al 95%)
Morrison et al [7]
Estudio de cohorte: 11.551 sujetos adultos (182 fallecieron por enfermedad cerebrovascular) Gingivitis grave y edentulismo Ictus fatal (isquémico y hemorrágico)
Edad, sexo, DM, tabaquismo, colesterol sérico total e hipertensión
Edentulismo: 1,63 (0,77-3,42) Gingivitis grave: 1,81
Elter et al [8]
Estudio transversal: 10.906 sujetos adultos (9.415 dentados y 1491 edéntulos)
% de sitios con pérdida de inserción periodontal ≥ 3 mm
Ictus (isquémico o hemorrágico) o AIT
DM, hipertensión, IMC, tabaquismo, edad, sexo, raza, antecedente de enfermedad coronaria, LDL, HDL y triglicéridos en mg/dL
Sujetos con pérdida de inserción periodontal ≥ 3 mm en más del 30% de los sitios: 1,30 (1,02-1,7) Edéntulos: 1,40 (1,1-1,7)
Grau et al [9]
Estudio de casos y controles: 303 casos, 300 controles de la población general y 168 controles hospitalarios (18-75 años)
Nivel de inserción periodontal clínico, índice de placa, índice gingival y pérdida ósea alveolar radiográfica
Ictus isquémico (aterotrombótico, cardioembólico, indeterminado y microangiopatía cerebral) o AIT
Edad, sexo, hipertensión, DM, tabaquismo, antecedente de isquemia cerebral, profesión paterna, número de visitas al odontólogo y número de dientes presentes en la boca
Periodontitis avanzada (NIC ≥ 6 mm): Cardioembólico: 2,35 (0,47-11,8) •
Aterotrombótico: 3,32 (1-11) •
Microangiopatía cerebral: •
3,19 (0,55-18,4)
Indeterminado: 13,2 (2,68-64,7) •
Dörfer et al [10]
Estudio de casos y controles: 303 casos y 300 controles de la población general (18-75 años)
Nivel de inserción periodontal clínico, índice de placa, índice gingival y pérdida ósea alveolar radiográfica
Ictus isquémico o AIT
Edad, sexo, hipertensión, DM, tabaquismo, enfermedad coronaria o enfermedad arterial periférica, antecedente de isquemia cerebral, profesión paterna, número de visitas al odontólogo, número de dientes presentes en la boca, profesión actual, historia familiar de ictus, consumo de alcohol, fibrilación auricular y nivel de educación
Periodontitis avanzada (NIC ≥ 6 mm): 7,38 (1,55-15,03)
Lee et al [11]
Estudio transversal: 5.123 sujetos > 60 años
Pérdida dentaria, nivel de inserción periodontal clínico ≥ 3 mm, nivel de inserción periodontal clínico ≥ 2 mm
Ictus Sexo, edad, raza/etnia, nivel de educación, tabaquismo, consumo de alcohol, nivel de pobreza, IMC, hipertensión, DM, hematocrito, ácido fólico total, fibrinógeno, PCR sérica, niveles de glucosa, colesterol total, LDL, HDL, y creatinina
Dientes en ambas arcadas y % de sitios con NIC ≥ 3 mm por debajo del 50% de los sujetos: 1 Dientes en ambas arcadas y % de sitios con NIC ≥ 3 mm por encima del 50% de los sujetos: 0,91 (0,5-1,66) Edéntulos en una arcada y % de sitios con NIC ≥ 3 mm por debajo del 50% de los sujetos: 1,31 (0,58-2,98) Edéntulos en una arcada y % de sitios con NIC ≥ 3 mm por debajo del 50% de los sujetos: 1,79 (0,97-3,31) Edéntulos totales: 1,28 (0,8-2,06)
Sim et al [12]
Estudio de casos y controles: 265 casos y 214 controles (40-79 años)
Presencia de periodontitis = nivel de inserción clínico periodontal ≥ 6 mm
Periodontitis leve: < 48% •
de los sitios con NIC ≥ 5 mm Periodontitis moderada: •
48-73% de los sitios con NIC ≥ 5 mm
Periodontitis avanzada: ≥ 73% •
de los sitios con NIC ≥ 5 mm
Ictus isquémico y hemorrágico
Edad, sexo, ingresos, educación, hipertensión, DM, IMC, enfermedad cardíaca, tabaquismo, consumo de alcohol, factores de riesgo vasculares familiares, frecuencia de cepillado dental y visita anual al odontólogo
Periodontitis moderada: 2,58 (1,39-4,81) Periodontitis avanzada: 4,30 (2,27-8,16)
You et al [13]
Estudio transversal: 22.862 sujetos > 45 años
Pérdida dentaria Ictus Edad, raza, sexo, nivel socioeconómico, enfermedad coronaria, DM, hiper-lipidemia, hipertensión, tabaquismo, fibrilación auricular y niveles de PCR
1-16 dientes perdidos: 1,13 (0,96-1,34) 17-32 dientes perdidos: 1,27 (1,09-1,49)
Pradeep et al [14]
Estudio de casos y controles: 100 casos y 100 controles (33-68 años)
Nivel de inserción periodontal clínico, índice de placa, índice de sangrado y profundidad de bolsa al sondaje
Ictus isquémico y AIT
cuentes de enfermedad cerebrovascular. Por lo tan-to, numerosos mecanismos podrían explicar cómo las bacterias de la placa dental pueden iniciar o em-peorar los procesos ateroescleróticos (Figura).
El primer mecanismo fisiopatológico en esta re-lación sería la activación de la inmunidad innata. Las bacterias se encuentran permanentemente co-lonizando la cavidad bucal. El epitelio oral actúa como una barrera fisiológica que interactúa con los péptidos antimicrobianos formados por la respues-ta de la inmunidad innarespues-ta. Los más imporrespues-tantes son las defensinas y las catelicidinas, que están produci-das por los leucocitos polimorfonucleares, el epite-lio y las glándulas salivales. Las catelicidinas son de vital importancia, ya que actúan como agentes qui-miotácticos sobre neutrófilos, linfocitos T y mono-citos, se adhieren a los lipopolisacáridos, neutrali-zan la actividad de ciertas endotoxinas y hasta po-seen actividad bactericida. Por lo tanto, es muy im-portante para la defensa de la cavidad oral que los neutrófilos migren al epitelio de unión del perio-donto transportando grandes cantidades de estos péptidos [32]. Las paredes de las bacterias gramne-gativas que se encuentran en la placa dental están formadas, entre otras moléculas, por lipopolisacá-ridos. En dos de las bacterias más periodontopató-Tabla I. Estudios retrospectivos (cont.).
Población de estudio
Diagnóstico periodontal
Enfermedad cerebrovascular
Variables ajustadas
Odds ratio
(intervalo de confianza al 95%)
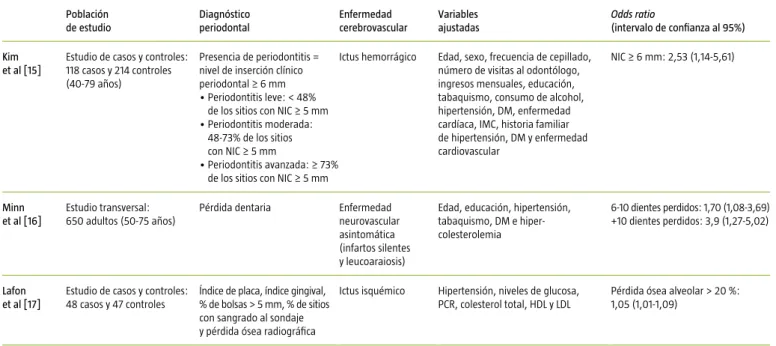
Kim et al [15]
Estudio de casos y controles: 118 casos y 214 controles (40-79 años)
Presencia de periodontitis = nivel de inserción clínico periodontal ≥ 6 mm
Periodontitis leve: < 48% •
de los sitios con NIC ≥ 5 mm Periodontitis moderada: •
48-73% de los sitios con NIC ≥ 5 mm
Periodontitis avanzada: ≥ 73% •
de los sitios con NIC ≥ 5 mm
Ictus hemorrágico Edad, sexo, frecuencia de cepillado, número de visitas al odontólogo, ingresos mensuales, educación, tabaquismo, consumo de alcohol, hipertensión, DM, enfermedad cardíaca, IMC, historia familiar de hipertensión, DM y enfermedad cardiovascular
NIC ≥ 6 mm: 2,53 (1,14-5,61)
Minn et al [16]
Estudio transversal: 650 adultos (50-75 años)
Pérdida dentaria Enfermedad neurovascular asintomática (infartos silentes y leucoaraiosis)
Edad, educación, hipertensión, tabaquismo, DM e hiper- colesterolemia
6-10 dientes perdidos: 1,70 (1,08-3,69) +10 dientes perdidos: 3,9 (1,27-5,02)
Lafon et al [17]
Estudio de casos y controles: 48 casos y 47 controles
Índice de placa, índice gingival, % de bolsas > 5 mm, % de sitios con sangrado al sondaje y pérdida ósea radiográfica
Ictus isquémico Hipertensión, niveles de glucosa, PCR, colesterol total, HDL y LDL
Pérdida ósea alveolar > 20 %: 1,05 (1,01-1,09)
AIT: accidente isquémico transitorio; DM: diabetes mellitus; HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal; LDL: lipoproteínas de baja densidad; NIC: nivel de inserción clíni-co; PBS: profundidad de bolsa al sondaje; PCR: proteína C reactiva.
Tabla II. Estudios prospectivos.
Población de estudio
Diagnóstico periodontal
Enfermedad cerebrovascular
Variables ajustadas
Segui- miento
riesgo relativo
(intervalo de confianza al 95%)
Beck et al [18]
1.147 hombres Pérdida ósea alveolar de toda la boca
Ictus isquémico Edad, nivel de educación, IMC, tabaquismo, hipertensión, antecedentes de enfermedad cardíaca y consumo de alcohol
25 años 2,8 (1,45-5,48)
Wu et al [19]
9.962 sujetos (25-74 años)
Sin enfermedad periodontal Gingivitis
Periodontitis (cuatro dientes o más con bolsas periodontales profundas) Edéntulos
Ictus hemorrágico y no hemorrágico
Sexo, raza, edad, educación, índice de pobreza, DM, hipertensión, tabaquismo, consumo de alcohol, IMC y colesterol
10 años Periodontitis: Ictus no hemorrágico: •
2,11 (1,3-3,42) Ictus hemorrágico: •
1,22 (0,53-2,83)
Howell et al [20]
22.071 hombres médicos (40-84 años)
Autoevaluación de la enfermedad periodontal
Ictus no mortal Edad, DM, hipertensión, IMC, tabaquismo, consumo de alcohol, actividad física, antecedentes de angina de pecho y antecedentes familiares de infarto de miocardio
12,3 años 1,01 (0,81-1,27)
Joshipura et al [21]
41.380 hombres profesionales sanitarios (40-75 años)
Autoevaluación de la enfermedad periodontal
Ictus isquémico Edad, consumo de alcohol, actividad física, IMC, tabaquismo, hipertensión, DM, hipercolesterolemia, historia familiar de enfermedad coronaria, uso de suplementos multivitamínicos o vitamina E y consumo regular de aspirina (> 2 veces/semana)
12 años 1,33 (1,03-1,7)
Abnet et al [22]
29.584 adultos (40-69 años)
Pérdida dentaria (comparación de la media de dientes perdidos en sujetos de la misma edad)
Ictus mortal (isquémico y hemorrágico)
Edad, sexo y tabaquismo 5,25 años 1,11 (1,01-1,23)
Tu et al [23]
12.631 adultos (< 30 años en basal)
Pérdida dentaria Ictus mortal (isquémico y hemorrágico)
Sexo, edad, clase social paterna, tabaquismo, IMC y presión sanguínea sistólica
57 años Por cada diente ausente: 1,02 (0,98-1,06)
Heitmann y Gamborg [24]
2.932 adultos Pérdida dentaria Ictus isquémico Edad, sexo, IMC, tabaquismo, presión sanguínea sistólica, DM, consumo de alcohol, estado civil y educación
7,5 años Edéntulos: 2,79 (1,27-6,14)
Jiménez et al [25]
1.137 hombres Pérdida ósea alveolar de toda la boca y profundidad al sondaje acumulativo
Ictus isquémico y AIT
Edad, IMC, HDL, colesterol total, triglicéridos, hipertensión, DM, consumo diario de alcohol, tabaquismo, estado civil, educación y ocupación
24 años Pérdida ósea alveolar media > 20%: 3,52 (1,59-7,81) Profundidad al sondaje acumulativo > 30 mm: 1,07 (0,59-1,93)
Choe et al [26]
867.256 sujetos (30-95 años)
Ausencia dentaria Ictus isquémico o ictus hemorrágico
Edad, obesidad, hipercolesterolemia, hipertensión, DM, consumo de alcohol, ejercicio físico y tabaquismo
14 años Ictus isquémico: Hombres con ausencia •
dentaria ≥ 7: 1,30 (1,2-1,4) Mujeres con ausencia •
dentaria ≥ 7: 1,1 (1-1,3) Ictus hemorrágico:
Hombres con ausencia •
dentaria ≥ 7: 1,3 (1,1-1,5) Mujeres con ausencia •
dentaria ≥ 7: 1,2 (1,1-1,5)
Holmlund et al [27]
7.674 sujetos (20-89 años)
Índice de placa (presencia/ ausencia), sangrado al sondaje, afectación de furcas, movilidad dentaria, pérdida ósea radiográfica y profundidad de la bolsa al sondaje
Ictus isquémico y hemorrágico
genas, estos lipopolisacáridos se unen a los recep-tores Toll-like-4, en el caso de la bacteria Aggregati-bacter actinomycetemcomitans, o Toll-like-2, en el caso de la Porphyromonas gingivalis. Esta última produce una enzima, la gingipaína, que degrada moléculas importantes en la superficie de células, como inmunoglobulinas [33], interleucina (IL)-6 o IL-1β [34], para proteger a esta bacteria contra la acción del sistema inmunitario. Un marcador im-portante en el desarrollo de la inflamación es el ni-vel de la proteína C reactiva, perteneciente al grupo de las pentraxinas. Estudios han demostrado que la proteína C reactiva está involucrada en el desarro-llo de la ateroesclerosis, ya que está presente en las lesiones ateroescleróticas. Además, elevados nive-les de esta proteína pueden llegar a predecir la en-fermedad coronaria [35].
Otro mecanismo sería la bacteriemia, que se de-fine como el paso de bacterias orales al torrente sanguíneo. Existen múltiples procesos que podrían explicar la diseminación sistémica de la bacteria periodontal. La primera hipótesis es que, debido a que el surco gingival está separado de los microca-pilares por células epiteliales, se cree que los pató-genos periodontales que invaden a las células orales pueden atravesar dicha barrera celular y entrar en la circulación [36]. Sin embargo, frecuentemente los periodontopatógenos pasan a la circulación de-bido a procedimientos tales como el raspado radi-cular [37,38], la cirugía de extracción de terceros molares [39] o incluso durante el sondaje periodon-tal [40]. Además, también existe evidencia sobre bacteriemias producidas por actividades diarias co-mo el cepillado dental [41], o al masticar una man-zana [42] o un chicle [43]. En pacientes con perio-dontitis, múltiples estudios demostraron la detec-ción de bacteriemias con diferentes patógenos pe-riodontales, sobre todo tras desbridamiento subgin-gival [43,44]. La última hipótesis, aunque no está probada, propone que el mecanismo de la bacterie-mia es que la bacteria entra en la circulación y se
disemina mediante células inmunitarias a sitios dis-tantes [45]. La capacidad de bacterias periodonto-patógenas como la P. gingivalis de invadir las células del endotelio y de la arteria aorta podría explicar la implicación directa en la activación de ciertos mar-cadores por parte de los antígenos de la placa den-tal en el proceso aterógeno y, por lo tanto, el si-guiente nexo de unión. Diversos estudios han mos-trado la presencia de ADN proveniente de la Pre-votella intermedia,A. actinomycetemcomitans y P. gingivalis en placas de ateroma, utilizando diversas técnicas de diagnóstico microbiológico, como la reacción en cadena de la polimerasa [46,47]. Basán-dose en una revisión reciente, se han identificado estas dos últimas bacterias orales como las más prevalentes en las placas de ateroma [48]. En un es-tudio experimental con ratones ApoE, en el que al grupo test se le inoculaba oralmente la P. gingivalis
para que desarrollase periodontitis y ateroesclero-sis, a los cuatro meses de seguimiento se observó que los ratones con periodontitis presentaban nive-les séricos elevados de IL-6 y VCAM-1 en la arteria aorta [49]. También se ha estudiado la posible aso-ciación entre enfermedad periodontal y el aneuris-ma aórtico abdominal. En el 86% de los casos, los pacientes operados de esta patología presentaban ADN de bacterias periodontopatógenas en la capa íntima de la arteria aorta obstruida [50].
El papel que desempeñan las citocinas y las pro-teínas de choque térmico provenientes de la placa dental bacteriana en la relación entre enfermedad periodontal y ateroesclerosis es muy relevante. Los tejidos periodontales producen citocinas inflama-torias (IL-1β, IL-6, interferón γ, factor de necrosis tumoral α e IL-10), óxido nítrico, prostaglandina PGE2 o quimiocinas como la IL-8 debido a la esti-mulación por parte de la bacteria y de sus compo-nentes (lipopolisacáridos y peptidoglucanos) [51]. Los lipopolisacáridos del A. actinomycetemcomitans
producen una sobreexpresión de selectinas e inte-grinas. Aunque los peptidoglucanos, igual que los li-Tabla II. Estudios prospectivos (cont.)
Población de estudio
Diagnóstico periodontal
Enfermedad cerebrovascular
Variables ajustadas
Segui- miento
riesgo relativo
(intervalo de confianza al 95%)
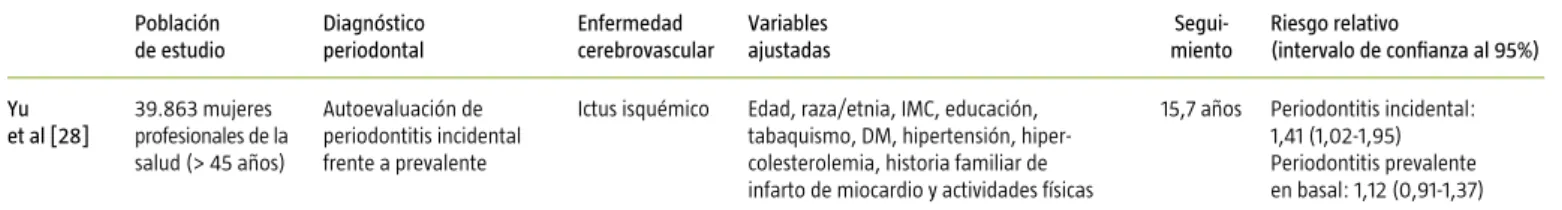
Yu et al [28]
39.863 mujeres profesionales de la salud (> 45 años)
Autoevaluación de periodontitis incidental frente a prevalente
Ictus isquémico Edad, raza/etnia, IMC, educación, tabaquismo, DM, hipertensión, hiper-colesterolemia, historia familiar de infarto de miocardio y actividades físicas
15,7 años Periodontitis incidental: 1,41 (1,02-1,95) Periodontitis prevalente en basal: 1,12 (0,91-1,37)
popolisacáridos, intervienen en la activación de las células de la inmunidad innata, no son potentes es-timuladores de las reacciones inmunológicas. Un estudio mostró que los niveles de IL-6 estaban au-mentados en pacientes con periodontitis en com-paración con sujetos sanos [52]. En cuanto a las proteínas de choque térmico, los pacientes con pe-riodontitis parecen tener reducida la respuesta pro-liferativa a este tipo de proteínas por parte de las células sanguíneas periféricas [53], y se observa una reducción en la producción de interferón γ [54]. Esto podría sostener la idea de que la respuesta de los linfocitos Th1 puede estar deprimida en pacien-tes periodontales y dar lugar a una mayor suscepti-bilidad para desarrollar periodontitis agresiva. Es-tudios en el modelo animal han mostrado que, de-bido a la infección producida por bacterias, se pro-duce una mayor producción de anticuerpos contra la HSP60, la cual se expresa en el endotelio de los vasos sanguíneos. La unión de los anticuerpos a la superficie del endotelio podría ser el mecanismo iniciador de la enfermedad inflamatoria autoinmu-ne [55]. Se observó que los niveles de anticuerpos contra la HSP60 humanas y de P. gingivalis fueron mayores en pacientes con ateroesclerosis que en sujetos sanos [56]. Otro de los mecanismos patogé-nicos que presentan las proteínas de choque térmi-co endógenas es la capacidad para iniciar la res-puesta citotóxica y apoptótica relacionada con los autoanticuerpos en enfermedades vasculares, ate-roescleróticas e autoinmunes [57]. Junto con la P. gingivalis, la Tannerella forsythia está presente en mayor número en sujetos que han sufrido un infar-to de miocardio y que tienen periodontitis modera-da o avanzamodera-da, y existe una correlación entre estas bacterias y el aumento de los niveles de anticuerpos contra HSP60 [58].
Otro mecanismo patogénico implicado en la re-lación entre enfermedad periodontal y enfermedad cerebrovascular es la disfunción endotelial. Los pa-cientes con periodontitis tienen con mayor fre-cuencia episodios bacteriémicos y, debido a ellos, se han detectado con frecuencia concentraciones de lipopolisacáridos en la circulación. Además, los modelos animales de infección en los que se han utilizado patógenos periodontales, como la P. gingi-valis, indican que la infección oral o sistémica pue-de promover la respuesta inflamatoria en sitios ale-jados de la cavidad bucal, como las placas de atero-ma [59-61]. Consecuentemente, las bacterias o los componentes proinflamatorios pueden estimular las respuestas inflamatorias sistémicas y locales en las le-siones ateromatosas [62]. Esto podría producir la aso-ciación o modificación de los lípidos séricos, la unión
de los receptores en las células inflamatorias y el endotelio, la invasión de células endoteliales o sem-brar de bacterias o componentes bacterianos las le-siones ateromatosas. Es en ese momento cuando las bacterias y sus productos pueden promover cam-bios inflamatorios que podrían contribuir al desa-rrollo de lesiones ateromatosas. Tras el crecimiento de la placa de ateroma, se produce una activación adicional y una proliferación de células inflamato-rias con un aumento de los mediadores inflamatorios y con la generación de trombina. La lesión vascular genera trombina a partir de protrombina, que, a su vez, enzimáticamente produce fibrina a partir del fibrinógeno. La trombina también interactúa con ciertos receptores de múltiples células, crea un am-biente proinflamatorio y genera mediadores de cé-lulas endoteliales, lo que hace que regule las molé-culas de adhesión de las células endoteliales, como ICAM-1, VCAM-1, E-selectina y P-selectina. El es-tado crónico inflamatorio sistémico producido y sostenido por la periodontitis puede producir dis-función endotelial, debido a un único o a múltiples mecanismos que existen entre ambos. Éstos inclu-yen una disminución de la biodisponibilidad del óxi-do nítrico, una disminución de la producción de óxióxi-do nítrico o un aumento de su inactivación. La disfun-ción del endotelio produce inflamadisfun-ción en la pared vascular [63]. Esto provoca un aumento de la pro-ducción de moléculas de adhesión y citocinas por parte de la pared vascular, y aumenta el riesgo de que se produzca un evento cerebrovascular.
En conclusión, aunque se ha demostrado una asociación entre la enfermedad periodontal y la en-fermedad cerebrovascular, en la actualidad todavía persisten numerosas incógnitas sobre la relación causa-efecto entre ambas, así como los mecanismos fisiopatológicos implicados en ellas. La realización de nuevos estudios prospectivos observacionales y de intervención que incluyan una población de es-tudio más homogénea en cuanto a la edad, sexo, número de sujetos y factores de riesgo vascular, así como unos criterios diagnósticos más estrictos de enfermedad periodontal (tipo, extensión y grave-dad) y análisis diferenciado de los distintos grupos de enfermedad cerebrovascular (isquemia cerebral de pequeño y gran vaso, hemorragia cerebral y en-fermedad neurovascular asintomática), proporcio-nará una información más real sobre la influencia de la enfermedad periodontal en el desarrollo de enfermedad cerebrovascular.
Bibliografía
2. Brea A, Laclaustra M, Martorell E, Pedragosa A.Epidemiología de la enfermedad vascular cerebral en España. Clin Invest Arterioscl 2013; 25: 211-7.
3. Page RC, Eke PI. Case definitions for use in population-based surveillance of periodontitis. J Periodontol 2007; 78: 1387-99. 4. Armitage GC. Development of a classification system for
periodontal diseases and conditions. Ann Periodontol 1999; 4: 1-6.
5. Díaz-Guzmán J, Egido JA, Gabriel-Sánchez R, Barberá-Comes G, Fuentes-Gimeno B, Fernández-Pérez C; IBERICTUS Study Investigators of the Stroke Project of the Spanish Cerebrovascular Diseases Study Group. Cerebrovasc Dis 2012; 34: 272-81.
6. Syrjänen J, Peltola J, Valtonen V, Iivanainen M, Kaste M, Huttunen JK. Dental infections in association with cerebral infarction in young and middle-aged men. J Intern Med 1989; 225: 179-84.
7. Morrison HI, Ellison LF, Taylor GW. Periodontal disease and risk of fatal coronary heart and cerebrovascular diseases. J Cardiovasc Risk 1999; 6: 7-11.
8. Elter JR, Offenbacher S, Toole JF, Beck JD. Relationship of periodontal disease and edentulism to stroke/TIA. J Dent Res 2003; 82: 998-1001.
9. Grau AJ, Becher H, Ziegler CM, Lichy C, Buggle F, Kaiser C, et al. Periodontal disease as a risk factor for ischemic stroke. Stroke 2004; 35: 496-501.
10. Dörfer CE, Becher H, Ziegler CM, Kaiser C, Lutz R, Jörss D, et al. The association of gingivitis and periodontitis with ischemic stroke. J Clin Periodontol 2004; 31: 396-401. 11. Lee HJ, Garcia RI, Janket SJ, Jones JA, Mascarenhas AK,
Scott TE, et al. The association between cumulative periodontal disease and stroke history in older adults. J Periodontol 2006; 77: 1744-54.
12. Sim SJ, Kim HD, Moon JY, Zavras AI, Zdanowicz J, Jang SJ, et al. Periodontitis and the risk for non-fatal stroke in Korean adults. J Periodontol 2008; 79: 1652-8.
13. You Z, Cushman M, Jenny NS, Howard G; REGARDS. Tooth loss, systemic inflammation, and prevalent stroke among participants in the reasons for geographic and racial difference in stroke (REGARDS) study. Atherosclerosis 2009; 203: 615-9. 14. Pradeep AR, Hadge P, Arjun Raju P, Shetty SR, Shareef K,
Guruprasad CN. Periodontitis as a risk factor for cerebro-vascular accident: a case-control study in the Indian population. J Periodontal Res 2010; 45: 223-8.
15. Kim HD, Sim SJ, Moon JY, Hong YC, Han DH. Association between periodontitis and hemorrhagic stroke among Koreans: a case-control study. J Periodontol 2010; 81: 658-65. 16. Minn YK, Suk SH, Park H, Cheong JS, Yang H, Lee S, et al.
Tooth loss is associated with brain white matter change and silent infarction among adults without dementia and stroke. J Korean Med Sci 2013; 28: 929-33.
17. Lafon A, Tala S, Ahossi V, Perrin D, Giroud M, Béjot Y. Association between periodontal disease and non-fatal ischemic stroke: a case-control study. Acta Odontol Scand 2014; 72: 687-93.
18. Beck J, Garcia R, Heiss G, Vokonas PS, Offenbacher S. Periodontal disease and cardiovascular disease. J Periodontol 1996; 67: 1123-37.
19. Wu T, Trevisan M, Genco RJ, Dorn JP, Falkner KL, Sempos CT. Periodontal disease and risk of cerebrovascular disease: the first national health and nutrition examination survey and its follow-up study. Arch Intern Med 2000; 160: 2749-55. 20. Howell TH, Ridker PM, Ajani UA, Hennekens CH, Christen WG.
Periodontal disease and risk of subsequent cardiovascular disease in U.S. male physicians. J Am Coll Cardiol 2001; 37: 445-50. 21. Joshipura KJ, Hung HC, Rimm EB, Willett WC, Ascherio A.
Periodontal disease, tooth loss, and incidence of ischemic stroke. Stroke 2003; 34: 47-52.
22. Abnet CC, Qiao YL, Dawsey SM, Dong ZW, Taylor PR, Mark SD. Tooth loss is associated with increased risk of total death and death from upper gastrointestinal cancer, heart disease, and stroke in a Chinese population-based cohort. Int J Epidemiol 2005; 34: 467-74.
23. Tu YK, Galobardes B, Smith GD, McCarron P, Jeffreys M, Gilthorpe MS. Associations between tooth loss and mortality patterns in the Glasgow Alumni Cohort. Heart 2007; 93: 1098-103.
24. Heitmann BL, Gamborg M. Remaining teeth, cardiovascular morbidity and death among adult Danes. Prev Med 2008; 47: 156-60.
25. Jiménez M, Krall EA, Garcia RI, Vokonas PS, Dietrich T. Periodontitis and incidence of cerebrovascular disease in men. Ann Neurol 2009; 66: 505-12.
26. Choe H, Kim YH, Park JW, Kim SY, Lee SY, Jee SH. Tooth loss, hypertension and risk for stroke in a Korean population. Atherosclerosis 2009; 203: 550-6.
27. Holmlund A, Holm G, Lind L. Number of teeth as a predictor of cardiovascular mortality in a cohort of 7,674 subjects followed for 12 years. J Periodontol 2010; 81: 870-6. 28. Yu YH, Chasman DI, Buring JE, Rose L, Ridker PM.
Cardiovascular risks associated with incident and prevalent periodontal disease. J Clin Periodontol 2014; Nov 10. [Epub ahead of print].
29. Sfyroeras GS, Roussas N, Saleptsis VG, Argyriou C, Giannoukas AD. Association between periodontal disease and stroke. J Vasc Surg 2012; 55: 1178-84.
30. Taguchi A, Miki M, Muto A, Kubokawa K, Migita K, Higashi Y, et al. Association between oral health and the risk of lacunar infarction in Japanese adults. Gerontology 2013; 59: 499-506. 31. Straka M, Trapezanlidis M. Periodontitis and stroke.
Neuroendocrinol Lett 2013; 34: 200-6.
32. Dale BA, Kimball JR, Krisanaprakornkit S, Roberts F, Robinovitch M, O’Neal R, et al. Localized antimicrobial peptide expression in human gingiva. J Periodontal Res 2001; 36: 285-94. 33. Sundqvist G, Carlsson J, Herrmann B, Tarnvik A. Degradation
of human immunoglobulins G and M and complement factors C3 and C5 by black-pigmented bacteroides. J Med Microbiol 1985; 19: 85-94.
34. Fletcher J, Reddi K, Poole S, Nair S, Henderson B, Tabona P, et al. Interactions between periodontopathogenic bacteria and cytokines. J Periodontal Res 1997; 32: 200-5. 35. D’Aiuto F, Ready D, Tonetti MS. Periodontal disease and
C-reactive protein-associated cardiovascular risk. J Periodontal Res 2004; 39: 236-41.
36. Takeuchi H, Furuta N, Morisaki I, Amano A. Exit of intracellular Porphyromonas gingivalis from gingival epithelial cells is mediated by endocytic recycling pathway. Cell Microbiol 2011; 13: 677-91.
37. Lafaurie GI, Mayorga-Fayad I, Torres MF, Castillo DM, Aya MR, Baron A, et al. Periodontopathic microorganisms in peripheric blood after scaling and root planing. J Clin Periodontol 2007; 34: 873-9.
38. Pérez-Chaparro PJ, Gracieux P, Lafaurie GI., Donnio PY, Bonnaure-Mallet M. Genotypic characterization of Porphyromonas gingivalis isolated from subgingival plaque and blood sample in positive bacteremia subjects with periodontitis. J Clin Periodontol 2008; 35: 748-53. 39. Tomas I, Pereira F, Llucian R, Poveda R, Diz P, Bagan JV.
Prevalence of bacteraemia following third molar surgery. Oral Dis 2008; 14: 89-94.
40. Kinane DF, Riggio MP, Walker KF, MacKenzie D, Shearer B. Bacteraemia following periodontal procedures. J Clin Periodontol 2005; 32: 708-13.
41. Lucas VS, Gafan G, Dewhurst S, Roberts GJ. Prevalence, intensity and nature of bacteraemia after toothbrushing. J Dent 2008; 36: 481-7.
42. Fine DH, Furgang D, McKiernan M, Teres-ki-Bischio D, Ricci-Nittel D, Zhang P, et al. An investigation of the effect of an essential oil mouthrinse on induced bacteraemia: a pilot study. J Clin Periodontol 2010; 37: 840-7.
43. Forner L, Larsen T, Kilian M, Holmstrup P. Incidence of bacteremia after chewing, tooth brushing and scaling in individuals with periodontal inflammation. J Clin Periodontol 2006; 33: 401-7.
periodontal microorganisms from bacteraemia samples after periodontal therapy using molecular-based diagnostics. J Clin Periodontol 2011; 38: 418-27.
45. Carrion J, Scisci E, Miles B, Sabino GJ, Zeituni AE, Gu Y, et al. Microbial carriage state of peripheral blood dendritic cells (DCs) in chronic periodontitis influences DC differentiation, atherogenic potential. J Immunol 2012; 189: 3178-87. 46. Haraszthy VI, Zambon JJ, Trevisan M, Zeid M, Genco RJ.
Identification of periodontal pathogens in atheromatous plaques. J Periodontol 2000; 71: 1554-60.
47. Taylor-Robinson D, Aduse-Opoku J, Sayed P, Slaney JM, Thomas BJ, Curtis MA. Oro-dental bacteria in various atherosclerotic arteries. Eur J Clin Microbiol Infect Dis 2002; 21: 755-7.
48. Cullinan MP, Seymour GJ. Periodontal disease and systemic illness: will the evidence ever be enough? Periodontol 2000 2013; 62: 271-86.
49. Lalla E, Lamster IB, Hofmann MA, Bucciarelli L, Jerud AP, Tucker S, et al. Oral infection with a periodontal pathogen accelerates early atherosclerosis in apolipoprotein E-null mice. Arterioscler Thromb Vasc Biol 2003; 23: 1405-11.
50. Kurihara N, Inoue Y, Iwai T, Umeda M, Huang Y, Ishikawa I. Detection and localization of periodontopathic bacteria in abdominal aortic aneurysms. Eur J Vasc Endovasc Surg 2004; 28: 553-8.
51. Shapira L, Champagne C, Van Dyke TE, Amar S. Strain-dependent activation of monocytes and inflammatory macrophages by lipopolysaccharide of Porphyromonas gingivalis. Infect Immun 1998; 66: 2736-42.
52. Loos BG, Craandijk J, Hoek FJ, Wertheim-Van Dillen PM, van der Velden U. Elevation of systemic markers related to cardiovascular diseases in the peripheral blood of periodontitis patients. J Periodontol 2000; 71: 1528-34.
53. Petit MD, Wassenaar A, Van der Velden U, Van Eden W, Loos BG. Depressed responsiveness of peripheral blood mononuclear cells to heat-shock proteins in periodontitis patients. J Dent Res 1999; 78: 1393-400.
54. Tabeta K, Yamazaki K, Hotokezaka H, Yoshie H, Hara K. Elevated humoral immune response to heat shock protein 60 (hsp60) family in periodontitis patients. Clin Exp Immunol 2000; 120: 285-93.
55. Wick G. Atherosclerosis –an autoimmune disease due to an immune reaction against heat-shock protein 60. Herz 2000; 25: 87-90.
56. Yamazaki K, Nakajima T. Antigen specificity and T-cell clonality in periodontal disease. Periodontol 2000 2004; 35: 75-100.
57. Wick G, Perschinka H, Millonig G. Atherosclerosis as an autoimmune disease: an update. Trends Immunol 2001; 22: 665-9.
58. Leishman SJ, Ford PJ, Do HL, Palmer JE, Heng NC, West MJ, et al. Periodontal pathogen load and increased antibody response to heat shock protein 60 in patients with cardio- vascular disease. J Clin Periodontol 2012; 39: 923-30. 59. Gibson FC 3rd, Genco CA. Porphyromonas gingivalis
mediated periodontal disease and atherosclerosis: disparate diseases with commonalities in pathogenesis through TLRs. Curr Pharm Des 2007; 13: 3665-75.
60. Gibson FC 3rd, Yumoto H, Takahashi Y, Chou HH, Genco CA. Innate immune signaling and Porphyromonas gingivalis-accelerated atherosclerosis. J Dent Res 2006; 85: 106-21. 61. Hayashi C, Gudino CV, Gibson FC 3rd, Genco CA. Pathogen-
induced inflammation at sites distant from oral infection: bacterial persistence and induction of cell-specific innate immune inflammatory pathways. Mol Oral Microbiol 2010; 25: 305-16.
62. Teles R, Wang CY. Mechanisms involved in the association between periodontal diseases and cardiovascular disease. Oral Dis 2011; 17: 450-61.
63. Huang AL, Vita JA. Effects of systemic inflammation on endothelium-dependent vasodilatation. Trends Cardiovasc Med 2006; 16: 15-20.
Association between periodontal disease and cerebrovascular disease. A review of the literature
Summary. Periodontal disease and cerebrovascular disease are two of the most prevalent processes in elderly people. Various studies have shown an association between them, although some methodological differences exist and this difficult the data interpretation. The aim of this paper is to conduct a critical review of the studies published about this association. Eleven prospective studies and 11 retrospective studies are included in this review. We analyse the different methodological outcomes (study population, periodontal diagnosis, cerebrovascular disease definition, adjusted outcomes and odds ratio/relative risk). Furthermore, we review several pathogenic mechanisms implicated in the progression and the relationship between both processes.
![Tabla I. Estudios retrospectivos. Población de estudio Diagnóstico periodontal Enfermedad cerebrovascular Variables ajustadas Odds ratio (intervalo de confianza al 95%) Morrison et al [7] Estudio de cohorte: 11.551 sujetos adultos (182 fallecie](https://thumb-us.123doks.com/thumbv2/123dok_es/6657193.243244/4.892.59.829.199.1087/retrospectivos-población-diagnóstico-periodontal-enfermedad-cerebrovascular-variables-ajustadas.webp)
![Tabla II. Estudios prospectivos. Población de estudio Diagnóstico periodontal Enfermedad cerebrovascular Variables ajustadas Segui- miento riesgo relativo (intervalo de confianza al 95%) Beck et al [18]](https://thumb-us.123doks.com/thumbv2/123dok_es/6657193.243244/6.892.64.832.195.1056/estudios-prospectivos-población-diagnóstico-periodontal-enfermedad-cerebrovascular-variables.webp)