Influencia del inicio del soporte nutricional sobre la mortalidad en pacientes con insuficiencia renal aguda que requieren hemodiálisis en cuidados intensivos
Andrés Orlando González Barret°, MD.
Tesis presentada a la Facultad de Medicina como requisito parcial para optar al Grado de
Nefrología
COAUTORES
Jorge Enrique Echeverri Sarmiento, MD.
Martha Patricia Rodríguez Sánchez, MD.
Paola Karina García Padilla. MD.
Roberto D'Achiardi Rey, MD.
Saúl Rugeles, MI)
CONTENIDOS
Pág.
Capitulo 1. Introducción 1
Capitulo 2. Marco teórico 4
Capitulo 3. Objetivos 11
Capitulo 4. Métodos 12
Capitulo 5. Resultados 16
Capitulo 6. Discusión 22
LISTA DE TABLAS
Pág.
Tabla I Requerimientos nutricionales en falla renal aguda 9
Tabla 2. Descripción de las variables 13
Tabla 3. Características epidemiológicas y clínicas 16 Tabla 4. Indicaciones de terapia de soporte renal 18
Tabla 5. Desenlaces finales a tres meses 19
LISTA DE FIGURAS
Pág.
Fig. 1 Diagnóstico de UCI en pacientes con falla renal aguda 17
Fig. 2. Modalidad de inicio de soporte nutricional de acuerdo
al tiempo de inicio de nutrición 20
AGRADECIMIENTOS
Debo agradecer a Dios por haberme dado la oportunidad de cursar una bella especialidad como la nefrología.
A mi familia, Claudia Patricia. Ana Lucia y Juan Diego, ya que de ellos es el tiempo dedicado a este trabajo.
A mis padres, Orlando y María, ya que por ellos no sería lo que soy hoy.
Capitulo 1
Introducción
La insuficiencia renal aguda (IRA) es una complicación frecuente en pacientes hospitalizados, y más en aquellos severamente enfermos con requerimiento de traslado a la Unidad de Cuidados Intensivos (UCI). Su alta frecuencia de presentación, 19.2 casos por
1000 hospitalizaciones en Estados Unidos [1], y el requerimiento de soporte renal agudo en el 6% de las hospitalizaciones en UCI, hacen de esta enfermedad una patología de gran interés hospitalario [1 J. Alrededor del 50% de los pacientes que presentan sepsis pueden desarrollar IRA, cerca del 30% pueden tener compromiso renal previo, entre el 15 y el 25% continúan con dependencia de diálisis y el 60% fallecen [2.3].
En pacientes críticamente enfermos en la UCI se requiere iniciar soporte nutricional en fases tempranas, el principal objetivo de la terapia es proporcionar la suplencia de nutrientes necesarios en los diferentes estados catabólicos y prevenir la depleción proteico -calórica característica de su condición clínica, previniendo complicaciones futuras [61.
El estado hipercatabólico frecuente en la IRA, asociado al compromiso ácido base. alteraciones electrolíticas y cambios en la gluconeogénesis del paciente crítico, puede impactar directamente en el compromiso nutricional. La implementación de las terapias de soporte renal agudo pueden afectar la remoción directa de micronutrientes y facilitar la depleción proteico - calórica [71. La nutrición y la rata catabólica proteica pueden
influenciar la decisión del inicio de soporte renal agudo en los pacientes con IRA severa, así mismo, estas condiciones podrían conducir a modificar tanto la dosis como la intensidad de la diálisis. La prescripción de la suplencia nutricional en términos de tiempo de inicio, intensidad, modalidad y fórmula elegida, pueden variar en pacientes con rata catabólica proteica alta. condición que es frecuente en pacientes con IRA.
Los pacientes con falla renal aguda en la UCI, tienen un estado hipercatabólico severo que puede limitar el inicio del soporte nutricional durante las primeras 72 horas. La decisión de cuál es el mejor momento de inicio del soporte nutricional es aún incierta y dependerá de la condición nutricional basal. las comorbilidades y el estado de catabolismo proteico. El soporte nutricional es parte fundamental del manejo multisistémico del paciente crítico. Es importante evaluar el momento de inicio del soporte nutricional y su impacto sobre la mortalidad en pacientes con falla renal aguda en UC1 que hayan requerido soporte dial ítico.
Capitulo 2
Marco Teórico
En condiciones fisiológicas el riñón participa hasta en un 25% con la gluconeogénesis, cerca del 20% al consumo de glucosa y en un 10% al gasto energético, la regulación de electrolitos y minerales, y al aclaramiento de los productos del metabolismo proteico [8].
hipercatabolismo intenso, asociado a alteración del transporte de aminoácidos al tejido músculo esquelético. inhibición de la síntesis proteica. diferente a las proteínas viscerales de fase aguda, y aumento del aclaramiento de la mayoría de aminoácidos hasta 1.8 g/kg/d. disminución de los niveles de valina e isoleucina y cambios en el perfil de ciertos aminoácidos no esenciales (firosina, arginina y glutamina), transformándolos en aminoácidos esenciales. La capacidad de corregir esta deficiencia proteica con administración exógena de nutrientes suele ser insuficiente en estados hipercatabólicos, además, la suplencia nutricional puede disminuir la tasa neta de pérdida proteica [8].
La estrategia de soporte renal invasivo pueden afectar la nutrición del paciente críticamente enfermo por la depleción de micronutrientes, pérdida de calor y activación de la cascada inflamatoria luego del contacto con la membrana extracorpórea [9], el estado catabólico severo se ha relacionado con incremento de la mortalidad en esta población. La disfunción de múltiples órganos ocasiona una mortalidad cercana al 70-80%. III
El soporte nutricional en pacientes críticamente enfermos y en terapias de remplazo renal. ha mejorado la sobrevida en los últimos 30 años. Las terapias de remplazo renal modificaron el abordaje en términos de aporte nutricional en los pacientes críticos, siendo cada vez más importantes las proteínas de alto valor biológico, el aporte calórico total y de macro y micronutrientes. Durante la hemodiálisis se presentan pérdidas de moléculas hidrosolubles y de bajo peso molecular como aminoácidos, vitaminas y L- carnitina. Además, se presenta activación de catabolismo proteico dado por la pérdida de sustratos como aminoácidos y liberación de sustancias inflamatorias (citoquinas).
El contacto con la membrana del dializador puede exacerbar el proceso catabólico por activación de los monocitos, aumentando la producción de interleukina-1, que estimula la producción local de prostaglandina E2 y generación de enzimas proteolíticas a nivel lisosomal llevando a degradación proteica [11]. Gutiérrez y cols, corroboraron este concepto. mostrando en 24 pacientes de hemodiálisis un aumento en la liberación de aminoácidos a nivel muscular de 148 nmol/min/100 g de tejido a 309 nmol/min/100 g de tejido. después de la exposición a diferentes tipos membranas [11].
además presenta falla renal aguda el ajuste nutricional resulta ser mucho más complejo. Raj y cols, encontraron que la infusión de aminoácidos durante hemodiálisis al disminuir la ruptura de proteínas favorece la síntesis de estas (42% vs 32.6%, p<0.001) 113]. En la actualidad se considera que la restricción proteico — calórica en el contexto de falla renal aguda y requerimiento soporte renal no son necesarias. independiente del estado hipercatabólico en que se encuentren los pacientes [14]. Las terapias extracorpóreas permiten mantener el balance hídrico, contribuyen a la remoción de productos del catabolismo y permiten un mejor control de los productos nitrogenados [14].
El inicio temprano de la nutrición puede variar en cierta medida los desenlaces y complicaciones derivadas de la estancia en la UCI. Existen pocos registros acerca de la influencia del soporte nutricional en relación al momento de inicio, mantenimiento y posibles desenlaces en los pacientes que presentan compromiso de la función renal y requieren soporte renal agudo [15].
La dosificación del soporte nutricional depende de la severidad de la IRA y el estado hipercatabólico. La estratificación de la falla renal aguda en términos de severidad y desenlaces clínicos propuesta por la ADQI (clasificación RIFLE) [17] permite identificar los pacientes con mayor riesgo de depleción nutricional que puedan llegar a requerir una intervención nutricional más rigurosa [18] en la medida en la que el compromiso renal sea más severo.
Condiciones como hipercatabolismo, riesgo de depleción nutricional y desacondicionamiento físico, incrementan la morbimortalidad de los pacientes críticos. Respecto a la falla renal aguda, la literatura no aporta recomendaciones específicas, ni lo suficientemente claras como para asumir tratamientos concretos en este grupo de pacientes 119]. En diversos escenarios clínicos se siguen recomendaciones generales como el aporte energético de 35 kcal/kg/d con una dieta polimérica (1 kcal/mL) [8]. El requerimiento nutricional más intenso y las dietas más específicas basadas en aporte alto, podrían estar indicadas en situaciones donde la gravedad de la enfermedad como pancreatitis aguda o disfunción intestinal, conllevan a un estado hipercatabólico severo y mayor riesgo de depleción nutricional.
No se ha establecido el tiempo de inicio de nutrición parenteral o entera] en los pacientes con falla renal aguda, incluyendo estudios de pacientes hospitalizados en UCI [20].
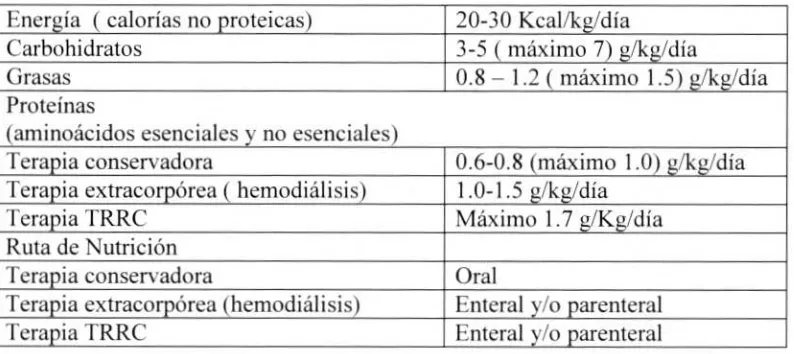
[image:16.572.60.457.287.464.2]El requerimiento de micronutrientes depende de la severidad, el estado catabólico y la modalidad de terapia de soporte renal. Tabla I
Tabla 1 Requerimientos nutricionales en falla renal aguda (15) Energía ( calorías no proteicas) 20-30 Kcal/kg/día
Carbohidratos 3-5 ( máximo 7) g/kg/día
Grasas 0.8 — 1.2 ( máximo 1.5) g/kg/día
Proteínas
(aminoácidos esenciales y no esenciales)
Terapia conservadora 0.6-0.8 (máximo 1.0) g/kg/día Terapia extracorpórea ( hemodiálisis) 1.0-1.5 g/kg/día
Terapia TRRC Máximo 1.7 g/Kg/día
Ruta de Nutrición
Terapia conservadora Oral
Terapia extracorpórea (hemodiálisis) Enteral y/o parenteral
Terapia TRRC Entera( y/o parenteral
Capitulo 3
Objetivos
3.1 Objetivo General
Determinar la mortalidad en relación con el tiempo de inicio de la nutrición en pacientes que requirieron hemodiálisis aguda en la UCI del Hospital Universitario San Ignacio desde enero de 2008 hasta noviembre de 2011.
3.2 Objetivos Específicos
3.2.1 Determinar la mortalidad de los pacientes con falla renal aguda acorde a las diferentes modalidades de soporte nutricional.
3.2.2 Identificar la modalidad de soporte nutricional más utilizada en los pacientes con hemodiálisis aguda en la UCI.
3.2.3 Establecer el tiempo en que se inicia la terapia de soporte nutricional en los pacientes con hemodiálisis aguda en la UCI.
Capitulo 4
Métodos
4.1 Tipo de estudio
Este fue un estudio de cohorte retrospectiva
4.2 Población de estudio
Pacientes hospitalizados en la UCI del Hospital Universitario San Ignacio que recibieron hemodiálisis aguda durante el periodo comprendido entre enero 2008 y noviembre 2011.
4.3 Criterios de selección
4.3.1 Criterios de inclusión
Pacientes mayores de 18 años con falla renal aguda con requerimiento de hemodiálisis aguda en la UCI del Hospital Universitario San Ignacio
4.3.2 Criterios de exclusión
Pacientes que fallecen antes de las 24 horas.
4.4 Variables
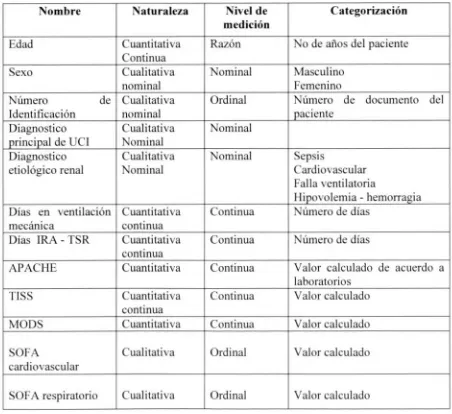
[image:20.576.66.518.279.693.2]Se analizaron variables demográficas, variables relacionadas con la terapia de reemplazo renal, variable nutricionales y mortalidad. Posteriormente se diseñó una base de datos en Excel office 2007, con la cual se logró la tabulación de las diferentes variables, anteriormente descritas.
Tabla 2. Descripción de las variables
Nombre Naturaleza Nivel de
medición
Categorización
Edad Cuantitativa
Continua
Razón No de años del paciente
Sexo Cualitativa nominal Nominal Masculino Femenino Número de Identificación Cualitativa nominal
Ordinal Número de documento del paciente
Diagnostico principal de UCI
Cualitativa Nominal Nominal Diagnostico etiológico renal Cualitativa Nominal Nominal Sepsis Cardiovascular Falla ventilatoria
Hipovolemia - hemorragia Días en ventilación
mecánica
Cuantitativa continua
Continua Número de días Días IRA - TSR Cuantitativa
continua
Continua Número de días
APACHE Cuantitativa Continua Valor calculado de acuerdo a laboratorios
TISS Cuantitativa
continua
Continua Valor calculado
MODS Cuantitativa Continua Valor calculado
SOFA
cardiovascular
Nutrición Cualitativa Ordinal
NVO VO 3. Enteral 4: Parenteral Dosis de nutrición Cuantitativa Continua Valor aportado Módulo nutricional
empleado
Cualitativa Ordinal Fórmula nutricional preparada Tiempo de inicio de
nutrición Cuantitativa Ordinal
Menos de 72 horas Mayor de 72 horas
Mortalidad en UCI Nominal Dicotómica Si
No
Colesterol total Cuantitativa Continua Medición de laboratorio Colesterol HM_ Cuantitativa Continua Medición de laboratorio Colesterol MI. Cuantitativa Continua Medición de laboratorio Trigliceridos Cuantitativa Continua Medición de laboratorio Glicemia Cuantitativa Continua Medición de laboratorio Albumina Cuantitativa Continua Medición de laboratorio Fosforo Cuantitativa Continua Medición de laboratorio Nitrogeno Ureico en
sangre - BUN
Cuantitativa Continua Medición de laboratorio
4.5 Instrumentos
4.6 Análisis estadístico
Se realizó un análisis univariado para determinar frecuencias. utilizando promedios y desviaciones estándar para las variables continuas y proporciones en las variables categóricas.
Posteriormente se realizó un análisis bivariado para determinar las diferentes modalidades de nutrición utilizadas en los pacientes y su relación con otras variables de interés.
Se evaluó el tiempo de inicio de la terapia nutricional en las primeras 72 horas, después de 72 horas hasta el día 5. y posterior al quinto día de ingreso a la UCI, se determinó la asociación entre las modalidades utilizadas y mortalidad, usando la prueba de Chi cuadrado.
4.7 Aspectos éticos
Capitulo 5 Resultados
5.1 Características epidemiológicas y clínicas
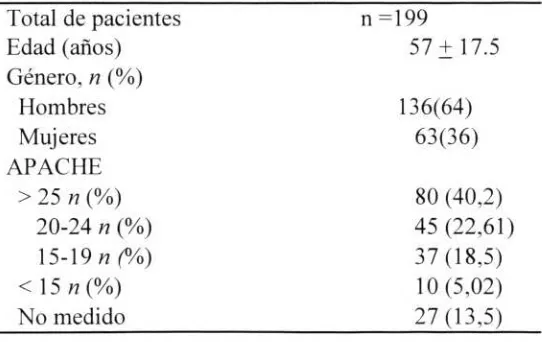
Se analizaron 199 pacientes que se encontraban en la UCI del Hospital Universitario San I gnacio. el periodo comprendido entre enero 2008 y noviembre 2011, se excluyeron los pacientes con diagnóstico de ERC y aquellos con falla renal de causa obstructiva; en total se realizaron 928 sesiones de hemodiálisis aguda. En la población estudiada predominó el sexo masculino. El promedio de edad de la población fue de 57 años (SD 17,58 años) , el rango de edad osciló entre 18 y 82 años.
[image:23.579.132.403.535.706.2]La severidad fue clasificada con la medición del APACHE al momento de ingreso a la UCI, la mayoría de pacientes estaban críticamente enfermos encontrándose dentro de diferentes grupos con puntajes más altos. Hubo un mínimo porcentaje de pacientes estudiados que no tuvieron puntaje de APACHE al ingreso de UCI. Tabla 3
Tabla 3. Características epidemiológicas y clínicas
Total de pacientes n =199
Edad (años) 57 + 17.5
Género, n (%)
Hombres 136(64)
Mujeres 63(36)
APACHE
> 25 n (%) 80 (40,2)
20-24 n (%) 45 (22,61)
15-19 n (%) 37 (18,5)
< 15 n (%) 10 (5,02)
Cardiovascular (choque cardiogénico-IAM-ICC )
Disfunción Metabólica (DM descom
pensada-pancreatitis- Tiroiditis etc..) Falla Ventilatoria (EPOC-IRA-Edema pulmonar)
Glomerulopatías u
enfermedades autoinmunes (LES etc..)
Hipovolemia O hemorragia
Neoplasias
Patología gastrointestinal o hepática
Patología Ginecológica u obstétrica
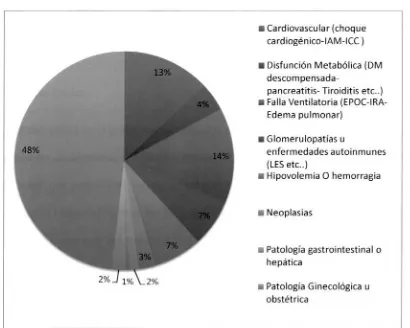
[image:24.578.89.499.233.561.2]Acorde a lo encontrado en la literatura, la sepsis fue el diagnóstico más frecuente en aquellos pacientes que presentaron falla renal aguda en la UCI. Sin embargo, se encontró un grupo heterogéneo de patologías asociadas a disfunción renal aguda, en especial debidas a compromiso cardiovascular (choque cardiogenico, evento coronario agudo, falla cardiaca), y otras de origen pulmonar (EPOC y falla respiratoria aguda). Fig. 1
Fig. 1 Diagnóstico de UCI en pacientes con falla renal aguda
3.2 Indicaciones de terapia de soporte renal
hipercalemia. Otras causas de soporte renal fueron sobrecarga hídrica por edema pulmonar. estado edematoso que no respondió a manejo diurético, elevación de azoados y alteraciones del estado ácido base, específicamente acidosis metabólica. Tabla 4
Tabla 4. Indicaciones de terapia de soporte renal
Oliguria n (%) 49 (25)
Anuria n
(0/0)
33 (17)Hipercalemia n
(%)
32 (16)Sobrecarga hídrica n (%) 30 (15) Elevación de azoados n (% ) 30 (15) Acidosis metabólica n (% ) 25 (13)
3.3 Desenlaces finales
La mortalidad global en la población a estudio fue de 55% (109 pacientes) a los tres meses de seguimiento, la dependencia de diálisis fue de 12% (24 pacientes) y la recuperación de la función renal que permitió el egreso de terapia fue de 34% (66 pacientes). Durante la hospitalización falleció el 94% de los pacientes. lo cual se correlaciona con la severidad de la enfermedad y esto a su vez con los APACHES más elevados; el 6% falleció posterior a la hospitalización.
La recuperación de la función renal se subdividió en 2 grupos, uno con recuperación total de la función renal definida por descenso de la creatinina sérica a su nivel basal o un valor
menor a 1.5 mg/dl.. y el otro dado por recuperación parcial, es decir que no lograron
Tabla 5. Desenlaces finales a tres meses
Total de muertes n (% ) 109 (55)
Intrahospitalarias n (%) 102 (94)
Extra hospitalarias n
(%)
7 (6)Dependencia de diálisis n (% ) 24 (12)
Recuperación de función renal n (1)/0) 66 (34)
Recuperación parcial n (%) 38 (57)
Recuperación total n (%) 28 (43)
3.3.1 Relación con el soporte nutricional
Por último, se buscó establecer la posible relación del momento del inicio de soporte nutricional con la mortalidad de la población que requirió hemodiálisis aguda.
Tabla 6. Tiempo de inicio de nutrición
Menor a 3 días n (%) 84 (42)
3 a 5 días n (%) 61 (31)
Mayor a 5 días n (%) 46 (23)
Sin nutrición n (%) 8 (4)
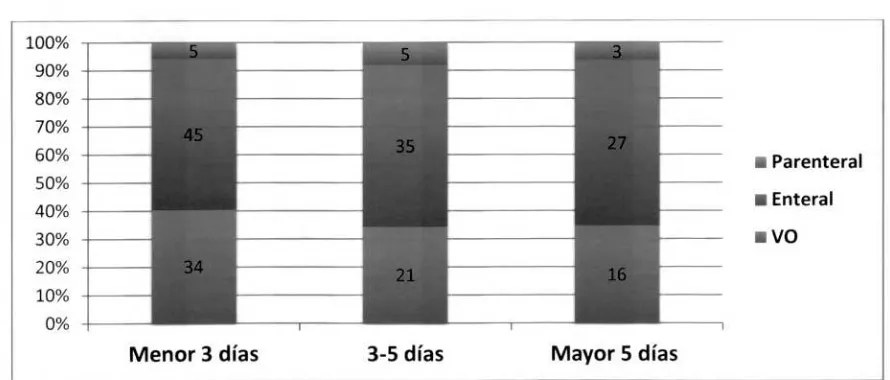
[image:27.588.72.517.489.679.2]La modalidad de soporte nutricional global más utilizada fue la enteral, seguida por la vía oral y en menor porcentaje parenteral; esta tendencia se mantuvo en los diferentes subgrupos en los que se distribuyeron los pacientes de acuerdo al tiempo de inicio, (ver figura 2). Durante las primeras 72 horas, la vía entera] se usó en el 53,5% (45 pacientes), seguida por la vía oral 40.4% (34 pacientes) y por último la nutrición parenteral en 5.9% (5 pacientes). En el grupo comprendido entre el tercer y el quinto día, 57.3% fue entera] (35 pacientes), 34,4% fue vía oral (21 pacientes) y 8,1% parenteral (5 pacientes). En el grupo de inicio tardío (posterior al quinto día) la nutrición por vía enteral fue 58,6% (27 pacientes), vía oral 34,7% (16 pacientes) y vía parenteral 6,5% (3 pacientes). Fig. 2
Fig. 2. Modalidad de inicio de soporte nutricional de acuerdo al tiempo de inicio de nutrición Parenteral Entera] VO 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0%
Recuperación renal
Dependencia de diálisis
63%
n
Muertes0%
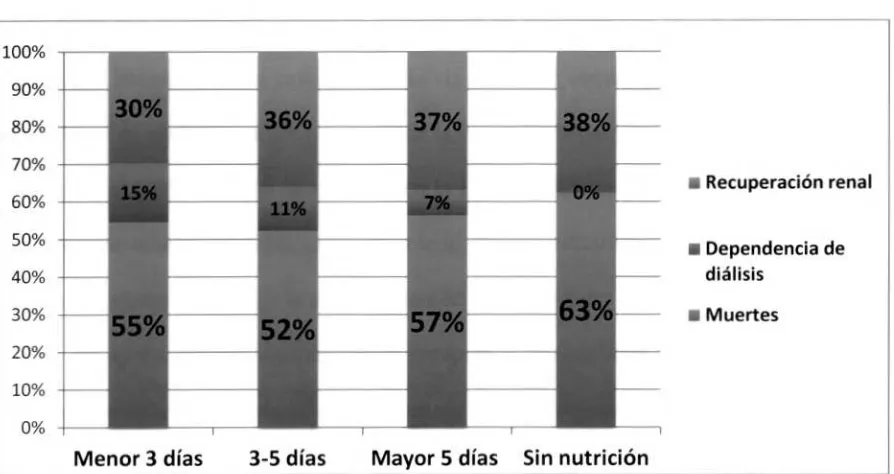
[image:28.567.75.522.453.690.2]Los desenlaces finales de la población tales como mortalidad, dependencia de diálisis y recuperación de la función renal, acorde al tiempo de inicio de nutrición, tuvieron un comportamiento similar en cada uno de los grupos; la población que inició la nutrición durante los tres primeros días mostró una mortalidad de 55% (46 pacientes), la dependencia de diálisis fue de 15% (13 pacientes) y la recuperación de la función renal fue del 30% (25 pacientes). En el grupo correspondiente al periodo entre el tercero y el quinto día de ingreso a UCI la mortalidad fue de 52% (32 pacientes). la dependencia de diálisis 11% (7 pacientes) y la recuperación de la función renal 36% (22 pacientes). En la población a la que se le inició la nutrición después del quinto día de ingreso a la UCI, la mortalidad fue 57% (26 pacientes), la dependencia de diálisis 7% (3 pacientes) y la recuperación de la función renal 37% (17 pacientes). La mortalidad en el grupo de pacientes que no recibió nutrición fue de 63% (5 pacientes), no hubo dependencia de diálisis y la recuperación de la función renal fue del 37% (3 pacientes). Fig. 3
Fig. 3. Desenlaces acorde al tiempo de inicio de nutrición
Capitulo 6
Discusión
En el presente estudio encontramos que la mortalidad de los pacientes que cursan con IRA hospitalizados en la UCI y que requieren hemodiálisis, no varía de acuerdo al tiempo de inicio del soporte nutricional. La mayoría de los pacientes tenían un puntaje APACHE elevado. El soporte nutricional es un apoyo importante dentro del proceso de recuperación. más no se considera como el único factor determinante en la mortalidad; es posible que medidas aplicadas a pacientes críticamente enfermos corno el soporte vasopresor, inicio temprano de antibióticos y manejo de las comorbilidades, contribuyan a modificar los diferentes desenlaces relacionados con la mortalidad y que el apoyo nutricional sea otro eslabón de esta cadena.
función intestinal. En nuestro estudio encontramos que la nutrición parenteral fue la menos utilizada, lo cual se relacionó con un 2 % de pacientes que tenían alguna patología gastrointestinal que hacía imposible iniciar un soporte nutricional enteral u oral.
Bibliografía
Orfeas L, Wald R, O'Bell J, Et al. Epidemiology and Outcomes of Acute Renal Failure in Hospitalized Patients: A National Survey. Clin J Am Soc Nephrol 2006: 1: 43-51.
Uchino S. Kellum J. Bellomo R. Et al Acute Renal Failure in Critical 111 Patients. A multinational, multicenter study. JAMA 2005; 294: No 7: 8313 — 818.
Palevsky PM, Zhang JH, O'Connor TZ, Et al. Intensity of renal support in critically patients with acute kidney injury. N Engl .1 Med. 2008: 359: 7-20.
Joannidis M, Metnitz P; Epidemiology and Natural History of Acute Renal Failure in ICU. Crit Care Clin 2005: 21: 239— 249.
Wiessen P, Van Overmeire L, Delanaye P; Nutrition Disorders 1)uring Acule Renal Failure and Renal Replacement Therapy. JPEN J Parenter Enteral Nutr 2011: 35: 217 222.
Bellomo R. How to feed patients with renal disfunction. Blood purif 2002;20: 296-303.
Gervasio J. Garmon W. Holowatyj M. Nutrition support in acute kidney injury. Nutr Clin Prac 201 1: 26 (4) 374 – 381.
Maursetter L, Kight C, Mennig J, Et al; Review of the mechanism and nutrition recornmendations for patients undergoing continuous renal replacement therapy. Nutr Clin Pract 2011:26 (4) 382 -390
10. Druml W. Kierdor H: Parenteral nutrition in patients with renal failure – Guidelines on parenteral nutrition – Chapter 17. German Medical Science 2009: Vol. 7: 1 -1 1 .
BrovIn R. Compher C. A.S.P.E.N. clinical guidelines: nutrition support in adult acute and chronic renal failure. J Parenter Entera! Nutr 2010; Vol 34 (4): 366-377.
Raj D., Oladipo A., Dominic E., Et al. Amino acid repletion does not decrease muscle protein catabolism during hemodialysis. Am l'hysiol Endocrino! Metate 2007; 292: El 534-1542.
14 Scurlock C., Jayashree R., Mechanick J.; Impact of new technologies on metabolic care in the intensive care unit. Curr Opin Clin Nutr Metab Care 2009, 12:196-200.
Cano N, Aparicio M, Brunori G; Et al. ESPEN Guidelines on Parenteral Nutrition: Adult Renal Failure. Clinical Nutrition 2009; Vol 28, Issue 4: 401-414.
1
Bellomo R, Ronco C, Keil= J, Et al; Acute renal failure — definition, outcome o measures, animal models, Huid therapy and information technology needs: the SecondInternational Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Critical Care: 2004; 8: 204 - 212
Valencia E, Marin A, Hardy G; Nutrition therapy for acute renal failure: a new approach based on 'risk, injury, failure, loss, and end-stage kidney' classification (RIFLE). Curr Opin Clin Nutr Metab Care: 2009; Vol 12: 241-244.
Kalista-Richards M. The Kidney: medical nutrition therapy — Yesterday and Today. Nutr Clin Pract: 2011; Vol 26 (2): 143-150.