UNIVERSIDAD NACIONAL DE TRUJILLO
FACULTAD DE FARMACIA Y BIOQUÍMICA
ESCUELA ACADEMICO PROFESIONAL DE FARMACIA Y BIOQUÍMICA
TESIS II
Equivalencia química de azitromicina 500 mg tabletas dispensado en
hospitales de la ciudad de Trujillo frente al producto innovador
PARA OPTAR EL GRADO ACADÉMICO DE BACHILLER
EN FARMACIA Y BIOQUÍMICA
AUTORES:
JULIÁN DÁVALOS, Madeleyne Makarena VÁSQUEZ MUÑOZ, Arturo Alejandro ASESOR:
Mg. GAMARRA SÁNCHEZ, César Demófilo Trujillo - Perú
A Dios:
Por ser quien nos dio la vida, a él que me ha
dado humildad, paciencia, fortaleza y
bendiciones, por esta a mi lado guiándome en
cada paso y por cada persona maravillosa que
ha puesto en mi camino que han sido mi
soporte y compañía en esta vida. A él le debo
todo lo logrado hasta ahora.
A mis padres:
Jorge Julián y María Dávalos
Por ser los mejores padres que Dios me ha
dado, mis mejores amigos. Gracias por el amor,
sus consejos y la confianza que depositaron en
mí. Que con su trabajo y esfuerzo he logrado
cumplir mis metas, son mi fortaleza cada día de
mi vida.
Los amo.
A mi abuelita
Dora Cabrera
Por todo el cariño y amor que me brindo
mientras que en vida fue, por la confianza y
A Dios, por darnos la vida
salud y múltiples bendiciones
A mis padres:
Por ser mi soporte
Por su paciencia y enseñanzas
A mis hermanos:
Por ser parte fundamental en
AGRADECIMIENTO
A nuestra Alma Mater y a toda la plana docente, especialmente a los docentes de la Facultad
de Farmacia y Bioquímica, quienes nos enseñaron los principios básicos de nuestra
profesión y nos facilitaron las herramientas necesarias para poder desenvolvernos en la vida
profesional.
A nuestro asesor Mg. Gamarra Sánchez Cesar Demófilo docente de la Facultad de
Farmacia y Bioquímica de la Universidad Nacional de Trujillo, a quien mostramos nuestra
gratitud por su dedicación como profesional, incondicional colaboración, paciencia y
apoyo. Por los conocimientos brindados y por guiarnos en cada paso hacia el desarrollo y
culminación de este trabajo.
PRESENTACIÓN
Señores Miembros del Jurado Dictaminador:
Dando cumplimiento a lo establecido por el reglamento de grados y títulos de
la Facultad de Farmacia y Bioquímica de la Universidad Nacional de Trujillo,
nos es grato someter a vuestra consideración y elevado criterio profesional, el
informe de Tesis II intitulado “Equivalencia química de azitromicina 500 mg
tabletas dispensado en hospitales de la ciudad de Trujillo frente al
producto innovador”
De manera muy especial agradecemos la colaboración de los señores miembros
del jurado.
Dejamos a vuestra consideración señores Miembros del Jurado, a respectiva
calificación del presente informe.
Trujillo, Abril del 2019
JURADO DICTAMINADOR
Dra. Olga Caballero Aquiño
Presidente
Mg. Cesar Demófilo Gamarra Sánchez
Miembro
RESUMEN
El objetivo del estudio fue determinar la equivalencia química entre azitromicina 500 mg tabletas que se dispensan en los Hospitales de la ciudad de Trujillo y azitromicina 500 mg tableta innovadora. Se tuvo como materiales deestudio cuatro lotes de producción, tres lotes adquiridos de los Hospitales de Apoyo III de la ciudad de Trujillo y un lote del producto innovador, considerándose para cada lote de producción 20 tabletas de azitromicina de 500mg. Para la cuantificación se utilizó el método espectrofotométrico ultravioleta a 547 nm propuesto por Jayanna B. Los resultados obtenidos fueron expresados en porcentajes prácticos promedio y porcentajes exceso o defecto para azitromicina tabletas dispensadas en el Hospital Victor Lazarte Echegaray, Hospital Regional Docente de Trujillo, Hospital Belén de Trujillo y el producto innovador, siendo 93.88%, 82.85%, 85.42%, 109.58% y 6.12%, -17.15%, -14.58%, 9.58% respectivamente estando sólo los valores del Hospital Victor Lazarte Echegaray y el producto innovador dentro de los rangos establecidos por la USP 41, la cual estipula que el contenido de principio activo de azitromicina en tabletas deben encontrarse entre el 90% y el 110% de lo declarado por el fabricante. Concluyendo que las tabletas de azitromicina dispensadas en el Hospital Victor Lazarte Echegaray frente al innovador son equivalentes químicos.
Palabras claves: equivalencia química, azitromicina, espectrofotométrico
ABSTRACT
The objective of this study was to determine the chemical equivalence between azithromycin 500 mg tablets that are dispensed in Hospitals of the city of Trujillo and azithromycin 500 mg innovative tablet. Four production batches were taken as study materials, three batches acquired from the Hospitals of Support III of the city of Trujillo and a batch of the innovative product, with 20 azithromycin 500 mg tablets being considered for each production batch. For the quantification, the ultraviolet spectrophotometric method at 547 nm proposed by Jayanna B was used. The results obtained were expressed in average practical percentages and percentages of excess or defect for azithromycin tablets dispensed in Victor Lazarte Echegaray Hospital, Regional Docente Hospital of Trujillo, Belen Hospital of Trujillo and the innovative product, being 93.88%, 82.85%, 85.42%, 109.58% and -6.12%, -17.15%, -14.58%, 9.58% respectively, only the values of the Victor Lazarte Echegaray Hospital and the innovative product within the ranges established by USP 41, which stipulates that the active substance content of azithromycin tablets should be between 90% and 110% of what was declared by the manufacturer. Concluding that the azithromycin tablets dispensed in the Victor Lazarte Echegaray Hospital versus the innovator are chemical equivalents.
Keywords: chemical equivalence, azithromycin, spectrophotometric
INDICE
RESUMEN………I
ABSTRACT……….II
I.
INTRODUCCION……….1
II.
MATERIAL Y MÉTODO………6
III.
RESULTADOS……….10
IV.
DISCUSION………..13
V.
CONCLUSIONES……… 16
VI.
RECOMENDACIONES………...17
VII.
REFERENCIAS BIBLIOGRÁFICAS……….18
1
I.
INTRODUCCIÓN
La industria farmacéutica, como eje fundamental del sistema de asistencia de la salud, conduce la investigación, fabricación y comercialización de productos farmacéuticos y biológicos, así como dispositivos médicos usados para el tratamiento agudo o crónico y el diagnóstico de la enfermedad en la población. En la fabricación de los productos farmacéuticos, así como de todos los productos relacionados en el campo de la salud, es indispensable y de vital importancia realizar un control de los procesos de la producción aplicando normas establecidas a fin de garantizar al consumidor que los productos que recibe son de buena calidad1,2.
La calidad de todos los productos farmacéuticos es un factor importante para asegurar la pronta recuperación de la salud del paciente. En muchos países en desarrollo se buscan alternativas para disminuir los costos del tratamiento de las enfermedades garantizando la eficacia de los medicamentos usados3.
2
plazo y su real efectividad en la práctica clínica, ya que los ensayos clínicos suelen realizarse en condiciones ideales y específicas4,5.
Es importante determinar la eficacia de los medicamentos multifuente con relación a los productos innovadores ya que existe entre ellos importante diferencia económica, lo que trasciende en la accesibilidad de muchos de los pacientes. Tratar a los pacientes con medicamentos de mala calidad determina una baja biodisponibilidad y una infradosificación del fármaco6.
El uso de medicamentos ineficaces y de mala calidad puede acarrear fracasos terapéuticos, agravamiento de las enfermedades, farmacorresistencias y, en muchas ocasiones, la muerte de pacientes. Ante ello, los estudios de bioequivalencia y equivalencia química serán de vital importancia en la mejora de los controles de calidad de los medicamentos realizado por las industrias farmacéuticas7, 8.
La Administración de Alimentos y Medicamentos (FDA) asume la equivalencia terapéutica cuando dos preparados son equivalentes farmacéuticos, tienen el mismo efecto terapéutico, son bioequivalentes y han sido fabricados cumpliendo sus normas vigentes de buena práctica de fabricación9.
3
Por ende, es deber del Estado, como responsable de la salud pública, velar por la calidad y el uso adecuado de los medicamentos, debiendo para ello establecer directivas y/o las normativas correspondientes que aseguren el uso seguro y eficaz de los medicamentos2. Un reciente estudio de la evaluación de la calidad de los productos farmacéuticos y afines pesquisados por DIGEMID se encontró un resultado no conforme crítico del 17%. De las pesquisas realizadas 45% fueron medicamentos de marca, 30% medicamentos genéricos, 10% material médico y 9% cosméticos. Estos resultados siguen siendo preocupantes pues muchos de estos medicamentos fueron y son pesquisados en Direcciones regionales de salud y que posteriormente son distribuidos a diferentes hospitales11.
Por otro lado, en el Perú la adquisición de medicamentos depende del Ministerio de Salud (MINSA), azitromicina tabletas junto con otras especialidades farmacéuticas son incluidas dentro el listado de medicamentos esenciales y de esta forma, sujetos a compras corporativas anuales, que son distribuidos en los distintos hospitales y centros asistenciales6.
La azitromicina pertenece a la clase de antibióticos macrólidos. Los antibióticos macrólidos son medicamentos bacteriostáticos que inhiben la síntesis de proteína mediante la unión reversible con las subunidades ribosómicas 50S de los microorganismos sensibles en o muy cerca del sitio para unión del cloranfenicol12.
4
antibiótico de primera línea en pacientes con Diarrea Aguda Infecciosa por Vibrio cholerae. Su espectro de actividad, mecanismo de acción y aplicaciones clínicas son similares a los de la claritromicina. La azitromicina es activa contra el complejo M. avium y T. gondii; es un poco menos activa que la eritromicina y la claritromicina contra los estafilococos y estreptococos, y ligeramente más activa contra H. influenzae; tiene actividad elevada contra especies de Chlamydia13,14.
La azitromicina se absorbe con rapidez y se tolera bien por vía oral; debe administrarse 1 h antes o 2 h después de las comidas. Los antiácidos de aluminio y magnesio no alteran la biodisponibilidad, pero retardan la absorción y disminuyen la concentración sérica máxima. Puesto que tiene un anillo de lactona de 15 miembros (no de 14), la azitromicina no inactiva a las enzimas del citocromo P450 y, por lo tanto, carece de las interacciones farmacológicas que ocurren con la eritromicina y la claritromicina12.
5
A partir de esta información nos planteamos el siguiente problema:
¿Tendrá azitromicina 500 mg tableta dispensada en Hospitales de la ciudad de Trujillo equivalencia química frente a azitromicina 500 mg tableta innovadora?
Hipótesis:
Azitromicina 500 mg tableta dispensada de Hospitales de la ciudad de Trujillo presenta equivalencia química frente a azitromicina 500 mg tableta innovadora.
Objetivo general
Determinar la equivalencia química entre azitromicina 500 mg tabletas que se dispensan en los Hospitales de la ciudad de Trujillo y azitromicina 500 mg tableta innovadora. Objetivo específico
6
II.
MÉTODO
2.1Material y Métodos 2.1.1. Material de estudio
El presente estudio de investigación tuvo como materiales de estudio cuatro lotes de producción de diferentes laboratorios, considerándose para cada lote de producción 20 tabletas de azitromicina de 500mg. Las muestras fueron adquiridas en las farmacias de los hospitales de apoyo III de la ciudad de Trujillo en el mes de enero del 2019.
Recolección de material de experimentación: se recolectaron en cuatro diferentes farmacias:
- Azitromicina 500 mg tableta adquirida en el Hospital Regional Docente de Trujillo (MINSA)
Lote: L807170605
Fecha de vencimiento: 06/2019
Titular de Registro Sanitario: LABOT S.A
Laboratorio: Laboratorio farmacéutico de procedencia China
- Azitromicina 500 mg tableta adquirida en el Hospital Belén de Trujillo(MINSA)
Lote: L807170601
Fecha de vencimiento: 06/2019
Titular de Registro Sanitario: LABOT S.A
7
- Azitromicina 500 mg tableta adquirida en el Hospital Víctor Lazarte Echegaray (ESSALUD)
Lote: L807170803
Fecha de vencimiento: 08/2019
Titular de Registro Sanitario: LABOT S.A
Laboratorio: Laboratorio farmacéutico de procedencia China
- Azitromicina 500 mg tableta (ZITROMAX) adquirida en un establecimiento farmacéutico privado: INNOVADOR
Lote: 1605172C
Fecha de vencimiento: 11/2021
Titular de Registro Sanitario: PFIZER S.A. PERÚ
Laboratorio: PFIZER S.A. MÉXICO
2.2.2. Método
1.1.1. Análisis cuantitativo de Azitromicina en las formulaciones farmacéuticas Se prepararon diluciones de cada una de las formulaciones de azitromicina en estudio. Luego se obtuvieron las absorbancias de cada uno de ellos en el espectrofotómetro UV-Visible15.
1.1.2. Cuantificación de azitromicina en las formulaciones farmacéuticas multifuente e innovadora:
Obtención de la curva de calibración
Método espectrofotométrico ultravioleta. El método se basó en la reducción de permanganato de potasio en medio alcalino con azitromicina. El permanganato
8
se decolora a medida que se reduce cuantitativamente a dióxido de manganeso en solución alcalina con azitromicina15.
Solución madre estándar: Se preparó una solución madre estándar de azitromicina (200 µg/mL) pesando y disolviendo con precisión 20 mg de azitromicina en agua destilada y diluyendo a 100 mL15.
Solución de permanganato de potasio: Se preparó permanganato de potasio (0.0012 mol/L) disolviendo 0.02 g de permanganato de potasio en agua destilada y se diluirá hasta 100 mL15.
Solución de carbonato de potasio (Medio alcalino): Se preparó carbonato de potasio (0.1 mol/L) disolviendo 1.3831 g de carbonato de potasio en agua destilada y se diluyó a 100 mL15.
9
Cuantificación de azitromicina en las muestras
Para el análisis de cada formulación, se pesaron con precisión 20 tabletas de azitromicina y se determinaron el peso promedio. Las tabletas se pulverizaron y el polvo equivalente a 10 mg se pesó con precisión y se disolvió en agua. El residuo se filtró a través de papel filtro Whatman No. 41 en una fiola de 100 mL. El residuo se lavó con agua destilada y los lavados se añadieron al filtrado. El volumen final de filtrado se completó con agua destilada y se analizó de acuerdo con el procedimiento recomendado15.
Análisis estadístico
10
III.
RESULTADOS
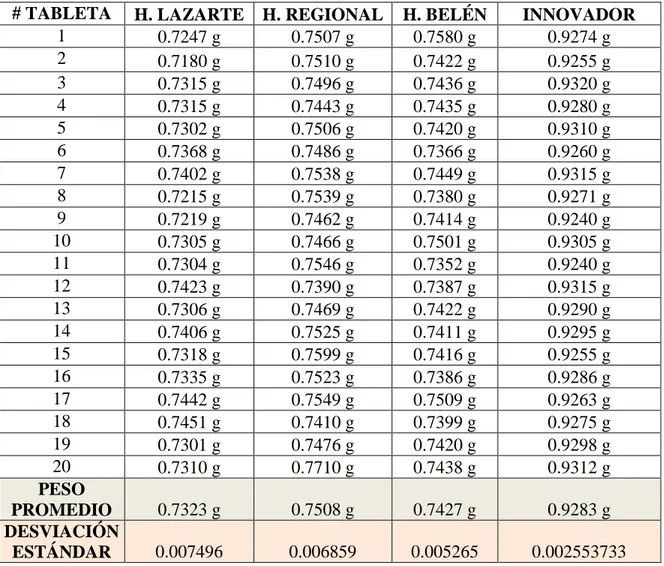
TABLA N°1: PESO PROMEDIO DE AZITROMICINA 500 mg TABLETAS DISPENSADAS EN HOSPITALES DE APOYO III DE LA CIUDAD DE TRUJILLO Y AZITROMICINA 500 mg TABLETA INNOVADORA
N° TABLETAS ESTABLECIMIENTO N° LOTE LABORATORIO PESO PROMEDIO 20 Hospital Víctor Lazarte
Echegaray
L807170803 Laboratorio farmacéutico de procedencia China
732.3 mg
20 Hospital Regional Docente de Trujillo
L807170605 Laboratorio farmacéutico de procedencia China
750.8 mg
20 Hospital Belén de Trujillo L807170601 Laboratorio farmacéutico de procedencia China
742.7 mg
20 Establecimiento privado (INNOVADOR)
11
TABLA N°2: CONCENTRACIÓN PROMEDIO, PORCENTAJE PRÁCTICO, EXCESO O DEFECTO DE AZITROMICINA EN TABLETAS DISPENSADAS EN HOSPITALES DE APOYO III DE LA CIUDAD DE
TRUJILLO Y AZITROMICINA TABLETA INNOVADORA
ESTABLECIMIENTO CONCENTRACIÓN DE AZITROMICINA DECLARADA (mg) CONCENTRACIÓN PROMEDIO DE AZITROMICINA ENCONTRADA (mg) PORCENTAJE PRÁCTICO (%) PORCENTAJE EXCESO DEFECTO
Hospital Víctor Lazarte Echegaray
500 469.38 93.88 6.12
Hospital Regional Docente de Trujillo(*)
500 414.27 82.85 17.15
Hospital Belén de Trujillo(*)
500 427.12 85.42 14.58
Establecimiento privado (INNOVADOR)
500 547.88 109.58 9.58
12
FIGURA N°1: PORCENTAJE DE LA CANTIDAD DE AZITROMICINA CONTENIDA EN LAS TABLETAS ADQUIRIDAS EN HOSPITALES DE APOYO III DE LA CIUDAD DE TRUJILLO Y AZITROMICINA TABLETA
INNOVADORA
Fuente: Tabla N°2 0 20 40 60 80 100 120 Hospital Víctor Lazarte Echegaray Hospital Regional Docente de Trujillo
13
IV. DISCUSIÓN
El presente trabajo de investigación de equivalencia química de azitromicina tabletas se realizó mediante la cuantificación del principio activo en diferentes muestras de Hospitales de Apoyo III de la ciudad de Trujillo y el producto innovador. El método que se ha utilizado para este fin es la espectrofotometría ultravioleta visible, que consiste en un método sencillo, rápido y menos costoso en comparación con la cromatografía líquida de alto rendimiento (HPLC). Actualmente, en el Perú, no se exige evidenciar la equivalencia química y terapéutica para los medicamentos que pretendan la obtención del registro sanitario, realizándose solamente la vigilancia sanitaria a través de control de calidad post obtención del registro sanitario a través de pesquisas rutinarias15,16.
14
rotulados de las tabletas dispensadas en el Perú no consignan dicho peso sino sólo la concentración del principio activo es de carácter obligatorio, no es posible realizar una aseveración correcta. Por otro lado, con el peso promedio de cada formulación será posible realizar el cálculo de principio activo en las tabletas17,18.
En la Tabla N°2 se muestran las concentraciones del principio activo halladas en las formulaciones de azitromicina tabletas adquiridas en los Hospitales Víctor Lazarte Echegaray, Hospital Regional Docente y Hospital Belén de Trujillo y el producto innovador adquirido en un establecimiento farmacéutico privado, que alcanzan como promedio 469.38 mg, 414.27 mg, 427.12 mg y 547.88 mg, respectivamente lo que deriva en un porcentaje practico de 93.88%, 82.85%, 85.42% y 109.58% respectivamente (Figura N°1). De estos resultados, los valores que se encuentran dentro del rango establecidos por la USP 41 son las tabletas de azitromicina adquiridas en el Hospital Víctor Lazarte Echegaray y el producto innovador, la cual estipula que el contenido de principio activo de azitromicina en tabletas puede encontrarse entre el 90% y el 110% de lo que declara el fabricante. Como es de suponer los laboratorios de producción tienden a colocar en sus formas farmacéuticas una cantidad de principio activo que permita cumplir con lo estipulado19,20.
15
junio del 2019 a diferencia del lote del Hospital Victor Lazarte Echegaray(L807170803) la cual posee una fecha de vencimiento de agosto del 2019, sin embargo esta también se encuentra en el límite inferior del rango estipulado por lo que aparentemente hay una pérdida en el tiempo del principio activo en los lotes mencionados. Por otro lado, estudios realizados consideran que pueden existir errores sistemáticos en la cuantificación que pueden proceder de la precisión del método; recordemos que la metodología usada a pesar de ser más sencilla (en comparación con el método de HPLC) puede adolecer de cierta precisión. También el error puede deberse al manejo de las soluciones y del equipo por parte del operador21,22.
16
V. CONCLUSIONES
1.- Las tabletas de azitromicina 500 mg dispensadas en el Hospital Victor Lazarte Echegaray y el producto innovador son equivalentes químicos entre sí.
2.- Las tabletas de azitromicina dispensadas en el Hospital Victor Lazarte Echegaray y el producto innovador, contienen en promedio 93.88% y 109.58% de principio activo respectivamente y cumplen con el rango de aceptación propuesto por la USP.
17
VI.
RECOMENDACIONES
18
VII. REFERENCIAS BIBLIOGRÁFICAS
1. Gennaro A. Remington Farmacia. 20° ed. Buenos Aires: Ed. Médica Panamericana; 2003. p. 1137.
2. DIGEMID. Mercado Farmacéutico y acceso a Medicamentos en el Perú. Perú; 2016. p.17-18.
3. Ramos G, Olivares G.Guía para las buenas Practicas de Prescripción. Ministerio de Salud de Chile. Chile; 2010. p.4-6.
4. Vásquez H, Salas S, Figueroa L, Gutiérrez S. Eficacia y seguridad en la nueva regulación de productos farmacéuticos en el Perú. Rev. perú. med. exp. salud pública [Revista en Internet]. 2012; vol. 29 (4): 545-547. [Fecha de acceso: 7 de noviembre del 2018]. Disponible en:
http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-46342012000400020
5. OMS. Assessing national medicines regulatory systems. Geneva: WHO; 2012 [Fecha de acceso: 7 de noviembre del 2018]. Disponible en:
http://www.who.int/medicines/areas/quality_safety/regulation_legisla-tion/assesment/en/index.html
19
7. Laosa O, Guerra P, López J. Estudios de bioequivalencia: la necesidad de establecer la fiabilidad de los medicamentos genéricos. Rev. Perú. med. exp. Salud pública. [Revista en Internet]; 2009.Vol. 26(4): 553-555. [Fecha de acceso: 7 de noviembre
del 2018]. Disponible en:
http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-46342009000400019
8. Campos V, Valverde G. Equivalencia química de tabletas de paracetamol de dos formulaciones multifuente frente al producto innovador. [Tesis tipo II para obtar el grado de Bachiller en Farmacia y Bioquímica]. Universidad Nacional de Trujillo; 2010.
9. Montañes B. Sustitución y Selección de Equivalentes Terapéuticos. Farm Hosp [Revista en Internet]; 1996. Vol. 20 (6): 351-358. [Fecha de acceso: 9 de noviembre
del 2018]. Disponible en:
http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-46342009000400019
10.Volonté M, Escales M, Gorriti C. Equivalencia Farmacéutica de comprimidos conteniendo Clorhidrato de Propranolol. Acta Farm. Bonaerense. [Revista en Internet]; 2005. Vol. 24 (4): 538-42. [Fecha de acceso: 9 de noviembre del 2018].
Disponible en:
http://www.latamjpharm.org/trabajos/24/4/LAJOP_24_4_1_8_LM56A5T2FQ.pdf 11.Coral M, Juarez J, Bravo G. Calidad de productos farmacéuticos y afines en el Perú
20
[Fecha de acceso: 30 de noviembre del 2018] Disponible en: http://revistasinvestigacion.unmsm.edu.pe/index.php/farma/article/view/3378/4502 12.García J, Fernandez L. Usos clínicos de los Macrólidos. Universidad Autónoma de
México. 2013. p.6-12
13.Panpanich R, Lerttrakarnnon P, Laopaiboon M. Azitromicina para el tratamiento de infecciones del tracto respiratorio inferior; 2008. Vol.3 (1). [Fecha de acceso: 9 de noviembre del 2018]. Disponible en: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001954.pub4/epdf /full
14.Gonzales C, Bada C, Rojas R, Barnaola A. Guía de práctica clínica sobre el diagnóstico y tratamiento de la diarrea aguda infecciosa en pediatría Perú – 2011. Rev. Gastroenterol [Revista en Internet]. Perú. Vol. 31(3): 258-277. Disponible en:
http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1022-51292011000300009
15.Jayanna B, Nagendrappa G, Gowda N. Spectrophotometric Estimation of Azithromycin in Tablets. Indian J. Pharm. Sci. [Revista en Internet]; 2012, vol. 74 (4): 365-367. [Fecha de acceso: 9 de noviembre del 2018]. Disponible en: http://www.ijpsonline.com/articles/spectrophotometric-estimation-of-azithromycin-in-tablets.pdf
16.Huayanay L. Bioequivalencia en medicamentos.Rev Med Hered [Revista en Internet];
2012, vol. 23(4):221-222 [Fecha de acceso: 10 de marzo del 2019]. Disponible en:
21
17.Farmacopea BP 2019. British Pharmacopeia. British Pharmacopoeia Commission Laboratory. 2019
18.MINSA. Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmaceúticos, Dispositivos Médicos y Productos sanitarios. DIGEMID. 2011. 19.Moncayo V, Muñera L. Fundamentos de Química Analítica. Colombia: Universidad
Nacional de Colombia. 2002. pp.829-830
20.Farmacopea USP 41. The United States Pharmacopeial Convention. 2018.
21.Gallardo C, Rojas J, Flórez O. La temperatura cinética media en los estudios de estabilidad a largo plazo y almacenamiento de los medicamentos. Revista Vitae [Revista en Internet]. 2004, vol. 11 (1): 67-72. [Fecha de acceso: 10 de marzo de 2019]. Disponible en: http://www.redalyc.org/pdf/1698/169818259009.pdf
22.Cardozo M. Programa de detección de fallas de calidad en los medicamentos comercializados. Revista Panamericana de Salud Pública [Revista en Internet].1999, vol. 6(3): 211-214 [Fecha de acceso: 10 de marzo de 2019]. Disponible en: https://scielosp.org/article/rpsp/1999.v6n3/211-214/es/
23.Santos H. Análisis de los expedientes sobre medicamentes genéricos. Agencia española del medicamento: Período 2000-2002. Departamento de Farmacia y Tecnología Farmacéutica Madrid, 2004 [Fecha de acceso: 10 de marzo de 2019] Disponible en: http://www.ucm.es/BUCM/tesis/far/ucm-t28222.pdf
22
VIII. ANEXOS ANEXO N°1
TABLA N°3: CONCENTRACIONES DE ESTÁNDAR DE AZITROMICINA Estándar Alícuotas (mL) Concentración de
Azitromicina (μg/mL)
Absorbancias
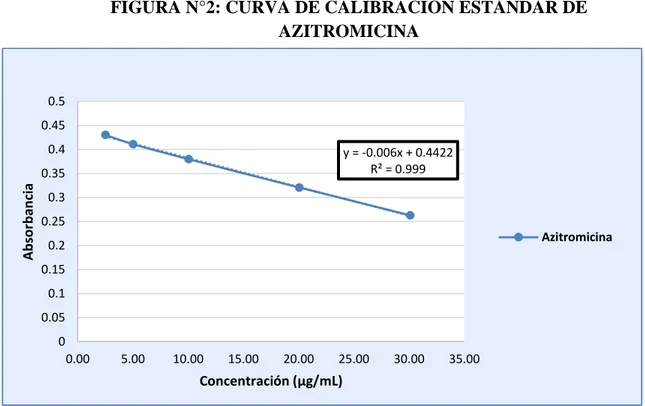
I 0.1 2.51 0.43027
II 0.3 5.02 0.41089
III 0.5 10.03 0.37969
IV 1.0 20.07 0.32069
V 1.5 30.10 0.26279
FIGURA N°2: CURVA DE CALIBRACIÓN ESTÁNDAR DE AZITROMICINA
Fuente: Tabla N°1
y = -0.006x + 0.4422 R² = 0.999
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.5
0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00
23
ANEXO N°2 ANALISIS ANOVA - Análisis de varianza de un factor RESUMEN
Grupos Cuenta Suma Promedio Varianza
LAZARTE 3 1408.1415 469.3805 1125.941 BELEN 3 1281.3653 427.12178 6332.933 REGIONAL 3 1242.8179 414.27263 713.1687 INNOVADOR 3 1643.6566 547.88554 1130.116
Origen de las variaciones Suma de cuadrados Grados de libertad Promedio de
los cuadrados F Probabilidad
Valor crítico para F
Entre grupos 32690.34 3 10896.779 4.68569 0.03585 4.066181 Dentro de los
grupos 18604.32 8 2325.5398
Total 51294.66 11
PRUEBA HSD DE TUKEY
LAZARTE BELEN REGIONAL INNOVADOR LAZARTE 42.25872 -55.107867 78.50504474
BELEN -38.547436 120.7637658
REGIONAL -133.612911
24
ANEXO N°3
TABLA N°4: PESOS DE AZITROMICINA 500 mg TABLETAS DISPENSADAS EN HOSPITALES DE LA CIUDAD DE TRUJILLO Y AZITROMICINA 500 mg
TABLETA INNOVADORA
# TABLETA H. LAZARTE H. REGIONAL H. BELÉN INNOVADOR 1 0.7247 g 0.7507 g 0.7580 g 0.9274 g 2 0.7180 g 0.7510 g 0.7422 g 0.9255 g 3 0.7315 g 0.7496 g 0.7436 g 0.9320 g 4 0.7315 g 0.7443 g 0.7435 g 0.9280 g 5 0.7302 g 0.7506 g 0.7420 g 0.9310 g 6 0.7368 g 0.7486 g 0.7366 g 0.9260 g 7 0.7402 g 0.7538 g 0.7449 g 0.9315 g 8 0.7215 g 0.7539 g 0.7380 g 0.9271 g 9 0.7219 g 0.7462 g 0.7414 g 0.9240 g 10 0.7305 g 0.7466 g 0.7501 g 0.9305 g 11 0.7304 g 0.7546 g 0.7352 g 0.9240 g 12 0.7423 g 0.7390 g 0.7387 g 0.9315 g 13 0.7306 g 0.7469 g 0.7422 g 0.9290 g 14 0.7406 g 0.7525 g 0.7411 g 0.9295 g 15 0.7318 g 0.7599 g 0.7416 g 0.9255 g 16 0.7335 g 0.7523 g 0.7386 g 0.9286 g 17 0.7442 g 0.7549 g 0.7509 g 0.9263 g 18 0.7451 g 0.7410 g 0.7399 g 0.9275 g 19 0.7301 g 0.7476 g 0.7420 g 0.9298 g 20 0.7310 g 0.7710 g 0.7438 g 0.9312 g PESO
PROMEDIO 0.7323 g 0.7508 g 0.7427 g 0.9283 g DESVIACIÓN
25
ANEXO N°4 Reacción química
+ 2 MnO4 - + 4 H2O
+ 2 MnO2 + 8 OH -Medio básico
Azitromicina