Análisis y simulación de un reactor de lecho fijo de naringinasa inmovilizada en vidrio poroso
Texto completo
(2) AGUSTÍN MIÑANA AZNAR, P r o f e s o r T i t u l a r , Director d e l Departamento de Química y JOSÉ LUIS IBORRA PASTOR, Catedrático Numerario , Director del Departamento de Bioquímica de l a F a c u l t a d de C i e n c i a s (Químicas y Matemáticas) de l a U n i v e r s i dad de M u r c i a .. CERTIFICAMOS :. Que esta. e l trabajo contenido en Memoria bajo e l título:. ANÁLISIS. Y. SIMULACIÓN. DE. UN. REACTOR DE LECHO FIJO DE NARINGINA SA INMOVILIZADA EN VIDRIO POROSO que para optar a l grado de Doctor en Ciencias, Sección de Químicas, p r e s e n t a D9 J o s e f a B a s t i d a Rodríguez ha s i d o r e a l i z a do en e s t o s Departamentos b a j o la dirección de l o s Doctores A n t o n i o Bódalo Santoyo y Arturo Manjón Rubio. Y. para. efectos. que. conste. a. oportunos expedimos. los el. p r e s e n t e c e r t i f i c a d o en M u r c i a , Septiembre. Agustín Miñana Aznar D i r e c t o r d e l Departamento de Química Técnica. de. 1.985. J.Luis Iborra Pastor D i r e c t o r d e l Departamento de Bioquímica.
(3) T r a b a j o presentado para o p t a r a l Grado de Doctor en C i e n c i a s , Se£ ción de Químicas.. M u r c i a , 10 de Septiembre. de. 1.985. Josefa B a s t i d a Rodriguez L i c e n c i a d a en C i e n c i a s Químicas. V i s a d o en M u r c i a a 10 de Septiembre. de I . 9 8 5. LOS DIRECTORES. A n t o n i o Bódalo Santoyo. A r t u r o Manjón Rubio. P r o f . T i t u l a r de Ingeniería. P r o f . T i t u l a r de Bioquímica. Química de l a U n i v e r s i d a d /. de l a U n i v e r s i d a d de M u r c i a. de M u r c i a ..
(4) E l presente t r a b a j o ha s i d o subvencionado, en p a r t e , por e l p r o y e c t o n^ I 5 I O / 8 2 de l a Comisión Asesora de Investigación Científica y Técnica. Asimismo, l a f i r m a n t e de l a Memoria es b e c a r i a d e l c i t a d o p r o y e c t o . También se ha r e c i b i d o una ayuda d e l Convenio C a j a de Ahorros P r o v i n c i a l - U n i v e r s i dad de M u r c i a . A ambas i n s t i t u c i o n e s se l e agradece l a s ayudas p r e s t a d a s . Parte expresan. en. esta. de. los. Memoria. resultados. han. sido. que. se. publicados. en l a s s i g u i e n t e s r e v i s t a s : Analytical v o l . 149,. Biochemistry. (1985). nS 1. Biotechnology L e t t e r s (I985) v o l . 7,. ne 7 ,. 477-483. y están p e n d i e n t e s de publicación en: Biotechnology. and. Bioengineering. Enzyme and M i c r o b i a l Technology Además, han dado l u g a r a l a s s i g u i e n t e s comunicaciones. a Congresos y Reuniones:. XI Congreso. Nacional. de l a Sociedad. Española de Bioquímica 32 Congreso Mediterráneo ría Química.. de I n g e n i e -.
(5) En primer lugar, deseo expresar mi más profundo agradecimiento a l o s Profs. Drs. Antonio Bódalo Santoyo y Arturo Manjón Rubio, d i r e c t o r e s de e s t e t r a b a j o , por l a s enseñanzas, estímulos y ayudas con l a s que me a l e n t a r o n en todo momento. Al Prof. Dr. José Luis Gómez Carrasco, mi reconocimiento por e l esfuerzo que desinteresadamente ha desplegado para l a elaboración d e l t r a b a j o . Al Pastor,. por. su. Prof.. Dr.. oportuna. José. Luis. colaboración. Iborra en. los. momentos más n e c e s a r i o s . A. la. Profa.. Gómez, por l a amistad. e. Dra.. Elisa. inestimable. Gómez. apoyo. que. siempre me ha f a c i l i t a d o . A l o s Licenciados Carmen Romero y A l f o n s o Gimeno por s u ayuda en l a realización de l a p a r t e e x p e r i m e n t a l . A Mariano T a r i y demás compañeros de l o s Departamentos de Química Técnica y Bioquímica por t a n t a s h o r a s de t r a b a j o c o m p a r t i d o . Por a l a empresa. Zoster. último,. mi. agradecimiento. S.A. y a l Centro. de. Proceso. de Datos de e s t a U n i v e r s i d a d p o r su colaboración..
(6) E l r u b o r que a f l o r a n d o , queda siempre inerme a l b r o t e d e l e s f u e r z o ya doblado, nos pone en situación de e s p e r a no r e s u e l t a . Y, por t a n t o , con l a esperanza de que e l después ha de alcanzarse. ALANO. A mi madre. A mamá-Carmen..
(7) ÍNDICE.
(8) ÍNDICE. 1.. INTRODUCCIÓN Y O B J E T I V O S. 2.. ANTECEDENTES 2.1.. La n a r i n g i n a , f l a v o n o i d e d e l amargor. responsable. en cítricos. 2.2.. Actuación de l a enzima n a r i n g i n a s a .. 2.3.. Extracción y purificación. 2.4*. Propiedades. 2.5.. Métodos de medida de l a a c t i v i d a d catalítica. 2.6.. Naringinasa. 2.7.. Difusión y reacción en s i s t e m a s. inmovilizada. enzimas i n m o v i l i z a d a s. de.
(9) 2.8.. Diseño y simulación de r e a c t o r e s en p r o c e s o s con enzimas i n m o v i l i zadas. MATERIALES Y MÉTODOS 3.1.. Materiales. 3.2.. Métodos 3.2.1.. Determinación de proteína. 3.2.2.. Determinación de l a masa molec u l a r de l a n a r i n g i n a s a por HPLC. 3.2.3.. E s p e c t r o s de absorción de p-nitrofenol y p-nitrofenil-. 3.2.4.. -L-ramnósido. A b s o r t i v i d a d e s molares de nar i n g i n a y prunina. 3.2.5.. Inmovilización de n a r i n g i n a s a .. 3.2.5.1.. En d e r i v a d o s. aminoa-. rílicos 3.2.5.2.. En d e r i v a d o s aldehídicos. 3.2.5.3.. En d e r i v a d o s. tiólicos. 3.2.5.4.. En d e r i v a d o s. aminados.
(10) 3.2.6.. Medida de a c t i v i d a d enzimática 3.2.6.1.. Con p - n i t r o f e n i l - o : -L-ramnósido como sustrato. 3.2.6.2.. Con n a r i n g i n a como sustrato. 3.2.7.. Obtención de l o s v a l o r e s de conversión en un r e a c t o r t u b u l a r ... 3.2.8.. Obtención y purificación de prunina. RESULTADOS EXPERIMENTALES Y DISCUSIÓN 4.1.. Cromatografía líquido-líquido de a l t a resolución de n a r i n g i n a s a . Determinación de l a masa m o l e c u l a r . C r i t e r i o de pureza. 4.2.. Métodos de medida de l a a c t i v i d a d. ü! -. -ramnosidasa de n a r i n g i n a s a 4.3.. Inmovilización y p r o p i e d a d e s de n a r i n g i n a s a i n m o v i l i z a d a. generales. 4.3.1.. Inmovilización en v i d r i o poroso.. 4.3.2.. E s t a b i l i d a d a l almacenamiento y operacional d e l derivado i n -.
(11) 4.3.3'. 4.3.4«. 4.4.. Variación de l a a c t i v i d a d con l a concentración de enzima Determinación de l a s c o n d i c i o nes óptimas de actuación de l a enzima. 110. Determinación de l o s parámetros cinéticos de n a r i n g i n a s a. 4 . 5.. 104. II8. E s t u d i o s de inhibición. 135. 4.5-1«. Inhibición por p - n i t r o f e n o l ..... 137. 4.5.2.. Inhibición por ramnosa. 139. 4.5.3'. Inhibición por g l u c o s a. 145. 4.5.3.. Inhibición por p r u n i n a. y narin-. genina 4.6.. 4.7.. Determinación de l a conversión de e q u i librio. 155. 159. R e s u l t a d o s d e l r e a c t o r de l e c h o f i j o con naringinasa inmovilizada 4.7.1.. S u s t r a t o sintético p - n i t r o f e n i l -0¿-L-ramnósido. 4.7.2.. I6I. Sustrato natural naringina. I6I 162.
(12) 5.. DESARROLLO TEÓRICO. 5.1.. 166. Difusión y reacción en partículas esfér i c a s porosas 5.1.1.. Ecuaciones d i f e r e n c i a l e s d e l proceso. 5.1.2.. F a c t o r de e f i c a c i a. 5.1.3.. Aplicación d e l modelo a procesos. 174. enzimáticos r e v e r s i b l e s , t i p o M i c h a e l i s - M e n t e n y con inhibición c o m p e t i t i v a por producto 5.1.4.. Resolución de l a ecuación d i f e rencial. 5.1.5.. 5.2.. 175. 181. R e s u l t a d o s p r o d u c i d o s por e l modelo y discusión de l o s mismos . I86. Diseño y simulación de r e a c t o r e s de l e cho f i j o para s i s t e m a s con enzimas inmov i l i z a d a s en partículas esféricas. I97. 5.2.1.. Ecuación de diseño. 197. 5.2.2.. Integración de l a ecuación de. 5.2.3.. diseño d e l r e a c t o r. 203. R e s u l t a d o s y discusión. 205.
(13) 6.. CONTRASTE DEL MODELO. 6.1.. 6.2.. Estimación de d i f u s i v i d a d e s de l o s s u s t r a t o s y productos. 218. Cinética de M i c h a e l i s - M e n t e n r e v e r s i b l e : s u s t r a t o p-nitrofenil--L-ramnósido ... 220 6.2.1.. F a c t o r de e f i c a c i a. 6.2.2.. Conversión de s a l i d a d e l r e a c t o r t u b u l a r de l e c h o f i j o. 6.3«. 215. 221. 225. Cinética de M i c h a e l i s - M e n t e n con i n h i b i ción c o m p e t i t i v a p o r p r o d u c t o : s u s t r a t o naringina. 228. 6.3.1.. F a c t o r de e f i c a c i a. 229. 6.3.2.. Conversión de s a l i d a d e l r e a c t o r t u b u l a r de l e c h o f i j o. 232. 7 . CONCLUSIONES. 241. 8.. BIBLIOGRAFÍA. 249. 9.. NOMENCLATURA. 273.
(14) 10. APÉNDICES. I.. II.. III.. IV.. 280. A l g o r i t m o para l a resolución d e l s i s t e m a de ecuaciones d i f e r e n c i a l e s por e l método de Runge-Kutta. 281. Diagrama de f l u j o d e l programa de ordenador para l a obtención d e l p e r f i l de concentraciones adimensionales y e l f a c t o r de e f i c a c i a. 288. A l g o r i t m o para l a resolución de l a ecuación de diseño d e l r e a c t o r por e l método de Runge-Kutta. 2 96. Diagrama de f l u j o d e l programa de ordenador p a r a l a obtención de l o s p e r f i l e s a x i a l e s de conversión en e l r e a c t o r t u b u l a r de l e c h o f i j o. 301.
(15) 1.- I N T R O D U C C I Ó N Y O B J E T I V O S.
(16) 1.-. INTRODUCCIÓN Y OBJETIVOS. La aplicación de enzimas en i n d u s t r i a s de procesado de cítricos es una práctica de uso c o r r i e n t e en e l d e s a r r o l l o de tecnologías avanzadas. Va d i r i g i d a fundamentalmente a increment a r l a c a l i d a d d e l producto por reducción de su amargor o v i s c o s i d a d , o b i e n a aumentar e l rendimiento en componentes extraibles de l o s mismos para su aplicación p o s t e r i o r .. Los de. compuestos. flavonoides. y. cítricos. amargos. contienen. químicamente. limonoides,. que. dos. tipos. diferentes,. afectan. de. forma. d i s t i n t a a l a c a l i d a d de l o s cítricos y sus productos. derivados.. distribuidos. en. Los todo. flavonoides el. se. fruto,. alcanzando. máxima concentración en e l a l b e d o . por. su parte,. menores jugo.. presentan. proporciones. habiéndose de. se. detectado. que su. en los. l o s cítricos. en. flavonoides,. no. en. de forma. a l sabor amargo t o t a l de un jugo cítrico.. - 2 -. su. Los l i m o n o i d e s ,. presencia. Además, c o n t r i b u y e n. encuentran. l o s sacos minoritaria.
(17) De entre l o s flavonoides, el p r i n c i p a l r e s p o n s a b l e d e l sabor amargo es l a n a r i n g i n a , y su procesado para l i m i t a r su concentración a n i v e l e s moderados se ha realizado por varias técnicas: seleccionando e l fruto, por c o n t r o l de l a presión empleada en l a extracción d e l jugo o por mezcla de diferentes zumos. En l a a c t u a l i d a d , e l uso de hidrólisis enzimática de naringina por n a r i n g i n a s a , constituye un medio de e l i m i n a r e f i c a z m e n t e e l amargor. La adición de l a n a r i n g i n a s a soluble a l o s zumos es un proceso de a l t o c o s t e que i m p l i c a , además, l a adición de componentes extraños a l o s mismos para l o g r a r l a eliminación de l a naringina, sin conseguirlo, a pesar de e l l o , ya que l a a c t i v i d a d enzimática es i n h i b i d a por l o s component e s d e l zumo así como por l o s p r o p i o s p r o d u c t o s de l a hidrólisis. Para s o l v e n t a r l o s problemas inherentes a estas d e s v e n t a j a s , l a utilización de reactores de enzimas inmovilizadas supone un gran avance en l a optimización de l o s p r o c e s o s i n d u s t r i a l e s que conducen a l a obtención de jugos cítricos no amargos. Además, l a utilización de t a l t i p o de d e r i v a d o s permitiría l a r e u t i l i z a ción del biocatalizador, así como un mejor c o n t r o l d e l proceso de desamargado, p o s i b i l i d a d e s ambas que redundarían en una disminución d e l coste g l o b a l d e l proceso.. Sin. embargo,. y. l a abundante bibliografía e x i s t e n t e aplicaciones procesos. de. las. enzimas. i n d u s t r i a l e s , algunas. -. 3. -. a. pesar. sobre. posibles. inmovilizadas de cuyas. de en. referen-.
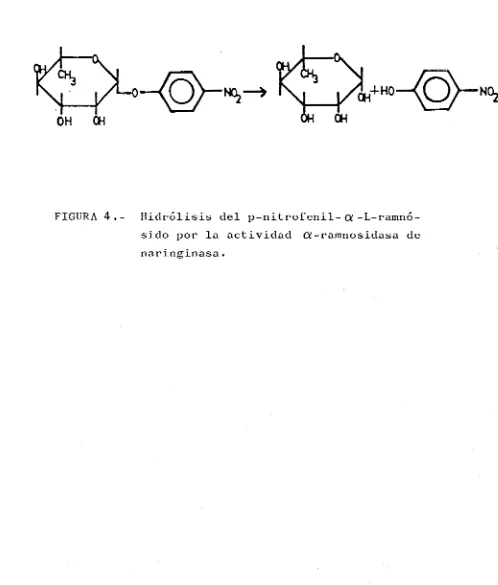
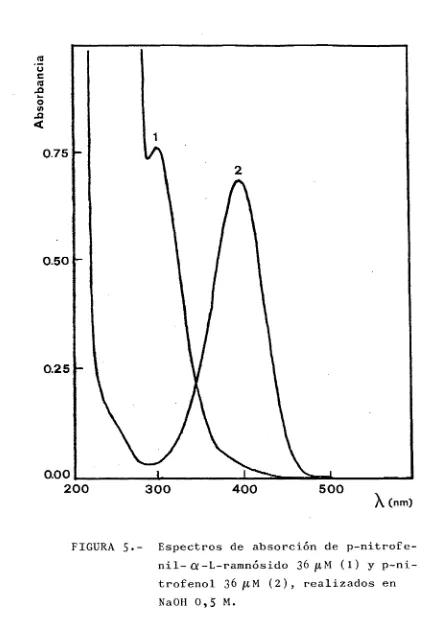
(18) c i a s se basan en l a utilización de naringinasa inmovilizada, l a utilización de e s t o s sistemas en l a i n d u s t r i a es muy e s c a s a , debido e s e n c i a l m e n t e a l a parquedad de modelos matemáticos g e n e r a l i zados que r e p r e s e n t e n l a hipotética descripción física de t a l e s s i s t e m a s y a l a i n e x i s t e n c i a de modelos d i g i t a l e s que sean o p e r a t i v o s y tengan posibilidades de uso h a b i t u a l para e l cálculo, diseño y c o n t r o l de unidades en l a s que se d e s a r r o l l e n e s t o s t i p o s de p r o c e s o s .. Así pues, el objetivo general d e l p r e s e n t e t r a b a j o ha c o n s i s t i d o en e l análisis y simulación de un r e a c t o r de l e c h o f i j o de n a r i n g i nasa i n m o v i l i z a d a en v i d r i o poroso^ para c o n s e g u i r l o , ha s i d o n e c e s a r i o c u b r i r l o s s i g u i e n t e s objetivos particulares: 12). Proponer un método a l t e r n a t i v o para. rización de l a a c t i v i d a d. ü!-ramnosidasa. nasa haciendo uso d e l s u s t r a t o nilno. o: -L-ramnósido, existe. un método. l a caracte-. ya. que. de. sintético en. y. para d e t e r m i n a r d i c h a a c t i v i d a d de forma naringinasa. específico. Dicho. sustrato. de l a c i t a d a. p-nitrofe-. l a bibliografía. rápido, s e n s i b l e. y d e f e r e n c i a d a de l a a c t i v i d a d. naringi-. global. específica. de l a enzima. es. actividad,. económico. absolutamente y uno. de l o s. p r o d u c t o s de l a reacción hidrolítica, e l p - n i t r o f e n o l , es fácilmente c u a n t i f i c a b l e colorimétricamente, mostrando, además, una a b s o r t i v i d a d lo que. que i m p l i c a. una gran. molar. sensibilidad. se propone.. - 4 -. elevada,. d e l método.
(19) 25) Proceder a l a inmovilización de l a enzima n a r i n g i n a s a , usándose para e l l o un soporte de vidrio poroso de n a t u r a l e z a hidrofílica bien d e f i n i d a , ya que va r e c u b i e r t o por una capa de r e s i d u o s de g l i c e r i l o y cuyo tamaño de partícula es uniforme. La inmovilización se ha llevado a cabo por c u a t r o procesos d i s t i n t o s tendentes a i m p l i c a r en l a unión soporte-proteína a c u a t r o r e s i d u o s de aminoácidos d i f e r e n t e s de l a enzima con e l f i n de e s t u d i a r e l e f e c t o de l a modificación química sobre l a a c t i v i d a d d e l d e r i v a d o .. 3-) Estudiar l a influencia d e l tamaño de poro del s o p o r t e , manteniendo c o n s t a n t e e l n i v e l de modificación química de l a enzima, sobre l a a c t i v i dad d e l d e r i v a d o , siendo éste un parámetro e x t r a o r d i n a r i a m e n t e importante en e l e s t u d i o d e l comportamiento cinético de l a s enzimas inmovilizadas por l o s problemas de difusión i n t e r n a que se plantean.. 4-) de. Proceder. a. l o s derivados. l a caracterización obtenidos. frente. del al. mejor. sustrato. sintético propuesto y a l s u s t r a t o n a t u r a l n a r i n g i n a , obteniéndose. l o s parámetros. cinéticos. intrínsecos. en ambos c a s o s , así como a l e s t u d i o de l a e s t a b i l i dad. a l almacenamiento. y. operacional. último. parámetro. derivado, siendo. este. cuando. l a aplicación. se prevé. proceso c o n t i n u o .. -. 5. -. de. dicho. fundamental. d e l sistema. a. un.
(20) 52) A f i n de d e s c r i b i r cuantitativamente l a interacción de l a reacción enzimática con l a s limitaciones difusionales internas, se pretende d e s a r r o l l a r un modelo matemático para r e a c c i o n e s enzimáticas heterogéneas monosustrato, en l a s que l a enzima se encuentra i n m o v i l i z a d a en partícul a s esféricas p o r o s a s , obteniéndose l o s p e r f i l e s r a d i a l e s de concentración a d i m e n s i o n a l de. s u s t r a t o en l a partícula, a s i como e l correspondiente f a c t o r de e f i c a c i a .. 62) Formular l a ecuación de diseño de un r e a c t o r de l e c h o f i j o para e s t e t i p o de s i s t e m a s , y r e s o l v e r l a t e n i e n d o en cuenta l a variación c o n t i n u a que experimenta e l f a c t o r de e f i c a c i a a l o l a r g o d e l r e a c t o r , examinando l a i n f l u e n c i a que puedan t e n e r cambios en l o s parámetros cinéticos y de operación sobre l o s p e r f i l e s a x i a l e s de conversión.. 72) tica. Por último, proceder a l a verificación sistemáde. l o s modelos. propuestos. resultados experimentales. obtenidos. comparando. con l o s p r e d i -. chos por l o s c i t a d o s modelos en términos de sión y de f a c t o r e s de e f i c a c i a .. -. 6 -. los. conver-.
(21) 2.-. ANTECEDENTES.
(22) 2.-. ANTECEDENTES. 2.1.-. LA NARINGINA, FLAVONOIDE RESPONSABLE DEL AMARGOR EN CÍTRICOS. En gran. variedad. l o s cítricos de. se. flavonoides.. encuentra. Estos. aparecen. normalmente como glicósidos y se h a l l a n distribuidos. en todos. los tejidos,. una. ampliamente. pero. en. mayor. concentración (más de un 2%) en e l albedo y fragment o s de membrana ( 1 ) .. En función d e l disacárido predominante. en. l a composición. del flavonoide,. éstos. se. d i v i d e n en dos grupos químico-taxonómicos : neohespe^ ridosas ( 2 - 0 - a - L - r a m n o p i r a n o s i l - ^ -D-glucopiranosa) y r u t i n o s a s (6-0-Q:. -L-ramnopiranosil-jQ-D-glucopira^. nosa) ( 1 ) .. Los concentración la. primera. amargas. flavonoides. que. son l a n a r i n g i n a. predomina. como a c i d a s ,. y. en pomelos mientras -. 8 -. alcanzan la. hesperidina;. y naranjas. que. la. mayor tanto. hesperidina.
(23) se encuentra. p r i n c i p a l m e n t e en n a r a n j a s ,. limones. y v a r i a s c l a s e s de mandarinas ( 2 ) .. La concentración de f l a v o n o i d e s en l o s zumos cítricos debe s e r r e d u c i d a , por dos r a z o n e s , fundamentalmente. En primer lugar, su i n s o l u b i l i d a d da l u g a r a l a aparición de depósitos c r i s t a l i n o s en l a s u p e r f i c i e de l o s equipos de procesado ( 3 ) ; y, en segundo l u g a r , algunos de e s t o s compuestos muestran un acusado sabor amargo, l o que c o n f i e r e a l o s zumos un sabor desagradable ( 4 ) .. Se la. relación. ha. estudiado. existente. entre. con. detalle. l a estructura del. disacárido d e l f l a v o n o i d e y e l amargor que c o n f i e r e a l zumo que l o posee. que la. era e l tipo. de. Así, i n i c i a l m e n t e enlace. glucosa e l factor. entre. l a ramnosa. determinante. siendo e l a g l i c o n e l modulador. se pensó y. d e l amargor,. de e s t a. ya que l a n a r i r u t i n a , isómero Qí ( 1 — ^ 6 ). propiedad, ramnoglu--. cosídico de l a n a r i n g i n a , no es amarga (5) m i e n t r a s que. l a poncirina. (un (x (1. de. l a neohesperidosa). es. ^ 2). ramnoglucósido. menos. amarga. que l a. n a r i n g i n a , llegándose por l o t a n t o a l a conclusión de. que todos. l o s 2-ramnoglucósidos. eran. amargos. y s o l o e l l o s ( 6 ) . S i n embargo, en e s t u d i o s p o s t e r i o r e s se ha confirmado que e l amargor es fundamentalmente. debido. a l enlace. (1. *-2 ),. es. decir,. no se r e q u i e r e que e l disacárido s e a un ramnoglucósido, n i tan siquiera entre poco. l a s dos. que sea. unidades. además e l t i p o. de. de -. (X. azúcar,. enlace. 9 -. ó j(3 con. e l enlace importando e l que e l.
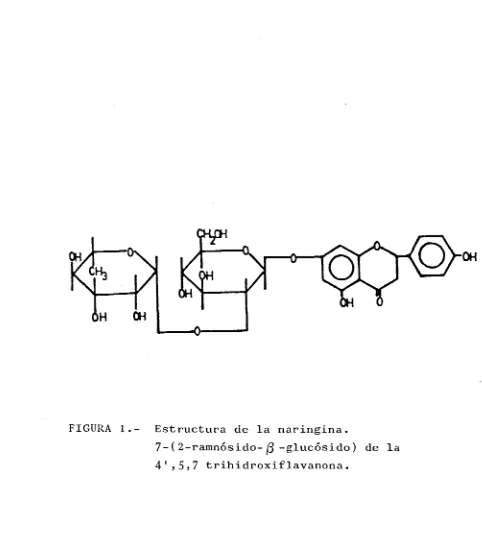
(24) segundo azúcar se une a l e s q u e l e t o. de l a flavonona. (7,8).. La. naringina,. - j3 -glucósido) de l a 4 ' , (Figura 1), del y. sabor. 7-trihidroxiflavanona flavonoide. en l o s zumos y en l 8 5 7. fué d e s c u b i e r t a. flores. 5,. es e l p r i n c i p a l amargo. 7-(2-ramnósido-. el. responsable. jugos. cítricos,. por De Vry (9). de l o s árboles de. pomelo. que. en l a s. crecían. en. Java. A l o largo del. fruto. de. se. produce. l a concentración. del. amargor,. en. dicho. d e l proceso una. de. marcada. disminución. naringina,. dependiendo,. flavonoide,. de maduración. de. y. además. factores. por. tanto. el. contenido. tales. como e l. t i p o de f r u t o , l a estación d e l año y l a s. condiciones. de extracción y filtración d e l zumo que se obtenga (10,. 11).. Se se. encuentra. proporción el. ha en. desea. Cuando. satisfactoria,. en. se disminuye. l o s zumos. la. cítricos. tengan. ya. resultados. realizadas a ya. de. aceptación. ese. orden. que muy. niveles. muchas. han demostrado. tales niveles que un c i e r t o. grado. desagradable. de. -. naringina. s i n embargo, organolépticas. que no c o n v i e n e de. 10. del. amargor -. de. d e l orden d e l. pruebas. l a concentración. estos. una. l a concentración a. una. necesario. 0,03%, e l sabor amargo desaparece ( 1 2 ) ; los. en. siendo. un s a b o r. cítricos. naringina. a f i n de d i s m i n u i r. que. concentración c o n f i e r e. que. de. 0,07^,. del. d e l zumo. s i se. comercial. l o s zumos. media. tratamiento. niveles. determinado. se. reducir. flavonoide, considera.
(25) FIGURA 1.-. E s t r u c t u r a de l a n a r i n g i n a . 7 - ( 2-ramnósido-j(3 -glucósido ) de l a 4',5,7. trihidroxiflavanona..
(26) que r e s u l t a r e f r e s c a n t e , por l o que e l c o n t e n i d o en n a r i n g i n a de l o s zumos cítricos se s u e l e r e d u c i r i n d u s t r i a l m e n t e a l 0 , 0 5 ^ v a l o r que permite e q u i l i b r a r l a s dos propiedades deseadas para e l zumo : a u s e n c i a de amargor y f r e s c o r . Por o t r a p a r t e es conveniente poder controlar e l amargor d e l producto f i n a l s i n a f e c t a r de forma adversa otras propiedades organolépticas d e l zumo (13 ) •. Se han propuesto d i v e r s o s métodos para r e d u c i r e l n i v e l de n a r i n g i n a de l o s productos cítricos. E l primero de ellos consiste en l a extracción de d i c h o f l a v o n o i d e con carbón a c t i v o , en determinadas condiciones de pH y t e m p e r a t u r a , pero e s t e t r a t a m i e n t o no es a p l i c a b l e puesto que también se e x t r a e n o t r o s compuestos que c o n t r i b u y e n a l a c a l i d a d d e l zumo o d e r i v a d o cítrico ( 1 4 ) •. Por o t r a p a r t e , l a hidrólisis a c i d a de l a n a r i n g i n a , u t i l i z a n d o ácido clorhídrico a 90-C (15) o una mezlca de ácido fórmico- c i c l o h e x a n o l ( l 6 ) , son p r o c e d i m i e n t o s demasiado drásticos para s u aplicación práctica.. Sin ampliamente. duda. utilizado. a l g u n a , e l método. para. la. naringina,. es. la. La. utilización. de. enzimas. y se. selectivo ha. de r e d u c i r. convertido. corriente,. ya. que. en. -. 12. eliminación. hidrólisis como. medio. -. de. práctica. trabaja. de. enzimática.. los niveles una. se. la. más. en. eficaz. naringina industrial. condiciones.
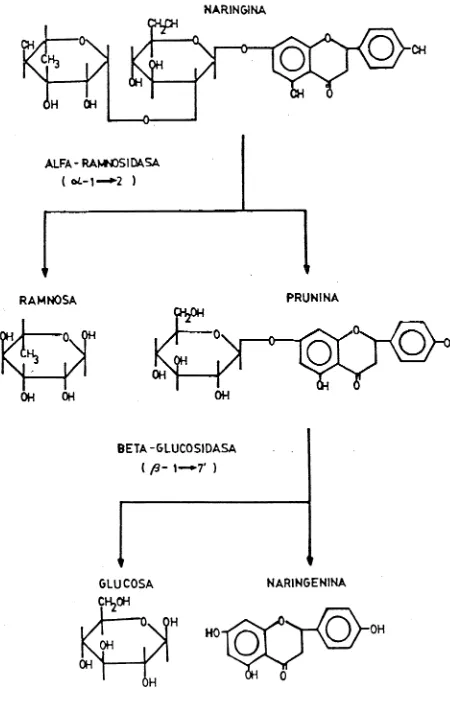
(27) suaves, de. l o que. redunda. l a s propiedades. vez. e l número. conseguir. Este método fué. el. mantenimiento. d e l producto. que s i m p l i f i c a. n e c e s a r i a s para. en. final,. de. manipulaciones. e l objetivo. propuesto. en. propuesto.. Japón. y utilizar. 1955. en. y desde entonces ha s i d o o b j e t o de muchas basadas en p r o d u c i r. a la. patentes. una enzima. capaz. de h i d r o l i z a r e l componente disacárido. neohesperi-. dosa de l o s f l a v o n o i d e s , pudiendo. hidrólisis. limitarse. (1. a l enlace. ^2). azúcares c o n s t i t u y e n t e s vista. la. relación. que. exclusiva. a los. glicosídica. existente. entre. (8,9).. ACTUACIÓN DE LA ENZIMA NARINGINASA. La. naringinasa. que h i d r o l i z a l a n a r i n g i n a cada. liga. de l a p a r t e. este t i p o de e n l a c e y e l amargor. 2.2.-. esta. una de e l l a s. diferente. y. una. en dos e t a p a s ,. c a t a l i z a d a por una. de l a enzima-;. -ramnosidasa (E C. es. así. enzima siendo. actividad. l a actividad. OL -. 3.2.1.40) hidroliza l a naringi(7-. na. a ramnosa. prunina. 4',. 5,7-trihidroxiflavanona) ,. j8 -glucósido. de l a. producto. este. último que es s u s t r a t o de l a a c t i v i d a d jQ-glucosida sa y Un. 3.2.1.21). (EC. naringenina esquema. l a Figura. de. que. lo. degrada. a. glucosa. (4',5,7-trihidroxiflavanona) l a reacción. 2.. -. 13. -. se. representa. en.
(28) NARIN&iNA. ALFA-RAMNOSIDASA ( o¿-1—^2 ). PRUNINA. RAMNOSA. CHjOH. • 0 ^. OH. OH. OH. BETA-GLUCOSJDASA ( /9- 1—7' ). GLUCOSA CH^OH. NARINGENINA. —Ov OH OH ÓH FIGURA 2.-. Hidrólisis enzimática de l a n a r i n g i n a ..
(29) Se ha demostrado que l a p r u n i n a es aproximadamente tres veces menos amarga que l a n a r i n g i n a ( 1 2 ) ; e l l o hace que para l o g r a r e l desamargado de un zumo, no haya necesidad de degradar l a n a r i n g i n a por completo a n a r i n g e n i na , proceso que es más l e n t o en su conjunto y que además puede dar l u g a r a l a formación de un p r e c i p i t a d o en e l zumo de c r i s t a l e s de naringenina^ dada su i n s o l u b i l i d a d en medio acuoso. Así pues, es s u f i c i e n t e l a a c t i v i dad 0!-ramnosidasa para proceder a l desamargado de zumos. La enzima empleada para e l l o puede s e r l a misma que se e n c u e n t r a en l o s zumos recién o b t e n i d o s , o l a que se puede a d i c i o n a r en e l caso de que c a r e z c a n de e l l a o se desee a c e l e r a r e l p r o c e s o . De c u a l q u i e r forma, tanto s i l a enzima se encuentra ya en e l zumo, como s i es exógena, es n e c e s a r i o c a r a c t e r i z a r adecuadamente e l n i v e l de a c t i v i d a d cí -ramnosidasa que p r e s e n t a , a f i n de c o n t r o l a r l a extensión de l a hidrólisis de n a r i n g i n a a p r u n i n a y obtener así un zumo con l a s características organolépticas deseadas.. -. 15. -.
(30) 2.3.-. EXTRACCIÓN Y PURIFICACIÓN. E l enorme interés práctico que presenta l a hidrólisis enzimática de l o s component e s amargos de l o s productos cítricos, r e q u i e r e d i s p o n e r de una preparación enzimática p u r i f i c a d a y l i b r e de enzimas contaminantes.. La naringinasa es una enzima que no se encuentra en abundancia en l a n a t u r a l e za. De hecho, no se ha detectado su p r e s e n c i a en e l r e i n o a n i m a l , m i e n t r a s que en e l v e g e t a l tan sólo se ha detectado en cítricos (en l a región comprendida e n t r e e l f l a v e d o y e l albedo d e l pomelo), en l a s s e m i l l a s de a p i o (17? l 8 ) , y en l a s hojas d e l árbol C i t r u s decumana ( 1 9 ) . S i n embargo, e l a i s l a m i e n t o y purificación de l a a c t i v i d a d h i d r o l i z a n t e de n a r i n g i n a de l a s dos últimas f u e n t e s condujo a una preparación que era capaz de h i d r o l i z a r l a n a r i n g i n a a n a r i n g e n i n a y e l disacárido i n t a c t o , debiendo pues c o n s i d e r a r se d i c h a enzima como una j8-glucosidasa, y no realmente como n a r i n g i n a s a , ya que no estaba presente l a a c t i v i d a d a - r a m n o s i d a s a .. Dado que l a s c a n t i d a d e s. extraibles. de l a enzima n a r i n g i n a s a de f u e n t e s de o r i g e n veg e t a l son muy pequeñas, fué e v i d e n t e desde un p r i ^ mer momento^ que se n e c e s i t a b a o t r a f u e n t e. distinta. capaz de p r o d u c i r l a enzima en c a n t i d a d e s. suficien. -. 16. -.
(31) t e s para su aplicación práctica. Por e l l o , cuando se encontró que una preparación c o m e r c i a l de enzimas pécticos de o r i g e n fúngico denominada P e c t i n o l 100-D (de Rohm and Haas Co.), e r a capaz de hidrolizar completamente l a naringina en disolución acuosa a ramnosa, g l u c o s a y n a r i n g e n i n a (19), l o s e s t u d i o s sobre obtención de enzimas de o r i g e n fúngico, se d i r i g i e r o n h a c i a e l a i s l a miento, purificación y comercialización de nuevas p r e p a r a c i o n e s enzimáticas de n a r i n g i n a s a . E f e c t i v a mente, ciertos cultivos de microorganismos, principalmente d e l reino Fungi, han r e s u l t a d o s e r l a s mejores f u e n t e s de n a r i n g i n a s a . En e l l o s , se induce l a síntesis de l a enzima haciéndolos c r e c e r en un medio de c u l t i v o que c o n t i e n e n a r i n g i na, pudiéndose r e a l i z a r e s t e proceso a escala i n d u s t r i a l . Es así como se han obtenido muchas p r e p a r a c i o n e s enzimáticas de n a r i n g i n a s a : " N a r i n g i nasa C" ( 2 0 ) , "Kumitanase" de A s p e r g i l l u s n i g e r ( 7 , 1 1 , 2 1 - 2 5 ) , " S o l a s e " de C o n i o t h y r i u m diplodiella o "Sankyo Naringinase" de A s p e r g i l l u s u s a m i i mut. s h i r o u s a m i i ( 2 6 ) .. La purificación de l a preparación enzimática a u t i l i z a r , t a n t o p a r a ción completa de l a enzima, ción práctica consecuente, en. l a obtención. preparaciones enzimas porque. una c a r a c t e r i z a -. como para. es una etapa. de l a enzima.. En. enzimáticas s u e l e n. pécticas, reducen. que pueden. que se ponen. considerablemente. complejo. romper. que mantiene -. e l sistema a 17. decisiva. este. tipo. estar. d e l zumo; s i n embargo su p r e s e n c i a ya. l a aplica-. de. presentes manifiesto. l a viscosidad no es. deseable. hidrocoloidal. l o s componentes -. de. del.
(32) zumo en suspensión, por l o que e l procedimiento más u s u a l para l a obtención de una preparación enzimática s a t i s f a c t o r i a i n c l u y e l a separación de e s t a s enzimas contaminantes. En primer l u g a r se s e l e c c i o n a e l c u l t i v o que p r e s e n t a l a mayor a c t i v i d a d n a r i n g i n a s a , que se hace c r e c e r en un medio con n u t r i e n t e s adecuados para l a producción de l a enzima, ya que e s t a no es s i n t e t i z a d a por e l microorganismo en c o n d i c i o n e s normales. Seguidamente, se efectúa una purificación p a r c i a l por t r a t a m i e n t o de l o s e x t r a c t o s d e l c u l t i v o con alcohol para precipitar l a s proteínas, para a continuación f i l t r a r y s e c a r e l p r e c i p i t a d o p r o t e i c o o b t e n i d o con a i r e ( 2 0 ) . La eliminación de l a s enzimas pécticas se r e a l i z a por d i f e r e n c i a de s o l u b i l i d a d de l a s g l i c o s i d a s a s y p e c t i n a s a s en disolución alcohólica (27) o p o r inactivación d i f e r e n c i a l de l a s p e c t i n a s a s a pH 8 y 37~C ( 2 8 ) . En líneas g e n e r a l e s éste es e l t r a t a m i e n t o para conseguir una preparación enzimática, aunque puede d i f e r i r l i g e r a m e n t e según l a fuente de p a r t i d a . S i n embargo, en ningún caso se e s p e c i f i c a en l a bibliografía e l c r i t e r i o para determinar l a pureza de l a s n a r i n g i n a s a s así o b t e n i d a s , empleándose normalmente e s t a s p r e p a r a c i o n e s en l o s ensayos analíticos.. -. 18. -.
(33) 2.4.-. PROPIEDADES. Una vez que ha s i d o o b t e n i d a una preparación enzimática de n a r i n g i n a s a y antes de su aplicación práctica en e l desamargado de cítricos y sus d e r i v a d o s , se r e q u i e r e un conocimiento previo de l a s características m o l e c u l a r e s y cinéticas de l a enzima. S i n embargo, en l a bibliografía d i s p o n i b l e no se ha encontrado una caracterización completa de l a n a r i n g i n a s a en s e n t i d o e s t r i c t o , s i n o mas bien estudios de l a s c o n d i c i o n e s óptimas de actuación de l a enzima para l l e g a r a un grado de liidrólisis de l a n a r i n g i n a satisfactorio para eliminar e l amargor d e l zumo. Tan sólo en un caso, e x i s t e una r e f e r e n c i a bibliográfica que menciona l a separación, mediante técnicas electrocromatográficas ( 2 9 ) , de l a s dos a c t i v i d a d e s enzimáticas de l a n a r i n g i n a s a . Puesto que d i c h a s a c t i v i d a d e s se d e t e r m i n a r o n en f r a c c i o n e s a s o c i a d a s a dos bandas de proteína d i f e r e n t e s , es o b v i o d e d u c i r , que l a naringinasa contiene como mínimo dos tipos de cadenas polipeptídicas diferentes. S i n embargo^ en d i c h o t r a b a j o no se llegó a ninguna conclusión en ese a s p e c t o , dedicándose l o s a u t o r e s t a n sólo a ensayar la idoneidad de d i f e r e n t e s ramnósidos, glucósidos y ramnoglucós i d o s de f l a v a n o n a s como s u s t r a t o s para cada una de l a s a c t i v i d a d e s . En t a l e s condiciones l a a c t i v i d a d Q!-ramnosidasa se expresó p r e f e r e n t e mente frente a l o s ramnoglucósidos, siendo muy b a j a cuando l a ramnosa se halló unida d i r e c t a mente a l aglicón ( 2 9 ) .. -. 19. -.
(34) Fuera de e s t a r e f e r e n c i a bibliográfica, l a n a r i n g i n a s a parece comportarse como una única e s p e c i e f r e n t e a l o s p r o c e d i m i e n t o s de purificación empleados normalmente ( p r e c i p i t a ción con s u l f a t o amónico o e t a n o l ) , no habiéndose tampoco r e f e r e n c i a d o l a p o s i b i l i d a d existente de que se separen l a s dos a c t i v i d a d e s a l añadir urea o i n c u b a r a temperaturas de SO^C, t r a t a m i e n t o s ambos usualmente empleados en l a s p r e p a r a c i o nes enzimáticas de n a r i n g i n a s a para eliminar l a s a c t i v i d a d e s asociadas a enzimas pécticas (20, 22, 23, 26, 3 0 ) .. Asimismo, tampoco e x i s t e n r e f e r e n c i a s bibliográficas en cuanto a tamaño m o l e c u l a r , punto isoeléctrico, e x i s t e n c i a de subunidades, o información relacionada con l a e s t r u c t u r a de l a proteína ( e s p e c t r o s UV-Vis, o de f l u o r e s c e n c i a , extinción de f l u o r e s c e n c i a , e t c . ) , o con los aminoácidos que p u d i e r a n participar en e l c e n t r o catalítico.. En catalíticas. de. cuanto l a enzima. a. las. es. necesario. que, en l a mayoría de l o s c a s o s , nes. cinéticas. método. se. de Davis. han. se discutirá más a d e l a n t e. decir. l a s determinacio-. realizado. (31). Este. propiedades. siguiendo. método, t a l y. en e l apartado. el como. corres-. p o n d i e n t e , no p e r m i t e d i f e r e n c i a r. entre. y prunina,. respectivamente,. de las. s u s t r a t o y producto,. l a actividad medidas. de. a-ramnosidasa, actividad. - 20 -. por. naringina l o que. referenciadas. son.
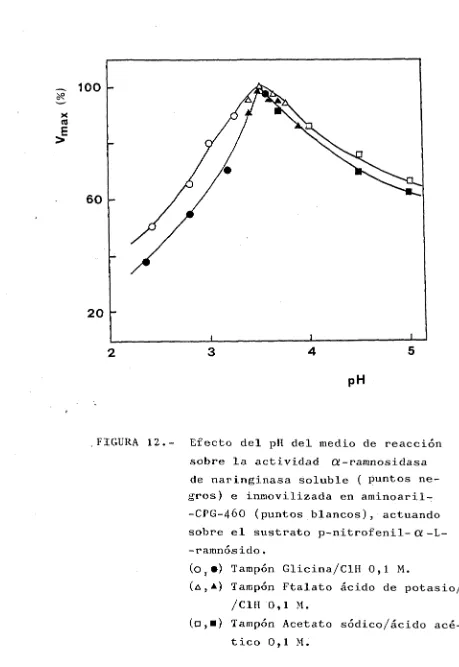
(35) un r e f l e j o de l a d i f e r e n c i a e n t r e e l contenido de n a r i n g i n a más prunina y e l de n a r i n g e n i n a en e l medio de reacción. De i g u a l forma, l a determinación de grupos r e d u c t o r e s como medida de l a a c t i v i d a d enzimática ( 3 2 , 33) refleja una mezcla de l a s dos a c t i v i d a d e s enzimáticas presentes en l a n a r i n g i n a s a , ya que e l método colorimétrico de Nelson-Somogyi no d i f e r e n c i a e n t r e ramnosa y g l u c o s a ( 2 2 , 2 3 ) .. Teniendo en cuenta e s t o s c o n d i cionamientos, l o s datos de l a bibliografía pueden servir para situar aproximadamente las condiciones óptimas para l a expresión de l a a c t i v i d a d de l a enzima así como para establecer, igualmente de forma aproximada, sus parámetros cinéticos. Así, por ejemplo, l a enzima extraída de l a s e m i l l a de apio h i d r o l i za l a naringina " in v i t r o " a pH 7 y 37^0 (17), condiciones que d i f i e r e n b a s t a n t e de l a s encontradas para l a mayoría de l a s prepara^ clones enzimáticas referenciadas : rangos de pH óptimos de 3>5 a 5 > 0 , y de temperatura de. 502. a. 602C. ( 10,. 19,. 20,. 34).. Tal. sucede. para l a n a r i n g i n a s a o b t e n i d a a p a r t i r de Coniot h y r i u m d i p l o d i e l l a que muestra unas c o n d i c i o n e s óptimas que están dentro d e l rango citado : pH 4 j 2 y temperaturas e n t r e 6 0 y 6 5 2 C , a l i g u a l que para l o s estudios r e a l i z a d o s con l a enzima de A s p e r g i l l u s n i g e r , en l o s c u a l e s se o b t u v i e r o n v a l o r e s semejantes (22-25, 35). La c o n s t a n c i a de e s t o s valores se mantuvo también en e l único caso r e f e r e n c i a d o de s e p a r a -. - 21 -.
(36) ción de l a s dos a c t i v i d a d e s de l a n a r i n g i n a s a por electrocromatográfxa (29); se determinó en t a l caso un pH óptimo de 4^5 y una temperatura óptima de ÓO^C para l a a c t i v i d a d O!-ramnosidasa, y un pH de 4^7 y temperatura óptima de 58-C para l a a c t i v i d a d j3-glucosidasa .. Por otra parte, mientras que e x i s t e n m u l t i t u d de r e f e r e n c i a s bibliográficas sobre e l e f e c t o d e l pH d e l medio y de l a tem p e r a t u r a de reacción sobre l a a c t i v i d a d enzimática de l a n a r i n g i n a s a , es muy escasa l a i n f o r m a ción d i s p o n i b l e sobre l a variación de l a a c t i v i dad enzimática con l a c a n t i d a d de enzima, e l p e r i o d o de incubación óptimo o l a e s t a b i l i d a d a l almacenamiento, y n u l a r e s p e c t o a l efecto de l a f u e r z a iónica sobre l a expresión de l a actividad de l a n a r i n g i n a s a .. Por. lo. que. se. refiere. parámetros cinéticos de l a enzima l a parquedad y d i v e r s i d a d. de datos. cos;. que. además,. estos. hay. p r e c a u c i o n e s ya que han s i d o Por ejemplo, se han p u b l i c a d o entre. 35),. mientras. para. velocidad. en de. cuenta pureza. que. 0,64. máxima. v a l o r e s de. y. es. diferente. -. 22. aún. como. 2,20. -. empleando. cada. constansustrato (22-24,. mM de. mayor.. de enzima en. con. de l a s o c a s i o n e s .. l a dispersión. que l a f u e n t e es. bibliográfi-. analizarlos. t e de M i c h a e l i s f r e n t e a n a r i n g i n a comprendidas. es m a n i f i e s t a. obtenidos. e l método Davis en l a mayoría. a los. valores Teniendo. y el. grado. caso,. tales.
(37) r e s u l t a d o s no son de extrañar. Así, para n a r i n ginasa extraída y p u r i f i c a d a de un cultivo de Aspergillus niger, l a actividad máxima c a l c u l a d a fué de 74 U/mg (22, 23), mientras que una preparación c o m e r c i a l de n a r i n g i n a s a de l a misma fuente d i o 78 U/g ( 2 4 ) ; l a p u r i f i c a ción por cromatografía en DEAE-Sephadex y precipitación por a l c o h o l de d i c h a preparación comercial, hizo s u b i r l a a c t i v i d a d hasta 375 U/mg ( 2 4 ) .. Por o t r a p a r t e , cuando se ha hecho a c t u a r l a enzima n a r i n g i n a s a sobre l a n a r i n g i n a - " p r e s e n t e en un jugo o zumo de cítrico, l a o b s e r v a ción g e n e r a l r e a l i z a d a es que se produce un descenso de. l a a c t i v i d a d enzimática. Teniendo. el. interés c o m e r c i a l. algunos efecto. autores de. de l a enzima. han. tratado. ciertos. l o s zumos. Sin. embargo, en l a mayoría. estudio. constantes. sobre. ya o. que. tipos. no. de. se. de. enzimática.. l o s casos,. citan. (26,. 35). valores Así,. y. l a actividad naringinasa,. sacarosa. (25). aunque. otros. o. son. no. e l caso d e l c i t r a t o , ser. claramente. dependiente. 23. -. En. i n h i b i d o r parece. d e l pH. realizó l a medida de a c t i v i d a d ( 1 9 ,. -. sacarosa (25).. inhibidores. e l efecto. (19,. sorbitol. que l a f r u c t o s a ,. málico. de por. e l citrato. a u t o r e s han p u b l i c a d o ácido. el. puramente. inhibición. que. el. particulares. (20, 24, 25),. glucosa. fructosa. inhiben. estudiar. l a actividad. se ha p u b l i c a d o. 25, 26, 35), (26),. de. se ha r e s t r i n g i d o a l aspecto. cualitativo, ejemplo,. naringinasa,. componentes. de. en cuenta. a l que 24,. 35)•. se.
(38) En cuanto a l a s e s p e c i e s que p a r t i c i p a n en l a p r o p i a reacción enzimática, l a ramnosa aparece como un inhibidor poco potente (19, 35) o muy potente ( 3 6 ) dependiendo de l a preparación enzimática u t i l i z a d a , m i e n t r a s que t a n t o l a p r u n i n a ( 3 6 ) como l a n a r i n g e n i n a (19) parecen t e n e r poco e f e c t o i n h i b i d o r sobre l a a c t i v i d a d de l a n a r i n g i n a s a .. Mientras que l a mayoría de l o s i n v e s t i g a d o r e s se han centrado en l a c a r a c t e rización y e s t u d i o de l a s propiedades de l a n a r i n g i n a s a " i n v i t r o " , o t r o s se han dedicado a l e s t u d i o fisiológico de l o s cambios d e l f r u t o con l a disminución d e l contenido de n a r i n g i n a . Así, se ha e s t u d i a d o ( 3 7 , 38) l a p o s i b i l i d a d de desamargar e l f r u t o "in situ", inoculándolo con naringinasa, prestándose tambie'n atención a l o s cambios en e l aroma y t e x t u r a d e l mismo que acompañan d i c h o t r a t a miento. S i n embargo e s t a técnica ha tenido poca aceptación y raramente es u t i l i z a d a en l a práctica.. -. 24. -.
(39) 2.5.-. MÉTODOS DE MEDIDA DE LA ACTIVIDAD. CATALÍTICA. La medida de la actividad n a r i n g i n a s a i m p l i c a l a determinación i n d i v i d u a l i zada de l a s a c t i v i d a d e s Oí-ramnosidasa y j g - g l u c o s i dasa, y l a cuantificación de l a contribución de cada una de e l l a s a l a a c t i v i d a d global de l a enzima. Este es un hecho que h a b i t u a l m e n t e no se e s p e c i f i c a en l a bibliografía cuando se h a b l a de l a a c t i v i d a d n a r i n g i n a s a .. La actividad O! -ramnosidasa se puede d e t e r m i n a r s i g u i e n d o l a desaparición de n a r i n g i n a , o l a aparición de p r u n i n a o ramnosa en e l medio ( s i se emplea e l s u s t r a t o n a t u r a l n a r i n g i n a ) , m i e n t r a s que l a a c t i v i d a d j3-glucosidasa se podría seguir a través de la desaparición de p r u n i n a o aparición de g l u c o s a y n a r i n g e n i n a , s i n embargo, para esta última a c t i v i d a d se ha recurrido frecuentemente a l uso de sustratos sintéticos, tipo salicina ( f e n i l - j(3 -0-glucopiranósido) u o - n i t r o f e n i l - jQ -D-glucopiranósido.. El. seguimiento. de. l a actividad. OL -ramnosidasa. la. aparición. ramnosa. de. cabo mediante e l uso de adicional, permite de. la. seguir. ramnosa. se un. ramnosa la. a. través. podría sistema. llevar. aparición. la. a que. producción. acoplada. NADH ( 3 9 ) . La mayor d e s v e n t a j a d e l método. - 25 -. de. enzimático. deshidrogenasa,. fotométricamente. por. exclusivo. de. estriba.
(40) , así en e l elevado c o s t e d e l c o f a c t o r NAD de emplear como e l o r i g i n a d o por l a n e c e s i d a d una enzima a d i c i o n a l , por l o que su uso no está estudiado.. Sin embargo, e l método más ampliamente u t i l i z a d o en l a determinación de l a a c t i v i d a d n a r i n g i n a s a es e l propuesto por Davis (3l)j o algunas de sus modificaciones ( 4 0 , 4 1 ) . E l método Davis se basa en l a formación de un producto c o l o r e a d o cuando r e a c c i o n a n a r i n g i n a con d i e t i l e n g l i c o l en un medio fuertemente a l c a l i no. Dicha coloración se puede medir fotométricament e a 410 nm y su i n t e n s i d a d es p r o p o r c i o n a l a l contenido en n a r i n g i n a de l a muestra. La naringenina, producto final de l a a c t i v i d a d hidrolítica de n a r i n g i n a s a , desarrolla mucho menos c o l o r en l a s mismas c o n d i c i o n e s , por l o que según D a v i s , es p o s i b l e s e g u i r e l curso de l a hidrólisis de n a r i n g i n a por comparación del c o l o r con l a s c u r v a s estándar preparadas a p a r t i r d e l ramnoglucósido y d e l aglicón a un temperatur a dada. S i n embargo, o t r a s muchas s u s t a n c i a s i n t e r f i e r e n dando e l mismo c o l o r , t a l e s como flavonas, flavonoles, c i t r a l , f u r f u r a l , geraniol, etc., e incluso e l producto de la primera a c t i v i d a d de n a r i n g i n a s a , p r u n i n a , por l o que e l t e s t de Davis no es un método f i a b l e para l a caracterización de l a a c t i v i d a d 01 -ramno s i d a s a , ya que l o s r e s u l t a d o s que se o b t i e n e n r e f l e j a n l a desaparición de n a r i n g i n a y prun i n a de forma c o n j u n t a . E s t a limitación, que es importante p o r cuanto lo que se mide es un reflejo de la actividad global de. - 26 -.
(41) n a r i n g i n a s a , y específicamente de l a a c t i v i d a d j8 - g l u c o s i d a s a , ya que e s t a a c t i v i d a d es l a l i m i t a n t e de v e l o c i d a d en e l proceso de hidrólisis t o t a l , ha s i d o c o n s i d e r a d a desde hace mucho tiempo (20) como una c l a r a d e s v e n t a j a d e l método de Davis en su aplicación a l a determinación de l a actividad naringinasa, y curiosamente es e l método que más se ha empleado y aún se s i g u e empleando para t a l f i n .. La. i n t e r f e r e n c i a de l a p r u n i n a se ha e l i m i n a d o mediante extracción s e l e c t i v a de este componente en a c e t a t o de e t i l o (40), aplicándose p o s t e r i o r m e n t e e l test de Davis a l a mezcla de reacción a s i t r a t a d a . S i n embargo, e l problema s i g u e siendo e l mismo, por cuanto s o l o se mide l a a c t i v i d a d g l o b a l de l a n a r i n g i n a s a .. Para han. aparecido. solventar. diversas. estos. problemas,. alternativas. basadas. e s e n c i a l m e n t e en l a separación de l o s componentes de. l a reacción. (29,. 42,. los. 43). productos. de. Davis,. para. cada. por cromatografía. de. y. posterior. c u a n t i f icación. separados,. ahora uno. ya de. bien. por. s i n ninguna. capa el. fina de. método. interferencia. l o s flavonoides,. bien. por. e s p e c t r o f otometría a 280 ntn ^ o por f l u o r o d e n s i t o metría, que mide de. fluorescencia. directamente. las. en e l cromatograma. intensidades (36).. Pero. t o d o s e l l o s son métodos muy l a b o r i o s o s y c o m p l i c a dos,. s i n dejar. tediosas. aún. de e s t a r son. las - 27. sujetos técnicas -. a. error.. que. Más. implican.
(42) dos experimentos c o n s e c u t i v o s para l a obtención de un único valor de actividad enzimática, como l a combinación d e l método clásico de Davis y l a determinación d e l c o n t e n i d o en aldohexosas l i b e r a d a s en l a reacción con o - a m i n o d i f e n i l o (32,. 33).. Sin duda alguna, e l método mas p r e c i s o de l o s que actualmente se emplean para cuantificar e l contenido en naringina de cítricos y demás productos d e r i v a d o s , es l a cromatografía líquido-líquido de a l t a r e s o l u ción (IIPLC), pero su gran problema es e l elevado c o s t e económico que implica su utilización. Fué en 1974 (44) cuando se publicó l a p r i m e r a aplicación práctica de HPLC en análisis de f l a v o n o i d e s . En e s t e método es e s e n c i a l e l uso d e l e l u y e n t e adecuado; l o s primeros u t i l i z a d o s f u e r o n mezclas metanol-ácido acético-agua ( 3 0 : 5 : 6 5 V/V) sobre una columna de C^g adecuada para l a resolución de e s t o s f l a v o n o i d e s . P o s t e r i o r m e n t e , se ha r e a l i z a d o una modificación de e s t e método ( 4 5 ) , u t i l i z a n d o una columna /x Boundapak Cj^g y como e l u y e n t e una mezcla a g u a - a c e t o n i t r i l o ( 8 0 : 2 0 , V/V); de e s t a manera se o b t i e n e n v a l o r e s para l a concentración de n a r i n g i n a en e l pomelo y sus d e r i v a d o s , que son aproximadamente e l d o b l e de l a s encontradas u t i l i z a n d o elTmétodo D a v i s . Actualmente, t o d a s l a s r e f e r e n c i a s b i b l i o - g r a f i c a s que se encuentran a c e r c a de l a c u a n t i f i c a ción de n a r i n g i n a y o t r o s f l a v o n o i d e s en zumos y d e r i v a d o s cítricos, hacen uso de l a técnica de cr£ matografía líquida de a l t a resolución ( 4 6 - 5 3 ) -. - 28 -.
(43) 2.6.-. NARINGINASA INMOVILIZADA. La adición de preparaciones c o m e r c i a l e s de n a r i n g i n a s a a zumos y jugos cítricos para proceder a s u desamargado, p l a n t e a algunos problemas. En p r i m e r l u g a r , e l producto final se encuentra contaminado por l o s p r o p i o s componentes de l a preparación enzimática, p e c t i n a s a s principalmente; e l l o , y l a inhibición de l a a c t i v i d a d enzimática por l o s p r o p i o s productos de l a reacción, así como por l o s componentes d e l medio de reacción, supone un c o s t o a d i c i o n a l a l uso de n a r i n g i n a s a en forma soluble para e l desamargado de zumos y demás d e r i v a d o s cítricos.. La. inmovilización. de l a enzima. en s o p o r t e s sólidos por e n l a c e s físicos o químicos o bien. su retención por medio. o un medio poroso permitiría si. no. todas,. A pesar referencias son. sobre. una. membrana. solventar. l a s desventajas. e l uso de l a enzima s o l u b l e. de. algunas,. mencionadas. para. (54).. de e l l o ,. inmovilización. relativamente recientes.. l a s primeras de. En 1971. naringinasa se. publicó. e l primer artículo sobre l a obtención de d e r i v a d o s insolubles enzima. en. agua. se inmovilizó. de. naringinasa. (55).. La. por oclusión en copolímeros. -. 29. -.
(44) de anhídrido maleico con d i s t i n t o s etilenos s u s t i t u i d o s y hexametilendiamina. Los d e r i v a d o s inmovilizados mostraron una disminución de l a a c t i v i d a d enzimática d e l 55-85^ como consecuenc i a de l a inmovilización y además perdían e l 90% de l a a c t i v i d a d cuando actuaban de forma c o n t i n u a sobre zumos de cítricos. En l o s c i n c o años p o s t e r i o r e s se han patentado distintos s i s t e m a s de n a r i n g i n a s a i n m o v i l i z a d a para desamargar zumos de pomelo con poco rendimiento (5Ó59) debido t a n t o a l a b a j a a c t i v i d a d y e s t a b i l i d a d de l o s d e r i v a d o s obtenidos como a l hecho de que l a n a r i n g i n a se adsorbía a l o s s o p o r t e s usados.. Los mejores resultados se han o b t e n i d o cuando se ha i n m o v i l i z a d o n a r i n g i n a s a b i e n por adsorción en DEAE-Sephadex (22), o en t a n i n o - a m i n o h e x i l c e l u l o s a (23), o b i e n por unión c o v a l e n t e a v i d r i o poroso con g l u t a r a l d e h i d o (24) o a q u i t i n a usando g l u t a r a l d e h i d o y b o r o h i druro sódico ( 3 5 ) .. Todos e s t o s d e r i v a d o s dos. presentaron. cuando de. buena. actuaron. naringina;. estabilidad. sobre. amarga. jugos usada. s i n embargo,. de N a t s u d a i d a i , comúnmente. operacional. disoluciones dicha. decreció drásticamente cuando sobre. inmoviliza-. estabilidad. se l e s h i z o variedad. para. acuosas. de. actuar naranja. l a obtención. de. zumos. De t o d a s formas, e l mejor de l o s d e r i v a d o s de. naringinasa. obtenidos. - 30. se d i o. -. cuando. se.
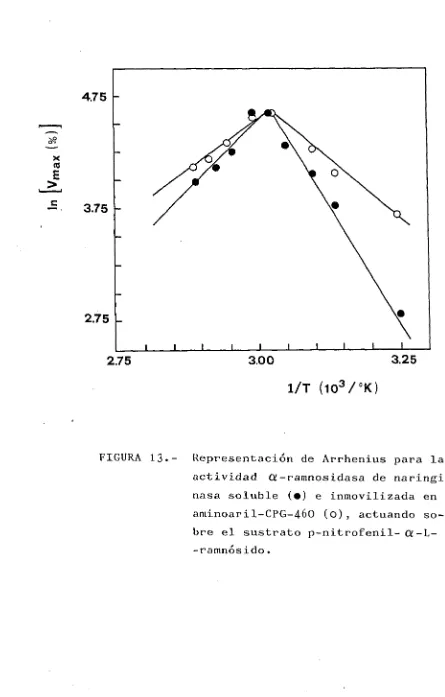
(45) usó como soporte tanino-aminohexilcelulosa. E l d e r i v a d o obtenido permitió desamargar I6OO t o n e l a d a s de jugo de N a t s u d a i d a i durante un mes, usándose para t a l f i n un r e a c t o r de l e c h o f i j o con 50 kg de d e r i v a d o i n m o v i l i z a d o .. La disminución de l a a c t i v i d a d observada cuando se u t i l i z a n a r i n g i n a s a i n m o v i l i zada para desamargar zumos cítricos, se debe probablemente a una o v a r i a s de l a s causas s i g u i e n t e s : contaminación física d e l c a t a l i z a d o r , inhibición de l a enzima por algunos compuestos p r e s e n t e s en e l zumo ( p o r ejemplo citrato o g l u c o s a ) o por l a desorción de l a enzima d e l s o p o r t e . Últimamente, e s t e problema de pérdida de enzima se ha s o l v e n t a d o ocluyendo l a enzima en membranas de f i b r a s huecas polisulfónicas anisotrópicas ( I 3 j 6 0 ) , siendo l o s r e s u l t a d o s o b t e n i d o s , a n i v e l de l a b o r a t o r i o , muy esperanzadores.. En de. naringinasa. anteriormente, a. l a enzima. general,. en se. los ha. por. pH. por una. óptimo. de. de. actuación. l a estabilidad. Michaelis. consecuencia. de. no. lO-lS^C y. la. mostró. todos. actividad,. alterado,. en l a. de dos. en. veces. La. 31. -. superior. constante. los. y. temperatura. casos. inmovilización,. -. respecto. ampliación d e l. resultó. térmica.. disminuyó. mencionados. caracterizado,. soluble,. un incremento. óptima en. su. inmovilización. soportes. rango de pH en e l que l a enzima aunque. la. de como. variando.
(46) e n t r e 0^48 y 0 , 8 6 mM para e l s u s t r a t o n a r i n g i n a .. Como ya se ha d i c h o , l a c a r a c t e rística más importante d e l uso de l o s d e r i v a d o s de naringinasa inmovilizada descritos en l a bibliografía, r e s i d e en l a pérdida brusca de actividad operacional a l actuar sobre zumos naturales o r e c o n s t i t u i d o s . Es, por tanto, necesario obtener d e r i v a d o s inmovilizados que aseguren l a unión de l a enzima al soporte a través d e l s u f i c i e n t e número de e n l a c e s coval e n t e s de t a l forma que se m i n i m i c e l a pérdida de enzima y, a l a v e z , permitan mantener l a conformación n a t i v a de l a misma con l a s u f i c i e n t e f l e x i b i l i d a d como para p e r m i t i r l a acción catalítica.. 2.1.-. DIFUSIÓN Y REACCIÓN EN SISTEMAS DE ENZIMAS INMOVILIZADAS. La s i m i l i t u d fenomenológica de l o s sistemas. catalíticos heterogéneos. en. ingeniería. química ( 6 l , 62) con l o s b i o c a t a l i z a d o r e s. inmovi-. l i z a d o s en biotecnología ( 6 3 - 6 5 ) ha s i d o i m p o r t a n te. cara. de. estos. los. a l desarrollo últimos.. factores. cinético. es. del. El. interés. que i n f l u y e n en debido. a l uso. biocatalizadores inmovilizados con. fines. análisis su. en. cinético investigar. comportamiento. creciente. de. los. (células y enzimas). analíticos. y. sintéticos. -. 32. -. (66,. 67)..
(47) Hay que hacer n o t a r , que l o s e s t u d i o s de enzimas inmovilizadas son importantes^ además, para comprender e l comportamiento " i n vivo " de c i e r t a s enzimas, dado que muchas de e l l a s actúan embebidas en membranas o adosadas a partículas s u b c e l u l a r e s . Así, con e l a u x i l i o de modelos s i m p l e s en l o s c u a l e s l a s enzimas están a t r a p a d a s en, o a d h e r i d a s a , s o p o r t e s sintéticos o membranas es p o s i b l e d e s c r i b i r y e s t u d i a r fenómenos s i m i l a r e s a l o s que t i e n e n l u g a r en s i s t e m a s n a t u r a l e s (68,. 69).. La velocidad de conversión del s u s t r a t o por enzimas inmovilizadas tanto en s i s t e m a s n a t u r a l e s como a r t i f i c i a l e s , depende de l a v e l o c i d a d de t r a n s f e r e n c i a d e l s u s t r a t o h a s t a e l i n t e r i o r de l a partícula biocatalítica donde se encuentran l o c a l i z a d a s l a s moléculas de enzima; y l a v e l o c i d a d así observada y medida, puede s e r c o n s i d e r a b l e m e n t e d i s t i n t a a l a v e l o c i dad correspondiente a l a misma c a n t i d a d de enzima pero en d i s o l u c i o n e s homogéneas. Además, cuando una enzima está u n i d a a un s o p o r t e sólido, e l modelo cinético d e l proceso también puede cambiar c o n s i d e r a b l e m e n t e , l o que conduce a cambios en l o s v a l o r e s de l o s parámetros cinéticos K.,vV.,.^ . La ecuación cinética M ^ MAX s i s t e m a s es difícil de o b t e n e r , complicado. cuantificar. real. de. ya que. parámetros. tales resulta. tales. como. cambios en l a conformación de l a misma provocados por. la. que. rodea. modificación. química^. a l a molécula. estéricos de l a m a t r i z , sobre. l a acción. de enzima, efectos. catalítica,. difusión i n t e r n a y e x t e r n a . -. microambiente. 33. -. impedimentos. d e l microentorno o. efectos. de l a.
(48) Por ello, los parámetros cinéticos observados son sólo e f e c t i v o s , s i e n d o r e f l e j a d o s a s u vez por e l uso de c o n s t a n t e s cinéticas aparentes K y V .. Al. considerar una reacción catalizada por enzimas inmovilizadas, hay que t e n e r en cuenta, fundamentalmente, tres etapas a través de l a s c u a l e s e l sustrato se c o n v i e r t e en p r o d u c t o . En primer lugar, e l s u s t r a t o que se encuentra en e l seno de l a disolución e x t e r n a a l a partícula de d e r i v a d o , debe ser transportado hasta la superficie d e l s o p o r t e donde se encuentra inmovilizada l a enzima. A continuación, e l s u s t r a t o debe d i f u n d i r s e a través de l o s poros de l a partícula, p a r a , f i n a l m e n t e s e r c o n v e r t i d o enzimáticamente en p r o d u c t o . E l p r o d u c t o así formado, deberá d i f u n d i r s e a su vez h a s t a l a s u p e r f i c i e e x t e r i o r del soporte, siendo entonces transportado h a s t a e l seno de l a disolución ( 7 0 ) .. Si inmovilizada de a. sólo. la en. enzima la. la. externa;. superficie. encuentra. superficie. l a partícula, únicamente l a difusión. se. existe. s i , por. catalíticamente. s i t u a d a también en e l i n t e r i o r. exterior resistencia. el. contrario,. activa. está. de l a partícula,. l a v e l o c i d a d de conversión puede. estar. limitada. i n d i s t i n t a m e n t e por una r e s i s t e n c i a a l a difusión e x t e r n a ^ por una (71)'. Estos. interna. fenómenos,. -. Oj i n c l u s o ^ por muchas. 34. -. veces,. no. ambas son.
(49) r e c o n o c i d o s por l o s i n v e s t i g a d o r e s , pudiendo causar marcadas d i f e r e n c i a s en l a medida de propiedades cinéticas que todos e l l o s r e a l i c e n .. M i e n t r a s que l a s l i m i t a c i o n e s d i f u s i o n a l e s e x t e r n a s son frecuentemente pequeñas y pueden hacerse despreciables mediante una e f i c i e n t e mezcla d e l seno de l a disolución, e l efecto de l a difusión i n t e r n a soV^re e l comportamiento cinético de l a s enzimas i n m o v i l i zadas en un s o p o r t e poroso puede s e r muy s i g n i f i c a t i v o . A menudo, l a mejor manera de r e d u c i r experimentalmente las limitaciones difusionales internas, consiste en disminuir el tamaño de l a s partículas d e l s o p o r t e o l a a c t i v i d a d del derivado inmovilizado. Así, l a i n f l u e n c i a de l a difusión i n t e r n a se ha demostrado v a r i a n d o e l espesor de una película de i i o l i a c r i l a m i d a (72) y membranas de colodión ( 7 3 ) o e l diámetro de l o s poros de partículas de vidrio (74) y Sephadex ( 7 5 ) , que se han usado como s o p o r t e s de l a s enzimas. En c o n c o r d a n c i a con l a teoría, un aumento en l a longitud característica, determina l a correspondiente disminución en e l f a c t o r de e f i c a c i a . S i n embargo, en algunos c a s o s , e s t a s a l t e r n a t i v a s no son c o n v e n i e n t e s o posibles, y es p r e f e r i b l e entonces usar técnicas que permitan c a l c u l a r l a s constantes cinéticas intrínsecas a p a r t i r de datos o b t e n i d o s en condiciones de limitaciones difusionales internas.. -. 35. -.
(50) En estas condiciones, se han propuesto métodos de cálculo para d e t e r m i n a r l o s v a l o r e s intrínsecos de v e l o c i d a d máxima y c o n s t a n t e de M i c h a e l i s , métodos que han s i d o r e c o p i l a d o s por algunos autores (65). Debido a l a c o m p l e j i d a d d e l t r a t a m i e n t o matemático, no r e s u l t a sorprendente que todos e s t o s métodos p r e s e n t e n d i f i c u l t a d e s cuando se p r e t e n den a p l i c a r . Uno de l o s casos ( 7 6 ) , por ejemplo, se cumple sólo s i l a representación de l o s datos e x p e r i m e n t a l e s por l o s métodos gráficos estándar conduce a l i n e a s r e c t a s , resultado que no siempre se puede a l c a n z a r ( 7 7 , 78). En o t r a s o c a s i o n e s ( 7 9 ) , se puede d e t e r m i n a r l a v e l o c i d a d máxima intrínseca, sólo s i p r e v i a mente se conoce l a constante de M i c h a e l i s intrínseca.. Los empleados los a. (77,. 78,. métodos 80,. 8l). que l a v e l o c i d a d máxima. e l e v a r l a concentración. seno. de. l a disolución. más son. comunmente aquellos. se e s t i m a de. sustrato. hasta. niveles. en. en base en e l a. los. que l a enzima i n m o v i l i z a d a se e n c u e n t r a s a t u r a d a , independientemene de l a s l i m i t a c i o n e s les.. Obviamente,. este. difusiona-. procedimiento. presenta. d i f i c u l t a d e s de a p l i c a b i l i d a d. cuando. con. insolubles. sustratos. relativamente. enzimas que p r e s e n t a n un v a l o r Adicionalmente,. para. se t r a b a j a elevado.. la. , estas. determinar. de puntos e x p e r i m e n t a l e s a b a j a s sustrato,. en. cuyo. caso. -. 36. elevado. concentraciones. las. -. con. de K'^^. técnicas r e q u i e r e n d i s p o n e r de un número de. o. limitaciones.
(51) difusionales son n o t a b l e s . El de e s t a condición se h a l l a además experimentalmente, ya que las de reacción observadas en e s t a s son pequeñas y por l o t a n t o d i f a ' c i l e s nar .. cumplimiento dificultado velocidades condiciones de d e t e r m i -. Otra p o s i b i l i d a d para evaluar l o s parámetros cinéticos intrínsecos estriba en p a r t i r de datos experimentales obtenidos operando en un r e a c t o r i n t e g r a l , es decir, con una conversión de salida elevada s i n necesidad de r e c i c l o , abarcando un rango l o s u f i c i e n t e m e n t e amplio de caudales y c o n c e n t r a c i o n e s de s u s t r a t o . S i n embargo es n e c e s a r i o d i s p o n e r de un modelo de diseño d e l r e a c t o r que considere adecuadamente la interacción e x i s t e n t e e n t r e l a reacción y l a difusión i n t e r n a . Este método se basa en minimizar l a suma de l o s cuadrados de l a s d i f e r e n c i a s e x i s t e n t e s e n t r e l a s p r e d i c c i o n e s d e l modelo y l o s resultados experimentales, según una función de l a forma :. O" =. fc. (X.i (.model) ^ H^ -. X.X (exp) ,. (1). '. donde X. , \ es l a conversión p r e d i c h a por e l 1 (model) modelo, X^^^^ ^ es l a o b t e n i d a experimentalmente y. n. es e l número de experimentos. r e a l i z a d o s . La. s e r i e de v a l o r e s de l o s parámetros cinéticos que. - 37 -.
(52) minimizan l a función (j es c o n s i d e r a d a estadísticamente l a mejor ( 6 5 ) .. como. Los e f e c t o s de l a t r a n s f e r e n c i a de m a t e r i a dentro de una e s t r u c t u r a porosa f u e r o n a n a l i z a d o s c u a n t i t a t i v a m e n t e por p r i m e r a vez por T h i e l e en Estados Unidos, Damkohler en Alemania y Z e l d o v i t c h en R u s i a , en e l p e r i o d o comprendido e n t r e l o s años 1937 y 1939 (82). E l r e s u l t a d o más i m p o r t a n t e de e s t o s análisis es l a descripción cuantitativa del factor que determina l a e f i c a c i a de un c a t a l i z a d o r . E l f a c t o r de e f i c a c i a , generalmente denominado 1] , se d e f i n e como l a relación e n t r e l a v e l o c i dad de reacción r e a l observada y l a que se mediría en a u s e n c i a de e f e c t o s d i f u s i o n a l e s . Este parámetro se emplea normalmente para d e t e r m i n a r s i l a s r e a c c i o n e s químicas o bioquímicas que usan c a t a l i z a d o r e s que se encuentran en un s o p o r t e sólido poroso, se h a l l a n l i m i t a d a s por difusión en e l poro y/o en l a partícula.. Los modelos de enzimas i n m o v i l i zadas que se han usado p a r a d e s c r i b i r vamente con. l a interacción. l a difusión. usualmente, o. a. a. partículas. de l a reacción. interna. una. cuantitati-. se. membrana. han. restringido,. porosa (85),. esféricas. química. (83,. 84),. conteniendo. una enzima d i s t r i b u i d a uniformemente. A f o r t u n a d a mente,. estos. modelos. pueden. a partículas de d i f e r e n t e s formas. irregulares,. geometrías. siempre. -. 38. generalizarse. -. que. e. incluso. se. defina.
(53) correctamente los. l a longitud. mismos ( 8 6 ) . E n. característica. tales. casos,. se. de. plantea. una ecuación d i f e r e n c i a l no l i n e a l , que únicamente. tiene. soluciones. analíticas. en. l o s casos. límite de cinéticas de orden cero y uno, o b t e n i e n dose. l a s siguientes. expresiones. para. e l factor. de e f i c a c i a en ambos casos (74) : Cinética de primer orden :. 1 =. 0. \ tanh 0. 0. Cinética de orden c e r o :. = 1. V=. 1. s i. - PI. 0 ^ A/Ó^ 0. si. >Y. 6/^'. donde :. D e f f . K' M. ^SR. -. 39. -.
(54) 1/2 (1+ p^) -. Bajo ecuaciones. estos. obtenidas. de. reacción. de. sustrato. a. para. bajas. supuestos,. las. l a velocidad. y. altas. global. concentraciones. son^ e s e n c i a l m e n t e ,. las. mismas. que l a s formuladas en l a bibliografía de i n g e n i e (87-91)•. ría química. Sin se. desea. cinética propuesto. analizar del. tipo. embargo, el. cuando. completo. de. Michaelis-Menten,. expresiones. de d e s a r r o l l o s. rango. para. en s e r i e. analíticas (92,. 93),. se en. la han. forma. aunque. estos. r e s u l t a d o s son de v a l o r l i m i t a d o en l a práctica. De hecho y muy. frecuentemente,. l a s ecuaciones. d i f e r e n c i a l e s que se o b t i e n e n han s i d o mediante. cálculo. numérico,. y. l o s resultados. presentados en términos de c a n t i d a d e s n a l e s de modo que l a interacción. resueltas adimensio-. de l a difusión. i n t e r n a con l a reacción química v i e n e. caracteri-. zada por módulos a d i m e n s i o n a l e s . Algunos a u t o r e s , han. definido. una. función. (76, los. e s t o s módulos de manera de. l a concentración. 8 4 ) , mientras. que. en. módulos se han hecho -. 40. otros. depender, -. de. que. sean. sustrato. tratamientos solamente,.
(55) de. parámetros. cinéticos. y. de. transporte. (94. -97).. La mayoría de l o s i n v e s t i g a d o r e s han r e s u e l t o e l problema de reacción química con limitaciones difusionales internas en e l caso de que l a reacción enzimática obedezca a una cinética d e l t i p o M i c h a e l i s - M e n t e n s i m p l e . En e s t o s casos l o s r e s u l t a d o s se p r e s e n t a n , normalmente, en forma de c u r v a s g e n e r a l i z a d a s d e l f a c t o r de e f i c a c i a f r e n t e a dos módulos adimensionales que engloban l a s constantes cinéticas intrínsecas, l a d i f u s i v i d a d efectiva y l a concentración de s u s t r a t o ( 8 4 , 9 8 ) .. El factor de eficacia es e l parámetro cuya determinación p r e s e n t a mayores d i f i c u l t a d e s , s i b i e n en algunos casos d e t e r m i n a dos se ha r e c u r r i d o a soluciones ingeniosas o p a r t i c u l a r e s para su obtención. Por ejemplo, Moo-Young y Kobayashi (84) han o b t e n i d o una expresión para e l f a c t o r de e f i c a c i a , en función de l o s que se pueden d e d u c i r en l o s casos límite de cinéticas de orden c e r o y uno, d i c h a expresión adopta l a s i g u i e n t e forma :. ''o. *.
(56) donde:. f a c t o r de e f i c a c i a p a r a cinética de orden c e r o . I. f a c t o r de e f i c a c i a p a r a cinética de primer orden.. Este método aproximado simplifica e l cálculo de l o s f a c t o r e s de e f i c a c i a para cinéticas d e l t i p o M i c h a e l i s - M e n t e n s i m p l e , puesto que e v i t a e l uso de métodos numéricos de resolución y, según sus a u t o r e s , p r o p o r c i o n a v a l o r e s de 7] que no se desvían de forma o s t e n s i b l e con l o s o b t e n i d o s mediante l a resolución de l a ecuación d i f e r e n c i a l por cálculo numérico. Los r e s u l t a d o s de l a s s i m u l a c i o n e s de o t r o s a u t o r e s p e r m i t e n obtener l o s p e r f i l e s de concentración en e l i n t e r i o r de l a s partículas de c a t a l i z a d o r ( 9 9 ) .. Sin sistemas una. bioquímicos. cinética. son de gran más c o m p l e j a s. embargo, pueden. del tipo. y. aunque. caracterizarse. Michaelis-Menten. importancia otros tipos tales. muchos por. simple,. de cinéticas. como a q u e l l a s que c o n s i d e r a n. inhibición por s u s t r a t o , por p r o d u c t o s o r e a c c i o n e s r e v e r s i b l e s . En e s t o s casos l a ecución que d e s c r i b e l a interacción la por. difusión. interna. tiene. de. diferencial. l a reacción. con. que r e s o l v e r s e también. métodos numéricos más o. menos. sofisticados,. y l o s módulos a d i m e n s i o n a l e s d e f i n i d o s se c o m p l i c a n más que en e l caso de l a cinética M i c h a e l i a n a .. - 42. -.
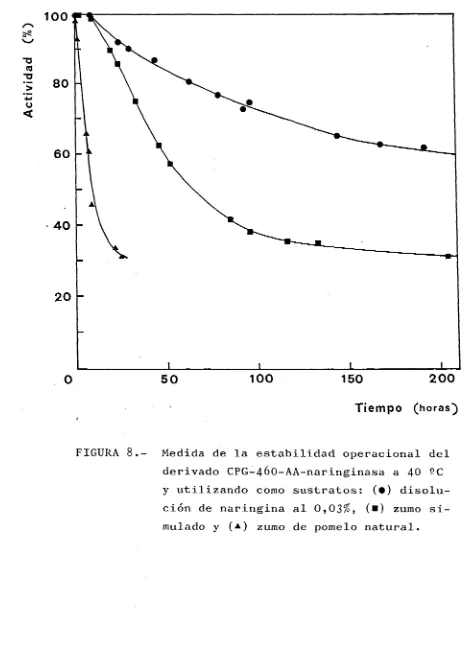
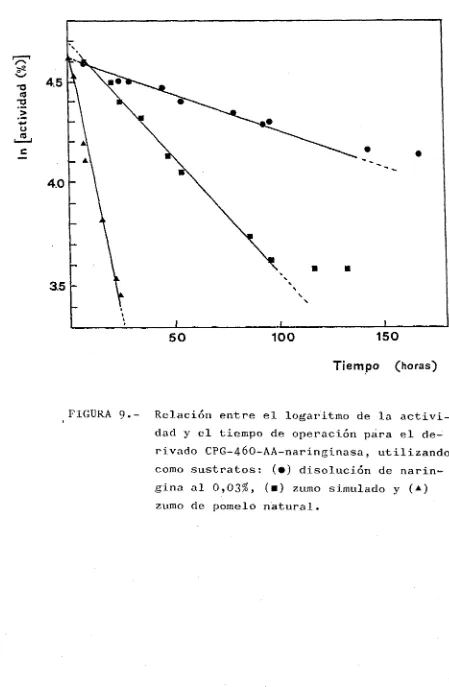
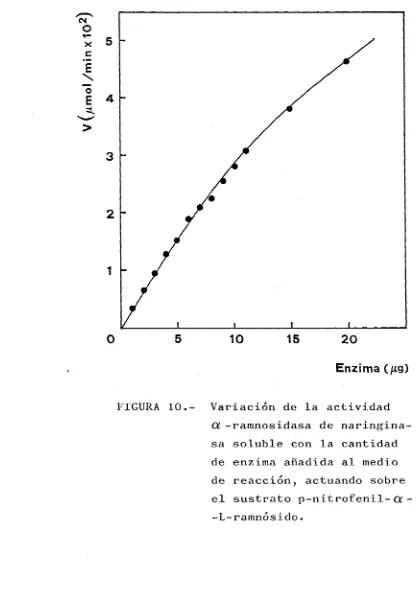
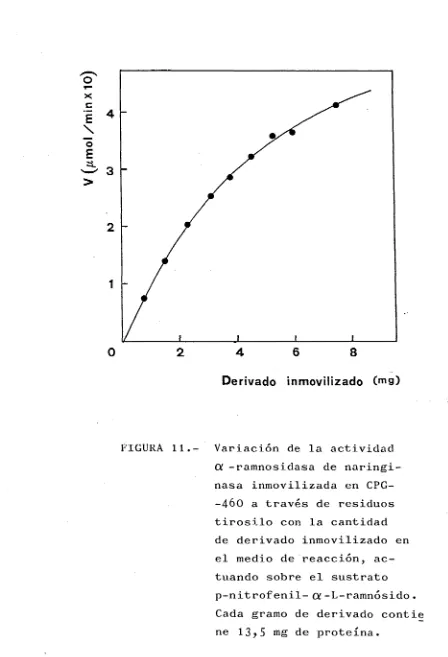
Figure
Documento similar
Uno de los métodos más utilizados para resolver numéricamente problemas de ecuaciones diferenciales ordinarias con condiciones iniciales es el método de Runge- Kutta de cuarto
7.. cuenta que los modelos están constituidos por muy pocos dispositivos como se verá en el siguiente capítulo). Pspice ha sido utilizado por otros autores para resolver problemas
En el cap´ıtulo 4, titulado “Din´ amica hamiltoniana de un gir´ ostato en interacci´ on newtoniana con un s´ olido r´ıgido esf´ erico”, se plantea la formulaci´ on
Después, utilizando la ecuación de la energía y la ecuación de descarga del vertedero, con ayuda de métodos numéricos para la resolución de ecuaciones diferenciales
Las ecuaciones de Lotka-Volterra[27][14] son un sistema de ecuaciones diferenciales no lineales de primer orden en las cuales se estudia la dinámica poblacional entre varias
Iniciamos el estudio de los métodos de solución de Ecuaciones Diferenciales Ordinarias (EDO) con la resolución de ecuaciones separables por simple integración de la expresión
Debido al riesgo de producir malformaciones congénitas graves, en la Unión Europea se han establecido una serie de requisitos para su prescripción y dispensación con un Plan
Como medida de precaución, puesto que talidomida se encuentra en el semen, todos los pacientes varones deben usar preservativos durante el tratamiento, durante la interrupción