Recomendación basada en la evidencia para el manejo inicial del recién nacido con sospecha de sepsis neonatal temprana
Utilidad del cuadro hemático en la estimación del riesgo de sepsis neonatal temprana
Julieta Villegas Rosales, MD
Tesis presentada a la Facultad de Medicina
como requisito parcial para optar al grado de Maestría en Epidemiología Clínica Pontificia Universidad Javeriana
TUTOR DE TRABAJO DE GRADO
Juan Gabriel Ruíz Peláez MD, MMedSci Profesor Titular
Resumen
Objetivo: Estimar las características operativas del recuento total de células blancas, recuento absoluto de neutrófilos y la razón de formas inmaduras a neutrófilos totales por medio de una revisión sistemática de la literatura, con el fin de asistir la formulación de una recomendación basada en evidencia, que utilice el modelo de umbral para el manejo del recién nacido con sospecha de sepsis neonatal temprana.
Diseño: Recomendación basada en evidencia para asistir la toma de decisiones en la práctica clínica.
Lugar: Colombia.
Población: Recién nacidos con sospecha de sepsis neonatal temprana.
Métodos: Desarrollo de una pregunta clínica, definición de los parámetros del modelo umbral que se va a emplear por medio de un consenso de expertos. Estimación de las características operativas del recuento total de células blancas, recuento absoluto de neutrófilos y la razón de formas inmaduras a neutrófilos totales por medio de una revisión sistemática de la literatura. Síntesis de la evidencia y generación de una recomendación basada en la evidencia fundamentada en la estrategia GRADE.
recién nacidos. El estudio proporciona información precisa de puntos de corte para los 3 índices de interés proporcionando razones de posibilidades (LR por sus siglas en inglés).
Conclusiones: No se recomienda utilizar estimadores de sensibilidad y especificidad sino razones de posibilidades. Los LR asociados con diferentes niveles de recuento total de células blancas, recuento absoluto de neutrófilos y de la razón de formas inmaduras a neutrófilos totales tienen una elevada capacidad de discriminación.
Abstract
Objective: To evaluate the value of white blood cell count, neutrophil count and mature to total neutrophil ratio in the work up of newborn infants suspected of having early onset neonatal sepsis through the conduction of a literature review to assist in the formulation process of an evidence-based recommendation.
Design: Evidence-based recommendation to assist the medical decisión making process.
Setting: Colombia.
Target population: Newborn infants suspected of having early-onset neonatal sepsis.
Methods: Development of a clinical question, systematic literature review of the best available evidence, synthesis of evidence, formulation of evidence-based recommendation based on the GRADE strategy.
Results: No evidence-based guidelines were identified. A systematic review was identified with low methodological quality assessment. The literature search generated 266 citations. Of these, 53 articles were selected as being potentially relevant for inclusion in the review. 4 articles met the inclusion criteria. The recommendation is based on the results of one single study with over 67,000 participants. The study provides precise information on different cut-off points through the use of likelihood ratios.
Conclusion: The use of likelihood ratios is highly recommended given its high discriminative ability.
1. INTRODUCCIÓN 2
2. MARCO TEÓRICO 4
2.1 Carga de la enfermedad 4
2.2 Definición 5
2.3 Factores de Riesgo 5
2.4 Agentes Causales / Etiología 6
2.5 Manifestaciones clínicas 7
2.6 Pruebas Diagnósticas 8
2.7 Tratamiento 9
3 MARCO DE REFERENCIA METODOLÓGICO 10
3.1 ¿ Por qué desarrollar una recomendación basada en evidencia? 10
3.2 Medicina Basada en Evidencia y Pruebas Diagnósticas 11
3.3 Decisiones clínicas y umbrales de diagnóstico y de tratamiento 12
4. JUSTIFICACIÓN 14
5. OBJETIVOS 15
5.1 Propósitos 15
5.2 Objetivo General 16
5.3 Objetivos Específicos 16
6. METODOLOGÍA 17
7. RESULTADOS 21
7.1 Pregunta Clínica 21
7.2 Búsqueda de la literatura 21
7.3 Definición de los parámetros del modelo umbral 27
9. RESPUESTA BASADA EN LA EVIDENCIA Y RECOMENDACIÓN 33
9.1 Recomendación 33
9.2 Relación entre la evidencia y la recomendación 36
9.3 Población 37
9.4 Usuarios 37
9.5 Alcance 37
9.6 Consideraciones de riesgos y beneficios 37
9.7 Consideraciones sobre los valores y preferencias de los pacientes 38
10. REFERENCIAS BIBLIOGRÁFICAS 39
11. ANEXOS 43
1. Introducción
La sepsis neonatal es un síndrome clínico caracterizado por un conjunto de signos y síntomas de infección, asociados o no con enfermedad sistémica (bacteriemia) que ocurre en el primer mes de vida.
La sepsis neonatal representa un grave problema de salud; corresponde a la principal causa de complicaciones y fallecimientos en las unidades de cuidados intensivos neonatales. (1)
La sepsis neonatal se clasifica en dos tipos dependiendo del tiempo de aparición del cuadro clínico. La sepsis neonatal temprana ocurre dentro de las primeras 72 horas de vida, se adquiere por transmisión vertical y los gérmenes involucrados más frecuentes son los que colonizan las áreas genital y perineal de la madre. La sepsis neonatal tardía ocurre entre las 72 horas de vida y el final del período neonatal. Usualmente se adquiere en la comunidad o dentro de un hospital (transmisión horizontal). (2)
El diagnóstico de sepsis neonatal en sus estadios iniciales es difícil y desafiante. Se fundamenta en que el clínico sospeche su presencia ante la existencia de factores de riesgo o manifestaciones inespecíficas. El problema fundamental es que las manifestaciones de enfermedad neonatal iniciales se limitan a un repertorio muy inespecífico que incluye: irritabilidad, letargia, apneas, mioclonías y convulsiones, pausas respiratorias, distermias, vómito, distensión abdominal y cambios sutiles del estado general (“no se ve bien”).
Las manifestaciones específicas de infección suelen indicar estadios avanzados de enfermedad, con peor pronóstico.
La capacidad de las pruebas paraclínicas y de las reglas de predicción para identificar sepsis fluctúa entre pobre y moderada, y su uso, sin tener en cuenta sus limitaciones, lleva a sobrediagnosticar y sobretratar, o a dejar de detectar oportunamente la sepsis neonatal, e iniciar manejos tardíos, con efectividad reducida.
El diagnóstico de sepsis en el recién nacido puede ser una tarea dificil debido a lo inespecífico de la presentación clínica y las pocas herramientas diagnósticas disponibles, que a su vez tienen diferentes valores predictivos para infección. Dentro de los estudios de laboratorio más comunes y fácilmente disponibles está el cuadro hemático, con el cual se busca evaluar la probabilidad de infección en un recién nacido con factores de riesgo.
Sin embargo, la interpretación de los datos en el cuadro hemático no es clara si se considera la falta de datos locales sobre los valores normales en el recién nacido, además de la proliferación de estudios en los que se publican diferentes rangos para cada componente del cuadro hemático (leucocitos, eosinófilos, neutrófilos, plaquetas, células inmaduras). Así mismo, al momento de considerar el uso del cuadro hemático, deben tenerse en cuenta factores que pueden alterar sus resultados como la edad del recién nacido y si existen condiciones maternas que puedan alterar sus valores, como hipertensión.
proporcionar una recomendación sobre el uso del cuadro hemático para la clasificación de riesgo, que guiara el manejo inicial de sepsis neonatal temprana respaldada por la mejor información disponible.
2. Marco teórico
Para la construcción del marco teórico se revisó DynaMed (http://www.ebscohost.com/DynaMed) que corresponde a una sinopsis basada en evidencia; adicionalmente se revisaron los listados de referencia de las fuentes primarias identificadas.
2.1Carga de la enfermedad
La sepsis neonatal es la principal causa de muerte durante el período neonatal, responsable de más de la mitad de ellas. (3) (4) La sepsis neonatal que ocurre dentro de las primeras cuatro semanas de vida es responsable de más de un millón de muertes anuales en el mundo. (1) La tasa de ataque de sepsis es variable ( desde <1% a >35% de todos los nacidos vivos) con base en la edad gestacional y en el tiempo de aparición ( temprana <72 horas después del nacimiento o tardía > 72 horas después del nacimiento). (5) (6, 7) Si se diagnostica tempranamente y se trata, es posible salvar a la mayoría de casos de sepsis neonatal. (2)
positivos). La incidencia de sepsis con cultivo positivo es de 2 por 1000 nacidos vivos. (8) No existe un acuerdo universal sobre la definición de sepsis neonatal; de acuerdo con distintos criterios, la incidencia de sepsis neonatal en países desarrollados varía entre 2.2 a 8.6 por 1,000 nacidos vivos. (9, 10)
2.2Definición
La sepsis neonatal se clasifica en dos tipos dependiendo del tiempo de aparición del cuadro clínico. La sepsis neonatal temprana ocurre dentro de las primeras 72 horas de vida y se adquiere por transmisión vertical; los gérmenes más frecuentemente involucrados son los que colonizan las áreas genital y perineal de la madre, entre ellos sobresalen los bacilos gram negativos y el Streptococcus del grupo B. Usualmente es más grave y tiene mayor morbimortalidad. (8)
La sepsis neonatal tardía tiene una presentación más gradual, ocurre a partir de las 72 horas de vida y hasta el final del período neonatal. Se adquiere por gérmenes provenientes del ambiente externo, ya sea del hogar o el hospital. La infección se transmite con frecuencia por las manos de los cuidadores de salud. Suele presentarse como una infección localizada, y la meningitis es muy frecuente, por lo que siempre hay que descartarla. Se adquiere en la comunidad o dentro de los hospitales y puede ser de etiología viral, bacteriana o micótica. Es común en recién nacidos pretérmino con estancia prolongada en la unidad de cuidados intensivos neonatal (UCIN). (11)
La incidencia de sepsis neonatal aumenta en presencia de los diferentes factores de riesgo. Estos son aditivos e incluyen factores maternos, ambientales y propios del huésped. Los factores de riesgo para la sepsis neonatal temprana incluyen la ruptura prematura de membranas, corioamnionitis, peso bajo al nacimiento, prematuridad, colonización materna por estreptococo beta hemolítico grupo B, infección del tracto urinario materno, asfixia perinatal y sexo masculino. (12)
Los factores de riesgo para la sepsis neonatal tardía incluyen maniobras de reanimación inmediatamente después del nacimiento, intubación, ventilación mecánica, catéter venoso central, procedimientos quirúrgicos y estancia prologanda en la UCIN. (11)
2.4Agentes Causales / Etiología
En los países desarrollados el Streptococcus agalactiae es la bacteria más comúnmente asociada con meningitis y sepsis neonatal, con una alta morbimortalidad. En los países en vía de desarrollo son los entéricos gram negativos como Klebsiella y E. Coli y el S. Aureus, las principales causas de infección en la primera semana de vida. Otros organismos que debemos de tener presentes son L. monocytogenes y H. influenza. En cuanto a la sepsis tardía, el estafilococo coagulasas negativo, principalmente en neonatos hospitalizados y con accesos venosos, el estafilococo áureo, Estreptococo del grupo B, enterococos y otros gram negativos. Cada vez hay más reportes de diferentes virus y hongos como causa de sepsis neonatal. (11)
En los países en vías de desarrollo los microroganismos más frecuentes son los microorganismos gram negativos (Klebsiella, Escherichia coli, Pseudomonas y Salmonella), seguido de microorganismos gram positivos (Streptococcus agalactiae del
Streptococcus pneumoniae y Streptococcus pyogenes). (12) (13)
El origen etiológico de la sepsis neonatal temprana dependerá de factores como la presencia en la madre de membranas ovulares íntegras o rotas; cuando hay membranas ovulares íntegras se sospecha principalmente de infección por: Mycoplasma hominis, Ureaplasma urealyticum, Fusobacterium spp, Gardnerella spp, Bacterioides spp, Peptostreptococcus
spp, Neisseria gonorrhoeae, Clamydia trachomatis. Cuando hay ruptura de membranas
ovulares los organismos relacionados son el Streptococo beta-hemolítico del grupo B (EGB) o el Streptococcus agalactiae y los Gram negativos entéricos, que son los que con mayor frecuencia se aíslan en el recto y vagina materna al final de la gestación. (13)
La exposición a Streptococcus agalactiae durante el nacimiento es común, lo que da como resultado la colonización de 1 de cada 10 recién nacidos. Generalmente es adquirido durante el trabajo de parto, es raro observarlo en neonatos nacidos por cesárea con membranas integras.6 Los factores de riesgo para su aparición son recién nacidos pretérmino, hijos de madres con antecedentes de sepsis neonatal en embarazos anteriores, infección de vías urinarias en el embarazo actual por S. agalactiae, ruptura prematura de membranas mayor de 18 horas, fiebre intraparto. (11)
2.5Manifestaciones clínicas
intravascular diseminada, hipertensión pulmonar, ictericia inexplicada y signos localizados de infección de piel, cordón umbilical o articulaciones. (2)
El 90% de los recién nacidos con sepsis tiene al menos un síntoma y más del 90% de los recién nacidos sépticos presentan síntomas en las primeras 24 horas de vida; el resto lo presentan antes de las 48 horas, por lo tanto la observación durante este tiempo es clave en el diagnóstico de sepsis neonatal. (14)
Es importante señalar que existen criterios objetivos que permiten sospechar sepsis (fiebre o hipotermia, taquicardia, taquipnea, alteración de conciencia, oliguria, mala perfusión periférica e inestabilidad hemodinámica).(15)
En la sepsis neonatal temprana las manifestaciones clínicas son de aparición abrupta con falla multisistémica, dificultad respiratoria severa, cianosis y apnea, mientras que la sepsis neonatal nosocomial es subaguda, insidiosa y presenta características como deterioro en el estado hemodinámico, ventilatorio y metabólico, desaceleraciones en la frecuencia cardíaca, necesidad de aumentar parámetros ventilatorios si el paciente se encuentra con asistencia respiratoria mecánica o reiniciar la ventilación mecánica en caso de haberse suspendido. (11)
El diagnóstico de sepsis neonatal probada es difícil por el alto porcentaje de cultivos negativos, por ello se ha creado el término de sepsis clínica, con base en los síntomas que se originan) y en las características clínicas descritas. (16)
2.6Pruebas Diagnósticas
la realización de pruebas diagnósticas. Algunas pruebas de tamizaje no especificas se usan para evaluar al recién nacido con sospecha de infección, y pruebas diagnosticas más especificas para confirmar la presencia de un determinado patógeno en los líquidos corporales. El examen diagnóstico temprano debe tener una alta sensibilidad más que especificidad.
No existe en la actualidad ningún marcador analítico que confirme o descarte con seguridad la infección en el neonato y el clínico no puede esperar los resultados de los cultivos de sangre o líquido cefalorraquídeo (LCR) para iniciar el tratamiento antibiótico.
El aislamiento de microrganismos en sangre, LCR u orina continúa siendo el patrón de oro para el diagnóstico definitivo de sepsis neonatal; sin embargo, la confirmación de un cultivo positivo puede tomar días y la sensibilidad de los cultivos es baja en la mayoría de los casos por el uso concomitante de antibióticos, bajo volumen de sangre para la muestra o bajo recuento de colonias. (2) Adicionalmente, los signos clínicos de sepsis son inespecíficos, en particular en recién nacidos pretérmino, en quienes la aparición de sepsis puede ser aguda, con un rápido deterioro.
Dentro de los estudios de laboratorio más comúnes y fácilmente disponibles está el cuadro hemático, con el cual se busca evaluar la probabilidad de infección en un recién nacido con factores de riesgo.
Entre los parámetros más usados del cuadro hemático se encuentra el conteo de leucocitos y neutrófilos absolutos, la relación de neutrófilos inmaduros / maduros, cambios en la morfología o degeneración como la vacualización, bacterias intracelulares o granulaciones tóxicas, que son estudiados y analizados individualmente y en conjunto. (11)
No se requiere estudiar a un recién nacido para iniciar tratamiento si el cuadro clínico corresponde a un caso obvio. El tratamiento temprano es crucial y consiste en medidas de soporte y uso de antibióticos. Se debe tener en cuenta que los antibióticos toman tiempo para actuar y las medidas de soporte constituyen la diferencia entre la vida y la muerte. El propósito de estas medidas es normalizar la temperatura, estabilizar el estado cardiovascular, corregir la hipoglucemia y prevenir sangrados. No existe una recomendación única sobre el esquema antibiótico de elección. La elección del antibiótico depende de la fuente de la infección, de la sospecha sobre el agente casual y de la sensibilidad antimicrobiana. (2)
3 Marco de referencia metodológico
3.1¿ Por qué desarrollar una recomendación basada en evidencia?
El proceso de toma de decisiones en medicina es un proceso complejo y multidimensional. Requiere no solo raciocinio fisiopatológico y deducciones de hipótesis biológicas basadas en la experiencia del clínico, sino la evaluación empírica de estas hipótesis y la obtención de la mejor información disponible.
La MBE incluye una serie de pasos sucesivos: a) identificar el problema del paciente sobre el que hay que tomar una decisión, b) convertirlo en una pregunta estructurada, que pueda ser contestada usando evidencia científica (por ejemplo, con estructura PECOT) c) hacer una búsqueda (no sistemática) de evidencia, d) recuperar y evaluar críticamente la evidencia identificada y e) incorporar los resultados de este proceso en la toma de decisiones específica para el paciente o para el problema clínico que dio origen al ejercicio.
La MBE se presenta como una herramienta de gran utilidad para la toma de decisiones, en especial para la generación de Guías de Práctica Clínica basadas en evidencia. Las Guías de Práctica Clínica (GPC) se pueden definir como: “recomendaciones desarrolladas sistemáticamente para asistir a los profesionales de la salud y a los pacientes en la toma de decisiones respecto al cuidado de salud más apropiado, en circunstancias clínicas específicas”. (17) Cuando se desarrollan de manera rigurosa, son consideradas como una
forma de investigación original integradora. (18)
Las GPC incluyen recomendaciones basadas en evidencia (RBE) que reúnen los conceptos fisiopatológicos, la experiencia de clínicos expertos, los estudios epidemiológicos, revisiones sistemáticas de la evidencia disponible y los valores y preferencias de los pacientes.
Las RBE son desarrolladas por grupos multidisciplinarios que se encargan de emitir recomendaciones para un contexto específico, sintetizando grandes volúmenes de conocimiento, con el fin de mejorar los procesos de calidad en atención en salud. (18)
La MBE es el uso de la mejor evidencia disponible para asistir en la toma de decisiones de dos áreas que están a su vez relacionadas, diagnóstico y tratamiento. El área de diagnóstico hace referencia a cómo evaluar una prueba y luego emplearla para estimar la probabilidad de que un paciente tiene una enfermedad determinada. El área de tratamiento corresponde a cómo determinar si un tratamiento resulta beneficioso en pacientes con una enfermedad determinada; y si resulta serlo, si los beneficios superan los costos y riesgos. Estas dos áreas están profundamente relacionadas. Aunque el diagnóstico puede ser útil para pronóstico, registro y seguimiento epidemiológico e interés científico, existen circunstancias en las que no se justifican los costos y riesgos que implican la realización de una prueba, si no existe un tratamiento efectivo para la enfermedad diagnosticada. Inclusive si existe un tratamiento efectivo pero las probabilidades de presentar la enfermedad son muy bajas, puede no justificarse realizar una prueba. Estas probabilidades dependen no solo de los costos y de las características operativas de la prueba sino también de la efectividad del tratamiento. (19)
3.3Decisiones clínicas y umbrales de diagnóstico y de tratamiento
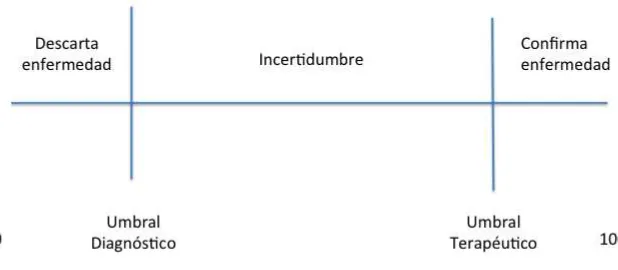
para que en términos prácticos el clínico descarte la enfermedad y no justifique realizar pruebas diagnósticas o intervenciones terapéuticas (área de descarte de enfermedad); la de la extrema derecha entre el umbral terapéutico y el 100%, que corresponde a las situaciones en las que la probabilidad es lo suficientemente elevada como para que el clínico decida iniciar una intervención sin necesidad de obtener exámenes adicionales (área de confirmación de la enfermedad) y el segmento intermedio, entre los dos umbrales, que representa el área en la que la probabilidad es insuficiente para confirmar o descartar (área de pruebas diagnósticas) y se requiere de información adicional (recolectada a través de maniobras y exámenes diagnósticos) que modifique la probabilidad hasta que cruce uno de los dos umbrales, bien sea el de diagnóstico, para finalmente descartar la enfermedad, o bien sea el terapéutico, para confirmarla.
[image:19.612.163.472.522.657.2]La ubicación de los umbrales es un proceso dinámico y no necesariamente explícito, que llevamos a cabo los clínicos, básicamente teniendo en cuenta las consecuencias para el paciente en caso de no diagnosticar la enfermedad, y contrastado con las consecuencias de diagnosticarla falsamente y ser expuesto innecesariamente al tratamiento. (19)
4. Justificación
El problema que enfrenta un clínico que maneja a recién nacidos con sospecha de sepsis neonatal es cómo tratar oportuna e intensamente a los sujetos que se benefician de tratamiento y omitir ofrecer tratamiento empírico a los sujetos sospechosos que eventualmente no tengan sepsis.
La tarea sería fácil si existiera una herramienta que discrimine entre los recién nacidos que tienen sepsis neonatal y aquellos que no tienen sepsis. El clínico puede clasificar a los recién nacidos en tres categorías de acuerdo con los antecedentes perinatales y con el examen físico. Una primera categoría son aquellos recién nacidos en quienes la posibilidad de sepsis es tan baja que la mayoría de los clínicos estarían de acuerdo en no iniciar investigación activa y tratamiento de sepsis. La segunda categoría corresponde a aquellos recién nacidos en quienes el riesgo es lo suficientemente elevado como para que los clínicos inicien tratamiento empírico e investigación confirmatoria de sepsis. Por ultimo, queda un numero considerable de recién nacidos en una tercera categoría, en quienes existe una gran incertidumbre. En estos casos el clínico debería buscar una herramienta adicional que le permita disminuir la incertidumbre en ese grupo.
otro extremo del espectro hay un umbral a partir del cual se justifica investigar la enfermedad (umbral diagnóstico). Cuando el clínico evalúa a un recién nacido con sospecha de sepsis neonatal, el principal reto corresponde a los recién nacidos que no cruzan el umbral terapéutico o diagnóstico. En estos casos el clínico necesita información adicional que modifique su percepción de que el recién nacido tiene sepsis neonatal.
La prueba diagnóstica puede clasificar erróneamente a los recién nacidos. El clínico debe tener una estrategia que le permita usar la información imperfecta de manera válida y repetible para modificar la estimación de la probabilidad de la enfermedad en recién nacidos que estén entre los dos umbrales y en los que exista incertidumbre.
Dado que una prueba diagnóstica es imperfecta, el resultado de una prueba no debe sustituir la sospecha diagnóstica, sino modificarla.
5. Objetivos
5.1 Propósitos
pragmática medir e interpretar indicadores de impacto sencillos, válidos y útiles, que sirvan como base para el aseguramiento de la calidad de atención basada en evidencia, del recién nacido.
5.2Objetivo General
Estimar las características operativas del recuento total de células blancas, recuento absoluto de neutrófilos y la razón de formas inmaduras a neutrófilos totales por medio de una revisión sistemática de la literatura, con el fin de asistir la formulación de una recomendación basada en evidencia que utilice el modelo de umbral para el manejo del recién nacido con sospecha de sepsis neonatal temprana.
5.25.3 Objetivos Específicos
Definir los parámetros del modelo umbral que se va a emplear por medio de un
consenso de expertos; definir el riesgo de sepsis neonatal temprana por encima del cual los expertos consideran que todo recién nacido debe recibir manejo (umbral terapéutico); definir el riesgo de sepsis por encima del cual los expertos consideran que se debe investigar a todo recién nacido para sepsis neonatal temprana (umbral diagnóstico).
Estimar la probabilidad preexamen de sepsis en diferentes escenarios de recién
Estimar las características operativas del recuento total de células blancas, recuento
absoluto de neutrófilos y la razón de formas inmaduras a neutrófilos totales por medio de una revisión sistemática de la literatura.
Definir los criterios de búsqueda.
Definir criterios de selección de artículos primarios.
Realizar una búsqueda exhaustiva de la literatura científica disponible.
Selección inicial de estudios primarios.
Evaluación de la calidad de los estudios primarios.
Extracción de los datos provenientes de estudios primarios previamente
seleccionados.
Análisis y presentación de resultados.
6. Metodología
La presente guía es el resultado de un proceso de investigación integradora realizada para generar recomendaciones basadas en evidencia. En su desarrollo se siguieron los pasos propuestos en el documento “Guía Metodológica para la elaboración de Guías de Práctica
Clínica basadas en evidencia, de evaluaciones económicas y de evaluación del impacto de la implementación de las guías en el POS y en la Unidad de Pago por Capitación del Sistema General de Seguridad Social en Salud Colombiano”, y se hicieron modificaciones
En esencia, cada recomendación es la respuesta a una pregunta científica relacionada con el proceso de cuidado de la salud de interés de la Guía. Las preguntas se plantean a propósito de cada punto en el proceso de atención en salud en el que el usuario de la guía y su paciente (o su familia) tienen que tomar decisiones con respecto a intervenciones específicas. Para responder cada pregunta, se llevó a cabo una revisión sistemática de la literatura científica que incluye búsqueda, selección, recuperación, extracción de información, apreciación crítica y elaboración de tablas de evidencia. El producto de la revisión se usó para formular recomendaciones específicas por un panel de expertos, siguiendo fundamentalmente la metodología propuesta por el grupo GRADE. (21)
El equipo desarrollador de la guía es un grupo multidisciplinario integrado por 4 subgrupos: a) expertos metodológicos, b) expertos de contenido (académicos de las universidades participantes y especialistas miembros de las sociedades científicas pertinentes -Pediatría y Neonatología-), c) representantes de los usuarios y d) representantes de los pacientes. Cada subgrupo desarrolló tareas específicas de acuerdo con su área de conocimiento o experiencia. Los integrantes del equipo recibieron capacitación básica en la elaboración de guías, y estandarización de definiciones, conceptos y métodos de generación de recomendaciones, por parte de los expertos metodológicos vinculados al proyecto.
insatisfactorias, se pasaba a estudios individuales con el mejor diseño posible de acuerdo con cada tipo de pregunta. En ausencia de investigación primaria se recurría a raciocinio fisiopatológico y a opiniones de expertos.
En el caso de identificarse guías potencialmente útiles, se contemplaba realizar una adaptación estandarizada (metodología ADAPTE (22) modificada de acuerdo con la propuesta del grupo de Nueva Zelanda). De lo contrario, se procedía a generar recomendaciones de novo. Para cada recomendación de novo se realizó una síntesis de la evidencia, se elaboraron perfiles y resúmenes de evidencia según la metodología GRADE y se formularon las recomendaciones basadas en evidencia. (21, 23)
Los resultados de cada etapa (formulación de preguntas y generación de recomendaciones), se sometieron a procesos de socialización y legitimación por pares y la comunidad.
En la etapa de formulación de preguntas, el resultado del trabajo del grupo desarrollador fue debatido en un foro público al que asistieron representantes del ente gestor (Ministerio de Salud Protección Social y Colciencias), de la academia (programas de formación de pregrado y posgrado de medicina y otras ciencias de la salud), de las asociaciones profesionales, y de agremiaciones y grupos de soporte de pacientes. Antes del debate se publicó el texto de las preguntas en la página web del Ministerio de Salud y se recibieron preguntas y sugerencias.
pacientes. El proceso se documentó (videograbaciones, grabaciones de voz, apuntes de campo) y se transcribió rigurosamente y las actas finales fueron aprobadas por los participantes. Además se les solicitó que, utilizando la metodología de GRADE para priorización de los desenlaces, realizaran un ordenamiento y priorización en tres categorías: desenlaces críticos, importantes y no críticos no importantes. Se utilizó una técnica formal de consenso llamada grupos nominales que reduce el riesgo de sesgos.
En la etapa de generación de recomendaciones se cumplieron tres pasos para asegurar la participación apropiada de todos los actores: a) generación de recomendación basada en evidencia, formulada por los expertos metodológicos y de contenidos, b) debate amplio en foro abierto (participaron todas las partes interesadas, aún con conflictos de interés), precedida por una publicación en la página web del Ministerio de Salud y usando los lineamientos metodológicos de las Conferencias de Consenso de los Institutos Nacionales de Salud de los EUA; y c) Talleres de validación de las versiones finales de las recomendaciones, adelantados con grupos extensos de usuarios (más de 30 participantes), agremiaciones profesionales y grupos asistenciales de la salud no médicos, padres de pacientes, agremiaciones y grupos de soporte de pacientes y público en general.
7. Resultados
7.1Pregunta Clínica
¿En recién nacidos con sospecha de infección neonatal, el cuadro hemático (CH) y las medidas derivadas del mismo como índices leucocitarios, tienen alta sensibilidad para detectar infección neonatal?
7.2Búsqueda de la literatura
Se hizo una búsqueda sistemática inicial de guías de práctica clínica en las siguientes fuentes y bases de datos: Trip Database (metabuscador y base de datos que busca repositorios de guías en EUA, Canadá, Reino Unido Australia, Nueva Zelanda, Pubmed y al menos 4 sistemas de búsqueda de evidencia: Netting the evidence, Laval University, ATTAC services y búsquedas manuales y automatizadas en internet), SumSearch2 (reúne el National Guidelines Clearinghouse del AHRQ de los EUA, DARE y Center for Research and Dissemination del National Institute for Health Research del Reino Unido, y Medline -a tr-avés de Pubmed-); EMBASE y Pubmed.
No se encontraron guías de práctica clínica.
En segundo lugar se hizo una búsqueda de revisiones sistemáticas de la literatura en las bases de datos Medline, que incluye la base de revisiones sistemáticas realizadas por la colaboración Cochrane, y EMBASE.
temprana. Adicionalmente la revisión no incluía una apropiada evaluación de la calidad de los estudios primarios, motivo por el cual se consideró con alto riesgo de sesgo. Siguiendo estas consideraciones se decidió realizar una nueva revisión sistemática de la literatura y no realizar una actualización de la misma.
Para cada tipo de estudio y fuente se generó una estrategia que utilizó un filtro de búsqueda específico (por tipo de estudio o publicación), que denominamos “filtro metodológico” y un
componente temático basado en la pregunta PECOT, usando el léxico de campos temáticos específicos según motor de búsqueda (MeSH Index para Medline y Cochrane Central, EMTREE “map preferred term” -MPT- para EMBASE). Las estrategias usadas en
Sumsearch2 usan los sistemas incorporados en los motores de búsqueda que sirven cada sitio. Los filtros metodológicos para EMBASE fueron adaptados a partir de los filtros publicados por SIGN. Dado que el lenguaje de consulta de EMBASE cambió desde la publicación de los filtros de SIGN, se realizó una traducción, prueba y calibración para que funcionen en la versión actual de EMBASE (2011-2012). Se revisaron los filtros para Medline propuestos por SIGN, que son una adaptación de los desarrollados por el Departamento de Epidemiología Clínica de la Universidad McMaster (Bryan Haynes). Dichos filtros fueron perfeccionados por el grupo de McMaster y actualmente forman parte del motor de búsqueda de Medline (Clinical Queries). Previa consulta con el desarrollador (Dr. Haynes) se decidió usarlos como filtro metodológico para Medline.
Búsqueda de estudios primarios
través de los filtros específicos de Medline y EMBASE para revisiones sistemáticas. Luego de no encontrar evidencia en los pasos previos se procedió a realizar una búsqueda sistemática de artículos primarios.
Identificación de estudios
Se realizó una búsqueda en las bases de datos Medline y EMBASE. Los términos de búsqueda empleados fueron “Blood cell count” “Sepsis” “Infant” “Newborn Infection”. No se aplicaron restricciones.
Selección de estudios y extracción de datos
Se seleccionaron los estudios para incluir en la RSL con base en los siguientes criterios de inclusión y de exclusión.
Criterios de inclusión: El artículo cumple con la definición de sepsis neonatal temprana menor de 72 horas (la definición puede ser por cultivo o clínica compatible con sepsis neonatal temprana), la prueba diagnóstica debe ser tomada dentro las primeras 72 horas, previo al inicio antibiótico. Debe incluir información sobre el total de sujetos con la enfermedad y sin la enfermedad, información en términos absolutos o relativos de verdaderos y falsos negativos para cada punto de corte. Idealmente los estudios deben incluir espectro de la enfermedad, sin embargo este no constituye un criterio de exclusión.
Criterios de exclusión: Que la sangre fuese del cordón o materna. Estudios en los cuales no se puede diferenciar sepsis temprana de sepsis tardía, en caso de existir análisis de subgrupos en los cuales se evalúe sepsis neonatal temprana estos se incluyeron.
Dos revisores examinaron la lista de los artículos identificados, preseleccionaron los artículos revisando el título o el resumen y descartaron los artículos irrelevantes temáticamente o por tipo de publicación (ej. revisiones narrativas, editoriales o cartas al editor). Los dos revisores compararon sus resultados y resolvieron sus discrepancias por consenso. En caso de duda o discrepancia persistente entre los revisores, se solicitó y consiguió el artículo completo.
Se obtuvo un total de 266 artículos, después de revisar los títulos y resúmenes se seleccionaron 53 artículos para revisión en texto completo. Se excluyeron 49 artículos por diferentes motivos, siendo el motivo más frecuente la imposibilidad para individualizar a los recién nacidos con sepsis neonatal temprana de aquellos con sepsis neonatal tardía.
Cuatro estudios cumplieron los criterios de selección; (25) (26, 27) (28) las características principales de los estudios se incluyen en una tabla en el anexo 1.
Los cuatro estudios tuvieron gran variabilidad con respecto a los criterios de reclutamiento. En especial hubo gran heterogeneidad en cuanto al peso al nacer y edad gestacional, siendo imposible individualizar el comportamiento del hemograma entre los subgrupos de recién nacidos prematuros o bajo peso al nacer.
Se realizó evaluación de calidad de los estudios de acuerdo con la herramienta QUADAS recomendada por la Colaboración Cochrane.(29) La evidencia es de buena calidad, no se identificaron sesgos de espectro de la enfermedad o de verificación.
El estudio de Newman tiene información de RN a término o muy cercanos al término, en quienes la biología del CH es relativamente uniforme. Adicionalmente el estudio brinda información de más de 67,000 recién nacidos, lo que corresponde a 150 veces más recién nacidos que los tres estudios combinados. (28)
Se solicitó un cuadro hemático y hemocultivo a todo recién nacido de acuerdo con
protocolos locales y juicio clínico del personal médico. Se sospechó sepsis en todo recién
nacido con signos clínicos de sepsis o factores de riesgo maternos, sin embargo la gran
mayoría de recién nacidos fueron asintomáticos.
Los hemocultivos constituyeron el patrón de oro para determinar sepsis neonatal temprana,
independiente del resultado del cuadro hemático. Se empleó el algoritmo basado en
categoría de riesgo según microorganismo y tiempo de positividad del cultivo para
clasificar los hemocultivos como positivo o negativo.
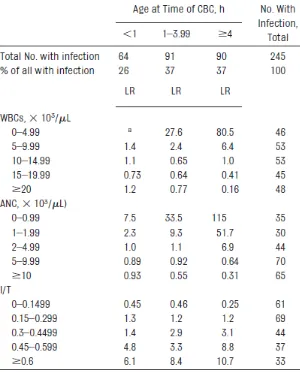
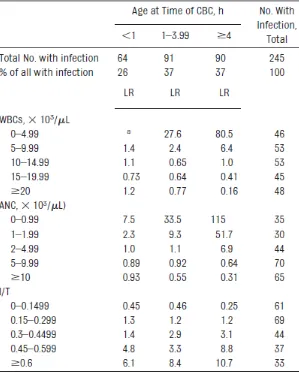
neutrófilos totales) (Figura 3), proporcionando LR estratificados que permiten hacer estimaciones muy precisas de probabilidades futuras (valores predictivos altos).
Los datos de este estudio recalcan que las características operativas de las diferentes mediciones en el hemograma mejoran cuando la muestra se toma después de las 4 horas.
Figura 3. LRs para cada una de las mediciones realizadas en el hemograma para el diagnóstico de sepsis neonatal temprana, de acuerdo con la edad al momento de la toma de la muestra. (28)
[image:32.612.103.403.298.670.2]positivo en un sujeto que tiene la enfermedad ( verdaderos positivos) con la de obtener un
mismo resultado en un sujeto sin la enfermedad (falsos positivos). Un LR mayor de uno
implica que ese resultado es más probable en sujetos con la enfermedad, y cuanto más
alejado de uno, mayor es la probabilidad de observar ese resultado en un sujeto enfermo, y
más aumentará la probabilidad postest. A la inversa, si el LR es menor a uno, la
probabilidad de enfermedad disminuye; así cuanto más pequeño sea el LR, menor será la
probabilidad postest de enfermedad.
El autor no reportó los LR para el conteo de plaquetas según estrato ya que no obtuvo
un LR significativamente diferente de uno. Un LR igual a uno no cambia la probabilidad
de enfermedad, o lo que es lo mismo, la probabilidad postest será igual a la pretest, no
aporta información para la toma de decisiones.
Los valores de LR según los distintos parámetros del cuadro hemático para los valores de
referencia ( valores considerados normales) se encuentran en un rango entre 0.15 a 0.3, se
ha descrito que valores entre 0.2 y 0.5 producen cambios pequeños en la probabilidad de la
enfermedad. Mientras que los valores de LR para los parámetros del cuadro hemático que
son considerados “anormales” se encuentran en un rango de 50 a 120, donde la
modificación de la probabilidad pretest a la postest suele ser concluyente para confirmar o
descartar la enfermedad. Estos valores “anormales” o extremos corresponden a los valores
más bajos del recuento total de células blancas y recuento absoluto de neutrófilos.
7.3Definición de los parámetros del modelo umbral
objetivo (basado en estudios de prevalencia de la condición en poblaciones con síntomas definidos) o subjetivo (estimación hecha por el clínico basada en su experiencia, en su apreciación subjetiva de la frecuencia de la condición, etc.).
La determinación de los umbrales diagnóstico y terapéutico nace de una valoración hecha por el clínico (juicio subjetivo informado) de las consecuencias de iniciar tratamiento en un falso positivo (con probabilidad postest que cruce el umbral terapéutico) o descartar la enfermedad en un falso negativo (probabilidad postest más baja que el umbral diagnóstico. Dicha valoración debe incorporar las preferencias del paciente o de la población potencialmente afectada.
Se realizó un ejercicio dinámico con los expertos temáticos, utilizando como insumo los resultados de la recomendación basada en la evidencia sobre el inicio del manejo antibiótico en recién nacidos hijos de madres con diagnóstico clínico de corioamnionitis. Se logró evidenciar en estudios primarios que la incidencia de sepsis neonatal temprana en hijos de madres con diagnóstico de corioamnionitis es relativamente baja, 1.3%. (30) (31)
Adicionalmente, utilizando como insumo la tabla que se presenta a continuación proveniente del artículo de Gerdes, (32) se plantearon distintos escenarios para explorar y cuantificar el riesgo de sepsis neonatal que los expertos estaban dispuestos a tolerar.
Tabla 1. Factores de riesgo para sepsis neonatal
Factores de riesgo Incidencia de sepsis neonatal
RPMO* > 18 horas
RPMO + Prematuridad 4 – 6%
RPMO + APGAR < 6 a los 5 minutos 3 – 4%
Corioamnionitis materna 3- 8 %
Madre (+) EGB** (sin profilaxis) 0.5 - 1%
Madre (+) EGB (con profilaxis) 0.2 – 0.4 %
Madre (+) EGB + RPMO o Fiebre o Prematuridad
4 – 7 %
Madre (+) EGB + Corioamnionitis 6 – 20%
*: Ruptura prematura de membranas ovulares, **: Estreptococo del grupo B
Se definió como umbral diagnóstico 2% y umbral terapéutico 5%.
8. Discusión
El alcance de una revisión sistemática de la literatura determina en gran medida qué tan diversos serán los estudios incluidos. Algunas veces una revisión incluirá estudios que resuelven una variedad de preguntas, por ejemplo cuando diferentes intervenciones son de interés para una misma condición. Los estudios deben ser analizados y presentados individualmente. Solo se puede considerar la opción de metaanálisis cuando el grupo de estudios es lo suficiente homogéneo en términos de participantes, intervención y desenlace.
Teniendo en cuenta la heterogeneidad clínica y la superioridad del estudio de Newman respecto a tamaño de muestra y calidad, se considera que incluir los estudios restantes solo agregaría ruido a los resultados.
El estudio proporciona información muy precisa y detallada de múltiples puntos de corte para los tres índices de interés (leucocitos, neutrófilos absolutos y razón de inmaduros a n totales) (Figura 3), y proporciona LR estratificados, a diferencia de los otros tres estudios, que proporcionan sensibilidades y especificidades.
La habilidad discriminativa del cuadro hemático mejora dramáticamente cuando la muestra
se toma después de las 4 horas de vida de los recién nacidos. Es mucho más informativo
utilizar LR específicos según estrato para cada parámetro que intentar dicotomizar los
resultados del cuadro hemático dentro de un grupo normal y anormal.
Si se empleara la estrategia de establecer los resultados del cuadro hemático dentro de un
grupo normal, los valores superiores del conteo de células blancas (<20.000) y conteo
absoluto de neutrófilos (<10.000) llevaría a recién nacidos con estos niveles a ser
categorizados con resultados “anormales” cuando en realidad sólo un conteo bajo de estos
El interés de la prueba se aborda desde la perspectiva de la habilidad discriminativa, la
capacidad de clasificar correctamente a recién nacidos con sepsis neonatal temprana, el
interés no radica en los desenlaces finales con el uso de la prueba.
Los textos clásicos han definido la utilidad de una prueba diagnóstica como accuracy que
corresponde a la proporción de sujetos correctamente clasificados. Sin embargo la palabra
utilidad también es empleada para describir la utilidad de una intervención en términos de
desenlaces finales que tienen en cuenta las preferencias de los pacientes por desenlace, lo
que ha generado confusión.
La habilidad discriminativa del cuadro hemático provee información para la toma de
decisiones clínicas referente a la posibilidad de sepsis, por ejemplo, si el interés es decidir
si iniciar manejo antibiótico empírico sería aconsejable diferir la toma del cuadro hemático
hasta las cuatro horas de vida. En el caso que los factores de riesgos o clínica del recién
nacido sean lo suficientemente preocupantes o graves para tomar un cuadro hemático
previo a las cuatro horas de nacimiento, puede ser prudente iniciar manejo antibiótico
simultáneo a la toma de la muestra, en vez de esperar los resultados. En este último caso la
probabilidad pretest del clínico sobrepasaría el umbral terapéutico, no requeriría la ayuda
del cuadro hemático y probablemente el resultado de este no cambiaría su decisión.
En aquellos recién nacidos en quienes la decisión para iniciar antibióticos se puede diferir
hasta cuatros horas después de nacimiento, en quienes existe incertidumbre y la
probabilidad pretest no sobrepasa el umbral diagnóstico o terapéutico, los resultados del
cuadro hemático serán de gran ayuda. Newman establece que la mayoría de los recién
nacidos tendrán un resultado de los distintos parámetros del cuadro hemático con LR
moderados en un rango entre 0.2 a 0.5, como se describió anteriormente valores entre 0.2 y
interprete adecuadamente el cuadro hemático, la decisión para iniciar manejo antibiótico
depende en gran medida de factores de riesgo maternos y la sintomatología del recién
nacido compatible con sepsis (probabilidad pretest).
Tanto si el resultado de una prueba se expresa como variable dicótoma o como polítoma, e incluso continua, es necesario evaluar la capacidad global de la prueba para clasificar correctamente a los pacientes. La sensibilidad y especificidad, o las razones de posibilidades sirven para expresar la manera como se modifican las probabilidades condicionales de enfermedad. Las razones de posibilidades, por otra parte, pueden emplearse para utilizar la información específica proveniente de pruebas con diferentes posibles puntos de corte, o incluso con valores expresados como variable continua.
En 1978 Ransohoff y Feinstein introdujeron el concepto de espectro de pacientes, observaron que el resultado de una prueba podía variar de acuerdo a si se incluía un rango muy estrecho de pacientes con la enfermedad, así como un rango muy estrecho de pacientes sin la enfermedad. Mostraron gran preocupación de que la relación entre el estado de la enfermedad y el desempeño de la prueba pudiera variar de acuerdo con las características de los pacientes. (33)
El término sesgo de espectro se aplica comúnmente cuando la relación entre enfermedad y prueba es heterogénea en subgrupos de pacientes, y que el estudio incluye solo una fragmento limitado de todo el espectro de la enfermedad. (37) El término sesgo de espectro es restringido porque sugiere falsamente que existe un error sistemático en el diseño del estudio o en la recolección de datos, que compromete la validez de los resultados. La literatura reciente recomienda que se haga una clara distinción entre sesgo de espectro y efecto del espectro de la enfermedad, que refleja la variación inherente en el desempeño de una prueba diagnóstica en subgrupos poblacionales. (38)
La variación en subgrupos no constituye un sesgo si no corresponde a información clínica relevante que deba ser identificada y reportada con un análisis apropiado. Si existe efecto de espectro de la enfermedad se debe manejar la heterogeneidad con análisis de subgrupos del desempeño de la prueba. Reportar un solo estimativo ponderado del desempeño de una prueba resulta en utilidad clínica limitada. Cuando existe heterogeneidad, la estimación ponderada no es generalizable para ninguna población especifica de pacientes. (37)
9. Respuesta basada en la evidencia y recomendación
No se recomienda utilizar estimadores de sensibilidad y especificidad sino razones de posibilidades (LR por sus siglas en inglés). Los LR asociados con diferentes niveles de recuento total de células blancas, de recuento absoluto de neutrófilos y de la razón de formas inmaduras a neutrófilos totales tiene una muy elevada capacidad de discriminación.
A. La habilidad discriminativa de las diferentes mediciones en el hemograma mejora cuando la muestra se toma al menos 4 horas después del nacimiento.
B. En caso de que el recién nacido se esté deteriorando o de que los factores de riesgo sugieran alta probabilidad de sepsis, se debe iniciar tratamiento antibiótico sin esperar los resultados del CH.
C. Si se estima que el riesgo de sepsis (incidencia esperada) es moderado o bajo (inferior a 5% pero >2%) y el paciente está estable (a término y sin comorbilidades), se debe realizar un CH, idealmente después de las 4 horas de vida.
D. Si el riesgo de sepsis es menor de 2% no se aconseja tomar rutinariamente un CH. En el caso de que por cualquier otra indicación se tenga información de un CH obtenido después de las 4 h del nacimiento, el conteo de leucocitos < 5000 indicará todavía un riesgo muy elevado de sepsis y necesidad de tratamiento, pero valores entre 5000 y 15000 no cambiarán el estimativo de probabilidad y no ayudarán a confirmar o descartar. Los leucocitos >15000 prácticamente descartarán el diagnóstico de sepsis (valores predictivos positivos muy inferiores a 1%).
E. En caso de discrepancia entre los resultados del recuento total de leucocitos, el recuento absoluto de neutrófilos y la razón I/T, se recomienda actuar de acuerdo con el parámetro con el resultado más desfavorable. Por ejemplo, si la razón I/T es 0.30 (no alarmante), el recuento total de neutrófilos es 1200 por ml (sugiere que no hay sepsis) pero el recuento total de leucocitos es inferior a 5000, se recomienda asumir que el niño tiene sepsis.
Nivel de evidencia: moderada ⊕⊕⊕⊝
Figura 3. LRs para cada una de las mediciones realizadas en el hemograma para el diagnóstico de sepsis neonatal temprana, de acuerdo con la edad al momento de la toma de la muestra.
A continuación, se presenta la forma en que se interpretaría el resultado de uno de los índices:
[image:41.612.104.403.200.573.2]1. Se asume un neonato que por sus características clínicas tiene una incidencia esperada (probabilidad pretest o riesgo cuantitativo) de sepsis temprana, entre menos de1 y 5%. Para este caso el LR obtenido del WBC <5.000 es 80,5 (Figura 3).
Si la frecuencia esperada de sepsis es 5%, los momios de sepsis serían 5/95 o simplificando 1/19. Si el WBC es < 5.000, los momios (ODDS) serían 1/19×80,5 u 80,5/19, lo que al convertirlo en probabilidad daría 80,5/99,5, lo que produce una probabilidad postest aproximada de 80%.
Este resultado se interpreta como que un neonato con una probabilidad pretest de 5% de sepsis temprana, en quien el reporte del hemograma evidencie un recuento de leucocitos menor de 5.000, tendría una probabilidad postest de sepsis de 80%, por lo que debería ser manejado como si tuviese sepsis probada
Por el contrario, los resultados entre 10 mil y 20 mil WBC tienen LR cercanos a 1 que no cambian la probabilidad y por tanto no ayudan a tomar decisiones.
Pueden hacerse operaciones similares con el recuento absoluto de neutrófilos y con el índice de inmaduros/ totales.
9.2Relación entre la evidencia y la recomendación
de este componente del hemograma. Sin embargo, el GDG hace claridad de que cuando existen signos clínicos de sepsis, el inicio de la terapia antibiótica no debe depender del resultado del mismo.
No existe evidencia suficiente para recomendar el recuento plaquetas como marcador de infección de acuerdo con la evidencia.
9.3Población
La recomendación va dirigida a recien nacidos con sospecha de sepsis neonatal temprana y en principio va dirigida a recien nacidos pretérmino y a término.
9.4Usuarios
Personal clínico asistencial que brinde cuidados al recién nacido atendido u hospitalizado en todos los niveles de complejidad de atención en salud. Esto incluye principalmente pediatras generales y neonatólogos, sin embargo la recomendación también está dirigida a médicos generales que ofrecen los primeros cuidados a recién nacidos.
9.5Alcance
Recomendación para el manejo del recién nacido con sospecha de sepsis neonatal temprana en instituciones hospitalarias de todos los niveles de complejidad de atención en salud. En los casos en que el recién nacido nazca en una institución de nivel I y desarrolle complicaciones, debe ser remitido de forma apropiada a un nivel de complejidad superior.
9.6Consideraciones de riesgos y beneficios
la toma de la muestra. Adicionalmente existen riesgos en el recién nacido a quien se diagnostique erróneamente debido a los falsos positivos con el uso de antibióticos y hospitalización innecesaria. Sin embargo, considerando que la sepsis neonatal temprana constituye una de las principales causas de morbimortalidad en el periodo neonatal, los beneficios superan los riesgos.
9.7Consideraciones sobre los valores y preferencias de los pacientes
10.Referencias Bibliográficas
1. Wynn JL, Wong HR. Pathophysiology and treatment of septic shock in neonates. Clinics in perinatology. 2010;37(2):439-79. Epub 2010/06/24.
2. Stefanovic IM. Neonatal sepsis. Biochemia medica : casopis Hrvatskoga drustva medicinskih biokemicara / HDMB. 2011;21(3):276-81. Epub 2011/01/01.
3. Stoll BJ. The global impact of neonatal infection. Clinics in perinatology. 1997;24(1):1-21. Epub 1997/03/01.
4. Bang AT, Bang RA, Baitule SB, Reddy MH, Deshmukh MD. Effect of home-based neonatal care and management of sepsis on neonatal mortality: field trial in rural India. Lancet. 1999;354(9194):1955-61. Epub 2000/01/06.
5. Stoll BJ, Hansen N, Fanaroff AA, Wright LL, Carlo WA, Ehrenkranz RA, et al. Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. The New England journal of medicine. 2002;347(4):240-7. Epub 2002/07/26.
6. Stoll BJ, Hansen N, Fanaroff AA, Wright LL, Carlo WA, Ehrenkranz RA, et al. Late-onset sepsis in very low birth weight neonates: the experience of the NICHD Neonatal Research Network. Pediatrics. 2002;110(2 Pt 1):285-91. Epub 2002/08/08.
7. Stoll BJ, Hansen NI, Higgins RD, Fanaroff AA, Duara S, Goldberg R, et al. Very low birth weight preterm infants with early onset neonatal sepsis: the predominance of gram-negative infections continues in the National Institute of Child Health and Human Development Neonatal Research Network, 2002-2003. The Pediatric infectious disease journal. 2005;24(7):635-9. Epub 2005/07/07.
8. Polin RA. Management of neonates with suspected or proven early-onset bacterial sepsis. Pediatrics. 2012;129(5):1006-15. Epub 2012/05/02.
9. Persson E, Trollfors B, Brandberg LL, Tessin I. Septicaemia and meningitis in neonates and during early infancy in the Goteborg area of Sweden. Acta paediatrica (Oslo, Norway : 1992). 2002;91(10):1087-92. Epub 2002/11/19.
10. Tessin I, Trollfors B, Thiringer K. Incidence and etiology of neonatal septicaemia and meningitis in western Sweden 1975-1986. Acta paediatrica Scandinavica. 1990;79(11):1023-30. Epub 1990/11/01.
11. Coronell W PC. Sepsis Neonatal. Revista de Enfermedades Infecciosas en Pediatría. 2002;XXIII(90).
13. Zaidi AK, Huskins WC, Thaver D, Bhutta ZA, Abbas Z, Goldmann DA. Hospital-acquired neonatal infections in developing countries. Lancet. 2005;365(9465):1175-88. Epub 2005/03/30.
14. Nice clinical guideline. Antibiotics for early-onset neonatal infection. 2012.
15. Mukhopadhyay S, Puopolo KM. Risk assessment in neonatal early onset sepsis. Seminars in perinatology. 2012;36(6):408-15. Epub 2012/11/28.
16. Ng PC. Diagnostic markers of infection in neonates. Archives of disease in childhood Fetal and neonatal edition. 2004;89(3):F229-35. Epub 2004/04/23.
17. MJ F, editor. Criteria for Topic Selection. Committee on Methods for Setting Priorities for Guidelines Development, Institute of Medicine Setting Priorities for Clinical Practice Guidelines; 1995; Washington.
18. Lozano JM CL. Desarrollo de Guías de Práctica Clínica. In: Ruiz AJ ML, editor. Epidemiología Clínica. Bogotá: Editorial Médica Panamericana; 2004. p. 373-94.
19. Newman TB KM. Evidence-Based Diagnosis. New York: Cambridge University Press; 2009.
20. Guía Metodológica para la elaboración de Guías de Práctica Clínica basadas en la evidencia, de evaluaciones económicas y de evaluación del impacto de la implementación de las guías en el POS y en la Unidad de Pago por Capitación del Sistema General de Seguridad Social en Salud Colombiano. Ministerio de la Protección. Colombia. Bogotá 2009.
21. Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ (Clinical research ed). 2008;336(7650):924-6. Epub 2008/04/26. 22. The ADAPTE collaboration. Resource tool kit for guideline adaptation. 2007.
23. Guyatt G, Oxman AD, Akl EA, Kunz R, Vist G, Brozek J, et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. Journal of clinical epidemiology. 2011;64(4):383-94. Epub 2011/01/05.
24. Da Silva O, Ohlsson A, Kenyon C. Accuracy of leukocyte indices and C-reactive protein for diagnosis of neonatal sepsis: a critical review. The Pediatric infectious disease journal. 1995;14(5):362-6. Epub 1995/05/01.
26. Manucha V, Rusia U, Sikka M, Faridi MM, Madan N. Utility of haematological parameters and C-reactive protein in the detection of neonatal sepsis. Journal of paediatrics and child health. 2002;38(5):459-64. Epub 2002/10/02.
27. Bender L, Thaarup J, Varming K, Krarup H, Ellermann-Eriksen S, Ebbesen F. Early and late markers for the detection of early-onset neonatal sepsis. Danish medical bulletin. 2008;55(4):219-23. Epub 2009/02/24.
28. Newman TB, Puopolo KM, Wi S, Draper D, Escobar GJ. Interpreting complete blood counts soon after birth in newborns at risk for sepsis. Pediatrics. 2010;126(5):903-9. Epub 2010/10/27.
29. Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC medical research methodology. 2003;3:25. Epub 2003/11/11. 30. Rouse DJ, Landon M, Leveno KJ, Leindecker S, Varner MW, Caritis SN, et al. The Maternal-Fetal Medicine Units cesarean registry: chorioamnionitis at term and its duration-relationship to outcomes. American journal of obstetrics and gynecology. 2004;191(1):211-6. Epub 2004/08/02004;191(1):211-6.
31. Alexander JM, McIntire DM, Leveno KJ. Chorioamnionitis and the prognosis for term infants. Obstetrics and gynecology. 1999;94(2):274-8. Epub 1999/08/04.
32. Gerdes JS. Diagnosis and management of bacterial infections in the neonate. Pediatric clinics of North America. 2004;51(4):939-59, viii-ix. Epub 2004/07/28.
33. Ransohoff DF, Feinstein AR. Problems of spectrum and bias in evaluating the efficacy of diagnostic tests. The New England journal of medicine. 1978;299(17):926-30. Epub 1978/10/26.
34. Irwig L, Tosteson AN, Gatsonis C, Lau J, Colditz G, Chalmers TC, et al. Guidelines for meta-analyses evaluating diagnostic tests. Annals of internal medicine. 1994;120(8):667-76. Epub 1994/04/15.
35. Begg CB. Biases in the assessment of diagnostic tests. Statistics in medicine. 1987;6(4):411-23. Epub 1987/06/01.
36. Philbrick JT, Horwitz RI, Feinstein AR, Langou RA, Chandler JP. The limited spectrum of patients studied in exercise test research. Analyzing the tip of the iceberg. JAMA : the journal of the American Medical Association. 1982;248(19):2467-70. Epub 1982/11/19.
11.Anexos
11.1 Anexo 1. Características principales de los estudios incluidos.
Artículo Tipo de Estudio
Edad gestacional y peso al nacer
Características Población
Prueba Evaluada
Punto de corte Prueba de oro
Tiempo nacimiento
y toma de la muestra
No. de RN
Mahale et al 2010.
Cohorte prospectiva
Entre las semanas 26 a 40
Edad promedio en semanas: 32.1+/- 3.3 Peso promedio en gramos: 1520+/- 655 16% menores
de 1000 gr.
Pacientes con sospecha clínica de sepsis (Disnea,
apnea, hipotermia) -Conteo absoluto de neutrófilos -Relación inmaduros a totales
Por encima de los limites específicos para edad gestacional aceptados en normas internacionales Cultivo en sangre positivo
0 a 72 horas 125
Newman et al 2010.
Corte transversal
Mayores de 34 semanas (38.8
+/- 1.9)
Pacientes con síntomas de
sepsis o
- Conteo de leucócitos -Leucocitos totales <5000/mm Cultivo en sangre positivo
Peso al nacer 3.430 +/- 560
gramos
factores de riesgo maternos. En su mayoría asintomáticos. -Conteo absoluto de neutrófilos -Relación inmaduros a totales -Conteo absoluto de neutrófilos <2000/mm -Relación inmaduros totales > 0.15 Bender et al
2008.
Cohorte prospectiva
Peso mayor de 1200 gramos.
Pacientes con sospecha de
sepsis por factores de riesgo maternos o clínica compatible. -Relación inmaduros totales
>0.2 Cultivo en sangre positivo.
0 a 72 horas 123
Manucha et al 2002.
Cohorte prospectiva
Entre las semanas 32 a 38
74.7% <2.5 gramos
150 pacientes con riesgo de
sepsis (hallazgos clínicos materno-fetales anormales, NO especifican cuales) -Leucocitos totales -Conteo absoluto de neutrófilos -Conteo de neutrófilos
TLC <5 x 10/L
TNC<8 x 10/L
Bandas >15%
Cultivo en sangre positivo.
inmaduros
-Relación inmaduros maduros
-Relación inmaduros totales
I/M > 0.25