i
EFECTO DE COBERTURAS VEGETALES Y ÉPOCA CLIMÁTICA SOBRE LA DENSIDAD DE MICROORGANISMOS TOTALES Y HETERÓTROFOS
EN SUELOS DE LA ECO-REGIÓN CAFETERA COLOMBIANA
FRANCY HELENA ÁVILA ARIAS ALEJANDRA MILENA CRUZ MORA
TRABAJO DE GRADO
Presentado como requisito parcial para optar al título de
Microbióloga Industrial
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE MICROBIOLOGIA INDUSTRIAL Bogotá, D. C.
ii
NOTA DE ADVERTENCIA
Artículo 23 de la Resolución N° 13 de Julio de 1946
“La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona
iii
EFECTO DE COBERTURAS VEGETALES Y ÉPOCA CLIMÁTICA SOBRE
LA DENSIDAD DE MICROORGANISMOS TOTALES Y HETERÓTROFOS
EN SUELOS DE LA ECO-REGIÓN CAFETERA COLOMBIANA
FRANCY HELENA ÁVILA ARIAS ALEJANDRA MILENA CRUZ MORA
iv
EFECTO DE COBERTURAS VEGETALES Y ÉPOCA CLIMÁTICA SOBRE
LA DENSIDAD DE MICROORGANISMOS TOTALES Y HETERÓTROFOS
EN SUELOS DE LA ECO-REGIÓN CAFETERA COLOMBIANA
FRANCY HELENA ÁVILA ARIAS ALEJANDRA MILENA CRUZ MORA
v
Agradezco a Dios por ser mi guía y protector y por brindarme todo lo que una
persona necesita para ser feliz; a mis padres, Pablo Enrique y Maria Nelcy, por la
inmensidad de su amor, por hacer de mi la persona que soy y por ser mi razón de
vivir; a mi hermana Paula Angélica por su cariño, amistad y admiración; a Diego
Fernando por su compañía, paciencia, apoyo y amor; a Alejandra Milena por ser
una grandiosa compañera, una excelente persona y mi amiga incondicional…
Francy Helena
Hoy al cumplir mi sueño de profesional me quedan grandes sentimientos de gratitud
y amor con Dios y Miguelito, quienes desde el cielo han iluminado mi vida y han
llenado de grandes satisfacciones mi existir. A mi madre y mis hermanos que me han
dado todo su cariño, apoyo y respaldo en todo momento. A Geven todo mi cariño por
ser parte de mi vida, compañero incondicional quien de la mano camina conmigo
brindándome inolvidables instantes de felicidad. A Francy mi amiga inseparable mil
gracias por cada paso recorrido, por cada experiencia vivida, por su valiosa
amistad que hacen hoy considerarla parte de mi familia…
vi
AGRADECIMIENTOS
Al Centro de Investigación en Biodiversidad y Recursos Genéticos (CIEBREG) y a la Vicerrectoría de la Pontificia Universidad Javeriana por la financiación para el desarrollo de este trabajo
Al Doctor Fabio Roldán, director de la investigación, por su amabilidad, comprensión, paciencia, constante apoyo científico y por todo el tiempo brindado durante este estudio
A Victoria Vallejo por abrirnos las puertas de USBA, por la confianza que depositó en nosotras desde el primer momento y por su permanente apoyo
A Erika García y Habib Yanine por su amistad, calidez y colaboración constante A Andrés Vela por transmitirnos su experiencia y por todos sus consejos
A María Gómez, Ricardo Amaya, Gloria Acosta, Ana Maria Cubillos, Aidé Sofia Muñoz, Carolina Díaz, Yamile Díaz, Sra. Miryam Peña, y a todos los integrantes de USBA por la colaboración brindada y por hacer del laboratorio un lugar ameno
A la UNESIS por su apoyo en la toma de muestras y determinación del porcentaje de materia orgánica
A Lina Sierra por su amabilidad y ayuda desinteresada
Y a todas las personas que nos acompañaron y ayudaron en la realización de este trabajo…
vii
TABLA DE CONTENIDOS
Pág
LISTA DE TABLAS ... x
LISTA DE FIGURAS ... xi
LISTA DE ANEXOS ... xiii
RESUMEN ... xv
ABSTRACT ... xvi
1. INTRODUCCIÓN ... 1
2. MARCO TEÓRICO ... 3
2.1. El suelo ... 3
2.1.1. Propiedades físicas ... 4
2.1.1.1. Temperatura ... 4
2.1.1.2. Humedad ... 4
2.1.1.3. Textura y estructura ... 5
2.1.2. Propiedades químicas ... 5
2.1.2.1. Materia orgánica ... 5
2.1.2.2. pH ... 7
2.1.3. Cobertura vegetal ... 7
2.2. Microorganismos del suelo ... 8
2.2.1. Microorganismos totales ... 9
2.2.1.1. Método de conteo directo por microscopia de epifluorescencia ... 10
2.2.2. Microorganismos heterótrofos ... 13
2.2.2.1. Metabolismo heterótrofo de compuestos orgánicos ... 14
2.2.2.2. Técnica de conteo en placa para heterótrofos ... 15
3. PROBLEMA Y JUSTIFICACIÓN ... 18
viii
4.1. Objetivo general ... 20
4.2. Objetivos específicos ... 20
5. MATERIALES Y MÉTODOS ... 21
5.1. Sitio de muestreo ... 21
5.1.1. Cuenca del río La Vieja ... 21
5.1.2. Cuenca del río Otún ... 21
5.2. Toma de muestras ... 22
5.3. Análisis de parámetros in situ y ex situ ... 23
5.3.1. Análisis in situ ... 23
5.3.2. Análisis ex situ ... 23
5.3.2.1. Determinación de humedad del suelo ... 23
5.3.2.2. Determinación de la materia orgánica total. ... 23
5.3.2.3. Determinación de pH del suelo ... 24
5.4. Análisis microbiológico ... 24
5.4.1. Evaluación de la precisión del conteo directo con DAPI y conteo en placa ... 24
5.4.1.1. Curva patrón de Escherichia coli ... 24
5.4.1.2. Precisión de la técnica de conteo directo con DAPI y conteo en placa utilizando un cultivo de E. coli ... 25
5.4.2. Procesamiento de las muestras ... 25
5.4.2.1. Conteo total de células con 4-6 diamidino-2-fenilindol (DAPI) ... 25
5.4.2.2. Conteo de microorganismos heterótrofos ... 27
5.4.3. Controles utilizados durante el procesamiento de las muestras ... 27
5.5. Análisis estadístico ... 28
6. RESULTADOS Y DISCUSIÓN ... 30
ix
6.1.1. Relación del conteo en placa y absorbancia de un cultivo de Escherichia
coli ... 30
6.1.2. Precisión de las técnicas de conteo directo con DAPI y conteo en placa empleando un cultivo en fase exponencial de E. coli ... 31
6.2. Densidad de células totales y heterótrofos en suelos de la eco-región cafetera ... 33
6.2.1. Comparación de las densidades de células totales y heterótrofos para la ventana La Vieja ... 33
6.2.1.1. Comparación de los parámetros fisicoquímicos y profundidad de la hojarasca para las coberturas de la ventana La Vieja ... 36
6.2.2. Comparación de las densidades de células totales y heterótrofos para la ventana Otún ... 41
6.2.2.1. Comparación de los parámetros fisicoquímicos y profundidad de la hojarasca para las coberturas de la ventana Otún ... 43
6.2.3. Efecto de la cobertura vegetal sobre la densidad de células totales y heterótrofos ... 47
6.3. Comparación de la densidad de células totales y heterótrofos entre el primer y el segundo año de estudio ... 54
6.4. Controles durante el procesamiento de las muestras ... 57
7. CONCLUSIONES ... 59
8. RECOMENDACIONES ... 60
BIBLIOGRAFÍA ... 61
x
LISTA DE TABLAS
Pág
Tabla 1. Partículas minerales del suelo y su tamaño ... 5 Tabla 2. Tipos de suelo según el pH ... 7 Tabla 3. Propiedades de algunos fluorocromos utilizados en el conteo de
microorganismos del suelo ... 11 Tabla 4. Densidad de células totales en suelos por conteo directo empleando el
fluorocromo DAPI ... 13 Tabla 5. Densidad de microorganismos heterótrofos en muestras de suelos
empleando el agar R2A ... 17 Tabla 6. Coberturas y fincas seleccionadas para el muestreo ... 22 Tabla 7. Comparación de las precisiones de las técnicas de conteo directo con
xi
LISTA DE FIGURAS
Pág
Figura 1. Estructura molecular del 4’-6-diamidino-2-fenilindol (DAPI) ... 12
Figura 2. Estructura del DAPI unido al DNA ... 12
Figura 3. Células coloreadas con DAPI en una muestra de suelo. ... 26
Figura 4. UFC de heterótrofos en agar R2A de una muestra de suelo ... 27
Figura 5. Relación entre la absorbancia y el conteo en placa durante la fase exponencial de un cultivo de E. coli ... 30
Figura 6. Comparación de los conteos obtenidos con las técnicas de conteo directo con DAPI y conteo en placa de diferentes soluciones de un cultivo de E. coli. ... 32
Figura 7. Densidad de células totales en las coberturas de la ventana La Vieja durante el estudio. ... 35
Figura 8. Densidad de microorganismos heterótrofos en las coberturas de la ventana La Vieja durante el estudio. ... 35
Figura 9. Abundancia relativa de microorganismos heterótrofos en las coberturas de la ventana La Vieja durante el estudio. ... 36
Figura 10. Porcentaje de humedad en las coberturas de la ventana La Vieja durante el estudio. ... 37
Figura 11. Temperatura del suelo en las coberturas de la ventana La Vieja durante el estudio ... 38
Figura 12. Porcentaje de materia orgánica en las coberturas de la ventana La Vieja durante el estudio. ... 39
Figura 13. pH en las coberturas de la ventana La Vieja durante el estudio. ... 39
Figura 14. Profundidad de la hojarasca en las coberturas de la ventana La Vieja durante el estudio. ... 40
xii
Figura 16. Densidad de microorganismos heterótrofos en las coberturas de la ventana Otún durante el estudio. ... 42 Figura 17. Abundancia relativa de microorganismos heterótrofos en las coberturas
de la ventana Otún durante el estudio. ... 43 Figura 18. Porcentaje de humedad en las coberturas de la ventana Otún durante el
estudio. ... 44 Figura 19. Temperatura del suelo en las coberturas de la ventana Otún durante el
estudio. ... 45 Figura 20. Porcentaje de materia orgánica en las coberturas de la ventana Otún
durante el estudio. ... 45 Figura 21. pH del suelo en las coberturas de la ventana Otún durante el estudio. ... 46 Figura 22. Profundidad de la hojarasca en las coberturas de la ventana Otún durante el estudio. ... 47 Figura 23. Densidad de células totales en las coberturas de la ventana La Vieja
durante el primer y segundo año de estudio. ... 55 Figura 24. Densidad de microorganismos heterótrofos en las coberturas de la
ventana La Vieja durante el primer y segundo año de estudio. ... 55 Figura 25. Densidad de células totales en las coberturas de la ventana Otún durante
xiii
LISTA DE ANEXOS
Pág
Anexo A. Preparación de la solución de DAPI ... 71 Anexo B. Cálculos para el conteo directo de células totales en el Microscopio de
fluorescencia ... 72 Anexo C. Factor de corrección para el conteo directo de células totales en el
Microscopio de fluorescencia ... 73 Anexo D. Composición del agar R2A ... 76 Anexo E. Curva patrón de un cultivo de Escherichia coli ... 77 Anexo F. Precisión de las técnicas de conteo directo con DAPI y conteo en placa
empleando un cultivo en fase exponencial de Escherichia coli ... 79 Anexo G. Tabla de datos de las densidades de células totales, microorganismos
heterótrofos y su abundancia relativa en la ventana La Vieja ... 81 Anexo H. Tabla de datos de las densidades de células totales, microorganismos
heterótrofos y su abundancia relativa en la ventana Otún ... 83 Anexo I. Distribución de los datos ... 85 Anexo J. Homogeneidad de varianzas ... 87 Anexo K. Efecto del uso de la cobertura sobre la densidad de células totales y
microorganismos heterótrofos de la ventana La Vieja ... 89 Anexo L. Comparación múltiple de la densidad de células totales entre las
coberturas de la ventana La Vieja ... 93 Anexo M. Efecto de la época climática sobre la densidad de células totales y
microorganismos heterótrofos de la ventana La Vieja ... 97 Anexo N. Comparación de la abundancia relativa de microorganismos heterótrofos
entre coberturas de la ventana La Vieja ... 98 Anexo O. Efecto de la época climática sobre la abundancia relativa de
xiv
Anexo P. Parámetros fisicoquímicos de la ventana La Vieja ... 104 Anexo Q. Correlación de los parámetros fisicoquímicos con las densidades de
células totales y microorganismos heterótrofos de la ventana La Vieja ... 106 Anexo R. Diferencias de los parámetros fisicoquímicos entre las coberturas de la
ventana La Vieja ... 107 Anexo S. Efecto de la época climática sobre los parámetros fisicoquímicos de las
coberturas de la ventana La Vieja ... 108 Anexo T. Efecto del uso de la cobertura sobre la densidad de células totales y
microorganismos heterótrofos de la ventana Otún ... 109 Anexo U. Comparación múltiple de la densidad de células totales entre las
coberturas de la ventana Otún ... 113 Anexo V. Efecto de la época climática sobre la densidad de células totales y
microorganismos heterótrofos de la ventana Otún ... 117 Anexo W. Comparación de la abundancia relativa de microorganismos heterótrofos
entre coberturas de la ventana Otún ... 118 Anexo X. Efecto de la época climática sobre la abundancia relativa de
microorganismos heterótrofos de las coberturas de la ventana Otún .... 119 Anexo Y. Parámetros fisicoquímicos de la ventana Otún ... 120 Anexo Z. Correlación de los parámetros fisicoquímicos con las densidades de
células totales y microorganismos heterótrofos de la ventana Otún ... 122 Anexo AA. Diferencias de los parámetros fisicoquímicos entre las coberturas de la
ventana Otún ... 123 Anexo BB. Efecto de la época climática sobre los parámetros fisicoquímicos de las
xv RESUMEN
El objetivo del presente estudio fue evaluar el efecto de las coberturas vegetales seleccionadas y de la época climática sobre la densidad de microorganismos totales y de heterótrofos, en suelos de las cuencas de los ríos La Vieja y Otún de la eco-región cafetera colombiana, mediante la técnica de conteo directo con DAPI y conteo en placa en agar R2A, respectivamente. Se realizaron dos eventos de muestreo, uno en época de lluvia (Abril/2007) y el otro en época seca (Agosto/2007), seleccionando tres coberturas representativas en cada cuenca. En cada cobertura se eligieron tres fincas representativas y en cada finca se tomaron tres puntos, para un total de 108 muestras de suelo compuesto. Se determinó la profundidad de la hojarasca y se analizaron propiedades fisicoquímicas del suelo como: temperatura, humedad, pH y materia orgánica. Se compararon los resultados obtenidos con los del primer año de estudio. Por otro lado, se determinó la precisión de la técnica de conteo directo con DAPI y conteo en placa utilizando un cultivo en fase exponencial de Escherichia coli. La técnica de conteo directo presentó mayor precisión que la técnica de conteo en placa y se evidenció que en concentraciones celulares bajas se puede llegar a subestimar o sobrestimar la carga microbiana de una muestra de un cultivo puro. La profundidad de la hojarasca no presentó correlación con las densidades evaluadas. La humedad y la temperatura favorecieron el desarrollo de los microorganismos heterótrofos, y, probablemente por esta razón, el pH se vio disminuido. Además, altos porcentajes de materia orgánica no indicaron altas densidades microbianas edáficas. Las densidades de células totales se vieron afectadas por el uso del suelo, mientras que las densidades de microorganismos heterótrofos solo se vieron afectadas por la época climática. Sin embargo, las coberturas mas intervenidas presentaron las mayores abundancias relativas de microorganismos heterótrofos. Estos resultados fueron similares a los obtenidos durante el primer año de estudio.
xvi ABSTRACT
The objective of the present study was to evaluate the effect of selected plant coverage and climate season over of total microorganisms and heterotrophic density, in soils of La Vieja and Otún river basins of the Colombian coffee eco-region, using the direct count DAPI technique and plate count in R2A agar, respectively. Two sampling events were carried out during the wet and dry season (April and August, respectively) selecting three representative plant coverage in each river basin. For each plant coverage three different representative locations were selected where three different sampling points were selected, for an overall of 108 composite soil samples. Depth of litter was determined and soil physiochemical properties as: the temperature, moisture, pH and organic matter, were analyzed. The results obtained were compared with those obtained in the first year of study. On the other hand, the precision of DAPI direct count technique and plate count was determined by using an exponential phase culture of Escherichia coli. The direct count technique was found to be more precise than the plate count, and it was demonstrated that with cellular concentrations lower, it is possible to underestimate or overestimate the microbial load of analyzed pure culture. The depth of the litter did not correlate with the evaluated densities. The density of the heterotrophic microorganisms was favored by moisture and temperature, and probably for this reason, a decrease in pH was observed. Moreover, a high percentage of organic matter did not indicate high edaphic microbial density. The density of the total cell count was affected by use of the soil, while the density of the heterotroph microorganisms was only affected by the climatic season. Nevertheless, the more intervened plant coverages displayed the greater relative abundance of heterotroph microorganisms. These results were similar to those obtained in the fist year of study.
1
1. INTRODUCCIÓN
El suelo es un sistema complejo, heterogéneo y dinámico capaz de sostener el crecimiento de un gran número de organismos y microorganismos. Un gramo de suelo puede albergar más de 108 microorganismos que son responsables de la mineralización de compuestos orgánicos, formación de humus, ciclaje de nutrientes y muchos otros aspectos importantes en el funcionamiento y en la salud del ecosistema. El conteo de microorganismos totales puede indicar la calidad, fertilidad y salud del suelo y, además, proporcionar información sobre los efectos de las intervenciones antropogénicas. El componente heterótrofo edáfico cumple un papel muy importante en el ciclo de carbono, en procesos de mineralización de compuestos orgánicos y producción de CO2, el cual puede ser usado como fuente de carbono por organismos
y microorganismos autótrofos. Los heterótrofos son los microorganismos más numerosos en el suelo y su conteo es muy importante ya que permite conocer la calidad y productividad del suelo, así como también la disponibilidad de nutrientes y materia orgánica.
Para el conteo de microorganismos totales se utiliza la técnica directa por microscopia de epifluorescencia, en donde es necesario el uso de fluorocromos. El fluorocromo DAPI (4’,6-diamidino-2-fenilindol) se une específicamente a secuencias ricas en AT del DNA de doble cadena y es muy utilizado para el conteo de microorganismos totales en suelos y otros ambientes. Por otro lado, una de las técnicas más empleadas para la determinación de heterótrofos en suelos es el conteo en placa, donde se emplean dos tipos básicos de medios de cultivo, los altos y bajos en nutrientes. Sin embargo, se ha observado que se obtiene una mayor recuperación empleando medios con bajo contenido de nutrientes.
2
de la época climática sobre esta. Sin embargo, el Centro de Investigación y Estudios en Biodiversidad y Recursos Genéticos (CIEBREG) esta desarrollando un proyecto con el objetivo de “conocer, valorar y desarrollar el potencial estratégico de los bienes y servicios ecológicos de la biodiversidad a partir del conocimiento tradicional y de investigación de frontera para el desarrollo sostenible de paisajes rurales (naturales y transformados) diversificados y funcionales” en donde la Unidad de Saneamiento y Biotecnología Ambiental (USBA) de la Pontificia Universidad Javeriana, como parte del CIEBREG, viene desarrollando investigaciones enmarcadas en uno de los objetivos específicos de este centro de excelencia, el cual es “caracterizar, evaluar y monitorear la biodiversidad de paisajes naturales asociada a sistemas productivos para
el mantenimiento de la funcionalidad ecológica”, específicamente en biodiversidad
microbiana del suelo. Estos estudios se realizan en la eco-región cafetera colombiana
como experiencia piloto.
3
2. MARCO TEÓRICO
2.1. El suelo
El suelo es un sistema estructurado, heterogéneo y discontinuo, fundamental e irremplazable, desarrollado a partir de una mezcla de materia orgánica, minerales y nutrientes capaces de sostener el crecimiento de organismos y microorganismos (Atlas y Bartha, 2002; Nannipieri et al., 2003).
La formación del suelo es un proceso complejo que involucra cambios físicos, químicos y biológicos de la roca originaria. Los cambios físicos implican la reducción de tamaño de las partículas sin ninguna alteración en su composición y son causados por ciclos de hielo-deshielo, lluvia y otros efectos ambientales.Los cambios químicos son originados por la separación de partículas minerales de las rocas, su alteración o destrucción y resíntesis a compuestos sólidos estables, se debe principalmente a la acción del agua, el oxígeno, el dióxido de carbono y compuestos orgánicos (Singer y Munns,1999; Budhu, 2007).
Los cambios biológicos son realizados por la comunidad que habita el suelo: flora (plantas), macrofauna (vertebrados), mesofauna (artrópodos, anélidos, nemátodos y moluscos), microfauna (protozoos y algunos nemátodos) y microbiota (bacterias, actinomicetes, hongos, y algas), donde el 80 al 90% de los procesos en el suelo son reacciones mediadas por la microbiota (Altieri,1999; Nannipieri et al., 2003; Porta et al., 2003). Estos cambios biológicos son: degradación y aporte de materia orgánica, producción de CO2 en la respiración, intervención en la movilidad de los ciclos
biogeoquímicos de los elementos y efectos mecánicos de animales y plantas como fraccionamiento de las rocas por las raíces, entre otros (Cepeda, 1991; Porta et al.,
2003).
4
importante, ya que tienen gran influencia en el componente microbiano edáfico (Porta
et al., 2003).
2.1.1. Propiedades físicas
Las propiedades físicas del suelo están determinadas por una serie de variables que le confieren sus características, tales como la temperatura, humedad, textura y estructura, e influencian el desarrollo y actividad de organismos y microorganismos edáficos (Malagón et al., 1995; Sadeghian et al., 2001).
2.1.1.1. Temperatura
La temperatura se define como la intensidad o el nivel de calor. Un ecosistema se ve afectado fuertemente por la temperatura, debido a que esta propiedad influencia procesos químicos, físicos y biológicos, como solubilidad de gases, velocidad de las reacciones, actividad microbiana, germinación y desarrollo de plantas, entre otros (Porta et al., 2003).
Es importante tener en cuenta que la temperatura del suelo y la del medio exterior están íntimamente relacionados, sin embargo, las mediciones de temperatura del suelo se deben realizar a una profundidad que este fuera del alcance de las fluctuaciones diarias (Forsythe, 2002).
2.1.1.2. Humedad
5
bacterias pueden vivir en suelos con un mayor contenido de agua (Foth, 1975; Malagón et al., 1995).
2.1.1.3. Textura y estructura
La mayoría de los suelos contienen partículas minerales de diversos tamaños: grandes llamadas grava, unas pequeñas arena, unos más pequeños limo y submicroscópicas
[image:21.612.220.409.384.460.2]arcilla, cuyas proporciones mezcladas determinan la textura del suelo, ya sea grueso (arenoso), intermedio (limoso) o fino (arcilloso) (Tabla 1). La textura del suelo se refiere al tamaño de las partículas, mientras que la estructura se refiere a su distribución. La estructura del suelo se forma por la unión de los agregados y cada agregado está constituido por partículas individuales (microorganismos, minerales, materia orgánica y poros); una buena estructura presenta espacios dentro y entre los agregados permitiendo la circulación del aire, gases, agua y nutrientes (Singer y Munns, 1999; Foght y Aislabie, 2005).
Tabla 1. Partículas minerales del suelo y su tamaño
Partícula mineral Tamaño (μm)
Grava > 2000
Arena 50-2000
Limo 2-50
Arcilla < 2
Tomado de: Wild, 1992; Sylvia et al., 2005 2.1.2. Propiedades químicas
El conocimiento de las propiedades químicas del suelo proporciona información de gran utilidad en estudios microbiológicos, ya que, al igual que las propiedades físicas, influencian su actividad y desarrollo (Sadeghian et al., 2001; Díaz et al., 2004). 2.1.2.1. Materia orgánica
6
suelo en forma libre, sino que se encuentran unidos en diferentes compuestos químicos como polisacáridos, proteínas, aminoácidos, carbohidratos, aceites, grasas, ceras y otras sustancias (Yadav y Malanson, 2007). La materia orgánica juega un rol vital en el mantenimiento de la calidad del suelo, ya que afecta su estructura, infiltración y retención de agua y es una reserva de nutrientes (Stocking, 1994; Zuluaga, 2004).
La descomposición de la materia orgánica es más rápida en ecosistemas agrícolas en comparación a ambientes arbóreos, puesto que los residuos vegetales tienden a tener menos compuestos recalcitrantes (lignina), lo que limita la liberación de los nutrientes de la hojarasca y ralentiza su descomposición (Coyne, 2000; Yadav y Malanson, 2007). Por consiguiente, en el momento en que la materia orgánica de la hojarasca se estabiliza y/o su descomposición se hace muy lenta (del 0 – 55% de la masa de la hojarasca), es cuando realmente hace parte del suelo. Por lo tanto, la hojarasca es la que mas aporta materia orgánica (Berg, 2000; Nogueira et al., 2006). Cabe destacar, que el exudado y descomposición de las raíces de las plantas también contribuyen al contenido de materia orgánica (Tate, 1987).
7 2.1.2.2. pH
El pH mide el grado de acidez o alcalinidad y es una de las propiedades químicas mas elementales del suelo, ya que tiene gran influencia en la disponibilidad de nutrientes y micronutrientes, capacidad de intercambio catiónico, afecta el tipo y grado de actividad microbiológica y por esta razón influencia procesos como la fijación simbiótica del nitrógeno y la mineralización de la materia orgánica (Díaz et al.,
2004).
[image:23.612.230.411.408.553.2]El suelo presenta un pH que puede variar dentro de un amplio rango (Tabla 2), ya que depende de las prácticas de cultivo, el contenido hídrico y el horizonte muestreado (Cepeda, 1991; Havlin et al., 1999), así como también varía de acuerdo a los procesos metabólicos de los microorganismos quienes producen ácido carbónico y ácidos orgánicos débiles. De igual forma el pH se altera, en menor medida, por la capacidad de intercambio catiónico (CIC) de las raíces de las plantas que absorben iones metálicos y liberan iones hidrógeno al suelo (Baird, 2001).
Tabla 2. Tipos de suelo según el pH
Acidez o alcalinidad pH del suelo
Excesivamente ácido <4 Fuertemente ácido 4-5 Moderadamente ácido 5-6 Ligeramente ácido 6-6.5
Neutro 6.5-7.5 Ligeramente alcalino 8-9
Fuertemente alcalino 9-10 Excesivamente alcalino >10
Tomado de: Cepeda, 1991
2.1.3. Cobertura vegetal
8
que están involucrados en los procesos de descomposición de la materia orgánica (Mary et al., 1996; Reicosky y Forcella, 1998).
La vegetación es el factor más determinante en el número y la composición de la comunidad de los microorganismos del suelo, ya que diferentes especies de plantas proveen diversos compuestos de carbono, lo que genera diversidad en las comunidades microbianas. Así mismo, las plantas pueden alterar algunas características físicas y químicas del suelo favoreciendo el crecimiento de determinadas especies de microorganismos (Nüsslein y Tiedje, 1999; Vieira y Nahas, 2005).
2.2. Microorganismos del suelo
Aunque la mayoría de los suelos representan un ambiente oligotrófico, es decir pobre en nutrientes, generalmente poseen una población microbiana muy extensa y diversa que se distribuye en microambientes discontinuos, los cuales proveen los requerimientos nutricionales y ambientales para su desarrollo (Mendes y Bottomley, 1998; Nannipieri et al., 2003; Kirk et al., 2004).
Estos microambientes presentan características químicas, físicas y biológicas que difieren en tiempo y espacio. Algunas variaciones ambientales en el suelo, como temperatura, humedad, pH, entre otros, pueden afectar la ecología, actividad y funcionamiento de los microorganismos, por esta razón los microambientes son sistemas dinámicos (Critter et al., 2002; Nannipieri et al., 2003; Garbeva et al.,
2004).
9
fijación de nitrógeno atmosférico, génesis y mejoramiento del suelo, control biológico, remediación de suelos contaminados, remoción de toxinas, entre otros (Kennedy, 1999; Shannon et al., 2002; Porta et al., 2003; Calbrix et al., 2005).
Sin embargo, diversas actividades antropogénicas como la rotación de cultivos, adición de materia orgánica (como compost, gallinaza, pollinaza), labranza excesiva, aplicación de pesticidas y fertilizantes químicos pueden alterar las condiciones fisicoquímicas y nutricionales perturbando la densidad y funcionamiento de los microorganismos del suelo (Garbeva et al., 2004).
La sumatoria de los microorganismos no cultivables y cultivables refleja la densidad edáfica total. Estos microorganismos son definidos por grupos funcionales debido a sus características fisiológicas y metabólicas (Steneck y Dethier, 1994). Los heterótrofos son uno de los grupos funcionales que participa activamente en el ciclo biogeoquímico del carbono y directa e indirectamente en el ciclaje de otros elementos (Wolf, 2006).
2.2.1. Microorganismos totales
En el suelo se encuentran múltiples fuentes de carbono, energía y electrones permitiendo el desarrollo de diversas poblaciones microbianas que difieren en sus capacidades fisiológicas y metabólicas. Por esta razón el suelo alberga un gran número de microorganismos que interactúan entre sí y con los demás componentes del ecosistema (Critter et al., 2002; Sait et al., 2002; Calbrix et al., 2005; Yadav y Malanson, 2007).
10
disponibilidad de nutrientes (Kepner y Pratt, 1994; Critter et al., 2002; Shannon et al.,
2002; Acuña et al., 2006).
Las características fisicoquímicas y la densidad y composición microbiana edáfica pueden presentar cambios debido a prácticas agrícolas, las cuales han reducido la capacidad productiva del suelo en más del 40% de los agroecosistemas del mundo (Kremer y Li, 2003).
Debido a esto, la biomasa o densidad (Atlas y Bartha, 2002) de los microorganismos totales ha sido usado para proporcionar información sobre el estado, calidad y fertilidad del suelo, ya que estos responden rápidamente a los cambios ambientales y antropogénicos (Wick et al., 2002; George, 2006).
2.2.1.1. Método de conteo directo por microscopia de epifluorescencia
Los procedimientos de conteo por observación directa al microscopio proporcionan números mucho más altos que los obtenidos por las técnicas de conteo de microorganismos cultivables, puesto que incluye células viables, muertas y viables no cultivables, es decir, tiene en cuenta todos los microorganismos independientemente de su estado fisiológico y actividad metabólica (Maier et al., 2000; Nannipieri et al.,
2003; Klauth et al., 2004; Prescott et al., 2005).
Sin embargo, las técnicas de conteo directo por microscopia de epifluorescencia presentan una serie de inconvenientes, tales como la incapacidad de distinguir los microorganismos vivos de los muertos, la dificultad de diferenciar los microorganismos de partículas que tienen el mismo tamaño como arcilla, detritos o coloides, los cuales pueden ser teñidos o ser autofluorescentes, y la imposibilidad de utilizar los microorganismos observados en estudios posteriores (Yu et al., 1995; Atlas y Bartha, 2002; Li et al., 2003; Klauth et al., 2004).
11
onda mayor (visible); cuando un electrón de baja energía de una molécula fluorescente absorbe un fotón se excita a un estado de energía más alto y regresa al estado inicial con una pérdida de energía hacia el entorno, emitiéndose un fotón de longitud de onda más largo, es decir, de menor energía (Ingraham e Ingraham, 1998; Li et al., 2004).
Algunas moléculas son autofluorescentes y emiten fluorescencia cuando se excitan y este fenómeno es llamado fluorescencia principal. La fluorescencia secundaria representa la emisión producida después que una molécula es combinada con una molécula fluorescente principal, llamada fluorocromo (Li et al., 2004).
Los fluorocromos pueden ser clasificados en dos grupos de acuerdo a sus características. El primer grupo tiñe específicamente componentes celulares como ácidos nucleicos, proteínas, lípidos o membrana celular. El segundo grupo fluoresce como resultado de los procesos metabólicos celulares, no por si mismo. Existen numerosos fluorocromos del primer grupo, sin embargo solo unos pocos son empleados para estudios de la densidad microbiana del suelo. Los tintes mas empleados son naranja de acridina, bromuro de etidio, FITC, DTAF, y DAPI (Tabla
3) (Li et al., 2003; Li et al., 2004).
Tabla 3. Propiedades de algunos fluorocromos utilizados en el conteo de microorganismos del suelo
Propiedad
Fluorocromos
AO Bromuro de
etidio FITC DTAF DAPI
Excitación (nm) 500 (DNA)
460 (RNA) 518 494 492 358
Emisión (nm) 525 (DNA)
650 (RNA) 605 519 516 461
Ionización Catiónico Catiónico Aniónico (pH neutro)
Aniónico (pH
neutro) Catiónico
Afinidad Ácidos
nucléicos
Ácidos
nucléicos Proteínas
Proteínas Carbohidratos
Polisacáridos
Doble cadena de DNA
Peso molecular 301.82 394.31 389.38 495.28 350.25
Color de las
células teñidas Verde o rojo Rojo Amarillo-verde Amarillo-verde Azul AO: Naranja de acridina; FITC: Isotiocianato de fluoresceína; DTAF: 5-(4,6-diclorotriazinil) aminofluorescenina; DAPI: 4’,6-diamidino-2-fenilindol
12
DAPI, 4’,6-diamidino-2-fenilindol (Figura 1), es un fluorocromo que se une de manera selectiva al DNA, específicamente a las secuencias ricas en AT (adenina – timina) a través de interacciones con los grupos fosfato (Figura 2) (Kapuscinski y Skoczylas, 1978; Manzini et al., 1983); aunque también hay reportes que demuestran que DAPI se une a secuencias de DNA que contienen tan solo dos pares de bases AT consecutivas, tal vez empleando una diferente forma de unión. Este colorante es muy soluble en agua, pero limita su solubilidad en buffer fosfato salino (Haugland, 2002). Por otro lado, DAPI es uno de los fluorocromos que más se ha utilizado para la determinación de la densidad de microorganismos en muestras de suelo por conteo directo (Kuwae y Hosakawa, 1999) (Tabla 4).
Figura 1. Estructura molecular del 4’-6-diamidino-2-fenilindol (DAPI)
Tomado de: Manzini et al., 1983
Figura 2. Estructura del DAPI unido al DNA
13
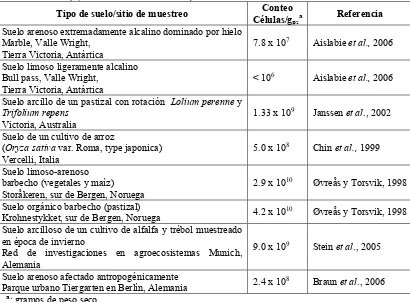
Tabla 4. Densidad de células totales en suelos por conteo directo empleando el fluorocromo DAPI (4,6-diamidino-2-fenilindol)
Tipo de suelo/sitio de muestreo Conteo Células/gpsa
Referencia
Suelo arenoso extremadamente alcalino dominado por hielo Marble, Valle Wright,
Tierra Victoria, Antártica
7.8 x 107 Aislabie et al., 2006 Suelo limoso ligeramente alcalino
Bull pass, Valle Wright, Tierra Victoria, Antártica
< 106 Aislabie et al., 2006 Suelo arcillo de un pastizal con rotación Lolium perenne y
Trifolium repens
Victoria, Australia
1.33 x 109 Janssen et al., 2002 Suelo de un cultivo de arroz
(Oryza sativa var. Roma, type japonica) Vercelli, Italia
5.0 x 108 Chin et al., 1999 Suelo limoso-arenoso
barbecho (vegetales y maíz) Storåkeren, sur de Bergen, Noruega
2.9 x 1010 Øvreås y Torsvik, 1998 Suelo orgánico barbecho (pastizal)
Krohnestykket, sur de Bergen, Noruega 4.2 x 10 10
Øvreås y Torsvik, 1998 Suelo arcilloso de un cultivo de alfalfa y trébol muestreado
en época de invierno
Red de investigaciones en agroecosistemas Munich, Alemania
9.0 x 109 Stein et al., 2005 Suelo arenoso afectado antropogénicamente
Parque urbano Tiergarten en Berlín, Alemania 2.4 x 10 8
Braun et al., 2006
a
: gramos de peso seco
2.2.2. Microorganismos heterótrofos
Los microorganismos heterótrofos utilizan compuestos orgánicos como fuente de carbono para la producción de energía y síntesis de constituyentes macromoleculares de la célula, incluyendo proteínas, ácidos grasos, polisacáridos y ácidos nucléicos (Staley, 2000; Atlas y Bartha, 2002). La variedad de compuestos orgánicos que son utilizados por los heterótrofos es muy amplia y prácticamente cualquier compuesto sintetizado por procesos biológicos, así como muchos xenobióticos, pueden ser degradados por estos microorganismos. Estos sustratos incluyen carbohidratos, ácidos grasos, alcoholes, aminoácidos, y compuestos aromáticos (Allen et al., 2004; Overmann, 2006).
14
inorgánica, produciéndose biomasa, agua y dióxido de carbono, sustrato para los organismos autótrofos. Además, se producen otros compuestos inorgánicos como amonio, sulfato y fosfato (Staley, 2000; Atlas y Bartha, 2002).
2.2.2.1. Metabolismo heterótrofo de compuestos orgánicos
Los microorganismos heterótrofos presentan dos mecanismos básicos para degradar compuestos orgánicos, que son fermentación y respiración. El término fermentación designa al conjunto de reacciones catabólicas productoras de energía en las que actúan los compuestos orgánicos como donadores y aceptores finales de electrones. Los carbohidratos son los principales sustratos de la fermentación, aunque también son susceptibles de ser fermentados compuestos de otras clases químicas, como ácidos orgánicos, aminoácidos, purinas y pirimidinas (Stanier et al., 1992; Madigan et al., 2004). En la fermentación hay menor producción de energía en forma de ATP, no se requiere un aceptor final de electrones (AFE) y hay una oxidación incompleta de los compuestos.
Por otro lado, la respiración es un proceso metabólico productor de energía que involucra un AFE. Durante los procesos oxidativos, los electrones son removidos del donador de electrones y son transferidos a través de la cadena de transporte de electrones al AFE, generando una mayor producción de energía en forma de ATP (con respecto a la fermentación) y la oxidación completa de los sustratos (Stanier et al., 1992; Maier et al., 2000).
En la respiración aerobia se lleva a cabo un proceso en el cual el substrato orgánico es desdoblado en pequeñas moléculas que pueden participar en el ciclo de Krebs, donde finalmente se obtiene CO2, H2O e iones hidrógeno. Este último produce un gradiente
15
Para los microorganismos anaeróbicos el AFE es un compuesto inorgánico distinto del oxígeno como CO2, NO3- o SO42-, o un metal oxidado, como el Fe3+ (Maier et al.,
2000), por esta razón se produce, además de CO2, N2, N2O, H2S, otros compuestos
reducidos (Staley, 2000).
2.2.2.2. Técnica de conteo en placa para heterótrofos
Los microorganismos cultivables que habitan diferentes ambientes han sido cuantificados por técnicas como el conteo en placa y el método de número más probable (NMP) (Nannipieri et al., 2003). El uso de estas técnicas requiere simular, en lo posible, las condiciones del ambiente natural tanto físicas como químicas, tales como temperatura, luz, AFE, nutrientes, contenido de materia orgánica y pH, con el fin de permitir una mayor recuperación y el desarrollo óptimo de los microorganismos de interés (Fernández-Canigia y Coyne, 2001; Kirk et al., 2004). Las técnicas de conteo de microorganismos viables tienen la ventaja de ser económicas, proveer información acerca de las comunidades activas, aislar grupos específicos ajustando las condiciones de cultivo (Atlas y Bartha, 2002) y, además, permitir que los microorganismos recuperados puedan ser utilizados y conservados para usos posteriores. Sin embargo, se calcula que solamente del 1 al 10 % del total de la microflora del suelo se recupera mediante el empleo de estas técnicas (Torsvik y Øvreås. 2002; Kirk et al., 2004; Singh et al., 2006).
16
Los microorganismos heterótrofos son el grupo funcional más abundante del suelo (Mayea et al., 1982; Sylvia et al., 2005) y su densidad puede proporcionar información general de la disponibilidad de nutrientes orgánicos en su ambiente (Maier et al., 2000). Estos microorganismos pueden clasificarse con base a su habilidad para utilizar fuentes de carbono dependiendo de su crecimiento en ambientes ricos o pobres en materia orgánica. Los microorganismos oligotróficos crecen en concentraciones muy bajas de nutrientes, en contraste a los copiótrofos (también llamadas eutróficos), los cuales se desarrollan en ambientes que tienen alta concentración de nutrientes orgánicos (Martin y MacLeod, 1984; Staley, 2000; Sylvia
et al., 2005).
17
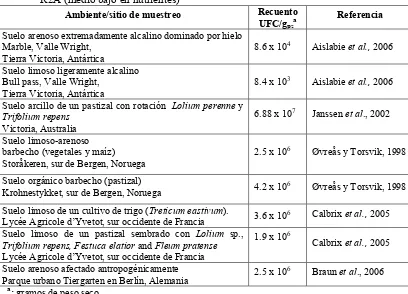
Tabla 5. Densidad de microorganismos heterótrofos en muestras de suelos empleando el agar R2A (medio bajo en nutrientes)
Ambiente/sitio de muestreo Recuento UFC/gpsa
Referencia
Suelo arenoso extremadamente alcalino dominado por hielo Marble, Valle Wright,
Tierra Victoria, Antártica
8.6 x 104 Aislabie et al., 2006 Suelo limoso ligeramente alcalino
Bull pass, Valle Wright, Tierra Victoria, Antártica
8.4 x 103 Aislabie et al., 2006 Suelo arcillo de un pastizal con rotación Lolium perenne y
Trifolium repens
Victoria, Australia
6.88 x 107 Janssen et al., 2002 Suelo limoso-arenoso
barbecho (vegetales y maíz) Storåkeren, sur de Bergen, Noruega
2.5 x 106 Øvreås y Torsvik, 1998 Suelo orgánico barbecho (pastizal)
Krohnestykket, sur de Bergen, Noruega 4.2 x 10 6
Øvreås y Torsvik, 1998 Suelo limoso de un cultivo de trigo (Treticum eastivum).
Lycée Agricole d’Yvetot, sur occidente de Francia 3.6 x 10
6 Calbrix et al., 2005 Suelo limoso de un pastizal sembrado con Lolium sp.,
Trifolium repens, Festuca elatior and Fleum pratense
Lycée Agricole d’Yvetot, sur occidente de Francia
1.9 x 106
Calbrix et al., 2005 Suelo arenoso afectado antropogénicamente
Parque urbano Tiergarten en Berlín, Alemania 2.5 x 10 6
Braun et al., 2006
a:
18
3. PROBLEMA Y JUSTIFICACIÓN
Colombia es considerado mundialmente uno de los países mas ricos en flora y fauna, donde se encuentra el 10% de la biodiversidad del planeta, representando tan solo el 0.7% de la superficie terrestre. Por tal razón, se ha dado una mayor importancia a su estudio y conservación, prestando poca atención a lo relacionado con la diversidad microbiana en diferentes ambientes.
El estudio de los microorganismos edáficos es de gran importancia debido a que ellos tienen la capacidad de llevar a cabo una gran variedad de funciones que intervienen directa o indirectamente en todos los procesos en el medio ambiente. De igual forma estos microorganismos proporcionan información acerca de la calidad, fertilidad y salud del suelo en ecosistemas naturales y transformados.
El complejo eco-regional de los andes del norte (CEAN) es una región de Colombia densamente poblada que ha sido fuertemente afectada por diferentes actividades humanas. A pesar de lo anterior, aún se encuentran suelos con coberturas vegetales naturales y otras poco intervenidas, donde el CIEBREG, uno de los centros de excelencia apoyados por el Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología (COLCIENCIAS), viene desarrollando investigaciones buscando la conservación biológica, la preservación y la forestación, para el mejoramiento de la calidad de vida de los habitantes de la región cafetera y del medio ambiente.
19
comparación, con un diseño experimental de cuatro coberturas vegetales por ventana y dos fincas por cobertura, y se establecieron procedimientos para el conteo de microorganismos totales, heterótrofos, bacterias asociadas al ciclo del nitrógeno y degradadoras de hidrocarburos. Vela (2007) estandarizó un protocolo de tinción con DAPI para el conteo de microorganismos totales en suelos y concluyó que los sistemas productivos son una escala muy general de comparación recomendando el uso de coberturas vegetales como unidad comparativa. De igual forma, la alta variación de los datos en su estudio hizo reconsiderar eliminar una cobertura y aumentar el número de fincas por cobertura. Por otro lado, Latorre (2007) estandarizó la extracción de microorganismos de la matriz del suelo y evaluó diferentes medios de cultivo (altos y bajos en nutrientes) para la recuperación de heterótrofos, determinando un medio con bajo contenido en nutrientes como el más óptimo (agar R2A).
20
4. OBJETIVOS
4.1. Objetivo general
Evaluar el efecto de coberturas vegetales y época climática sobre la densidad de microorganismos totales y heterótrofos en suelos de la eco-región cafetera
4.2. Objetivos específicos
• Evaluar la precisión de la técnica de conteo directo con DAPI y la técnica de conteo en placa utilizando un cultivo de Escherichia coli de concentración conocida
• Determinar y comparar la densidad microbiana total y heterótrofa y su abundancia relativa en las coberturas vegetales seleccionadas de las cuencas de los ríos La Vieja y Otún
• Comparar y establecer el efecto de parámetros fisicoquímicos y profundidad de la hojarasca sobre la densidad microbiana total y heterótrofa edáfica
21
5. MATERIALES Y MÉTODOS
El presente estudio se llevó a cabo en el laboratorio de la Unidad de Saneamiento y Biotecnología Ambiental (USBA) de la Pontificia Universidad Javeriana (Bogotá, Colombia). El objetivo de este trabajo fue evaluar el efecto de coberturas vegetales y época climática sobre la densidad de microorganismos totales y heterótrofos provenientes de suelos de la eco-región cafetera.
5.1. Sitio de muestreo
5.1.1. Cuenca del río La Vieja
Esta cuenca está localizada en el centro occidente de Colombia en los Departamentos del Quindío, Valle del Cauca y Risaralda, con una extensión de 2,836 km2, se encuentra entre los 900 y 1,800 msnm, la longitud del cauce es de 102 km y pertenece a la región Andina Centro Occidente. Esta ventana esta dominada por sectores intervenidos por actividades agropecuarias donde predomina el pastizal y una alta densidad poblacional (Camargo, 2006).
5.1.2. Cuenca del río Otún
22 5.2. Toma de muestras
Se tomaron como unidades de muestreo dos ventanas correspondientes a las cuencas de los ríos La Vieja y Otún en la eco-región Cafetera, las cuales fueron seleccionadas por el CIEBREG por su heterogeneidad espacial, gradiente altitudinal y estructura de paisaje (Camargo, 2006).
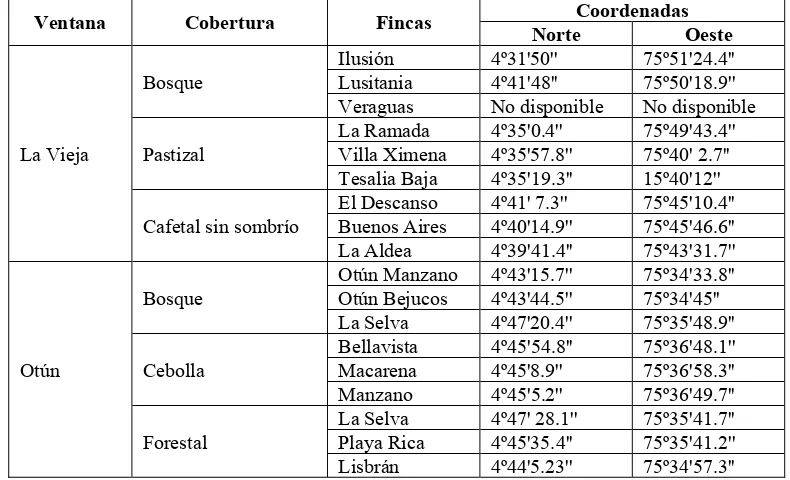
De cada ventana se seleccionaron las tres coberturas más representativas (Roldán, 2007) y en cada una de estas se tomaron tres fincas (Tabla 6). En cada una de ellas se ubicaron tres cuadrantes de 2.5 x 2.5 m, al menos a 30 m del borde de la cobertura. En cada cuadrante se tomó una muestra de suelo de cada uno de los vértices y del centro para generar una muestra compuesta de aproximadamente 500 g. Estas muestras se depositaron en bolsas Wirlpark® debidamente rotuladas, y se almacenaron en refrigeración (4-6ºC) hasta su análisis.
[image:38.612.122.517.445.685.2]El primer evento de muestreo se realizó del 14 al 21 de Abril de 2007 (época de lluvia) y el segundo del 24 Agosto al 1 de Septiembre de 2007 (época seca).
Tabla 6. Coberturas y fincas seleccionadas para el muestreo
Ventana Cobertura Fincas Coordenadas
Norte Oeste
La Vieja
Bosque
Ilusión 4º31'50'' 75º51'24.4'' Lusitania 4º41'48'' 75º50'18.9'' Veraguas No disponible No disponible Pastizal
La Ramada 4º35'0.4'' 75º49'43.4'' Villa Ximena 4º35'57.8'' 75º40' 2.7'' Tesalia Baja 4º35'19.3'' 15º40'12'' Cafetal sin sombrío
El Descanso 4º41' 7.3'' 75º45'10.4'' Buenos Aires 4º40'14.9'' 75º45'46.6'' La Aldea 4º39'41.4'' 75º43'31.7''
Otún
Bosque
Otún Manzano 4º43'15.7'' 75º34'33.8'' Otún Bejucos 4º43'44.5'' 75º34'45'' La Selva 4º47'20.4'' 75º35'48.9'' Cebolla
Bellavista 4º45'54.8'' 75º36'48.1'' Macarena 4º45'8.9'' 75º36'58.3'' Manzano 4º45'5.2'' 75º36'49.7'' Forestal
La Selva 4º47' 28.1'' 75º35'41.7'' Playa Rica 4º45'35.4'' 75º35'41.2''
23 5.3. Análisis de parámetros in situ y ex situ
5.3.1. Análisis in situ
En campo se determinó la profundidad de la hojarasca empleando una regla acrílica y la temperatura del suelo a 20 cm de profundidad con un termómetro de campo. Estos análisis se realizaron en el momento de la toma de las muestras.
5.3.2. Análisis ex situ
5.3.2.1. Determinación de humedad del suelo
Se pesaron 10 g de muestra sobre una bandeja de aluminio (previamente pesada) en una balanza de precisión (Sartorius portable) y se llevó a un horno de secado (Gallenkamp) a 105ºC durante 24 h. Trascurrido este tiempo, la bandeja de aluminio con la muestra de suelo se pesó nuevamente (Olarte et al., 1979). El porcentaje de humedad se determinó según la ecuación:
( )
( )
( )
sec 100% = − × g fresco peso g o peso g fresco peso Humedad
5.3.2.2. Determinación de la materia orgánica total.
Se tomaron de 5 a 10 g de muestra compuesta de suelo los cuales fueron secados a 80ºC por 2 h en un crisol previamente pesado. Posteriormente, se dejó enfriar el crisol y se registró su peso. Nuevamente, se llevó el crisol con el suelo a calentamiento en mufla (Termoline, 48000 furnace) a 550ºC por 2 h, se dejó enfriar en desecador y se registró su peso (Storer, 1984). La pérdida de peso por ignición (PPI) se calculó mediante la ecuación:
(
)
(
)
(
)
10080 ) ( 550 ) ( 80 ) ( % = − × C g peso C g peso C g peso PPI o o o
24 5.3.2.3. Determinación de pH del suelo
Se mezclaron 10 g de la muestra compuesta de suelo con 10 mL de agua desionizada y se dejaron en agitación orbital durante 15 min. Trascurrido este tiempo se dejó decantar durante 1 h a temperatura ambiente y se midió el pH de la solución acuosa empleando un pHmetro (Metrohm E-744) (EPA, 1999).
5.4. Análisis microbiológico
5.4.1. Evaluación de la precisión del conteo directo con DAPI y conteo en placa
5.4.1.1. Curva patrón de Escherichia coli
25
5.4.1.2. Precisión de la técnica de conteo directo con DAPI y conteo en placa utilizando un cultivo de E. coli
Para determinar la precisión de la técnica de conteo directo utilizando DAPI se prepararon diferentes soluciones de E. coli a partir de un cultivo puro en fase exponencial llevado a cabo a las mismas condiciones de la curva patrón, el cual se diluyó con base 10 en solución salina 0.85% (p/v). A cada solución se le realizó conteo directo con DAPI y conteo en placa en agar nutritivo por triplicado.
5.4.2. Procesamiento de las muestras
La extracción de los microorganismos de la matriz del suelo se realizó según la metodología desarrolla por Latorre (2007). Para esto se tomaron 10 g de muestra y se adicionaron a 90 mL de solución salina 0.85% (p/v) (Merck) filtrada (0.22 µm) y estéril, y se llevaron a agitación orbital (InnovaTM 2100) a 160 rpm por 15 min. Pasado este tiempo se dejó sedimentar durante 5 min, y en condiciones de esterilidad se realizaron diluciones seriadas con base 10 hasta 10-5, homogenizando entre cada dilución en un vortex (Barnstead/thermolyne M-37615).
Los datos obtenidos durante el conteo de microorganismos totales con DAPI y el conteo de heterótrofos de las muestras de suelo se convirtieron a gramos de peso seco (gps) dividiendo el dato por la fracción de peso seco de cada una de las muestras.
5.4.2.1. Conteo total de células con 4-6 diamidino-2-fenilindol (DAPI)
(ROA-P164-26
AA:GAST). El filtro se dejó secar por 20 min a temperatura ambiente. Posteriormente, se agregaron 100 μL de DAPI (5 μg/mL) (D9542; Sigma) (Anexo A) y se dejó reaccionar por 30 min. Luego se lavó el filtro con agua Milli-Q por 1 min, seguido de etanol (Merck) al 70% (v/v) por 2 seg y se dejó secar en oscuridad a temperatura ambiente por 1 h. Este procedimiento se realizó por duplicado para cada muestra.
El filtro seco se colocó en una lámina porta objetos, se agregó una gota de aceite Citifluor AF1 (No.17970-25; Electron Microscopy Science) y se colocó una laminilla evitando la formación de burbujas. Para realizar la lectura de cada filtro en el microscopio de eplifluorescencia (Eclipse 5.0i; Nikon) se empleó un aceite de inmersión de baja luminiscencia (50 tipo NF, Nikon), se enfocó con el objetivo 100x y se realizaron las lecturas en el filtro 1 y/o 4. Se consideró como células los óvalos, puntos y círculos con bordes definidos con coloración azul fluorescente.
[image:42.612.162.482.458.675.2]Si se observaba un número de células por campo de lectura menor a 30, se leían 50 campos aleatorios por filtro; en caso contrario, se leían 20 campos aleatorios por filtro (Anexo B y C) (Figura 3).
27
5.4.2.2. Conteo de microorganismos heterótrofos
Se sembró en superficie 0.1 mL de las tres últimas diluciones realizadas a cada una de las muestras sobre agar R2A (Oxoid) (Anexo D) por duplicado y se dejaron incubando a 21±2ºC por 5 d. Posterior a este tiempo se contaron las cajas que presentaron entre 30 a 300 UFC (Figura 4).
Figura 4. UFC de heterótrofos en agar R2A de una muestra de suelo
Latorre (2007) evaluó diferentes medios de cultivo con alto y bajo concentración de nutrientes para la recuperación de microorganismos heterótrofos en suelos de la misma zona de muestreo y determinó que con el agar R2A, un medio con baja concentración de nutrientes, se obtuvieron los mayores conteos, por esta razón en el presente estudio se empleó este medio de cultivo.
5.4.3. Controles utilizados durante el procesamiento de las muestras
28
procedimiento para el conteo directo con DAPI y recuenteo en placa sobre agar nutritivo, el cual se llevó a incubación durante 24 h a 37°C. Finalmente, los datos obtenidos se colocaron en la curva UFC/mL vs. células/mL obtenida anteriormente, para determinar si los controles que se realizaron se encontraban dentro del intervalo de confianza del 95%.
Con el fin de confirmar la esterilidad de los materiales y reactivos empleados se realizaron controles a los rastrillos, a las puntas para micropipeta, a la solución salina 0.85% (p/v) filtrada (0.22 µm) y estéril y al agar R2A. La esterilidad de los rastrillos se realizó haciendo un frotis directamente sobre el medio de cultivo. Para el análisis de las puntas se realizó un enjuague con solución salina 0.85% (p/v) filtrada (0.22 µm) y estéril y se inoculó con la misma punta un volumen de esta solución sobre el agar. El control de esterilidad de la solución salina 0.85% (p/v) filtrada (0.22 µm) y estéril se llevó a cabo inoculando un volumen de ésta sobre el medio. Finalmente una caja de petri con medio de cultivo R2A fue incubada sin haber sido inoculada con el fin de corroborar su esterilidad. Estos controles se realizaron diariamente durante los días de procesamiento.
El medio de cultivo empleado para realizar todas las pruebas de esterilidad fue el agar R2A, el cual se incubó a las mismas condiciones que las muestras.
5.5. Análisis estadístico
29
30
6. RESULTADOS Y DISCUSIÓN
6.1. Comparación de la precisión de las técnicas de conteo directo con DAPI y conteo en placa
6.1.1. Relación del conteo en placa y absorbancia de un cultivo de Escherichia coli
Con el objetivo de conocer la concentración de células en un cultivo de E. coli enun tiempo determinado, se estableció la relación de la absorbancia y el conteo en placa (UFC/mL) en el tiempo (Figura 5).
Se seleccionó la fase exponencial de crecimiento buscando mayor viabilidad de las células así como una velocidad de crecimiento constante. Se obtuvo la ecuación de la recta de mejor ajuste, la cual se utilizó para determinar la concentración de células (UFC/mL) utilizando la absorbancia de un cultivo de E. coli en fase exponencial en un tiempo específico.
[image:46.612.144.488.458.661.2]31
6.1.2. Precisión de las técnicas de conteo directo con DAPI y conteo en placa empleando un cultivo en fase exponencial de E. coli
Después de establecer la relación de la absorbancia y conteo en placa de E. coli se utilizó un cultivo de concentración conocida en fase exponencial para obtener cuatro soluciones diferentes realizando diluciones con base 10, y establecer la precisión de las técnicas de conteo directo con DAPI y conteo en placa (Tabla 7).
[image:47.612.120.511.420.642.2]Teniendo en cuenta los porcentajes de coeficientes de variación (%CV) se observó que ambas técnicas presentaron variabilidad en cada una de las soluciones evaluadas. Sin embargo, los porcentajes de la técnica de conteo directo con DAPI fueron generalmente menores comparados con los obtenidos con conteo en placa para cada solución. Esto indicó que la técnica de conteo directo con DAPI presentó una mayor precisión y una menor dispersión. Esta precisión se debió a que el volumen tomado para el conteo directo es mayor que el tomado para realizar el conteo en placa (1 y 0.1 mL, respectivamente).
Tabla 7. Comparación de las precisiones de las técnicas de conteo directo (cél/mL) con DAPI yconteo en placa (UFC/mL)
SlnA
Conteo cél/mL (107)
Promedio
cél/mL (107) % CV B
Conteo UFC/mL (107)
Promedio
UFC/mL (107) % CV B
1
79.7
75.9 ± 9.32 12.3
80.0
70.3 ± 10.6 15.1 65.3 72.0 82.8 59.0
2
10.5
10.2 ± 0.30 2.96
9.00
10.0 ± 1.00 10.0 10.1 11.0 9.90 10.0
3
1.22
1.05 ± 0.16 15.3
0.93
0.98 ± 0.11 11.0 0.90 1.10 1.02 0.90
4
0.26
0.27 ± 0.01 5.10
0.13
0.14 ± 0.01 8.45 0.26 0.15 0.28 0.13
A
: Soluciones preparadas con diluciones base 10 de un cultivo en fase exponencial de E. coli
B
32
Sin embargo, para el conteo en placa se evidenció que a mayor dilución se presentó mayor precisión, contrario a la técnica de conteo directo, donde la variabilidad fue independiente de la dilución, ya que no se observó una tendencia a disminuir o aumentar con el cambio de concentración.
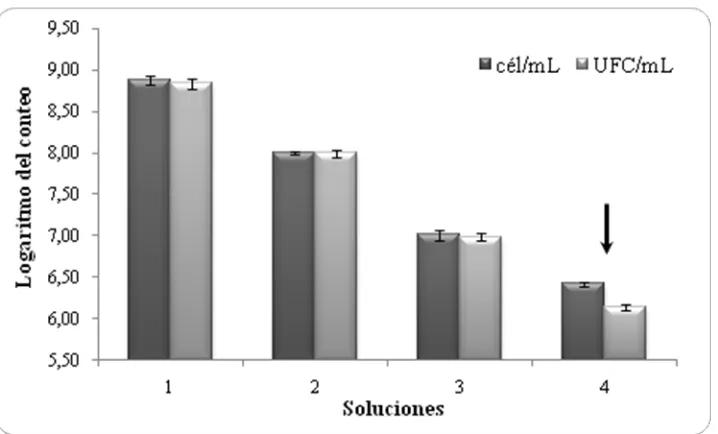
[image:48.612.144.503.276.493.2]Durante la comparación de los conteos obtenidos de las soluciones de E. coli con las técnicas evaluadas, se observó que en el rango de concentraciones de 107-108 cél ó UFC/mL no se presentaron diferencias (P>0.05), contrario a lo que se observó en la solución mas diluida (106) (P≤0.05) (Figura 6) (Anexo F).
Figura 6. Comparación de los conteos obtenidos con las técnicas de conteo directo con DAPI (cél/mL) y conteo en placa (UFC/mL) de diferentes soluciones de un cultivo de E. coli. (n=3). La flecha indica diferencia significativa.
33
6.2. Densidad de células totales y heterótrofos en suelos de la eco-región cafetera
Se procesaron un total de 108 muestras de suelo por duplicado para evaluar el efecto de las coberturas vegetales y de la época climática sobre las densidades de células totales y de heterótrofos, en las ventanas La Vieja y Otún (Tabla 8) (Anexos G y H). 6.2.1. Comparación de las densidades de células totales y heterótrofos para la ventana La Vieja
Durante el primer y segundo evento de muestreo (1EM y 2EM) (época de lluvia y seca, respectivamente), la cobertura bosque presentó los conteos significativamente mayores de células totales seguido de las coberturas pastizal y cafetal sin sombrío. En el 1EM se observaron diferencias significativas entre las coberturas bosque y cafetal sin sombrío, mientras que pastizal no presentó diferencias con ninguna de estas coberturas debido a la alta dispersión de los conteos. En el 2EM se presentó una menor variabilidad en los conteos en pastizal, lo que permitió evidenciar las diferencias significativas entre las tres coberturas (Figura 7) (Anexo K, L y M).
34
Tabla 8. Densidad de células totales (cél/gps), heterótrofos (UFC/gps) y su abundancia relativa durante el estudio en suelos de la ecorregión cafetera
EM A Ventana Cobertura Finca
Células totales Heterótrofos cél/gpsC
(108)
cél/gpsD
(107)
UFC/gps
C
(106)
UFC/gps
D
(106) Ar
DE
1 La Vieja Bosque Ilusión 3.81
40.3 ± 3.5
4.02
3.89 ± 1.0 0.98 ± 0.3
1 La Vieja Bosque Lusitania 3.96 4.54
1 La Vieja Bosque Veraguas 4.31 3.11
1 La Vieja Pastizal La Ramada 4.03
24.8 ± 13.0
4.65
5.34 ±1.6 2.97 ± 2.2
1 La Vieja Pastizal Villa Jimena 1.62 5.75
1 La Vieja Pastizal Tesalia Baja 1.80 5.63
1 La Vieja Cafetal SSB El Descanso 1.07
10.4 ± 1.5
2.56
3.71 ±2.1 3.71 ± 2.4
1 La Vieja Cafetal SSB Buenos Aires 9.94 5.66
1 La Vieja Cafetal SSB La Aldea 1.05 2.92
1 Otún Bosque Otún Manzano 1.89
17.7 ± 6.0
8.67
4.67 ± 3.3 2.82 ± 1.7
1 Otún Bosque Otún Bejucos 1.06 3.02
1 Otún Bosque La Selva 2.35 2.32
1 Otún Cebolla Bellavista 8.94
11.7 ± 2.3
5.97
4.28 ± 2.8 3.92 ± 2.9
1 Otún Cebolla Macarena 1.37 4.83
1 Otún Cebolla Manzano 1.25 2.05
1 Otún Forestal La selva 1.77
19.7 ± 5.4
4.50
5.55 ±3.1 2.74 ± 1.2
1 Otún Forestal Playa Rica 2.04 7.56
1 Otún Forestal Lisbrán 2.11 4.60
2 La Vieja Bosque Ilusión 3.35
33.8 ± 3.9
6.57
7.25 ± 4.0 2.18 ± 1.2
2 La Vieja Bosque Lusitania 3.25 7.52
2 La Vieja Bosque Veraguas 3.55 7.68
2 La Vieja Pastizal La Ramada 1.69
19.7 ± 3.7
7.63
13.0 ± 12.0 6.96 ± 7.1
2 La Vieja Pastizal Villa Jimena 2.14 21.4
2 La Vieja Pastizal Tesalia Baja 2.09 9.86
2 La Vieja Cafetal SSB El Descanso 1.02
9.69 ± 1.0
4.28
6.77 ± 2.2 7.09 ± 2.5
2 La Vieja Cafetal SSB Buenos Aires 0.87 7.56
2 La Vieja Cafetal SSB La Aldea 1.02 8.46
2 Otún Bosque Otún Manzano 1.41
13.7 ± 2.6
9.36
11.3 ± 4.7 8.50 ± 4.2
2 Otún Bosque Otún Bejucos 1.17 10.9
2 Otún Bosque La Selva 1.53 13.6
2 Otún Cebolla Bellavista 8.80
10.1 ± 2.8
8.94
10.2 ± 5.9 9.70 ± 3.8
2 Otún Cebolla Macarena 1.34 16.0
2 Otún Cebolla Manzano 0.82 5.81
2 Otún Forestal La selva 1.67
16.4 ± 1.1
12.1
12.2 ± 4.2 7.44 ± 2.7
2 Otún Forestal Playa Rica 1.61 9.96
2 Otún Forestal Lisbrán 1.65 14.4
A
: Evento de muestreo. 1: 14-21 de abril y 2: 24 de agosto-1 de septiembre de 2007.
B
: Cafetal sin sombrío
C
: Se presenta el promedio de tres datos
D
: Se presenta el promedio y la desviación estándar de nueve datos
E
: Abundancia relativa ([(UFC/gps)/(cél/gps)]x100)
35
Figura 7. Densidad de células totales en las coberturas de la ventana La Vieja durante el estudio (n=9).
Diferente letra minúscula indica diferencias significativas (P≤0.05) entre coberturas en cada evento de muestreo. Diferente letra mayúscula indica diferencias significativas entre los eventos de muestreo en cada cobertura (P≤0.05). 1EM: primer evento de muestreo 14-21 de abril, 2EM: segundo evento de muestreo 24 de agosto-1 de septiembre.
Figura 8. Densidad de microorganismos heterótrofos en las coberturas de la ventana La Vieja durante el estudio (n=9).
[image:51.612.159.475.95.330.2] [image:51.612.133.479.405.655.2]36
En el 1 y 2EM bosque presentó la abundancia relativa de microorganismos heterótrofos significativamente menor a las coberturas pastizal y cafetal sin sombrío. En contraste, cafetal sin sombrío mostró la mayor abundancia relativa, aunque sin presentar diferencia significativa con pastizal. En el 2EM se observó un aumento de la abundancia relativa en las tres coberturas, siendo estadísticamente significativa en pastizal y cafetal sin sombrío, contrario a lo evidenciado en bosque (Figura 9) (Anexos N y O).
Figura 9. Abundancia relativa de microorganismos heterótrofos en las coberturas de la ventana La Vieja durante el estudio (n=9).
Diferente letra minúscula indica diferencias significativas (P≤0.05) entre coberturas en cada evento de muestreo. Diferente letra mayúscula indica diferencias significativas entre los eventos de muestreo en cada cobertura (P≤0.05). 1EM: primer evento de muestreo 14-21 de abril, 2EM: segundo evento de muestreo 24 de agosto-1 de septiembre.
6.2.1.1. Comparación de los parámetros fisicoquímicos y profundidad de la hojarasca para las coberturas de la ventana La Vieja
[image:52.612.153.477.242.471.2]37
cuenta esta última característica, debido a que esta cobertura no presenta hojarasca (Anexos P - S).
En relación al porcentaje de humedad se observó que pastizal presentó valores significativamente mayores que bosque, mientras que cafetal sin sombrío no presentó diferencia significativa con las otras dos coberturas. Este comportamiento se evidenció en los dos eventos de muestreo.
En términos generales, se observó un aumento del porcentaje de humedad en el 2 EM. Para bosque y cafetal sin sombrío el porcentaje de humedad que se presentó en el 2EM fue significativamente superior al observado en el 1EM, pese a que se trataban de las épocas seca y lluviosa, respectivamente. Esto se debió a que en el 2EM se presentaron fuertes precipitaciones que ocasionaron el aumento de este parámetro en los suelos (Figura 10).
Figura 10. Porcentaje de humedad en las coberturas de la ventana La Vieja durante el estudio (n=9).
Diferente letra minúscula indica diferencias significativas (P≤0.05) entre coberturas en cada evento de muestreo. Diferente letra mayúscula indica diferencias significativas entre los eventos de muestreo en cada cobertura (P≤0.05). 1EM: primer evento de muestreo 14-21 de abril, 2EM: segundo evento de muestreo 24 de agosto-1 de septiembre.