12º CONGRESO IBEROAMERICANO DE INGENIERÍA MECÁNICA Guayaquil, 10 a 13 de Noviembre de 2015
EXTRACCIÓN Y CARACTERIZACIÓN DE ACEITE MICROALGAL DE LA
ESPECIE Chlorella vulgaris POR MÉTODOS QUÍMICOS
Alejandra Franco Soriano*, Helen D. Lugo Méndez°, Alejandro Torres Aldaco°, Jesús A. Ochoa Tapia°, Raúl Lugo Leyte°
* Departamento de Ingeniería de Procesos e Hidráulica, Universidad Autónoma Metropolitana-Iztapalapa, Av. San Rafael Atlixco No. 186, Colonia Vicentina, Iztapalapa, 09340, Ciudad de México, D.F.
*e-mail:alejandra.fran.so@gmail.com
PALABRAS CLAVE: Microalga, Chlorella vulgaris, extracción, método químico.
RESUMEN
La microalga Chlorella vulgaris es precursora de los biocombustibles de tercera generación, sus lípidos y biomasa se utilizan como materia prima para la producción de biodiesel y biogás respectivamente. En este trabajo, se presenta la evaluación de la extracción de lípidos microalgales por los métodos Soxhlet y Folch usando hexano y reactivo Folch (metanol/cloroformo) como solventes. En el método Soxhlet, aunque las cadenas hidrocarbonadas de los aceites son alteradas por la aplicación de calor, se obtiene un rendimiento másico del 10% por cada 10gr de biomasa seca; y con el método en frío Folch el rendimiento es del 9% por cada 10gr de biomasa húmeda. Cabe destacar que, es posible aumentar el contenido lipídico de la microalga hasta en un 80% de peso seco, al limitar su medio de nitrógeno y modificando la intensidad de luz. El aceite obtenido es una mezcla de ácidos grasos saturados y poli-insaturados, tales como los ácidos mirístico, palmítico, esteárico, linoleico y oleico como principales componentes. El uso de solventes polares en el método Folch, permite extender la composición del aceite microalgal mediante la captura de lípidos totales y ácidos grasos poli-insaturados como ácido palmitoleico y gama linolenico, aptos también para su conversión a biodiesel.
INTRODUCCIÓN
Desde hace más de veinte años se han realizado investigaciones para obtener biodiesel a partir de aceite microalgal, investigadores de todo mundo han demostrado el potencial de varias especies de microalgas como materia prima para la producción de biodiesel, combustible sustituto del gasóleo o diesel de petróleo [1]. Las microalgas, al tener la capacidad de retener y utilizar el CO2de manera fotoautotrófica y mixotrófica, son un medio importante de secuestro de CO2 y contribuyen a la mitigación del efecto invernadero [2]. Además, los sistemas de cultivo de microalgas muestran una versatilidad, que les permite ser utilizados en el tratamiento de aguas residuales domésticas, en comparación con el proceso de tratamiento de AR´s convencional, que introduce lodos activados, una mezcla de microorganismos, para degradar materia orgánica a CO2, las microalgas pueden asimilar los componentes orgánicos y convertirlos en constituyentes celulares, tales como, lípidos, carbohidratos y proteínas, por tanto, se logra una reducción de contaminantes de una forma ambientalmente más amigable [2]. Las formas más comunes e importantes de nitrógeno en las AR´s en su correspondiente estado de oxidación son: Amoníaco (NH3), Amonio (NH4), Nitrógeno molecular (N2), iones Nitritos (NO2-), e iones Nitratos (NO3-) [3], las cuales se encuentran en diferentes concentraciones en cada tipo de aguas residuales, y no es posible controlar dichas concentraciones. Estas formas de nitrógeno son asimiladas fácilmente por las microalgas.
La capacidad de producción y acumulación de aceite de las microalgas depende de las condiciones de cultivo, tales como, temperatura, intensidad de luz, pH, salinidad, minerales, aportes de nitrógeno y enriquecimiento de CO2 [4],[5]. En [6] reportaron una disminución del índice de crecimiento y el tiempo de reproducción de la microalga al limitar de nitrógeno su medio de cultivo; sin embargo, se observa un incremento de contenido lipídico de hasta un 40 y 50% en peso seco de cepas de Chlorella, en algunas especies puede superar hasta el 80% [7].
Las algas verdes triplican su contenido lipídico durante los primeros 4 a 9 días en ausencia de nitrógeno en el medio, aumentando la proporción de triglicéridos, reduciendo el contenido de lípidos polares [8], obteniendo a su vez lípidos con alto porcentaje de ácidos grasos con ausencia de fosfato, siendo ideales para la producción de biodiesel [9].
Los lípidos son extraídos de la membrana celular y de la vacuola, estos lípidos están compuestos por fracciones de ácidos grasos libres, triacilgliceroles, ceras, esteroles, hidrocarburos glicolipidos (predominantes en membranas cloroplásticas), fosfolípidos (abundantes en plasmalema y diversos sistemas endomembranosos) y pigmentos (carotenoides, clorofilas, ficobilinas, etc.) [10], [11], [12].
No todos los lípidos microalgales son aptos para su conversión a biodiesel, sin embargo los apropiados para ello son los ácidos grasos, libre y unidos covalentemente al glicerol y sus derivados, los cuales son producidos con frecuencia por la célula microalgal y constituyen la mayor fracción de los lípidos totales, usualmente del 20% al 40% [13], [14], siendo entonces los ácidos grasos de cadena larga con un bajo grado de instauración la materia prima requerida para la elaboración de biocombustibles de calidad [15]. El contenido de ácidos grasos componentes de la microalga son: ácidos grasos saturados (Laúrico C12:0, Mirístico C14:0, Palmítico C16:0, Esteárico C18:0), monoinsaturados (Palmitoléico C16:1, Oléico C18:1), ácidos grasos poliinsaturados
(Linoleico C18:2, γ-linolénico yα-linolénico C18:3ω6 y C18:3 ω3, Araquidónico C20:4ω6, Eicosapentanoico C20:5 ω3 (EPA), Docosahexanoico C22:6 ω3 (DHA)), las concentraciones predominantes en la composición del lípido microalgal consta del 34% de ácido linoleico, 26% ácido Palmítico y 20% ácido γ linolenico,[16], [17], [18].
Las técnicas usadas generalmente para la extracción lipídica de la biomasa son métodos químicos, usando disolventes orgánicos polares, como el hexano o una mezcla metanol cloroformo (Reactivo Folch), basado en mecanismos físicos que actúan sobre las estructuras celulares [19]. Las técnicas usadas en esta investigación fueron elegidas por ser los métodos con mayor rendimiento es por eso que los método Folch y Soxhlet son los métodos analizados en esta investigación, tomando en cuenta las desventajas que a su vez estos presentan en su aplicación, al presentar desventajas como saponificación y degradación de las cadena hidrocarbonadas respectivamente en estos métodos.
por unidad de masa o unidad de volumen desprendida en la reacción química de oxidación, expresando la energía liberada entre un combustible y un comburente, que es igual a la energía que mantenía unidos a los átomos en las moléculas de combustible menos la energía utilizada en la formación de nuevas moléculas formadas en la combustión [1].
Metodología
Condiciones de cultivo de la cepa de microalga Chlorella vulgaris
La cepa de microalga Chlorella vulgaris, es cultivada en un medio monoalgal no axénico, enriquecido con
medio de cultivo “BAYFOLAN®”, dicho medio contiene los nutrientes requeridos por microalga para su
reproducción, con condiciones de temperatura en el intervalo de (18-27°C); iluminación con lámpara de luz blanca, la cual proporciona 61.00 µmol m-2 s-1, aplicando un fotoperiodo luz/obscuridad de 12/12, manteniéndolas en agitación constante y flujo de aire de 10 ml s-1y variaciones de pH 6-9, durante el periodo de cultivo, debido a la producción de OH-en el medio, Fig. 1.
Fig. 1. Cultivo madre de la cepa Chlorella vulgaris bajo Condiciones de laboratorio.
La microalga Chlorella vulgaris, no solo produce una gran cantidad de lípidos, si no también tienen la capacidad de asimilar componentes orgánicos contenidos en los efluentes del tratamiento convencional de lodos activados no removidos en el proceso, convirtiéndolos en constituyentes celulares, tales como, lípidos, carbohidratos y proteínas , así también, al tener la capacidad de retener y utilizar CO2de manera fotoautótrofa y mixotrófica , son un medio de secuestro de CO2y contribuyen a la mitigación de los gases de efecto invernadero[4], es por eso que se realizan cultivos de la microalga Chlorella vulgaris en efluentes de salida del tratamiento secundario, tomados de una PTAR de la Cuidad de México y de esta manera se obtiene un beneficio más en el proceso de producción de lípidos microalgales.
Colecta de biomasa microalgal
Fig2. Decantación de biomasa microalgal por diferencia de densidades
Fig3. Colecta y secado de biomasa a temperatura ambiente
Extracción por metodología Soxhlet
Se monta el dispositivo Soxhlet y se prepara el dedal de celulosa de 25 mm x 80 mm con 10 gr de biomasa seca, macerada previamente en mortero como se muestra en la fig. 4, el cartucho se tapa con una bolita de algodón para evitar fugas de biomasa y prevenir la contaminación de la muestra, el dedal se coloca dentro del tubo de extracción, se vierten 300 ml de hexano al matraz bola y se monta completamente el dispositivo de extracción Soxhlet. Se calienta el solvente a baño maría a una temperatura interna de 60ºC, el solvente se evapora circulando por el brazo del dispositivo condensando sobre el dedal de celulosa, llenando por completo el deposito captando las moléculas de aceite y de esta manera se recuperen los ácidos grasos junto con el Hexano, el proceso de recirculación se lleva a cabo por una hora y media para garantizar la mayor extracción de lipídica.
Una vez obtenida la mezcla hexano/ácido graso se realiza una destilación de la mezcla, tomando el punto de ebullición del hexano como límite de temperatura para evitar la quema y degradación de los ácidos grasos, se colecta en un matraz Erlenmeyer el Hexano resultante y la fracción de ácidos grasos se queda contenida en el matraz bola.
La muestra es llevada a caracterización por espectrofotometría de gases.
Fig. 4. Ruptura celular por maceración
Extracción por método Folch
Las fases orgánicas obtenida en el filtrado se mezcla en un embudo de separación con cloruro de sodio al 0.78% agitando suavemente y se deja reposar por 2 hrs, pasado este lapso de tiempo se observan dos fases, la fase inferior será filtrada con gránulos de sulfato de sodio anhidro y papel Whatman #40, esta fase contiene los solventes con los ácidos grasos el filtrado se realiza para quitar cualquier impureza contenida.
Finalmente se hace un segundo lavado con cloruro de sodio al 0.58% dejando reposar por una noche, filtrando nuevamente como se menciona anteriormente se obtiene la mezcla Folch/ ácido graso, para la separación de los solventes y los ácidos grasos se realiza una destilación fundamentada en el punto de ebullición de los solventes usados, de esta manera y una vez obtenido como producto fina los ácidos grasos se realiza una cromatografía de gases para su caracterización.
Caracterización del aceite microalgal
Cromatografía de gases (GC)
La caracterización se realiza por medio de cromatógrafo de gases (GC) Agilent Technologies 7820A, con una columna HP, inyector trasero, deterctor FID, dicho método que permite analizar la composición del aceite extraído y sus concentraciones, es posible debido a que es un método físico de separación en el cual los componentes de la mezcla son distribuidos entre dos fases (estacionaria y móvil). Los componentes son separados por sus diferencias de partición entre la fase móvil gaseosa y la fase estacionaria en la columna, permitiendo que sean separados en tiempo y espacio.
El proceso de análisis se realiza de la siguiente manera: se abren las válvulas gases (H2, N2, Aire, He), a su vez se prende la computadora con el programa correspondiente para el método que se va a realizar. Posteriormente se enciende el GC y la interface, dejando estabilizar el equipo a las condiciones del método, una vez estabilizado el GC y el programa listo se inyecta la muestra de 1 µl en el puerto correspondiente, cuidando no meter aire al momento de la inyección.
Espectrofotometia de infrarrojo (IR)
La espectrofotometria de infrarrojo es aplicada en esta investigacion para identificar los principales acidos grasos y de esta manera corroborar los resultados arrojados por el cromatografo de gases, determinando el numero de dobles enlaces en la mezcla de los acidos grasos.
El analisis se realiza en un espectrofotometro de infrarrojo “Buck Scientific M530”, como primerpaso se prende el equipo, permitiendo estabilzarse durante un tiempo, se limpia la celda donde se contendra la muestra, se inyecta con una geringa especial una porcion de muestra a la celda, se corre la muestra por 5 minutos.
Poder calorífico
Para determinar la energía que es capaz de desprender el aceite microalgal y saber si es adecuado para la
conversión a biodiesel y si nos proporcionara energía suficiente, se mide este parámetro en un Calorímetro “IKA C2000 basic”, para este análisis se usaron 0.19gr de aceite microalgal, a una temperatura en la caldera de 25°C,
un ΔT: 0.6984 K y un C: 10500 J/K.
Resultados
En tanto el poder calorífico superior arrojado muestra un valor de Ho: 37969 J/g, este valor es el calor producido verdaderamente en la reacción de combustión en una determinada cantidad de volumen, esto sin contar el calor latente de vapor del agua generado en la combustión.
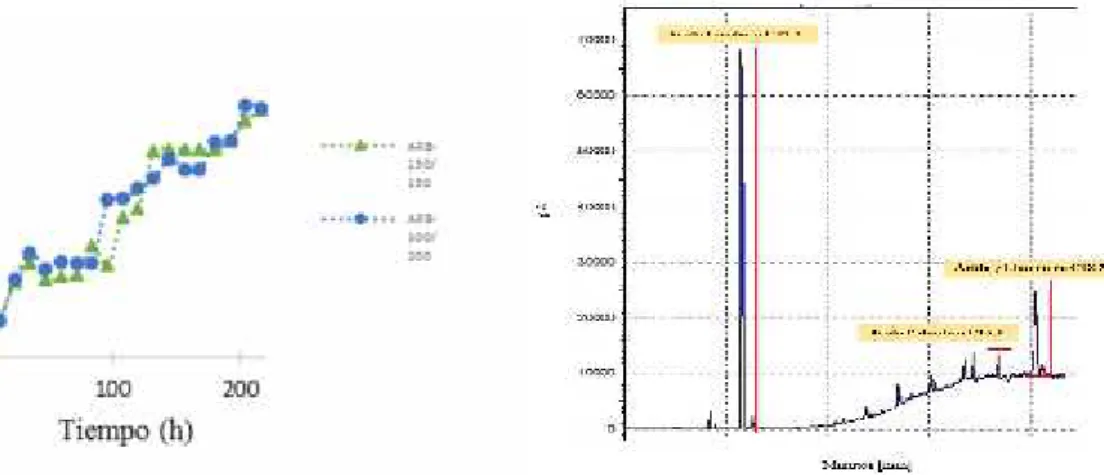
Fig. 5. Curvas de crecimiento de la cepa de Chlorella vulgaris en A2
Fig. 6. CG de lípido microalgal, concentraciones en mayor proporción el ácido linoleico, seguido de ácido γ linoleico, menor concentración de ácido palmítico.
Fig. 7. IR 1970- 2860 cm-1 corresponden a las vibraciones de tención de C-H y aquellas que se
encuentran entre 1365-1470 cm-1 corresponden a las vibraciones de flexión de grupos metilos CH 3 y
metileno CH2. La banda intensa en 1700 cm-1 corresponde a tención de estiramiento C꞊O del grupo
carbonilo y entre 1180-1350 cm-1se encuentran vibraciones C-O, ambas características de los esteres.
Conclusiónes
Los cultivos en agua secundaria del proceso de tratamiento de aguas residuales resultan convenientes para la reproducción de la microalga Chlorella vulgaris y producción de lípidos para su conversión a biodiesel, tambien permite mejorar la calidad del efluente ayudando a la mitigación de los gases de efecto invernadero.
De los métodos de extracción el que mayor uso y rendimiento muestra es el método Soxhlet, en el método Folch se corre el riesgo de una saponificación,
De los análisis de CG e IR observamos que la composición de ácidos grasos de los lípidos microalgales es muy parecida a la composición de los aceites de cocina. El poder calorífico superior (PCS) que se obtuvo de la muestra de lípidos microalgales (aceite) fue de 37,969 kJ/kg, de la literatura se obtiene el PCS del aceite virgen 39,186 kJ/kg, para el aceite residual de cocina 38,936 kJ/kg, lo que indica que el PCS del aceite microalgal está dentro del rango, con una diferencia del 3.1% con respecto al aceite virgen y del 2.4% para el aceite residual de cocina. De lo anterior se concluye que el cultivo de microalgas es una alternativa viable para la producción de biocombustibles sustentable en combinación con las plantas de tratamiento de aguas residuales.
CH3
CH2 C꞊H C-H C-O
REFERENCIAS
[1] A. G. H., R. V. Duhalt, M. d. P. S., L. S. Carreón y A. M. Jiménez, «Biodiesel a partir de microalgas,» Bio
Tecnología, vol. 13, nº 3, 2009.
[2] K. R. &. A. J. R. Barghbani, Investigating the Effects of Several Parameters on the Growth of Chlorella
vulgaris Using Taguchi’s Experimental Approach, vol. 1, 2012, pp. 128-133.
[3] M. a. Eddy, Constituents in Wastewater, 2003.
[4] W. Q. MIAO X, Biodiesel production from heterotrophic microalgal oil. Bioresour Technol, vol. 6, 2006, pp. 841-846.
[5] L. W. &. M. Min, Cultivation of Green Algae Chlorella sp. in Different Wastewaters from Municipal Wastewater Treatment Plant, Springer Science+Business Media, 2009.
[6] J. S. Z. R. Z. A. Khoeyi, «Effect of light intensity and photoperiod on biomass and fatty acid composition of the microalgae, Chlorella vulgaris,» Aquaculture International, nº 20, pp. 41-49, 2012.
[7] E. e. a. Molina Grima, «A study on simultaneous phottolimitation and photoinhibition in dense microalgal cultures taking into accountincident and averaged irradiances,» Journal of Biothecnology, vol. 45, pp. 59-69, 1996.
[8] A. Richmond, «Microalgaculture,» CRC, Critical Reviews in Biotecnology, nº 4, pp. 369-438, 1986. [9] J. L. O. a. M. A. J. W. Richardson, «The economics of microalgae Oil,» The economics of microalgae Oil,
vol. 13, nº 2, 2010.
[10] Y. Chisti, «Biodiesel from Microalgae,» Biotechnological Advances, nº 25, pp. 294-306, 2007.
[11] A. S. S. S. A. Illman, «Increase in Chlorella strains calorific values when growth in low nitrogen medium,» nº 27, pp. 631-635, 2000.
[12] J. V. V. G. C. G. y. L. J. Pruvost, «Investigation of biomass and lipids production,» Bioresource
Technology.
[13] C. Z, Products from microalgae, CRC Press, 1986, pp. 421-454.
[14] A. B. &. V.-D. R, «Aplicaciones biotecnológicas en el cultivo de microalgas,» de Ciencia y Desarrollo, 1991, pp. 17: 99-111.
[15] G. I. &. H. JL, de Lipids and lipid metabolism in eukaryotic algae, 2006, pp. 160-186.
[16] C. Y, «Biodiesel from microalgae,» de Biotechnol, 2007, pp. 294-306.
[17] K. G, «Dependence of biodiesel fuel properties on the structure of fatty acid alkyl esters,» de Fuel Process
Technol, 2005, pp. 1059-1070.
[18] Q. S. M. J. E. G. M. P. M. S. M. y. D. A. Hu, «Microalgal triacylglycerols as feedstocks for biofuel procuction: perspectives and advances,» de The Plant Journal, vol. 54, 2008, pp. 621-639.
[19] N. P. A. W. B. y. L. C. Courchesne, «Enhacement of lipid production using biochemical, genetic and transcription factor engineering approaches,» de Journal of Biotechnology, 2009, pp. 31-41.
[20] H. C. L. L. M. L. S. R. J. L. R. W. y. F. K. J. Greenwel, «Placing microalgae on the biofuels priority list: a review of thetechnological challenges,» de Journal of the Royal Societyu Interface, 2010, pp. 703-726. [21] M. C. M. B.-A. A. y. G. A. Koberg, «Bio-diesel production directly from the microalgae biomass of
Nannochloropsis by microwave and ultrasound radiation.,» de Bioresource Technology, 2011, pp. 4265-4269.