SELECCIÓN DE EXTRACTOS FÚNGICOS EXTRACELULARES (EFE)
CON POTENCIAL PARA EL CONTROL DE
Botrytis cinerea
EN TOMATE
(
Lycopersicon esculentum
Mill.)
DIANA CATALINA POVEDA PARRA
TRABAJO DE GRADO
Presentado como requisito parcial
Para optar al título de
MICROBIÓLOGA INDUSTRIAL
PONTIFICIA UNIVERSIDAD JAVERIANA
FACULTAD DE CIENCIAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL
Bogotá, D. C.
SELECCIÓN DE EXTRACTOS FÚNGICOS EXTRACELULARES (EFE)
CON POTENCIAL PARA EL CONTROL DE
Botrytis cinerea
EN TOMATE
(
Lycopersicon esculentum
Mill.)
DIANA CATALINA POVEDA PARRA
TRABAJO DE GRADO
Presentado como requisito parcial
Para optar al título de
MICROBIÓLOGA INDUSTRIAL
Director: ALBA MARINA COTES PRADO Ph. D.
Codirector: ANDRÉS DÍAZ GARCÍA I.Q.
PONTIFICIA UNIVERSIDAD JAVERIANA
FACULTAD DE CIENCIAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL
Bogotá, D. C.
NOTA DE ADVERTENCIA
Artículo 23 de la Resolución N° 13 de Julio de 1946
SELECCIÓN DE EXTRACTOS FÚNGICOS EXTRACELULARES (EFE)
CON POTENCIAL PARA EL CONTROL DE
Botrytis cinerea
EN TOMATE
(
Lycopersicon esculentum
Mill.)
DIANA CATALINA POVEDA PARRA
APROBADO
_____________________________________ __________________________________
ALBA MARINA COTES PRADO Ph. D. ANDRÉS DÍAZ GARCÍA I.Q.
Director
Codirector
______________________________________ __________________________________
MARIA CARIDAD DE GARCÍA MsC. MARÍA MERCEDES MARTÍNEZ
SELECCIÓN DE EXTRACTOS FÚNGICOS EXTRACELULARES (EFE)
CON POTENCIAL PARA EL CONTROL DE
Botrytis cinerea
EN TOMATE
(
Lycopersicon esculentum
Mill.)
DIANA CATALINA POVEDA PARRA
APROBADO
_______________________________________ _______________________________
ANGELA UMAÑA MUÑOZ M.Phil.
LUIS DAVID GÓMEZ M.
A Dios mi Director Principal porque me dio la visión y fortaleza necesarias cada día, Él y mi familia con su amor, apoyo y guía sabia me han enseñado que la perseverancia, la
AGRADECIMIENTOS
La autora manifiesta su gratitud a:
Dra. Alba Marina Cotes, por su enseñanza y por la oportunidad de formar el hábito
investigativo.
Andrés Díaz, por su enfoque y discusiones acertadas.
Carlos Andrés Moreno, por su asesoría.
Los estudiantes, profesionales y auxiliares del Laboratorio de Control biológico, por
su ayuda y colaboración.
Corpoica C.I. Tibaitatá por mostrarme posibilidades en un área que necesita ser
explorada, la investigación en la agricultura.
Mis Padres por su confianza y consejo sabio, a Moni mi hermana por su ayuda.
A todos aquellos que me acompañaron en esta carrera y me comunicaron sus
conocimientos y trabajos para la construcción de éste, su apoyo ha sido clave a lo
TABLA DE CONTENIDOS
Página
ÍNDICE DE TABLAS XI
ÍNDICE DE FIGURAS XII
RESUMEN
ABSTRACT 2
INTRODUCCIÓN 3
1. MARCO TEÓRICO 5
1.1 LOS MICROORGANISMOS COMO FUENTE DE METABOLITOS DE
INTERÉS 5
Biodiversidad Microbiana 5
Bioprospección: Proceso esencial en la investigación biotecnológica 7
Metabolitos Fúngicos en Medicina 9
Antibióticos 9
Anticancerígenos, Antidiabéticos e Inmunosupresores 12
Metabolitos Fúngicos en Alimentación e Industria 13
Metabolitos Fúngicos en Fitoprotección 14
Antibióticos 15
Enzimas 18
Volátiles 19
1.1.2 Metodologías empleadas para la bioprospección de metabolitos con
interés en fitoprotección 20
Bioprospección in vitro 20
Bioprospección in vivo e in planta 22
1.1.2.1Metabolismo secundario: Biosíntesis de productos naturales con
1.2 IMPORTANCIA DEL TOMATE (Lycopersicon esculentum Mill.) 25
1.2.1 Principales patologías del Tomate 25
1.3 MOHO GRIS: Botrytis cinerea 26
1.3.1 Generalidades del Agente Etiológico del Moho Gris. 26
1.3.2 Características Microscópicas y Macroscópicas de Botrytis cinerea. 27
1.3.3 Epidemiología y Ciclo de Vida del Fitopatógeno B. cinerea 28
Diseminación del Patógeno 28
Ciclo de Infección de Botrytis cinerea 29
1.4 CONTROL DEL MOHO GRIS (Botrytis cinerea) 31
1.4.1 Control Químico 31
1.4.2 Metabolitos fúngicos reportados para el control de B. cinerea 33
1.4.3 Características de los metabolitos fúngicos utilizados para fitoprotección 33
2. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN 35
2.1FORMULACIÓN DEL PROBLEMA. 35
2.2 JUSTIFICACIÓN DE LA INVESTIGACIÓN. 35
3. OBJETIVOS 37
3.1 OBJETIVO GENERAL. 37
3.2 OBJETIVOS ESPECÍFICOS. 37
4. MATERIALES Y MÉTODOS 38
4.1 PRODUCCIÓN DE LOS EXTRACTOS FÚNGICOS EXTRACELULARES
(EFE) 38
4.1.1 MICROORGANISMOS Y MEDIOS DE CULTIVO 38
Cepas nativas de hongos filamentosos 38
Colección de trabajo de los Hongos 38
Obtención de los Extractos Microbianos 39
4.2 ENSAYOS in vitro. 40
4.2.1 Suspensión de conidios de Botrytis cinerea. 40
4.2.2 Lectura de las Placas 41
4.2.2.1 Curva de Calibración para Botrytis cinerea 42
4.2.2.2 Actividad Antifúngica de los Extractos (EFE) 42
4.2.3 Análisis Estadístico 43
4.3 ENSAYOS in planta. 44
4.3.1 Selección del Bioensayo 44
4.3.2 Evaluación de los Extractos Fúngicos Extracelulares (EFE) seleccionados 45
4.3.2.1 Material Vegetal 45
Inoculación en Foliolos de Tomate. 45
4.3.3 Análisis Estadístico 46
5. RESULTADOS Y DISCUSIÓN 48
5.1 MICROORGANISMOS Y MEDIOS DE CULTIVO 48
5.1.1 Cepas nativas de hongos filamentosos 48
5.1.2 Producción de los Extractos Fúngicos Extracelulares (EFE) 53
5.2 ENSAYOS in vitro 59
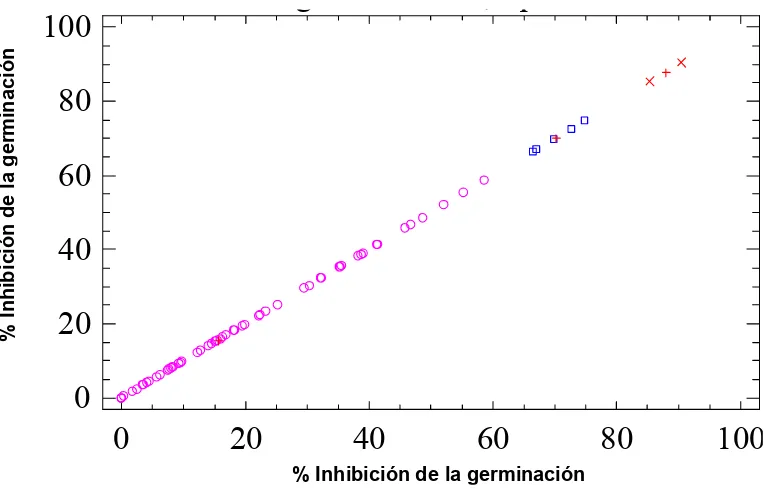
5.2.1 Efecto de los extractos fúngicos (EFE) sobre la inhibición de la
germinación de B. cinerea 59
5.2.2 Cuantificación de la densidad óptica en relación con el efecto de los
extractos fúngicos (EFE) sobre la inhibición de la germinación de B. cinerea 74
5.3 ENSAYOS in planta 85
5.3.1 Selección del Bioensayo 85
5.3.2 Evaluación de la actividad antifúngica de los extractos en ensayos
in planta. 86
7. RECOMENDACIONES 95
8. REFERENCIAS 96
ÍNDICE DE TABLAS
Página
Tabla 1. Taxonomía de Botrytis cinerea 28
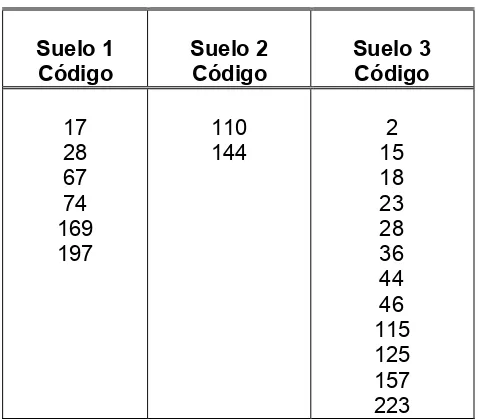
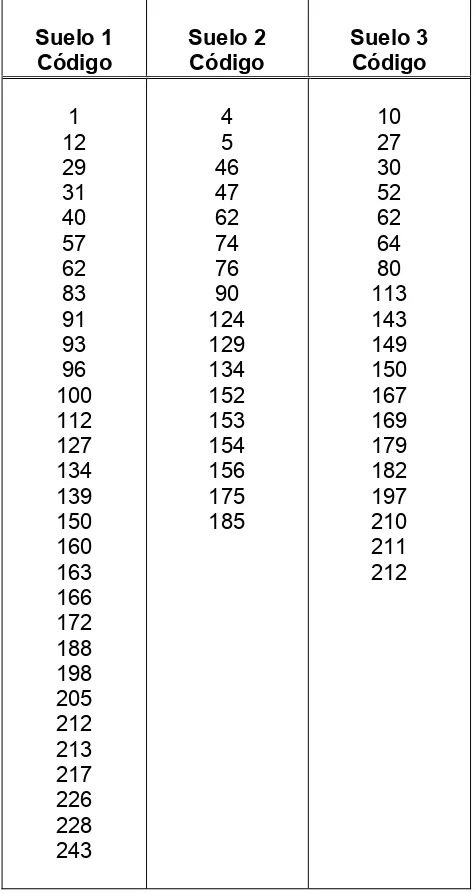
Tabla 2. Morfoespecies recuperadas de los tubos de agar 48
Tabla 3. Morfoespecies recuperadas de los viales en aceite 51
Tabla 4. Características de los EFE provenientes de las morfoespecies
suelo 1 56
Tabla 5. Características de los EFE provenientes de las morfoespecies
suelo 2 57
Tabla 6. Características de los EFE provenientes de las morfoespecies
suelo 3 58
Tabla 7. Efectos potenciales de los extractos con actividad antifúngica
sobre la germinación de B. cinerea 68
Tabla 8. Características de los EFE pertenecientes al grupo de inhibición
alta de la germinación de B. cinerea y sus correspondientes
extractos producidos en el otro medio de cultivo 69
Tabla 9. Delta de diferencias de la densidad óptica para cuatro longitudes
de onda 74
Tabla 10. Valores de densidad óptica para diferentes concentraciones
de B. cinerea 75
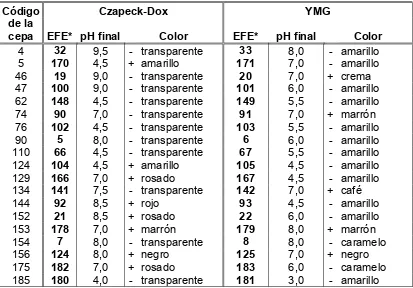
Tabla 11. EFE producidos en el medio Czapeck-Dox, empleados para la
calibración 78
Tabla 12. EFE producidos en el medio YMG, empleados para la
calibración 80
Tabla 13. Relación entre el porcentaje de inhibición de la germinación de
B. cinerea y la densidad óptica, obtenido con los extractos
49 y 56 82
Tabla 14. Porcentajes de severidad y eficacia para los tratamientos EFE
ÍNDICE DE FIGURAS
Página
Figura 1. Estructura del metabolito paclitaxel 12
Figura 2. Estructura del antidiabético L-783,281 13
Figura 3. Estructura de la gliotoxina 15
Figura 4. Estructura de la glisoprenina C, neobulgarona D y scytalol D 17
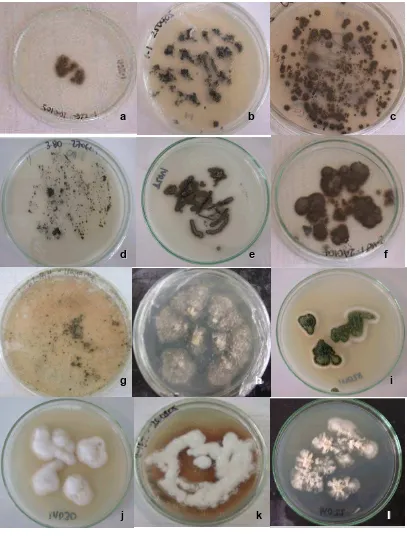
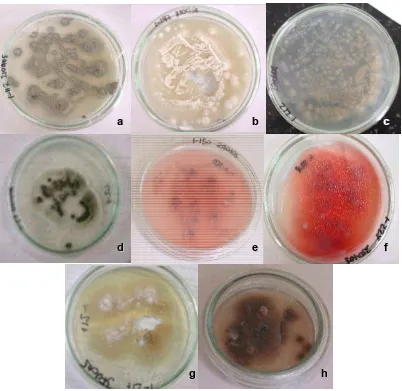
Figura 5. Fotografías macroscópicas de diferentes morfoespecies de los
suelos 1, 2 y 3 49
Figura 6. Fotografías macroscópicas de diferentes morfoespecies de los
suelos 1, 2 y 3 50
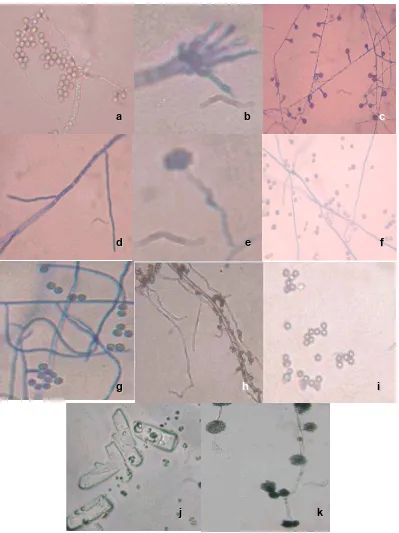
Figura 7. Fotografías microscópicas de diferentes morfoespecies 52
Figura 8. Fotografías de algunos de los extractos producidos 53
Figura 9. Agrupamiento del efecto inhibitorio de los EFE producidos en
el medio Czapeck-Dox 59
Figura 10. Agrupamiento del efecto inhibitorio de los EFE producidos en
el medio YMG 60
Figura 11. Tubos germinales cortos de B. cinerea en presencia de algunos
EFE 63
Figura 12. Concentración del contenido citoplasmático de conidios de
B. cinerea en presencia de algunos EFE 64
Figura 13. Tubos germinales secundarios y terciarios de B. cinerea en
presencia de algunos EFE 64
Figura 14. Agrupamiento del efecto inhibitorio de los EFE producidos en
Czapeck-Dox pertenecientes a los grupos de inhibición media
y alta 66
Figura 15. Agrupamiento del efecto inhibitorio de los EFE producidos en
YMG pertenecientes a los grupos de inhibición media y alta 67
Figura 16. Fotografías de los extractos del grupo de inhibición alta 69
Figura 18. Morfoespecies productoras de los extractos del grupo de
inhibición alta 72
Figura 19. Curva de calibración para B. cinerea, concentración vs.
densidad óptica 75
Figura 20. Disposición espacial de los tratamientos evaluados en una placa
de microtitulación de 96 pozos 76
Figura 21. Modelo de calibración lineal entre la densidad óptica y el porcentaje
de germinación para los EFE producidos en Czapeckl-Dox 79
Figura 22. Modelo de calibración lineal entre la densidad óptica y el
porcentaje de germinación para los EFE producidos en YMG 79
Figura 23. Incidencia B. cinerea en el modelo de foliolos de tomate 85
Figura 24. Incidencia B. cinerea en el modelo de tallos de tomate 86
Figura 25. Fitotoxicidad sobre foliolos de tomate en presencia del EFE 49 87
Figura 26. Fitotoxicidad sobre foliolos de tomate en presencia del EFE 66 87
Figura 27. Progreso moho gris sobre foliolos de tomate 88
Figura 28. Curva de progreso incidencia moho gris sobre foliolos tomate 88
Figura 29. Porcentaje de incidencia del moho gris en el día 19 89
Figura 30. Fotografías del área foliar con moho gris en presencia de los
tratamientos evaluados 90
Figura 31. Progreso severidad moho gris sobre foliolos expresado en
UABC 90
Figura 32. Porcentaje de severidad del moho gris en el día 19 91
RESUMEN
Los hongos filamentosos presentes en zonas tropicales como el Amazonas, proveen
fuentes potenciales de compuestos con actividad para inhibir la germinación de
hongos fitopatógenos durante su ciclo de infección. Este tipo de alternativas
permitirá el control de brotes epidemiológicos como el producido por el moho gris B.
cinerea, durante la pre y postcosecha en cultivos de importancia agrícola, como el
tomate. Por otra parte, en la actualidad se han desarrollado técnicas de
bioprospección de alta eficiencia en el formato de placas de microtitulación de
96-pozos para evaluar el efecto de extractos crudos o moléculas puras sobre la
fisiología, morfología o actividad de microorganismos de importancia clínica,
agrícola e industrial. Dicho efecto puede ser cuantificado relacionando la
observación directa por microscopia del fenómeno con la densidad óptica obtenida
en un lector de ELISA. Por tanto, el objetivo de este trabajo fue seleccionar
extractos fúngicos extracelulares (EFE) que inhibieran la germinación de B. cinerea
in vitro e in vivo mediante el empleo de una técnica de microtitulación. Se emplearon
cepas de hongos filamentosos aisladas previamente del Amazonas para la
producción de extractos fúngicos extracelulares (EFE) en dos medios de cultivo,
Czapeck-Dox y YMG. Los EFE fueron evaluados en placas de microtitulación de
96-pozos para cuantificar la inhibición de la germinación de 5 x 105 conidios.ml-1 de
B. cinerea, relacionando la germinación del hongo observada mediante microscopia
óptica con la densidad óptica a 405 nm. En total, 22 extractos (15 producidos en el
medio YMG y 7 en Czapeck-Dox), lograron inhibir la germinación de B. cinerea en
más del 60% en comparación con el testigo patógeno. De estos, cuatro EFE
codificados como 49, 56, 66 y 158, producidos por las morfoespecies 44 (Penicillium
sp.), 223 (Beauveria sp.), 110 (Aspergillus sp.) y 150 (Phialophora sp.)
respectivamente, en los medios YMG y CD, presentaron inhibiciones de la
germinación de B. cinerea entre el 85% y 90%. De los cuatro extractos
seleccionados in vitro, dos de ellos presentaron actividad fitotóxica en las hojas de
tomate y el extracto 56 presentó la mayor actividad sobre foliolos de tomate
ABSTRACT
Filamentous fungi from tropical ecosystems as the Amazonas, possess potential
sources of compounds with activity to inhibit germination of fungal phytopathogens
during their infection cycle. These alternatives allow to control epidemic outbreaks
produced by the gray mould B. cinerea, during pre- and postharvest of importance
agricultural cultives as the Tomato. Nonetheless, currently high-troughput
bioprospection techniques have been developed based on the 96-well microtitre
plate format to evaluate the effect of crude extracts, or pure molecules over the
physiology, morphology or activity of clinical, industrial and agricultural
microorganisms. Such effect may be scored considering the direct observation by
optical microscopy with optical density obtained in ELISA´s microplate reader.
Therefore, the objective of this investigation was to select extracellular fungal
extracts (EFE) that inhibited B. cinerea germination in vitro and in vivo through the
microtitration technique. Strains of filamentous fungi isolated previously from the
Amazonas, were used and grown for the production of the extracellular fungal
extracts (EFE) in the Czapeck-Dox and YMG media. EFE were tested on the 96-well
microtitre plates to estimate inhibition of germination from B. cinerea 5 x 105
conidia.ml-1 which was related between optical microscopy with optical density at
405nm. Twenty two extracts (15 produced on YMG medium and 7 on Czapeck-Dox
medium), inhibited conidial germination of B. cinerea up to 60% as compared to the
pathogen. From of these ones, four EFE codified as 49, 56, 66 and 158, produced by
the morphospecies 44 of Penicillium sp., 223 of Beauveria sp., 110 of Aspergillus sp.
and 150 of Phialophora sp., respectively, on YMG and CD media, showed
germination inhibition of B. cinerea ranged between 85% and 90% after 16 h. From
these four extracts selected against B. cinerea two of them showed phytotoxic
activity over tomato leaves, and was only the EFE 56 that showed the highest
activity in vivo upon tomato leaves reducing severity of gray mould at 74 % after 19
INTRODUCCIÓN
Los hongos filamentosos representan gran parte de la diversidad macro y
microscópica universal, con aproximadamente más de 250.000 especies, y más de
3.000 productos derivados de su metabolismo, identificados hasta la fecha. De
algunas de estas cepas y metabolitos, no se conocen todas sus propiedades y
actividades específicas, reflejando aún un amplio campo de interés para su
exploración e investigación. Esto es especialmente relevante en aquellos
microorganismos aislados de zonas megadiversas de nuestro país como el
Amazonas, donde la microbiota fúngica y productos derivados todavía no han sido
explorados ni explotados.
Adicionalmente, dentro del reservorio de productos naturales, existen varios
metabolitos fúngicos que han demostrado su utilidad en fitoprotección de cultivos,
debido tanto a sus efectos directos sobre los fitopatógenos, como a los efectos
indirectos sobre la planta. Esto es debido a que, estos pueden inhibir el desarrollo
de estructuras de infección y de penetración del patógeno, o actuar como inductores
de respuestas de defensa en el huésped, protegiendo en ambos casos a la planta
de los efectos deletéreos de los hongos fitopatógenos.
Las disminuciones en el rendimiento en muchos casos, también son una
consecuencia del desarrollo de resistencia por parte de los patógenos a los agentes
químicos de control tradicionalmente empleados, reduciéndose el efecto de los
agroquímicos y por ende ocasionando la persistencia de estas cepas dentro de los
cultivos. Como resultado de lo anterior se han presentado numerosos brotes
epidemiológicos de impacto económico, como los reportados para el moho gris una
enfermedad ocasionada por Botrytis cinerea, un patógeno de alto riesgo en lo
concerniente al manejo de resistencia, por su capacidad para adaptarse con
Botrytis cinerea es un hongo necrótrofo y polífago que causa serios daños y
pérdidas en un amplio rango de cultivos de frutales, vegetales y ornamentales en
todo el mundo, genera pérdidas significativas ya que puede infectar y destruir hojas,
tallos, flores y frutos, durante la producción y el almacenamiento. Desencadena un
impacto negativo con repercusiones económicas, tanto por su distribución,
versatilidad como por sus características únicas de patogenicidad dentro del ciclo de
infección, porque es capaz de desarrollar estructuras de penetración especializadas,
así como una matriz extracelular cuya función es la adhesión en la superficie de la
planta, que junto con un amplio espectro de enzimas potencian su ingreso y acción
en el huésped, desencadenando efectos letales para los cultivos. El tomate
(Lycopersicon esculentum Mill.) se ve afectado por varios problemas fitosanitarios
dentro de los que también se encuentra la enfermedad del moho gris causada por
B. cinerea.
Tradicionalmente, el control de B. cinerea se ha realizado a través de aspersiones
químicas, se estima que el mercado de productos anti-Botrytis en los últimos años,
ha alcanzado alrededor de los US $ 15-25 millones. Sin embargo, existe el riesgo de
la aparición y el establecimiento de cepas resistentes de Botrytis sp. a dichos
químicos; creándose la necesidad de buscar otro tipo de estrategias de control del
moho gris, tales como los metabolitos fúngicos que representan una alternativa
natural. Estos beneficios potenciales pueden ser descubiertos mediante procesos de
bioprospección de algunas cepas de hongos filamentosos y de los metabolitos
1. MARCO TEÓRICO
1.1 LOS MICROORGANISMOS COMO FUENTE DE METABOLITOS DE
INTERÉS.
Biodiversidad Microbiana.
Los microorganismos son una gran fuente de recursos biotecnológicos porque tanto
bacterias como hongos poseen una maquinaría enzimática y una composición
genética y fisiológica diversa, haciéndolos atractivos para la investigación, mediante
programas de búsqueda y exploración. Procesos que han permitido descubrir un
amplio número de especies, distribuidas en la mayoría de ecosistemas terrestres y
acuáticos, así como un potencial de compuestos microbianos. Hawksworth y
Rossman (1987) estiman, que existen al menos 1,5 millones de hongos en nuestro
planeta, donde para ese año, el 10% de la microbiota (100.000 especies) estaba
descrita. Pero, según datos de Selitrennikoff, en 2001, el número ha incrementado a
250,000 especies identificadas, un 25% de la población, lo que significa que aún
queda un 75% de nuevos géneros y biotipos por caracterizar. Sin contar con que, el
número de especies continúa creciendo, especialmente con el hallazgo de los
hongos endofíticos, con aproximadamente 1 millón de especies (Dreyfuss y
Chapela, 1994 citado por Strobel y Daisy, 2003), reflejando la diversidad de este
grupo de organismos asombrosos y extremadamente versátiles, porque además del
incremento en su número, se presume que con cada nueva especie se pueden
encontrar nuevos productos naturales y biomoléculas asociadas (Strobel y Daisy,
2003), de las cuales también es necesaria su identificación.
Demain (1999) reporta que existen 100,000 productos naturales, donde alrededor
los hongos filamentosos, significando aproximadamente 2,640 sustancias con
propiedades antimicrobianas. El 78% restante, se divide entre los producidos por
bacterias filamentosas (66%) y no filamentosas (12%), confirmando al grupo de los
actinomycetes, especialmente al género Streptomyces, como la principal fuente de
antibióticos a nivel mundial (Strobel y Daisy, 2003).
El número de antibióticos derivados de fuentes fúngicas, pertenece a los más de
3,000 metabolitos producidos por esta microbiota (IBWF, 2005), con diferencias
tanto en sus estructuras químicas y moleculares, como las funciones que realizan,
las cuales no siempre son conocidas (Calvo et al., 2002).
Como se mencionó anteriormente, muchos de los metabolitos descritos se derivan,
de bacterias y hongos filamentosos que son habitantes del suelo (Fravel, 1988).
Encontrándose una marcada influencia del ecosistema, de donde se aísla el
microorganismo, sobre la tasa de producción de sustancias fúngicas, porque en su
microhábitat, el microorganismo desarrolla interacciones benéficas o negativas
(Atlas y Bartha, 2002) que posiblemente pueden resultar en un efecto inductor o
supresor, de la producción de sustancias antibióticas (Fravel, 1988). Investigaciones
realizadas por el IBWF (2005) basadas en el supuesto que los hongos nunca viven
solos, y por tanto se ven influenciados por las relaciones con otros organismos,
demuestran que existe una mutua inducción entre hongos, para la producción de
metabolitos secundarios, especialmente entre hongos que presentan el mismo
hábitat, porque cepas de Penicillium sp. inducen la producción de strobilurina en
Oudemansiella mucida, que a su vez incrementa la síntesis de crisogina en P.
notatum, en comparación a la inoculación de la misma cepa en un medio de cultivo
diseñado para su fermentación. Evidenciándose una diferencia de rendimiento para
aquellas cepas que se cultivan en medios de producción frente a las mismas pero
en condiciones naturales. Este fenómeno también se ha observado para algunos
basidiomycetes, que produjeron compuestos bioactivos, cuando se cultivaron en
medios enriquecidos, bajo condiciones de laboratorio, pero donde el porcentaje de
cepas productoras (50%) no fue comparable a los obtenidos al propiciar el
producen antibióticos para suprimir el crecimiento de hongos que compiten por
sustrato o espacio (IBWF, 2005).
Este tipo de diferencias observadas al cultivar un microorganismo a escala de
laboratorio frente a las condiciones nativas, comprueba la influencia de los factores
abióticos y bióticos en la gran biodiversidad microbiana, que se ha desarrollado
como respuesta a las características que le proporciona el medio ambiente,
conllevando a la expresión y desarrollo de un sinnúmero de estrategias para poder
conservar su hábitat y nicho, dentro de un determinado ecosistema (Atlas y Bartha,
2002; Fravel, 1988; IBWF, 2005). Motivo por el cual se observan microorganismos
(bacterias y hongos) que pueden vivir en condiciones adversas o extremas, bien sea
de temperatura (-12°C a >110°C), radiación (ionizante, UV, luz visible), presión
(atmosférica, hidrostática, osmótica), salinidad, actividad de agua (0,60-1,00), pH (0,
ácidos y 13, básicos) y potencial redox, entre otros (Atlas y Bartha, 2002).
Todas estas características, también revelan el potencial biotecnológico de la
microbiota en general, porque todos los factores moleculares, enzimáticos,
metabólicos y estructurales, que le confieren resistencia y que suceden en
respuesta al escenario, son deseables para su aprovechamiento en diversos
procesos de interés industrial y económico, por la producción de pigmentos,
enzimas, polímeros, lípidos, ácidos, sales y demás derivados del reservorio
metabólico y bioquímico de los microorganismos.
Bioprospección: Proceso esencial en la investigación biotecnológica.
El conocimiento de la biodiversidad y del potencial de un microorganismo, se define
a través del estudio de sus propiedades fisiológicas, metabólicas y bioquímicas así
como de los diferentes metabolitos sintetizados, lo cual se logra mediante la
realización de pruebas exploratorias para encontrar dentro de grandes poblaciones
(Guarro et al., 1999), aquellos organismos que posean las características
La bioprospección da a la investigación una línea de tendencia, que puede resultar
en el desarrollo de nuevos productos naturales, de bioplaguicidas, o bien de
fungicidas, dependiendo del caso. Esquema de producción, que según el
Laboratorio de Control Biológico de Corpoica (C.I. Tibaitatá), comprende procesos
biológicos, tecnológicos y legales.
En los procesos biológicos, se concentran las exploraciones primarias, con las
etapas de aislamiento, selección y caracterización de microorganismos o de los
productos de síntesis, perfilando el potencial existente y haciendo de esta fase de la
investigación, el fundamento dentro de la consecución de nuevos productos. Porque
después de descubrir y seleccionar factores de interés, se continúa con los
siguientes procesos tecnológicos para el registro, comercialización y demás etapas
legales del producto.
La bioprospección de metabolitos secundarios de origen microbiano, ha permitido
identificar nuevas moléculas biológicamente activas. Esta práctica ha sido frecuente,
desde el siglo XVIII y el pasado, mediante la exploración de extractos de
fermentación microbiana con actividad antibiótica (Higgs et al., 2001). Desde, las
investigaciones realizadas por científicos visionarios como A. Fleming y S.
Waksman, resultado en el conocimiento de la mayoría de la microbiota actualmente
identificada y en el descubrimiento de algunos metabolitos, que ingresaron en la era
de los antibióticos, con la penicilina (1929) y la estreptomicina (1943), derivada de
Penicillium sp. (Atlas y Bartha, 2002; IBWF, 2005) y Streptomyces sp.
respectivamente, como los primeros metabolitos secundarios utilizados como
medicamentos con aplicaciones clínicas.
Además de las aplicaciones en salud humana, de los metabolitos secundarios
derivados de fuentes microbianas, se ha descubierto el gran potencial, de los
hongos filamentosos y de sus diferentes compuestos de biosíntesis, en diferentes
arenas. Encontrándose que esta microbiota comprende una colección de
microorganismos industrialmente muy importantes, por ser una rica fuente de
metabolitos secundarios (Calvo et al., 2002; Nieminen et al., 2002; Singh et al.,
2000; Thines et al., 2004) y de su prospección resultan grandes posibilidades de
nuevas enfermedades en humanos, plantas y animales (Strobel y Daisy, 2003),
entre otras implicaciones futuras.
Metabolitos Fúngicos en Medicina.
Antibióticos.
Al explorar un amplio rango de hongos filamentosos, se han encontrado compuestos
orgánicos de bajo peso molecular, que a bajas concentraciones son deletéreos tanto
para el crecimiento como para el desarrollo de actividades metabólicas de otros
microorganismos (Fravel, 1988), los cuales se conocen como agentes
antimicrobianos o antibióticos, que pueden ser utilizados en medicina y salud
humana frente al creciente aumento de nuevas enfermedades microbianas así como
de cepas resistentes a los medicamentos, expresado por una amplia variedad de
bacterias y hongos patógenos.
Encontrándose compuestos con estructuras y modos de acción diversos, como lo
reportado por Singh y colaboradores (2000), durante la selección de extractos de
fermentación fúngica, donde encontraron un nuevo diterpenoide, el
guanacastapeno, con actividad bactericida frente a S. aureus y E. faecium,
resistentes a los fármacos, meticilina y vancomicina, tradicionalmente empleados
para su control. En ese mismo año, Nose y col., aislaron dos nuevos antifúngicos
PF1163A y B, de un caldo de fermentación de Penicillium sp., que mostraron una
potente actividad inhibitoria del crecimiento de Candida albicans, al interferir en la
biosíntesis de ergosterol. Estos resultados son interesantes, porque se podrían
utilizar este tipo de compuestos, para reemplazar los azoles y polienos que
presentan deficiencias en el tratamiento de varias micosis e infecciones sistémicas,
ocasionadas por hongos y levaduras oportunistas, en pacientes inmunodeprimidos;
infectados por el VIH o que han recibido quimioterapia.
Igualmente, el hongo filamentoso Acanthostigmella sp. aislado del jardín botánico de
Nueva York, USA, puede ser utilizado en terapias con estos mismos pacientes,
CJ-los hongos C. albicans, C. neoformans y A. fumigatus (Watanabe et al., 2001),
patógenos de alto riesgo. Clavariopsis aquatica, un hongo hiphomycete, también
sintetiza compuestos deletéreos, para A. fumigatus y otras especies como A. niger
y C. albicans, conocidos como clavariopsinas A y B, depsipéptidos de carácter
cíclico, encontrados por Kaida y colaboradores (2001).
Otro compuesto que también podría ser empleado, es un nuevo antibiótico
CJ-17,665, derivado de Aspergllus ochraceus (Sugie et al., 2001) que inhibe cepas
bacterianas resistentes, como las mencionadas inicialmente, causantes de serios
problemas de salud pública. Chu y colaboradores en el 2003, también encontraron
dentro de cientos de extractos, dos antibióticos (Sch -484129 y -484130) de
naturaleza glicolipídica y acción frente a cepas de Saccharomyces como de
Aspergillus.
La mayoría de estos nuevos metabolitos tienen estructuras complejas con
propiedades únicas, como queenslandon, una micotoxina de la familia de las
zearalenonas (fórmula C20H26O8, estructura aromática, grupo ceto y éster carbonil,
E-configuración), encontrada dentro del grupo de las naftoquinonas, al que también
pertenece un complejo de tres altersolanoles (A, B, C), todos derivados de
Chrysosporium queenslandicum, un hongo patógeno aislado de una muestra de
suelo colectada en Egipto (Hoshino et al., 2002). Queenslandon, tiene además de
su función lactona, un fuerte espectro de actividad biológica contra bacterias y
hongos patógenos, como M. luteus, B. subtilis, A. alternata, P. chrysogenum, A.
nidulans y P. variotii, entre otros (Hoshino et al., 2002).
FR901469 es otro nuevo antimicrobiano (Fujie et al., 2000) que también presenta
una estructura y función de interés, porque es uno de los 40 miembros de las
lipopeptidolactonas macrocíclicas, con 12 aminoácidos y motilidad
3-hidroxipalmitolil, que interfiere con las enzimas encargadas de la síntesis de 1,3-β -glucanos, los cuales son componentes esenciales de la pared celular de hongos
patógenos de importancia clínica, como C. albicans y Aspergillus sp.. Este espectro
de actividad es ideal, porque no existen enzimas similares en las células de los
mamíferos (Fujie et al., 2000), que puedan ser inhibidas durante los tratamientos
selectivo y específico dentro de vías metabólicas de los hongos patógenos, es la
Khafrefungina, aislada de un micelio estéril perteneciente a un hongo endofítico.
Porque la Khafrefungina, inhibe la síntesis de esfingolípidos en etapas claves para
su consecución (Mandala et al., 1997).
Hasta el momento, se han relacionado algunos de los antibióticos con espectro de
actividad prospectiva frente a bacterias y hongos patógenos, pero existen dos
inhibidores de proteasa, los ácidos citónicos A y B, aislados de la fermentación en
estado sólido de hongo endofítico Cytonaema sp. que presentan un modo de acción
llamativo, por la inhibición del citomegalovirus humano (Strobel y Daisy, 2003).
De todos los compuestos mencionados, se hace necesario no solo evaluar su
actividad biológica sino la citotóxica o genotóxica (Nieminen et al., 2002; Watanabe
et al., 2001) debido a que, muchos de estos productos se emplearán como fármacos
para humanos. Es así como algunos de ellos están en fase exploratoria, en
laboratorio, para conocer su posible toxicidad (Hoshino et al., 2002), mientras que
otros se encuentran en las últimas etapas dentro del desarrollo de nuevos
productos, como el caso de los lipopéptidos FK 463 y WF 11899A, derivados cepas
de hongos filamentosos que fueron clasificadas dentro de dos grupos, los
Coleomycetes e Hiphomycetes (Hino et al., 2001). Cabe resaltar que, muchas de las
cepas productoras de metabolitos secundarios, con potencial prospectivo
encontradas en procesos de selección, no han sido clasificadas porque se
desconoce su género y especie.
Los antibióticos de la clase de los β-lactámicos, ya han sido comercializados y son un ejemplo destacado para la biotecnología, por su producción industrial por
fermentación, desde hace 50 años, y porque actualmente estos antibióticos,
particularmente penicilinas y cefalosporinas representan en el mundo productos de
importancia biotecnológica con ventas mundiales de alrededor de US$ 15 billones,
aproximadamente el 65% del mercado total de antibióticos en el mundo (Elander,
2003). Muchos de estos antibióticos han sido modificados químicamente mediante
un proceso conocido como semisíntesis, desde 1974 (Demain, 1981).
materias primas, la mayor parte de industrias se están moviendo hacia el este, con
China, Corea e India como los países más favorecidos (Elander, 2003).
Además de los antibióticos, existen otro tipo de metabolitos fúngicos con actividad
prospectiva en medicina, pero con otros modos de acción diferentes, como los
mencionados a continuación.
Anticancerígenos, Antidiabéticos e Inmunosupresores.
De la revisión realizada por Strobel y Daisy (2003), se puede inferir que muchos de
los metabolitos fúngicos descubiertos son de interés para su aplicación en humanos,
especialmente algunos aislados de hongos endofíticos, porque se han encontrado,
entre otros, compuestos anticancerígenos, como el Paclitaxel (Figura 1) y algunos
de sus derivados, que representan el principal grupo de fármacos de este tipo,
producidos por estos microorganismos, llegando a ventas de billones de dólares a
[image:26.612.237.402.389.506.2]nivel mundial.
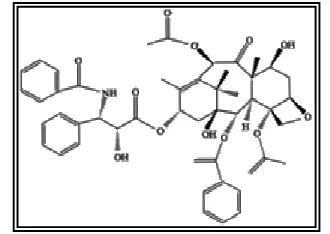
Figura 1. Paclitaxel (Strobel y Daisy, 2003)
Paclitaxel, ha sido aislado de varios hongos endofíticos alrededor del mundo, p. Ej.
T. andreanae y nuevas especies como Seimatoantleriumtepuiense, en Venezuela
(Strobel et al., 1999; Strobel y Daisy, 2003).
Además de los beneficios mencionados, este compuesto ha sido empleado para
tratar otras enfermedades en tejidos humanos y también presenta actividad frente a
Lee y colaboradores 1996, citado por Strobel y Daisy (2003), aislaron de una cepa
de Pestalotiopsis microspora, el ácido toreyanico una quinona dímerica citotóxica y
selectiva, empleada también como agente anticancerígeno.
En 1999, Zhang y col. encontraron, de una muestra de hongos nativos de selvas del
África (Kinshasa, República democrática del Congo), un metabolito
L-783,281(Figura 2) de Pseudomassaria sp., que actúa de manera similar a la
insulina y por ende, puede utilizarse en nuevas terapias para la diabetes, ya que a
diferencia de la insulina, este compuesto puede ser administrado oralmente porque
no es destruido en el tracto digestivo y además, ha demostrado una reducción de
los niveles de glucosa en la sangre, en ensayos realizados en ratones.
Otro descubrimiento sobresaliente para la medicina, ha sido la ciclosporina, aislada
de Tolypocladium inflatum (Borel y Kis, 1991, citado por Strobel y Daisy, 2003), así
como otros metabolitos fúngicos con modo de acción parecido (IBWF, 2005; Strobel
y Daisy, 2003), que actúan de forma similar a los inmunosupresivos empleados en
la actualidad en pacientes que han sido transplantados, para prevenir el rechazo a
los injertos. Lo cual, abre un amplio espectro, para el desarrollo de nuevos
fármacos, dentro de los que también se pueden contar algunos metabolitos que
presentan, actividad antitumoral (Strobel y Daisy, 2003), acción frente a la
hipercolesterolemia (IBWF, 2005), entre otros.
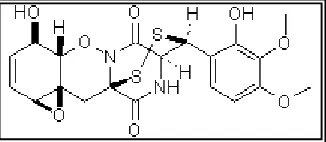
Figura 2. Estructura del antidiabético L-783,281 aislado de Pseudomassaria sp.
(Zhang et al., 1999. Science)
Metabolitos Fúngicos en Alimentación e Industria.
Los hongos filamentosos también han sido empleados para la elaboración de una
y celulasas, entre otras, que aceleran diversos procesos industriales. Utilizándose
para la degradación de materiales (p. ej. papel, residuos vegetales, grasas),
obteniéndose productos y subproductos de interés. Beneficios que se derivan de la
versatilidad de los microorganismos para aprovechar los materiales y recursos
existentes en el ambiente.
Descubriéndose, un sinnúmero de enzimas de fuentes fúngicas; amilasas
encontradas en varios cultivos de Aspergillus sp. como la α-amilasa de A. oryzae (Pedersen y Nielsen, 2000); pectinasas (Endo- y Exo- Poligalacturonasas PG) en A.
awamori (Blandino et al., 2002); Celulasas (β- glucosidasas, β−1-4 glucanasas) producidas por varias cepas de Aspergillus, Phoma, Fusarium y Trichoderma (Atlas
y Bartha, 2002), proteasas y lipasas.
La mayoría de estos metabolitos fúngicos son empleados en la industria de
alimentos para la fabricación de bebidas alcohólicas, edulcorantes, jugos, quesos
madurados y en la producción detergentes, enzimas, entre otros.
Además, de las enzimas fúngicas, el ácido cítrico derivado de la fermentación de
Aspergillus niger (Demain, 1981), ha demostrado ser uno de los metabolitos más
importantes en varios alimentos, por su carácter acidulante y conservante.
Metabolitos Fúngicos en Fitoprotección.
Muchos de los metabolitos fúngicos utilizados como agentes de biocontrol de
microorganismos fitopatógenos, presentan diferentes modos de acción específicos o
no específicos, y comprenden tanto agentes líticos, enzimas, compuestos volátiles y
otras sustancias tóxicas, siendo considerados como mecanismos de antibiosis,
según Fravel (1988). A continuación, se enumeran algunos de los metabolitos
fúngicos utilizados en fitoprotección, que han sido agrupados dentro de estos
Antibióticos
Desde los años 50´s, existen varios reportes (Fravel, 1988) que mencionan la
producción de metabolitos fúngicos para el control de ciertas enfermedades
ocasionadas por fitopatógenos. Como la gliotoxina (Figura 3) (Wright, 1956 citado
por Fravel, 1988) producida por Trichoderma viride (G. virens), para el control de
Pythium, patógeno que induce volcamiento en plantas.
En 1962, Barnett y col. (referido por Fravel, 1988) citan la producción in vitro de un
antibiótico que explica el antagonismo de G. roseum, frente a varios hongos,
relacionándolo como uno de los posibles mecanismos responsables, además del
hiperparasitimo. Otra correlación, pero entre la actividad in vitro y en invernadero,
fue realizada para la quetomina producida por Chaetomium globosum, viéndose una
inhibición del patógeno Venturia inequalis, en ambos modelos de estudio (Cullen y
Andrews, 1984 citado por Fravel, 1988).
Fravel (1988), considera algunas investigaciones realizadas durante la década de
los 80´s, donde se mencionan varios estudios que relacionan el empleo de
diferentes extractos de fermentación fúngica con la inhibición de algunos
fitopatógenos. En 1982 (Papavizas et al.), el extracto del medio de cultivo de
Trichoderma harzianum resultó en una inhibición de la pudrición blanca ocasionada
por S. cepivorum. En 1986, Ricard y Bollen, encontraron una sustancia producida
por Scytalidium sp. que inhibía a Poria carbonica. El año siguiente, Fravel et al.,
aislaron un metabolito del medio de cultivo de Talaromyces flavus, que destruía los
esclerocios de V. dahliae.
[image:29.612.240.403.546.617.2]Figura 3. Estructura de la Gliotoxina
Wilson y Wisniewski (1994), también exponen una revisión de diversas
líquidos, principalmente de especies de Trichoderma sp., varios compuestos de
estructura 6-pentil-α-pirona, siendo de este grupo, el 6-amil- α-pirona el más común y potente in vitro e in vivo. Otras especies como T. lignorum y T. viride producen
trichodermina, que inhibe no solo a hongos filamentosos sino también a Candida
albicans.
Otros metabolitos fúngicos derivados de este género, son las koninginas, aisladas
de T. Koningi que produce Koningina A, y de T. harizianum que sintetiza tanto la
Koninginas A y B, así como dos nuevas estructuras butenolidas, estas últimas con
actividad frente a Gaeumannomyces graminis, un patógeno de cereales (Wilson y
Wisniewski, 1994).
Para favorecer el ingreso a la planta, después de la germinación del conidio,
muchos fitopatógenos desarrollan una estructura conocida como apresorio, la cual
también se ha visto afectada por numerosos metabolitos orgánicos, con diferentes
estructuras químicas y modos de acción, dentro de las que se cuentan 4
glisopreninas de carácter lipofílico (Figura 4A) de cultivos de Clonostachys rosea, 6
dímeros derivados de la antraquinona, las Neobulgaronas A-F, con mayor actividad
de la Neobulgarona D (Figura 4B), purificadas del micelio de Neobulgaria pura
(asomycete) (Eilbert et al., 2000). Así como, varios ácidos grasos de longitud de
cadena de 16,18 ó 20 átomos de C, hallados en extractos de micelio de hongos,
viéndose según Eilbert y colaboradores (1999; citado por Thines et al., 2004) una
mejor actividad inhibitoria frente a M. grisea, para aquellos que presentaban
configuración –cis en su instauración, como el ácido palmitoléico, el octadecenico y
el petroselínico (C18, cis-6) principalmente.
Otros compuestos con la misma afinidad por el sitio de acción son Scytalol D (Figura
4C), producido por el hongo anamórfico Scytalidium sp. (Thines et al. 1998) y una
cerulenina obtenida de un aislamiento originalmente llamado Cephalosporium
Figura 4. (A) Glisoprenina C, la más activa de las 4 glisopreninas de C. rosea,
(B) Neobulgarona D, (C) Scytalol D (Thines et al., 2004).
Algunos metabolitos también han sido aislados de hongos basidiomycetes, puesto
que según el IBWF (2005) la mitad de ellos producen antibióticos, como los
encontrados en el extracto de Resupinatos leightonii, dos sesquiterpenos, el
4-germacradieno-2,6,12-triol y 1,6-farnesadieno-3,10,11-triol, asimismo inhibidores de
M. grisea (Eilbert et al., 2000; Thines et al., 2004).
Strobilurina A, ha sido un ejemplo destacado de metabolitos empleados como
moléculas modelo para el desarrollo de nuevos productos originalmente aislados de
fuentes fúngicas, en este caso de basidiomycetes. Porque según el IBWF (instituto
de investigación en Biotecnología y Drogas) junto con la Universidad de
Kaiserslautern (2005), de Alemania, esta es la clase más importante de fungicidas
utilizados en agricultura, descubiertas por Anke y colaboradores en 1977 de cultivos
líquidos de Strobilurus tenacellus un basidiomycete que crece en los conos de los
pinos.
En 1986 se produjeron los primeros derivados sintéticos que tenían estabilidad
frente a la radiación UV, porque aplicaciones del compuesto natural en campo
demostraron una relativa volatilidad e inestabilidad fotoquímica (Gullino et al. 2000),
además que existían dificultades para producir el compuesto a gran escala. De la
optimización química han resultado varios análogos, especialmente kresoxin-metil,
desarrollada por BASF y comercializada como Stroby®, Brio®, Discus® y Juwel®.
A
C
Las strobilurinas en el presente, están dentro de los fungicidas más vendidos
alrededor del mundo, siendo usados como protectantes de plantas frente a los más
importantes hongos fitopatógenos. Porque análogos químicos como kresoxin-metil,
azoxystrobina, metominostrobina y trifloxystrobina, tienen un amplio espectro de
actividad ya que, son inhibidores de la respiración fúngica controlando ascomycetes
y basidiomycetes, mildeos (polvoso y velloso) y royas (Gullino et al., 2000),
presentes en hojas, tallos, frutos y espigas principalmente de cebada, trigo, arroz.
Además de su uso para cultivos de cereales, estos fungicidas se emplean para en
otros cultivos para el control de Alternaria, Rhizoctonia solani, Pythium spp.,
Venturia, Botrytis cinerea y Sclerotinia, entre otras enfermedades (Gullino et al.,
2000).
Estos fungicidas del tipo strobilurina son un ejemplo del éxito en la aplicación
comercial de un producto a base de hongos ó de sus metabolitos, evidenciando que
las sustancias naturales pueden ser una importante fuente de agentes antifúngos,
que luego pueden ser desarrollados como productos o bien como moléculas modelo
para la síntesis de nuevos fungicidas selectivos (Gullino et al., 2000; Thines et al.,
2004). Este último autor, además menciona su importancia para el ambiente, porque
se asume que los compuestos naturales, siendo parte del ecosistema, pueden ser
biodegradables, compatibles y menos tóxicos.
Enzimas
Las enzimas son otro tipo de metabolitos fúngicos que median el antagonismo
ejercido por agentes de biocontrol, lo que significa su uso potencial sobre
poblaciones de fitopatógenos y de insectos plaga. Debido a que, las enzimas
pueden degradar las paredes celulares y otros compuestos estructurales, o bien
actuar frente a algunos eventos relacionados con la patogénesis de organismo.
Fravel (1988) menciona dos investigaciones realizadas en 1982 y 1987, por Marois
y colaboradores y Lewis y Papavizas respectivamente, donde encontraron
compuestos que tenían una acción enzimática en fitopatógenos como Sclerotinia y
R. solani, derivados de Talaromyces flavus, Gliocladium virens y especies de
agroecológica, son las que producen varias especies de este género, como las
chitinasas y B-1,3-glucanasas reportadas por Elad y Kapat (1999) para Trichoderma
harzianum cepa T39.
Además de estas enzimas, De la Cruz y Llobell (1999) y Ait-Lahsen y colaboradores
(2001) indican la producción de B-1,6-glucanasas y proteasas corroborando la
producción de una gran variedad de estos metabolitos que lisan la pared celular, de
micelios y conidios en hongos fitopatógenos, por diferentes aislamientos de
Trichoderma.
Volátiles
Como se mencionó anteriormente, T. harzianum es una fuente de antifúngicos con
diferentes modos de acción, como los metabolitos volátiles reportados por Claydon
et al. (1987, citado por Fravel, 1988) identificados como alquilpironas con acción
fungicida y mayoritariamente fungistática sobre patógenos como R. solani.
Otro microorganismo que produce sustancias volátiles protectoras, es Boletus
varigatus (Krupa y Nyland; 1972 por Fravel, 1988) dentro de las que se incluyen
alcoholes como etanol e isobutanol y ácido isobutírico.
Por lo general los principales compuestos volátiles, pertenecen al grupo de los
alcoholes y de los ácidos, como los compuestos reportados para el hongo endofítico
Muscodor albus, denominado “biofumigante” según Mercier y Jiménez en el 2004,
porque este micelio estéril aislado de una árbol de canela (Cinnnamomum
zeylanicum) en Centro América (Strobel et al., 2001) produce 28 compuestos que
inhiben y destruyen varias especies de hongos, oomycetes y bacterias (Mercier y
Jiménez, 2004).
Este tipo de metabolitos principalmente 2-metil-1-butanol y el ácido isobutírico,
pueden ser empleados para controlar algunas de la enfermedades que se presentan
en postcosecha durante el almacenamiento de los frutos, ocasionadas por Botrytis,
Colletotrichum, Geotrichum, Monilinia, Penicillium y Rhizopus, ya que no se requiere
el contacto del hongo con el fruto o el fitopatógenos para ver un efecto inhibitorio,
1.1.2 Metodologías empleadas para la bioprospección de metabolitos con
interés en fitoprotección.
Para definir el perfil de un metabolito fúngico, es decir su modo de acción y
aplicabilidad, se hace necesario evaluar su actividad biológica en protocolos que
permitan cuantificar la sensibilidad del fitopatógeno respecto de los compuestos
antifúngicos, lo cual se puede lograr mediante ensayos in vitro e in vivo, en los que
se enfrenta el compuesto con el patógeno.
Bioprospección in vitro.
Bauer y colaboradores (1966, citado por Hadacek y Greger, 2000) implementaron la
metodología in vitro, para la evaluación de la actividad antagónica de los metabolitos
frente a los hongos filamentosos, mediante protocolos de difusión del producto en
cajas de petri que contienen un medio de cultivo (p.ej. Agar Papa Dextrosa –PDA-,
Extracto de Malta), que queda mezclado con el compuesto en una proporción
definida. Para luego, colocar un disco (5-10 mm de diámetro) con desarrollo del
hongo fitopatógeno en el centro de la caja sobre la superficie del medio y evaluar la
inhibición del crecimiento radial respecto del control (Daoubi et al., 2004; Folman et
al., 2004). Una variación de esta metodología, es disponer una suspensión de
esporas (10-20µl) en el centro de la caja (Hadacek y Greger, 2000), o bien, colocar la suspensión (0.5-1ml) distribuida sobre la superficie del medio de cultivo, donde se
colocan discos de papel filtro (3-5 mm de diámetro) impregnados con el metabolito,
para medir el halo de inhibición producido (zonas libres de micelio), después del
tiempo de incubación, tomando como parámetros de aceptación los valores dentro
del rango de 10-20 mm (Dardari et al., 2004; Hadacek y Greger, 2000; Santamarina
et al., 2002; Zhang et al., 2001).
Para evaluar estos compuestos difusibles, también se pueden colocar discos con
crecimiento del hongo (7mm) enfrentados con discos (5mm) inoculados con el
metabolito, conservando una distancia entre ellos de 2,0-2,5 cm, dentro de cajas de
petri con medio de cultivo (Chaurasia et al., 2005), para estimar igualmente el
Además de estos ensayos de difusión en medio sólido, desde mediados de los 90´s
se desarrollaron protocolos de dilución (microdilución) en medio líquido, en placas
tipo ELISA de 96-pozos, protocolo ampliamente adoptado por autores como
Alemany, 2001; Dardari et al., 2004; Hadacek y Greger, 2000; Hjeljord et al., 2001;
López-García et al., 2002; Meepagala et al., 2003; Pohanka et al., 2004; Salah et al.,
2003; Slawecki et al., 2002; Thines et al., 2004; Wilson et al., 1997; Wedge et al.,
2000 y Zhang et al., 2001, entre otros, para evaluar la susceptibilidad de los
fitopatógenos, a este tipo de compuestos antifúngicos. El formato de placas de
microtitulación es un bioensayo cuantitavo (Roberts y Boyce, 1972 citado por
Hadacek y Greger, 2000) que permite evaluar el modo de acción, al valorar la
inhibición de la adhesión y germinación del conidio, mediante observación directa
por microscopia (Alemany, 2001; Hadacek y Greger, 2000; Hjeljord et al., 2001;
Slawecki et al., 2002), así como la interferencia en el crecimiento del hongo, por
determinación de la absorbancia (Wilson et al., 1997).
Junto con las metodologías mencionadas, existen otros protocolos que buscan
evaluar únicamente una variable, como la inhibición de la germinación, al disponer
en láminas de vidrio un volumen (µl) del compuesto y de la suspensión de esporas del hongo, como lo realizado por Silva y colaboradores (2002) y por Walker y
colaboradores (2001), para evaluar extractos vegetales de Caryocar brasiliense
Camb. y metabolitos de Pseudomonas antimicrobica frente a Botrytis cinerea,
respectivamente.
Otro efecto in vitro que también puede ser cuantificado, es el carácter volátil de los
metabolitos, una variable que ha sido estimada para extractos vegetales y aceites
esenciales en microplacas, al sellar cada pozo con láminas de cera dental para
prevenir la contaminación cruzada (Wilson et al., 1997). Esta variable también
puede ser evaluada en cajas de petri, creando dos áreas con medio de cultivo al
retirar una tira de agar, del centro de la caja, con el fin de inocular a un lado del plato
un microorganismo productor de volátiles (p. Ej. M. albus) y en el otro lado, 7-10
días después, un disco de agar con el hongo fitopatógeno, para ver el efecto sobre
De todos los ensayos de antagonismo, se puede inferir que la metodología en
microplacas ofrece por una parte, un potencial para una alta eficiencia en el análisis
de 10,000 o más compuestos por semana ya que, se reduce la cantidad de
metabolito y de inóculo necesarias y por otro lado, permite una observación directa
para detectar anomalías morfológicas (Hadacek y Greger, 2000), como inhibición en
la germinación y daño de las hifas, entre otros.
Bioprospección in vivo (in planta).
En los ensayos in vivo principalmente se busca ver el desarrollo de los signos y
síntomas del fitopatógeno estimado como incidencia y severidad de la enfermedad,
evaluando también la inhibición de la germinación o del crecimiento del patógeno,
expresado como la supresión de la enfermedad en la planta.
Conduciendo en muchas ocasiones, a que los parámetros evaluados in vitro puedan
ser o no correlacionados con el biocontrol in vivo, en condiciones similares a la
naturales (Fravel, 1988). Por ejemplo, este autor cita un ensayo realizado por
Richard y Bollen (1986), donde se vio la inhibición de un fitopatógeno frente a una
sustancia microbiana, tanto en ensayos in vitro en agar como in planta, sobre trozos
de madera.
Elad y Kapat, 1999; Fravel, 1988; O´Neill et al., 1997 y Mercier y Jiménez, 2004,
entre otros autores, reportan la aplicación de los extractos fúngicos, sobre hojas o
segmentos de éstas, en tallos, en frutos, o en suelo estéril y en combinación o no
del fitopatógeno para observar la supresión del microorganismo o de estructuras de
resistencia como esclerocios (Fravel, 1988), lo que resulta en la disminución de la
enfermedad. De Meyer y colaboradores (1998) indican que al emplear la totalidad
de la planta, también se puede observar la inhibición de los fitopatógenos, porque
dependiendo del sitio de inoculación se pueden inducir respuestas de defensa en el
1.1.2.1 Metabolismo secundario: Biosíntesis de productos naturales con
interés en fitoprotección.
Brakhage y colaboradores (2004), estudiaron algunos mecanismos que regulan la
biosíntesis de penicilina en hongos filamentosos, encontrando que la producción de
este metabolito secundario, no es esencial para la directa supervivencia del
organismo productor, indicando que los genes para la biosíntesis son controlados
por una red compleja de regulación; por el pH del ambiente, la fuente de carbono,
nitrógeno, aminoácidos, entre otros elementos, coincidiendo con Calvo y
colaboradores (2002), en que varios aspectos internos y externos, como factores
ambientales y genéticos pueden influenciar la producción de metabolitos
secundarios. Incluyendo en algunos casos, reacciones muy alejadas del
metabolismo energético (Doran, 1998), ya que muchos de estos compuestos no son
esenciales ni para el crecimiento ni como intermediarios del metabolismo básico del
microorganismo, entendiéndose que probablemente juegan algún otro rol en la vida
de los hongos (Turner 1971; Demain, 1981; Guarro et al., 1999).
Cabe resaltar que toda la producción de metabolitos, está enmarcada dentro del
comportamiento cinético del microorganismo, en este caso de los hongos
filamentosos, los cuales experimentan una tendencia diferente que se caracteriza
por tener una primera fase llamada trofofase o de crecimiento, en la cual se
sintetizan los metabolitos primarios y la idiofase donde se producen los metabolitos
secundarios (Demain, 1981; Poutou, 2002). En la trofofase o fase de crecimiento, se
le proporcionan condiciones apropiadas al hongo filamentoso para que crezca de
manera eficaz y es donde el microorganismo produce metabolitos relacionados con
su crecimiento. Para la fase siguiente, la Idiofase, se producen metabolitos
secundarios, esta producción puede no derivarse del sustrato primario de
crecimiento, sino a partir de un producto que él mismo formó, a partir de esa fuente
primaria (Demain, 1981; Poutou, 2002). Sirviendo el metabolismo primario, en las
vías biosintéticas de antibióticos, como un proveedor de precursores y cofactores
para el metabolismo secundario (Gunnarsson et al., 2004) con la consecuente
En estudios con biorreactores realizados por Saha y colaboradores, 2004, se ha
demostrado que la producción de este tipo de metabolitos, también depende
fuertemente de la escala de operación, donde existe una relación definitiva entre la
concentración de oxígeno disuelto, pH del medio, empleo de glucosa, diferenciación
celular y producción. Ratificando que todas las condiciones del cultivo y de la
fermentación, soportan e influencian la síntesis de metabolitos secundarios (Higgs et
al., 2001).
La morfología fúngica, en algunas ocasiones, es otro parámetro clave dentro de la
producción industrial, porque puede variar durante el proceso de fermentación, ya
que también está influenciada por aspectos como la velocidad de agitación, la tasa
de crecimiento, el oxígeno disuelto, el número de esporas o conidias por litro de
medio de fermentación, aspectos de importancia que deben ser considerados
cuando se quieren altos rendimientos en el proceso (Pazouki et al., 2000).
Además de los diferentes parámetros y condiciones de fermentación, mencionados
anteriormente, cabe resaltar que al interior de las células es donde se evidencia el
impacto de este tipo de factores, lo que desemboca en la consecución del producto
de interés y en el desarrollo de vías metabólicas para tal fin. Una de las rutas
metabólicas de donde se derivan los metabolitos secundarios, es la vía del
shikimato o ácido shikímico (Demain, 1981), porque según Adachi y colaboradores
(2003), la producción y vía salvaje de shikimato, es favorable para la biosíntesis de
muchos antibióticos, herbicidas y aminoácidos aromáticos, porque en esta vía se
sintetiza el corismato, un precursor común de muchos metabolitos aromáticos, tanto
1.2 IMPORTANCIA DEL TOMATE (Lycopersicon esculentum Mill.).
El Tomate (Lycopersicon esculentum Mill.) es la principal hortaliza a nivel mundial,
se cultiva en cerca de casi 4,0 millones de hectáreas, con más de 100 millones de
toneladas promedio de producción (FAO 2005). Siendo países como China y
Estados Unidos de América, los principales productores con 30 y 12 millones de
toneladas, respectivamente.
En Colombia, según datos emitidos por la FAO (2005), el cultivo de tomate ocupa un
lugar representativo dentro de los productos básicos del país, en cuanto a
producción e importancia alimenticia. La producción promedio es de 382,438
toneladas, durante los últimos seis años (1999-2004), con una superficie cultivada
promedio para el mismo período de 16.200 hectáreas, siendo para él último año
(2004) de 15.000 Ha. En cuanto a rendimiento, los datos suministrados entre
1999-2003 arrojan un valor medio de 23.502 kg/Ha (2,3 Ton/Ha). Variables que presentan
crecimientos para los últimos dos años. Pero, cuyos resultados son sustancialmente
inferiores, comparados con países como Brasil y Chile, primer y segundo productor
suramericano, que presentan datos de producción de 3,4 y 1,3 millones de
toneladas, frente a las 370,000 toneladas nacionales, lo que significa una diferencia
de 3 millones (Ton), respecto de Brasil y de 930,000 toneladas menos frente a Chile.
Estos datos son un reflejo de la brecha tecnológica existente, que traduce en una
menor productividad. Porque, aunque existe una baja diferencia de área cultivada p.
Ej., entre Colombia y Chile, con 15,000 y 20,000 Ha, este último país, triplica la
producción deduciéndose que realiza un mejor aprovechamiento de los recursos
junto con la introducción de programas de cultivo sostenible.
Cabe resaltar que el cultivo de esta hortaliza presenta una gran variedad de
enfermedades, que minan su producción, de las cuales Colombia no es una
excepción.
1.2.1 Principales Patologías del Tomate.
nemátodos; virus, como el mosaico del tomate; bacteriosis, Pseudomonas syringae,
y hongos filamentosos, dentro de los que se consideran, al moho gris (Botrytis
cinerea), mildeo polvoso y velloso, moho blanco (S. sclerotiorum), Alternaria sp.,
Fusarium oxysporum f sp.lycopersici y Verticillium dahliae (Infoagro, 2004), como los
más representativos, por su incidencia sobre todas las partes de la planta lo cual,
conduce a la reducción en el rendimiento porque se limita el desarrollo de la planta,
entre otros efectos. Estas enfermedades, concuerdan con lo reportado Bareño
(citado por Moreno, 2003) quien relaciona la presencia en el país, de algunos de
estos problemas fitosanitarios del ambiente foliar, tanto en época seca como
húmeda. Para el primer período algunos son causados por la mosca blanca, el
pasador de fruto, el gusano cogollero y Oidium sp., y en tiempo húmedo son
Phytophthora infestans, Alternaria solani, Fulvia fulva, bacteriosis, mildeo velloso y
Botrytis cinerea los factores restrictivos.
Por estas y otras patologías microbianas que afectan al tomate, se ha creado la
necesidad de buscar e implementar nuevas alternativas de control que aumenten la
productividad del cultivo, además de minimizar el uso indiscriminado de productos
químicos (Infoagro, 2004) a los que se expone esta hortaliza, surgiendo nuevas
estrategias que pueden ser implementadas dentro de un Manejo Integrado de las
Plagas (MIP) que afectan al tomate. Diseñadas también, en respuesta a la
resistencia que adquieren algunos de los patógenos. El Laboratorio de Control
Biológico, de Corpoica C.I, Tibaitatá, ha encaminado algunos de sus proyectos de
investigación, en la búsqueda de alternativas de manejo, en pre y postcosecha del
tomate, derivadas de fuentes microbianas que disminuyan algunos problemas de
importancia hortícola, como los ocasionados por Botrytis cinerea un fitopatógeno
frecuente del ambiente de invernadero.
1.3. MOHO GRIS: Botrytis cinerea.
1.3.1 Generalidades del Agente Etiológico del Moho Gris.
Botrytis cinerea es un hongo polífago que causa serios daños y pérdidas en un
atacando prácticamente plantas de todas las especies hortícolas, frutícolas y
florícolas (Kerssies, 1993; De la Isla, 1994; Malolepsza, 2004), durante la
producción y el almacenamiento (Malolepsza, 2004) en la pre- y poscosecha
(Morandi et al., 2000, 2001).
El moho gris causado por Botrytis cinerea es probablemente una de las
enfermedades de vegetales, ornamentales, frutales y cultivos de campo, más
comunes y ampliamente distribuidas a lo largo del mundo (Ben-Shalom et al., 2003;
Barka et al. 2002; Elad, 1996), generando un impacto negativo con repercusiones
económicas, tanto por su distribución como por la capacidad de infectar las hojas,
los tallos, las flores y los frutos (O´Neill et al., 1997). Ocasionando la enfermedad
conocida como Moho o podredumbre gris, que durante epidemias severas puede
destruir la totalidad del follaje (Elad et al., 1999), porque el patógeno ocasiona una
propagación de lesiones necróticas en hojas (Morandi et al., 2001).
B. cinerea se disemina por el aire, se comporta como saprófito mientras encuentra
las condiciones favorables para infectar el hospedero y convertirse en patógeno
(Avila, 1993). Esta habilidad de desarrollarse como saprófito es esencial pues le
permite incrementar su inóculo sin recursos de sostenimiento derivados de la
patogénesis de las células del huésped (Blakeman, 1993 citado por Moreno, 2003).
1.3.2 Características Microscópicas y Macroscópicas de Botrytis cinerea. Botrytis cinerea Pers ex Fr, es el hongo más importante de las especies de Botrytis
(Daoubi et al., 2004), siendo un hongo Deuteromycete (Hyphomycete) (Tabla1), es
el estado imperfecto de Botryotinia fuckeliana (su teleomorfo) (De Meyer et al.,
1998) (Ellis y Waller, 1974 citado por Kerssies, 1993).
Microscópicamente B. cinerea, presenta los extremos de las hifas ramificados, al
comienzo de su formación se ven hialinas, con el tiempo se tornan pardas o negras
(Piñeros et al., 1998). La célula terminal de cada ramificación tiene forma de ampolla
a partir de la cual se forma en un dentículo una conidia hialina, esférica o elipsoide y