Instituto Tecnológico y de Estudios Superiores de Monterrey Campus Monterrey
Monterrey, Nuevo León a
Lic. Arturo Azuara Flores:
Director de Asesoría Legal del Sistema
", en los sucesivo LA OBRA, en virtud de lo cual autorizo a el Instituto Tecnológico y de Estudios Superiores de Monterrey (EL INSTITUTO) para que efectúe la divulgación, publicación, comunicación pública, distribución y reproducción, así como la digitalización de la misma, con fines académicos o propios al objeto de EL INSTITUTO.
El Instituto se compromete a respetar en todo momento mi autoría y a otorgarme el crédito correspondiente en todas las actividades mencionadas anteriormente de la obra.
De la misma manera, desligo de toda responsabilidad a EL INSTITUTO por cualquier violación a los derechos de autor y propiedad intelectual que cometa el suscrito frente a terceros.
Nombre y Firma AUTOR (A)
de 200
Estudio de la Cinética de la Transesterificación de Aceites
Vegetales y Grasas Animales con Cromatografía de
Gases-Edición Única
Title Estudio de la Cinética de la Transesterificación de Aceites Vegetales y Grasas Animales con Cromatografía de Gases-Edición Única
Authors Mirna María Guadalupe Saldívar Ramírez Affiliation ITESM
Issue Date 2005-12-01 Item type Tesis
Rights Open Access
Downloaded 19-Jan-2017 12:36:23
INSTITUTO TECNOLÓGICO Y DE ESTUDIOS SUPERIORES DE MONTERREY
CAMPUS MONTERREY
DIVISIÓN DE INGENIERÍA Y ARQUITECTURA
PROGRAMA DE GRADUADOS EN INGENIERÍA
ESTUDIO DE LA CINÉTICA DE LA TRANSESTERIFICACIÓN DE ACEITES
VEGETALES Y GRASAS ANIMALES CON CROMATOGRAFÍA DE GASES
TESIS
PRESENTADA COMO REQUISITO PARCIAL PARA OBTENER EL GRADO DE
MAESTRO EN CIENCIAS
ESPECIALIDAD EN INGENIERÍA ENERGÉTICA
MIRNA MA. GPE. SALDÍVAR RAMÍREZ
INSTITUTO TECNOLÓGICO Y DE ESTUDIOS SUPERIORES DE
MONTERREY
CAMPUS MONTERREY
DIVISIÓN DE INGENIERÍA Y ARQUITECTURA
PROGRAMA DE GRADUADOS EN INGENIERÍA
Los miembros del comité de tesis recomiendan que la presente tesis presentado por la Ing.
Mirna Maria Guadalupe Saldívar Ramírez sea aceptado como requisito parcial para obtener el
grado académico de Maestra en Ciencias con especialidad en Ingeniería Energética.
Comité de Tesis
_______________________________ Dr. Oliver M. Probst Oleszewski
Asesor
_____________________________ __________________________ Dr. Jesús Pablo Morales Pinal M.C. Javier Aranda Alarcón
Sinodal Sinodal
___________________________ Dr. Federico Viramontes Brown
INDICE
Capítulo I Página
1.1 Introducción 1
1.2 Antecedentes 2
1.2.1 Características del Biodiesel 3
1.2.2 Ventajas del Biodiesel 5
1.2.3 Desventajas del Biodiesel 5
1.2.4 Biodiesel en Motores Diesel 5
1.2.5 Consideraciones Ambientales 6
1.2.6 Biodiesel en la Unión Europea 7
1.2.7 Economía del Biodiesel 9
1.3 Objetivo 12
1.4 Justificación 12
Capítulo II
2.1 Caracterización de Aceites Vegetales y Grasas Animales 13
2.1.1 Sebo 15
2.1.2 Propiedades Físicas y Composición del Sebo 16 2.1.3 Control del Proceso de Refinamiento 18
2.1.4 Apariencia Verde del Sebo 19
2.1.5 Apariencia Oscura 19
2.2 Reacción de Transesterificación 19
2.2.1 Elaboración de biodiesel 21
2.2.1.1 Mezclado del alcohol y el catalizador 21
2.2.1.2 Reacción 21
2.2.1.3 Separación 22
2.2.1.4 Remoción del alcohol 22
2.2.1.5 Neutralización de la glicerina 22
2.2.1.6 Lavado del metil éster 22
2.2.1.7 Calidad del producto y registro 23
2.3 Glosario 24
Capítulo III
3.1 Cinética Química 25
3.1.1 Velocidad de Reacción 25
3.1.2 Orden de Reacción y Constante de Velocidad de Reacción
25
3.1.3 Reacciones Reversibles 27
3.2 Cinética del Biodiesel 27
3.2.1 Variables que influyen en la Conversión 33
3.2.1.1 Temperatura de la reacción 33
3.2.1.2 Relación alcohol / aceite 34
3.2.1.3 Intensidad de mezclado 34
3.2.1.4 Pureza de los reactantes 34
Capítulo IV
4.1 Cromatografía de Gases 35
4.1.1 Detector 35
4.1.2 Columna Capilar 37
4.1.2.1 Cambio a una fase estacionaria más polar 37
4.1.2.2 Capacidad de la muestra 37
4.1.2.3 Diámetro interno más pequeño (a un idéntico grosor de
película) 38
4.1.2.4 Incremento del grosor de la película 38 4.1.2.5 Aumentar al doble la longitud de la columna 38 4.1.2.6 Ajuste del Flujo de Gas de Acarreo 38 4.1.2.7 Características de la Columna Capilar DB-5HT 39 4.1.2.8 Características de la Columna Capilar Elite FFAP
40
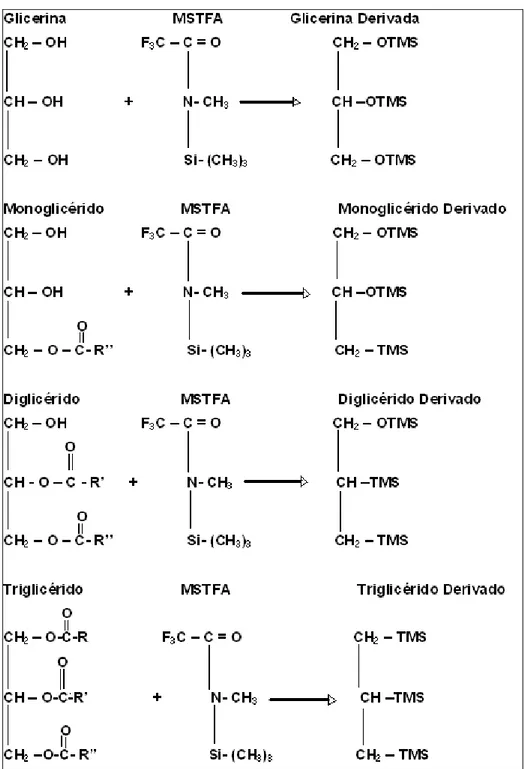
4.1.3 Derivatización 40
4.1.3.1 Siliación 42
4.2 Espectroscopia de Cercano Infrarrojo 46
4.2.1 Teoría de Espectroscopia Infrarroja 47 4.2.2 Modelo de Mecánica Quántica de una molécula 48 4.2.3 Medición de Espectros Infrarrojos 50
4.3 Espectroscopia visible y ultravioleta 51
4.3.1 Interacción de la luz con la sustancia 52 4.3.2 Transiciones electrónicas y cromóforos 54 4.3.3 Espectrómetros Ultravioleta Visible 55 4.3.4 Errores del método de espectroscopia ultravioleta 57
Capítulo V
5.1 Elaboración de Experimentos por cromatografía de gases 58
5.1.1 Descripción de la Reacción de Transesterificación a Nivel
Laboratorio 58
5.1.1.1 Tratamiento de la Materia Prima 58 5.1.1.2 Reacción de Transesterificación a Nivel Laboratorio
59
5.1.2 Análisis de la cinética por Cromatografía de Gases 61
5.1.2.1 Determinación de Glicerina Ligada: Monoglicéridos, Diglicéridos y Triglicéridos, por Cromatografía de Gases 62
5.2 Exploración por Espectroscopia Cercano Infrarrojo 73 5.2.1 Determinación de Metil Esteres y Triglicéridos 73
5.2.2 Determinación cualitativa de Triglicéridos, Diglicéridos y
Monoglicéridos 75
5.3 Exploración de Espectroscopia Ultravioleta 76
Capítulo VI
6.1 Resultados 80
6.1.1 Análisis de un pico extra en el cromatograma de Metil Ésteres
80
6.1.2 Presentación de Resultados Finales 85 6.1.3 Análisis de Trgilcéridos, Diglicéridos y Monoglicéridos en el aceite
de Soya 94
Capítulo VII
7.1 Conclusiones 96
Resumen 98
Bibliografía 99
Apéndice A 102
Apéndice B 108
Anexos 109
AGRADECIMIENTOS
Quisiera agradecer primero que nada a mi familia, a mi papa Jorge Saldivar Cabrales, a mi mamá Maria Gpe. Ramírez Izaguirre y a mi hermano que lo adoro Domingo Saldivar Ramírez por todo su apoyo a lo largo de mi maestría, a ellos principalmente les dedico este trabajo.
Agradezco también a mi asesor el Dr. Oliver Probst por haberme apoyado en este trabajo y en toda mi estancia aquí en monterrey. A mi sinodal y mi amigo M.C. Javier Aranda quien a través de su enseñanza académica logré finalizar mi tesis.
A todos mis compañeros de la maestría Alfredo Morales, Fabiola Gutiérrez, Aníbal Morones, Brenda, Adrian, Jaime Martínez y Rocío, gracias a todos y fue un placer conocerlos.
A mis amigos con quien conviví aquí en Monterrey, Stephania Poulis, Emma de la Garza, Yolanda Piña, Jesús Vázquez, Peter Pfister, Carlos Mariscal, Rodrigo Ponce, y Raúl Hernández, gracias por esos momentos tan agradables.
A mis amigas de Cd. Obregón sobre todo Paulina Moreno Ochoa y Francis Lugo, gracias por brindarme su amistad a lo largo de mi vida y darme siempre su apoyo en mi metas y mis logros.
CAPÍTULO I
El mundo enfrenta dos tipos de crisis: una es la disminución de combustibles fósiles y
otra es la degradación del ambiente [1]. La indiscriminada extracción y consumo de
combustibles fósiles ha motivado la reducción de las reservas petroleras [1].
Combustibles alternativos, conservación y manejo de la energía, uso eficiente de la
energía y protección al ambiente se ha vuelto importante en los últimos años. El
incremento en los costos de importación ha creado la necesidad de buscar
combustibles líquidos como alternativa hacia el diesel, el cual es utilizado en grandes
cantidades en transportación, agricultura, industria, comercio y sectores domésticos.
El biodiesel obtenido de aceites vegetales ha sido considerado como una
prometedora opción [1].
El biodiesel puede ser elaborado a partir de aceites vegetales o grasas animales
nuevas o usadas. No es toxico, es biodegradable, y es una fuente renovable. El
biodiesel se ha vuelto atractivo debido a sus beneficios ambientales.
Debido a los recientes incrementos de los precios del petróleo y su incertidumbre
concerniente a su disponibilidad, existe un nuevo interés en los combustibles de
aceites vegetales para los motores diesel. En Europa el más importante
biocombustible es el biodiesel y representa el 82% de la producción de
biocombustibles [2].
1.1 INTRODUCCIÓN
La reacción de transesterificación ocurre cuando un éster de un ácido graso
reacciona con ácidos grasos, alcoholes u otros ésteres de ácidos grasos para
producir un éster de distinta composición al original. Para la producción de biodiesel
se necesita un aceite vegetal, alcohol y un catalizador.
Los aceites vegetales puedes ser de cualquier tipo ya sea maíz, soya, algodón,
canola, lino, palma y olivo los cuales son aceites refinados y muy limpios. Sin
usados de cocina o grasas animales. Es importante mencionar que si se utilizan
aceites con altos contenidos en ácidos grasos libres deben ser sometidos a un
proceso de esterificación ya que durante la reacción los mismos pueden establecer
una afinidad hacia el catalizador dándonos formación de jabones lo cual genera un
descenso en cuanto a la calidad del producto.
En cuanto al alcohol se puede utilizar metanol, etanol y propanol, no obstante se
utiliza metanol debido a su facilidad para reaccionar aunque tenga propiedades
toxicas. El catalizador puede ser ácido o básico, en este proceso se utiliza el
catalizador básico hidróxido de sodio. La alcalinidad del catalizador es importante ya
que si se utilizara un catalizador ácido, en altas concentraciones, dentro del proceso
se tienen que realizar cambios muy drásticos en cuanto al uso de la infraestructura
por la propiedad de corrosión y deterioro que tiene este catalizador. Además de que
utilizando un catalizador ácido la reacción es más lenta que utilizando un catalizador
básico.
La reacción de biodiesel a lo largo del tiempo se da por pasos intermedios, donde
intervienen los compuestos llamados triglicéridos, diglicéridos, monoglicéridos,
metanol, glicerina y metil ésteres (biodiesel), los cuales pueden ser medidos y de
esta manera obtener la cinética de la reacción bajo condiciones especificadas como
son principalmente temperatura, presión, concentración de reactivos y concentración
de catalizador. La medición de la cinética es importante debido a que podemos
observar como varía la calidad del producto al mover las distintas variables que
contiene.
Finalmente las técnicas para medición de la cinética se pueden realizar por medio de
cromatografía de gases (GC), cromatografía de líquidos de alta precisión y por
espectroscopia de cercano infrarrojo. Cabe señalar que la técnica por GC está
1.2 ANTECEDENTES
La literatura muestra un número de estudios en transesterificación con catalizadores
básicos y ácidos, los cuales han sido llevados a cabo. Freedman y Pryde [3], y Kusy
[4] alcanzaron más del 95% de ésteres en una hora utilizando catalizadores alcalinos.
Freedman encontró que para que se una mayor conversión de triglicéridos a metil
ésteres, los requisitos son valores de porcentaje de contenido de ácidos grasos libres
menores de 1%, en aceites libres de alcohol y aceites vegetales. Nye y Southwell [5],
estudiaron el efecto de la catálisis en metil y etil esteres en aceites de semilla a
temperatura ambiente. Boocock [6] desarrollo un nuevo método, el cual produce
metil esteres mas rápido. Schwab [7] y Liu [8] compararon la catálisis ácido y base.
Nye [5] comparó la catálisis base y ácido para producir metil esteres de aceites
freídos. Kusidiana y Saka [9] estudiaron la cinética de transesterificación de biodiesel
con aceites de semilla usando metanol supercrítico [1].
1.2.1 Características del Biodiesel
El biodiesel es una fuente natural y renovable. Es un combustible limpio que
remplaza al diesel convencional, el cual proviene de fuentes renovables y naturales
como aceites vegetales y grasas animales nuevas o usadas [2].
El biodiesel es caracterizado determinando su densidad, viscosidad, High Heating
Value (poder calorífico), índice de cetano, punto nube, punto de burbuja,
características de destilación, y punto de ignición y combustión de acuerdo a las
normas ISO (Internacional Organization for Standardization). Los combustibles son
caracterizados por evaluación de los parámetros requeridos en ASAE EP X552. Las
pruebas son densidad especifica, viscosidad, punto nube, punto de burbuja, punto
de ignición, poder calorífico, valor ácido, composición de ácidos grasos, punto de
ebullición, determinación de agua y sedimento, residuos de carbón, cenizas, azufre,
numero de cetano, corrosión de cobre, determinación de agua por Karl Fischer,
numero de yodo, y análisis elementales. Metil y etil ésteres preparados de un aceite
obstante metil, etil, 2-propil y butil esteres derivados de un aceite vegetal en particular
tiene valores similares en cuanto al grosor del poder calorífico. Sin embargo sus
densidades, las cuales son de 2 a 7% mas altas que en los combustibles diesel,
estadísticamente disminuyen en el orden de metil similar al 2-propil > etil > butil
esteres. El poder calorífico para combustibles de biodiesel en base masa es de 9 a
13% menor que el diesel numero 2 (D2). Las viscosidades del biodiesel son
aproximadamente el doble que las de D2. El punto nube y de burbuja del D2 es
significativamente menor que el biodiesel. El biodiesel produce una levemente baja
potencia y torque y un mayor consumo de combustible que el D2. Las propiedades
físicas del biodiesel y el diesel numero 2 son dadas en la tabla 1.2.1. Algunas
propiedades de varios combustibles son dadas en la tabla 1.2.2 [2].
Características físicas de Biodiesel y Diesel No. 2
Propiedades Biodiesel Diesel No. 2
Gravedad Específica (kg/L) 0.87-0.89 0.84-0.86
Número de Cetano 46-70 47-55
Punto Nube (ºK) 262-289 256-265
Punto de Burbuja (ºK) 258-286 237-243
Punto de Ignición (ºK) 408-423 325-350
Azufre (%peso) 0-0.0024 0.04-0.01
Cenizas (%peso) 0.002-0.01 0.06-0.01
Número de Yodo 60-135 -
Viscosidad Cinemática, 313 ºK 3.7-5.8 1.9-3.8
Poder Calorífico, MJ/kg 39.3-39.8 45.3-46.7
Tabla 1.2.1. Características físicas del biodiesel y el diesel número 2 [2].
Algunas propiedades de varios combustibles
Combustible Peso del
combustible (Lbs/gal) Calor de Combustión (BTU/gal) Número de Cetano Viscosidad (centistokes)
No. 2 Diesel 7.05 140,000 48 3.0
100% Biodiesel (B100) Metil o Etil
Ester
7.30 130,000 55 5.7
B20 mezcla (20/80) 7.10 138,000 50 3.3
Aceite vegetal de semilla
7.50 130,000 35-45 40-50
1.2.2 Ventajas del Biodiesel
Algunas de las ventajas técnicas del biodiesel son:
1. Prolonga la vida del motor y reduce la necesidad de mantenimiento
2. Es mas seguro de manejar siendo menos toxico, mas biodegradable y tiene un
punto de ignición mas alto.
3. Reduce la emisión de contaminantes.
El biodiesel es una energía alternativa más limpia y 100% natural que los
combustibles derivados del petróleo. Además de las ventajas del biodiesel se incluye
lo siguiente: es seguro de usar en todos los motores diesel convencionales, ofrece
similar rendimiento y durabilidad del motor que el diesel, es no inflamable ni toxico,
reduce emisiones, el humo es visible y sin olor. El biodiesel es mejor que el diesel ya
que no contiene azufre y aromáticos, también es mejor en su punto de ignición y
biodegradabilidad.
1.2.3 Desventajas del Biodiesel
Las desventajas técnicas del biodiesel y las mezclas de biodiesel, incluyen
problemas en climas fríos, menor densidad de energía y degradación del combustible
bajo largos periodos de almacenamiento. Un problema adicional es encontrado
cuando las mezclas son introducidas por primera vez en equipos que a lo largo de su
historia han utilizado hidrocarburos. Los hidrocarburos por lo general forman una
capa de depósitos dentro de los tanques, mangueras, etc. Las mezclas de biodiesel
aflojan estos depósitos, causando un bloqueo en los filtros. Sin embargo, este es un
problema menor remediado fácilmente con el adecuado mantenimiento de los filtros
durante el periodo de introducción de las mezclas de biodiesel [2].
1.2.4 Biodiesel en Motores Diesel
Los convencionales motores de combustión interna pueden ser operados con diesel
sin muchas modificaciones. En comparación al diesel, el alto número de cetano del
biodiesel da como resultado un retraso de ignición más corto y una duración de
carbón en los inyectores. Está reportado que si un motor es operado con biodiesel
por largo tiempo, el tiempo de inyección puede requerir de un reajuste para obtener
una mejor eficiencia térmica [1]. Varias combinaciones de biodiesel con diesel han
sido probadas, pero el B-20 ha sido encontrado como la más apropiada mezcla. Es
notorio que todas las combinaciones dan una alta eficiencia térmica en comparación
al diesel y por lo tanto un mejoramiento del funcionamiento. El efecto de la
concentración de la mezcla del éster en el pico de la eficiencia térmica esta dada en
la figura 1.2.3.
La figura muestra que la combinación del éster con una concentración del 20% de
biodiesel da un máximo mejoramiento en la máxima eficiencia térmica, un mínimo de
interrupción en consumo de energía específica y un mínimo de opacidad en el humo.
Por lo tanto, B-20 es recomendado como la óptima combinación para una larga
operación del motor [1].
Figura 1.2.3. Mejoramiento de la Eficiencia del Pico Térmico contra la Concentración del Biodiesel en las mezclas [1].
1.2.5 Consideraciones Ambientales
Otros estudios han revelado que las combinaciones de biodiesel permiten una
reducción de la opacidad en el humo y en la emisión de partículas, hidrocarburos no
quemados, dióxido de carbono y monóxido de carbono pero causa un leve
mediante el uso de biodiesel. Como se puede observar en la figura se representan
los gases más nocivos que se emiten como son monóxido de carbono,
hidrocarburos, óxidos de nitrógeno y partículas sólidas. En ella se puede analizar el
cambio en cuanto al porcentaje de su emisión contra el tipo de mezcla
biodiesel-diesel que se requiera emplear. En la escala cero se representan las emisiones por
parte de diesel puro y conforme avanza la mezcla contiene más biodiesel. La figura
1.2.4 describe perfectamente como se tendría una disminución de estos gases al
utilizar el biodiesel como combustible.
Figura 1.2.4. Impacto promedio de emisiones de biodiesel por motores de vehículos [10].
1.2.6 Biodiesel en la Unión Europea
La producción total de biodiesel en la Unión Europea fue de alrededor de 1.504*106
toneladas en el 2003. La figura 1.2.5 muestra la capacidad de biodiesel en el mundo
entre 1991 y 2003. La producción de biodiesel para el 2003 en la Unión Europea [11]
productor seguido de Francia e Italia. Todos estos países incrementaron su
producción en el 2003, particularmente Alemania e Italia donde el impacto de la
legislación fue favorable para el biodiesel ayudando a aumentar su producción.
Según la Comisión Europea estimo, que Alemania produjo alrededor de 715,000
toneladas en el 2003, Francia produjo 357,000 toneladas e Italia produjo 273,000
toneladas.
La producción del biodiesel utiliza alrededor de 1.4 millones de hectáreas de tierra
arable en la Unión Europea. El más importante productor de biodiesel es Alemania
con 40% de la producción. Existen aproximadamente 40 plantas en la Unión
Europea, sin embargo el numero de plantas y la capacidad esta creciendo
rápidamente. Las plantas están localizadas principalmente en Alemania, Italia,
Austria y la Republica Checa, Francia y Suecia [2].
Figura 1.2.5. Capacidad mundial del biodiesel, 1991-2003 [2].
EU-25 Producción de Biodiesel (toneladas)
País 2002 2003 2004a
Alemania 450,000 715,000 1,088,000
Francia 366,000 357,000 502,000
Dinamarca 10,000 41,000 44,000
Austria 25,000 32,000 100,000
Reino Unido 3,000 9,000 15,000
España - 6,000 70,000
Suecia 1,000 1,000 8,000
Polonia - - 1,200
Hungría - - 2,000
Total (EU-25) 1,133,800 1,504,000 2,296,200
e
stimados
Tabla 1.2.3. Producción de biodiesel (toneladas) en la Unión Europea [2].
El uso de biodiesel puro predomina en Alemania. Fue tan solo hasta el 2004 que
también comenzó la venta de biodiesel mezclado con diesel. La capacidad de
producción por año fue de 90,000 a 1, 060,000 toneladas en el 2004 y las ventas
alcanzaron 1, 000,000 de toneladas lo que hace que Alemania sea el mayo productor
en Europa. En Enero del 2004, había 1800 estaciones para biodiesel. La capacidad
de producción aumentó (entre 2000 y 150,000 toneladas por año). En Francia, la
producción de biodiesel comenzó en 1992. En el 2004 la capacidad de producción
era de 520,000 toneladas, lo que hace a Francia el segundo productor mayor de
biodiesel en Europa. En contraste con Alemania, el biodiesel Francés es
exclusivamente vendido para mezclas con diesel las cuales tienen valores por
encima del 5% o del 30% de biodiesel en diesel.
La planta mas grande de Europa será terminada a principios del 2005 en Teesside,
Inglaterra y una segunda planta un año después. Esta planta tendrá una capacidad
para producir 250,000 toneladas de biodiesel en el año, usa aceites vegetales como
aceite de canola, soya, y de palma como materia prima [2].
1.2.7 Economía del Biodiesel
El costo del biodiesel es más alto que el combustible diesel. Actualmente, existen
siete productores de biodiesel en Estados Unidos. El biodiesel puro es vendido por
$1.50 a $2.00 dólares por galón antes de impuestos. Los impuestos por combustibles
Una mezcla de 20% de biodiesel y 80% de diesel costara alrededor de 15-20
centavos de dólares más por galón en comparación al diesel. El costo de producción
de biodiesel es por lo general aceptado desde el punto de vista industrial en Europa
en el cual el biodiesel no es rentable sin un soporte fiscal. La tabla 1.2.4 muestra un
escenario de costo y retorno para una planta de 60,000 toneladas de biodiesel. Un
resumen de factibilidad de 12 economías muestra que el costo del proyecto para el
biodiesel de aceites de semilla y grasas animales tiene un rango de $0.30 a $0.69
dólares por litro, incluyendo los créditos por glicerina y asumiendo una reducción de
costos de capital invertido teniendo la facilidad de la esterificación incluyendo el
grano o la grasa.
El costo de las proyecciones desiguales del biodiesel de aceite vegetal y de aceite
usado son respectivamente $0.54 a 0.62 dólares por litro y $0.34 a 0.42 dólares por
litro. Con un preimpuesto de diesel de $0.18 dólares por litro y $0.20 a 0.24 dólares
por litro en países Europeos, por lo tanto el biodiesel no es económicamente factible
y mas desarrollo de investigación y tecnología será necesitada [2].
Escenario de Costo y Retorno para 60,000 toneladas en una planta de biodiesel
Millones de Eurosa
Retorno 60,000 toneladas biodiesel @ Є 617/ton 37.03
7500 toneladas 80% glicerina @ Є 500/ton
3.75
Indeterminada cantidad de ácidos grasos libres vendidos como alimento
para ganado
40.78
Retorno Total
Gastos 60,900 toneladas de aceite vegetal @ Є
520/toneladas
31.67
6000 toneladas de metanol @ Є 265/toneladas
1.59
Indeterminada cantidad de NaOH incluida en costos variables
Є 30 millones de inversión con amortización de 10 años con un interés
de 10%
Costos variables igual costos fijos
4.70
Costo Total 42.66
a 1 Euro = 1.17 dólares americanos
Tabla 1.2.4. Escenario costo retorno de una planta biodiesel con capacidad de 60,000 toneladas [2].
Sin embargo, los costos de biodiesel se ven favorecidos por los altos precios de
combustibles fósiles. Los altos precios es un tema que mantiene en vilo a todos los
consumidores del crudo. Según expertos la curva de producción global del crudo,
esta por tocar el punto de descenso. Un crudo más caro aceleraría la explotación de
uno de más baja calidad, trayendo consigo un efecto nocivo para el medio ambiente.
El petróleo es un producto que tiende a agotarse. La escasez del petróleo no solo
traería consigo altos precios sino que encarecería también los fertilizantes que tienen
como base el crudo. Aumentarían los cortes eléctricos (apagones). Todo esto
provocaría un efecto negativo tanto para la industria como para la agricultura. La
primera tendría que acomodar en lo posible su producción a la carga de
disponibilidad eléctrica. En cuanto a la agricultura, los consumidores de fertilizantes
derivados del crudo, se verán forzados a reducir su aplicación debido a los altos
precios.
Algunos factores que han influido en los altos precios del petróleo son la alta
demanda en el ámbito internacional sobre todo en Asia, y problemas con el
inventario comercial del petróleo en los países desarrollados, en especial Estados
Unidos. También hay que considerar que los yacimientos localizados tanto en el mar
del Norte como en Alaska están envejecidos, lo que provoca que hayan perdido
productividad. Por otro lado las perspectivas africanas exceptuando Argelia, Libia,
Nigeria o Angola, no han sido evaluadas con la seriedad ni la profundidad que se
requiere por lo que el panorama se torna más sombrío. Todo esto repercute en el
1.3 OBJETIVO
Los objetivos principales de este trabajo son los siguientes:
1. Estudio de la cinética de la reacción de transesterificación por medio de
Cromatografía de Gases con distintas materias primas.
2. Exploración de métodos analíticos alternativos como Espectroscopia Infrarroja y
Ultravioleta-visible
1.4 JUSTIFICACION
La elaboración de metil ésteres llevada a cabo por la transesterificación de ácidos
grasos con alcohol requiere de una serie de reacciones las cuales son reversibles. Es
importante conocer el comportamiento de la reacción con sus diferentes variables
debido a que por medio de ella las producciones industriales pueden tomar la
decisión correcta en cuanto a la selección de materia prima y las condiciones que
deben de tener dentro del proceso de elaboración de biodiesel.
El estudio de la reacción puede ser realizado mediante distintas técnicas como
cromatografía de gases (GC) y cromatografía de líquidos de alta precisión (HPLC).
La cromatografía de gases es una técnica muy precisa, sin embargo esta técnica
requiere de una exhausta preparación de estándares y muestras las cuales aparte
toman un determinado tiempo de estudio.
Por otro lado, la exploración para el desarrollo de una técnica que permita la
observación del comportamiento de la reacción por medio de espectroscopia de
cercano infrarrojo seria benéfico ya que no requiere de muchos reactivos para
analizar la muestra, no se realiza ninguna derivatización de la misma y el tiempo de
estudio es muy rápido comparado con la técnica de cromatografía de gases. Hoy en
día para todas las empresas es importante el ahorro de tiempo que toman los
CAPÍTULO II
2.1 CARACTERIZACIÓN DE ACEITES VEGETALES Y GRASAS ANIMALES
Químicamente los aceites y las grasas son una combinación de glicerina y ácidos
grasos. La molécula más abundante en los aceites y las grasas se conoce como
triglicérido. Físicamente, aceites y grasas son diferentes; a temperatura ambiente las
grasas son sólidas y los aceites son líquidos. Sus diferentes propiedades son
definidas por su composición de ácidos grasos y la extensión de su saturación o
insaturación. Estos aspectos son identificados por la longitud de las cadenas de
carbono y el número y la posición de los dobles enlaces para ácidos grasos
individuales y su posición en la glicerina. Generalmente, grasas sólidas contienen
predominantemente ácidos grasos saturados, y los aceites líquidos son identificados
por su alto contenido en ésteres de ácidos grasos insaturados.
La longitud de las cadenas de carbono en los aceites y grasas comestibles varía
entre 4 y 24 átomos de carbono, con hasta tres dobles enlaces. La tabla 2.1.1
muestra el nombre común de ácido graso y el grado de saturación e insaturación de
los ácidos grasos más comunes en aceites y grasas comestibles.
Tabla 2.1.1 Nombres comunes de ácidos grasos principales de aceites y grasas comestibles [13].
Ácidos Grasos (dobles enlaces) Longitud
de la Cadena
Saturado (ninguno)
Mono (uno) Di (dos) Tri (tres) Tetra
(cuatro)
C-4 Butírico
C-6 Caproico
C-8 Caprílico
C-10 Cáprico
C-12 Láurico
C-14 Mirístico Miristoleico
C-15 Pentadecanoico
C-16 Palmítico Palmitoleico
C-17 Margárico Margaroleico
C-18 Esteárico Oleico Linoleico Linolénico
C-20 Araquídico Gadoleico Eicosadie noico
Araquidó nico
C-24 Lignocérico
Los factores que afectan la composición de ácidos grasos en aceites vegetales son
las condiciones climáticas, tipo de suelo, estación en que crece, madurez de la
planta, salud de la planta, localización microbiológica de la semilla con la flor y la
variación genética de la planta. La composición de grasas animales y aceites varía
de acuerdo a la especie animal, dieta, salud, localización de la grasa en la carcasa y
madurez [13].
Los análisis resumidos en la tabla 2.1.2, representan una recopilación de resultados
reales obtenidos en diversos laboratorios industriales. Las muestras incluidas en este
resumen son de tipo rutinario y representan a grasas y aceites comprados y vendidos
en los mercados comerciales [13].
Tabla 2.1.2. Análisis típicos de algunas grasas y aceites naturalesa y de otros productos grasos comerciales [13].
(%) Ácido Graso Grasas Animales y
Aceites Vegetales Oleico Linoleico Linolénico Araquidónico Saturados
Manteca de vacab 31.5 1.3 0.53 0.3 66
Sebo de buey 35-45 0.7-3 0.2-0.6 0.6-0.2 48-58 Manteca de cerdo 47-58 6.7-13 0.2-1.4 0.17-0.44 29-37
Manteca de cacao 35-37 3.3-3.4 0.2 .. 57-60
Aceite de coco 6-8 0.9-2 0.1 .. 86-91
Aceite de maíz 25-37 50-55 0.1-0.6 .. 9-15
Aceite de algodón 17-37 44-55 0-0.6 .. 17-31
Aceite de Oliva 67-83 7.6-12.4 0.6-0.7 .. 9-22
Aceite de cacahuate 30-58 21-37 0-0.5 .. 16-26
Aceite de soja 16-47 39-53 4-9 .. 5-24
Aceite de lino 31-36 8-21 42-50 0 0-6
Aceite de nabina 59-62 15 9-10 0.2 14-16
Aceite de palma 34-56 10-11 0.1-0.2 0 34-50
Aceite de sésamo 47 40 0 0 12
Aceite de cártamo 16-23 69-76 0-0.3 0 5-7
Manteca para repostería casera (grasas
vegetales)
53-75 3-14 0-0.5 0 16-31
Mantecas comerciales
(grasas vegetales) 45-76 3-13 0-0.7 0 15-40
Mantecas comerciales (grasas vegetales y
cárnicas)
40-65 3.5-13 0-0.8 0-0.5 28-40
Mantecas líquidas para
repostería 18-45 30-47 0-1 0 17-36
Aceites de margarina 42-79 2.3-18.1 0-0.4 0 12-24 Aceites de mesa de
algodón 17-36 42-55 0-0.7 0 18-30
a
) Datos recopilados por el Technical Committee of the Institute of Shortening and Edible Fats, Inc.
b
) Únicamente una sola muestra.
2.1.1 Sebo
El sebo de es la grasa dura de los rumiantes. En Estados Unidos la mayoría del sebo
es obtenida del ganado de res y una cantidad menor de las ovejas. Todas las grasas
de carne son subproductos de la industria productora de carne, lo que quiere decir
que su disponibilidad depende de la producción de carne, más que de la necesidad
de las grasas como materia prima.
El uso de grasas cárnicas para productos comestibles ha disminuido por
recomendaciones médicas en varias dietas y modificaciones alimentarias, incluyendo
las grasas saturadas y el colesterol.
Las grasas cárnicas están esencialmente listas para usarse así como están, excepto
por una posible desodorización recibido de un proceso de calentamiento después de
un procedimiento de clarificación. Las dos principales impurezas en grasas cárnicas
son las proteínas remanentes del proceso de calentamiento y los ácidos grasos
libres. Es necesario remover los materiales proteínicos antes de la desodorización.
Con la destilación de vapor las proteínas se vuelven negras y requieren de un
blanqueamiento para ser removidas. Dos procesos han sido empleados para
remover el material proteínico de las grasas cárnicas.
Filtración: Tierras minerales y/o blanqueamiento con tierra son añadidos a la grasa
Lavado: Grasas cárnicas pueden ser lavadas con 10% del agua para remover las
proteínas, en vez de una filtración. El lavado no es ampliamente empleado como la
filtración para clarificar debido a que requiere una capacidad de centrifugación extra
además que la mayoría de las grasas cárnicas requieren un blanqueamiento
inclusive después del lavado.
Por otro lado, para eliminar ácidos grasos libres el refinado cáustico o neutralización
del sebo era utilizado en aceite freído como una opción para las papas francesas por
muchos restaurantes de comida rápida por varios años. Para producir este producto,
la buena calidad del sebo fresco era cáusticamente refinada, con un doble lavado y
un secado a vacío. El sebo neutralizado no era blanqueado, tenía un límite de 0.05%
de ácidos grasos libres y un característico sabor a sebo fresco. Blanqueamiento y
desodorización de estos productos era utilizado para mantener el sabor fresco del
sebo. El uso de este producto ha sido eliminado por cuestiones del colesterol [13].
2.1.2 Propiedades Físicas y Composición del Sebo
El sebo contiene muy pocos pigmentos rojos y amarillos pero puede tener un alto
contenido en clorofila. La clorofila es fácilmente removida del sebo fresco con el
blanqueamiento de tierras minerales para lograr mantener la apariencia blanca del
agua. Las características físicas y composición típicas del sebo son las de la tabla
2.1.2.
Tabla 2.1.2 Propiedades físicas y composición de sebo [13].
Típicas Rango
Gravedad Específica a 99/15.5 °C 0.86 – 0.87
Número de Refracción (Zeiss) a 40 °C 46 – 49
Valor del Yodo 38 – 48
Valor de Saponificación 193 – 202
Materia Insaponificable, % 0.8 máx.
Punto de solidificación, °C 40 – 46
Índice de solidificación, %
33.3 °C 13.8 11.5 – 16
37.8 °C 8.6 7 – 10.5
40 °C 6.1 4.5 – 8
Punto de caída, °C 42.6 41 - 44
Punto fusión capilar, °C 44.5
Composición de Ácidos Grasos, %
Láurico 0.1 Traza – 0.2
Mirístico 3.2 2 – 8
Miristoleico 0.9 0.4 – 0.6
Pentadecanoico 0.5
Palmítico 24.3 24 – 37
Palmitoleico 3.7 1 – 2.7
Margárico 1.5
Margaroleico 0.8
Esteárico 18.6 14 – 29
Oleico 42.6 40 – 50
Linoleico 2.6 1 – 5
Linolénico 0.7
Arachídico 0.2 Traza – 1.2
Gadoleico 0.3
Composición de Triglicérido, % mol
Trisaturado (GS3) 15 – 28
Disaturado (GS2U) 46 – 52
Monosaturado (GSU2) 0 – 64
Tri-insaturado (GU3) 0 – 2
El sebo contiene altos niveles de ésteres de ácidos grasos saturados y es sólido a
temperatura ambiente. Los sólidos triglicéridos en el sebo le dan plasticidad, lo cual
es ideal para retener el calor en sistemas de calentamiento. En muchos casos los
aceites vegetales son hidrogenados para lograr el mismo grado de saturación por la
funcionalidad que naturalmente contiene el sebo.
El arreglo geométrico de los triglicéridos del sebo es altamente asimétrico, el cual se
cristaliza en la forma beta-prima, un tipo de estructura molecular para las proteínas.
La estructura cristalina del sebo beta-prima provee una buena matriz para atrapar y
retener pequeñas burbujas de aire. El contenido y consistencia de los sólidos da una
plasticidad ideal para una rápida incorporación a las mezclas. Por lo tanto, la
funcionalidad del sebo se centra alrededor de aplicaciones donde se requiere lubricar
del sebo pueden ser utilizadas ventajosamente como mezclas con margarina,
hojaldre, y otras aplicaciones de panecillos. Estas mezclas intentan de proveer un
perfil de índices de grasas sólidas con el fin de dar propiedades de panecillos y
expansión deseada. El sebo da una consistencia plástica necesaria para alcanzar
una mejoría ante un amplio rango de temperaturas requerido.
El sebo generalmente tiene un sabor y olor desagradable para la mayoría de los
productos y desarrolla un revertido sabor después de la desodorización. Contiene
bajos niveles de ácidos grasos linolénico y linoleico que pueden contribuir a una
reversión del sabor a menos que estén protegidos por un antioxidante. Los
antioxidantes que son efectivos para la manteca también aplican para el sebo como
son BHA (Butylated hydroxyanisole) y BHT (Butylated hydroxytoluene) o TBHQ
(Tertiary Butylhydroquinone) con un metálico combinado como el ácido cítrico [13].
2.1.3 Control del Proceso de Refinamiento
Tradicionalmente el método utilizado para refinar grasas cárnicas ha sido el que
ahora se identifica como refinamiento físico. Las impurezas en la grasa cárnica
consisten en material proteínico remanente del proceso de calentamiento y de ácidos
grasos libres. Este material debe ser removido por filtración utilizando bajos niveles
de blanqueamiento con tierras minerales o alternativamente por un lavado seguido
de un blanqueamiento. Después de la clarificación, la grasa cárnica limpia y seca,
puede ser procesada por una desodorización o hidrogenación y desodorización. Las
especificaciones de la calidad típica estándar para un control del proceso físico de
refinación están representadas en la tabla 2.1.3 [13].
Tabla 2.1.3. Limites Típicos del Control de Refinamiento Físico en el Sebo [13].
Estándares de Calidad Por
Filtrar
Durante la Filtración
Ya Filtrado
Colorímetro Lovibond del Color Rojo, máx.
1 1 1
Ácidos Grasos Libres, % máx. 0.4 0.4 0.4
incrementando su calentamiento
2.1.4 Apariencia Verde del Sebo
El sebo puede tener una apariencia verde debido al alto contenido de clorofila
resultado del forraje o pasturas. Como el sebo tiene bajas coloraciones rojas y
amarillas, el color verde es acentuado y debería ser solamente aparente en un
recipiente. La clorofila del sebo puede ser removida con un blanqueo con tierras
minerales activadas con ácido [13].
2.1.5 Apariencia Oscura
Material Proteínico: Para eliminar este problema es requerido un efectivo filtrado o un
lavado. Inmediatamente el lote requerirá de una desodorización para limpiar el
material proteínico y facilitar su eliminación en el blanqueamiento [13].
2.2 REACCIÓN DE TRANSESTERIFICACIÓN
El uso de aceites vegetales o grasas animales como fuente de energía ha sido
considerado desde hace mucho tiempo, quemándolos directamente en presencia de
aire y a condiciones normales de presión y siendo sus gases de combustión
disipados en la atmósfera. Sin embargo, la utilización del aceite en forma natural en
máquinas de diesel puede causarles numerosos problemas, puesto que la alta
viscosidad, la baja volatilidad, así como las pobres propiedades de los aceites
vegetales para fluir a temperaturas relativamente bajas afectan severamente los
depósitos de la máquina, los inyectores y los anillos de los pistones. Dichos efectos
pueden reducirse o eliminarse con la transesterificación del aceite vegetal, formando
un metil éster. Este proceso disminuye la viscosidad del combustible pero mantiene
el número de cetano y el poder calorífico; además elimina la glicerina, reduce el
punto de ebullición del aceite, así como su punto de ignición. Los monoésteres
producidos por la transesterificación de aceites vegetales, utilizando para ello un
alcohol, son conocidos como biodiesel, el cual posee características similares al
La transesterificación se refiere a una clase de reacciones en la que un éster de un
ácido graso puede reaccionar con ácidos grasos, alcoholes u otros ésteres de ácidos
grasos para producir un éster de diferente composición al original. En este caso, nos
referimos al proceso químico que convierte los ésteres de glicerol que constituyen los
aceites vegetales en otro éster, tales como los alquil monoésteres que forman el
biodiesel, lo que ocurre por la reacción de un aceite vegetal con alcohol y
regularmente en presencia de un catalizador ácido o alcalino, siendo los más
comunes los ácidos sulfúrico, sulfónico y clorhídrico, así como hidróxido de sodio, de
potasio y metóxido de sodio. Como se usa un alcohol en la reacción, ésta se
denomina más específicamente alcohólisis. Los alcoholes que pueden ser utilizados
para la transesterificación son el metanol, etanol o el butanol y dependiendo de cuál
se esté utilizando, se le dará el nombre a los ésteres, ya sea metil ésteres, etil
ésteres o butil ésteres, respectivamente [14].
La reacción del la transesterificación se representa en la figura 2.2.1 con la ecuación
general:
Figura 2.2.1. Ecuación global de la reacción de biodiesel y metanol [14].
Aunque la ecuación refleja la ecuación total, la reacción usualmente consiste de una
serie de pasos consecutivos reversibles. La secuencia de pasos es triglicérido a
diglicérido a monoglicérido con la producción de un mol de metil éster en cada etapa
Diglicérido + CH3OH ↔ Monoglicérido + R-COOCH3
Monoglicérido + CH3OH ↔ Glicerol + R-COOCH3
2.2.1 Elaboración de biodiesel
En la figura 2.2.2 se muestra un esquema que representa el proceso básico de
producción de biodiesel, por tanto, se hará una breve descripción de manera general
el proceso de producción de biodiesel vía catálisis básica.
2.2.1.1 Mezclado del alcohol y el catalizador. El catalizador es típicamente
hidróxido de sodio o hidróxido de potasio. Es disuelto en alcohol, formando metóxido
de sodio, utilizando un agitador o mezclador previo al inicio de la reacción, ya que si
se añade catalizador de manera directa al aceite no se disolverá adecuadamente.
2.2.1.2 Reacción. La mezcla de alcohol-catalizador se alimenta a un reactor y se
adiciona la grasa o el aceite. De aquí en adelante el sistema puede ser
completamente cerrado a la atmósfera para prevenir pérdidas de alcohol. La mezcla
reaccionante se conserva justo abajo del punto de ebullición del alcohol (alrededor de
65ºC) para acelerar la reacción. El tiempo recomendado de reacción varía de una a
ocho horas si se utilizan sistemas a temperatura ambiente. Se utiliza normalmente
alcohol en exceso para asegurar una conversión total de la grasa o el aceite a sus
ésteres. Debe tenerse especial cuidado en monitorear la cantidad de agua y ácidos
libres de la grasa o el aceite, ya que niveles muy altos pueden causar problemas
formando jabones y en la separación de la glicerina. Debido a que el alto contenido
de ácidos grasos permite la formación de jabones debido a su gran afinidad al
catalizador álcali. En cuanto al agua roba catalizador que no permite una buena
reacción. Además los jabones resultantes incrementan la viscosidad que forman gel
2.2.1.3 Separación. Una vez que la reacción se completa, se tienen dos productos
principales: glicerina y biodiesel. Cada uno tiene una cantidad sustancial del alcohol
en exceso que se utilizó en la reacción. Algunas veces la mezcla obtenida se
neutraliza en esta etapa, si es necesario. Usualmente, debido a la diferencia de
densidad la glicerina tiende a decantarse en cuanto se detiene la agitación. La
separación se lleva a cabo en la parte inferior del reactor. En algunos casos, se usa
una centrífuga para separar los dos materiales más rápido. La separación del metil
éster por centrifugación parece ser a primera vista interesante porque se remueve la
mayor parte de los subproductos y la glicerina, pero el catalizador residual no se
elimina con este método. Una tercera opción puede ser separar el éster por
destilación al vacío, teniendo un fraccionamiento del éster como una ventaja, que es
la separación de los ésteres pesados y los más ligeros. En este proceso se tendrá
acarreo de una pequeña cantidad de glicerina, la cual puede ser eliminada por
decantación.
2.2.1.4 Remoción del alcohol. Una vez que las fases de la glicerina y el metil éster
han sido separadas, el exceso de alcohol puede removerse de cada fase con un
proceso de evaporación flash o por destilación. Posteriormente este alcohol será
reutilizado. Es conveniente asegurarse que no se acumule agua en la corriente del
alcohol recuperado.
2.2.1.5 Neutralización de la glicerina. La glicerina contiene el catalizador y jabones
que son neutralizados con un ácido. En algunos casos la sal formada en esta etapa
se recupera para ser usada como fertilizante, pero en la mayoría de los casos se deja
en la glicerina. Se remueven el agua y el alcohol para obtener glicerina con un
80-88% de pureza, que puede venderse como glicerina cruda.
En operaciones más sofisticadas, la glicerina se destila para lograr un 99% de pureza
y ser utilizada en la industria farmacéutica o cosmética.
que el éster es insoluble en ésta, mientras que los otros productos no lo son. En
algunos procesos este procedimiento no es necesario. La separación del agua que
se agregó, así como de los subproductos se realiza por decantación o centrifugación;
éste último sistema es más rápido y más eficiente ya que retira el 99% del agua, pero
el resto tiene que ser eliminada por calentamiento a presión baja, con el fin de evitar
exponer a los metil ésteres a altas temperaturas en presencia de aire, lo que
causaría su oxidación.
2.2.1.7 Calidad del producto y registro. Previo a su uso como combustible comercial, el biodiesel debe ser analizado para asegurarse que cumple con las
especificaciones indicadas para combustibles de este tipo [14].
2.3 GLOSARIO
Blanqueamiento: El blanqueo con tierras minerales naturales o activadas con ácido
es para adsorber los compuestos coloreados y para descomponer los hidroperóxidos.
Este proceso es crítico en la refinación de aceites. El objetivo principal del blanqueo
adsorbente es eliminar todos los compuestos oxigenados presentes en el aceite. La
reducción del color es un efecto adicional de la operación, pero no debe ser el
propósito principal.
Desodorización: Es un proceso cuyo objetivo es eliminar los compuestos volátiles,
principalmente aldehídos y cetonas, con bajos umbrales de detección por el gusto y
el olfato. La desodorización es fundamentalmente un proceso de destilación con
vapor que se lleva a cabo a bajas presiones (2-6 milibares) y elevadas temperaturas
(180-220 °C).
Punto de solidificación, °C: Es la medición de la de la dureza de la grasa. Es
determinada fundiendo la grasa y midiendo enseguida la temperatura de su punto de
congelación en grados centígrados. Entre mas alto sea este valor, mas sólida o dura
es la grasa a temperatura ambiente.
Valor de Yodo: Es la determinación de dobles enlaces aislados en grasas, se basa
en la absorción del halógeno bajo condiciones elegidas, para provocar resultados
estequiométricos.
Materia Insaponificable: Son aquellas sustancias que se encuentran
frecuentemente disueltas en grasas y aceites, que no pueden saponificarse por
álcalis cáusticos, pero son solubles en los disolventes corrientes de las grasas. Se
CAPÍTULO III
3.1 CINÉTICA QUÍMICA
La cinética química es la parte de la química física que estudia la velocidad de las
reacciones químicas, los factores que la afectan y el mecanismo por el cual
transcurren.
3.1.1 Velocidad de Reacción
Es la variación por unidad de tiempo de la concentración de un reactante o de un
producto. La velocidad de reacción depende de la concentración de los reactantes, y
en algunos casos especiales, también de los productos; es de esperar entonces que
al avanzar la reacción y modificarse las concentraciones varíe la velocidad. Por lo
tanto, conviene referirse a velocidades instantáneas, lo cual requiere definir la
velocidad de reacción como la derivada de la concentración con respecto al tiempo.
Dada una transformación química
A + B → C [1]
La velocidad de reacción será:
dt C d dt B d dt A d
r= − [ ]=− [ ]= [ ] [2]
El signo negativo indica que la concentración de los reactantes A y B decrece al
transcurrir el tiempo; por el contrario el signo de la velocidad será positivo respecto
del producto de la reacción C, pues su concentración aumenta al aumentar el tiempo.
3.1.2 Orden de Reacción y Constante de Velocidad de Reacción
Una vez fijadas ciertas condiciones de reacción tales como temperatura, disolvente si
es una reacción en disolución, etc., la velocidad es función de la concentración de los
reactivos. En ciertas ocasiones la concentración de los productos y de sustancias no
implicadas en la ecuación estequiométrica afecta también la velocidad de reacción.
En muchos casos se puede hallar experimentalmente que la velocidad de reacción
se ajusta a una expresión matemática de tipo:
[ ] [ ]
a b B A kEn casos de expresiones cinéticas de este tipo se define como orden de reacción
respecto a una de las sustancias, el exponente al cual está elevada la concentración
de dicha sustancia en la expresión cinética. La suma de los exponentes es el orden
total de reacción: n = a + b + c. [15]
La constante de la velocidad de reacción k no es en realidad una constante, pero es
independiente de la concentración de las especies envueltas en la reacción. Además
es por lo general fuertemente dependiente de la temperatura. En reacciones de fase
gaseosa depende de la catálisis y puede ser una función de la presión total. En
sistemas líquidos puede ser una función de la presión total y de otros parámetros
como la fuerza iónica y el solvente escogido. Estas otras variables ejercen un efecto
mucho menor en la constante de la velocidad de reacción como lo hace la
temperatura; para propósitos del material presentado se asumirá que depende de la
solamente de la temperatura. Esta suposición es valida en muchas reacciones y
parece trabajar bien [16].
Fue el gran químico Arrhenius quien primero sugirió que la dependencia de la
constante de velocidad de reacción con la temperatura podía estar relacionada con
la siguiente ecuación [16]:
( )
E RTAe
T
k
=
− / [4]Donde A = Factor pre-exponencial o factor de frecuencia
E = Energía de activación, J/mol o cal/mol
R = Constante de los gases, J/mol °K
T = Temperatura absoluta, °K
Esta ecuación conocida como la ecuación de Arrhenius, la cual ha sido verificada
empíricamente para dar el comportamiento de la temperatura de varias constantes
de velocidad de reacción, con experimental exactitud sobre amplios rangos de
La energía de activación es determinada experimentalmente llevando a cabo la
reacción a diferentes temperaturas. Después de tomar el logaritmo natural de la
ecuación: − = T R E A
k ln 1
ln [5]
3.1.3 Reacciones Reversibles
Todas las leyes de las velocidades de reacciones reversibles tienen que ser
reducidas a sus termodinámicas relaciones relacionando las concentraciones de las
especies reaccionando en el equilibrio. En el equilibrio la velocidad de reacción es
cero para todas las reacciones. Esto es para la reacción general
dD cC bB
aA+ ↔ + [6]
Las concentraciones de equilibrio están dadas por
b Be a Ae d De c Ce C
C
C
C
C
K
=
[7]Las unidades de KC son (mol/dm3) d + c – b- a [16].
3.2 CINÉTICA DEL BIODIESEL
En el capitulo 2 se observaron las etapas que tiene el biodiesel en su reacción.
Usando la notación de la cinética química las tres etapas de la reacción de
transesterificación del biodiesel quedarían de la siguiente manera:
TG + CH3OH
⇔
1
2 k
k
DG + RCOOCH3 [8]
DG + CH3OH
⇔
3
4 k
k
MG + RCOOCH3 [9]
MG + CH3OH
⇔
5
6 k
k
GL + RCOOCH3 [10]
TG + 3CH3OH
⇔
7
8 k
k 3RCOOCH3 + GL [11] Donde:
TG Molécula de Triglicérido.
DG Molécula de Diglicérido.
MG Molécula de Monoglicérido.
CH3OH Metanol (Alcohol).
RCOOCH3 Biodiesel (molécula de metil éster) GL Glicerina
k1 a k8 Constantes de velocidad de cada reacción.
Obteniendo las derivadas de cada concentración de las tres etapas de la reacción y
relacionándolas con su respectiva constante de velocidad de reacción se obtiene el
siguiente análisis.
rTG =
[ ]
dt TG d
= -k1[TG][A] + k2[DG][E] – k7[TG][A]3 + k8[GL][E]3 [12]
rDG =
[ ]
dt DG d
= k1[TG][A] – k2[DG][E] – k3[DG][A] + k4[MG][E] [13]
rMG =
[ ]
dt MG d
= k3[DG][A] – k4[MG][E] – k5[MG][A] + k6[GL][E] [14]
rE =
[ ]
dt E d
= k1[TG][A] – k2[DG][E] + k3[DG][A] - k4[MG][E] + k5[MG][A] - k6[GL][E] +
k7[TG][A]3 - k8[GL][E]3 [15]
rA =
[ ]
dt A d =
[ ]
dt E d − [16]rGL =
[ ]
dt GL d
= k5[MG][A] - k6[GL][E] + k7[TG][A]3 - k8[GL][E]3 [17]
Donde:
[E] = Concentración de Esteres [GL] = Concentración de Glicerina [A] = Concentración de Metanol
Si se obtienen experimentalmente las concentraciones de triglicéridos, diglicéridos,
monoglicéridos, metil esteres y glicerina, seríamos capaces de obtener todas las
constantes de velocidad para cada etapa de la reacción, donde según el desarrollo
de las ecuaciones consideran reacciones reversibles.
Para el análisis de sus resultados experimentales de Noureddini y Zhu [17] para la
reacción de transesterificación con aceite de soya consideraron una reacción de
segundo orden. El tipo de catalizador fue NaOH con un porcentaje en peso en base
al aceite de soya igual a 0.2 y una relación molar alcohol - aceite de 6:1. Observaron
los efectos sobre las constantes de velocidad de reacción en función de la
temperatura y la intensidad de mezclado a 150, 300 y 600 rpm respectivamente. En
la figura 3.2.1 se observa el comportamiento de las concentraciones que involucran
Figura 3.2.1. Modelo cinético de las curvas y puntos experimentales para la composición de la mezcla de la reacción durante la transesterificación del aceite de soya a 50 °C y NRe =
6200. (+) Triglicéridos, (Õ) Metil Esteres, (□) Diglicéridos, (○) Monoglicéridos, (∆) Glicerina [17].
En la figura 3.2.2 se puede observar el efecto de la temperatura en la conversión de
la reacción. Y en la figura 3.2.3 se observa el efecto de la intensidad de mezclado en
la conversión de la reacción. En este caso la intensidad de mezclado se representa
con el Número de Reynolds el cual considera la velocidad rotacional del mezclador,
Figura 3.2.2. Efecto de la temperatura y el tiempo en toda la conversión de metil esteres a NRe = 6200 (■) 30 °C,(▲) 40 °C,(∆) 50 °C ,(●) 60 °C ,(□) 70 °C [17].
Figura 3.2.3. Efecto de la intensidad de mezclado y el tiempo en toda la conversión de metil esteres a 50 °C. (■) NRe = 3100, (▲) NRe = 6200, (□) NRe = 12400 ,(∆) NRe = 18600 [17].
En la tabla 3.2.1 y 3.2.2 se presentan los resultados experimentales que obtuvieron
Noureddini y Zhu [17] de energías de activación y constantes de velocidad de
reacción.
Tabla 3.2.1. Energía de Activación (cal/mol) a diferentes intensidades de mezclado [17].
NRe = 6200 NRe = 12400
Reacción Arrheniusa Arrhenius
Modificadob
Arrheniusa Arrhenius
TG→DG 13,145 11,707 13,600 12,130
DG→TG 9,932 8,482 9,783 8,313
DG→MG 19,860 18,439 18,769 16,767
MG→DG 14,639 13,433 11,177 9,710
MG→GL 6,421 7,937 5,182 8,036
GL→MG 9,588 10,992 9,873 11,365
a
Ecuación de Arrhenius, k = Ae-E/RT
bEcuación de Arrhenius Modificada, k = ATe-E/RT. T, temperatura;TG, triglicérido; DG,
diglicérido; MG, monoglicérido; GL, Glicerina; NRe, Número de Reynolds.
Tabla 3.2.2. Promedio de la Constante de Reacción(min-1) a 50 °C y NRe = 6200 [17]. Constante de Velocidad de
Reacción
Con k7 y k8 igual a
cero
Sin k7 y k8 igual a cero
k1 0.050 0.049
k2 0.110 0.102
k3 0.215 0.218
k4 1.228 1.280
k5 0.242 0.239
k6 0.007 0.007
k7 - 7.84 * 10-5
k8 - 1.58 * 10-5
Otros trabajos experimentales que se han hecho son los de Freedman y Darnoko
[3,18] en donde suponen que la reacción es de pseudo segundo orden, y las
concentraciones de alcohol y glicérido son las mismas. Además considera que las
reacciones son irreversibles, por lo tanto solo calculan las tres constantes de
reacción siendo una por etapa.
Tabla 3.2.3. Constantes de velocidad de reacción [19].
Reacción K Freedman (min)-1 K Darnoko (%peso min)-1
TG→DG 3.822 0.018
DG→MG 1.215 0.036
MG→GL 0.792 0.098
Tabla 3.2.4. Energías de activación [19].
Reacción E Freedman (kcal/mol) K Darnoko (kcal/mol)
TG→DG 15.360 14.7
Las condiciones para el cálculo de las constantes de velocidad de reacción y las
energías de activación fueron las que se muestran en la siguiente tabla 3.2.5.
Tabla 3.2.5 [19].
Reacción Freedman Darnoko
% de Catalizador 1 1
Tipo de Catalizador NaOBu KOH
Temperatura, °C 60 50
Relación Molar, alcohol-aceite
30:1 6:1
Tipo de Aceite Aceite de Soya Aceite de Palma
3.2.1 Variables que influyen en la Conversión
Las variables más importantes que afectan el tiempo de reacción, así como la
conversión son:
* Temperatura de la reacción
* Relación de alcohol / aceite
* Tipo de catalizador y concentración
* Mezclado
* Pureza de los reactantes.
Otra variable que resulta importante es la cantidad inicial de agua que pueda
contener el aceite a usar, por la acción inhibidora que provoca en la
transesterificación.
3.2.1.1 Temperatura de la reacción. La reacción puede llevarse a cabo a
temperatura ambiente con una tasa de conversión alta si se deja el tiempo necesario
para ello. Generalmente la reacción se lleva a cabo cerca del punto de ebullición del
metanol a presión atmosférica (para aceites con un cierto grado de refinación). La
máxima producción de ésteres ocurre de los 60 a 80ºC, aunque se encuentra
reportado que con un exceso de 100% de metanol y utilizando un 1% de hidróxido de
sodio, después de una hora a 45ºC, se tiene la misma tasa de conversión (97%) que
3.2.1.2 Relación alcohol / aceite. La estequiometría de la reacción requiere tres
moles de metanol por cada mol de triglicérido. Sin embargo, cuando se usa un 100%
de metanol en exceso, la tasa de conversión es la más alta y permite la separación
del glicerol formado. Por otro lado, un exceso considerable dificulta la recuperación
de la glicerina, por lo que la relación alcohol / aceite debe determinarse
empíricamente, dependiendo de cada proceso.
3.2.1.3 Intensidad de mezclado. En la transesterificación se tienen inicialmente dos
fases líquidas de difusión, y si se tiene una difusión pobre la tasa de conversión es
baja. Conforme se forman los metil ésteres, estos actúan como solventes de ambas
fases y originando un sistema de una sola fase. Esto implica que la agitación sea
más importante en la primera etapa de la reacción, ya que una vez que una vez que
se presenta el sistema contiendo una fase el mezclado se vuelve insignificante.
3.2.1.4 Pureza de los reactantes. Las impurezas contenidas en el aceite afectan las
tasas de conversión. En el caso de usar aceites vegetales crudos se reportan tasas
del 67 al 84%, en tanto que enaceites refinados se presentan tasas del 94 al 97%. En
caso de utilizar aceites vegetales reciclados, normalmente no presentan grandes
diferencias en sus propiedades físicas y químicas con respecto a aceites nuevos.
3.2.1.5 Tipo de catalizador y concentración. La selección del catalizador, así como
su concentración tiene un efecto fundamental dentro de la transesterificación de
aceites vegetales y es una de las áreas de estudio con más desarrollo en lo que se
CAPÍTULO IV
4.1 CROMATOGRAFÍA DE GASES
La cromatografía de gases es un método físico de separación en el que los
componentes a desglosar se distribuyen entre dos fases, una de las cuales consiste
en un lecho estacionario de gran área superficial y la otra es un fluido que pasa a
través o a lo largo del lecho estacionario.
Al elegir uno de los muchos aparatos cromatográficos que se fabrican en serie se
tendrán en cuenta los siguientes factores más importantes [20]:
1. Control de temperatura e intervalo de la misma.
2. Tipo y características del detector.
3. Variedad de columnas utilizables.
4. Control del caudal de gas.
5. Estabilidad de la línea de base trabajando al máximo de sensibilidad.
6. Tipo de sistema para la inyección de muestras.
4.1.1 Detector
Con el detector de flama ionizante las sustancias son quemadas en una flama de
hidrógeno y son parcialmente ionizadas (Tabla 4.1.1). Como el inyector de cuarzo,
como se ve en la figura 4.1.1, tiene un potencial negativo, los iones positivos son
neutralizados. Los correspondientes electrones son capturados en el colector de
electrodo de forma de anillo para dar la señal. El electrodo tiene un potencial el cual
es 200 V mas positiva que el inyector de cuarzo.
Tabla 4.1.1. Reacciones en un detector de flama ionizante (Perkin Elmer) [21].
Pirolisis CH3°,CH2°,CH°,C°
Radicales Excitados O2*, OH*
-Figura 4.1.1. Construcción de un detector de flama ionizante (Finnigan) [21].
El hidrógeno se quema en la flama, por lo tanto solamente reacciones con radicales
ocurren. No se forman iones. Si sustancias orgánicas con enlaces C-H y C-C entran
en la flama, son primero pirolisadas. El contenido carbónico en los radicales es
oxidado por el oxígeno y los radicales OH formados en la flama. La excitación de
energía lleva a la ionización de los productos oxidados. Solo sustancias con al menos
un enlace C-H o C-C son detectados, pero no gases permanentes como el
tetracloruro de carbono o agua.
Si un reactor (hidrogenizador, metanoizador) es conectado antes del detector de
flama ionizante, lo que sigue puede ser convertido a un detector extremadamente
sensible a gases permanentes como CO y CO2. El detector específico de oxígeno
(O-FID) usa dos reactores. En el primero se descomponen los hidrocarburos en
flama ionizante. Con el O-FID, por ejemplo, componentes oxigenados en
combustibles pueden ser detectados [21].
Tabla 4.1.2. Características del FID (Detector de Flama Ionizante) [21]. Ventajas -Muy dinámico
-Muy sensible
-Robusto
Usos -Hidrocarburos, como combustibles, sustancias incoloras, BTX, poli
aromáticos, hidrocarburos, etc.
-Comparaciones de diesel con petróleo
Limites -Como es universal, su rendimiento es pobre para análisis de trazas en
matrices complejas.
-Baja respuesta a sustancias altamente cloradas o bromadas.
4.1.2 Columna Capilar
No hay reglas para escoger una columna para cromatografía de gases o
espectrometría de masas. Si la sustancia no exhibe una interacción con la fase
estacionaria, no habrá retención y la sustancia dejará la columna en un tiempo
muerto. La polaridad de la fase estacionaria debería corresponder a la polaridad de
las sustancias siendo separadas. Sustancias menos polares son mejor separadas
por una fase no polar y viceversa.
4.1.2.1 Cambio a una fase estacionaria más polar
-Débil retención de compuestos no polares
-Fuerte retención de compuestos polares
-Cambio de compuestos con una interacción específica
4.1.2.2 Capacidad de la muestra
-Incrementa con el diámetro interno.
- Incrementa con el grosor de la película.
![Figura 1.2.4. Impacto promedio de emisiones de biodiesel por motores de vehículos [10]](https://thumb-us.123doks.com/thumbv2/123dok_es/4536260.39186/15.892.138.773.437.885/figura-impacto-promedio-emisiones-biodiesel-motores-vehiculos.webp)
![Tabla 1.2.4. Escenario costo retorno de una planta biodiesel con capacidad de 60,000 toneladas [2]](https://thumb-us.123doks.com/thumbv2/123dok_es/4536260.39186/19.892.163.778.152.319/tabla-escenario-costo-retorno-planta-biodiesel-capacidad-toneladas.webp)
![Tabla 2.1.1 Nombres comunes de ácidos grasos principales de aceites y grasas comestibles [13]](https://thumb-us.123doks.com/thumbv2/123dok_es/4536260.39186/21.892.128.776.731.1093/tabla-nombres-comunes-acidos-grasos-principales-aceites-comestibles.webp)
![Tabla 2.1.2. Análisis típicos de algunas grasas y aceites naturales a y de otros productos grasos comerciales [13]](https://thumb-us.123doks.com/thumbv2/123dok_es/4536260.39186/22.892.126.805.596.1091/tabla-analisis-tipicos-grasas-aceites-naturales-productos-comerciales.webp)
![Figura 3.2.2. Efecto de la temperatura y el tiempo en toda la conversión de metil esteres a N Re = 6200 ( ■) 30 °C,(▲) 40 °C,(∆) 50 °C ,(●) 60 °C ,(□) 70 °C [17]](https://thumb-us.123doks.com/thumbv2/123dok_es/4536260.39186/39.892.244.672.152.433/figura-efecto-temperatura-tiempo-toda-conversion-metil-esteres.webp)
![Figura 5.1.6. Esquema de preparación de soluciones estándar [27].](https://thumb-us.123doks.com/thumbv2/123dok_es/4536260.39186/72.892.122.758.596.741/figura-esquema-preparacion-soluciones-estandar.webp)
![Figura 5.1.7. Cromatograma de identificación de picos según la norma ASTM D6584 [27].](https://thumb-us.123doks.com/thumbv2/123dok_es/4536260.39186/73.892.140.765.151.605/figura-cromatograma-identificacion-picos-segun-norma-astm-d.webp)
![Figura 5.1.9. Cromatograma para identificar metil ésteres de un aceite vegetal [28].](https://thumb-us.123doks.com/thumbv2/123dok_es/4536260.39186/78.892.257.658.201.619/figura-cromatograma-para-identificar-metil-esteres-aceite-vegetal.webp)
![Tabla 5.2.2. Bandas de absorción en los espectros infrarrojos de monoglicéridos, diglicéridos y triglicéridos [30]](https://thumb-us.123doks.com/thumbv2/123dok_es/4536260.39186/84.892.127.782.201.570/tabla-bandas-absorcion-espectros-infrarrojos-monogliceridos-digliceridos-trigliceridos.webp)