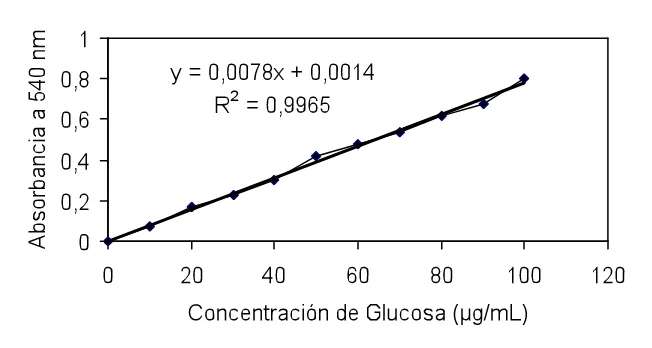
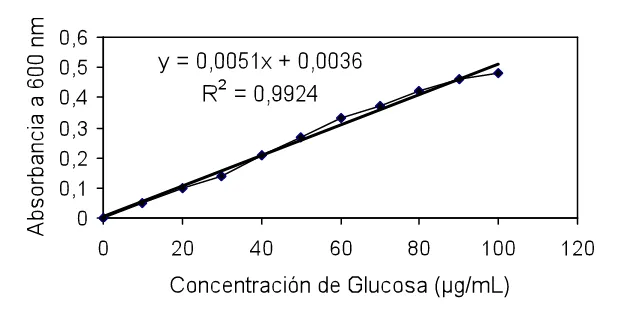
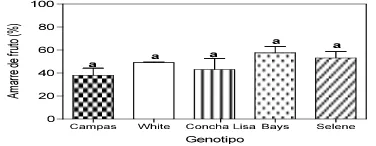
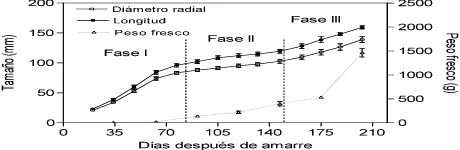
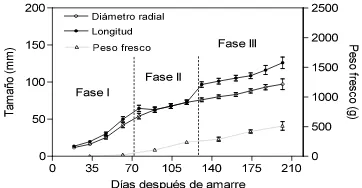
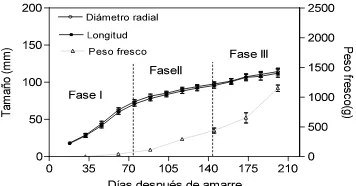
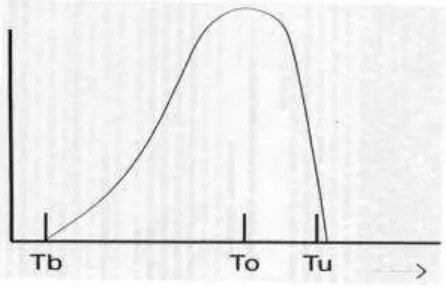
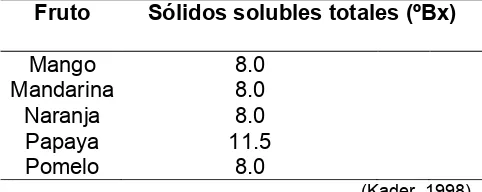
Evaluación del crecimiento, desarrollo y patrón de maduración de cinco genotipos de chirimoya (Annona cherimola Mill.) con potencial comercial
Texto completo
Figure

Documento similar
En junio de 1980, el Departamento de Literatura Española de la Universi- dad de Sevilla, tras consultar con diversos estudiosos del poeta, decidió propo- ner al Claustro de la
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
entorno algoritmo.
[r]
SVP, EXECUTIVE CREATIVE DIRECTOR JACK MORTON
Social Media, Email Marketing, Workflows, Smart CTA’s, Video Marketing. Blog, Social Media, SEO, SEM, Mobile Marketing,
The part I assessment is coordinated involving all MSCs and led by the RMS who prepares a draft assessment report, sends the request for information (RFI) with considerations,
• For patients with severe asthma and who are on oral corticosteroids or for patients with severe asthma and co-morbid moderate-to-severe atopic dermatitis or adults with