Determinación De Los Patrones De Tinción Y Efecto De La Giberelina Sobre La Germinación De Las Semillas De Caoba (Swietenia Macrophylla) Y Guayacán Amarillo (Handroanthus Chrysanthus)
Texto completo
(2) DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) y GUAYACÁN AMARILLO (Handroanthus chrysanthus). KATERINE ANDREA CÉSPEDES TORRES. Director: Biól. Favio López Botía. M.Sc.. TESIS PRESENTADA COMO REQUISITO PARA OPTAR AL TÍTULO DE INGENIERA FORESTAL; MODALIDAD DE INVESTIGACIÓN - INNOVACIÓN. ENTIDAD COOPERANTE: El Semillero. UNIVERSIDAD DISTRITAL FRANCISCO JOSÉ DE CALDAS FACULTAD DE MEDIO AMBIENTE Y RECURSOS NATURALES INGENIERÍA FORESTAL BOGOTÁ D.C. 2018.
(3) TABLA DE CONTENIDO RESUMEN........................................................................................................................... 1 ABSTRAC ........................................................................................................................... 2 I. INTRODUCCIÓN ....................................................................................................... 3 II. OBJETIVOS ............................................................................................................... 4 2.1 OBJETIVO GENERAL .......................................................................................... 4 2.2 OBJETIVOS ESPECÍFICOS .................................................................................. 4 III. PLANTEAMIENTO DEL PROBLEMA ......................................................................... 5 3.1 DESCRIPCIÓN DEL PROBLEMA .......................................................................... 5 3.2 JUSTIFICACIÓN .................................................................................................. 5 3.3 FORMULACIÓN DE HIPÓTESIS .......................................................................... 6 IV. ESTADO DEL ARTE ................................................................................................... 7 4.1 GENERALIDADES PARA LA ESPECIE FORESTAL: CAOBA (S. MACROPHYLLA) ......... 7 4.1.1 Clasificación taxonómica ..................................................................................... 7 4.1.2 Estado de amenaza: ........................................................................................ 7 4.1.3 Distribución geográfica ................................................................................... 7 4.1.4 Descripción del hábitat ................................................................................... 8 4.1.5 Gremio ecológico ............................................................................................ 9 4.1.6 Descripción ..................................................................................................... 9 4.1.7 Usos e importancia ........................................................................................ 10 4.1.8 Calidad física de las semillas ........................................................................... 10 4.1.9 Germinación ...................................................................................................11 4.1.10 Tratamientos pregerminativos .................................................................. 12 4.1.11 Imbibición .................................................................................................. 13 4.1.12 Floración y fructificación ............................................................................ 13 4.2 GENERALIDADES PARA LA ESPECIE FORESTAL: GUAYACÁN AMARILLO (H. CHRYSANTHUS).................................................................................................................. 14 4.2.1 Clasificación taxonómica ................................................................................... 14 4.2.2 Estado de amenaza: ....................................................................................... 15 4.2.3 Distribución geográfica .................................................................................. 15 4.2.4 Descripción del hábitat .................................................................................. 15 4.2.5 Gremio ecológico ........................................................................................... 15 4.2.6 Descripción .................................................................................................... 15 4.2.7 Usos e importancia ........................................................................................ 16 4.2.8 Calidad física de las semillas ........................................................................... 17 4.2.9 Germinación .................................................................................................. 17 4.2.10 Tratamientos pregerminativos .................................................................. 17 4.2.11 Imbibición .................................................................................................. 17 4.2.12 Floración y fructificación ............................................................................ 17 4.3 GENERALIDADES DE LA SEMILLA ..................................................................... 18 4.3.1 Partes de la semilla ............................................................................................ 18 I.
(4) 4.3.2 Viabilidad .......................................................................................................... 19 4.4 GERMINACIÓN ................................................................................................. 22 4.4.1 Proceso de germinación ................................................................................. 22 4.4.2 Factores que afectan la germinación.............................................................. 23 4.4.3 Expresión de resultados .................................................................................24 4.5 ÁCIDO GIBERÉLICO ...........................................................................................25 4.5.1 Naturaleza química ............................................................................................ 25 4.5.2 Actividad biológica ............................................................................................26 4.5.3 Mecanismo de acción ........................................................................................26 4.5.4 Efectos fisiológicos ........................................................................................... 27 4.5.5 Ensayos con Giberelina ......................................................................................28 V. MATERIALES Y MÉTODOS ..................................................................................... 29 5.1 ÁREA DE ESTUDIO ........................................................................................... 29 5.2 MATERIAL EXPERIMENTAL ............................................................................. 29 5.3 METODOLOGÍA...................................................................................................... 29 5.3.1 Prueba de Imbibición .....................................................................................29 5.3.2 Pruebas de Calidad Física .............................................................................. 30 5.3.3 Viabilidad....................................................................................................... 37 VI. RESULTADOS Y ANÁLISIS...................................................................................... 39 6.1 PRUEBA IMBIBICIÓN ....................................................................................... 39 6.2 PRUEBAS CALIDAD DE SEMILLAS .................................................................... 40 6.2.1. Pureza, Número de semillas, Contenido de humedad. .................................. 40 6.2.2 Germinación. ................................................................................................. 41 6.3 PRUEBAS DE VIABILIDAD. ................................................................................ 51 6.3.1 Prueba de corte. ............................................................................................ 51 6.3.2 Prueba de tetrazolio. ..................................................................................... 52 6.4. RELACIÓN PRUEBA DE GERMINACIÓN VS. PRUEBA DE VIABILIDAD. .................. 55 VII. DISCUSIÓN ............................................................................................................. 58 7.1 PRUEBA DE IMBIBICIÓN .................................................................................. 58 7.2 PRUEBAS DE CALIDAD DE SEMILLAS............................................................... 58 7.2.1 Pureza, numero de semillas, contenido de humedad. ................................... 58 7.2.2 Germinación ................................................................................................. 59 7.3 VIABILIDAD ....................................................................................................... 61 7.3.1 Prueba de corte ............................................................................................. 61 7.3.2 Prueba de tetrazolio ......................................................................................62 VIII. CONCLUSIONES ..................................................................................................... 64 IX. RECOMENDACIONES ............................................................................................. 66 X. BIBLIOGRAFÍA ....................................................................................................... 67 XI. ANEXOS ..................................................................................................................73. II.
(5) ÍNDICE DE TABLAS. Tabla 1. Cuadro fenológico de la especie S. macrophylla. ............................................................... 14 Tabla 2. Efectos fisiológicos por la fitohormona Giberelina. ........................................................... 27 Tabla 3. Tratamientos pregerminativos utilizados para la prueba de germinación. ........................ 32 Tabla 4. Dosis empleada de agua y PROGIBB ® 10SP, para cada tratamiento. ................................. 32 Tabla 5. Modelo de ANAVA. ........................................................................................................... 35 Tabla 6. Formulas manejadas para el cálculo de las variables de germinación. ............................... 35 Tabla 7. Categorías de tinción de Tetrazolio. .................................................................................38 Tabla 8. Características físicas de las semillas de las dos especies en estudio. ................................ 41 Tabla 9. Efecto de los diferentes tratamientos sobre el Porcentaje de Germinacion (PG), Tiempo Medio de Germinacion (TMG), Energia germinativa (EG), Velocidad Media de Germinacion (VMG) y el Valor de Germinacion en semillas de Swietenia macrophylla. .................................................... 41 Tabla 10. Efecto de los diferentes tratamientos sobre el Porcentaje de Germinacion (PG), Tiempo Medio de Germinacion (TMG), Energia germinativa (EG), Velocidad Media de Germinacion (VMG) y el Valor de Germinacion en semillas de Handroanthus chrysanthus. ............................................ 46 Tabla 11. Porcentajes de viabilidad mediante la prueba de corte de las semillas de Caoba (S. macrophylla). ............................................................................................................................... 51 Tabla 12. Porcentajes de viabilidad mediante la prueba de corte de las semillas de Guayacan amarillo (H. chrysanthus). ............................................................................................................. 52 Tabla 13. Patrones de tincion para la interpretacion de los resultados de la prueba de tetrazolio en semillas de Caoba (Swietenia macrophylla). .................................................................................. 52 Tabla 14. Porcentajes de viabilidad mediante la prueba topografica de tetrazolio de las semillas de Caoba (S. macrophylla). ................................................................................................................ 53 Tabla 15. Patrones de tincion para la interpretacion de los resultados de la prueba de tetrazolio en semillas de Guayacán amarillo (Handroanthus chrysanthus) ......................................................... 54 Tabla 16. Porcentajes de viabilidad mediante la prueba topografica de tetrazolio de las semillas de Guayacan amarillo (H. chrysanthus). ............................................................................................. 55. III.
(6) ÍNDICE DE FIGURAS Figura 1. Distribución histórica de S. macrophylla. .......................................................................... 8 Figura 2. Morfología de la semilla de la especie forestal Caoba (S. macrophylla). ........................... 10 Figura 3. Descripción de la morfología de las semillas y el desarrollo del embrión de Swietenia macrophylla, antes de la germinación. Adaptado de los resultados de Alvarenga & Flores (1988). 12 Figura 4. Disposición de la media sombra. ..................................................................................... 13 Figura 5. Semillas de Handroanthus chrysanthus. .......................................................................... 16 Figura 6. Estructura interna y detalles de la estructura externa. .................................................... 18 Figura 7. Patrón de tinción después de la prueba con tetrazolio en semillas dicotiledóneas. .......... 21 Figura 8. Curva de absorción de agua en las diferentes fases de germinación. .............................. 22 Figura 9. Estructura química de GA3. ............................................................................................. 26 Figura 10. Modelo de activación de la germinación de semillas por las giberelinas. ........................ 28 Figura 11. Distribución de los tratamientos del diseño experimental para cada especie. ................. 33 Figura 12. a) Distribución de las semillas de Caoba (S. macrophylla) por unidad experimental. b) Distribución de las semillas de Guayacán amarillo (H. chrysanthus) por unidad experimental........ 34 Figura 13. Representación de la codificación utilizada para cada bandeja de germinación ..............36 Figura 14. Semillas con exposicion de la radicula, primeros dias de germinacion. a) semillas de Handroanthus chrysanthus, b) semillas de Swietenia macrophylla. ............................................... 37 Figura 15. Modelo de regresión polinomica cúbica del peso ganado de la semilla de Caoba (S. macrophylla) con el paso de las horas. ......................................................................................... 40 Figura 16. Modelo de regresión logarítmica del peso ganado de la semilla de Guayacán amarillo (H. chrysanthus) con el paso de las horas........................................................................................... 40 Figura 17. Efecto de los tratamientos sobre: A: Porcentaje de germinacion (PG), B: Tiempo Medio de Germinacion (TMG), C: Energia de Germinacion (EG), D: Velocidad Media de Germinacion y E: Valor de Germinacion (VG) en semillas de Swietenia macrophylla. ................................................ 43 Figura 18. Porcentaje de germinacion acumulada de las semillas de Swietenia macrophylla, sembradas durante 26 dias bajo los cuatro tratamiento. .............................................................. 44 Figura 19. Efecto de los diferentes tratamientos empleados en la Velocidad de Germinacion Diaria de las semillas de Caoba (S. macrophylla). ..................................................................................... 45 Figura 20. Efecto de los tratamientos sobre: A: Porcentaje de germinacion (PG), B: Tiempo medio de Germinacion (TMG), C: Energia de Germinacion (EG), D: Velocidad Media de Germinacion y E: Valor de Germinacion (VG) en semillas de Handroanthus chrysanthus. ......................................... 48 Figura 21. Porcentaje de germinacion acumulada de las semillas de Handroanthus chrysanthus, incubadas durante 36 dias bajo los cuatro tratamiento. ............................................................... 49 Figura 22. Efecto de los diferentes tratamientos empleados en la Velocidad de Germinacion Diaria (VGD) de las semillas de Guayacan amarillo (H. chrysanthus)........................................................ 50 Figura 23. Ataque Damping-off a la plantula de Guayacan amarillo (H. chrysanthus). ................... 50 Figura 24. Representación grafica de la morfologia de las semillas de Caoba. ................................ 52 Figura 25. Representación grafica de la morfologia de las semillas de Guayacan amarillo (H. chrysanthus). ................................................................................................................................ 53 Figura 26. Porcentajes de germinacion de las semillas de Caoba (S. macrophylla) para cada prueba realizada. ......................................................................................................................................56 Figura 27. Porcentajes de germinacion de las semillas de Guayacan amarillo (H. chrysanthus) para cada prueba realizada. .................................................................................................................. 57. IV.
(7) ÍNDICE DE ANEXOS Anexo 1. Prueba de imbibicion semillas de Caoba. ......................................................................... 73 Anexo 2. Prueba de imbibicion semillas de Guayacan amarillo. ...................................................... 76 Anexo 3. Resultados y procesamiento de prueba de calidad fisica de semillas de Caoba ............... 77 Anexo 4. Resultados y procesamiento de prueba de calidad fisica de semillas de G. amarillo. ........78 Anexo 5. Resultados diarios para prueba de germinacion de las semillas de Caoba, T0. ................. 79 Anexo 6. Resultados diarios para prueba de germinacion de las semillas de Caoba, T1. ................. 80 Anexo 7. Resultados diarios para prueba de germinacion de las semillas de Caoba, T2................... 81 Anexo 8. Resultados diarios para prueba de germinacion de las semillas de Caoba, T3. ................. 82 Anexo 9. Resultados diarios para prueba de germinacion de las semillas de G. amarillo, T0. ..........83 Anexo 10. Resultados diarios para prueba de germinacion de las semillas de G. amarillo, T1. ........ 84 Anexo 11. Resultados diarios para prueba de germinacion de las semillas de G. amarillo, T2. ..........85 Anexo 12. Resultados diarios para prueba de germinacion de las semillas de G. amarillo, T3. ........ 86 Anexo 13. Registros prueba de corte de las semillas de Caoba. ......................................................87 Anexo 14. Registros prueba de corte de las semillas de Guayacán amarillo. .................................. 88 Anexo 15. Registros prueba de tetrazolio de las semillas de Caoba. .............................................. 89 Anexo 16. Registros prueba de tetrazolio de las semillas de Guayacán amarillo. ............................ 91 Anexo 17. Resultados del analisis de varianza para las diferentes variables analizadas para las semillas de Caoba (S. macrophylla). ..............................................................................................93 Anexo 18. Resultados del analisis de varianza para las diferentes variables analizadas para las semillas de Guayacan amarillo (H. chrysanthus). ...........................................................................93. V.
(8) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. RESUMEN El objetivo del estudio fue determinar la relación entre el porcentaje de germinación obtenido por la inmersión de las semillas en diferentes concentraciones de AG 3 y el porcentaje de semillas viables según la prueba de tinción con tetrazolio, para las semillas de las especies forestales Caoba (S. macrophylla) y Guayacán amarillo (H. chrysanthus). El proyecto se desarrolló en el invernadero de la sede administrativa de la empresa “El Semillero”, dentro del cual se pudo controlar las variables climáticas (Temperatura promedio de 29 °C y Humedad Relativa del 100%). Se evaluó la germinación de las especies bajo el efecto del Ácido Giberélico (AG3) en tres concentraciones; para esto, se instalaron los ensayos con un Diseño Experimental Simple Completamente al Azar con tres repeticiones, en donde el factor correspondió a la concentración de ácido giberélico: H2O, 50, 100 y 300 ppm, utilizando 20 unidades experimentales para los ensayos de Swietenia macrophylla y 40 unidades experimentales para Handroanthus chrysanthus. El análisis de la germinación se realizó mediante las siguientes variables: Porcentaje de Semillas Germinadas, Tiempo Medio de Germinación, Energía Germinativa y Velocidad Media de Germinación. Los resultados obtenidos para las dos especies no mostraron diferencias significativas entre los tratamientos; no obstante, con la imbibición de las semillas de Caoba (S. macrophylla) en AG3 a 300 ppm (T3), las semillas alcanzan su mayor porcentaje de germinación; las semillas de Guayacán amarillo (H. chrysanthus) al ser imbibidas en 100 ppm de AG3 (T2) logro la máxima germinación. La viabilidad de las semillas, medidas con la prueba de corte y tinción con tetrazolio al 1%, presento una sobreestimación en un 17% y 12% respectivamente, sobre el mejor tratamiento para las semillas de Caoba (S. macrophylla); para las semillas de Guayacán amarillo (H. chrysanthus) la prueba de corte sobreestima en un 31.08% el porcentaje de germinación del mejor tratamiento y subestima en un 8.17% la prueba de Tetrazolio. Palabras clave: Ácido giberelico (AG3), Handroanthus chrysanthus, Germinación, Swietenia macrophylla, Tetrazolio, Viabilidad.. 1.
(9) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. ABSTRAC The objective of the study was to determine the relationship between the percentage of germination obtained by the immersion of the seeds in different AG3 concentrations and the percentage of viable seeds according to the tetrazolium staining test, for the seeds of the forest species Caoba (S. macrophylla) and Guayacán amarillo (H. chrysanthus). The germination of the species under the effect of Gibberellic Acid (AG3) in three concentrations was evaluated; the trial was installed with an Experimental Design Simple Randomized with three repetitions, where the factor corresponded to the concentration of gibberellic acid: H2O, 50, 100 and 300 ppm, using 20 experimental units for the Swietenia macrophylla trials and 40 units experiments for Handroanthus chrysanthus. The germination analysis was carried out by means of the following variables: Germinated Seeds Percentage, Germination Average Time, Germinative Energy and Average Germination Speed. The results obtained for the two species did not show significant differences between the treatments; however, with the imbibition of the seeds of Caoba (S. macrophylla) in AG3 at 300 ppm (T3), the seeds reach their highest percentage of germination; the seeds of Guayacán amarillo (H. chrysanthus) its maximum germination to 100 ppm of AG3 (T2). The viability of the seeds, measured with the cut and stain test with 1% tetrazolium, presented an overestimation in 17% and 12% respectively, on the best treatment for the seeds of Caoba (S. macrophylla); for seeds of Guayacán amarillo (H. chrysanthus) the cut test overestimates in 31.08% the percentage of germination of the best treatment and underestimates in 8.17% the Tetrazolium test.. Key words: Gibberellic Acid, Handroanthus chrysanthus, Germination, Swietenia macrophylla, Tetrazolium, Viability. 2.
(10) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. I. INTRODUCCIÓN La importancia de estudiar las semillas radica en el uso que a estas se les da para realizar manejos de poblaciones de plantas, reforestar, conservar el germoplasma vegetal, y para recuperar especies valiosamente explotadas (Tolentino et al., n.d.). Por ende, una semilla de calidad debe ser viable ante condiciones ambientales no ideales, por lo que su establecimiento en campo tiene que dar paso a plantas vigorosas, lo que se traduce en un cultivo de características deseadas (Lallana et al., 2011). En la industria semillera se requiere de controles de calidad, por lo tanto, se hace indispensable emplear metodologías que permitan realizar análisis rápidos para determinar la calidad de las semillas y paralelamente conocer el potencial de germinación que estas tengan. Las pruebas empleadas en este ensayo buscan determinar la viabilidad con base en la tinción con Tetrazolio y la Germinación empleando Giberelinas. La prueba de tinción con tetrazolio busca determinar la viabilidad de las semillas que presentan algún grado de dormición o que presentan una velocidad de germinación muy baja, esto se determina cuando la sal de tetrazolio logra penetrar al interior de la semilla y hace que las células vivas se logren ver, gracias a la tinción que este genera (Pérez & Pita, 2001). Por otro lado, las Giberelinas son un método hormonal que se emplea para sacar del periodo de reposo a las semillas, esto se logra mediante la inmersión de las semillas en ácido giberélico a diferentes concentraciones, permitiendo la liberación de enzimas y posteriormente lograr que los nutrientes necesarios para el desarrollo del embrión estén disponibles, lo que da paso a un aumento en la actividad celular para que se dé la emergencia de este. La metodología de este proyecto consta de tres partes. La primera, es la prueba de imbibición, que busca determinar el tiempo en el que las semillas logran su mayor ganancia en agua para rehidratarse y dar paso a la emergencia del embrión; la segunda parte, son las pruebas que determinan la calidad física de las semillas (pureza, peso de mil semillas, contenido de humedad, ensayo de germinación); la tercera parte, son las pruebas de viabilidad (corte, y tinción con tetrazolio). Con la realización de estas pruebas se busca aportar al paquete tecnológico de las especies Caoba (S. macrophylla) y Guayacán amarillo (H. chrysanthus).. 3.
(11) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. II. OBJETIVOS. 2.1. OBJETIVO GENERAL. Determinar la relación existente entre el porcentaje de germinación obtenido por la inmersión de las semillas en diferentes concentraciones de AG 3 y el porcentaje de semillas viables según la prueba de tinción con Tetrazolio, para las semillas de las especies forestales Caoba (S. macrophylla) y Guayacán amarillo (H. chrysanthus).. 2.2 . . OBJETIVOS ESPECÍFICOS Desarrollar las curvas de imbibición de las semillas de cada especie, que permita determinar tiempos requeridos para que las semillas alcancen la fase de emergencia. Evaluar el efecto del regulador hormonal AG3 a diferentes concentraciones en el porcentaje de germinación. Establecer los patrones de tinción de tetrazolio para las semillas de Caoba (S. macrophylla) y Guayacán amarillo (H. chrysanthus).. 4.
(12) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. III. PLANTEAMIENTO DEL PROBLEMA. 3.1. DESCRIPCIÓN DEL PROBLEMA. La semilla es la estructura de reproducción sexual de las plantas, es decir son el punto de partida para la producción, lo cual requiere que dichas semillas tengan la capacidad de producir plántulas vigorosas que sean capaces de sobrevivir a los diferentes ambientes en las cuales se establecen. El control de calidad es un aspecto fundamental en la industria semillera, por lo cual se requiere de metodologías para análisis rápido de la calidad de las semillas; poder determinar el potencial de germinación de las semillas con agilidad permite al comerciante y comprador obtener mayores ganancias, ya que el productor no tendrá porcentajes de reposición de semillas y el comprador no deberá invertir mayores tiempos en una posible resiembra de las semillas. Actualmente las investigaciones que determinan la viabilidad de las semillas mediante la tinción con tetrazolio, se centran en especies agrícolas, como soja, arroz, maní entre otros, dejando a un lado las especies forestales. El problema consiste en el desconocimiento de la actuación del Ácido Giberélico (AG3) en el porcentaje de germinación de las semillas Caoba (S. macrophylla) y Guayacán amarillo (H. chrysanthus), así mismo no se conocen porcentajes de viabilidad determinados con la prueba de tinción con sal de tetrazolio, por lo que permite inferir que no hay patrones de tinción determinados para estas especies.. 3.2. JUSTIFICACIÓN. Se seleccionan las especies Handroanthus chrysanthus y Swietenia macrophylla, debido a: tienen demanda comercial, no poseen paquete tecnológico completo, la estructura de las semillas son diferentes, y por último no se conocen ensayos con Ácido Giberélico (AG3) para estas especies. Así mismo, se resalta la especie Caoba (S. macrophylla) debido a que está incluida en los apéndices CITES a causa de la extracción selectiva, por la calidad de su madera, sufriendo así una sobreexplotación que no ha sido compensada. El Ácido Giberélico (AG3) es un método hormonal empleado para estimular la germinación de las semillas, debido a que incentiva la liberación de enzimas que ponen a disposición nutrientes requeridos por el embrión para su desarrollo. Las ventajas de 5.
(13) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. emplear este método se traducen en la emergencia de las semillas en poco tiempo y reducción de costos por establecimiento en vivero. La prueba de tinción con tetrazolio es una herramienta útil que permite conocer la viabilidad de los embriones y la capacidad que estos tienen para germinar. Lo anterior se puede traducir en una ventaja para el productor de semillas, debido a que permite evitar gastos innecesarios en procedimientos de secado, procesamiento, transporte, etc., de semillas inviables.. 3.3. FORMULACIÓN DE HIPÓTESIS 1. Para la prueba de germinación se tienen las siguientes hipótesis:. Hipótesis nula: H0 = El porcentaje de germinación de las semillas de Caoba (S. macrophylla) es igual en cada uno de los tratamientos pregerminativos al emplear Ácido Giberélico (AG3). H0 = El porcentaje de germinación de las semillas de Guayacán amarillo (H. chrysanthus) es igual en cada uno de los tratamientos pregerminativos al emplear Ácido Giberélico (AG3). H0 : T0 = T1 = T2 = T3. Hipótesis alterna: Hi = El porcentaje de germinación de las semillas de Caoba (S. macrophylla) es diferente en cada uno de los tratamientos pregerminativos al emplear Ácido Giberélico (AG3). Hi = El porcentaje de germinación de las semillas de Guayacán amarillo (H. chrysanthus) es diferente en cada uno de los tratamientos pregerminativos al emplear Ácido Giberélico (AG3). Hi: T0 ≠ T1 ≠ T2 ≠ T3. 6.
(14) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. IV. ESTADO DEL ARTE. 4.1. GENERALIDADES PARA LA ESPECIE FORESTAL: CAOBA (S. macrophylla) 4.1.1 Clasificación taxonómica Nombre Científico: Swietenia macrophylla Reino: Plantae División: Magnoliophyta Clase: Magnoliopsida Orden: Sapindales Familia: MELIACEAE. Nombres Vernáculos: Apamate, Mara, Palo Santo, Cedro Caoba, Caobo. Sinónimos: Swietenia macrophylla var. marabaensis Ledoux & Lobato 4.1.2. Estado de amenaza: CR. En Peligro Crítico.. Caoba (S. macrophylla) es una de las especies con mayor presión comercial y sus poblaciones han sido diezmadas rápidamente en todas sus áreas de distribución natural. Esta situación motivó a que fuera incluida en el apéndice II de la Convención sobre Comercio Internacional de Especies Amenazadas de Fauna y Flora (CITES) en el año 2002, siendo categorizada a nivel mundial como vulnerable (VU A1cd+2cd) (World Conservation Monitoring Centre, 1998) y a nivel nacional fue categorizada En Peligro Crítico (CR A2cd) debido a la reducción de sus poblaciones naturales en más del 80% (Cárdenas & Salinas, 2007). 4.1.3. Distribución geográfica. Se distribuye desde el sur de México hacia el sur hasta Colombia, Venezuela, Perú, Bolivia y Brasil (Céspedes et al., 2003). En Colombia se encuentra reportada en los departamentos de Antioquia, Bolívar, Córdoba, Guajira, Huila, Magdalena, Choco, Sucre y Santander (SIB, 2009b); con 99 registros de los cuales tan solo 34 de ellos se encuentran en cobertura boscosa (Cárdenas et al., 2015). 7.
(15) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. Figura 1. Distribución histórica de S. macrophylla. Obtenido de Cárdenas et al. (2015). 4.1.4. Descripción del hábitat. El hábitat natural de esta especie es bosques tropicales y subtropicales secos, húmedos y muy húmedos hasta 1500 m de altitud, con temperaturas mayores a 24°C y precipitaciones entre 1500 y 3500 mm. La especie se encuentra en sitios planos con pendientes moderadas hasta de 15%, suelos arcillosos o franco arenosos medianamente fértiles, profundos y bien drenados con pH entre 6.9 y 7.7 (López & Cardenas, 2002; Céspedes et al., 2003; CATIE, 1997; Cárdenas et al., 2015).. 8.
(16) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. 4.1.5. Gremio ecológico. Caoba (S. macrophylla) es una especie heliófita durable (López & Cardenas, 2002). 4.1.6. Descripción. Esta especie es monoica, puede alcanzar entre los 15-45 m de altura, tiene fuste recto cilíndrico, con raíces tablares. Corteza externa marrón con tintes grisáceos y con fisuras superficiales, madera interna amarilla, albura rosada a rojiza. Ramas jóvenes delgadas, con lenticelas pequeñas y abundantes. Hojas compuestas, alternas, paripinnadas de 1530 cm, raquis glabro, con 3 a 6 pares de foliolos, opuestos o subopuestos, cartáceos, ovado lanceolados, ápice agudo o acuminado, base ligeramente redondeada, cordada y asimétrica, haz verde claro y envés verde oscuro (López & Cárdenas, 2002; CATIE, 1997.). Inflorescencias: usualmente axilares, muy ramificadas de 10-18 cm de largo, glabras, formando fascículos o panículas de color blanco verdoso, con flores pequeñas de cinco pétalos blancos amarillentos y diez estambres castaños diminutos. (López & Cárdenas, 2002; CATIE, 1997) Frutos: capsulares erectos, alargado-ovoide a veces en forma de pera (López & Cardenas, 2002) a elíptica (Alvarenga & Flores, 1988) , de 10-16 cm de largo y 6-8 cm de diámetro, gris-café oscuro, valvas exteriores leñosas, interiores mucho más delgadas y manchadas de café y blanco, semillas 7-10 cm de largo incluyendo el ala, de color café oscura y lustrosa (López & Cardenas, 2002), leñosos, dehiscentes, pentacarpelar, con carpelos cerrados. El promedio de semillas es de 60-57 por fruto y de 12-11 por lóculo (Alvarenga & Flores, 1988; CATIE, 1997). Semillas: anemócoras, diásporas aladas, localizadas en el extremo distal del fruto, dispuestas verticalmente en los lóculos, en forma estratificada y se mantienen unidas a la placenta por medio de un funículo largo y delgado, presentan un ala larga color pardo claro, constituida por un tejido parenquimático, esponjoso, de origen tegumentario. El hilo es de color pardo oscuro prominente, cubierto con tricomas. En un extremo del hilo se encuentra incluido el micrópilo. El tegmen es delgado unido a los cotiledones. El embrión presenta dos cotiledones grandes y carnosos. La plúmula y la radícula son inconspicuas. El material de reserva es endosperma (Alvarenga & Flores, 1988).. 9.
(17) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. Figura 2. Morfología de la semilla de la especie forestal Caoba (S. macrophylla). er: región del embrión, hr: región hilar, mi: micrópilo, mr: región media, te: testa, tg: tegmen, vb: haz vascular. Escala de barras= 3 mm. (Adaptado de Paiva et al., 2006). 4.1.7. Usos e importancia. Según Negreros et al. (2014), la especie forestal Caoba (S. macrophylla) es la especie comercial más importante de América Latina, por sus diferentes usos: reforestación en zonas degradadas, empleada en sistemas agroforestales y apicultura, su madera sirve para elaborar artesanías, instrumentos musicales, construcciones rurales, curtiente, implementos agrícolas, embarcaciones, partes de molinos, muebles de lujo, gabinetes entre otros. El aceite extraído de sus semillas es utilizado para preparar cosméticos. El fruto seco se emplea artesanalmente para formar arreglos florales. Tanto la corteza como la semilla se usan medicinalmente para tratar diarrea, fiebre y dolor. 4.1.8. Calidad física de las semillas. Peso: Según el CATIE (1997) el número de semillas por kg, varía entre 1800 a 2500, dato aproximado al que registra Cárdenas et al. (2015) de 1300 a 2000 semillas por kg. Además, Rodríguez & Nieto (1999) registran que el peso de 1000 semillas es de 771,64 gr y por kg son un total de 1283 semillas. Por otro lado, Negreros et al. (2014) indican que el peso por semilla en promedio es de 0,66 gr, tomando como referente 1500 semillas por kg.. 10.
(18) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. Pureza: CATIE (1997) reporta que el porcentaje de pureza es del 95 al 99%, al igual que los resultados de Samaniego et al. (1994) de 98,85%. En contraste, Rodriguez & Nieto (1999) indican que el porcentaje de pureza es de 84,26%. Contenido de humedad: El contenido de humedad varía entre el 9 y 12 % (CATIE, 1997). Por otro lado, Rodriguez & Nieto (1999) registran que el contenido de humedad es de 59,19%, a pesar de que Samaniego et al. (1994) reporta que el contenido de humedad es de 4,8%. Viabilidad: En los estudios realizados por Alvarenga & Flores (1988) los índices de viabilidad superan el 90%. Por otro lado, Cárdenas et al. (2015) indican que por fruto se pueden encontrar alrededor de 40 a 60 semillas viables. Además de ello, el Banco de Semillas Forestales, BSF & CATIE (1995) reportan que por kg se encuentran 1450 semillas viables. 4.1.9. Germinación. La especie presenta una germinación hipogea con alta capacidad de germinación y establecimiento de plántulas, incluso con capacidad de regeneración en potreros (Gerhardt, 1996; citado por Alcala, 2011 ), sin embargo Grogan & Galvão (2006, citado por Alcala, 2011) expresan que son necesarias condiciones micro ambientales propias de un dosel cerrado para que la especie germine. Gutiérrez et al. (2011) obtuvieron un porcentaje de germinación de 34%, representada por 98 semillas germinadas (de 300 semillas sembradas). Samaniego et al. (1994) reportan que a nivel de laboratorio la germinación se inicia a los 8 días y finaliza a los 21 días. Por otro lado, Negreros et al. (2014) indican que la especie requiere de 10-40 días para su germinación con un porcentaje de germinación del 95%.. 11.
(19) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. Figura 3. Descripción de la morfología de las semillas y el desarrollo del embrión de Swietenia macrophylla, antes de la germinación. Adaptado de los resultados de Alvarenga & Flores (1988).. 4.1.10 Tratamientos pregerminativos De acuerdo con el CATIE (1997) y Cárdenas et al. (2015), esta especie no requiere de tratamientos pregerminativos. Los anteriores autores indican que se puede sembrar en camas germinadoras o directamente en bolsas, colocando en este caso de 1 a 2 semillas por bolsa, en un lugar ligeramente sombreado y con buena humedad. La profundidad de siembra recomendable es de 2 a 3 cm en el sustrato, ya sea acostada o vertical, con el lado del ala hacia arriba. En contraste con lo anteriormente mencionado, Samaniego et al. (1994) realizaron diferentes tratamientos pregerminativos, los cuales consistían en 1. Testigo. 2. Imbibición de la semilla en agua durante 24 horas. 3. Corte opuesto al embrión. 4. Imbibición en ácido giberélico (10, 100 y 500 ppm). El tratamiento que les presento mejores resultados en relación a la germinación fue la imbibición de la semilla por 24 horas (77%), y en segundo lugar la inmersión en giberelina a 100 ppm por 26 horas (logrando una germinación del 72,73% de las semillas tratadas).. 12.
(20) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. En cuanto a sus requerimientos climatológicos, Samaniego et al. (1994) expresan que la temperatura para maximizar la germinación debe ser constante (30°C), en cuanto al pH del sustrato, este debe ser neutro y por último se recomienda luz controlada (16 h luz y 8 h sin luz) para la germinación de las semillas. La FAO et al. (2010) recomiendan quitar las alas de las semillas, protegiendo las semillas con media sombra a dos metros de altura como se muestra en la siguiente figura:. Figura 4. Disposición de la media sombra. Obtenido de FAO et al. (2010). 4.1.11 Imbibición Según Paiva et al. (2006) el inicio de imbibición es rápido, el cual se presenta a los 30 minutos de sumergida la semilla, absorbiendo la semilla 30 mg/cm 2. Por otro lado, Alvarenga & Flores (1988) evaluaron la germinación de esta especie, determinando que el tiempo requerido de imbibición es de 48 horas, tiempo al cual la semilla aumenta de volumen y el micrópilo y el hilo se ensanchan. 4.1.12 Floración y fructificación Según CATIE (1997) la floración de Caoba (S. macrophylla) comienza entre los 12 y 15 años en los meses de noviembre a marzo. La fructificación se da en marzo y desde agosto hasta diciembre, sin embargo Cárdenas et al. (2015) indican que el periodo de floración es de abril a junio para la parte norte y central de Suramérica, y la época de producción 13.
(21) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. de semillas es variable respecto al área. Para el caso de Colombia, la fructificación se da entre los meses de febrero a abril y de agosto a diciembre, la floración según Negreros et al. (2014) ocurre en abril. Tabla 1. Cuadro fenológico de la especie S. macrophylla.. Meses. Ene Feb Mar Abr May Jun Jul Ago Sep Oct Nov Dic Fructificación. Floración Fuente: Adaptado de CATIE, 1997. Para el caso del bioma Amazónico FAO et al. (2010) destacan que la temporada de floración es en los meses de julio a noviembre y la temporada de fructificación donde la semilla está madura es en los meses de mayo a agosto (Gullison et al., 1996).. 4.2 GENERALIDADES PARA LA ESPECIE FORESTAL: GUAYACÁN AMARILLO (H. chrysanthus) 4.2.1 Clasificación taxonómica Nombre Científico: Handroanthus chrysanthus Reino: Plantae División: Magnoliophyta Clase: Magnoliopsida Orden: Sapindales Familia: BIGNONIACEAE. Nombres Vernáculos: Lapacho amarillo, guayacán, guayacán amarillo, tahuarí, flor amarilla, puy, cañaguate, cañaguate, chicalá, polvillo, roble amarillo, araguaney, guayacán polvillo, palo de arco, abejón. Sinónimos: Bignonia chrysantha Jacq., Tabebuia chrysantha (Jacq.) G.Nicholson, Tabebuia rufescens J.R.Johnst., Tecoma chrysantha (Jacq.) DC., Tecoma evenia Donn.Sm., Tecoma palmeri Kraenzl.. 14.
(22) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. 4.2.2 Estado de amenaza: NE. No Evaluado. 4.2.3 Distribución geográfica Se distribuye en el trópico americano desde México, Venezuela, Ecuador, Colombia y Perú (Escobar & Suarez, 2013). En Colombia se encuentra en los departamentos de Amazonas, Bolívar, Cesar, Chocó, Córdoba, Guaviare, Magdalena y Tolima (SIB, 2009a). 4.2.4 Descripción del hábitat El hábitat de esta especie es bosque seco tropical y bosque húmedo tropical, entre 0 – 1500 msnm, con temperaturas entre 18 – 24 ° C y precipitaciones entre 1000 a 2000 mm (Becerra & Silva, 2010), con una evapotranspiración promedio para el bosque seco tropical de 920 mm y para el bosque húmedo de 1400 mm (Arevalo et al., 2000). Se desarrolla en bosques primarios y secundarios, con suelos arenosos o franco arenosos, profundos, fértiles, aluviales, con pH entre 5,5 y 6,5, de buen drenaje, aunque tolera suelos poco drenados, con inundaciones temporales, las deficiencias de fosforo desfavorece su desarrollo (Escobar & Suarez, 2013). 4.2.5 Gremio ecológico El gremio ecológico de esta especie es heliófita durable (Escobar & Suarez, 2013). 4.2.6 Descripción Árbol: caducifolio de gran porte, alcanzando 20 metros de altura y 60 cm de diámetro, con fuste recto y con corteza de color grisáceo a marrón oscuro con grietas verticales profundas, la raíz principal es pivotante y las secundarias semisuperficiales (Becerra & Silva, 2010). Hojas: digitado-compuestas, opuestas, sin estipula, con 5 foliolos de forma lanceolada a elípticas, borde liso a ligeramente aserrado hacia el ápice el cual es cortamente acuminado, la base es aguda a redondeada. Hoja membranácea hasta rígido-cartáceas. 15.
(23) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. de color verde oscuro con el envés densamente cubierto por pelos estrellados de color canela. (Escobar & Suarez, 2013 & Gómez et al., 2013) Inflorescencias: panículas terminales, con flores amarillas con líneas rojas por dentro de los pétalos, cáliz en forma de campana y corola en forma de embudo. (Gómez et al., 2013) Frutos: vainas delgadas de hasta 40 cm de longitud, los cuales maduran a los dos meses después de la floración, con dehiscencia longitudinal (Gómez et al., 2013 & López et al., 2006). Semillas: aplanadas doblemente aladas asimétricas e irregulares y papiráceas blancas (Escobar & Suarez, 2013).. Figura 5. Semillas de Handroanthus chrysanthus. (A) aspecto general de las semillas: cara dorsal: (B) aspecto general de las semillas: cara ventral; (C) embrión cubierto con envoltura coriácea, señalando la radícula.. 4.2.7 Usos e importancia Según el CATIE & OFI (2003) la especie forestal Guayacán amarillo (H. chrysanthus) es utilizada por su madera, debido a su peso, durabilidad, y resistencia al comején. De igual manera se utiliza en sistemas silvopastoriles, para dar sombra a cultivos; como ornamental, y para la producción de miel. Su corteza es empleada medicinalmente para tratar el paludismo.. 16.
(24) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. 4.2.8 Calidad física de las semillas Peso: CATIE (2000) reporta que por kilogramo hay de 40.000 a 55.000 semillas. Siendo el peso de 1000 semillas de 21,9 gr. Pureza: Según el CATIE (2000) la pureza de esta semilla es del 85 al 95%. Contenido de humedad: Según el CATIE (1995) las semillas de Guayacán amarillo (H. chrysanthus) tienen un contenido de humedad del 7-9 %. Sin embargo, Rodríguez & Nieto (1999) reportan que el contenido de humedad es del 26,8 %. 4.2.9 Germinación De acuerdo con Escobar & Suarez (2013) las semillas tienen germinación errática, iniciándose a los 15 días hasta los 6 meses. Por otro lado, el CATIE (1999) reporta que la germinación es epigea y se da inicio de 7 a 15 días después de sembrada y finaliza a los 25 días, con un porcentaje de germinación del 60 a 80%. 4.2.10 Tratamientos pregerminativos En concordancia con el CATIE (1999) y Trujillo (2007), el tratamiento pregerminativo que se puede emplear para esta especie es la inmersión en agua a temperatura ambiente por 24 a 48 horas. De igual modo, Luzuriaga & Reyes (2014) determinan que con la inmersión de las semillas por 24 horas, se obtiene un potencial germinativo del 29%. 4.2.11 Imbibición La literatura no reporta curvas de imbibición para esta especie, sin embargo se recomienda la imbibición de las semillas por 24 horas (Trujillo, 2007; Alvarado & Encalada, 2010). 4.2.12 Floración y fructificación Según Justiniano et al. (2000), la floración de Guayacán amarillo (H. chrysanthus) en Bolivia, ocurre en los meses de julio a septiembre, la fructificación se da en los meses de agosto a octubre. Para el caso de Colombia, la floración y fructificación se presenta durante todo el año (CATIE, 1999). 17.
(25) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. 4.3. GENERALIDADES DE LA SEMILLA. La semilla es el embrión de la planta que ha alcanzado la madurez y se encuentra en estado de “vida latente”. Puede permanecer en este estado durante mucho tiempo, de acuerdo a la especie. Cuando la semilla encuentra las condiciones ambientales adecuadas, germinará. 4.3.1 Partes de la semilla. Figura 6. Estructura interna y detalles de la estructura externa. (Centro Internacional de Agricultura Tropical, 1983). . Cubierta seminal:. También llamado epispermo, que deriva de la transformación del tegumento. Estructura que cubre el eje embrionario y los cotiledones. . Hilo: cicatriz en la superficie de la testa, formada por la ruptura del funículo que une el ovulo fertilizado al ovario. Micrópilo: parecido a un poro pequeño, donde se había producido la entrada del tubo polínico en el ovulo y es por donde se dirige la radícula en la germinación.. 18.
(26) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. . Embrión:. Es una plántula diminuta dentro de las semillas, la cual se desarrolla por la unión entre el gameto masculino y femenino durante la fecundación. Se diferencian tres partes dentro del embrión: . Radícula: Parte que emerge en primer lugar, dando origen a la raíz primaria. Plúmula: También llamado epicótilo, ubicado por encima del nudo cotiledonar y da origen a la parte aérea de la planta. Hipocotíleo: Región entre el nudo cotiledonar y la radícula. Cotiledones: Sirven como reserva alimenticia y dan formación a las primeras hojas. Según el número de cotiledones, se puede dividir la semilla en monocotiledónea (un cotiledón) o dicotiledónea (dos cotiledones).. 4.3.2 Viabilidad La viabilidad de las semillas, hace referencia a su capacidad de germinar y de originar plántulas normales en condiciones ambientales favorables (F. Pérez & Pita, 2001). Para evaluar y determinar rápidamente la viabilidad de semillas de especies que normalmente germinan con lentitud o muestran latencia cuando se le aplican los métodos de germinación normales, se realizan los siguientes test: . Prueba de incisión o corte. El ensayo de corte trata de obtener una idea aproximada de la vitalidad de la semilla mediante una inspección visual directa de las semillas, previamente cortadas longitudinalmente dejando a la vista el embrión y principalmente su raicilla. Del aspecto de ésta y de los cotiledones se desprenden las mayores o menores condiciones de vida que reúne una semilla. De acuerdo a esto se pueden agrupar las semillas en tres grupos (Prats, 1944): . Semillas de aspecto completamente sano.. . Semillas de aspecto dudoso.. . Semillas en mal estado o vanas.. La FAO (1991) da las siguientes indicaciones para la evaluación de la prueba de corte: Si el endospermo tiene un color normal y el embrión está bien desarrollado, la semilla tiene 19.
(27) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. muchas posibilidades de germinar; las semillas no viables presentan el embrión lechoso, poco firme, mohoso, podrido, consumido o con olor rancio ;y se puede distinguir las semillas abortivas debido a que carecen de embrión. Con este ensayo no es posible distinguir las semillas moribundas, recién muertas o recién dañadas debido a que siguen teniendo el mismo aspecto que las semillas viables, por último, recomienda este ensayo al término de un ensayo de germinación para determinar la viabilidad aparente de las semillas que no han germinado. . Prueba de tetrazolio. Este ensayo es indicado para conocer la viabilidad de semillas que presentan dormición, o tienen velocidad de germinación muy baja; el sustento para ensayo bioquímico, son los procesos reductores que tienen lugar en las células vivas que se hacen visibles por la reducción del indicador, conocido como sal de tetrazolio que se hace penetrar en el interior de la semilla. Esta solución se interfiere en los tejidos de las semillas con los procesos reductores de las células vivas y se apodera del hidrogeno liberado por deshidrogenasas. Por hidrogenación del cloruro de 2, 3, 5 trifeniltetrazolio, se forman en las células vivas Trifenil-Formasan la cual es una sustancia roja, estable y no difusible (Ministerio de agricultura, 1984). Criterios para la evaluación de semillas mediante el análisis de tetrazolio: Con el ensayo se pueden distinguir las partes vivas de la semilla (las cuales se colorean de rojo) y las partes muertas (no se colorean). Adicionalmente, se pueden determinar semillas parcialmente coloreadas, observándose los tejidos con necrosis en diversas partes de la semilla. La viabilidad de la semilla depende de la localización y extensión de la necrosis en el embrión y/o en el endospermo, mas no en la intensidad de la coloración. Los resultados de la prueba de tinción se pueden comparar con una prueba de germinación (Ministerio de agricultura, 1984). Al realizar la prueba de tinción, el embrión no necesita estar completamente teñido para ser capaz de germinar, por tal motivo existen diagramas de mapas de tinción de varios tipos de semillas, los cuales permiten al analista la distinción entre semillas viables y no viables (Figura 7); Rao et al. (2006) expresan que los tonos rosados y rojos muy oscuros, indican que el tejido está muerto.. 20.
(28) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. Figura 7. Patrón de tinción después de la prueba con tetrazolio en semillas dicotiledóneas. Los números del 1 al 6 son semillas germinables; 7 al 15 son semillas no germinables. Obtenido de Rao et al. (2006). Análisis de semillas de especies dicotiledóneas . Semillas viables (Moreno, 1984):. . Estructuras del embrión bien desarrollado, intacto y con una coloración rojo normal. Los embriones de semillas viables pueden presentar el siguiente tipo de daño: Pequeñas áreas necróticas en los cotiledones, excepto en el área de unión del eje embrionario y los cotiledones. Pequeñas áreas necróticas en la parte distal de la ridícula. Semillas no viables (Moreno, 1984): Embrión completamente sin colorear. Un poco más de la punta de la radícula sin teñir. Más de la mitad del cotiledón sin teñir. Áreas necróticas profundas en la unión del cotiledón y el eje embrionario, o sobre la ridícula. Radícula fracturada Semilla inmadura o con desarrollo deficiente. 21.
(29) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. Cálculo y registro de los resultados. En cada repetición de la prueba se cuentan las semillas viables. El resultado final, es el porcentaje de las semillas viables de los resultados de las cuatro repeticiones.. 4.4. GERMINACIÓN. CATIE (1996) define la germinación, como la reanudación del crecimiento de los embriones que son activados al estar expuestos a condiciones favorables, los cuales permiten convertir la semilla en una plántula autosuficiente. En adición, la FAO (1991) determina que la germinación se expresa como el porcentaje de semillas puras que produce plántulas normales o como el número de semillas que germinan por unidad de peso de la muestra. 4.4.1. Proceso de germinación. Figura 8. Curva de absorción de agua en las diferentes fases de germinación. Obtenido de Herrera, Alizaga, Guevara, & Jimenez (2006). 22.
(30) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. . Fase I _ Imbibición: Consiste en la absorción del agua necesaria para la rehidratación de proteínas y organelos celulares, así como para el transporte y para que ocurran las reacciones hidrolíticas. En esta fase se da el hinchamiento de la semilla causando la ruptura de la testa.. . Fase II _ Germinación: En esta fase se produce la activación del metabolismo, donde ocurre la síntesis de ácidos nucleicos y proteínas; también se incrementan las actividades enzimáticas y se degradan las reservas iniciales.. . Fase III _ Crecimiento: En esta fase se da el crecimiento y división celular que provoca la emergencia de la radícula y posteriormente la plúmula. En esta fase se vuelve a aumentar la absorción de agua (Figura 8). 4.4.2 Factores que afectan la germinación. . Factores endógenos . . Semillas con cubierta dura: muchas semillas tienen la testa dura o impermeable, lo que impide la imbibición del agua para iniciar la germinación. Típico de las leguminosas. Inhibidores químicos. Embriones inmaduros.. Factores Ambientales Según Gliessman (2002) los factores ambientales que afectan la germinación de la semilla son: . Profundidad de la semilla: según la profundidad del suelo las condiciones cambian, debido a esto, cada semilla tiene recomendaciones de profundidad según las condiciones mejores para la germinación.. 23.
(31) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. . Luz: algunas semillas requieren de luz para germinar y otras son inhibidas por la luz. Precipitación: factor determinante, ya que influye en la humedad del suelo y su efecto directo en la semilla. Temperatura: cada especie tiene temperaturas óptimas para la germinación ligeramente diferentes. Factores bióticos, viento, fuego. Cobertura del suelo: la materia orgánica sobre la superficie del suelo incide en la germinación de la semilla al alterar el movimiento del agua, la temperatura del suelo, la disponibilidad de luz.. 4.4.3 Expresión de resultados El análisis de los resultados de los ensayos de germinación se puede mostrar de diferentes maneras: . Porcentaje de germinación:. Este término determina el porcentaje real de todas las semillas de la muestra que han germinado durante la prueba y desarrolla plántulas normales debido a condiciones ambientales óptimas para su crecimiento. . Tiempo medio de germinación. Es el tiempo promedio requerido por las semillas para que el porcentaje de germinación final se genere. . Energía germinativa. Este término representa el porcentaje de semilla de la muestra que ha germinado durante la prueba hasta el momento en que la cantidad de semilla que germina por día llega a su máximo. . Velocidad media de germinación. Este término busca determinar el número de semillas germinadas por día.. 24.
(32) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. . Valor de germinación:. Según la FAO (1991), este término tiene por finalidad combinar en una sola cifra una expresión de la germinación total al término del período de ensayo y una expresión de la energía o velocidad de germinación. La germinación total se expresa en forma de germinación diaria media (GDM) (final), que se calcula como el porcentaje acumulado de semillas germinadas al final del ensayo dividido por el número de días que transcurren desde la siembra hasta el término del ensayo. La velocidad de germinación se expresa en forma de valor máximo (VM), que es la germinación diaria media máxima (porcentaje acumulado de germinación de semilla llena dividido por el número de días transcurridos desde la fecha de siembra) que se alcanza en cualquier momento del período del ensayo.. 4.5. ÁCIDO GIBERÉLICO. La fitohormona: giberelina, comprende el grupo más numeroso de hormonas vegetales conocidos en la actualidad. Conociéndose más de 40 giberelinas aisladas, variando en estructura y actividad, siendo la más destacada AG3 (ácido giberélico) obtenido del hongo Giberella fujikuroi (Lluna, 2006), el cual cuando se presenta un ataque en sí del hongo, produce un crecimiento excesivo de los tallos y los brotes. Las giberelinas por lo tanto, actúan como reguladores endógenos del crecimiento y el desarrollo en los vegetales superiores. Los efectos más evidentes se observan en la estimulación del crecimiento del tallo, la inducción del desarrollo del fruto y la germinación de las semillas (Azcón-Bieto & Talón, 2013). Generalmente, se encuentran mayores niveles de giberelinas en las partes reproductivas respeto a las partes vegetativas, y en partes jóvenes en relación con las maduras. De esta manera se encuentran con facilidad en ápices de tallos y raíces, en hojas jóvenes, partes florales, semillas inmaduras y embriones en germinación (Cruz et al., 2006). 4.5.1 Naturaleza química Las giberelinas son compuestos que contienen un esqueleto gibane y propiedades biológicas apropiadas, aunque también se refiere que todas las giberelinas contienen el esqueleto del enantiomero de giberelano (ent-giberelano) con fórmula química es C19H22O6, este esqueleto tiene la ventaja de utilizar un sistema de numeración que corresponde al de otro diterpenos cíclicos, categoría a la que pertenecen todas las. 25.
(33) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. giberelinas. Aunque en las plantas se encuentran muchas clases de giberelinas naturales, el ácido giberélico (AG3) es el más empleado para aplicaciones exógenas en vista de que es producido en cultivos de hongos encontrándose disponible comercialmente. El ácido giberélico tiene 8 átomos asimétricos de carbono, presentando 256 isómeros (Weaver, 1976).. Figura 9. Estructura química de GA3. Obtenido de Azcón-Bieto & Talón (2013). 4.5.2 Actividad biológica Las giberelinas biológicamente activas, actúan como reguladores esenciales del desarrollo de las plantas, modulando diferentes respuestas del crecimiento como la germinación de semillas, el crecimiento del tallo, la partenocarpia, la expansión foliar, la elongación de la raíz, la floración y la liberación de enzimas hidrolíticas en algunos tejidos (Cruz et al., 2006). 4.5.3 Mecanismo de acción Según Weaver (1976) las giberelinas pueden terminar con el reposo de las semillas de muchas especies, debido a que las giberelinas pueden provocar cambios a nivel genético que estimulan a su vez la síntesis enzimática en las células. La acción de la giberelina tiene relación con la síntesis del mensajero RNA, dirigida por el DNA, en el núcleo. Weaver refiere que se cree que las giberelinas modifican el RNA producido en los núcleos, y así 26.
(34) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. puede este ejercer su control sobre la expansión celular, así como otras actividades de crecimiento y desarrollo vegetal. 4.5.4 Efectos fisiológicos Las giberelinas pueden generar alargamiento de plantas intactas, observándose en el crecimiento del vástago, o a menudo los tallos se vuelven largos y delgados, con pocas ramas. Así mismo, las giberelinas estimulan la división celular afectando tanto a las hojas como a los tallos (Lluna, 2006). En la siguiente tabla se relacionan los aspectos fisiológicos correspondientes con las Giberelinas: Tabla 2. Efectos fisiológicos por la fitohormona Giberelina.. Efecto Fisiológico. Efecto. Respuestas trópicas. Si Crecimiento de secciones de coleóptilos de avena. A veces Aumento del tamaño celular en cultivo de tejidos. Si, en algunos casos Control de la diferenciación en cultivo de tejidos. Si Estimula el enraizamiento en estaquillas. No Inhibe el desarrollo radicular. No Estimula la división del cambium. Si Abscisión de hojas y frutos. No directamente Activa el crecimiento de frutos. Si Afecta al crecimiento del tallo. Si, lo activa Interrumpe el reposo de las yemas vegetativas. Si Favorece la germinación en algunas semillas. Si Favorece la síntesis de α-amilasa en granos de cereal. Si Mantenimiento de la dominancia apical. Si Inhibe la degradación de proteínas y clorofilas en la senescencia. Si Aumenta la respiración del fruto durante la maduración. No Fuente: Adaptado de Pérez, F y Martínez-Laborde, J.B. (1994) citado por Lluna (2006). Relativo a lo mencionado, las giberelinas estimulan el proceso de germinación de las semillas, a causa de que, en algunas especies suplen los requerimientos de luz o frio que precisan las semillas para germinar. Así mismo lo refiere el modelo de Khan (Bidwell, 1993), el cual dice que la giberelina es necesaria para la germinación y su ausencia da por resultado un inevitable letargo, este presente o no un inhibidor. La Figura 10, muestra 27.
(35) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. como la giberelina junto con las bajas temperaturas, la estimulación por la luz roja mediada por el fitocromo conduce a un incremento de la biosíntesis de AGs activas. Estos estímulos inhiben la expresión de AG 2-oxidasas y estimulan los transcritos de AG3oxidasas, induciendo así el crecimiento del embrión.. Figura 10. Modelo de activación de la germinación de semillas por las giberelinas. Obtenido de Azcón-Bieto & Talón (2013). 4.5.5 Ensayos con Giberelina Los tratamientos con AG3 pueden superar el letargo fisiológico de semillas, se usa el AG3 a una concentración de 500 ppm generalmente, aunque la gama de usos va de 200 a 10.000 ppm; para las concentraciones superiores a 800 ppm se recomienda la adición de una solución amortiguadora (Arevalo Proaño, 1998). Por otro lado, Zabaleta et. al (2010; citado por Escobar & Suarez, 2013) refieren que las aplicaciones en muy bajas concentraciones pueden resultar en buenos resultados, mientras que concentraciones muy altas pueden dar el efecto negativos.. 28.
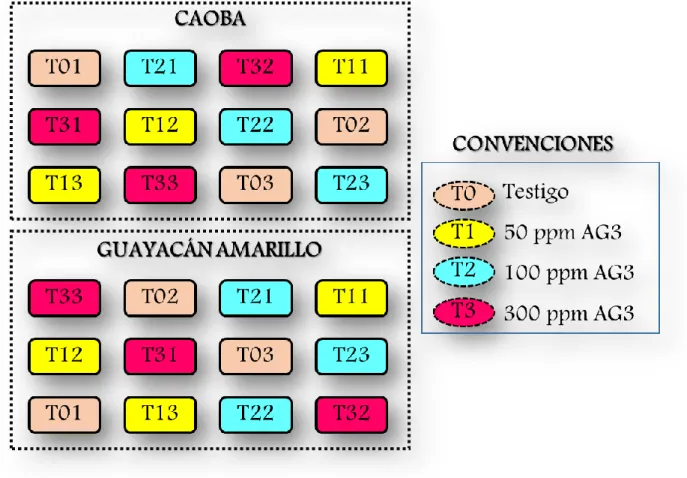
(36) “DETERMINACIÓN DE LOS PATRONES DE TINCIÓN Y EFECTO DE LA GIBERELINA SOBRE LA GERMINACIÓN DE LAS SEMILLAS DE CAOBA (Swietenia macrophylla) Y GUAYACÁN AMARILLO (Handroanthus chrysanthus)”. V.MATERIALES Y MÉTODOS. 5.1 ÁREA DE ESTUDIO El análisis de la calidad física de las semillas se llevó acabo en el laboratorio de silvicultura y de fisiología de la Universidad Francisco José de Caldas - sede vivero (Facultad de Medio Ambiente y Recursos Naturales). Las pruebas de germinación y viabilidad se realizaron en el invernadero tradicional de la sede administrativa de la empresa El Semillero S.A.S, bajo las siguientes condiciones climáticas: Temperatura promedio 29ºC y Humedad Relativa del 100%.. 5.2 MATERIAL EXPERIMENTAL Se utilizaron semillas de las especies forestales Caoba (S. macrophylla) y Guayacán amarillo (H. chrysanthus), Acido giberélico (PROGIBB ® 10SP), Sal de Tetrazolio y Turba; suministradas por la empresa El Semillero S.A.S.. 5.3 METODOLOGÍA 5.3.1. Prueba de Imbibición. Para realizar la prueba de imbibición se utilizaron los siguientes materiales: . Vasos de precipitado Toallas absorbentes Agua destilada Balanza analítica. Se utilizaron dos muestras de 3,5 g para las semillas de Caoba (S. macrophylla) y 0,5 g para las semillas de Guayacán amarillo (H. chrysanthus); para esta última especie se les retiro las alas con el fin de no tener alteración en el peso. Posteriormente se depositaron en un recipiente y se cubrieron con agua. Los datos fueron tomados cada hora hasta tener un peso constante. Con los datos obtenidos se realizó la curva de imbibición de las semillas: Cantidad de agua imbibida (%) vs. tiempo (t), en la cual:. 29.
Figure




Documento similar
Where possible, the EU IG and more specifically the data fields and associated business rules present in Chapter 2 –Data elements for the electronic submission of information
The 'On-boarding of users to Substance, Product, Organisation and Referentials (SPOR) data services' document must be considered the reference guidance, as this document includes the
In medicinal products containing more than one manufactured item (e.g., contraceptive having different strengths and fixed dose combination as part of the same medicinal
Products Management Services (PMS) - Implementation of International Organization for Standardization (ISO) standards for the identification of medicinal products (IDMP) in
Products Management Services (PMS) - Implementation of International Organization for Standardization (ISO) standards for the identification of medicinal products (IDMP) in
This section provides guidance with examples on encoding medicinal product packaging information, together with the relationship between Pack Size, Package Item (container)
Package Item (Container) Type : Vial (100000073563) Quantity Operator: equal to (100000000049) Package Item (Container) Quantity : 1 Material : Glass type I (200000003204)
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi