Influencia de la dosificación de carragenina natural sobre la eficiencia de inhibición de la corrosión del acero astm a335 grado p22 en h2so4 1,0 m a temperaturas de 25 ºc, 45 ºc y 65 ºc
Texto completo
(2) UNIVERSIDAD NACIONAL DE TRUJILLO FACULTAD DE INGENIERÍA ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA METALÚRGICA. TESIS. INFLUENCIA DE LA DOSIFICACIÓN DE CARRAGENINA NATURAL SOBRE LA EFICIENCIA DE INHIBICIÓN DE LA CORROSIÓN DEL ACERO ASTM A335 GRADO P22 EN H2SO4 1,0 M A TEMPERATURAS DE 25 ºC, 45 ºC Y 65 ºC. PARA OPTAR EL TÍTULO DE INGENIERO METALURGISTA. BACHILLERES: Aguirre Gonzáles, Cristhian Arnold Juárez Vílchez, Paul Abel. ASESOR: Dr. Ing. Zavaleta Gutiérrez, Nilthon Emerson. TRUJILLO – PERÚ 2018.
(3) DEDICATORIA A DIOS Agradecer a nuestro Padre del cielo por el don de la vida y porque siempre he sentido su presencia protectora a lo largo del camino. A MI MAMÁ RAQUEL VÍLCHEZ Por darme la vida y guiarme en el camino correcto. Gracias por tu amor, sacrificio, comprensión y apoyo incondicional en todo momento. Este logro es tuyo. Eres y serás mi más grande ejemplo de vida. También quiero agradecer a mi papá Juan Julio porque me ilumina y cuida desde el cielo. A MIS HERMANOS VIVIANA CELESTE, MARTIN N., JULIO D. Y J. DANIEL Por la confianza, el apoyo incondicional y el cariño constante que saben darme en todo momento. Este logro también es para ustedes. A MI ASESOR, DR. ING. NILTHON ZAVALETA Por sus enseñanzas, apoyo y dedicación constante para hacer realidad el presente trabajo. Ing. Elmer Polo, por su apoyo brindado y a todo el personal del laboratorio de corrosion y proteccion de metales. A MARÍA ELISA Gracias por el apoyo, comprensión y confianza que me has dado en los momentos difíciles.. PAUL JUÁREZ. i.
(4) DEDICATORIA Dedico este trabajo de investigación a Dios por darme la vida y salud para poder concluir con esta etapa universitaria y bendecir mi vida. A mis padres, Hermes y Nelly, a quienes agradezco su ayuda incondicional, su cariño y el apoyo económico brindado. Dedicado también a los ingenieros docentes de la Escuela Académico Profesional de Ingeniería Metalúrgica, los cuales transmiten los conocimientos de la metalurgia y sus experiencias del campo de acción minero-metalúrgico.. AGRADECIMIENTO Mi especial agradecimiento al Dr. Ing. Nilthon Zavaleta Gutiérrez por su asesoría y apoyo en el desarrollo de este trabajo de investigación, su continua enseñanza en los ensayos; así también, al personal del laboratorio de Corrosion y Proteccion de metales involucrados en el trámite de esta investigación.. CRISTHIAN AGUIRRE. ii.
(5) ÍNDICE Agradecimientos y dedicatorias……………………………………………………………..…i Índice………………………………………………………………………………………….iii Listado de tablas…………………………………………………………………………….…v Listado de figuras……………………………………………………………………………viii Resumen…………………………………………………………………………………….…x Abstract………………………………………………………………………………….……xi. 1.. INTRODUCCIÓN............................................................................................................1. 1.1. Realidad problemática......................................................................................................1 1.2. Antecedentes…………………………………………………………………………….2 1.2.1. Inhibidores de corrosión en ácido sulfúrico……………………………………………..3 1.2.1.1. Inhibidores corrosión por adsorción física……………………………………………3 1.2.1.2. Inhibidores corrosión por adsorción química…………………………………………8 1.3. Marco teórico…………………………………………………………………………..10 1.3.1. Chondracanthus chamissoi……………………………...………………………..……10 1.3.2. Acero ASTM A335 grado P22…………………………………………………………11 1.3.3. Inhibidores de corrosión……………………………………………………………..…12 1.3.4. Isotermas de adsorción………………………………………………………………....15 1.3.5. Parámetros termodinámicos de las isotermas de adsorción…………………………….17 1.3.6. Métodos electroquímicos para evaluar la velocidad de corrosión……………………..19 1.3.6.1. Curvas de polarización potenciodinámicas................................................................20 1.3.6.2. Espectroscopía de impedancia electroquímica...........................................................21 1.3.6.3. Modulación de frecuencia electroquímica..................................................................24 1.4. Enunciado del problema..................................................................................................27 1.5. Hipótesis……………………………………………………………………………….27 1.6. Objetivo………………………………………………………………………………..28 1.6.1. Objetivo general……………………………………………………………………..…28 1.6.2. Objetivos específicos…………………………………………………………………..28 2.. MATERIALES Y MÉTODOS………………………………………………………...29. 2.1. Material de estudio……………………………………………………………………..29 2.2. Materiales, reactivos y equipos……………………………………………………...…30 2.3. Procedimiento experimental……………………………………………………….…...31. iii.
(6) 2.3.1. Obtención de la carragenina natural…………………………………….……………...31 2.3.2. Ensayos de pérdida de peso………………………………………………………….…31 2.3.3. Ensayos electroquímicos……………………………………………………………….32 3.. RESULTADOS Y DISCUSIÓN………………………………………………….……38. 3.1. Ensayos de pérdida de peso…………………………………………………………….38 3.2. Técnica de extrapolación de Tafel……………………………………………………..41 3.3. Técnica de modulación de frecuencia electroquímica………………………………….44 3.4. Técnica de espectroscopia de impedancia electroquímica……………………………..48 3.5. Isoterma de adsorción de carragenina natural sobre el acero P22……………………..51 3.6. Parámetros termodinámicos de adsorción……………………………………………...56 3.7. Parámetros termodinámicos de activación……………………………………………..59 3.8. Examen superficial por SEM del acero P22 en presencia y ausencia de la carragenina natural obtenida del alga Chondracanthus chamissoi………………………………………64 4.. CONCLUSIONES Y RECOMENDACIONES………………………………………..70. 4.1. Conclusiones…………………………………………………………………………...70 4.2. Recomendaciones………………………………………………………………...……72 5.. REFERENCIAS BIBLIOGRÁFICAS…………………………………………………73. Anexos………………………………………………………………………………………..80 Anexo 1. Datos experimentales de los ensayos de corrosión del acero ASTM A335 P22 en H2SO4 1 M inhibido con el mucílagos del alga Chondracanthus chamissoi............................81 Anexo 2. Datos experimentales de los ensayos de corrosión del acero ASTM 335 P22 H 2SO4 1.0 M inhibido con el mucílagos del alga Chondracanthus chamissoi....................................86 Anexo 3. Datos experimentales de los ensayos de corrosión del acero ASTM 335 P22 en H2SO4 1.0 M inhibido con el mucílagos del alga Chondracanthus chamissoi....................................95 Anexo 4. Datos de ajuste de las gráficas................................................................................103. iv.
(7) LISTADO DE TABLAS. 1.. INTRODUCCIÓN. Tabla 1.1. Composición química del grado P22 (% en peso) ( ASTM A 335/A 335M-00) 2.. MATERIALES Y MÉTODOS. Tabla 2.1. Composición química del acero ASTM A335 grado P22 3.. RESULTADOS Y DISCUSIÓN. Tabla 3.1. Parámetros obtenidos de los ensayos de pérdida de peso del acero P22 en H 2SO4 1.0 M en ausencia y presencia de diferentes concentraciones de la carragenina natural, con temperaturas y tiempo de inmersión de 25 °C – 6h, 45 °C – 3 h y 65 °C – 3 h. Tabla 3.2. Parámetros electroquímicos obtenidos mediante la técnica de modulación de frecuencia electroquímica para el acero P22 en una solución 1,0 M H2SO4 sin y con diferentes concentraciones de la carragenina natural a diferentes temperaturas. Tabla 3.3. Parámetros electroquímicos obtenidos mediante la técnica de espectroscopia de impedancia electroquímica para el acero P22 en una solución 1,0 M H 2SO4 en ausencia y presencia de diferentes concentraciones de la CCC a diferentes temperaturas. Tabla 3.4. Valores del grado de recubrimiento de la superficie del acero ASTM P22 en H 2SO4 1,0 M, en función de la concentración de carragenina natural y temperatura. Técnica EFM. Tabla 3.5. Parámetros termodinámicos para la adsorción de carragenina natural sobre la superficie del acero P22 en H2SO4 1,0 M, a diferentes temperaturas. Técnicas EFM. Tabla 3.6. Resultados de velocidad de corrosión del acero P22 en H 2SO4 1,0 M en ausencia y presencia de diferentes concentraciones de carragenina natural, con temperaturas de 25 °C, 45 °C y 65 °C. Técnica EFM Tabla 3.7. Parámetros obtenidos de la regresión lineal entre el ln Vcorr y 1/T (ecuación de Arrhenius) del proceso corrosivo del acero P22 en H 2SO4 1,0 M en ausencia y presencia de carragenina natural. ANEXO 1 Tabla 1. Pérdidas de peso de las probetas de acero en ASTM P22 en H2SO4 1 M en ausencia y presencia de diferentes concentraciones del mucílago de Chondracanthus chamissoi a 25 °C y 6 h de inmersión.. v.
(8) Tabla 2. Pérdidas de peso de las probetas de acero ASTM P22 en H2SO4 1 M en ausencia y presencia de diferentes concentraciones del mucílago de Chondracanthus chamissoi a 45 °C y 3 h de inmersión. Tabla 3. Pérdidas de peso de las probetas de Acero ASTM P22 en H2SO4 1 M en ausencia y presencia de diferentes concentraciones del mucílago de Chondracanthus chamissoi a 65 °C y 3 h de inmersión. ANEXO 2 Tabla 1. Parámetros electroquímicos obtenidos mediante la técnica de modulación de frecuencia electroquímica para el acero ASTM 335 P22 en una solución H2SO4 1.0 M sin y con diferentes concentraciones del mucílago de Chondracanthus chamissoi a la temperatura de 25 °C. Tabla 2. Parámetros electroquímicos obtenidos mediante la técnica de modulación de frecuencia electroquímica para el acero ASTM 335 P22 en una solución H2SO4 1.0 M sin y con diferentes concentraciones del mucílago de Chondracanthus chamissoi a la temperatura de 45 °C. Tabla 3. Parámetros electroquímicos obtenidos mediante la técnica de modulación de frecuencia electroquímica para el acero ASTM 335 P22 en una solución H2SO4 1.0 M sin y con diferentes concentraciones del mucílago de Chondracanthus chamissoi a la temperatura de 65 °C. ANEXO 3 Tabla 1. Parámetros electroquímicos obtenidos mediante la técnica de espectroscopia de impedancia electroquímica para el acero ASTM 335 P22 en una solución H 2SO4 1.0M sin y con diferentes concentraciones del mucílago de Chondracanthus Chamissoi a la temperatura de 25 °C. Tabla 2. Parámetros electroquímicos obtenidos mediante la técnica de espectroscopia de impedancia electroquímica para el acero ASTM 335 P22 en una solución H 2SO4 1.0M sin y con diferentes concentraciones del mucílago de Chondracanthus Chamissoi a la temperatura de 45 °C Tabla 3. Parámetros electroquímicos obtenidos mediante la técnica de espectroscopia de impedancia electroquímica para el acero ASTM 335 P22 en una solución H 2SO4 1.0 M sin y con diferentes concentraciones del mucílago de Chondracanthus Chamissoi a la temperatura de 65 °C. vi.
(9) ANEXO 4 Tabla A.1. Resultados del ajuste de los datos de los ensayos de corrosión con el acero P22 a la ecuación de Arrhenius. Medio: H2SO4 1 M con diferentes dosificaciones de la CCC. Técnica EFM. Tabla A.2. Resultados del ajuste de los datos de los ensayos de corrosión con el acero P22 a la isoterma de Langmuir. Medio: H2SO4 1 M con diferentes dosificaciones de la carragenina natural del Chondracanthus chamissoi. Temperatura 25 °C, 45 °C y 65 °C. Técnica de modulación de frecuencia electroquímica. Tabla A.3. Resultados del ajuste de los datos de los ensayos de corrosión con el acero P22 a la isoterma de Freundlich. Medio: H2SO4 1 M con diferentes dosificaciones de la carragenina natural del Chondracanthus chamissoi. Temperatura 25 °C, 45 °C y 65 °C. Técnica de modulación de frecuencia electroquímica. Tabla A.4. Resultados del ajuste de los datos de los ensayos de corrosión con el acero P22 a la isoterma de Temkin. Medio: H2SO4 1 M con diferentes dosificaciones de la carragenina natural del Chondracanthus chamissoi. Temperatura 25 °C, 45 °C y 65 °C. Técnica de modulación de frecuencia electroquímica. Tabla A.5. Resultados del ajuste de los datos de los ensayos de corrosión con el acero P22 a la isoterma de Frumkin. Medio: H2SO4 1 M con diferentes dosificaciones de la carragenina natural del Chondracanthus chamissoi. Temperatura 25 °C, 45 °C y 65 °C. Técnica de modulación de frecuencia electroquímica. Tabla A.6. Resultados del ajuste de los datos de los ensayos de corrosión con el acero P22 a la isoterma de Flory-Huggins. Medio: H2SO4 1 M con diferentes dosificaciones de la carragenina natural del Chondracanthus chamissoi. Temperatura 25 °C, 45 °C y 65 °C. Técnica de modulación de frecuencia electroquímica. Tabla A.7. Resultados del ajuste de los datos de los ensayos de corrosión con el acero P22 a la ecuación de Van´t Hoff. Medio: H2SO4 1 M con diferentes dosificaciones de la carragenina natural del Chondracanthus chamissoi. Temperatura 25 °C, 45 °C y 65 °C. Técnica de modulación de frecuencia electroquímica.. vii.
(10) LISTADO DE FIGURAS. 1.. INTRODUCCIÓN. Figura 1.1. Alga roja Chondracanthus chamissoi. Figura 1.2. Microestructuras típicas en el acero grado 22. (a) Microestructura predominantemente bainítica representativa de un enfriamiento rápido y (b) microestructura predominantemente ferrítica representativa de enfriamiento lento (Gandy, 2005). Figura 1.3. Curva de Polarización Potenciodinámica. (ASTM G 3, 1999) Figura 1.4. Representación esquemática de una interfase electroquímica en función de elementos pasivos Figura 1.5. Diagrama de Nyquist. Componente real (Z') e imaginario (Z'') de la impedancia total (Z) para un circuito en paralelo: resistencia (R) – capacitancia (C), con resistencia de la solución (Rsol), a diferentes frecuencias. La flecha indica la dirección en la cual aumenta la frecuencia. (Mendoza y col., 2007) Figura 1.6. Frecuencias armónicas e intermodulación que resultan desde las frecuencias básicas de 2 Hz y 5 Hz. (Bosch y Bogaerts, 1996) 2.. MATERIALES Y MÉTODOS. Figura 2.1. Acero ASTM A335 grado P22 utilizado en la investigación. Figura 2.2. Fotomicrografía de la microestructura en estado de suministro del acero ASTM A335 grado P22. Microestructura: bainita con ferrita. Figura 2.3. Circuito equivalente usado para ajustar los datos experimentales de impedancia obtenidos con los aceros en estudio en soluciones de H2SO4 1,0 M, en ausencia y presencia de la carragenina natural. 3.. RESULTADOS Y DISCUSIÓN. Figura 3.1. Efecto de la dosificación de la carragenina natural en la solución de H2SO4 1,0 M sobre la velocidad de corrosión y eficiencia de inhibición de la corrosión en el acero P22, a diferentes temperaturas. Técnica de pérdida de peso. Figura 3.2. Curvas de polarización potenciodinámicas del acero P22 en H2SO4 1,0 M conteniendo diferentes concentraciones de la carragenina natural (g/l) a 25 ºC, 45 ºC y 65 ºC. Figura 3.3. Efecto de la dosificación de la CCC en la solución de H2SO4 1,0 M sobre los espectros de intermodulación del acero P22, a diferentes temperaturas.. viii.
(11) Figura 3.4. Efecto de la dosificación de la carragenina natural en la solución de H2SO4 1,0 M sobre la velocidad de corrosión y eficiencia de inhibición de la corrosión en el acero P22, a diferentes temperaturas. Técnica de modulación de frecuencia electroquímica. Figura 3.5. Diagrama de Nyquist obtenidos al potencial de corrosión del acero P22 en la solución de H2SO4 1,0 M, en ausencia y presencia de la carragenina natural, a diferentes temperaturas. Figura 3.6. Curva de ajuste de los datos de corrosión del acero P22 en H2SO4 1,0 M, en presencia de carragenina natural a las isotermas de Langmuir, Freundlich, Temkin, Frumkin y Flory-Huggins a diferentes temperaturas. Técnica EFM. Figura 3.7. Grafica de Van´t Hoff para el acero P22 en H2SO4 1.0 M, en presencia de carragenina natural. Técnicas EFM. Figura 3.8. Gráfica de Arrhenius para la velocidad de corrosión del acero P22 en H2SO4 1,0 M con diferentes concentraciones de carragenina natural como inhibidor. Técnicas de EFM. Figura 3.9. Fotomicrografías SEM del acero ASTM A335 grado P22. Microestructura: ferrita + bainita. Se muestra la alta densidad de precipitados de segunda fase. Figura 3.10. EDS del acero ASTM A335 grado P22, mostrando los picos característicos de sus elementos presentes. Figura 3.11. (a) Imagen SEM del acero P22 sumergido durante 1 h en una solución aireada de H2SO4 1,0 M sin inhibidor a 25 °C. (b) Imagen SEM del acero P22 sumergido durante 1 h en una solución aireada de H2SO4 1 M que contiene 2,5 g/l de la CCC, a 25 °C. Figura 3.11. (Continuación) (a) Imagen SEM del acero P22 sumergido durante 1 h en una solución aireada de H2SO4 1 M sin inhibidor a 25 °C. (b) Imagen SEM del acero P22 sumergido durante 1 h en una solución aireada de H2SO4 1 M que contiene 2,5 g/l de la CCC, a 25 °C. Figura 3.12. (a) Imagen SEM del acero P22 sumergido durante 1 h en una solución aireada de H2SO4 1 M sin inhibidor a 65 °C. (b) Imagen SEM del acero 22 sumergido durante 1 h en una solución aireada de H2SO4 1 M que contiene 2,5 g/l del MCC, a 65 °C. Figura 3.12. (Continuación) (a) Imagen SEM del acero P22 sumergido durante 1 h en una solución aireada de H2SO4 1 M sin inhibidor a 65 °C. (b) Imagen SEM del acero sumergido durante 1 h en una solución aireada de H2SO4 1 M que contiene 2,5 g/l del MCC, a 65 °C. ix.
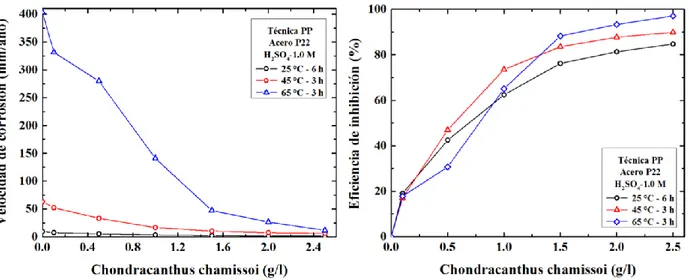
(12) RESUMEN. La inhibición de la corrosión del acero ASTM A335 grado P22 en una solución 1,0 M de ácido sulfúrico (H2SO4) a diferentes temperaturas, por el mucílago de Chondracanthus chamissoi, fue investigado utilizando los métodos de pérdida de peso, extrapolación Tafel, modulación de frecuencia electroquímica y espectroscopia de impedancia electroquímica. El mucílago de Chondracanthus chamissoi (CCC) actúa como un óptimo inhibidor de la corrosión de este acero corroyéndose en una solución de ácido sulfúrico. Las eficiencias promedias de inhibición a 25 °C fue 84,7%; 70,8 % y 71,7 %; a 45 °C fue 89,9 %; 91,9 % y 89,7%; y a 65 °C fue 97,1 %; 98,4% y 96,2 %, para una concentración del mucílago de 2,5 g/l. Dosificaciones del mucílago en el rango de 0,5 a 2,5 g/l solo generaron un leve incremento en la eficiencia de inhibición. Los resultados corresponden al promedio obtenido con las cuatro técnicas utilizadas. Se encontró que la eficiencia de inhibición y la constante de adsorción incrementaron con el aumento de temperatura. La entalpia estándar de adsorción fue positiva y la energía de activación aparente disminuyó con el incremento de la concentración del mucílago. Todos estos parámetros indican que la adsorción del mucílago de Chondracanthus chamissoi en el acero ASTM A335 grado P22 ocurre mediante una adsorción química. Asimismo, el mucílago actúa como un inhibidor de tipo mixto y el comportamiento de la adsorción de la CCC (Carragenina de Chondracanthus chamissoi) sobre la superficie del acero P22 en una solución de H2SO4 1,0 M, se ajustan a la isoterma de adsorción de Langmuir.. Palabras claves: mucílago de Chondracanthus chamissoi, ácido sulfúrico, H2SO4, velocidad de corrosión, inhibición ácida, adsorción, acero ASTM A335 grado P22, técnica electroquímica, EIS, EFM.. x.
(13) ABSTRACT. The corrosion inhibition of ASTM A335 grade P22 steel in a 1,0 M solution of sulfuric acid (H2SO4) at different temperatures, by the mucilage of Chondracanthus chamissoi, was investigated using weight loss methods, Tafel extrapolation, modulation of electrochemical frequency and electrochemical impedance spectroscopy. Chondracanthus chamissoi mucilage acts as an optimal corrosion inhibitor of this steel corroding in a sulfuric acid solution. The average efficiencies of inhibition at 25 °C was 84,7%; 70,8% and 71,7%; at 45 °C it was 89.9%; 91,9% and 89,7%; and at 65 °C it was 97,1%; 98,4% and 96,2%, for a mucilage concentration of 2,5 g/l. Dosages of the mucilage in the range of 0,5 to 2,5 g/l only generated a slight increase in the efficiency of inhibition. The results correspond to the average obtained with the four techniques used. It was found that the inhibition efficiency and the adsorption constant increased with the increase in temperature. The standard enthalpy of adsorption was positive and the apparent activation energy decreased with the increase in mucilage concentration. All these parameters indicate that the adsorption of Chondracanthus chamissoi mucilage in ASTM A335 grade P22 steel occurs through chemical adsorption. Also, the mucilage acts as a mixed type inhibitor and the adsorption behavior of the CCC on the surface of P22 steel in a 1,0 M H2SO4 solution conforms to the Langmuir adsorption isotherm.. Keywords: Chondracanthus chamissoi mucilage, sulfuric acid, H2SO4, corrosion rate, acid inhibition, adsorption, ASTM A335 grade P22 grade steel, electrochemical technique, EIS, EFM.. xi.
(14) 1.. INTRODUCCIÓN. 1.1. Realidad problemática El acero es utilizado en la fabricación de diversos componentes en la industria. Entre estos componentes tenemos tuberías de transporte de fluidos, recipientes de almacenamiento, equipos de perforación, etc. Su amplia utilidad es debida principalmente a sus excelentes propiedades mecánicas y conductividad térmica. El proceso de corrosión en el acero se produce fácilmente cuando es sometido a soluciones ácidas durante los procedimientos de decapado, eliminación de incrustaciones y limpieza de óxidos, lo que da como resultado fallas del metal y enormes pérdidas financieras. De los diversos métodos de protección contra la corrosión, la aplicación de inhibidores de corrosión es una técnica más conveniente y ampliamente aplicada. Aunque se han sintetizado una amplia gama de inhibidores de la corrosión, que muestran una alta eficiencia de inhibición, sus aplicaciones en la industria son limitadas debido a su toxicidad y sus procesos de fabricación complejos. Esto ha obligado a buscar inhibidores de la corrosión más seguros llamados “inhibidores de la corrosión verde” debido a sus propiedades como la no toxicidad, la biodegradabilidad y el bajo costo (Sharma y Sharma, 2011). Los extractos de plantas muestran las ventajas de un bajo costo, recursos abundantes, procedimientos de producción simples y son amigables con el medio ambiente. Los inhibidores naturales de la corrosión se pueden producir fácilmente mediante un procedimiento común: primero, las plantas son secadas al sol o a la sombra, luego pulverizadas. El polvo derivado de las plantas se remoja en un solvente (agua destilada, alcohol, solución ácida, etc.) y luego se somete a reflujo durante algunas horas; después del reflujo, la solución se enfría, se filtra y se concentra. Finalmente, el residuo se diluye a la concentración deseada. La alta eficiencia de inhibición de la corrosión que presentan los extractos de plantas se debe a que contienen una variedad de constituyentes fitoquímicos tales como taninos, 1.
(15) alcaloides, flavonoides, polifenoles, saponinas, glucósidos, antraquinonas, aminoácidos, proteínas, polisacáridos y otros compuestos heterocíclicos. Estos fitoquímicos han sido considerados como posibles inhibidores de la corrosión. Diversas son las técnicas utilizadas para investigar las propiedades de inhibición de extractos de plantas. Estas técnicas incluyen la pérdida de peso, la polarización potenciodinámica, la resistencia a la polarización lineal, la espectroscopia de impedancia electroquímica (EIS), la modulación de frecuencia electroquímica (EFM) y el método gasométrico de evolución de hidrógeno, para calcular la eficiencia de un inhibidor de la corrosión; la espectroscopia de fotoelectrones de rayos X (XPS), la espectroscopia dispersiva en energía (EDS) para analizar las composiciones y elementos de la superficie del acero; la microscopía de fuerza atómica (AFM) y microscopía electrónica de barrido (SEM) para caracterizar el estado de la superficie. Asimismo, con la finalidad de dilucidar aún más el mecanismo de protección de los inhibidores naturales, espectroscopia de resonancia magnética nuclear (NMR), espectroscopia infrarroja de transformada de Fourier (FTIR) y espectrometría de masas de cromatografía de gases o líquidos (GC-MS o HPLC-MS) se utilizan para separar y analizar los componentes de extractos de plantas. Estudios realizados en los últimos años, presentan a los extractos de plantas como potenciales inhibidores de la corrosión del acero. Es en esta línea de la investigación de inhibidores de la corrosión ecológicos que se presenta este estudio, donde se plantea como objetivo principal la evaluación de la carragenina natural obtenida a partir del alga roja Chondracanthus chamissoi como inhibidor de la corrosión del acero ASTM A335 grado P22 en H2SO4 1,0 M.. 1.2. Antecedentes En la limpieza de los aceros se usa generalmente el ácido sulfúrico debido a su bajo costo, su disponibilidad, su relativa facilidad en la manipulación respecto a otros reactivos químicos 2.
(16) y porque no genera mucha niebla u olor en el proceso de tratamiento. Durante el proceso de decapado, la reacción entre el ácido sulfúrico y el acero o sus óxidos es muy fuerte, por lo tanto, un inhibidor de la corrosión es un aditivo necesario para evitar el sobredecapado y la pérdida del metal. Se han informado de varios extractos de plantas que se presentan como efectivos inhibidores de la corrosión con ácido sulfúrico (H2SO4). El efecto de protección contra la corrosión de los extractos puede atribuirse a la existencia de diferentes componentes fitoquímicos en su composición. Asimismo, los extractos de diferentes partes de una planta también pueden exhibir propiedades anticorrosivas distintivas debido a sus variados principios activos. Estos extractos se adsorben en la superficie del acero inhibiendo el proceso corrosivo. En general, se consideran dos tipos de adsorción como las interacciones principales entre los inhibidores orgánicos y la superficie del metal. El proceso de fisisorción o adsorción física que requiere la presencia de una molécula cargada eléctricamente del inhibidor de corrosión y la adsorción química que implica la formación de un enlace de quimisorción entre las especies adsorbidas y la superficie metálica.. 1.2.1. Inhibidores de corrosión en ácido sulfúrico 1.2.1.1. Inhibidores corrosión por adsorción física La característica de adsorción y el tipo de inhibidor se pueden determinar analizando la variación en la eficiencia de inhibición con la temperatura, el modo del inhibidor adsorbido y los parámetros termodinámicos de adsorción (energía de activación, energía libre de adsorción, entalpia libre de adsorción, etc.) (Popova et al., 2003; Martinez & Stern, 2002; Zucchi et al., 1994). Algunos autores han señalado que algunos de los parámetros (por ejemplo, la energía libre estándar de adsorción) no se pueden calcular debido a la masa molar desconocida del extracto (Cardozo da Rocha et al., 2010). Sin embargo, el tipo de adsorción del producto natural puede ser determinado por la energía de activación (Krishnegowda et al., 2013; Faustin et al., 3.
(17) 2015). Además, otros investigadores han aplicado la masa molar del agua para calcular la energía libre estándar de adsorción. El tipo de adsorción del extracto de la planta determinado por estos datos estuvo de acuerdo con el de la energía de activación (Mourya et al., 2014). Se supone que es adsorción física si la eficiencia de la inhibición disminuye con el aumento de la temperatura y el valor de la energía de activación efectiva en presencia del inhibidor fue mayor que en la solución en blanco (Oguzie, 2006). La mayoría de los extractos de plantas reportados como inhibidores de la corrosión pertenecen a este tipo. El árbol Azadirachta indica, se consideraba un rico recurso de inhibidor verde e informes en la literatura (Okafor et al., 2010) sobre extractos de las semillas, raíces y hojas de este árbol han demostrado que estos extractos son inhibidores de corrosión eficientes en ácido sulfúrico y los resultados experimentales mostraron que la eficiencia de inhibición del extracto de las hojas es más alta que el de las semillas, debido a la mayor concentración de taninos en las hojas. Okafor et al. (2013) utilizaron técnicas de pérdida de masa y evolución de hidrógeno para analizar la acción inhibidora de extractos de etanol de diferentes partes de Nauclea latifolia; asumieron que los alcaloides presentes en las raíces y los extractos de las hojas son responsables del orden decreciente de eficiencia de inhibición observado: raíces, hojas, corteza. Para confirmar el papel de los alcaloides en la inhibición de la corrosión, se investigó el extracto de etanol, alcaloides y no alcaloides de la raíz de Nauclea latifolia; se concluyó que el rendimiento protector de la corrosión de los tres extractos siguió la tendencia: alcaloides, etanol, no alcaloides. La goma del algarrobo que se extrae desde las semillas de algarrobo, está compuesta principalmente de polisacáridos de tipo galactomanano, con una relación de galactosa:manosa de aproximadamente 1:4. La goma del algarrobo se investigó para determinar el potencial de inhibición de la corrosión en los aceros al carbono de tipo 39, 44 y B500 en solución de H 2SO4. Métodos electroquímicos y de polarización potenciodinámica se utilizaron para la prueba de. 4.
(18) inhibición que reveló que la goma de algarrobo muestra su efecto de inhibición de Steel 39 en medio ácido con la adición de NaCl (Jano et al., 2012). En presencia de incrustaciones complejas en la superficie del acero, se hace necesario, para su eliminación, prolongar el tiempo de inmersión o aumentar la concentración de ácido. Por consiguiente, un inhibidor "verde" debería mantener su alto valor de eficiencia de inhibición bajo estas condiciones. Varios extractos de plantas se desempeñaron excelentemente a altas concentraciones de ácido sulfúrico, o protegieron al acero de la corrosión incluso durante un largo tiempo de inmersión. Un extracto de hojas de Acacia cyanophylla disminuyó la densidad de corriente de corrosión anódica más que la del cátodo, actuó como un inhibidor anódico y protegió el acero dulce contra la corrosión en ácido sulfúrico 1 M incluso después de cinco días. Además, el valor máximo de eficiencia de inhibición fue capaz de alcanzar aproximadamente el 93% en presencia de 20 g/l del inhibidor a 20 °C (Avci & Keles, 2011). Algunos extractos de malezas también se usaron para proteger el acero contra la corrosión, lo cual que tiene una importancia económica y ambiental. Se investigó la acción anticorrosiva de Cotula cinerea (Benmenine et al., 2011) y hojas de Retama Retam (Benmenine et al., 2014) en acero X52 al 20% en masa del H2SO4, y se encontró la máxima eficiencia de inhibición de los dos extractos aproximadamente del 95% a 400 mg/l y 1400 mg/1, respectivamente. Diferentes técnicas son utilizadas para analizar los productos de corrosión y la morfología de la superficie del acero para confirmar la acción inhibidora del extracto de la planta. Muthukrishnan et al. (2013a, 2013b, 2013c) estudiaron el comportamiento de adsorción de los extractos obtenidos desde las hojas de Lannea coromandelica y desde las vainas de Leucaena leucocephala utilizando métodos de pérdida de masa y electroquímicos; la estructura de la superficie y la composición del acero se analizaron mediante mediciones de XRD, SEM y AFM. Con dosis de 250 mg/l de extracto de Lannea coromandelica y 500 mg/l de extracto de Leucaena leucocephala, las eficiencias de inhibición máximas a 35 °C se encontraron en 89%. 5.
(19) y 95%, respectivamente. Se encontraron taninos en estos extractos de plantas, así como otros compuestos como fenoles, flavonoides y alcaloides. El mecanismo de inhibición de estos extractos se considera a la formación de un complejo entre las moléculas inhibidoras protonadas y el Fe2+, y la posterior adsorción del complejo sobre la superficie del acero. La goma acacia se informó como un buen inhibidor de corrosión en solución de HCl y H2SO4 para la corrosión de acero de bajo carbono. Los resultados obtenidos muestran que las velocidades de corrosión del acero en HCl y H2SO4 disminuyeron con una concentración creciente de Goma Acacia. Se utilizaron las técnicas de pérdida de peso, polarización potenciodinámica y de evolución del hidrógeno para evaluar el potencial de la Goma acacia como un inhibidor de corrosión verde para el acero suave en medio ácido (Dalo-Abu et al., 2012). La Goma Acacia también se reportó como un buen inhibidor para el acero dulce en solución de H2SO4 con aditivos de haluro y los resultados obtenidos muestran que la eficiencia de inhibición aumenta con el aumento de la concentración de inhibidor y el aditivo de haluro aumenta el efecto de la inhibición y su mecanismo obedeció a la adsorción de la isoterma Temkin (Umoren et al., 2008a). La goma de Anogessius leocarpus se reportó como inhibidor eficiente de la corrosión del acero con la adición de iones de haluro de potasio en solución de HCl mediante el uso experimental de pérdida de peso. Los resultados obtenidos revelaron que la eficiencia de inhibición aumenta con el aumento de la concentración y disminuye con la temperatura, mediante un mecanismo de adsorción física y ajusta a la isoterma de adsorción Langmuir (Eddy et al., 2012a). La goma Ficus platyphylla (FP) se reportó como un buen inhibidor de la corrosión de acero dulce en solución de HCl mediante la pérdida de peso, FTIR y técnicas de gasometría. Los resultados obtenidos muestran que la eficiencia de inhibición aumenta con el aumento de la concentración, pero disminuye con el aumento de la temperatura y la adsorción de la goma. 6.
(20) Ficus platyphylla en la superficie de acero suave es exotérmica y espontánea, lo que favorece la adsorción física y se ajusta a la isoterma de adsorción de Langmuir (Eddy et al., 2012b). También se ha evaluado el potencial anticorrosivo de los extractos de plantas bajo diversas condiciones experimentales. Se informó que la eficiencia de inhibición del extracto de hojas de Combretum bracteosum (Okafor et al., 2009) se ensayó en soluciones de H2SO4 2 M y 5 M, respectivamente, y el nivel de la eficiencia en la misma dosis del inhibidor cambió ligeramente con la concentración de ácido. También se investigó la actividad de protección en acero de los extractos alcohólicos de cinco especies de Mentha y los resultados mostraron que estos productos naturales disminuyeron notablemente la densidad de corriente anódica y la eficiencia de inhibición del extracto de Mentha crispa L., fue la más alta de estos extractos (de Oliveira Ramos et al., 2012). Eddy y colaboradores estudiaron las propiedades de inhibición y adsorción de extractos de etanol de hojas de Gongronema latifolium y Heinsia crinata en H2SO4 2 M utilizando mediciones de pérdida de masa, termométricas y gasométricas (Eddy y Ebenso, 2010; Eddy y Odiongenyi, 2010). Los taninos y alcaloides se informaron como los compuestos comunes en estos dos extractos. Los extractos de hojas de tres hierbas, Wrightia tinctoria, Clerodendrum phlomidis e Ipomoea triloba, se emplearon como inhibidores en ácido sulfúrico 0,5 M; los resultados revelaron que todos los extractos de plantas disminuyeron tanto la velocidad de disolución anódica como la evolución del hidrógeno catódico, actuando, así como excelentes inhibidores de tipo mixto para el acero (Patel et al., 2013). El comportamiento anticorrosivo del extracto de flor de caléndula (Tagetes erecta) se investigó mediante diversos métodos electroquímicos, SEM y AFM; las fotomicrografías de la superficie del acero mostraron que la película formada por el inhibidor disminuía la rugosidad de la superficie del acero. La luteína, un componente principal del extracto de flor, se seleccionó para elucidar el mecanismo de inhibición usando la teoría funcional de densidad (DFT); el resultado indicó que la luteína protonada contribuyó significativamente al efecto inhibidor más que la luteína en su. 7.
(21) estado neutral. Además, la eficacia de la inhibición disminuye marcadamente con un aumento de la temperatura de 20 °C a 60 °C (Mourya et al., 2014). Bloqueando tanto la disolución de hierro como las reacciones de evolución de hidrógeno en H 2SO4 1 M, el extracto de hojas de Hemidesmus indicus se consideró como un inhibidor de tipo mixto, y el valor negativo de la 𝑜 entalpia de adsorción calculada ∆𝐻𝑎𝑑𝑠 asociada con el valor de Ea indicó que el inhibidor. adoptó la fisisorción (Patel & Šnita, 2014). En general, se considera que cuando el valor de la 𝑜 entalpia adsorción ∆𝐻𝑎𝑑𝑠 es positivo, el proceso de adsorción es endotérmico y ocurre mediante 𝑜 un mecanismo de quimisorción. Sin embargo, cuando el valor de ∆𝐻𝑎𝑑𝑠 es negativo, esto puede. significar un proceso de quimisorción o fisisorción, y esto debe ser confirmado por otros parámetros termodinámicos tales como: la energía libre de adsorción y la energía de activación.. 1.2.1.2. Inhibidores corrosión por adsorción química Se informó que el aumento de la temperatura podría acelerar la quimisorción del inhibidor en la superficie del metal (Stoyanova y Sokolova, 1997). Comparado con el sistema de baja temperatura, el inhibidor quimisorbido puede exhibir una alta eficacia de inhibición y, en consecuencia, puede aplicarse en un entorno de alta temperatura. El menor valor de E a obtenido a partir de la adición de un inhibidor natural sobre el que no contiene un inhibidor 𝑜 indica la quimisorción del inhibidor de la corrosión. Se reconoce que el valor de ∆𝐺𝑎𝑑𝑠 ≤ -40. kJ/mol indica quimisorción formando un enlace metálico coordinado a través del intercambio de carga entre el compuesto natural y la superficie del metal (Ansari et al., 2015). Curiosamente, el tipo de adsorción de algunos inhibidores de la corrosión es físico a baja temperatura, y se cambia a químico con el aumento de la temperatura (Znini et al., 2011). Varios extractos actuaron como inhibidores del tipo de adsorción química en un rango de temperaturas. De acuerdo con los análisis de constituyentes químicos de extractos de las flores y raíces de Anacyclus pyrethrum L., el fenómeno de que la eficiencia de inhibición de la primera era más pronunciada que la última se puede atribuir a las mayores concentraciones de 8.
(22) taninos de catecol y flavonoides presentes en el extracto de la flor (Benali et al., 2014). Las propiedades anticorrosivas de los extractos de Warionia saharea y Lavandula multifida L. en H2SO4 0,5 M con una temperatura que varía de 30 °C a 70 °C fueron estimados por Znini et al. (2011, 2012); se indicó que carvacrol hizo una contribución importante al efecto de protección de Lavandula multifida L., aceite esencial. La goma arábiga (GA) es la más antigua y popular en todas las gomas naturales. Se obtiene desde varias especies de árboles de la Acacia de la familia Leguminosa. Se ha investigado el potencial de la goma arábiga como inhibidor de la corrosión del aluminio en medio alcalino. La inhibición de la corrosión del aluminio por la goma arábiga se debe a la presencia de arabinogalactan, oligosacáridos, polisacáridos y glucoproteínas. El potencial de inhibición de la corrosión de GA se reportó para el acero dulce y aluminio en solución de H2SO4 mediante el uso de la pérdida de peso y técnicas termométricas. La eficiencia de la inhibición aumenta con el incremento de la concentración del inhibidor; se encontró que el inhibidor GA obedecía a la isoterma de adsorción de Temkin para acero dulce y aluminio. Se informó de adsorción química para corrosión de acero suave y adsorción física para aluminio. Sobre la base de estudios de termodinámica, la adsorción de GA en la superficie del metal fue espontánea y GA es mejor inhibidor de la corrosión para el aluminio (Al) que para el acero dulce (Umoren, 2008). El efecto inhibidor de los exudados de goma de Acacia Seyal Var. Seyal ha sido reportado como un buen inhibidor anódico para el agua potable usando polarización potenciodinámica y técnicas EIS. Los resultados obtenidos muestran que el % de inhibición aumenta con el aumento de la concentración del inhibidor de la goma y la eficiencia de inhibición es insensible al aumento de la temperatura. Su mecanismo es atribuido a los quimisorción (Buchweishaija y Mhinzi, 2008). La goma de Commiphora kestingii se ha reportado como un inhibidor de corrosión para la corrosión de aluminio en medio ácido mediante el uso de técnicas de cromatografía de gases-. 9.
(23) espectrometría de masas (GCMS) y espectroscopia infrarroja transformada de Fourier (FTIR). Los resultados obtenidos muestran el aumento de la eficiencia de inhibición con el aumento de temperatura y concentración que aplica el mecanismo de adsorción química. Se informó adsorción del tipo Freundlich, Temkin y Florry-Huggins (Ameh, 2014b). El Ficus glumosa o higo de roca africana ha sido reportada como un buen inhibidor para la corrosión de acero suave en la solución de H2SO4 por las técnicas de pérdida de peso, termométricas y SEM. Los resultados obtenidos muestran que la eficiencia de la inhibición aumenta con el aumento de la temperatura y la concentración. El mecanismo de efecto de inhibición se debió a la adsorción química y obedeció el modelo de adsorción de Langmuir (Ameh et al., 2012).. 1.3. Marco teórico 1.3.1. Chondracanthus chamissoi Chondracanthus chamissoi es un alga roja marina béntica distribuida desde Paita, Perú hasta Ancud, Chile, figura 1.1. Es ampliamente utilizada como materia prima por la industria del carrageno y se exporta a muchos países como algas comestibles.. Figura 1.1. Alga roja Chondracanthus chamissoi.. 10.
(24) Según Bixler (1996), el alga Chondracanthus chamissoi contiene polisacáridos compuestos de carragenina- y carragenina-. Wang et al. (2012), obtuvo dos tipos de polisacáridos a partir del alga Chondracanthus chamissoi mediante agua fría y agua caliente a 80 °C. El análisis de cromatografía de gases realizado a ambos polisacáridos reportó que están compuestos de galactosa, anhidro galactosa, SO42- y proteína, cuyo contenido fue de 50,3%, 16,2%, 27,8%, 1,1% y 36,6%, 31,8%, 23,1%, 0,8% para la carragenina obtenida en frío y caliente, respectivamente. El contenido de sulfato de la carragenina obtenida en frío fue mayor al contenido de las carrageninas- y - ideales; por lo cual su carácter estructural era un galactano sulfatado-híbrido. Por otro lado, la carragenina obtenida en caliente tenía un contenido de sulfato y una composición de monosacáridos muy similares al estándar de carragenina-.. 1.3.2. Acero ASTM A335 grado P22 Los aceros al Cr-Mo son ampliamente utilizados en componentes de las centrales térmicas tales como tuberías y cañerías de transporte de vapor. El acero de baja aleación 2¼Cr1Mo ha sido estandarizado en países de todo el mundo. En la actualidad, basado en la norma ASTM, está aleación es ampliamente conocida como Grado 22 y es utilizada con éxito en diversas aplicaciones en plantas de generación de energía. El acero P22 presenta una buena resistencia a alta temperatura (resistencia al creep), producto de una dispersión fina de precipitados de carburo de molibdeno; y una buena resistencia a la oxidación, derivado del contenido de cromo. Las aplicaciones más comunes son en los tubos de los sobrecalentadores y recalentadores, así como los cabezales donde la operación se realiza normalmente hasta aproximadamente 600 ºC. Basado en la norma ASTM A335 se muestra en la tabla 1.1 la composición química del acero P22.. 11.
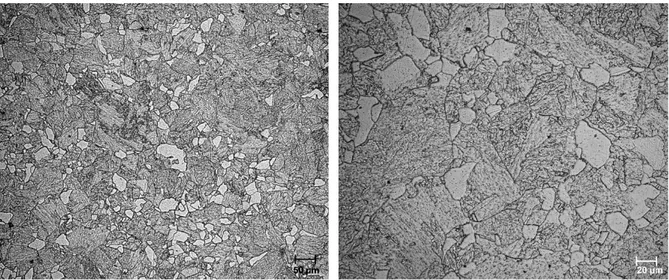
(25) Tabla 1.1. Composición química del grado P22 (% en peso) (ASTM A 335/A 335M-00) C. Si. Mn. P. S. Cr. Mo. 0.05-0.15 0.50 0.30-0.6 0.025 0.025 1.90-2.6 0.87-1.13. Su microestructura depende de la velocidad de enfriamiento. En aplicaciones prácticas como la obtenida en el metal de soldadura, la microestructura será bainita como la mostrada en la figura 1.2 (a). Para enfriamiento lento como ocurre en el tratamiento térmico de componentes de sección gruesa, la microestructura es ferrítica como la mostrada en la figura 1.2 (b).. (a). (b). Figura 1.2. Microestructuras típicas en el acero grado 22. (a) Microestructura predominantemente bainítica representativa de un enfriamiento rápido y (b) microestructura predominantemente ferrítica representativa de enfriamiento lento (Gandy, 2005).. 1.3.3. Inhibidores de corrosión Un inhibidor de corrosión es una sustancia química que, tras la adición a un ambiente corrosivo, resulta en la reducción de la velocidad de corrosión a un nivel aceptable. Los inhibidores de corrosión se utilizan generalmente en pequeñas concentraciones. Un inhibidor. 12.
(26) de corrosión no sólo debería mitigar la corrosión, sino también ser compatible con el medio ambiente. Por lo general, el inhibidor de corrosión es evaluado en términos de eficiencia de inhibición (EI) y se define como: 𝐸𝐼 (%) =. 𝐶𝑅0 −𝐶𝑅𝑖 𝐶𝑅𝑜. 𝑥100. (1). donde CR es la velocidad de corrosión y los subíndices i y o se refieren, a la presencia y ausencia del inhibidor, respectivamente. Los inhibidores de corrosión pueden ser clasificados de diferentes maneras. Los dos tipos principales son (i) inhibidores de adsorción e (ii) inhibidores de formación de película. En el caso de los inhibidores de corrosión verde son inhibidores de adsorción. La quimisorción sobre la superficie del metal a proteger, es la adsorción más importante de un inhibidor en soluciones ácidas. La quimisorción implica una transferencia real de carga o la coparticipación de carga entre la molécula de inhibidor y la superficie de metal. Al interactuar con los átomos de la superficie de metal, el inhibidor quimisorbido interfiere con la disolución metálica. La descripción más sencilla es la de un bloqueo de los sitios activos en la superficie, pero este punto de vista no es del todo completo. Como todas las especies adsorbidas, las moléculas quimisorbida tienen un cierto tiempo de residencia en la superficie y por lo tanto desempeñan un papel dinámico al participar en una serie de pasos de adsorción-desorción (McCafferty, 2011). Los inhibidores de tipo quimisorción por lo general contienen N, S, o átomos de O; y la quimisorción ocurre a través de la donación de electrones de estos átomos hacia los átomos que constituyen la superficie del metal. En una serie homóloga que difieren en la identidad del átomo donador, el orden de inhibición de la corrosión es (McCafferty, 2011): −𝑆 > −𝑁 > −𝑂. (2). ← 𝐼𝑛𝑐𝑟𝑒𝑚𝑒𝑛𝑡𝑜 𝑑𝑒 𝑙𝑎 𝑖𝑛ℎ𝑖𝑏𝑖𝑐𝑖ó𝑛 → 𝐼𝑛𝑐𝑟𝑒𝑚𝑒𝑛𝑡𝑜 𝑑𝑒 𝑙𝑎 𝑒𝑙𝑒𝑐𝑡𝑟𝑜𝑛𝑒𝑔𝑎𝑡𝑖𝑣𝑖𝑑𝑎𝑑. 13.
(27) El orden de la inhibición de la corrosión es inverso al orden de la electronegatividad de estos átomos. Por ejemplo, los compuestos de azufre son generalmente los mejores inhibidores de la corrosión que sus análogos de nitrógeno debido a que un átomo de S es menos electronegativo que un átomo de N (es menos efectivo en atraer los electrones a sí mismo), por lo que S es un mejor donante de electrones que es N. Cuando un metal se sumerge en una solución acuosa, la superficie metálica se cubre con moléculas de agua; por lo tanto, para que la molécula orgánica se adsorba en la superficie del metal primero tiene que desplazar estas moléculas de agua adsorbidas. La adsorción de moléculas orgánicas a partir de soluciones acuosas es, pues, una reacción de sustitución dada por la ecuación (3) (Bockris y Swinkels, 1964). 𝑀(𝑛𝐻2 𝑂)𝑎𝑑𝑠 + 𝐼(𝑠𝑜𝑙) = 𝑀𝐼𝑎𝑑𝑠 + 𝑛𝐻2 𝑂𝑠𝑜𝑙. (3). La energía libre total de adsorción ∆𝐺𝑎𝑑𝑠 implica tanto a las moléculas orgánicas y al agua: 𝑂𝑟𝑔. 𝐻 𝑂. 2 ∆𝐺𝑎𝑑𝑠 = ∆𝐺𝑎𝑑𝑠 − 𝑛∆𝐺𝑎𝑑𝑠. 𝑂𝑟𝑔. (4). 𝐻 𝑂. 2 donde ∆𝐺𝑎𝑑𝑠 y ∆𝐺𝑎𝑑𝑠 son las energías libres de adsorción por mol del compuesto orgánico y. agua, respectivamente. La energía libre de adsorción, en los procesos de electrodo, es difícil de medir directamente, pero se pueden calcular a partir de un ajuste de los datos de adsorción a partir de las isotermas de adsorción. Además de afectar en la adsorción de los inhibidores de corrosión, las moléculas de agua también participan en la transferencia de carga durante las reacciones de corrosión. La corrosión del hierro en soluciones ácidas procede a través de una serie de etapas en los que las moléculas de agua adsorbidas sobre los átomos del metal ayudan en la disolución del átomo de metal. Por lo tanto, la sustitución del agua adsorbida por las moléculas orgánicas adsorbidas altera la cinética de las reacciones de disolución anódica en soluciones ácidas.. 14.
(28) 1.3.4. Isotermas de adsorción Para la descripción del equilibrio termodinámico de adsorción se requiere conocer la concentración de los reactantes y de los productos que forman parte del proceso de adsorción. Mientras que la concentración en la solución es una cantidad conocida en un determinado ensayo de corrosión, la concentración en la superficie no es una cantidad conocida directamente de los resultados experimentales. El modelo de inhibición más utilizado es el bloqueo de la superficie metálica mediante la formación de una monocapa. En este modelo, la concentración de inhibidor en la interfase metal-inhibidor se puede considerar proporcional a la superficie metálica recubierta. Así, la concentración de inhibidor en la superficie metálica (𝐶𝑖 ) está relacionada con el recubrimiento de la superficie () de la forma siguiente: 𝐶𝑖 = 𝜃. 𝐶𝜃 = 1. (5). donde 𝐶𝜃 = 1 corresponde a la saturación de la superficie metálica por el inhibidor (=1). Si el fenómeno de corrosión tiene lugar en los lugares activos de la superficie metálica y el efecto del inhibidor es bloquear dichos lugares mediante su adsorción, entonces la capacidad del inhibidor para reducir la velocidad de corrosión se puede relacionar con el grado de recubrimiento () de la forma siguiente: 𝑉. −𝑉. 𝜃 = 𝑉𝑐𝑜𝑟𝑟,𝑜−𝑉 𝑐𝑜𝑟𝑟,𝑖𝑛ℎ 𝑐𝑜𝑟𝑟,𝑜. 𝑐𝑜𝑟𝑟,𝑚𝑎𝑥. (6). donde 𝑉𝑐𝑜𝑟𝑟,𝑜 y 𝑉𝑐𝑜𝑟𝑟,𝑖𝑛ℎ son las velocidades de corrosión del metal en ausencia y presencia de inhibidor, respectivamente, y 𝑉𝑐𝑜𝑟𝑟,𝑚𝑎𝑥 es la velocidad de corrosión del metal para el máximo de inhibición. Se conoce que la velocidad de corrosión para el máximo de inhibición (𝑉𝑐𝑜𝑟𝑟,𝑚𝑎𝑥 ) es despreciable, comparada con la velocidad de corrosión en ausencia de inhibidor: 𝑉𝑐𝑜𝑟𝑟,𝑜 ≫ 𝑉𝑐𝑜𝑟𝑟,𝑚𝑎𝑥 . Así, para un electrodo sin polarizar, la ecuación (6) se simplifica a la siguiente expresión (Ammar y Ei-Khorafi, 1973):. 15.
(29) 𝜃=. 𝑉𝑐𝑜𝑟𝑟,𝑜 −𝑉𝑐𝑜𝑟𝑟,𝑖𝑛ℎ 𝑉𝑐𝑜𝑟𝑟,𝑜. (7). Basado en estas consideraciones, las isotermas de adsorción expresan el grado de recubrimiento () de la superficie metálica en función de la concentración del inhibidor (C) en la solución acuosa estudiada. Es decir, indican la relación existente entre la cantidad de inhibidor en las soluciones ácidas y su capacidad de ser adsorbido sobre la superficie del acero. Existen una variedad de isotermas de adsorción, por lo que es necesario determinar empíricamente que isoterma de adsorción ajusta mejor a la data de grado de recubrimiento superficial. Los modelos más frecuentemente utilizados en la literatura sobre inhibidores de corrosión (Durnie y col., 1999; Bastidas y col., 2000 (a), Banerjee y col., 2012) son: Isoterma de Langmuir 𝜃. 𝑘𝐶 = 1−𝜃. (8). 𝜃 = 𝑘𝐶 1/𝑛. (9). Isoterma de Freundlich. Isoterma de Temkin 𝑘𝐶 = 𝑒𝑥𝑝(−2𝑎𝜃). (10). Isoterma de Frumkin 𝜃. 𝑘𝐶 = 1−𝜃 𝑒𝑥𝑝(−𝑓𝜃). (11). Isoterma de Flory - Huggins 𝜃. 𝑘𝐶 = 𝜒(1−𝜃)𝜒. (12). donde C es la concentración del inhibidor en la solución ácida, f es el parámetro de interacción (f < 0 indica fuerza de repulsión y f > 0 fuerza de atracción lateral entre moléculas orgánicas adsorbidas). f también puede ser definido como: f = 2a (a > 0 fuerza de atracción y a < 0 fuerza 16.
(30) de repulsión) (Bastidas y col., 2000 (a); Bastidas y col., 2000 (b)), k es la constante de equilibrio de la reacción de adsorción y es el número de moléculas de agua desplazadas por una molécula del compuesto orgánico. La isoterma de Langmuir hace referencia al desplazamiento de una molécula de agua y no considera la interacción lateral entre adsorbato-adsorbato; las isotermas de Temkin y Frumkin consideran la interacción entre adsorbatos y se refieren al desplazamiento de una molécula de agua; Flory-Huggins hace referencia al desplazamiento de χ moléculas de agua. Un aspecto adicional de las isotermas consideradas es su gran analogía, a menudo una ecuación es una modificación o mejora de otra. Si = 1 y f = 0 todas las ecuaciones se simplifican a la de Langmuir. En otras palabras, se está ante el caso de que no existen interacciones laterales y solo una molécula de agua (solvente) es desplazada por el adsorbato (inhibidor).. 1.3.5. Parámetros termodinámicos de las isotermas de adsorción Los parámetros termodinámicos de las isotermas de adsorción son los siguientes: la 𝑜 𝑜 energía libre estándar de adsorción (∆𝐺𝑎𝑑𝑠 ), la entalpía estándar de adsorción (∆𝐻𝑎𝑑𝑠 ) y 𝑜 entropía estándar de adsorción (∆𝑠𝑎𝑑𝑠 ). El análisis de estos parámetros permite estimar la. factibilidad del proceso de adsorción, así como el efecto de la temperatura sobre los mismos. Estos parámetros pueden ser calculados a partir de los valores estimados de la constante de equilibrio, k, obtenidos desde las isotermas de adsorción a diferentes temperaturas, de la siguiente manera: 𝑘 = [𝐶. 1. 𝐻2 𝑂. 𝑜 ∆𝐺𝑎𝑑𝑠. ] 𝑒𝑥𝑝 [. 𝑅𝑇. ]. (13). 17.
(31) donde 𝐶𝐻2 𝑂 es la concentración del agua en la solución en mol×l-1, cuyo valor es 55,5, R es la 𝑜 constante universal de los gases y T la temperatura absoluta. Los valores de ∆𝐺𝑎𝑑𝑠 obtenidos. desde la ecuación 13 son graficados contra la temperatura de acuerdo con la siguiente ecuación: 𝑜 𝑜 𝑜 ∆𝐺𝑎𝑑𝑠 = ∆𝐻𝑎𝑑𝑠 − 𝑇∆𝑆𝑎𝑑𝑠. (14). 𝑜 El intercepto de la regresión lineal representa los valores de ∆𝐻𝑎𝑑𝑠 . Posteriormente, 𝑜 𝑜 𝑜 introduciendo los valores de ∆𝐺𝑎𝑑𝑠 y ∆𝐻𝑎𝑑𝑠 en la ecuación (14) se obtiene los valores de ∆𝑆𝑎𝑑𝑠. para todas las temperaturas estudiadas. Esta ecuación se utiliza en primera instancia a nivel de sistemas de gases ideales, pero su uso puede ser extendido a adsorción en interfases sólido - líquido muy diluido, ya que ello implica que la distancia intermolecular es lo suficientemente grande para garantizar un comportamiento del tipo gas ideal. 𝑜 La energía libre estándar de adsorción (∆𝐺𝑎𝑑𝑠 ), permite discernir si un proceso es 𝑜 espontáneo o no. Valores negativos de ∆𝐺𝑎𝑑𝑠 implican un proceso espontáneo, mientras que. valores positivos significan que es necesario aportar energía al sistema ya que el sistema no es capaz de evolucionar por sí solo. 𝑜 La entalpía estándar de adsorción (∆𝐻𝑎𝑑𝑠 ), aporta información acerca del carácter. exotérmico o endotérmico del proceso, se puede también estimar la energía de activación y además permite diferenciar si se trata de un proceso que ocurre vía fisisorción (valores bajos) o quimisorción (valores altos). 𝑜 La entropía estándar de adsorción (∆𝑠𝑎𝑑𝑠 ), permite predecir la magnitud de los cambios. sobre la superficie del adsorbente, ya que si los cambios son muy profundos en la misma se afecta la reversibilidad con lo que se obtendría un valor negativo de la entropía de adsorción, en caso contrario es indicativo de alta posibilidad de reversibilidad.. 18.
(32) 1.3.6. Métodos electroquímicos para evaluar la velocidad de corrosión El proceso corrosivo se compone de dos reacciones electroquímicas que ocurren al mismo tiempo en la superficie del metal expuesto a un medio electrolítico, por esta razón las técnicas electroquímicas constituyen una herramienta muy valiosa para hacer mediciones y estudios del proceso de corrosión e incluso a nivel interfase entre el metal y capas de productos de corrosión formados. Las técnicas electroquímicas pueden utilizarse para estudiar los mecanismos de reacción y velocidades de corrosión en diferentes medios. Como la naturaleza de los procesos de corrosión es electroquímica, se han utilizado diferentes técnicas electroquímicas con el propósito de conocer la velocidad de corrosión. Las técnicas electroquímicas se basan en la ley de Faraday debido a la relación existente entre la transferencia de cargas eléctricas, el flujo de masa y la densidad de corriente eléctrica. La ventaja de los métodos electroquímicos es el corto tiempo de ensayo y su alta confiabilidad y posibilidad de analizar el proceso corrosivo. Sin embargo, la principal desventaja es la necesaria perturbación del sistema aplicando un cambio en el potencial, lo cual puede generar cambios en el sistema. Las perturbaciones más o menos irreversibles que puede causar la polarización, dependen de la intensidad de la señal. Los métodos electroquímicos permiten limitar el tiempo de perturbación (impulsos cortos), o aplicar la señal a una velocidad tal que no pueden tener lugar fenómenos de transporte que modifiquen las concentraciones de reactantes y productos en los alrededores del electrodo, o de las sustancias absorbidas, como es el caso de las señales de corriente alterna de frecuencia suficientemente elevada. (Kutz, 2005). 19.
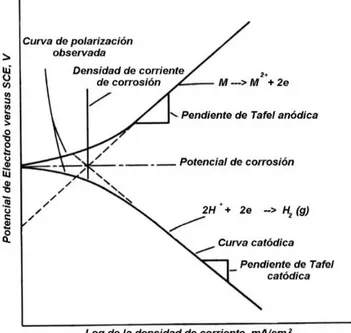
(33) 1.3.6.1. Curvas de polarización potenciodinámicas Las curvas de polarización potenciodinámicas, figura 1.3, son diagramas que presentan el comportamiento de las reacciones anódica y catódica en el proceso corrosivo en un determinado rango de potencial.. Figura 1.3. Curva de Polarización Potenciodinámica. (ASTM G 3, 1999). Mediante estas curvas se puede estudiar la cinética y los mecanismos de reacción del proceso de corrosión. Esta técnica electroquímica consiste en aplicar un barrido de potencial en un rango seleccionado y a una velocidad de barrido constante, registrando y graficando la corriente generada entre el electrodo de trabajo y el electrodo auxiliar. La curva de polarización potenciodinámica obtenida es la representación gráfica del potencial aplicado con respecto al electrodo de referencia (generalmente electrodo de calomel saturado) versus la densidad de corriente generada. Esta técnica es de alta perturbación puesto que emplea altas polarizaciones alrededor de los ± 300 mV respecto al E corr con velocidades de barrido de 0,1 a 0,5 mV/s. En la figura 1.3 se puede observar las curvas de polarización anódica (oxidación del metal) y la curva de polarización catódica (reducción del hidrógeno). A partir de la curva de polarización 20.
(34) de polarización potenciodinámica se puede determinar la velocidad de corrosión y las pendientes de Tafel (ASTM G5, 1994). Para determinar experimentalmente las pendientes de Tafel (βa y βc) se recomienda una representación gráfica, donde la densidad de corriente esté en una escala logarítmica. Esto debido a que si ambas reacciones están siendo controlada por transferencia de carga (activación), existirá una relación lineal entre el logaritmo de la densidad de corriente y el potencial, especialmente para altas polarizaciones. Los materiales que son susceptibles de ser evaluados mediante la aplicación de la polarización lineal, deben estar inmersos en electrolitos conductores; es decir, que la resistividad de las soluciones no sea alta, y deben encontrarse libres de películas resistivas. La velocidad de corrosión obtenida como icorr, puede ser convertida a pérdida de peso por unidad de tiempo utilizando las leyes de Michael Faraday. Si se parte de icorr cuya unidad esta en A/cm2 y aplicando la segunda ley de Faraday se tiene la siguiente conversión: (ASTM G102, 1999). 𝑚𝑚. 𝐴. 𝐶. 𝑃.𝑒𝑞.. 𝑉𝑐𝑜𝑟𝑟 [ 𝑎ñ𝑜 ] = 𝑐𝑚2 𝑥 𝐴.𝑠 𝑥 96487 𝐶 𝑥. [. 𝑀.𝐴. ]𝑔 𝑧. 𝑃.𝑒𝑞. 𝑐𝑚 3. 𝑥 (𝜌)𝑔 𝑥. 10 𝑚𝑚 1 𝑐𝑚. 𝑥. 60𝑥60𝑥24𝑥365 𝑠 𝑎ñ𝑜. (15). donde, M,A., es la masa atómica; ρ, es la densidad del metal; z, es el número de equivalentes; y P.eq. es la masa equivalente. La velocidad de corrosión obtenida por este método es una velocidad instantánea.. 1.3.6.2. Espectroscopía de impedancia electroquímica La técnica de espectroscopía de impedancias electroquímicas (EIS), consiste en aplicar al material estudiado, en una celda electroquímica, una perturbación senoidal de potencial eléctrico en un amplio rango de frecuencias y registrar la respuesta en intensidad de corriente. La impedancia (Z), se define como el cociente entre el potencial aplicado y la intensidad medida a la salida. La impedancia, es una medida de la oposición de un sistema eléctrico de. 21.
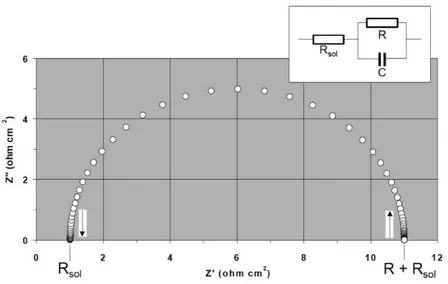
(35) corriente alterna al paso de corriente y se considera como un concepto más general de resistencia. La espectroscopia de impedancia electroquímica tiene su fundamento en que un metal corroyéndose puede ser interpretado como un circuito eléctrico, figura 1.4. R ct es la resistencia de transferencia de carga a través de la interface electroquímica, y está relacionada con la velocidad de la reacción de corrosión y Cdl es la capacitancia de la doble capa electroquímica producto de los iones y moléculas adsorbidos en la superficie del metal. La combinación en paralelo de Rct y Cdl representa la interfase metal–electrolito en el proceso corrosivo. En un proceso controlado por activación, el valor de Rct es equivalente a la resistencia a la polarización lineal, Rp, calculada por la técnica de resistencia a la polarización lineal. El elemento Rsol, por su parte, es la resistencia no compensada entre el electrodo de trabajo y el electrodo de referencia, donde se incluye la resistencia del electrólito.. Figura 1.4. Representación esquemática de una interfase electroquímica en función de elementos pasivos. 22.
Figure



Documento similar
que hasta que llegue el tiempo en que su regia planta ; | pise el hispano suelo... que hasta que el
Hasta en los moros de Granada habríamos de suponer conocimiento de los vaticinios del adivino céltico, si hubiéramos de tener por auténtica la «carta que el moro de Granada sabidor
E Clamades andaua sienpre sobre el caua- 11o de madera, y en poco tienpo fue tan lexos, que el no sabia en donde estaña; pero el tomo muy gran esfuergo en si, y pensó yendo assi
d) que haya «identidad de órgano» (con identidad de Sala y Sección); e) que haya alteridad, es decir, que las sentencias aportadas sean de persona distinta a la recurrente, e) que
De hecho, este sometimiento periódico al voto, esta decisión periódica de los electores sobre la gestión ha sido uno de los componentes teóricos más interesantes de la
Ciaurriz quien, durante su primer arlo de estancia en Loyola 40 , catalogó sus fondos siguiendo la división previa a la que nos hemos referido; y si esta labor fue de
Las manifestaciones musicales y su organización institucional a lo largo de los siglos XVI al XVIII son aspectos poco conocidos de la cultura alicantina. Analizar el alcance y
En la realización de este estudio se sintetizaron NPs de PbS con recubrimiento 25 % tiofenol y 75 % decanotiol a distintas temperaturas (0 ºC, 25 ºC y 50 ºC). Las NPs sintetizadas