P
E
P
UNIVERSIDAD AUTONOMA METROPOLITANA
UNIDAD IZTAPALAPA
’ C 3 5
MATERIA:
“BIOQUUiIICA AVMZADIk”
PROFESORES:
Dr. JORGE GOMEZ
Dr. GUSTAVO VINIEGRA
ALUMNA:
CRISTINA CRUZ HERNANDEZ
MATRICULA:
96358644
J
HR<.e.\
T3ro-r&e kJOLOG\C+PRACTICA
DE
LABORATORIO:
TERMOESTANiLlDAD DE ENDOPOUGALACTURONASA
PRODüClDA
POR KLUWEROMYCES
MARXMNUS
CDBEL-278
J
~
~
DE CONSTANTES
~
CINETICAS
~
~
Y
i
~
~
~
i
~
~
!
’
ASESORES:
Men
C.
Lorena Gómez Ruíz
M
en
C.
Alma Cruz.
Guerrero.
Casaabiertidtiempo
UNIVERSIDAD AUTONOMA METROPOLITANA
DIVISION DE CIENCIAS BIOLOGICAS Y DE LA SALUD
Posgrado en Biotecnologia
Marzo 13,1998.
M. EN C. ALMA ELUBETH CRUZ GUERRERO P R E S E N T E .
Por medio de este conducto, la Comisión del Posgrado en Biotecnologla. a trav6s del Dpto. de Biotecnología, otorga el presente reconocimiento por su participación corno asesor en el trabajo "Determinación de constantes cinéticas y termoestabilidad de endo-poligalacturonasa producida por Kluvveromvces manianus CDBB-L-278". realizado por la alumna CRISTINA CRUZ HERNANDEZ, con nlimero de matricula 96358644, en el trimestre 96-0 de la Maestría en Biotecnologla.
Le reitero el agradecimiento y esperamos seguir contando con su colaboraci6n
A T E N T A M E N T E . "CASA ABIERTA AL TIEMPO"
UNIDAD IZTAPALAPA
P
AUTORES
ASESORES: M en C. L. GÓmez Ruiz, M en C. A. Cruz Guerrero
ALUMNA: Q.A Cristina Cruz Hernández
Departamento de Biotecnología, Universidad Autónoma Metropolitana, Iztapalapa, A.P
55-535, México D.F 09340
RESUMEN
En este trabajo se determinó la KM y VW de la pectinasa (endopoligalacturonasa) producida a partir de K/uyveromyces marxianus CDBB-L-278 en el ácido poligalacturónico, obtenikndose los valores de 0.6369 pg/ml y 1136.37 U/ml respectivamente.
Por otra parte se determinó la Termoestabilidad de dicha enzima encontrándose que a
3OoC
sólo
el 20% de su actividad en 2 hrs disminuye, mientras que a 60% su actividad disminuye drásticamente.INTRODUCCION
Debido a que actualmente en la industria alimentaria el auge de la utilización de enzimas en los procesos de elaboración de alimentos ha ido en aumento es necesario encontrar enzimas equivalentes que demanden menos recursos en su obtención y uso, ya que muchas veces el consumo y utilizacidn de éstas resulta costoso.
Un ejemplo de lo anterior es el estudio que se ha llevado a cabo con la levadura Kluyveromyces fragilis, con posibilidades de utilización comercial, donde se ha encontrado que la fermentación de suero de queso con esta levadura cuenta con un alto potencial de implementación (la conversión de lactosa en biomasa rica en proteínas y vitaminas), este potencial aumenta si paralelamente a la fermentación básica, se recupera la endo- poligalacturonasa del liquido residual, la cual ha sido utilizada en la clarificación de jugos con una alta eficiencia al igual que la pectinasa comercial[s].
como metiltransferasas; su clasificación depende en general de la preferencia de pectina como sustrato y de la acción de la enzima dependiendo del ataque endo o exo.
Actualmente son las pectinasas fúngicas las de mayor importancia comercial representando aproximadamente el 3% de la enzima en el mercado (Godfrey and Reichelt 1983) con un amplio rango de aplicaciones en frutas y vinos de procesado industriai[g].
Más recientemente se han estudiado las grandes ventajas y aplicaciones que pueden proporcionar enzimas pécticas provenientes de otros microorganismos como la levadura Kluyveromyces marxianus (antes Sacharomyces fragilis o Kluyveromyces fragilis) la cual hasta el momento sigue siendo objeto de estudio en muchas ramas de investigación a fin de obtener una mejor caracterización de la misma por ser una enzima de gran interés industrial [5.7.9].
Por todas estas razones
,
el objetivo de este trabajo fue determinar parámetros cinéticos como la KM, VMm (por el método de Lineweaver Burk) y Termoestabilidad de la endopoligalacturonasa de Kluyveromyces marxianus CDBB-L-278, parámetros que hasta el momento no se encuentran reportados en la literatura para esta enzima en especifico, siendo además una enzima que actúa de forma constitutiva. La levadura entes mensionada ha sido identificada también es productora de otras enzimas de alto potencial económico como la lactasa y la inulinasapl.ANTECEDENTES
Las enzirnas son proteínas biocatalizadores, pero también pueden considerarse como aditivos altamente específicos para aplicaciones en alimentos. Los aspectos clave en la elaboración de enzimas son los bioquimicos, los cinéticos de regulación y los
elementos importantes en el diseño de procesos y obtención de cepas microbianas para la producción de enzimas cuyas características deseables son:
No
ser patógeno, de preferencia que la enzima sea producida extracelularmente y con altos rendimientos y queel costo de producción sea razonable [io.i9.20].
.
i
La mayor parte de las enzimas comerciales son inducibles, es decir, requieren de una sustancia, generalmente el sustrato de la enzima, como inductor, el inductor permite la sintesis de la enzima al unirse con el represor que bloquea al gen operador impidiendo su transcripción.
Un ejemplo de enzima inducible es la pectinasa donde el microorganismo generalmente empleado es Aspergillus niger y el inductor es la pectina la cual es un polisacárido que corresponde al ácido galacturónico metilado y forma geles con ácido y azúcar. Los productos comerciales provienen generalmente del hongo antes mencionado, dado que de la gran variedad de microorganismos que producen enzimas pécticas, el mayor número de estas produce: una endo y una ex0 poligalacturonasa, además de una endo pectin liasa proporcionando as¡ una gran variedad de aplicaciones de la enzima [9,20].
2111
La levadura Kluyveromices marxianus produce una endopoligalacturonasa la cual es una enzima constitutiva. Además la levadura antes mensionada sido usada también en la producción de lactasa en conjunto con la inulinasa [5,7,8,9].
Otras enzimas constitutivas como la poligalacturonato liasa producida extracelularmente por Bacillus subtilis es capaz de atacar a la pectina rápidamente pero
sólo si se encuentra presente la pectin-metilesterasa, siendo la pectina un sustrato pobre para el crecimiento por inducci6n de la poligalacturonato liasa por que el organismo no produce pectin-metilesterasa; de la misma forma se observa una pérdida de actividad cuando el polipectato es la fuente de carbono[i].
Se denominan pectinasas a un complejo de enzimas que se clasifican de acuerdo con:*El sustrato (pectina o ácido péctico), *El tipo de reacción (hidrólisis o
transeliminación) y *El mecanismo (endo o exo) o Clasificadas generalmente como:
4
-
o pectinesterasas que al hidrolizar los enlaces éster metílico, liberan y producen pectinas de bajo metoxilo e incluso ácido poligalacturónico;6) -P , que rompen el enlace glucosidico a(l,4) de las pectinas con una acci6n tanto endo (reduce viscosidad) como exo (producción de moléculas libres de ácido galacturónico sin afectar la viscosidad). Estas en la maduración provoca que las pectinas se degraden y
el
fruto adquiera una textura más adecuada para ser consumido aunque una excesiva actividad enzimática causa ablandamiento notorio, lo cual propicia las condiciones para un ataque microbiano y aumenta la concentracibn de ácido galacturónico.C)
-
o pectintranseliminasas: son las hasas de mayor importancia. Además de las anteriores se suele también considerar a la protopectinasa.. .
hidrolisis pectina
hidrolisis
Pectinesterasa t CH30H + Ac. poligalacturonico (ac p6ctico)
poligalacturonaca CH30H + Ac monogalacturónico, azúcares, otras
Ac poligalacturonico sustancias
(14.1 7,19201.
Entre las principales fuentes de obtención de la enzima se encuentran: las plantas superiores (tomate, rábano, calabaza, zanahorias), los frutos inmaduros,
los
tejidos suaves (cáscara de cítrico, manzana , peras, fresas, uvas, espinacas, apio, chícharo), levaduras (Sacharomyces fragiiis) , mohos -Aspergii/us niger- y bacterias -Kieybsella y Erwinia sp-.La principal razón del uso de pectinasas es quiza que proporciona un incremento en la calidad y estabilidad de los productos con sus respectivos beneficios económicos incluyendo las ganancias asi como la rápida adaptabilidad a plantas de procesos de ingenieria estándar y avanzada. Además de los grandes beneficios en la industria de jugos y vinos principalmente [i.17].
Son ampliamente utilizadas en la Industria fruticola pues al hidrolizar la pectina, incrementan los rendimientos de extracción, disminuyendo
los
tiempos de filtración y permitiendo la clarificación en el caso que el jugo asi se comercialice, en clarificación de vinos, vinagres, jarabes, gelatinas y jaleas de frutas, actividad hidrolitica durante la fermentación de cocoa, ablandamiento de frutos, extracción de aceite de oliva, reduce viscosidad y mejora la extracción del color de las pieles y de las frutas y vegetales macerados, es una fuente principal de ácido citrico; además de otras aplicaciones en la industria alimentaria y de investigación académica [9,13,17,19.20].Para determinar la actividad de todas las enzimas pécticas se suele emplear en la práctica la pectina, para determinar Únicamente las poligalacturonasas se emplea como sustrato el ácido pectico no esterificado.
Los
cambios mensurables que experimenta el sustrato son:
aumento de grupo reductor, disminución de la viscosidad, disminución de la precipitabilidad con iones calcio y disminución de la rotación óptica.Es importante también considerar que la actividad enzimática puede verse afectada por factores como inhibidores, temperatura, concentración de sustrato, cambio de pH, etc,.
EFECTO DE LA CONCENTRACION DE SUSUTRATO SOBRE LA ACTIVIDAD ENZIMATICA
Las enzimas actúan formando un intermediario enzima-susutrato para luego transformar al sustrato en producto.
En un ensayo donde se coloca en un tubo cierta cantidad de enzima y de sustrato, dejando correr la reacción, veremos que conforme el tiempo avanza la actividad de la
enzima decrece.
Para observar realmente el efecto de la concentración de sustrato sobre la actividad enzimática se deben hacer una serie de ensayos manteniendo constantes la concentración de enzima, el volumen de reacción, pH y la temperatura; variando la concentración de substrato.
Si se grafican los resultados como se muestra en la Figura 1. podemos observar varias etapas de cinética: A corresponde a una cinética de primer orden donde la concentración de sustrato es baja y es limitante de la velocidad, B es un cinética mixta entre primer orden y orden cero y C nos indica una cinética de orden cero ya que la gráfica se vuelve casi horizontal señalando que la velocidad prácticamente ya no aumenta a pesar de que se aumente la concentración de sustrato
.
Esta fase denota la saturación de la enzima por el sustrato ya que todas las moléculas de enzima están combinada con el sustrato.La velocidad que muestra una enzima en su estado saturado a pH y velocidad óptimas , es conocida como Velocidad máxima y es un parámetro cinético de una enzima con respecto a un sustrato.
El valor de la concentración de sustrato (en molesllitro) que se requiere para que la enzima logre alcanzar la mitad de la Velocidad máxima (Vw) se denomina constante de Michaelis y se representa por KMa es constante característica de una enzima con respecto a un sustrato y es independiente de las concentraciones de enzima y de sustrato y es también un parámetro cinético de gran importancia cuyo valor nos denota la afinidad existente entre la enzima y el sustrato; cuanto menor sea el valor de KM mayor será la afinidad entre la enzima y sustrato, VO es la velocidad inicial y es cualquier valor de velocidad enzimática desde cero hasta Vw.
Para poder evaluar los datos, son más Útiles las gráficas rectas que las curvas. La ecuación de Michaelis es trasformada tomando los inversos de
los
dos miembros de la ecuacibn original y reordenando.Esta ecuación se conoce con el nombre de Lineweaver-Burk y su representación gráfica se muestra en la Figura 2. Si el sistema sigue una cinética de Michaelis la gráfica
1
No
frente a Ils será una recta y al cruzar en 1No
la intersección es igual a INmax y alcruzar l/s el valor de la intersección es igual a -1/Km, osea l / s
=
(-INYAX) / (KMNMAX)KM [Sustrato]
GRAFICA 1. DE MICHAELIS
=I/Vmax
=-I íK, NSl
GRAFICA 2. DE LA EC. DE LINEWEAVER- BURK
EFECTO DE LA TEMPERATURA SOBRE LA ACTIVIDAD ENZlMATlCA
Es natural observar un incremento en la velocidad de cualquier reacción química al elevar la temperatura ya que aumenta la energía cinética de las moléculas y por lo tanto aumenta la posibilidad de choques efectivos entre ellas originando mayor velocidad en la reacción.
En el caso de las reacciones enzimáticas lo anterior es también válido pero hasta cierto punto. Es conocido que las enzimas manifiestan una máxima actividad a cierta temperatura llamada por esto temperatura Óptima. Fuera de la cual su actividad decrece .
El valor de temperatura optima de una enzima se debe al incremento iatural de velocidad al aumentar la energía cinética y también a la resistencia a la desnaturalización por calefacción que oponga la enzima.
5 m
La disminución de la actividad enzimática a temperaturas distintas de la optima se puede deber a dos razones fundamentalmente: Una enzima pierde actividad al subir la temperatura por arriba de su óptima debido a la desnaturalización de su parte proteica ya que ai aumentar la energia cinética de los &tomos que la componen el movimiento es mayor y se rompen los puentes de hidrbgeno y de disulfuro que estabilizan a la estructura secundaria y terciaria.
Por otro lado la causa por la cual una enzima presenta menor actividad a temperaturas inferiores de la óptima no se debe a su desnaturalización si no a que la
energia cinética en la moléculas de sustrato y de enzima es menor y la probabilidad de choques entre ellos es menor[z.3,6.i8,zo~.
M
ETODOLOGIA
I
Preparación de medio selectivoI
I
Obtención de enzimai
Actividad enzimática de
la
endopoligalacturonasas!d
DESCRIPCION DE LA METODOLOGIAI. PREPARACION DEL MEDIO SELECTIVO
v
O Cepa Kluyveromyces marxianus CDBB-L-278, (CINVESTAV-IPN-México)
O Para la Droducción de Dectinasa se utilizó el medio de cultivo con la siguiente composición: 2% de glucosa (Baker), O. 1 % de sulfato de amonio [(NHJ2S0,, Baker], 0.2% de extracto de levadura (Bioxon), 0.5% sulfato de magnesio (MgSO,), 0.5% fostato de potasio dibásico [KH2P04 ) Baker], 0.1% ácido galacturónico.
O El pH se ajustó a 5 con H2S04
(1:l)
P
En un matraz de 500ml se colocaron IOOml del medio liquido, se esterilizó (15 lb/l5min), posteriormente se inoculó con la levadura y se incubó a 30°C durante 48 horas con una agitación de 200rpm en un agitador con incubadora ambiental New Brunswick modelo G24.
II. OBTENCION DE LA ENZIMA
Se centrifug6 el caldo de fermentación a 3500 r.p.m., 4% durante 25 minutos. Se decantó sobrenadante y se filtró através de membranas de 0 . 4 5 ~ de poro (sistema Millipore).
Ill: ULTRAFILTRACION DE LA ENZIMA.
membrana de 30
O00
daltons en ultrafiltro Millipore.El filtrado del paso anterior se concentró 5X por ultrafiltración através de
\
IV. ACTIVIDAD DE ENDOPOLOGALACTURONASA
*
CURVA PATRONPara realizar esta curva se prepararon soluciones de 0.0005ghl de ácido poligalacturónico para la determinación de endo-poligalacturonasa, las cuales se diluyeron a diferentes concentraciones para cubrir un intervalo de O a 500 pglml.
ACTIVIDAD ENZIMATICA DE ENDOPOLIGALACTURONASA
La actividad enzimática se midió determinando el aumento de azúcares reductores por el método de Nelson-Somogy (1994) a partir de soluciones de ácido poligalacturónico, para lo cual fue necesario elaborar los reactivos que a continuación se mencionan:
REACTWO 1
SOLUCION A: En 800
ml
de agua destilada se disolvieron- 259 de carbonato de sodio anhidro (Na, CO,)
-
259 de tartrato de sodio y potasio (KNaC406,4H,0)-
209 de bicarbonato de sodio (NaHCO,)- 2009 de sulfato de sodio (Na,S04) Aforando a un litro.
SOLUCION B
(H2S04) y se disolvieron 309 de sulfato de cobre (CuS0,.5H2O).
solución A.
-
En 200ml de agua destilada se agregaron 4 gotas de ácido sulfúrico concentrado- Para preparar el reactivo se mezcló un mililitro de la solución B y 25
ml
de laREACTIVO 2
SOLUCION A: en 450 ml de agua destilada se disolvió
-
21 rnl de ácido sulfúrico concentrado (H2S04)-
259 de molibdato de amonio (NH4)SMo7024.4H20))SOLUCION B: en 25 ml de agua destilada se disolvieron 39 de arseniato de sodio heptahidratado (NaHAsO, .iH20)
Se mezclaron lentamente y con agitación las soluciones y se aforaron a 500ml Posteriormente se calentó a 55OC durante 30 minutos.
TECNICA NELSON-SOMOGY
4 Se colocó en un tubo de ensaye 1 ml de muestra problema y se adicionó 1ml del
4 Se incubó el tubo durante 20 minutos en un balio de agua hirviendo, se retiró del baiío
4 Se agregó Iml del reactivo 2 y se agitó vigorosamente
4 Se leyeron las muestras en el espectrofotómetro (Scimadzu UV -160A) a 520 nm ,
reactivo 1.
de agua y se dejó enfriar.
A DETERMINACION DE LA ACTIVIDAD ENZIMATICA DE LA
ENDOPOLIGALACTURONASA
Las actividades extracelulares se determinaron en el sobrenadante después de centrifugación (3500 r.p.m., 25 minutos), filtración y ultrafiltración, como a continuación se menciona:
1) Se preparó una serie de cinco tubos de ensaye y se adicionó 1 ml del reactivo 1 de Nelson-Somogy
,
_.
1 . .,.. ..,..
<., , .,~, ._...,. _,..*t__*+-ll”,**_I_CC_) ~.__
. . *,..
-..
, , . . .. , . ...-.
”.. .. - . . ,.. , , . ,.
. ... . . I.
3) Se tomaron muestras de la mezcla de reaccion de 1ml
a
1, 5 10 y 15 minutos respectivamente. Estas muestras se colocaron en cada uno de los tubos que contenían el reactivo 1 con lo cual se detuvo la reacci6n enzimática.4) Una vez que se habían tomado todas las muestras se continúo con la técnica del Método de Nelson-Somogy.
Una unidad de endopoligalacturonasa (UPG) se defini6 como la cantidad de enzima necesaria para liberar un microgramos de azúcar reductor por minuto a 3OoC, pH 5.
Cada actividad se determinb por triplicado, cada repetici6n se muestra en el apéndice.
V. DETERMINACION DE LA K, Y V M A ~ DE LA ENDOPOLIGALACTURONASA
Se determin6 la actividad enzimática a siete diferentes concentraciones de sustrato (ácido poligalactur6nico) : 0.12, 0.25, 0.50, 1.00, 1.50 y 2.00 mglml. Con base en lo anterior se hizo una gráfica de Lineweaver-Burk de donde se obtuvieron los valores de
KM Y vMAX.
VI. DETERMINACION DE LA TERMOESTABILIDAD DE LA ENDOPOLIGALACTURONASA
Se determinó la actividad enzimática a cinco diferentes temperaturas: 30°C, 35OC, 4OoC, 5OoC,
60°C,
con lo que se observ6 la termoestabilidad de la enzima.RESULTADOS
Y DISCUSION
A continuación se proporciona la información obtenida en cuanto a actividades enzimáticas para determinar la Termoestabilidad. K M y VM, de la pectinasa de
. Kluyverornyces marxianus.
En la Tabla 1. se muestra la curva patrón obtenida, con la que se trabajo para todas las determinaciones, en la Figura 3. se muestra su representación gráfica.
Volumen dicido
I
VoiúmenaguaI
Absorbancla1
0.9 -
0.8
0.7 0.6
0.5 am 0.4
0.3
0.2
0.1
0 ,
O
___ ... . -
,-
I
[microglml] = (ASza. 1 . 2 7 ~ 1 0 ~ )
?= 0.99943
1.613~10'
_,
. ,
En la Tabla 2. se muestran
los
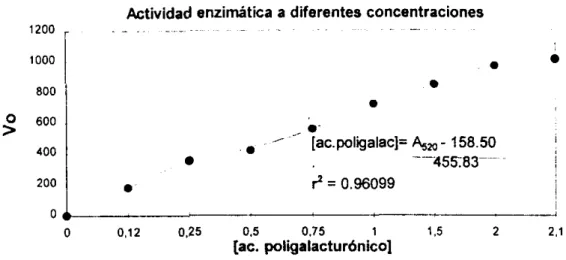
resultados obtenidos de actividad enzimática de la pectinasa expresada en Unidades enzimáticaslml = Vo, a diferentes concentraciones del sustrato, ácido poligalacturónico, a las que se trabajo, también se muestran los inversos de concentración de sustrato y Vo de acuerdo a la ecuaci6n de Lineweaver-Burk.TABLA 2. ACTIVIDAD ENZlMATlCA A DIFERENTES CONCENTRACIONES
Para determinar las unidadeslml , se tomó en cuenta el promedio de la pendiente de cada actividad a sus diferentes concetraciones (ver apendice), además de los factores de dilución.
Ejemplo para [1.5 mglml]
8.5278 (pgl(min*mlreac,)~l Oml*l O= 852.78 pgl(min*ml enzima)
En la Figura 4. se muestra la grafica de Michaelis para Vo a diferentes concentraciones y en la Figura 5. la gráfica de Lineweaver-Burk
i
600
400
200
Actividad enzimática a diferentes concentraciones
. -
1200 ~
__
e-.
, [ac.poiigaiac]= 420- 158.50 l
' e
--45S83-~-
I
e r? = 0.96099
1000
800
0,005
0.004
O
2 0.003 Y e e e . , ~
1
.~I
.
, . , -~
~ 1N,,,=0.79x1Q1 , ~ ' l/vo= 0.55XlO-3 *l/[Ac polig~.879xlO-3
-
O 0.12 0.25 0.5 0.75 1 1.5 2 2.1
[ac. pooligrlacturónico]
O l
FIGURA 4. GRAFICA DE MICHAELIS
0.5 0,666 1 1.333 2 3 4 5 6 8,333
I/[Ac poligaiacturónico]
FIGURA 5. GRAFICA DE LINEWEAVER-BURK PARA LA PECTINASA
Como se puede observar en la gráfica anterior y de acuerdo a ta ecuación de Lineweaver-Burk
l N M M =
0.0008799;
por io tantoVu = 1136.37 U/ml
K. = 0.6369 W m i
-(I/KM) = -1.57
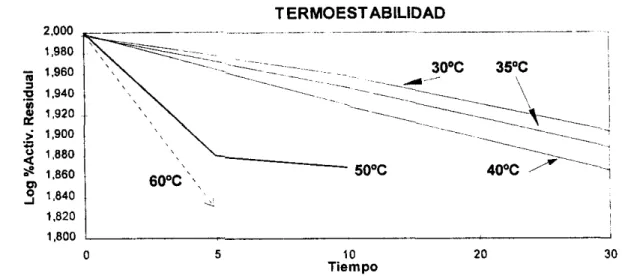
La termoestabilidad de la enzima se observó a diferentes temperaturas, para 30.35
y 4OoC se midi6 la actividad a O, 10,20 y 30 minutos, para 50 y 6OoC se midió a O, 5 y 10 minutos debido a que en los ensayos se not6 una gran disminución de la actividad a esas temperaturas en corto tiempo. En la tabla 3. se muestran los datos del log
YO
de Actividad residual a los tiempos de trabajo.Log=Log % de actividad residual
TABLA 3. LOG %ACTIVIDAD RESIDUAL A DIFERENTES TEMPERATURAS
NOTA: En el apéndice se encuentran reportadas las actividades para cada temperatura as¡ como sus repeticiones.
Para calcular el log
YO
de Actividad residual la actividad enzimática control=773.9 (668.4Ulm1'100) R73.9 = 86.367 % de actividad residualLog % de actividad residual= 1.936
(sin ningún tratamiento) se tom6 como el 100%. Ejemplo para 3OoC
En la Figura 6. se muestra la representación gráfica de la tabla 3, donde se puede observar la estabilidad de la enzima a diferentes cambios de temperatura; as¡, con 6OoC se observa un descenso notorio de la actividad de la enzima.
!
T ERMOESTABILIDAD
1.980
.
1.820
1,800
O 5 10 20 30
Tiempo
FIGURA 6. LOG % DE ACTIVIDAD RESIDUAL A DIFERENTES TEMPERATURAS
Para la enzima pectinasa producida por la levadura Kluyveromyces marxianus CDBB-L-278 se determin6 una
KM
de 0.6369 pglml y una Vw de 1136.37 Ulml.Además se encontr6 que la enzima es termoestable a 3OoC ya que sólo pierde 20% de actividad en dos horas de incubacibn y disminuye su estabilidad conforme aumenta la temperatura, también se observó que a 6OoC la actividad de la enzima se redujo drásticamente produciendo una ineficiente hidr6lisis del ácido poligalacturónico.
I
I
I f )
{
7'
$ 8
Q a
!
&,
'4
1,:
,io
1.0
"F,
b
b
i
:
*
,-
k 3
~1. 2. 3. 4. 5. 6. 7. 8. 9.
1
o.
11.
12.
13.
14.
15.
A. Aguilar M.; "Estudio de microorganismos pectinoliticos aislados del bagazo de henequen en descomposición",
-, 1960.
Bernhand, "Estructura y función de las enzimas" Primera edcición, 1977 Editorial H. Blume
Colby D S , Compendio de Bioquimica ED Manual Moderno, México-Bogota 1985.
J. O. Dziezak., "Enzymes: Catalysts for Food Processes, Special Report", Food Technol., 78-85, January 1991.
P. Espinoza., et al; "Evaluation of Kluyveromyces marxianus for the production of
lactase simultaneously to pectinase or inulinase",
VLemers.,
Ferdinand W. "The enzime molecule" De John Wiley and Sons LTD, 1978.
Garcia-Garibay., et al; "Studies on the simultaneous production of single cell protein and polygalacturonase from kluyveromyces fragilis",
Biotechnoloav
Letters.,
9(6): 411416 (May 1987).Garcia-Baribay., et al., "Obtención de biomasa y endopoligalacturonasa de Kluyveromyces fragilis a partir de suero de queso", Departamento de Alimentos, División de Estudios de Posgrado, Facultad de Química UNAM.
L. Gómez- Ruíz ., et al; "Utilization of Endo-poligalacturonase from Kluyveromyces
(1 988).
S.K. Hargander., Biotechnology in Food Processing, Hoyes Publications; New Yersey, USA 1986
W.M Kurowski & J.A Dunleavy; "Cellular and Enviromental Factors affecting the 14(11):1053-1058 (NOV. 1992).
fragilis in the Clarification of Apple juice", J. Food Sc
L,
53(4):1236-1237 &I240synthesis of Polygalacturonate lyase by Bacillus subtilis", Fur. J. ADD- , 2:
J. Lim., et al; "Multiple forms of Endo-poligalacturonase from Sacharomyces i
103-112 (1976).
fragilis", Baric. B iol. Chem. ,44(3), 473-480 (1980).
21(2): 23-30 (1986).
, (México) López-Munguia C.A., "Enzymes and Food Processing", _ T e c . A l i m
Neidleman S.L., "Enzymes in the Food Industry: A backward Glance",
Food
Tech, 88-991, January 1991.Penet Ch.S., "New Applications of Industrial Food Enzymology: Economics and Processes", Food Tech., 98-100, January 1991.
16. Schwan R.F. and A.H. Rose; "Polygalacturonase production by kluyveromyces
marxianus: effcet of medium composition", L & p I. Bacte riologll, 76(1): 62-67
(1 994).
17. Source Book of Food Enzymology
18. Voet D. & Voet J. Biochemistry, Second edition Ediciones John Willey &Sons,
Inc. New York , 1995.
19. Alan Wiseman; Handbook of Enzyme Biotechnology, Pari I y 11; 1975.
20. Witaker J.N., Principles of Enzymology for the Food Sciences, De Marcel Dekker, Inc., New York, 1972