Corrosión en ánodos de acero inoxidable aisi – 304 en celdas electrolíticas, conteniendo soluciones cianuradas artificiales de desorción
Texto completo
(2) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. DEDICATORIA. A DIOS PADRE. Por haberme dado fuerzas en todo momento y por haber guiado mí camino con la luz de su Fortaleza, su Bondad y su Amor. Gracias Dios mío.. A MIS PADRES Francisco y Alicia, por darme la vida, porque a pesar de la distancia siempre desearon lo mejor para mí. Por haberme apoyado en todo momento, por sus consejos, sus valores, por la motivación constante que me ha permitido ser una persona de bien, pero más que nada, por su amor.. A MIS HERMANOS Ronny y Xiomara, por su inmenso cariño, por apoyarme en los momentos difíciles y darme ánimos para alcanzar esta meta tan importante en mi vida.. OSMAR i Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(3) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. DEDICATORIA. A DIOS TODOPODEROSO Por darme la oportunidad de vivir y por estar conmigo en cada paso que doy, por fortalecer mi corazón e iluminar mi mente y por haber puesto en mi camino a aquellas personas que han sido mi soporte y compañía durante todo el periodo de estudio.. A MIS PADRES Melesio y Esther, por los ejemplos de perseverancia y constancia que los caracterizan y que me han infundado siempre, por el valor mostrado para salir adelante y por su amor. A MIS HERMANOS Mónica, por ser el ejemplo de una hermana mayor y de la cual aprendí aciertos y a sobrellevar los momentos difíciles. Luis, por ser mi amigo incondicional, por el apoyo mutuo en nuestra vida profesional.. MARÍA ESTHER ii Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(4) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. AGRADECIMIENTO. Al personal encargado del Laboratorio de Corrosión y Degradación de Materiales, perteneciente al Departamento de Ingeniería de Materiales, Escuela académico profesional de Ingeniería de materiales, Facultad de Ingeniería de la Universidad Nacional de Trujillo, por todas las facilidades brindadas para el desarrollo y ejecución de este trabajo de investigación. Un especial agradecimiento al Dr. Donato Cárdenas Alayo, por permitirnos desarrollar el presente trabajo de investigación bajo su asesoramiento y valiosos aportes en la ejecución del mismo. De la misma manera a todos los Docentes y amigos de la Escuela de Ingeniería de Materiales; en especial a nuestro compañero Anthony Fernández Escobedo, que de una u otra forma nos brindó su incondicional apoyo durante la ejecución de este trabajo de investigación. Nuestra eterna gratitud y reconocimiento por siempre.. Los Autores.. iii Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
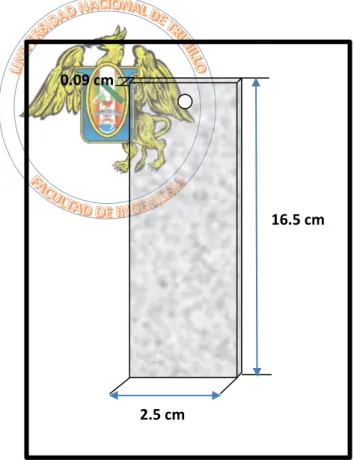
(5) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. RESUMEN. En esta investigación se evaluó la velocidad de corrosión del acero inoxidable AISI – 304 en una solución básica con un pH en un rango de 12 – 14. Para la recopilación de datos, se ensambló una celda electrolítica en la cual tanto el ánodo como los cátodos fueron probetas rectangulares de acero inoxidable AISI - 304 de 16,5 cm de largo x 2,5 cm de ancho x 0,009 cm de espesor según (Amy Jo Chambers, 2014), inmersas en una solución que contiene una relación molar de NaOH: NaCN de 5:4 con temperaturas en el rango de: T° ambiente – 80 °C y el voltaje aplicado entre 2,5 V – 4,0 V. La velocidad de corrosión se determinó mediante el método gravimétrico. Los resultados óptimos (según la Figura 3.1) se encuentran para un voltaje de 3,0 V a cualquier temperatura de estudio; obteniéndose una velocidad de corrosión de 691 111 µ/a para 25 °C, 822 405 µ/a para 40°C, 976 460 µ/a para 60 °C, 1 103 336 µ/a para 80 °C. Se realizó el análisis termo – cinético mediante la ecuación de Arrhenius y el diagrama de Evans respectivamente; demostrando que la temperatura es una variable determinante en la obtención de la velocidad de corrosión y la energía de activación necesaria para cada reacción entre los electrodos y el medio de estudio. Según el análisis ANAVA, se concluye que hay una interacción significativa entre la temperatura del medio y el voltaje aplicado. Además, se muestra que los efectos principales de la temperatura del medio y el voltaje aplicado también son significativos individualmente.. iv Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(6) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. ABSTRACT. In this research the corrosion rate of stainless steel AISI evaluated - 304 in a basic solution with a pH in the range of 12 to 14. For data collection, a cell electrodeposition in which both the anode and the cathodes were rectangular specimens of stainless steel AISI was assembled - 304 16.5 cm long x 2.5 cm wide x 0.009 cm thick, immersed in a solution containing a molar ratio of NaOH : NaCN 5: 4 when the temperature was varied in the range of : T ° ambient - 80 ° C and applied voltage between 2.5 V - 4.0 V. corrosion rate was determined by the gravimetric method.. Optimal results are for a voltage of 3.0 V at any temperature study; obtaining a corrosion rate of 691,111 μ / a to 25 ° C , 822 405 μ / a to 40 ° C , 976 460 μ / a to 60 ° C , 1,103,336 μ / a to 80 °. the thermal analysis was done - by kinetic Arrhenius equation and Evans diagram respectively ; showing that the temperature is a key variable in obtaining the corrosion rate and the activation energy necessary for each reaction between the electrodes and through study.. According to the ANAVA analysis, it is concluded that there is a significant interaction between the medium temperature and applied voltage. Also it is shown that the main effect of the medium temperature and the applied voltage are also significant individually.. v Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(7) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. ÍNDICE Dedicatoria. i. Agradecimiento. iii. Resumen. iv. Abstract. v. Índice. vi. Apéndice. ix. Anexos. ix. Listado de figuras. x. Listado de tablas. xii. Simbología. xiv. I. INTRODUCCIÓN. 1.1 Realidad problemática. 1. 1.2 Antecedentes Empíricos. 2. 1.3 Antecedentes Teóricos. 3. Definición de Corrosión. 3. Corrosión en Aceros Inoxidables. 5. ¿Por qué el acero inoxidable es resistente a la corrosión?. 5. La Capa Pasiva. 5. Tipos de Corrosión. 6. vi Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(8) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Corrosión Generalizada. 7. Corrosión Localizada. 8. Corrosión por Picadura. 8. Corrosión por Cavidades. 11. Corrosión Intergranular. 11. Corrosión Bajo Tención. 12. Corrosión Galvánica. 12. Proceso Electroquímico de la Corrosión. 12. Cinética de Corrosión. 15. Fenómenos de Polarización. 15. Electrodeposición. 17. Limpieza de Grasas y Sólidos. 18. Activación. 19. Ecuación de Arrhenius. 22. Conductividad. 25. Conductividad Eléctrica. 25. Conductividad en Medios Líquidos. 25. Ley de OHM. 27. Aceros Inoxidables. 29. Tipos de Acero Inoxidable. 29. Aceros Inoxidables Austeníticos. 30. Serie 300 AISI. 31. Serie 200 AISI. 31. 1.4 Problema. 32. 1.5 Hipótesis. 32 vii. Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
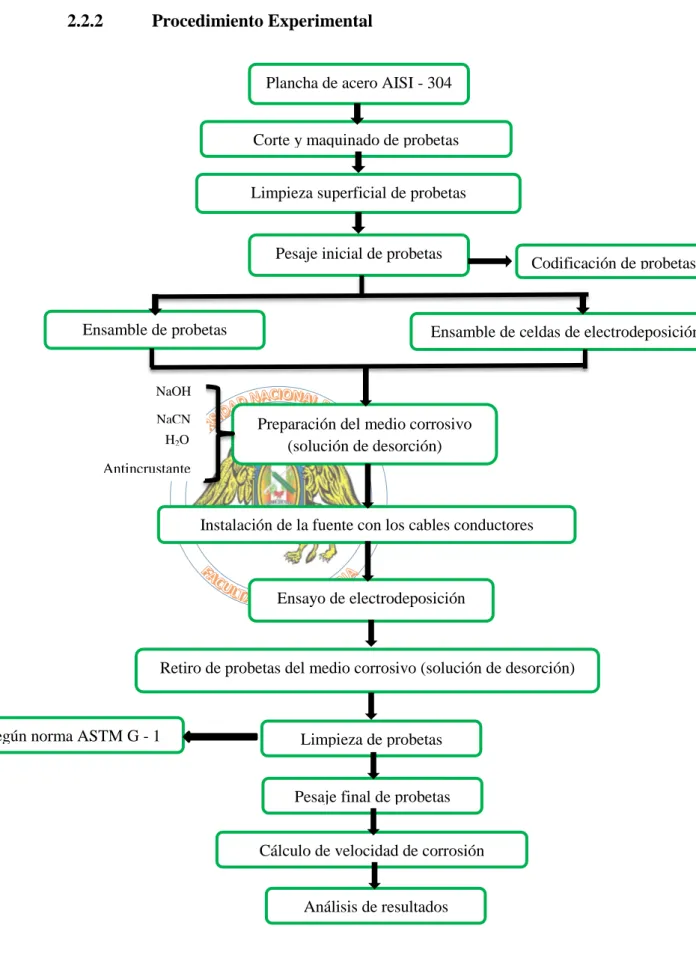
(9) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. 1.6 Objetivos. 32. 1.6.1 Objetivos General. 32. 1.6.2 Objetivos Específicos. 32. 1.7 Justificación. 33. II. MATERIALES Y MÉTODOS 2.1 Materiales. 34. 2.1.1 Población o Universo Muestral. 34. 2.1.2 Muestra o Población de Estudio. 34. 2.2 Métodos. 35. 2.2.1 Diseño de Investigación. 35. 2.2.2 Procedimiento Experimental. 37. A. Corte y Maquinado de Probetas. 38. B. Limpieza Superficial de Probetas. 38. C. Codificación y Aleatorización. 38. D. Pesaje Inicial de Probetas. 39. E. Ensamble de Probetas. 39. F. Ensamble de Celda de Electrodeposición. 39. G. Preparación del Medio Corrosivo. 39. H. Instalación de la Fuente con los Cables Conductores. 39. I. Retiro de Probetas del Medio Corrosivo. 40. J. Limpieza de Probetas según Norma ASTM G-1. 40. K. Pesaje Final de Probetas y Cálculo de Velocidad de Corrosión. 40. L. Análisis de Resultados. 41 viii. Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(10) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. III. RESULTADOS Y DISCUSIÓN 3.1 Velocidad de Corrosión del acero AISI – 304. 42. 3.2 Evaluación cinética de la Corrosión del acero AISI – 304. 43. Diagrama de Evans. 44. IV. CONCLUSIONES Y RECOMENDACIONES 4.1 Conclusiones. 48. 4.2 Recomendaciones. 48. REFERENCIAS BIBLIOGRÁFICAS. 49. APÉNDICE APÉNDICE I: Resultados Obtenidos del Ensayo de Corrosión en Ánodos de Acero Inoxidable AISI – 304. 52. APÉNDICE II: Procesamiento Matemático de Datos. 58. APÉNDICE III: Análisis Estadístico de los Resultados. 59. ANEXOS ANEXO I: Fotos. 68. ANEXO II: Medición de pH y Voltaje. 78. ANEXO III: Evaluación de la influencia de la temperatura en la velocidad de corrosión 86 ANEXO IV: Fichas Técnicas. 94. ix Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(11) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. ANEXO V: Norma ASTM G1-81: Preparación, Limpieza y Evaluación de Muestras para Ensayos de Corrosión 100 ANEXO VI: Cuadros Estadísticos. 104. LISTADO DE FIGURAS Fig. 1.1: Película de óxido de cromo. 6. Fig. 1.2: Clasificación de los tipos de corrosión. 7. Fig. 1.3: Corrosión generalizada. 8. Fig. 1.4: Corrosión localizada. 8. Fig. 1.5: Representación esquemática de la corrosión por picadura. 9. Fig. 1.6: Celda electroquímica. 13. Fig. 1.7: Diagrama de Evans de un sistema en corrosión. 16. Fig. 1.8 Sistema bajo control: (a) anódico, (b) catódico. 17. Fig. 1.9: Fundamento de la electrodeposición de metales. 18. Fig. 1.10: Representación Lineal de la corriente en función del voltaje. 28. Fig. 1.11: Diagrama esquemático del problema de investigación. 32. Fig. 2.1: Dimensiones de la probeta de acero AISI - 304 en estudio. 34. Fig. 2.2: Diagrama del procedimiento experimental para la evaluación de la velocidad de corrosión del acero AISI – 304 37 Fig. 2.3: Procedimiento de la limpieza de las probetas según la Norma ASTM G – 1. 38. Fig. 2.4: Procedimiento de la limpieza final de las probetas según la Norma ASTM G – 1 40 Fig. 3.1: Velocidad de corrosión del acero AISI 304 respecto al voltaje aplicado y temperatura de operación. 42. x Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(12) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Fig.3.2: Diagrama de Evans del acero inoxidable AISI-304.. 44. Fig. I.1: Corte del acero AISI – 304. 68. Fig. I.2: Perforación de probetas para el ensamblaje. 68. Fig. I.3: Confección de los agitadores. 69. Fig. I.4: Confección de los soportes para los agitadores. 69. Fig. I.5: Confección de los soportes para las probetas. 70. Fig. I.6: Limpieza de las cubas de vidrio. 70. Fig. I.7: Limpieza de las probetas. 71. Fig. I.8: Secado de probetas. 71. Fig. I.9: Ensamble de los agitadores con su soporte en las cubas de vidrio. 72. Fig. I.10: Codificación de probetas. 72. Fig. I.11: Medición de probetas (área expuesta). 73. Fig. I.12: Pesaje inicial de las probetas. 73. Fig. I.13: Ensamble de las probetas con sus soportes. 74. Fig. I.14: Ensamble de las probetas listas con las cubas de vidrio. 74. Fig. I.15: Preparación de la cuba de calentamiento controlado. 74. Fig. I.16: Preparación de la solución de desorción. 75. Fig. I.17: Instalación de los cables con las fuentes de cc. 76. Fig. I.18: Ensayo de electrodeposición y medida de Ph. 76. Fig. I.19: Retiro de las probetas luego del ensayo de electrodeposición completado. 77. Fig. I.20: Solución de desorción después del ensayo. 77. Fig. III.1: Gráfica Arrhenius para 2.5 V. 88. Fig. III.2: Gráfica Arrhenius para 3.0 V. 89. Fig. III.3: Gráfica Arrhenius para 3.5 V. 90. Fig. III.4: Gráfica Arrhenius para 4.0 V. 91 xi. Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
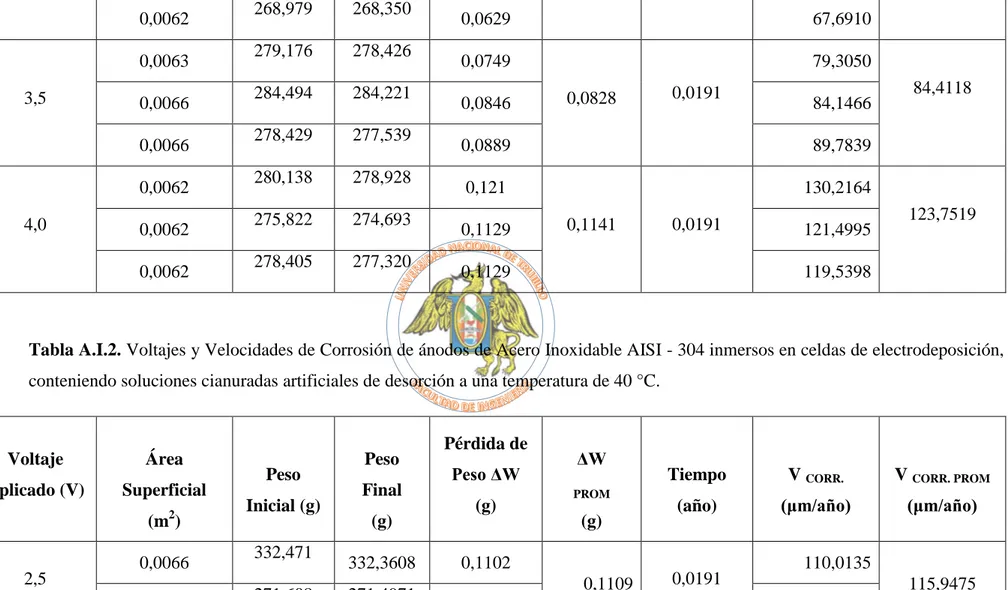
(13) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Fig. III.5: Energía de activación para cada voltaje aplicado. 92. LISTADO DE TABLAS Tabla 1.1: Resultados del trabajo de Pasco y Apetri.. 2. Tabla 1.2. Valores de equivalentes electroquímicos para diferentes metales. 21. Tabla 1.3: Clasificación y características de los aceros inoxidables (AISI). 30. Tabla 2.1: Niveles de las variables de estudio. 35. Tabla 2.2: Matriz del diseño experimental. 35. Tabla 3.1: Resultados de las pruebas realizadas. 42. Tabla 3.2: Densidades de corriente a diferente temperatura y voltaje. 45. Tabla 3.3: Tabla comparativa de velocidades de corrosión y condiciones de ensayo para cada antecedente empírico 46 Tabla A.I.1. Voltajes y Velocidades de Corrosión de ánodos de Acero Inoxidable AISI 304 inmersos en celdas de electrodeposición, conteniendo soluciones cianuradas artificiales de desorción a una temperatura de 25 °C 52 Tabla A.I.2. Voltajes y Velocidades de Corrosión de ánodos de Acero Inoxidable AISI 304 inmersos en celdas de electrodeposición, conteniendo soluciones cianuradas artificiales de desorción a una temperatura de 40 °C 53 Tabla A.I.3. Voltajes y Velocidades de Corrosión de ánodos de Acero Inoxidable AISI 304 inmersos en celdas de electrodeposición, conteniendo soluciones cianuradas artificiales de desorción a una temperatura de 60 °C 55 Tabla A.I.4. Voltajes y Velocidades de Corrosión de ánodos de Acero Inoxidable AISI 304 inmersos en celdas de electrodeposición, conteniendo soluciones cianuradas artificiales de desorción a una temperatura de 80 °C 56 Tabla A III.1.- Tabla de varianza para el análisis estadístico para el diseño bifactorial. 60. Tabla A III.2.- Velocidad de corrosión del acero AISI – 304. 61. Tabla A III.3.- Tabla bifactorial de los resultados obtenidos de la velocidad de corrosión del acero AISI – 304 62. xii Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(14) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Tabla A III.4.- Desarrollo de cálculos matemáticos. 62. Tabla A III.5.- Análisis de varianza de los resultados experimentales 6682 Tabla II.1: Medición de pH y voltajes aplicados en cada celda electrolítica a una temperatura de 25 °C. 78. Tabla II.2: Medición de pH y voltajes aplicados en cada celda electrolítica a una temperatura de 40 °C. 80. Tabla II.3: Medición de pH y voltajes aplicados en cada celda electrolítica a una temperatura de 60 °C. 82. Tabla II.4: Medición de pH y voltajes aplicados en cada celda electrolítica a una temperatura de 80 °C 90. 84. Tabla III.1: Datos para determinar la energía de activación para un voltaje suministrado de 2.5 V 87 Tabla III.2: Datos para determinar la energía de activación para un voltaje suministrado de 3.0 V 88 Tabla III.3: Datos para determinar la energía de activación para un voltaje suministrado de 3.5 V 89 Tabla III.4: Datos para determinar la energía de activación para un voltaje suministrado de 4.0 V 90 Tabla III.5: Tabla resumen de energía de activación. 91. Tabla III.6: Datos con la energía libre de Gibbs, correspondiente a cada proceso. 92. Tabla V.1: Puntos porcentuales de la distribución F0.05, V1 y V2. 107. xiii Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(15) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. SIMBOLOGÍA PBI: Producto Bruto Interno AISI: American Iron and Steel Institute (Instituto americano del hierro y el acero). ASTM: American Society for Testing Materials mdd: mg/ dm2. día µm: micra - año mV: mili voltio pH: grado de acidez o basicidad de una solución acuosa °C: Grado centígrado mA: mili amperio E: Potencial electroquímico E°: Potencial estándar R: constante de gases (1.987 cal/Kg mol) T: temperatura N: Número de electrones F: Constante de Faraday (23068 cal / mol) K: Constante de equilibrio Ea: Energía de activación Vcorr: Velocidad de corrosión ΔG: Energía libre de Gibss I: Intensidad de corriente xiv Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(16) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. V: Voltaje R: Resistencia I0: Densidad de corriente de intercambio CC: Corriente continua ΔW: Pérdida de peso ANAVA: análisis de varianza. xv Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(17) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. I.. 1.1. INTRODUCCIÓN. REALIDAD PROBLEMÁTICA La corrosión de los metales es un problema latente en la industria, debido a que es el origen principal de las fallas en los metales con relación al medio que los rodea; siendo el más peligroso por su carácter inevitable, lo cual ocasiona cuantiosas pérdidas económicas y problemas sociales de seguridad y salud.. Uno de los grandes problemas que enfrenta el sector industrial y principalmente el minero metalúrgico en metales preciosos, especialmente usa procesos electroquímicos, es el deterioro por corrosión electroquímica que sufre sus componentes metálicos expuestos a medios que contienen agentes que aceleran el proceso de corrosión de dichos materiales; estas estructuras podrían ser por ejemplo los ánodos presentes en celdas de electrodeposición utilizados por la Compañía Minera La Arena durante la campaña 2015. Para contrarrestar el perjuicio ocasionado por este fenómeno, la mayoría de los ánodos son de aleaciones de tipo hierro – cromo – níquel, conocidos como los aceros inoxidables; siendo estos los más usados por tener una alta resistencia a la corrosión.. Sin embargo, a pesar de ofrecer una gran resistencia a la corrosión estos aceros presentan severos problemas de corrosión en celdas electrolíticas, lo que trae como consecuencia un bajo rendimiento y por consiguiente un elevado costo en su mantenimiento. El interés por investigar este tema, no es evitar el deterioro de las estructuras metálicas, sino el de disminuirlas al mínimo posible; controlando ciertos parámetros (temperatura, densidad de corriente, voltaje, etc.), para así dar solución a la problemática presentada por La Compañía Minera La Arena durante la campaña 2015.. Ante esta situación, se ha creído conveniente realizar una investigación para la explicación del daño ocasionado por la corrosión a los componentes de una 1 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
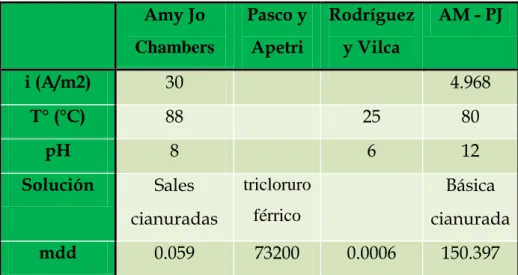
(18) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. celda de electrodeposición (ánodos) que se utilizan en la industria minera para la recuperación de oro, plata, cobre, zinc y otros.. En el Perú, se estima que las pérdidas por corrosión están alrededor de 3 a 5 % del Producto Bruto Interno (PBI), el cual en el año 2015 fue de 344 mil millones de soles, correspondiéndole 10 320 millones al 3%, sin embargo solo con capacitar al personal de trabajo con métodos de protección puede dar solución a esta problemática y sería posible reducir las pérdidas económicas en un 25%; y si se hace investigación se ahorraría otro 25%, por lo tanto se conseguiría un ahorro total del 50%. (Torres y Zapata, 2016).. 1.2. ANTECEDENTES EMPÍRICOS. Pasco y Apetri (1999:45), evaluaron la resistencia a la corrosión por picadura de los aceros AISI - 304L Y AISI – 316L en solución de tricloruro férrico de acuerdo a la norma ASTM G – 48-76 y ASTM – 46-74, usando como referencia el electrodo de calomel saturado, los resultados de los 7 días de ensayo se muestran en la tabla 1.1. Tabla 1.1: Resultados del trabajo de Pasco y Apetri. (Pasco y Apetri, 1999) MATERIAL. Velocidad de. Densidad de. Profundidad. Potencial de. corrosión. picado. máxima de. picado (mV). 2. (mmd). (picaduras/m ). picado (um). AISI - 304L. 73.200x103. 2.260x103. 3470. -400. AISI - 316L. 63.120x103. 1.340x103. 3100. -620. Rodríguez y Vilca (2004:15-52), evaluaron la influencia de la concentración de sal industrial y ácido cítrico, del líquido para conserva de esparrago en la susceptibilidad a la corrosión del acero AISI – 304 a temperaturas de 25°C y pH = 6, concluyendo que el potencial de picado en este medio es de -317mV respecto al electrodo de calomel saturado y que la velocidad de corrosión es de 2.78 μm/año.. 2 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(19) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Amy Jo chambers (2014:71-72), evaluó la corrosión sufrida por ánodos de aceros AISI – 304 y emisión de gases durante la electrodeposición de oro, obteniendo como resultados que la temperatura de 76.7°C a menos es la sugerida para operar en planta.. Balarezo Zavala (2010:50-51), estudiaron la influencia de la densidad de corriente catódica aplicada, sobre la variación del potencial de protección y velocidad de corrosión del par galvánico AISI – 304/ASTM A-36 expuesta en solución salina ácida industrial caliente, concluyendo que el rango efectivo de densidad de corriente catódica para el par galvánico está entre 670 a 780 mA/m2. El rango de potencial electroquímico de protección es de -1162 a -1230.7 mV. Los valores mínimos de velocidad de corrosión para el AISI – 304 es de 47.54 um/año y el del ASTM A-36 es de 1653.8 um/año.. 1.3. ANTECEDENTES TEÓRICOS. DEFINICIÓN DE CORROSIÓN La corrosión puede definirse como la reacción química o electroquímica de un metal o aleación con su medio circundante con el consiguiente deterioro de sus propiedades. No obstante que otros materiales, además de los metales (madera, plásticos, etc.) pueden corroerse, el término se emplea especialmente al deterioro de metales (Fontana, 1986). La reacción básica de la corrosión es por tanto: Men+ + ne-. Me. (1). De acuerdo con ello también es posible definir la corrosión desde un punto de vista más químico como el tránsito de un metal de su forma elemental a su forma iónica o combinada con cesión de electrones a un no metal como el oxígeno o el azufre. Es decir a través de la corrosión, retorna a la forma combinada formando óxidos, sulfuros, hidróxidos, etc.; que es como los. 3 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(20) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. metales se encuentran habitualmente en la naturaleza por tratarse de formas termodinámicamente más estables. Desde el primer momento de su extracción, para lo cual es necesario cambiar las condiciones termodinámicas utilizando reductores, altas temperaturas, etc.; el metal muestra una tendencia inherente a reaccionar con el medio ambiente (atmósfera, agua, suelo, etc.) retornando a la forma combinada (Otero, 1997).. La causa de que un metal se corroa depende de la cantidad de energía que se le aplica a su mineral base para transformarlo en un metal comercial. La energía calorífica necesaria para extraer los metales de sus compuestos químicos naturales se almacena en el propio metal. Durante el proceso de corrosión, el metal revierte el proceso artificial para regresar a su estado natural. (Otero, 1997). La velocidad de regreso del metal a su estado natural como mineral es directamente proporcional a la cantidad de energía almacenada por él mismo (Fontana, 1986). La cantidad de energía que se requiere y almacena varía de un metal a otro; es relativamente alta en metales como el magnesio, aluminio y hierro; y baja en metales como la plata y el oro; de ahí que la vulnerabilidad a la corrosión es más alta para el magnesio, aluminio y hierro, que para la plata y el oro.. El hierro es un buen ejemplo de este ciclo. La fuente más común de hierro es la hematita (oxido de fierro Fe2O3). El producto que resulta de la corrosión del hierro es el hidróxido férrico; el cual tiene alta estabilidad termodinámica. La energía que se requiere para convertir los compuestos de hierro metálico, se revierte cuando el hierro se corroe para formar el mismo compuesto. Lo único que cambia es la velocidad de la liberación de la energía. Algunas propiedades de los materiales pueden alterarse debido a la corrosión, lo cual suele ocasionar fallas inesperadas. Estos cambios pueden pasar inadvertidos en exámenes visuales y/o cambios de peso. (Fontana, 1986).. 4 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(21) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. CORROSIÓN EN ACEROS INOXIDABLES ¿Por qué el acero inoxidable es resistente a la corrosión? Todos los aceros inoxidables poseen una alta resistencia a la corrosión debida, principalmente, al contenido de cromo en la aleación.. Esta adición de poco más de 10% de cromo permite la formación de una delgada película transparente de óxido de cromo sobre la superficie del acero y excluye la corrosión adicional del acero inoxidable. En caso de que ocurra daño mecánico o químico, esta película es auto-reparable en presencia de oxígeno (ver figura 1.1). Se dice entonces que el acero inoxidable tiene una propiedad denominada pasividad, y a la película protectora se le conoce como la. capa. pasiva.. (http://www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la _corrosion.pdf, 2016).. La Capa Pasiva La pasividad es la resistencia natural que poseen los aceros inoxidables para combatir la corrosión, y se define como el estado en el que un metal o una aleación pierde su reactividad química y se transforman en inerte.. El contenido de poco más de 10% de cromo da al acero inoxidable su pasividad, lo cual se debe a la formación en su superficie de una película extremadamente delgada, uniforme, continua, resistente y estable de óxido de cromo.. La capa pasiva se puede mejorar adicionando elementos de aleación que permiten ampliar la gama de aceros inoxidables que, junto con una selección cuidadosa y la adecuada fabricación, pueden satisfacer una amplia variedad de necesidades en diversos sectores industriales. (http://www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la _corrosion.pdf, 2016).. 5 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(22) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Fig. 1.1: Película de óxido de cromo. (http://www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la_corros ion.pdf, 2016).. TIPOS DE CORROSIÓN. La estabilidad de la capa pasiva y por consiguiente la capacidad de resistir la corrosión, está ligada a las características de la aplicación: Composición, estructura y modalidad; así como al ambiente agresivo al que se somete el acero inoxidable.. Los fenómenos corrosivos que cuantitativamente son más frecuentes en la práctica son los que se denominan de corrosión húmeda, es decir, en presencia de agua en estado de condensación, aunque sea en forma de simple humedad atmosférica.. La corrosión húmeda puede ser de tipo generalizada o localizada. También existe la corrosión a altas temperaturas, la misma que se caracteriza por la formación de una cascarilla superficial que no es más que una mezcla de óxidos que forman los metales presentes en la aleación cuando se someten a temperaturas mayores a 500°C (ver figura 1.2).. 6 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(23) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Fig. 1.2: Clasificación de los tipos de corrosión. (http://www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la_corros ion.pdf, 2016).. . Corrosión Generalizada. Es la forma más común de corrosión y se presenta en la totalidad de la superficie expuesta del metal en forma de agresión progresiva y a velocidad constante, frecuentemente es más observada en ácidos no-oxidantes como el ácido sulfúrico, ya que se provoca un rompimiento del estado pasivo. (www.iminox.org, 2016). Esta se extiende en todas las superficies del metal produciendo una pérdida de espesor y por consiguiente una disminución de la resistencia mecánica. Las superficies rugosas son más propensas a este tipo de corrosión que las que tienen un pulido brillante. Tenemos una resistencia excelente cuando la pérdida de peso es inferior a 25 mg/cm2/24h y es aceptable cuando es inferior a 250 mg/cm2/24h. (www.jnaceros.com.pe, 2016).. 7 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(24) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Fig. 1.3: Corrosión generalizada. (http://www.trytech.com.ar/index.php).. . Corrosión Localizada. Existen varias causas posibles para este tipo de ataque, en general se trata de variaciones en las condiciones locales de la superficie (ver figura 1.4).. Fig. 1.4: Corrosión localizada. (http://www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la_corros ion.pdf).. . Corrosión por Picadura. El picado es un tipo de corrosión que frecuentemente se observa en los aceros inoxidables; es una forma de corrosión localizada muy peligrosa, ya que en ocasiones el avance del debilitamiento en el material puede no ser observable. 8 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(25) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Este tipo de corrosión se caracteriza por la presencia de pequeñas perforaciones localizadas en una superficie que por otro lado presenta áreas no afectadas. La perforación avanza en el sentido de la gravedad; tanto, que para cambiar la dirección de propagación del picado en el interior de una pared, a veces es suficiente cambiar su inclinación con respecto a la vertical. Los ambientes típicos capaces de desarrollar la corrosión por picaduras son el agua marina y en general las aguas que contienen iones cloruro, sobre todo si están estancadas. Cuando se ha presentado el fenómeno de corrosión por picaduras conviene proceder en primer lugar, si es posible, al arranque de la zona picada, actuando con medios mecánicos abrasivos o utilizando, si es preciso, suspensiones abrasivas que se hacen circular en la instalación para hacer desaparecer la zona de superficie picada; después será necesario proceder a la pasivación, que puede realizarse con aireación forzada, de toda la superficie. La acción de pasivación sobre una superficie que presente abundantes picaduras y sin el arranque previo de la zona picada, no resulta ventajosa porque el efecto pasivante no llega al fondo de las picaduras; por el contrario, empeora la situación porque al pasivar los bordes de la picadura se crean zonas anódicas. todavía. más. localizadas. que. las. originales.. (www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la_corro sion.pdf, 2016).. Fig. 1.5: Representación esquemática de la Corrosión por Picadura (Fontana, 1987) 9 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(26) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. La figura 1.5 representa esquemáticamente la naturaleza de una picadura creciendo en un metal M, en presencia de una solución aireada de cloruro de sodio. Se tiene la disolución de los metales al interior de la picadura, mientras la reducción del oxígeno tiene lugar en las superficies vecinas.. Las flechas discontinuas indican el sentido de movimiento de los electrones cuando se desprenden de sus respectivos cationes M+.. La siguiente es la secuencia de dicha reacción: -. En el interior de la picadura el metal es disuelto, creando cationes metálicos (M+), los cuales liberan electrones: M +n + ne). (M. -. Los electrones liberados son consumidos en una reacción de reducción por el oxígeno en la superficie adyacente del material 4OH-). (O2 + 2H2O + 4e -. La rápida disolución de cationes metálicos produce un exceso de carga positiva (exceso de M+), en el interior de la picadura, atrayendo iones de cloro para mantener la electroneutralidad.. -. Gracias al exceso de Cl buscando los M+, se genera una alta concentración de MCl, que en presencia del H2O produce la reacción de hidrólisis. (M + Cl- + H2O. M + OH- + H + Cl-). Generando alta cantidad de H+, lo que significa alta acidez (bajo pH), en el interior de la picadura y nuevamente se realiza el ciclo, además, la picadura actúa como una pequeña área anódica unida a una superficie. 10 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(27) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. catódica mayor, lo que genera un efecto galvánico que ayuda a acelerar su crecimiento. (Fontana, 1986). . Corrosión por Cavidades. Esta corrosión puede surgir cuando se presenten intersticios entre dos superficies acopladas de piezas metálicas del mismo o diferente tipo, o bien entre piezas metálicas y depósitos de cuerpos extraños, incluso no metálicos (microorganismos u otros depósitos de materiales).. Este tipo de corrosión ataca la superficie metálica, debajo de la cual se encuentra oculta. (www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la_corro sion.pdf, 2016). . Corrosión Intergranular. Es una corrosión localizada a escala microscópica en los límites de grano de la aleación. En el acero inoxidable usualmente es resultado del agotamiento del cromo sobre los límites de grano en zonas sensibilizadas por procesos térmicos. Cuando los aceros inoxidables austeníticos son expuestos a temperaturas de un rango de 500 a 850°C y los ferríticos a un rango de 500 a 650°C, el cromo en la aleación tiende a combinarse con el carbono formando carburos de cromo. Los carburos formados se precipitan principalmente en los bordes de grano, reduciendo el cromo de las áreas adyacentes. Esto reduce la resistencia a la corrosión de las áreas con menor cantidad de cromo sensibilizando el material. La corrosión intergranular se caracteriza por la desintegración del material debida a la pérdida de los granos microscópicos. Existen también los aceros estabilizados con elementos como el titanio o el niobio que provocan preventivamente la precipitación de carburos que no empobrecen de cromo la aleación. (www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la_corro sion, 2016).. 11 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(28) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. . Corrosión Bajo Tensión. Toma la forma de una fractura ramificada en un material aparentemente dúctil. Para que la corrosión de fractura bajo tensión ocurra, se requiere de la interrelación de dos factores esenciales: en primer lugar, la superficie del material expuesto al medio corrosivo debe estar bajo esfuerzo de tensión; en segundo lugar, el medio corrosivo debe específicamente ser causa de la corrosión bajo tensión. El esfuerzo de tensión puede ser el resultado de cargas aplicadas, presión interna en el sistema, o esfuerzos residuales provenientes de soldaduras anteriores o combadura. El medio corrosivo que puede provocar la corrosión de fractura bajo tensión es aquel que tiene presencia de cloruros, sosa cáustica y sulfuros bajo condiciones de alta temperatura. La corrosión de fractura bajo tensión rara vez tiene lugar si la temperatura es menor a 50°C. (www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la_corro sion, 2016). . Corrosión Galvánica. Este tipo de corrosión ocurre cuando dos metales distintos están en contacto eléctrico y sumergido en el mismo electrolito (incluyendo la humedad atmosférica). El material más activo de los dos, denominado ánodo, se corroe a una velocidad mayor. El metal más pasivo, denominado cátodo, queda protegido y su velocidad de corrosión será menor a la normal. Al utilizar el mismo tipo de metal o al evitar el contacto eléctrico entre los dos metales diferentes. a. unir,. se. evita. este. tipo. de. corrosión.. (www.iminox.org.mx/downloads/publicaciones/manual_resistencia_a_la_corro sion, 2016).. PROCESO ELECTROQUÍMICO DE LA CORROSIÓN La corrosión metálica puede clasificarse en dos grandes categorías: corrosión seca y corrosión húmeda. La seca tiene lugar con la ausencia de una etapa líquida, o abajo del punto de humedad del ambiente. En este caso, el metal reacciona con los vapores de gases naturales, usualmente a altas temperaturas, formando óxidos secos o escamas. (Ávila y Genescá, 1986).. 12 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(29) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. En la corrosión húmeda, el metal reacciona con soluciones acuosas.. La. corrosión por humedad es la causa de la mayor cantidad del deterioro de materiales. Se ha establecido perfectamente que la corrosión húmeda es regularmente una reacción electroquímica. En la Figura 1.6 se presentan los elementos que forman la celda electroquímica. La reacción electroquímica se define como la reacción química que requiere de transferencia de electrones o que requiere de un proceso de oxidación y reducción. (Ávila y Genescá, 1986).. Fig. 1.6: Celda electroquímica. (http://members.tripod.com/~lizgarcia_2/corrosion1.htm, 2016). Las ecuaciones de oxidación y reducción que ocurren en este fenómeno son las siguientes:. A: 2 Fe. 2 Fe2+ + 4e- ……………… - 0.44 V. C: 2 H2O + O2 + 4e-. 4 OH-…………….. 0.40 V. El cátodo es la superficie del metal en la que la corriente deja la solución, y regresa al metal; no hay disolución del metal en el cátodo. El circuito se completa a través del metal mismo o afuera de la solución, mediante un conductor que une dos piezas del metal. (Ávila y Genescá, 1986).. 13 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(30) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. La oxidación o reacción anódica está marcada por el incremento en la valencia o en la producción de electrones. La disminución de la carga de valencia o el consumo de electrones significa una reducción, o reacción catódica. Las dos reacciones ocurren simultáneamente y a la misma velocidad en la superficie del metal. La velocidad de oxidación equivale a la velocidad de la reducción (producción y reducción de electrones). En algunas reacciones corrosivas, la oxidación se produce uniformemente en la superficie; mientras que en otros casos, ésta es localizada (ocurre en un área específica). Finalmente la demostración termodinámica de las reacciones de oxidación y reducción mencionadas anteriormente es la siguiente: C: O2 + 2 H2O + 4 e- 4 OH-. 0.40 V. A: 2 Fe 2 Fe 2+ + 4 e-. - 0.44 V. ----------------------------------------------------O2 + 2 H2O + 2 Fe 4 OH- + 2 Fe 2+. [. ] [. [. [. ------------------------ER = EC – EA = 0.84 V. ]. ] [. ]. [. ]. ]. [. [. ]. ] 14. Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(31) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. La energía libre de Gibbs (ΔG) es negativa, eso quiere decir que la reacción es espontánea. CINÉTICA DE CORROSIÓN . Fenómenos de Polarización. Una vez establecido el mecanismo de la corrosión electroquímica, los aspectos termodinámicos en que se fundamenta y conocidos los múltiples factores que justifican la existencia de regiones con distinto potencial electroquímico sobre la superficie metálica, y, por tanto, el funcionamiento de las pilas de corrosión, es preciso considerar como se puede conocer la velocidad con el que el proceso se lleva a cabo. La reflexión general sería la siguiente: “Si desde el punto de vista termodinámico el tránsito de un metal de la forma elemental a la forma combinada (corrosión) es un proceso espontáneo y favorecido, será importante conocer con que rapidez se produce, para poner los medios conducentes a que el tránsito sea lo más lento posible. (Otero, 1997). Desde un punto de vista cinético, en un sistema cualquiera en el cual tenga lugar el fenómeno de corrosión, existe un balance perfecto entre las reacciones anódicas y catódicas sobre la superficie del metal. En la figura 1.7 se ejemplifica un diagrama de Evans: a) que representa un diagrama que relaciona 15 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(32) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. la densidad de corriente con el potencial. Por razones de simplicidad en la construcción gráfica, se acostumbra a representar ambos procesos, anódico o de oxidación y catódico o de reducción, en un mismo cuadrante con lo que se obtiene, como se indica en la figura 1.7 b) el diagrama de Evans, o el de Evans – Tafel si en lugar de utilizar la corriente se emplea el logaritmo de la corriente en la Figura 1.7 c). Polarizando la superficie del metal que se corroe a un valor igual o inferior a Ea se anula la reacción anódica en el metal, siendo Ipc la corriente catódica que tendrá que ser suministrada por el sistema de protección catódica.. Fig. 1.7: Diagrama de Evans de un sistema en corrosión. (http://www.scielo.org.mx/pdf/sv/v25n1/v25n1a5.pdf, 2016). Cuando la cinética de los dos procesos, anódico y catódico, es tal que una pequeña variación en la corriente catódica provoca una gran variación en la 16 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(33) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. corriente anódica (osea en la corriente de corrosión), se dice que el sistema está bajo control catódico. Inversamente, cuando una pequeña variación en la corriente anódica produce un gran desequilibrio en el proceso catódico, o sea, en la intensidad de corrosión, se dice que el sistema está bajo control anódico. En la figura 1.8 se representan ambos casos.. Fig. 1.8: Sistema bajo control: (a) anódico, (b) catódico. (http://www.scielo.org.mx/pdf/sv/v25n1/v25n1a5.pdf, 2016). ELECTRODEPOSICIÓN La teoría del proceso de electrodeposición fue postulada inicialmente por Faraday y es uno de los tratamientos más utilizados para superficies metálicas para protegerlas de la corrosión, brindarles acabados decorativos según el metal empleado, para refinar, conformar o revestir. Tiene su fundamento en el fenómeno de electrólisis que procede cuando se hace pasar una corriente directa de electricidad entre electrodos sumergidos en una solución que contiene sales metálicas. Como resultado se tiene que los metales en su forma iónica migraran hacia el cátodo o electrodo negativo. La parte no metálica del electrolito, también en forma de iones, migrará a su vez hacia el ánodo o electrodo positivo. Basado en este principio es posible, en teoría, recubrir con una capa de espesor uniforme de cualquier metal una superficie metálica, pero existen restricciones de tipo químico, electroquímico, metalúrgico y económico. 17 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(34) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. que reducen el número de metales que es posible emplear. (Alvarado y colaboradores, 2010).. Fig.1.9: Fundamento de la electrodeposición de metales. (www.corinto.pucp.edu.pe, 2016) Los recubrimientos más comunes son de Aluminio, Cobre, Níquel, Zinc, Cromo, Bronce, Estaño, Oro y Plata entre otros, y las sales de las que se compone el electrolito varían entre cloruros, sulfatos y cianuros. Aunque el agua es el solvente más común empleado para las sales metálicas, existen desarrollos de investigaciones en los cuales se emplean soluciones no acuosas, solventes orgánicos y sales fundidas. En todo proceso de electrodeposición es de vital importancia que las superficies estén químicamente limpias, concretamente exentas de grasas, partículas extrañas no derivadas del metal base, como arena y polvo; y óxidos los cuales influyen negativamente en la calidad del depósito. A continuación se presentan las principales etapas de limpieza que se siguen antes del recubrimiento a escala industrial, aunque estas etapas pueden tener variaciones dependiendo de la forma y tipo de limpieza: (Alvarado y colaboradores, 2010). . Limpieza de Grasas y Sólidos. Generalmente se lleva a cabo en solución acuosa con una fase de inmersión en caliente seguida por una de limpieza electrolítica. Se usan solventes orgánicos. 18 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(35) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. (keroseno, gasolina), soluciones alcalinas (Hidróxido de Sodio, Carbonato de Sodio) y emulsiones dependiendo del tipo de suciedad a remover. (Ross, 1988). . Activación. En esta etapa se asegura que la superficie se encuentra libre de óxidos para dar lugar a enlaces intermetálicos de buena calidad en el depósito. La activación debe realizarse inmediatamente antes de la electrodeposición y no deben presentarse retardos entre ambas operaciones. Para la activación en aceros se hace una inmersión de 2 minutos a temperatura ambiente en una solución de ácido clorhídrico del 10% al 20%, o también es posible emplear ácido sulfúrico al 50% cuando se involucran componentes que requieren buena adhesión como el cromado. (Ross, 1988) El proceso de recubrimiento electrolítico se rige por las dos leyes de Faraday que establecen: El metal se depositará proporcionalmente en peso a la corriente usada. Así entre mayor sea la densidad de corriente alcanzada, mayor será el grosor del depósito dentro de una medida de tiempo dada (ecuación 2). (2) Dónde: W = Cantidad de elemento liberado en la electrólisis (mg o g) i = Corriente (Amperios (A)) t = Tiempo (seg o hr) Z = Equivalente electroquímico del metal (mg/C o g/A.h). Nota: El producto i.t expresa la cantidad de Coulombs que han circulado. El equivalente electroquímico (Z) representa el número de gramos depositados cuando ha circulado una cantidad de corriente de un Coulomb y se calcula de la siguiente manera de acuerdo a la ecuación 3: (Alvarado y colaboradores, 2010). 19 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
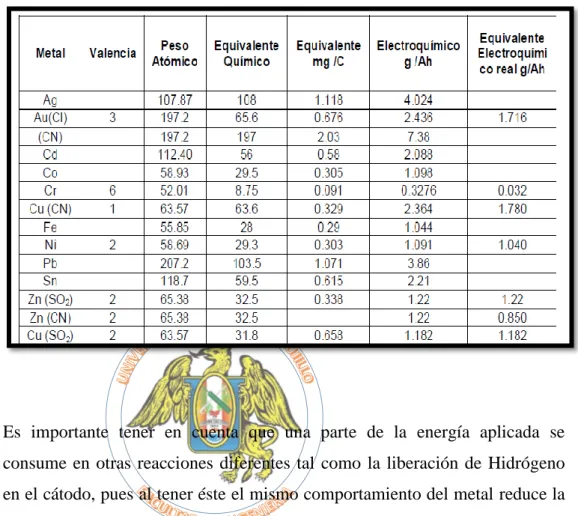
(36) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. (3). Y a su vez el equivalente gramo o químico se define como en la ecuación 4:. (4). Dónde: EG = Equivalente gramo M = Peso atómico F = Número de Faraday = 96,493 C/equiv. = 26.8 A.h n = Número de cargas que intervienen por átomo – gramo El número de Faraday se define como la cantidad de electricidad necesaria para depositar el peso equivalente (razón de peso atómico a valencia) en gramos de un elemento. Multiplicando el equivalente químico por la eficiencia del baño obtenemos el equivalente electroquímico real Zr. La velocidad de deposición estará controlada por el equivalente químico del metal que se deposita. Para las mismas condiciones de proceso la cantidad en peso de un metal depositado será diferente cuando varíe dicho equivalente, pues para una misma cantidad de electricidad el peso de un elemento liberado es proporcional a éste. La representación matemática de esta ley se presenta en la ecuación 8. (Alvarado y colaboradores, 2010). (5). 20 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(37) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Tabla 1.2. Valores de equivalentes electroquímicos para diferentes metales. (Alvarado y colaboradores, 2010). Es importante tener en cuenta que una parte de la energía aplicada se consume en otras reacciones diferentes tal como la liberación de Hidrógeno en el cátodo, pues al tener éste el mismo comportamiento del metal reduce la cantidad depositada. El rendimiento de la corriente catódica (R.C.C.) para un depósito metálico se define de acuerdo a las ecuaciones 6 - 8:. (6). (7). (8). 21 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(38) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Usualmente los valores de eficiencia catódica se ubican por encima de 90%. Los aspectos más importantes a controlar durante un proceso de electrodeposición son: a) Limpieza y activación previa de la superficie. b) Concentración de las soluciones electrolíticas. c) Temperatura. d) Densidad de corriente aplicada (entendida como la relación: corriente directa/área superficial a recubrir). En cuanto a la superficie recubierta como producto se realiza un monitoreo constante de: En cuanto a la superficie recubierta como producto se realiza un monitoreo constante de: Espesor del depósito. Adhesión. Apariencia en general. (Sujeta al uso de aditivos como abrillantadores). (Alvarado y colaboradores, 2010). ECUACIÓN DE ARRHENIUS La ecuación de Arrhenius es una expresión matemática que se utiliza para comprobar la dependencia de la constante de velocidad (o cinética) de una reacción química con respecto a la temperatura a la que se lleva a cabo esa reacción. (www.hiru.eus/quimica/energia-de-activacion-ecuacion-de-arrheniuscatalisis, 2016). Experimentalmente se observa que la velocidad de una reacción química aumenta al incrementarse la temperatura. (www.quimitube.com, 2016). Arrhenius observó que la mayoría de reacciones mostraba un mismo tipo de dependencia con la temperatura.. 22 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(39) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Esta observación condujo a la Ecuación de Arrhenius donde: (A) y (Ea) son conocidos como los parámetros de Arrhenius de la reacción. A es el factor de frecuencia o factor pre-exponencial (mismas unidades que k), es la frecuencia con la que se producen las colisiones (con orientación adecuada) en la mezcla reactiva por unidad de volumen.. (9). Donde: Ea = Energía de activación (kJ/mol), y es la energía cinética mínima de la colisión necesaria para que la reacción ocurra. e-Ea/RT = Es la fracción de colisiones con suficiente energía para reaccionar. Esta fracción aumenta cuando T aumenta, debido al signo negativo que aparece en el exponente. T = Temperatura en Kelvin R = constante de los gases ideales (8.314 J mol-1 K-1) ¾ K = constante de velocidad Forma logarítmica de la ecuación de Arrhenius: ln k versus 1/T da pendiente = –Ea/R y ordenada= ln A. (10). 23 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(40) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Una Energía de Activación alta corresponde a una velocidad de reacción muy sensible a la temperatura (la representación de Arrhenius tiene una pendiente grande) y al revés, una Energía de Activación pequeña corresponde a una velocidad de reacción relativamente insensible a cambios de temperatura.. Manipulación de la ecuación de Arrhenius: (i) Conocida la Energía de activación podemos predecir el valor de la constante de velocidad k’ a la temperatura T’ a partir de otro valor de k a otra temperatura T.. 24 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(41) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. (11). ln k’ – ln k = ln A – ln A – Ea/RT’ – (-Ea/RT). (12). (ii) Al revés, podemos calcular Ea si k’, k, T’ y T son conocidas. (www.uv.es/tunon/pdf_doc/QAIBtema5, 2016) CONDUCTIVIDAD Es la inversa de la resistividad, por lo tanto:. (13). Su unidad es el S/m (siemens por metro), no confundir con la conductancia que es G = 1/R (inversa de la resistencia). Un conductor tienes una conductividad (permisividad eléctrica) de 1 Siemens, si una diferencia de potencial entre sus extremos provoca el flujo de corriente de 1 Amperio. . La Conductividad Eléctrica. Es la capacidad de un cuerpo de permitir el paso de la corriente eléctrica a través de sí. También es definida como la propiedad natural característica de cada cuerpo que representa la facilidad con la que los electrones pueden pasar por él. La conductividad varía con la temperatura (es una de sus características más importante). . La Conductividad en Medios Líquidos. Está relacionada con la presencia de sales en solución, cuya disociación genera iones positivos y negativos capaces de transportar la energía eléctrica si se somete el líquido a un campo eléctrico. Estos conductores iónicos se. 25 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(42) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. denominan electrolitos o conductores electrolíticos. La conductividad es el parámetro utilizado para medir la concentración de iones y la actividad de una solución. Las determinaciones de la conductividad reciben el nombre de determinaciones conductométricas y tienen muchas aplicaciones, algunos ejemplos: -. En electrólisis, ya que el consumo de energía eléctrica en este proceso depende en gran medida de ella.. -. En estudios de laboratorio para determinar el contenido de sal de distintas soluciones durante la evaporación del agua (por ejemplo en el agua de calderas o en la producción de leche condensada, etc.. -. En estudio de las basicidades de los ácidos, puesto que pueden ser determinadas por mediciones de la conductividad.. -. Para determinar las solubilidades de electrólitos escasamente solubles y para hallar concentraciones de electrólitos en soluciones por titulación.. -. En control de plantas de producción de agua potable. -. En determinaciones de la salinidad del agua de mar. La conductividad eléctrica se utiliza para determinar la salinidad (contenido de sales) de suelos y substratos de cultivo, ya que se disuelven éstos en agua y se mide la conductividad del medio líquido resultante. Suele estar referenciada a 25 °C y el valor obtenido debe corregirse en función de la temperatura. (www.gisiberica.com/conduct%EDmetros/conductividad_el%E9ctrica.htm, 2016). Como la viscosidad de un líquido disminuye con la temperatura, la facilidad de transporte iónico y por tanto la conductividad eléctrica aumentará a medida que se eleva la temperatura. (www.hannainst.es/blog/conductividad-electrica-ytemperatura, 2016).. 26 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(43) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. LEY DE OHM La ley de Ohm dice que: "la intensidad de la corriente eléctrica que circula por un conductor eléctrico es directamente proporcional a la diferencia de potencial aplicada e inversamente proporcional a la resistencia del mismo".. (14). En el Sistema internacional de unidades: I= Intensidad en amperios (A) V = Diferencia de potencial en voltios (V) R = Resistencia en ohmios (Ω) La diferencia de potencial del generador "empuja " a moverse a los electrones, pero los cables y los demás elementos del circuito frenan este movimiento. (www.recursostic.educacion.es/secundaria/edad/3esofisicaquimica/3quincena1 1/3q11_contenidos_5d.htm, 2016) La ley de ohm propone que la corriente que fluye a través de un conductor, es proporcional a la fuerza electromotriz aplicada entre sus extremos, teniendo en cuenta que la temperatura y demás condiciones se mantengan constantes. En un circuito pasivo, la corriente es el resultado del voltaje aplicado; y existen efectos térmicos definitivos en la resistencia (o la resistencia efectiva) en los conductores.. 27 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
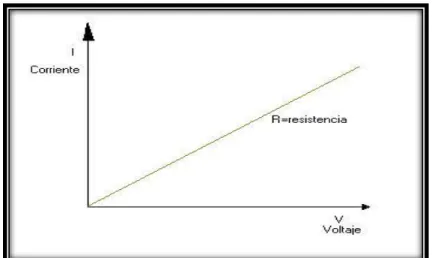
(44) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Fig. 1.10: Representación lineal de la corriente en función del Voltaje.. (www.uv.es/tunon/pdf_doc/QAIBtema5, 2016) La ley de Ohm es lineal y por lo tanto asume su linealidad en la parte electrónica. línea. Es. fácil. pensar. en. términos. de. una. ecuación. de. considerando la resistencia como la constante m, la corriente. como la variable x, y el voltaje como la variable dependiente y. De esta manera se establece una relación de proporcionalidad entre el voltaje y la corriente. Por supuesto, la Ley de Ohm puede ser reorganizada de tres maneras válidas y equivalentes. (https://es.wikiversity.org/wiki/Ley_de_Ohm, 2016). (15). (16). (17). 28 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
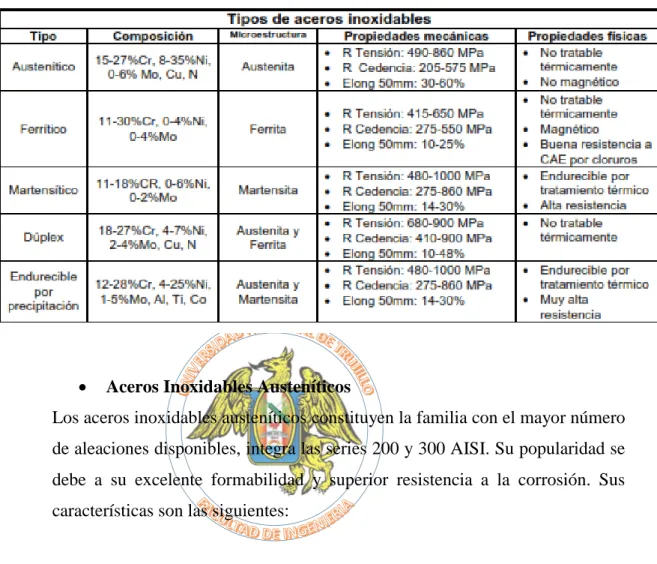
(45) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. ACEROS INOXIDABLES La principal característica del acero inoxidable es: La resistencia a la corrosión, propiedad que le infiere el contener cuando menos 10.5% de cromo en su peso. Al reaccionar con el oxígeno se forma una película de óxido de cromo (Cr2O3) pasivamente continua, muy resistente y estable en la superficie de los mismos. Esta película es extremadamente delgada (2 a 5 X 10-7 mm de espesor) y se encuentra aún en los aceros inoxidables con acabado súper-espejo. La capa pasiva se puede mejorar adicionando diferentes elementos de aleación. (www.bonnet.es/resitcorrosion.pdf,2016).. TIPOS DE ACERO INOXIDABLE. La familia de aceros inoxidables está clasificada y realizada por AISI (cuyas siglas en inglés significan, American Iron and Steel Institute, Instituto Americano del Hierro y el Acero), como se puede observar en la Tabla 1.3.. -. Acero Inoxidable austenítico, designaciones AISI 200 y 300. -. Acero Inoxidable ferrítico, designación AISI 400. -. Acero Inoxidable martensítico, designaciones AISI 400 y 500. -. Acero Inoxidable endurecido por precipitación, designación XXXHP. Para el último grupo de aceros, los dos primeros números de la designación representan el contenido de cromo en %; la tercera cifra indica el contenido de níquel; y las letras HP, el tipo de acero (por sus siglas en inglés “Hardening Precipitation”), endurecidos por precipitación.. En cada uno de los cuatro tipos principales de aceros inoxidables, existe una composición química que representa la aleación base de la familia (tabla 1.3) Las demás aleaciones del grupo se derivan de esta aleación base, con variaciones específicas de composición para impartir propiedades específicas.. 29 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(46) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. Tabla 1.3: Clasificación y características de los aceros inoxidables (AISI). (http://www.worldstainless.org, 2016). . Aceros Inoxidables Austeníticos. Los aceros inoxidables austeníticos constituyen la familia con el mayor número de aleaciones disponibles, integra las series 200 y 300 AISI. Su popularidad se debe a su excelente formabilidad y superior resistencia a la corrosión. Sus características son las siguientes:. -. Excelente resistencia a la corrosión. -. Endurecidos por trabajo en frío y no por tratamiento térmico. -. Excelente soldabilidad. -. Excelente factor de higiene y limpieza. -. Formado sencillo y de fácil transformación. -. Tienen la habilidad de ser funcionales en temperaturas extremas. -. Son no magnéticos. Los Austeníticos se obtienen adicionando elementos formadores de austenita, tales como níquel, manganeso y nitrógeno. El contenido de cromo generalmente varía del 16 al 26% y su contenido de carbono es del rango de 0.03 al 0.08%. El cromo proporciona una resistencia a la oxidación en. 30 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
(47) BIBLIOTECA DIGITAL - DIRECCIÓN DE SISTEMAS DE INFORMÁTICA Y COMUNICACIÓN. temperaturas aproximadas de 650º C en una variedad de ambientes. Esta familia se divide en dos categorías:. -. SERIE 300 AISI.- Aleaciones cromo-níquel. -. SERIE 200 AISI.- Aleaciones cromo-manganeso-nitrógeno. a) SERIE 300 AISI Es la más extensa, mantiene alto contenido de níquel y hasta 2% de manganeso. También puede contener molibdeno, cobre, silicio, aluminio, titanio y niobio, elementos que son adicionados para conferir ciertas características. En ciertos tipos se usa azufre o selenio para mejorar su habilidad de ser maquinados.. 304.- Todo propósito, tiene propiedades adecuadas para gran cantidad de aplicaciones. Se recomienda para construcciones ligeras soldadas que requieran buena resistencia a la corrosión. Tiene buen desempeño en temperaturas elevadas (800 a 900º C) y buenas propiedades mecánicas. Es recomendable cuando se requiera soldar altos espesores de material. Algunas aplicaciones son equipo químico de proceso, accesorios para aviones, remaches, equipo para hospitales, etc.. b) SERIE 200 AISI Contiene menor cantidad de níquel. El contenido de manganeso es de 5 a 20%. La adición de nitrógeno incrementa la resistencia mecánica.. 31 Esta obra ha sido publicada bajo la licencia Creative Commons Reconocimiento-No Comercial-Compartir bajo la misma licencia 2.5 Perú. Para ver una copia de dicha licencia, visite http://creativecommons.org/licences/by-nc-sa/2.5/pe/.
Figure
Documento similar
Parámetros de corrosión obtenidos la técnica de ruido electroquímico para el acero al carbono AISI 1018 sumergido en una muestra de agua amarga proveniente de la industria del
Parámetros de corrosión obtenidos la técnica de ruido electroquímico para el acero al carbono AISI 1018 sumergido en una muestra de agua amarga proveniente de la industria
Vista local de la corriente, potencial y resistencia al ruido obtenidos mediante ruido electroquímico para un sistema de acero al carbono SAE 1018 sumergido en una muestra de
Además de aparecer en forma de volumen, las Memorias conocieron una primera difusión, a los tres meses de la muerte del autor, en las páginas de La Presse en forma de folletín,
Esto viene a corroborar el hecho de que perviva aún hoy en el leonés occidental este diptongo, apesardel gran empuje sufrido porparte de /ue/ que empezó a desplazar a /uo/ a
por unidad de tiempo (throughput) en estado estacionario de las transiciones.. de una red de Petri
Las poliamidas, como se ha explicado anteriormente, tienen un módulo de elasticidad bajo por lo que carecería de resistencia mecánica suficiente para poder ejercer
Cuatro puntos importantes de los avances de esta época son: en primer lugar, los resultados publicados por IBM sobre los experimentos con el sistema estadístico puro Candide;