CARACTERIZACIÓN DE ESPECIES DE MALASSEZIA COMO MICROBIOTA COMENSAL EN LA PIEL DE EQUINOS
DIANA MILENA RODRÍGUEZ SANDOVAL
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE BACTERIOLOGÍA BOGOTÁ
CARACTERIZACIÓN DE ESPECIES DE MALASSEZIA COMO MICROBIOTA COMENSAL EN LA PIEL DE EQUINOS
DIANA MILENA RODRÍGUEZ SANDOVAL
TRABAJO DE GRADO Presentado como requisito
Para optar al título de
BACTERIÓLOGA
DIRECTOR:
Dra. RUBIELA CASTAÑEDA SALAZAR M.V., MSc. CO-DIRECTOR:
Dra. MELVA YOMARY LINARES LINARES BACT., MSc.
PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS
CARRERA DE BACTERIOLOGÍA BOGOTÁ
CARACTERIZACIÓN DE ESPECIES DE MALASSEZIA COMO MICROBIOTA COMENSAL EN LA PIEL DE EQUINOS
DIANA MILENA RODRÍGUEZ SANDOVAL
NOTA DE ADVERTENCIA
Resolución No 13 de Julio de 1946.
DEDICATORIA
La dedico profundamente a Dios y a la Virgen por darme fortaleza, e iluminar cada día de mi vida
A mi Madre por su dedicación, amor, comprensión y esfuerzo por brindarme un buen futuro
A mi Primo Hermano Carlos Alberto por su dedicación, apoyo, y compañía,
A mis Abuelitos Bárbara, Rita y Leonardo por su amor, ejemplo y apoyo incondicional
A mi Novio Juan Pablo Ramírez por su colaboración, amor y paciencia
AGRADECIMIENTOS
Agradezco a mis profesores que a lo largo de mi carrera han dejado su huella plasmada y me han inculcado grandes valores, convirtiéndome en una persona perseverante y triunfadora
A la Universidad Javeriana y al grupo de investigación UNIDIA los cuales me permitieron la realización de este trabajo
A la Dra. Rubiela Castañeda Salazar por sus conocimientos, por creer en mí, por su apoyo, su paciencia, dedicación y cariño
A la Dra. Melva Yomary Linares Linares por su apoyo, su valiosa orientación, por sus conocimientos, su paciencia y cariño
TABLA DE CONTENIDO
PAGINA
RESUMEN 1
1. INTRODUCCIÓN, PLANTEAMIENTO DEL PROBLEMA, JUSTIFICACIÓN 2
2. MARCO TEORICO 3
2.1 Características del genero Malassezia 3
2.2 Identificación Macroscópica y Microscópica del genero Malassezia 4
2.3. Identificación de especies del genero Malassezia 4
2.3.1 Pruebas bioquímicas 5
2.3.2 Otras pruebas complementarias 7
2.4 Malassezia en Equinos 8 3. OBJETIVOS 10
3.1 Objetivo General 10 3.2 Objetivos Específicos 10
4. METODOLOGÍA 11 4.1 Población de estudio 11
4.2 Muestreo, transporte y procesamiento de las muestras 11
4.3 4.4 Control de calidad y Mantenimiento de las cepas Análisis de la información 13 13 5. RESULTADOS Y DISCUSIÓN 13 5.1 Examen directo 13 5.2 Descripción macroscópica 14
5.3 Descripción microscópica 15 5.4 Identificación de especies del genero Malassezia mediante pruebas
bioquímicas
16
6. CONCLUSIONES 23
7. RECOMENDACIONES 23
ÍNDICE DE TABLAS
PÁGINA Tabla 1. Identificación de las especies del genero Malassezia 8 Tabla 2. Descripción macroscópica de las colonias identificadas como
Malassezia
14
Tabla 3. Mediciones microscópicas de las especies identificadas como Malassezia a partir de los aislamientos obtenidos.
16
Tabla 4. Identificación de los aislamientos obtenidos de acuerdo con las pruebas bioquímicas.
19
Tabla 5. Especies aisladas según variables como raza, género y edad. 22
ÍNDICE DE FIGURAS
PÁGINA
.
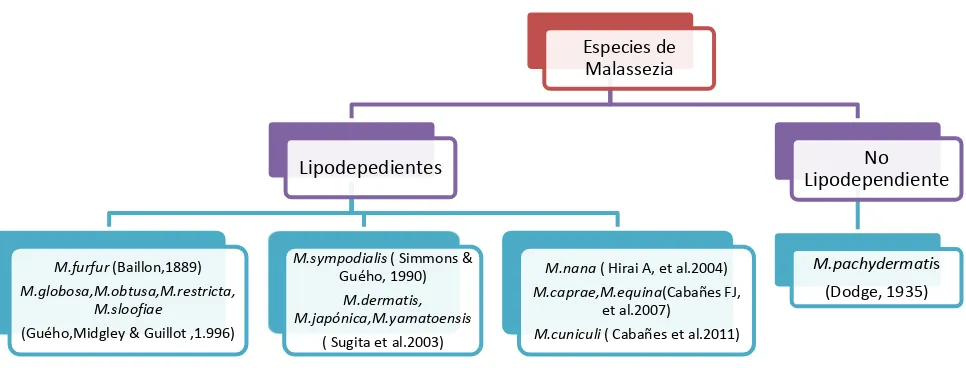
Figura 1. Clasificación de las especies del Género Malassezia según el
requerimiento de lípidos para su crecimiento. 4
Figura 2. Identificación bioquímica de especies de Malassezia 6
Figura 3. Distribución de las especies de Malassezia en diferentes localizaciones de la piel en equinos.
9
Figura 4. Medidas microscopicas identificadas como Malassezia Tinción de Gram 100x
15
Figura 5. Resultados pruebas bioquímicas aislamientos identificados como Malassezia
CARACTERIZACIÓN DE ESPECIES DE MALASSEZIA COMO MICROBIOTA COMENSAL EN LA PIEL DE EQUINOS
RESUMEN
1. INTRODUCCIÓN, PLANTEAMIENTO DEL PROBLEMA Y JUSTIFICACIÓN
El género Malassezia comprende un grupo de levaduras unicelulares que forman parte de la microbiota fúngica normal de la piel de humanos y animales de sangre caliente (Kaneko, 2007). Fisiológicamente tienen afinidad por los lípidos, los cuales utilizan como única fuente de carbono, a excepción de Malassezia pachydermatis, la cual es no lipodependiente (Hernández, 2005).
Se han descrito casos en los que esta microbiota comensal puede ocasionar patologías en humanos como: pitiriasis versicolor (PV), dermatitis seborreica (DS) y dermatitis atópica (DA), comportándose como patógeno oportunista si se presenta alteración en la piel u otros factores que puedan favorecer el paso de flora comensal a patógena como humedad, desórdenes en la queratinización e inmunosupresión, entre otros (Hernández, 2005).
En los animales, Malassezia ha adquirido importancia por su asociación a procesos patológicos como patógeno oportunista emergente (Hernández,2005), siendo M. pachydermatis el agente etiológico aislado con mayor frecuencia en diferentes patologías como otitis externa en los caninos y dermatitis en los felinos (Garau,2005 ;Castellá et al. 2005) recientemente, dos nuevas especies han sido descritas como flora comensal en la piel de animales sanos, M. caprae (caprinos)y M. equina (equinos).(Cabañes et al. 2007).
2. MARCO TEÓRICO
2.1 Características del género Malassezia
Las levaduras del género Malassezia se clasifican dentro del phylum Basidiomicota, subphylum Ustilaginomycotina, clase Exobasidiomycetes, orden Malasseziales, (Erchiga et al. 2008), familia Malasseziaceae (Gaitanis et al. 2012). Estas levaduras hacen parte de la microbiota comensal cutánea de humanos y animales (Hernández, 2005) y se reproducen por gemación unipolar dejando una prominente y característica cicatriz en la célula madre (Giusiano, 2006).
Fisiológicamente, Malassezia se caracteriza por ser lipidodependiente, debido a que tiene un defecto en la capacidad de sintetizar ácidos grasos saturados C12–C16, lo que se manifiesta en el requerimiento de una fuente exógena de estos ácidos para su desarrollo, a excepción de M. pachydermatis quees la única especie del género que no requiere de sustancias lipídicas para su crecimiento (Giusiano, 2006). Por lo anterior, los medios comúnmente utilizados son Agar Dixon y Agar Leeming y Notman, medios selectivos que son efectivos para la recuperación y aislamiento de las levaduras del genero Malassezia (Hernández 2005; Kaneko et al. 2007).
Figura 1. Clasificación de las especies del género Malassezia según el requerimiento de lípidos para su crecimiento.
2.2 Identificación Macroscópica y Microscópica del genero Malassezia
La morfología macroscópica es variable, observándose colonias pequeñas, de aspecto cremoso a amarillo, algunas veces lisas o ligeramente rugosas umbilicadas; brillantes u opacas, planas, con borde liso, textura cremosa, esféricas, ovales o cilíndricas y de tamaños diferentes de acuerdo con la especie evaluada (Hernández , 2005).
Al microscopio se aprecian Blastoconidias que pueden ser ligeramente alargadas, u ovales de 2-4 μm de largo por 1-2 μm de ancho aproximadamente, con gemas pequeñas. (Bonifaz, 2012)
2.3 Identificación de especies del género Malassezia
Para la identificación de aislamientos del género Malassezia spp, se realizan diferentes pruebas de laboratorio que permiten llegar a identificar la especie entre ellas se citan las siguientes:
Especies de Malassezia
Lipodepedientes
M.furfur (Baillon,1889)
M.globosa,M.obtusa,M.restricta, M.sloofiae
(Guého,Midgley & Guillot ,1.996)
M.sympodialis ( Simmons & Guého, 1990)
M.dermatis, M.japónica,M.yamatoensis
( Sugita et al.2003)
M.nana ( Hirai A, et al.2004)
M.caprae,M.equina(Cabañes FJ, et al.2007)
M.cuniculi ( Cabañes et al.2011)
No Lipodependiente
2.3.1 Pruebas bioquímicas
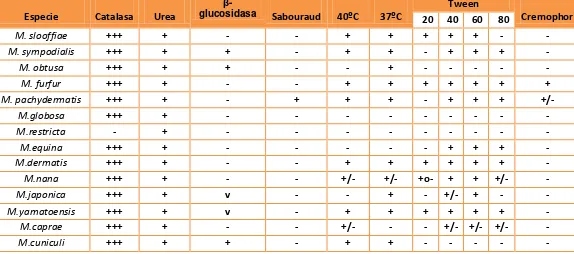
- Catalasa: Esta prueba permite evaluar si el microorganismo posee o no la enzima catalasa que descompone el peróxido de hidrogeno en oxígeno y agua. La prueba se considera positiva, si se observa formación de burbujas (Khosravi et al. 2008), siendo M. restricta la única especie de este género que es catalasa negativa (Guého et al. 1996, Hernández, 2005; Kaneko et al. 2007; Cabañes 2011), aunque la reacción de M. pachydermatis para esta prueba es variable (Khosravi et al. 2008)
- Ureasa: Por medio de esta prueba se evalúa la capacidad del microorganismo para hidrolizar la úrea formando dos moléculas de amoniaco por medio de la reacción enzimática de la ureasa. La prueba se considera positiva si el medio vira a color fucsia debido al indicador rojo de fenol (Pérez et al. 2002).
- β- glucosidasa: Prueba que se utiliza para evidenciar si el microorganismo produce o no la enzima β- glucosidasa, que hidroliza la beta esculina en glucosa y esculetina, por reacción con una sal de hierro formando un complejo de color castaño oscuro o negro (Mayzer et al. 1997). Para esta prueba se considera una reacción positiva el viraje a color negro en el medio de cultivo (Khosravi et al. 2008).
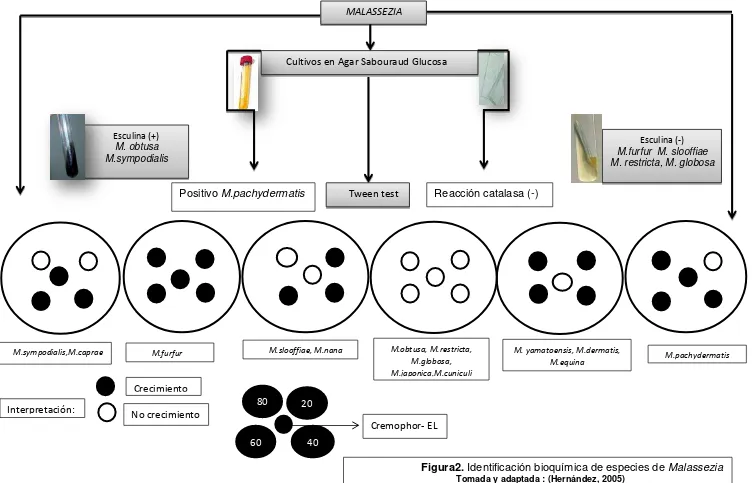
- Asimilación del Cremophor-EL: Esta prueba determina la capacidad del microorganismo para asimilar el Cremophor-EL (Aceite de castor). Se considera una reacción positiva si luego de 5 días de incubación a 32°C se observa alrededor del pozo un halo de asimilación y una reacción negativa si hay ausencia del mismo (Figura 2) (Kaneko et al. 2007). Siendo M. furfur la única especie reportada como positiva (Mayzer, 1997; Hernández, 2005; Giusianio, 2006), aunque últimamente para M.pachydermatis se ha reportado una reacción variable para asimilar el Cremophor (Ashbee, 2007).
Esculina (+) M. obtusa M.sympodialis
Esculina (-) M.furfur M. slooffiae M. restricta, M. globosa
MALASSEZIA
Cultivos en Agar Sabouraud Glucosa
Tween test
M.sympodialis,M.caprae M.furfur M.slooffiae, M.nana M.obtusa, M.restricta, M.globosa, M.japonica,M.cuniculi
M. yamatoensis, M.dermatis,
M.equina M.pachydermatis
80 20
60 40
Crecimiento
No crecimiento
Cremophor- EL Interpretación:
Figura2. Identificación bioquímica de especies de Malassezia Tomada y adaptada : (Hernández, 2005)
[image:15.792.24.776.52.535.2]2.3.2 Otras pruebas complementarias
- Crecimiento en Agar Sabouraud: Por medio de esta prueba se evalúa la capacidad del microorganismo para crecer en agar Sabouraud sin suplementos lipídicos (Guého et al. 1996), siendo M. pachydermatis la única especie de este género que crece en agar Sabouraud (Guého et al. 1996; Sugita et al. 2003; Hirai et al. 2004; Hernádez ,2005; Kaneko, 2007; Cabañes &Castellá, 2011).
- Producción de fosfolipasa en agar Sabouraud con yema de huevo: Permite determinar si el microorganismo produce la enzima fosfolipasa (Pini et al. 2011). La lectura de la prueba se realiza mediante la medición del halo formado alrededor de la colonia (Ortiz, 2012). Los resultados de la actividad enzimática se expresan como una razón (Pz) que se determina midiendo el diámetro de la colonia y el diámetro de la colonia más el halo de hidrólisis que se generó alrededor de ella (Price et al. 1982; Pini et al. 2011). Se han establecido rangos que permiten clasificar la actividad fosfolipasa así: PZ<0.64: muy alta, PZ ≥ 0.64 y <1: alta y PZ=1: nula (Cafarchia & Otranto, 2004). La actividad fosfolipasa juega un papel importante como factor de virulencia, una alta actividad fosfolipasa puede estar involucrada en el mecanismo por el cual estas levaduras pueden generar procesos inflamatorios (Ortiz, 2013).
- Crecimiento en agar Dixon a temperaturas de 37 y 40 oC: Otra forma para poder identificar las especies del genero Malassezia es por la capacidad del microorganismo para crecer a diferentes temperaturas (Guého et al. 1996; Hernández, 2005) a 37°c se ha reportado crecimiento débil para las especies M. globosa, M. obtusa, M.restricta, M. equina y M.nana; buen crecimiento para: M.pachydermatis, M.furfur M. sympodialis, M. slooffiae, M. dermatis, M, japónica, M. yamatoensis y M. cuniculi. Mientras que a 40°C se ha reportado crecimiento para todas las especies excepto M. globosa, M. obtusa, M. restricta, M. japonica, M. equina y M. caprae. Para las dos temperaturas se ha reportado crecimiento para las especies M. furfur, M. pachydermatis, M. sympodialis, M. slooffiae, M. dermatis, M. yamatoensis y M. cuniculi (Guého et al. 1996; Sugita et al. 2003; Hirai et al. 2004; Hernández, 2005; Kaneko, 2007; Cabañes, 2011).
Tabla 1. Identificación de las especies del genero Malassezia
(+) Crecimiento, (-) no crecimiento, +/- Crece débilmente
Tomada y adaptada de (Guého et al. 1996; Sugita et al.2003; Hirai et al.2004;Hernández, 2005; Cabañes, 2011)
2.4 Malassezia en Equinos
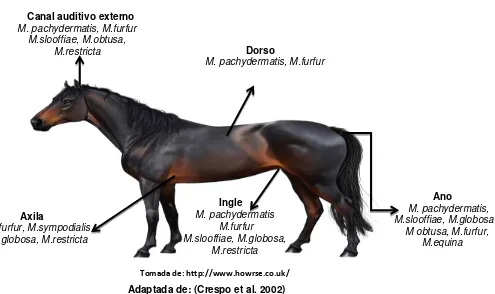
Las infecciones de tipo micótico son de rara ocurrencia en equinos, a excepción de las ocasionadas por Dermatofitos (Pérez et al. 2000); sin embargo actualmente existen reportes sobre la participación de levaduras del género Malassezia que han ido adquiriendo importancia debido a que aunque se pueden encontrar como microbiota comensal en diferentes áreas del cuerpo, pueden causar o estar asociadas a determinados desórdenes dermatológicos (Cafarchia, 2013), siendo las levaduras lipodependientes las más comúnmente reportadas como flora normal (Crespo et al. 2002). Aunque existen pocos estudios sobre la presencia de Malassezia spp como microbiota comensal en diferentes regiones anatómicas de la piel de los equinos, algunos reportes evidencian la presencia de especies de Malassezia en diferentes localizaciones de la siguiente forma: M. pachydermatis, en ingle, dorso, ano, canal auditivo externo; M.furfur
Especie Catalasa Urea
β-
glucosidasa Sabouraud 40ºC 37ºC Tween Cremophor
20 40 60 80
M. slooffiae +++ + - - + + + + + - -
M. sympodialis +++ + + - + + - + + + -
M. obtusa +++ + + - - + - - - - -
M. furfur +++ + - - + + + + + + +
M. pachydermatis +++ + - + + + - + + + +/-
M.globosa +++ + - - - - - - - - -
M.restricta - + - - - - - - - - -
M.equina +++ + - - - - - + + + -
M.dermatis +++ + - - + + + + + + -
M.nana +++ + - - +/- +/- +o- + + +/- -
M.japonica +++ + v - - + - +/- + - -
M.yamatoensis +++ + v - + + + + + + -
M.caprae +++ + - - +/- - - +/- +/- +/- -
[image:17.612.20.594.135.389.2]en axila, ingle, dorso, ano y canal auditivo externo; M. restricta en axila, ingle y canal auditivo externo, M.sympodialis en axila; M. slooffiae en ingle, ano, canal auditivo externo; M .obtusa en ano y canal auditivo externo y M. globosa en axila, ingle y ano (White 2006; Crespo et al. 2002). Adicionalmente, Cabañes & Boekhout en el año 2007, reportaron el aislamiento de una nueva especie de Malassezia a partir de muestras del ano de un equino sano, la cual fue clasificada como M. equina, que se caracteriza macroscópicamente por presentar colonias rugosas color crema de 2-3 mm, con células elipsoidales u ovales, de 3-4.5 x 2.2-3.5 μm , catalasa positiva, β- glucosidasa negativa, asimila los Tweenes 40, 60 y 80, no asimila el cremophor EL, presenta un crecimiento débil a 37°C; se considera que guarda una relación con M. sympodialis ya que se ha demostrado un grado de similitud en sus nucleótidos al realizarles análisis moleculares en la secuencia D1/D2 en los dominios del gen 26S rRNA en la región ITS 1 (Cabañes et al. 2007). La distribución de las diferentes especies según el sito anatómico se detalla en la figura 3.
Tomada de: http://www.howrse.co.uk/
[image:18.612.77.572.365.659.2]Adaptada de: (Crespo et al. 2002)
Figura 3. Distribución de las especies de Malassezia en diferentes localizaciones de la piel en equinos.
Ano
M. pachydermatis, M.slooffiae, M.globosa. M obtusa, M.furfur, M.equina Dorso
M. pachydermatis, M.furfur
Axila M.furfur, M.sympodialis M.globosa, M.restricta Ingle M. pachydermatis M.furfur M.slooffiae, M.globosa, M.restricta
Canal auditivo externo M. pachydermatis, M.furfur
En cuanto a la participación de Malassezia en procesos patológicos en equinos, existen dos reportes de caso. En el primero de ellos, un macho presentaba lesiones dérmicas en la cara, el cual tenía una condición pre existente de Alopecia areata, sin embargo, al realizar examen directo y crecimiento en agar sabouraud se identificaron levaduras del genero Malassezia spp, las cuales fueron consideradas como un patógeno oportunista, por lo cual se enfatizó sobre la necesidad de estudiar el papel de Malassezia spp como microbiota normal en la piel de los equinos o si está relacionada como patógeno en un proceso de enfermedad como el reportado en este caso. (Paterson ,2002)
En el otro caso reportado, se examinaron yeguas que presentaban prurito intenso en la glándula mamaria a las cuales les fue realizado un examen citológico que reveló numerosas levaduras las cuales no pudieron ser identificadas hasta especie, lo cual sugeriría su posible papel como patógeno oportunista en estos animales; sin embargo se examinaron también las yeguas sanas, a las cuales se les identificó un gran número de levaduras en la glándula mamaria las cuales sí pudieron ser identificadas hasta especie encontrándose M. slooffiae y M equina (White, 2005). Posteriormente, en otro estudio realizado en 11 equinos (5 hembras y 6 machos castrados) se aisló a partir de la piel, en particular en la región intermamaria de las yeguas y la fosa prepucial de los machos, 7 levaduras pertenecientes al género Malassezia, dentro de las cuales predominó la especie M. equina con lo cual corroboraron que las levaduras de este génerohacían parte de la microbiota normal de los equinos evaluados (White et al. 2006).
3. OBJETIVOS
3.1 OBJETIVO GENERAL: Caracterizar las especies del género Malassezia en el canal auditivo externo y la piel de equinos remitidos a la Clínica de Grandes Animales de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia. 3.2 OBJETIVOS ESPECÍFICOS:
Identificar aislamientos de Malassezia spp en muestras de canal auditivo externo y piel de equinos sanos.
Determinar la prevalencia de Malassezia spp. en piel de equinos remitidos a la Clínica de Grandes animales de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia durante el periodo comprendido entre Diciembre de 2013 a Abril de 2014.
4. METODOLOGÍA
4.1 Población de estudio: Para este estudio se evaluaron 22 Equinos remitidos a la Clínica de Grandes Animales (CGA) de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, durante los meses de Diciembre de 2013 a Abril de 2014.
4.2 Muestreo, Transporte y Procesamiento de las muestras: Se realizaron hisopados de la piel del prepucio, glándula mamaria, ingle e hisopados de canal auditivo externo, obteniéndose 82 muestras en total, las cuales fueron transportadas al laboratorio de la PUJ, en tubo estéril, a temperatura ambiente y en el menor tiempo posible. A cada muestra se le realizó examen directo mediante la elaboración de un frotis en lámina portaobjetos, se fijó y se coloreó con tinción de Gram para ser observado al microscopio e identificar la presencia de estructuras levaduriformes o blastoconidias redondas u ovales de tamaño variado, estructuras filamentosas y/o bacterias. Posterior a esto cada muestra fue sembrada en Agar Dixon modificado (Extracto de malta 36 g, Peptona 6 g, Ox bile 20 g, Tween 40 10 ml, Glicerol 2 ml, Ácido oleico 2 ml, Agar 12 g, Agua desionizada 1.000 ml) (López ,2007) y se incubó a 320C durante 5 días.
De las siembras en las que se observaron colonias compatibles con Malassezia se hizo un nuevo aislamiento para obtener colonias puras y de esta forma poder realizar la descripción macroscópica del crecimiento observado, evaluando las diferentes características de los aislamientos obtenidos como tamaño, textura, color; forma; así como el borde y la superficie de la colonia. Para la descripción microscópica se utilizó el microscopio Leica DM 100 LED versión 2.1.0 el cual permitió medir el ancho y el largo de las células en micrómetros, por medio de un extendido teñido con coloración de Gram; por último, para la identificación de especies del género Malassezia se realizaron las siguientes pruebas bioquímicas:
- Ureasa: La prueba se realizó inoculando la levadura en la superficie del medio de cultivo (agar úrea), posteriormente se incubó a 32oC, durante 7 días. La prueba se consideró positiva si el medio viraba a color fucsia debido al indicador rojo de fenol (Pérez et al. 2002)
-β- glucosidasa: La prueba se realizó inoculando el microorganismo por punción en el medio, se incubo a 32oC durante 7 días. Para esta prueba se consideró una reacción positiva el viraje a color negro en el medio de cultivo. (Khosravi et al.2008)
-Asimilación del Cremophor-EL: La prueba se realizó a partir de una suspensión concentrada del microorganismo, de la cual se adicionaron 400µl a 10 ml de agar mycosel esta mezcla se depositó en una caja de Petri pequeña hasta que se solidificó, posteriormente se realizó un pozo en el centro, donde se agregaron 50µl de Cremophor. Para esta prueba se consideró una reacción positiva si luego de 7 días de incubación a 32°C se observaba alrededor del pozo un halo de asimilación (Kaneko, 2007).
-Asimilación del Tween: A partir de una suspensión del microorganismo en una concentración de 0,5 en la escala de MacFarland, se adicionaron 2 ml a un tubo con 16ml de agar sabouraud adicionado con 0,05% de cloranfenicol y 0.05% cycloheximida (Mayzer, 1997; Khosravi et al. 2008). Esta preparación se depositó en una caja de Petri grande hasta su solidificación. Posteriormente, se hicieron 4 pozos de (2mm) a los que se adicionaron 7µl de cada Tween. La lectura se realizó evidenciando el crecimiento o asimilación del microorganismo frente a cada Tween después de 7 días de incubación a 32°C (Kaneko, 2007; Hernández, 2005).
Pruebas complementarias
-Crecimiento en agar sabouraud: Se realizó siembra superficial de cada uno de los aislamientos en tubo inclinado con agar sabouraud, se incubaron a 32°C por 7 días, para observar si hubo crecimiento (Kaneko, 2007; Hernández, 2005)
-Producción de fosfolipasa en agar Sabouraud con yema de huevo: La prueba se realizó en agar Sabouraud adicionado con 10% de yema de huevo, para esto se realizaron cuatro inoculaciones del microorganismo en puntos equidistantes, se incubó a 32oC por 7 días, después de los cuales se hizo la medición de los halos y se calcularon los índices Pz (Countinho, 2005)
- Características microscópicas: Se realizó la medición del largo y ancho de las células en micrómetros en un extendido de los aislamientos obtenidos teñido con coloración de Gram, para lo cual se utilizó el microscopio Leica DM 100 LED versión 2.1.0
4.3 Control de calidad y Mantenimiento de las cepas: Como control de calidad se utilizaron las cepas de referencia M. furfur CBS 7019, M. pachydermatis CBS 1879, M. sympodialis CBS 7222, M. slooffiae CBS 7956 pertenecientes a la colección de microorganismos del Grupo de Micología y Fitopatología de la Universidad de Los Andes, las cuales se conservaron en el medio Skim milk a -20°C, al igual que los aislamientos obtenidos.
4.4 Análisis de la información: Los datos obtenidos fueron registrados utilizando tablas de Excel y se determinó la prevalencia general de Malassezia en la población evaluada utilizando la formula:
5. RESULTADOS Y DISCUSIÓN
De las 82 muestras procesadas, 12,2% (n=10) correspondieron a hisopados de prepucio, 14,6% (n=12) de glándula mamaria, 19,5% (n=16) de ingle y 53,6% (n=44) de canal auditivo externo izquierdo y derecho.
5.1 Examen directo: Al examen directo con tinción de Gram se observaron levaduras de formas y tamaños diferentes en el 17,07% (n=14) del total de las muestras de las cuales el 8,53% (n=7) fueron identificadas como Malassezia, el 6,09%(n=5) como Cándidas y el 2,43%(n=2) como Cryptococcus spp, a las cuales se les realizó la descripción macroscópica, microscópica y las pruebas bioquímicas para su identificación. Adicionalmente, en el 40,24% (n=33) de las muestras se observaron en el directo bacterias y en el 42,68% (n=35) se observaron hifas.
Numero de eventos P=
5.2 Descripción macroscópica: A las colonias morfológicamente compatibles con Malassezia se les realizó descripción macroscópica evaluando diferentes parámetros como: Tamaño, borde, superficie, apariencia, elevación, color textura (Tabla 2) donde predominaron las colonias planas pequeñas, de bordes lisos, aisladas en su mayoría de oído izquierdo (n=5) y de glándula mamaria (n=2).
Tabla 2. Descripción macroscópica de las colonias identificadas como Malassezia
ID PUJ Descripción macroscópica de las colonias en Agar
Dixon Imagen
300-1-1
M.slooffiae
Colonias irregulares , rugosas elevadas, blancas,
opacas (1mm de diámetro en promedio) 300-5-13
M.obtusa
Colonias pequeñas, planas, bordes lisos, puntiformes, opacas (1,3mm de diámetro
en promedio) 300-5-13A
Malassezia spp
Colonias planas pequeñas, bordes lisos, opacas(2mm
de diámetro en promedio)
300-5-13B
Malassezia spp
Colonias umbilicadas pequeñas, bordes lisos, opacas (1mm de diámetro
en promedio)
300-14-47
M. globosa
Colonias puntiformes, elevadas, medianas, brillantes, cremosas, bordes lisos (1,4mm de diámetro en
promedio)
300-14-49
M.pachydermatis
Colonias medianas, umbilicadas, borde irregular, elevadas, brillantes, blancas
(2,1mm de diámetro en promedio)
300-15-53
M.sympodialis
Colonias lisas, elevadas, blancas, puntiformes,
pequeñas brillantes. (1,7mm de diámetro en
Al comparar los resultados obtenidos en la descripción macroscópica de los aislamientos identificados como Malassezia spp. con lo reportado por diferentes autores los cuales mencionan unas características propias para cada especie de Malassezia, se encontró que hubo coincidencia en cuanto a la descripción de las colonias y los parámetros evaluados como: forma, bordes, elevación y textura, sin embargo se observaron diferencias en cuanto al tamaño de las colonias, esto debido probablemente a imprecisiones en la medición ocasionadas por la distribución de las colonias (Gueho et al.1996; Sugita et al. 2003; Hirai et al. 2004; Hernández, 2005; Cabañes et al. 2007; Arenas, 2008; Crespo et al. 2008).
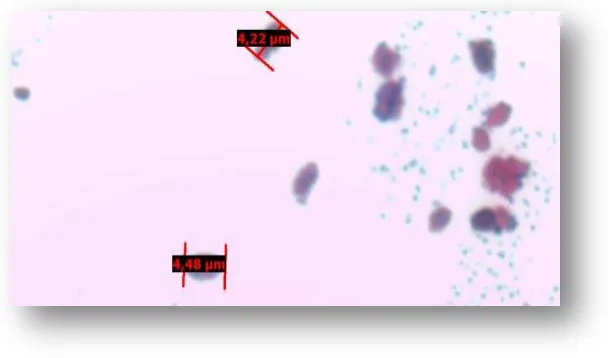
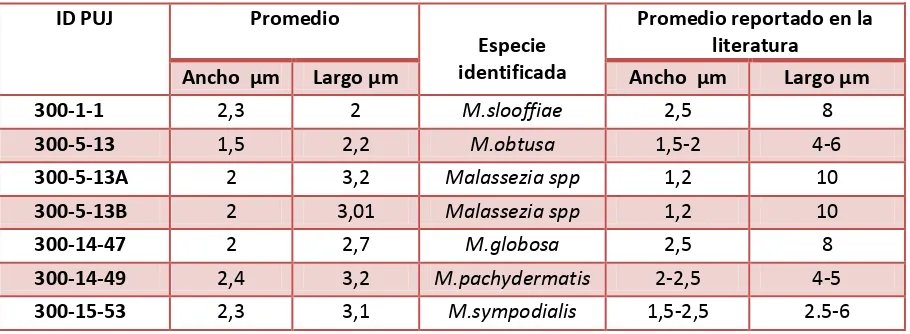
[image:24.612.156.460.348.527.2]6.3 Descripción microscópica: Las medidas microscópicas para los aislamientos identificados como Malassezia (Figura 4) mostraron que M. pachydermatis presenta el tamaño más grande 2,4 μm de ancho x 3,2 μm de largo, y M. obtusa el tamaño más pequeño 1,5 μm de ancho x 2,2 μm de largo (Tabla 3).
Tabla 3. Mediciones microscópicas de las especies identificadas como Malassezia a partir de los aislamientos obtenidos
ID PUJ Promedio
Especie identificada
Promedio reportado en la literatura
A cho μ Largo μ A cho μ Largo μ
300-1-1 2,3 2 M.slooffiae 2,5 8
300-5-13 1,5 2,2 M.obtusa 1,5-2 4-6
300-5-13A 2 3,2 Malassezia spp 1,2 10
300-5-13B 2 3,01 Malassezia spp 1,2 10
300-14-47 2 2,7 M.globosa 2,5 8
300-14-49 2,4 3,2 M.pachydermatis 2-2,5 4-5
300-15-53 2,3 3,1 M.sympodialis 1,5-2,5 2.5-6
ID PUJ Urea ,Esculina, Sabouraud Cremophor Tween Actividad Fosfolipasa
300-1-1 M.slooffiae
300-5-13 M.obtusa
300-5-13A Malassezia spp
300-5-13B Malassezia spp
ID PUJ Urea, Esculina ,Sabouraud Cremophor Tween Actividad Fosfolipasa
300-14-49 M.pachydermatis
300-15-53 M.sympodialis
Tabla 4. Identificación de los aislamientos obtenidos de acuerdo con las pruebas bioquímicas
ID PUJ Sitio Toma de la
muestra Catalasa Urea glucosidasa β- Sabouraud Agar
37ºC
Tween
Cremophor Fosfolipasa Actividad Especie de Malassezia
40ºC 20 40 60 80
300-1-1 Canal auditivo izquierdo
+++ +++ - - + +++ - + + - - +
Pz=0,66 M. slooffiae 300-5-13 Canal
auditivo izquierdo
+++ +++ + - - + - - - -
M.obtusa
300-5-13A Canal auditivo izquierdo
+++ +++ - - + + - - - -
Malassezia spp
300-5-13B Canal auditivo izquierdo
+++ +++ + débil - + + + - - - - -
Malassezia spp
300-14-47 Canal auditivo izquierdo
+++ +++ - - - + - - - +
Pz=0,40 M.globosa 300-14-49 Glándula
mamaria +++ ++ + +++ + + + + + + + Pz=0,75 + pachydermatis M.
300-15-53 Glándula
De acuerdo con los resultados obtenidos de las pruebas bioquímicas se pudo determinar que de los aislamientos obtenidos el 2,43% (n=2) correspondió a Malassezia spp, las cuales no pudieron identificarse hasta especie debido a que los perfiles bioquímicos no coincidieron con lo reportado por literatura para las diferentes especies. Los demás aislamientos si pudieron ser identificados hasta especie: M. pachydermatis, M. globosa, M. obtusa, M slooffiae y M. sympodialis con un porcentaje del 1,22% (n=1) para cada una de ellas. Estos datos concuerdan con reportes de literatura en los que se menciona que estas especies son las más comúnmente aisladas en la piel de equinos sanos. (White, 2006; Crespo et al. 2002).
Las especies identificadas en el presente estudio fueron M. slooffiae, M. obtusa, M. globosa, M. pachydermatis, M. sympodialis y Malassezia spp, aisladas de Oído Izquierdo y Glándula mamaria de equinos sanos. De acuerdo con los resultados obtenidos en este estudio y con lo reportado por White 2005 y Crespo et al. 2010 se aislaron en los equinos las mismas especies exceptuando M. furfur y M. restricta que no fueron identificadas, encontrando una concordancia en cuanto al sitio anatómico como lo es el canal auditivo externo tanto para M. obtusa, como para M. slooffiae. Mientras que las especies M. pachydermatis y M. sympodialis fueron aisladas de glándula mamaria, lo cual no coincide con lo reportado por White, 2005 y White et al. 2006, quienes aislaron M. slooffiae y M.equina en el primer estudio y M.equina en el segundo a partir de la glándula mamaria de yeguas sanas.
La prevalencia general para la población evaluada fue de 18,2%, identificando las especies M. slooffiae, M. obtusa, M.globosa, M. pachydermatis, M. sympodialis coincidiendo con lo reportado por diferentes autores Crespo et al.2002; Giusiano,2006; White,2006 quienes reportan la presencia de estas levaduras como las especies más aisladas en la microbiota normal de la piel de equinos.
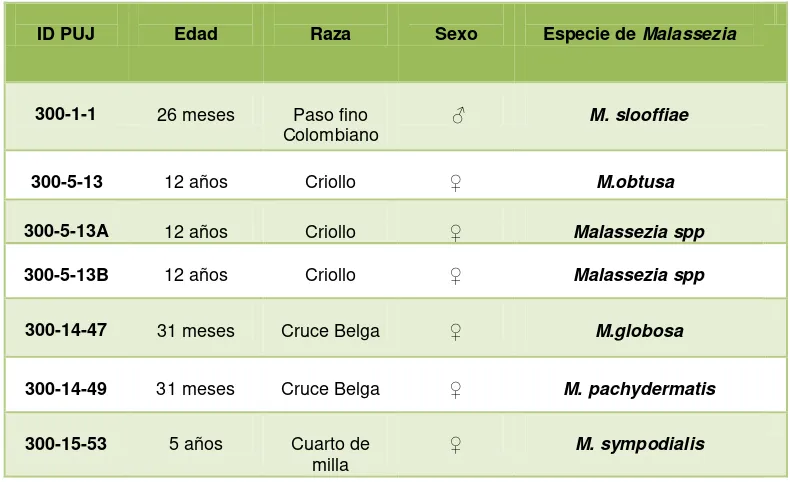
De acuerdo con lo observado en este estudio (Tabla 5) no fue posible establecer una relación entre los aislamientos y las variables edad, sexo y raza debido al bajo número de aislamientos obtenidos ya que el 71,42% (n=5) de ellos se obtuvieron de dos equinos 3 de un equino de raza criolla y 2 de un animal de raza cruce belga, 1 aislamiento se obtuvo de un equino de raza paso fino y 1 de un equino de raza cuarto de milla, lo que sesgaría el análisis no solamente en cuanto a la variable raza sino también a las variables sexo y edad.
Tabla 5. Especies aisladas según variables como raza, género y edad.
ID PUJ Edad Raza Sexo Especie de Malassezia
300-1-1 26 meses Paso fino
Colombiano ♂ M. slooffiae
300-5-13 12 años Criollo ♀ M.obtusa
300-5-13A 12 años Criollo ♀ Malassezia spp
300-5-13B 12 años Criollo ♀ Malassezia spp
300-14-47 31 meses Cruce Belga ♀ M.globosa
300-14-49 31 meses Cruce Belga ♀ M. pachydermatis
300-15-53 5 años Cuarto de
milla ♀ M. sympodialis
6. CONCLUSIONES
La prevalencia de Malassezia para los animales evaluados en este estudio fue de 18,2%.
Se determinó la presencia de M. sympodialis, M. pachydermatis, M. slooffiae, M.
obtusa y M. globosa como microbiota normal en la piel de los equinos evaluados.
Los sitios anatómicos con mayor presencia de Malassezia en los animales evaluados fueron glándula mamaria y canal auditivo.
Se evidenció una tendencia de mayor presencia de Malassezia en las hembras
No se estableció una relación entre la presencia de Malassezia spp y las variables edad, sexo y raza.
7. RECOMENDACIONES
Para futuros estudios se recomienda realizar otras pruebas adicionales como técnicas moleculares que permitan la identificación de los aislamientos que no pudieron ser identificados hasta especie.
8. REFERENCIAS
Arenas R (2008) Micología médica ilustrada. Mc Graw Hill, México DF, México
Ashbee H. (2007) Update on the genus Malassezia. Medical Mycology 45:287-303
Boekhout T, Guého E, Mayser P, Velegraki A. (2010) Malassezia and the skin. Springer-Verlag, Heidelberg, Germany
Bonifaz A. (2012) Micología médica básica. Mc Graw Hill, México DF, México
Cabañes J, Theelen B, Castellá G, Boekhout T. (2007) Two new lipi-dependent Malassezia species from domestic animals. Vet Mycology 7:1064
Cabañes F, Vega S, Castellá G. (2011) Malassezia cuniculi sp. nov., a novel yeast species isolated from rabbit skin. Medical Mycology, 49:40–48
Cafarchia C & Otranto D. (2004) Association between phospholipase production by Malassezia pachydermatis and skin lesions. Journal of Clinical Microbiology 42(10): 4868–4869
Cafarchia C, Figueredo L, Otranto D. (2013) Fungal diseases of horses. Vet Mycology 6078
Castellá G, Hernández J, Cabañes F. (2005) Genetic typing of Malassezia pachydermatis from different domestic animals. Vet Microbiology 108 : 291–296
Crespo M, Abarca M, Cabañes F. (2002) Occurrence of Malassezia spp. in horses and domestic ruminants. mycoses 45, 333–337
Crespo V, Gómez E, Crespo M. (2008) La pitiriasis versicolor y las levaduras del género Malassezia. Actas Dermosifiliográficas 99:764-771
Gaitanis G, Velegraki A, Frangoulis E, Mitroussia A, Tsigonia A. (2002) Identification of Malassezia species from patient skin scales by PCR-RFLP. Clinical Microbiology and Infection 8:162-173
Garau M, Palacio A, García J. (2005) Prevalence of Malassezia spp. in healthy pigs. Mycoses, 48, 17–20
Giusiano G. (2006) Malassezia: Estado del conocimiento y perspectivas en su estudio. Revista Argentina de Microbiología 38:41-48
Guého E, Midgley G, Guillot J. (1996) The genus Malassezia with description of four new species. Anton.Leeuw.Int J.G69:337-355
Hirai A, Kano R, Makimura K, Duarte E, Hamdam J et al. (2004) Malassezia nana, a novel lipid-dependent yeast species isolated from animals. International Journal of Systematic and Evolutionary Microbiology 54:623-627
Kaneko T, Makimura k, Abe M, Shiota R, Nakamura Y, Kano R,Hasegawa A, Sugita T, Shibuya S, Watanabe S, Yamaguchi H, Abe S, Okamura N. (2007) Revised Culture-Based System for Identification of Malassezia Species. Journal of clinical microbiology, p. 3737–3742
Khosravi A, Eidi S, Ziglari T, Bayat M. (2008) Isolation and differentiation of Malassezia species isolated from healthy and affected small animals, ear and skin. World Journal of Zoology 3(2):77-80
López A, Sánchez A, Gil J. (2007) Fundamentos básicos para el diagnóstico micológico. Revista Iberoamericana de Micología.
http://www.guia.reviberoammicol.com/ Obtenido 10 enero 2014
Mayser P, Haze P, Papavassilis C, Pickel M, Gruender K et al. (1997) Differentiation of Malassezia species: selectivity of Cremophor EL, castor oil and ricinoleic acid for M. furfur. British Journal of Dermatology 137:208-213
Nardoni S, Merildi V, Frangioni S, Ariti G, Verin R, Vannucci P, Mancianti F. (2010) Isolation and characterization of Malassezia spp. in healty swine of different breeds. Veterinary microbiology. 141.,155-158
Nell A, James S, Bond C, Hunt B, Herrtage M. (2002) Identification and distribution of a novel Malassezia species yeast on normal equine skin. Vet. Rec.150:395–398.
Ortiz G, Carmen M, Alfonso J. Carrillo M,y Paya M. (2012) Producción de
fosfolipasa y proteinasa en cepas de Malassezia pachydermatis aisladas de perros con otitis y sin otitis.Rev Iberoam Micol. 30(4):235–238
Paterson S. (2002) Identification of Malassezia from a horse’s skin case report. Equine vet. Educ. 14 (3) 121-125
Perez C, Goitia K, Mata S, Hartung C, Colella M , Reyes H, Hernandez C, Villaroel M, Ontiveros J, Magaldy S, Suarez R. (2002) Use of the stuart urea broth for the urease test, like proof in the identification of yeast. Revista de la sociedad venezolana de microbiología. 22: 2
Pini G, Faggi E. (2011) Extracellular phospholipase activity of Malassezia strains isolated from individuals with and without dermatological disease. Rev Iberoam Micol 28(4):179-182
Salah B I, Makni F, Cheikhrouhou F, Neji S, Sellami H, Ayadi A. (2010) Les levures du genere Malassezia : pathologie, milieux d’isolement et d’identification. Malassezia species: Pathology, isolation and identification media. Journal de mycologie Médicale. 20: 53-60
Sugita T, Takashima M, Kodama M, Tsuboi R, Nishikawa A. (2003) Description of a new yeast species Malassezia japonica and its detection in patients with atopic dermatitis and healthy subjects. Journal of Clinical Microbiology 41:4695-4699 White SD. (2005) Equine Bacterial and Fungal Diseases: A Diagnostic and
Therapeutic Update. Clin Tech Equine Pract 4:302-310